Una fístula aortoentérica (FAE) es una comunicación aberrante entre la aorta y la pared del tubo digestivo. Se trata de una entidad rara pero con alta mortalidad que requiere, por tanto, un diagnóstico certero y precoz. Se clasifica como primaria si se desarrolla sobre una aorta nativa no intervenida previamente o como secundaria cuando ocurre en un contexto de complicación posquirúrgica de reparación vascular.
Todo radiólogo debería saber reconocer los signos directos e indirectos que pudieran sugerir la existencia de una FAE. En este artículo se revisan los tipos de FAE y su correlación clínico-fisiopatológica, así como el algoritmo diagnóstico exponiendo los hallazgos radiológicos típicos en tomografía computarizada.
An aortoenteric fistula is an abnormal communication between the aorta and the gastrointestinal tract wall. The high mortality associated with this rare entity means it requires early accurate diagnosis. Aortoenteric fistulas are classified as primary when they develop on a native aorta that has not undergone an intervention and as secondary when they develop after vascular repair surgery.
All radiologists need to be able to recognize the direct and indirect signs that might suggest the presence of an aortoenteric fistula. This article reviews the types of aortoenteric fistulas and their clinical and pathophysiological correlation, as well as the diagnostic algorithm, illustrating the most characteristic findings on multidetector computed tomography.
La fístula aortoentérica (FAE) es una comunicación entre la aorta y un segmento del tubo digestivo, generalmente la tercera y/o cuarta porción duodenal por la vecindad existente entre ambas estructuras. La segunda región anatómica más frecuentemente afectada es el esófago, aunque también se han descrito casos de fistulización hacia el estómago, yeyuno, íleon y colon1,2.
La primera descripción la realizó Sir Astley Cooper en 1829 como una complicación infrecuente de aneurisma de aorta3. Desde entonces, todos los casos notificados habían surgido de novo a partir de una aorta patológica no intervenida antes, normalmente causada por erosión de un aneurisma de aorta abdominal. Sin embargo, con el desarrollo de técnicas de reparación aórtica, la incidencia de FAE creció paralelamente en el marco de complicaciones posquirúrgicas, y la primera FAE secundaria fue descrita en 1953 por Brock4.
La incidencia notificada de FAE primarias oscila entre 0,04% y el 0,07% de la población general1 y entre el 0,69% y el 2,36% de los pacientes con aneurisma de aorta abdominal5; no obstante, la incidencia real debe ser menor, ya que la mayoría de los aneurismas son desconocidos por la escasa sintomatología asociada. En la actualidad, las FAE secundarias son más frecuentes; su incidencia se estima en un 0,3-1,6% de los pacientes intervenidos6,7. Debido a la creciente esperanza de vida y al aumento en el número de intervenciones aórticas, se presume que la incidencia de FAE también aumente; sin embargo, es probable que mejoren simultáneamente las técnicas y los materiales de endoprótesis.
Del mismo modo que existe una clara prevalencia de aneurismas de aorta abdominal en el sexo masculino frente al femenino, la incidencia de FAE es mayor en el varón. La edad media de presentación en FAE primaria es 64 años, mientras que los pacientes con FAE secundarias suelen ser mayores, alrededor de los 70 años8.
La FAE tiene una alta tasa de mortalidad extrahospitalaria, cuyo diagnóstico se realiza post mortem. Asimismo, en el ámbito hospitalario, la mortalidad sigue siendo elevada, en parte debido al desconocimiento existente de esta entidad y a la baja sospecha clínica, lo que retrasa el diagnóstico y el manejo quirúrgico adecuado.
ClasificaciónAtendiendo a la fisiopatología, las FAE se clasifican en primarias y secundarias.
Fístulas aortoentéricas primariasGeneralmente se originan en un contexto de enfermedad ateroesclerótica con desarrollo ulterior de aneurisma de aorta abdominal. No obstante, cualquier proceso que motive una inflamación crónica en la pared aórtica también podrá generar una FAE primaria. Se han descrito casos en relación con úlcera péptica, neoplasia, radioterapia, infección micótica o enfermedad del colágeno. La tuberculosis y la sífilis son otras entidades nosológicas clásicamente consideradas como causantes de aortitis y FAE que en la actualidad prácticamente han desaparecido en nuestro medio gracias a la terapia eficaz disponible3; no obstante, en áreas endémicas como India continúan notificándose casos en la actualidad en relación con aneurismas micóticos en contexto de aortitis tuberculosa9. El mecanismo fisiopatológico subyacente está relacionado con la pulsatilidad constante del aneurisma sobre la pared intestinal y un proceso infeccioso-inflamatorio concomitante con bacteriemia transitoria, normalmente Klebsiella o Salmonella8. Ello permite la colonización microbiológica que debilita la pared de la aorta y origina una fistulización3. La fistulización aórtica primaria también se podría presentar en una aorta nativa tras la ingesta de un cuerpo extraño (habitualmente como fístula aortoesofágica10).
Fístulas aortoentéricas secundariasSon más frecuentes que las FAE primarias y ocurren en el marco de una complicación posquirúrgica de reparación aórtica, ya sea por aneurisma abdominal o enfermedad oclusiva periférica, si bien se han notificado menos casos en este último ámbito. Para prevenir el desarrollo de esta complicación en las reparaciones abiertas, se recomienda la interposición de omento mayor entre el tubo digestivo y la anastomosis vascular3. En caso de abordaje retroperitoneal, la incidencia de FAE es prácticamente inexistente. El intervalo temporal varía desde 2 semanas hasta una década después de la intervención.
Recientemente se ha descrito un caso asociado a un osteofito vertebral anterior prominente que impronta sobre la anastomosis vascular proximal favoreciendo la erosión mecánica; por ello, es necesaria la descripción detallada de las estructuras periaórticas en el estudio vascular prequirúrgico sin subestimar la proliferación ósea degenerativa11.
La infección primaria del injerto, así como las adherencias resultantes, tienen un papel fundamental en el desarrollo de las fístulas secundarias, posiblemente más importante que la constante pulsatilidad, entendiéndose la FAE como una evolución natural de la infección periinjerto en un espectro continuo de la enfermedad12. En este caso, el principal microorganismo asociado es Staphylococcus aureus. El punto de mayor debilidad se encuentra en la línea de sutura, lo que permite la formación de un seudoaneurisma y posterior fistulización. No obstante, también se han descrito casos de FAE secundarias en reparaciones endovasculares a pesar de la ausencia de sutura, lo que demuestra que este no debe considerarse un factor sine qua non13. La infección de la endoprótesis, la migración de esta o la presencia de endofugas son elementos favorecedores14.
Por otro lado, la cirugía primaria del tubo digestivo también puede originar una FAE secundaria. Se han descrito casos de fistulización aortogástrica tras funduplicatura de Nissen, probablemente asociados a fenómenos de isquemia local tras la ligadura de vasos gástricos cortos, al trauma directo y a la inflamación posquirúrgica15.
Manifestaciones clínicas y técnicas diagnósticasLa tríada clásica de hemorragia gastrointestinal (hematemesis, melenas), dolor abdominal y masa pulsátil no es tan frecuente en la práctica diaria16. La presentación clínica puede ser variable como se expone a continuación:
Con hemorragia manifiesta• Hemodinámicamente inestable: es una causa de hemorragia digestiva alta, con gasto elevado, en la que existe una comunicación franca con la luz gastrointestinal. Habitualmente está precedida por uno o más episodios de hemorragia menor autolimitados (hemorragia heraldo o centinela) que se presentan desde horas a varios meses antes de la hemorragia aguda masiva17. Estos pacientes deben ser intervenidos de urgencia mediante laparotomía exploratoria, ya que cualquier prueba de imagen retrasaría el tratamiento y el desenlace podría ser fatal. Únicamente en aquellos casos en los que no haya aneurisma conocido se podría realizar una ecografía para apoyar el diagnóstico de aneurisma (no para estudiar la fístula per se).
• Hemodinámicamente estable: en este caso, el papel de la imagen sí es de vital importancia, y la tomografía computarizada (TC) es la prueba de elección. Debe realizarse como estudio de primera línea (los hallazgos de imagen se detallan en el apartado siguiente).
- –
La endoscopia alta presenta una sensibilidad considerablemente baja (25-50%)16 por la dificultad para explorar el duodeno distal e identificar el punto de hemorragia cuando esta es de alto flujo. En fugas intermitentes se podría realizar un marcaje endoscópico del vaso visible/manchas hematínicas para un manejo terapéutico posterior. Si la activación espontánea de la cascada de la coagulación logra una hemostasia eficaz y la consecuente estabilización hemodinámica, hay que tener cautela con el endoscopio, ya que podría favorecer el desprendimiento del coágulo rojo adherido a la pared duodenal que estabiliza la ulceración18 (vídeo 1). Por todo ello, es preferible reservar este método como técnica diagnóstica de segunda elección, para excluir otras causas de hemorragia gastrointestinal. Asimismo, cabe reseñar que hallazgos endoscópicos de úlcera péptica son frecuentes a nivel poblacional y particularmente en pacientes con patología aneurismática19 por lo que podrían actuar como factores de confusión.
- –
La angiografía convencional presenta una sensibilidad limitada en aquellos casos en los que la tasa de hemorragia es lenta; por otro lado, la alta presión de inyección de contraste intravascular podría acrecentar la hemorragia. En la actualidad, el papel de la angiografía ha quedado relegado por la TC, dada la alta disponibilidad de esta última en la sala de Urgencias, cortos tiempos de adquisición y mayor sensibilidad diagnóstica, mismas razones por las que la resonancia magnética no se considera en el algoritmo diagnóstico inicial. No se requiere angiografía de confirmación; se reserva únicamente para procedimientos terapéuticos de reparación percutánea.
En aquellos casos en los que no existe una comunicación franca con el lumen entérico, sino una erosión parietal o del injerto, las manifestaciones son más inespecíficas e incluyen sepsis, malestar y pérdida de peso. Esto ocurre particularmente en las fístulas secundarias, en donde existen erosiones en la mucosa intestinal que justificarían la detección de sangre oculta en heces sin repercusión clínica sobre el paciente, quien no percibe ningún signo de hemorragia. Por tanto, la sospecha de FAE debe entrar en el diagnóstico diferencial en aquellos pacientes con antecedente de cirugía aórtica que presentan un cuadro de fiebre de origen desconocido independientemente de la presencia de datos sugerentes de hemorragia gastrointestinal20,21. Las pruebas de medicina nuclear como la gammagrafía con hematíes autólogos radiomarcados son útiles para la detección de hemorragia oculta.
Protocolo y hallazgos por imagen (tabla 1)Se debe realizar una TC en todos los pacientes estables. El protocolo habitual incluye la realización de estudio basal (colimación de 3mm) y tras administración de contraste yodado intravenoso (CIV) con adquisición en fases arterial mediante técnica de bolus tracking (colimación 2 mm y reconstrucción 1 mm) y venosa portal con retraso de 70 segundos (3mm) en un escáner de 16 detectores o superior.
Signos directos e indirectos de fístula aortoentérica en tomografía computarizada
| Signos directos | Signos indirectos |
|---|---|
| Extravasación de contraste aórtico a la luz intestinal | Líquido libre (<20 UH) o edema de partes blandas (>20 UH) en disposición circunferencial rodeando la aorta |
| Fuga de material entérico al espacio periaórtico | Pérdida del plano graso de separación entre la aorta y el tubo digestivo |
| Disrupción de la pared aórtica | Engrosamiento focal de la pared intestinal> 5 mm |
| Gas aórtico/perivascular | Complicaciones de aneurisma aórtico (seudoaneurisma, hematoma intramural, etc.) |
| Presencia de burbujas de gas ectópico más allá de 3-4 semanas de la cirugía o manguito de partes blandas, líquido libre y hematoma después de 2-3 meses |
Debe evitarse el uso de contraste oral, ya que puede ocultar la extravasación intraluminal22. Se reservará únicamente para valoración de dehiscencias en pacientes posquirúrgicos.
El hallazgo patognomónico de FAE es la extravasación activa del contraste aórtico hacia la luz intestinal patente en la fase arterial (vídeo 2, figs. 1-3 a). Otros hallazgos directos de alta especificidad incluyen la fuga de material entérico al espacio periaórtico y la disrupción de la pared aórtica12. Asimismo, la presencia de gas periaórtico o intravascular (fig. 4) es altamente sugestivo de FAE, ya que la infección aórtica normalmente es causada por microorganismos no formadores de gas4.
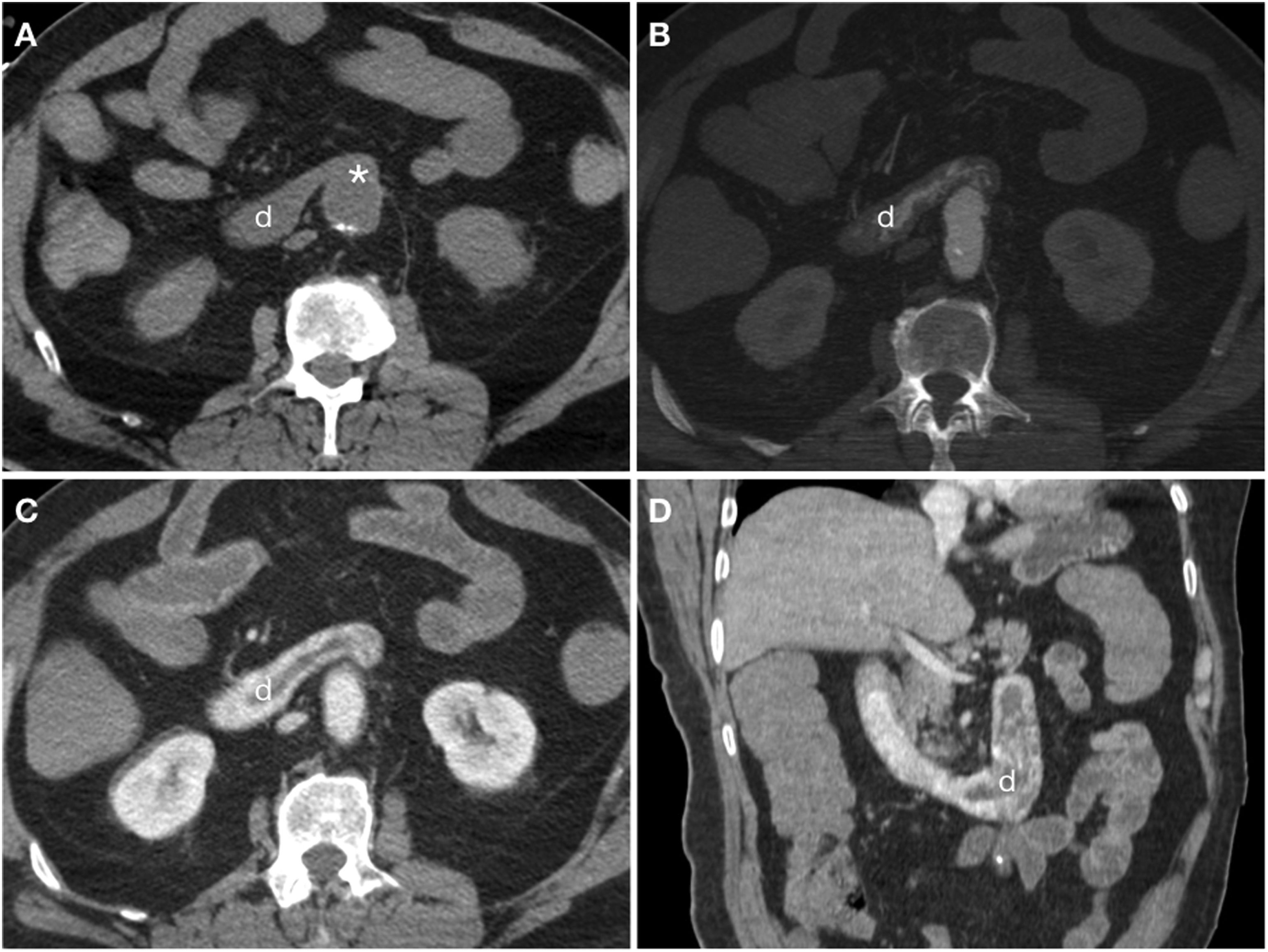
Cortes axiales del mismo paciente del vídeo 2. Tomografía computarizada basal (A) y en fases arterial (B) y portal (C) que demuestra pérdida del plano graso de separación (*) entre el injerto y la tercera porción duodenal (d) con extravasación activa de contraste intravenoso hacia la luz duodenal evidente desde la fase arterial. Reconstrucción en el plano coronal (D).
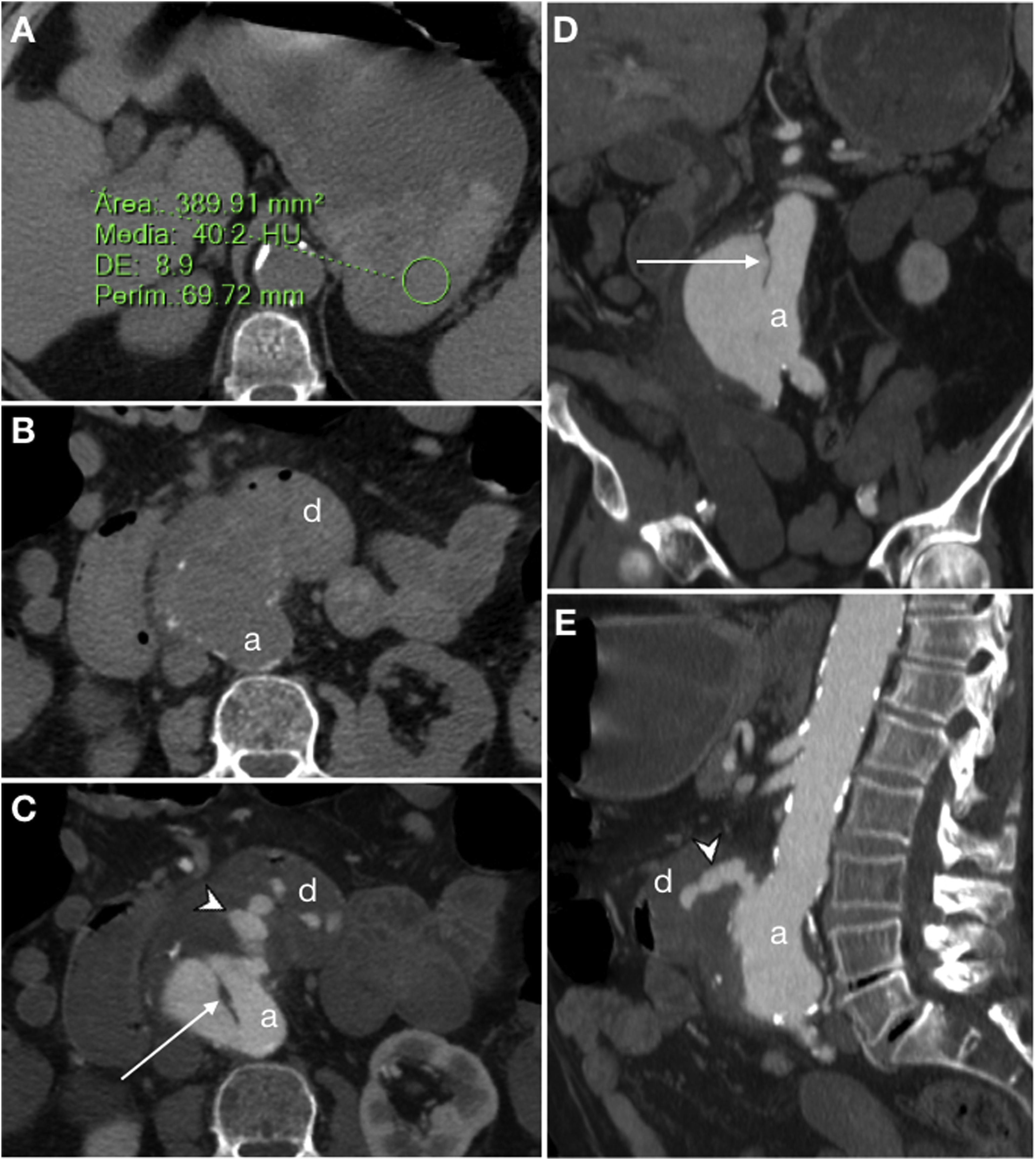
Fístula aortoduodenal primaria en varón de 90 años con hematemesis y dolor abdominal intenso en contexto de síndrome aórtico agudo. La tomografía computarizada (TC) basal muestra un gran coágulo de 40 UH en el estómago (A) y un aneurisma aórtico calcificado (a) con pérdida del plano graso de separación con la luz duodenal (d) (B). La TC con contraste intravenoso (CIV) en fase arterial (C) muestra una úlcera penetrante (flecha) y extravasación activa de CIV (punta de flecha) hacia el duodeno. Las reconstrucciones MIP en planos coronal (D) y sagital (E) muestran el flap intimomedial (flecha) y el jet de CIV (punta de flecha).
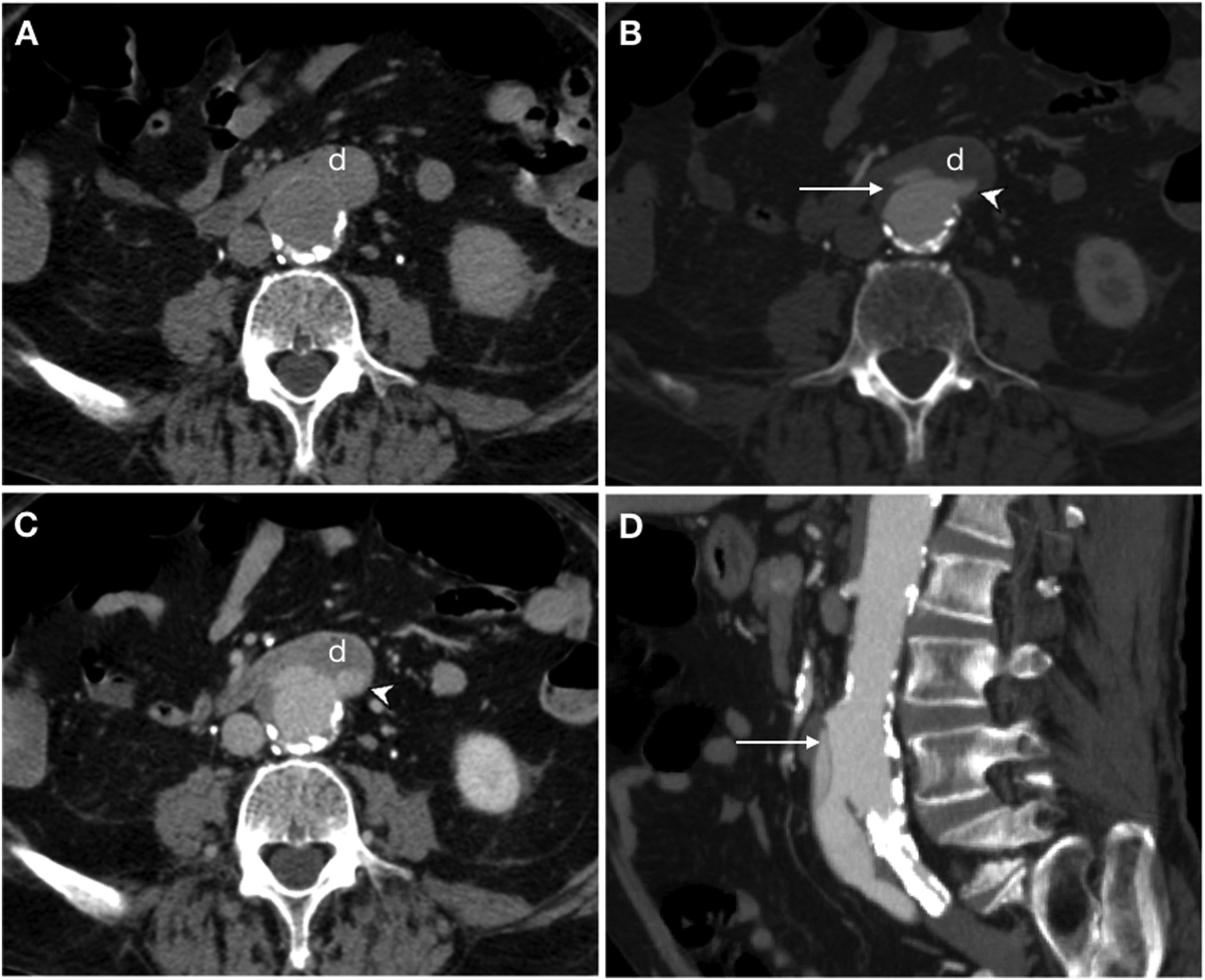
Fístula aortoentérica secundaria en varón de 77 años con antecedente de bypass aortobifemoral que actualmente presenta episodio de sangrado gastrointestinal con hematoquecia masiva, distensión abdominal y pulsos distales débiles. La tomografía computarizada basal (A), en fases arterial (B), portal (C) y la reconstrucción sagital MIP (D) muestran un desgarro intimomedial (flecha) que afecta a la superficie anterior del injerto contactando con la tercera porción del duodeno (d). Se observa asimismo extravasación del contraste aórtico al tracto gastrointestinal (punta de flecha).
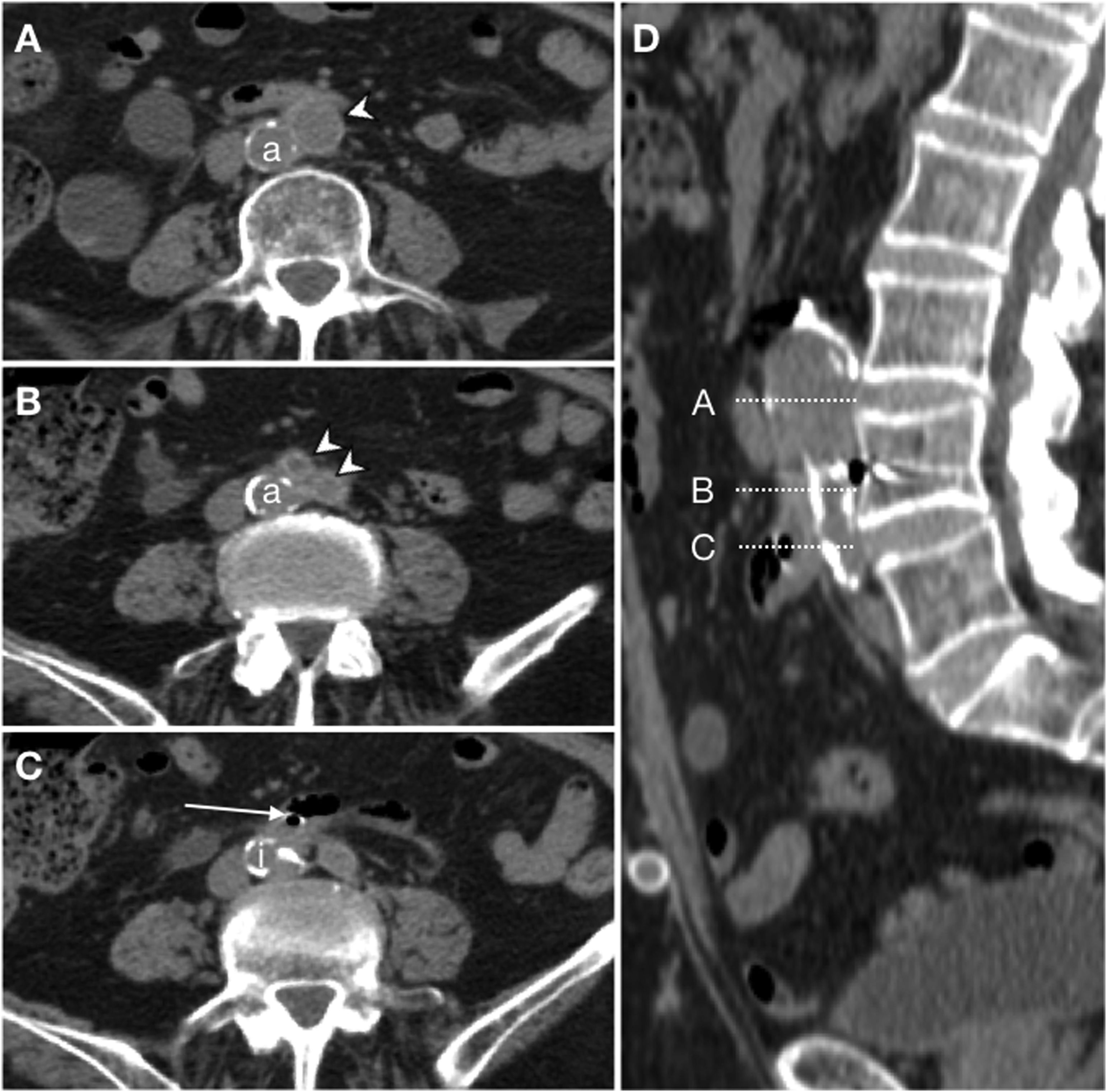
Fístula ilioentérica secundaria en un varón de 93 años, con antecedente de bypass aortobifemoral, que acude por presentar vómitos en posos de café y melenas. No se administra contraste intravenoso por disminución de la tasa de filtrado glomerular. Se representan cortes craneocaudales en el plano axial (A, B, C) del bypass aortobifemoral (punta de flecha) localizado en una disposición anterior a la aorta nativa (a). En la figura C se identifica gas intraluminal en la rama derecha del bypass (flecha) procedente del asa intestinal inmediatamente adyacente; se indica la arteria ilíaca nativa como referencia anatómica (i). La reconstrucción sagital (D) representa el nivel de los cortes.
En ocasiones, la TC también permite valorar la etiología de la fistulización, por ejemplo, demostrando la extensión tumoral de un carcinoma digestivo, habitualmente de localización esofágica infiltrando la grasa periaórtica (fig. 5).
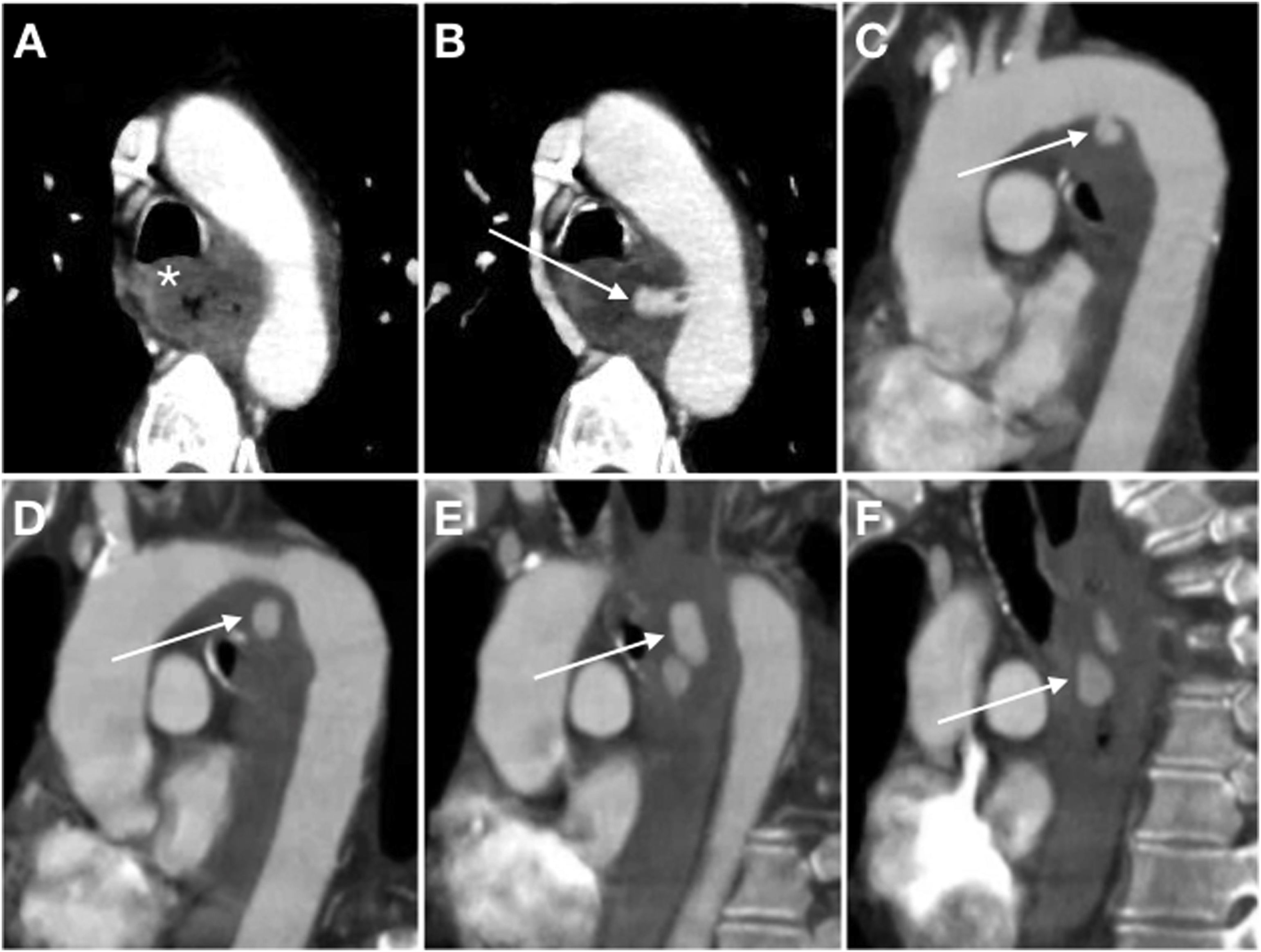
Varón de 54 años con esófago de Barrett que acude por cuadro de hemorragia digestiva alta con inestabilidad hemodinámica. Se realiza endoscopia en primera instancia que demuestra una lesión estenótica en tercio proximal del esófago que impide el paso del endoscopio. Ante nuevo episodio de inestabilidad se decide realizar tomografía computarizada basal y tras administración de contraste intravenoso (CIV) con adquisición bifásica (solo se muestra fase arterial). Corte axial (A) en el que se identifica un engrosamiento parietal esofágico (*) con infiltración serosa que oblitera el plano graso de separación con el cayado aórtico en relación con extensión tumoral. Las reconstrucciones MIP en planos axial (B) y sagital (C-F) demuestran extravasación activa de CIV desde el cayado aórtico hacia la luz esofágica (flecha).
Estos hallazgos directos presentan baja sensibilidad y es más habitual la existencia de signos indirectos que comprenden la presencia de líquido libre periaórtico de baja atenuación (<20 UH) o edema de partes blandas (>20 UH) en disposición circunferencial rodeando la aorta, pérdida del plano graso de separación entre aorta y tubo digestivo, engrosamiento focal de la pared intestinal (>5mm) y formación de seudoaneurisma22 (fig. 6).
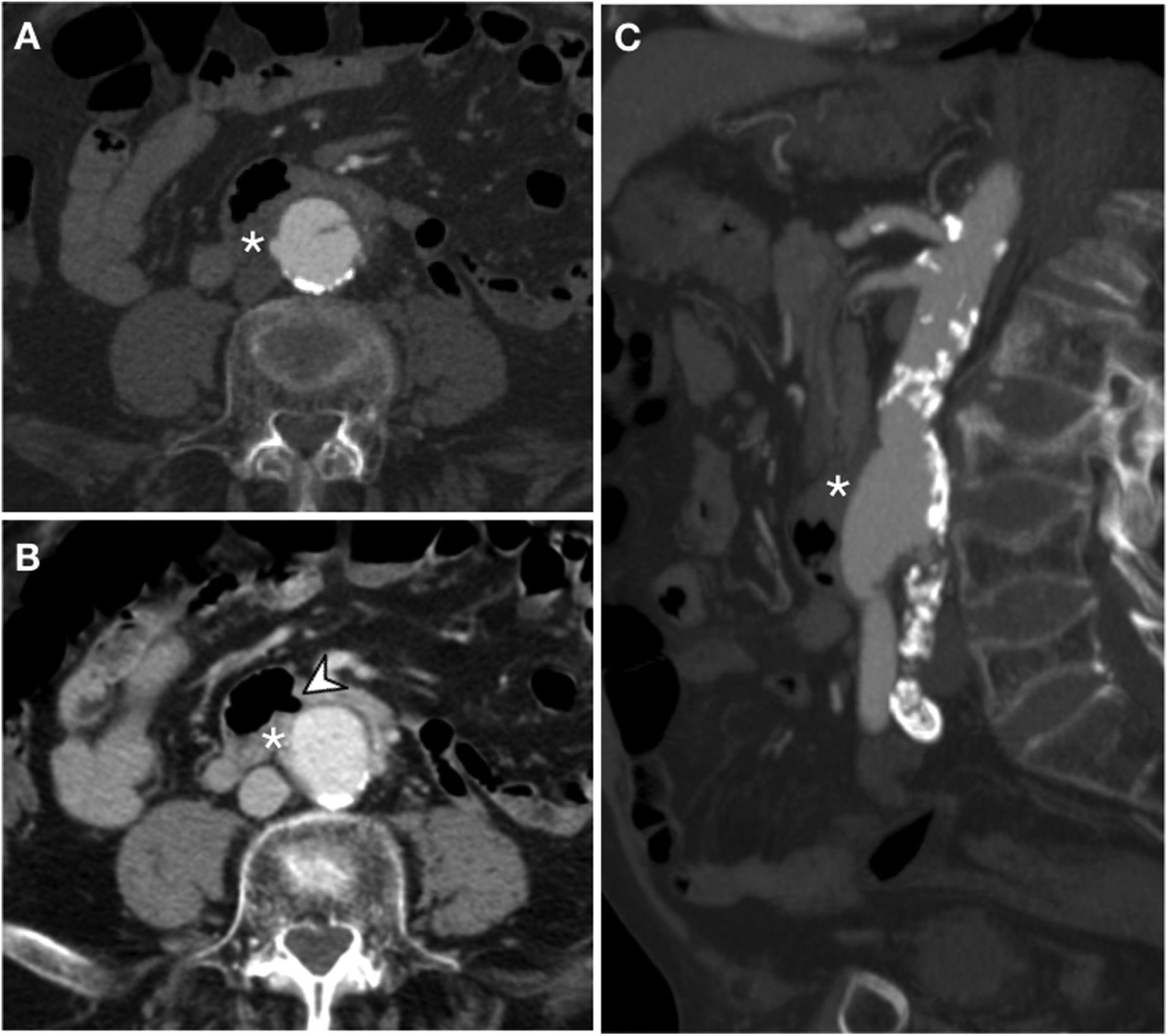
Fístula aortoentérica secundaria en varón de 78 años con antecedente de bypass aortobifemoral y enfermedad ulcerosa péptica que acude por cuadro de hemorragia digestiva alta. La endoscopia reveló una ulceración de la pared intestinal con observación directa del material del bypass. Ante la estabilidad hemodinámica del paciente se decide valorar con tomografía computarizada. Fases arterial (A), portal (B) y reconstrucción MIP en el plano sagital (C). El bypass aortobifemoral se observa en íntimo contacto con el duodeno retroperitoneal presentando un manguito de partes blandas que rodea el bypass (*) y una burbuja de aire ectópico (punta de flecha) sin plano graso de separación. Aunque no se demuestra extravasación activa de CIV, la cirugía confirmó la presencia de FAE.
El estudio basal es imprescindible para la valoración de complicaciones aneurismáticas que podrían originar una FAE, como el hematoma intramural y el desplazamiento central de calcificaciones intimales en la úlcera penetrante (fig. 7). Es frecuente identificar asimismo contenido endoluminal de alta atenuación en relación con restos hemáticos.
Fístula aortoesofágica primaria en varón de 67 años con hematemesis, sudoración profusa, palidez cutánea e hipotensión. La tomografía computarizada basal (A) muestra una dilatación esofágica con contenido intraluminal de alta atenuación en relación con componente hemático (*) y desplazamiento de calcificaciones intimales que indica rotura de placa ateromatosa con puerta de entrada (flecha). La fase arterial en plano axial (B), reconstrucción sagital (C) y volumétrica (D) muestra calcificaciones en la pared de la aorta descendente y una dilatación sacular (punta de flecha) que contacta con la pared esofágica sin plano graso de separación. Estos hallazgos sugieren úlcera penetrante. A pesar de la ausencia de extravasación de contraste intravenoso, se confirmó la presencia de fístula aortoentérica en la cirugía.
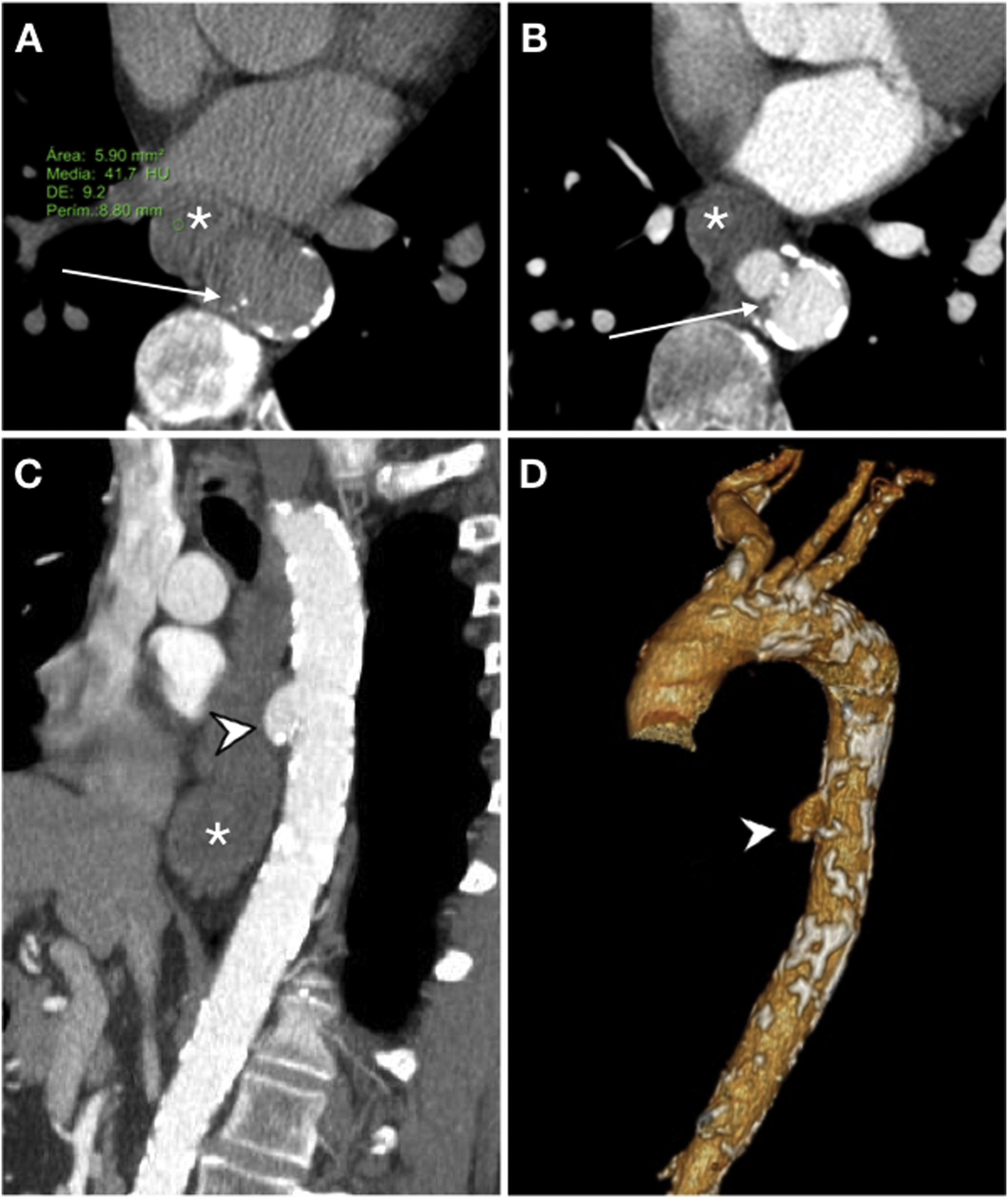
Recientemente, Kennedy et al. han descrito el desarrollo de un abombamiento de nueva aparición en la vertiente anterior/anterolateral de la aorta en la proximidad de un asa intestinal vecina como signo precoz de FAE23 (fig. 8). En presencia de trombo excéntrico este hallazgo podría ser menos evidente. Sin embargo, se trata de un estudio retrospectivo sin grupo de control que no permite valorar la incidencia de este signo en la población general, por lo que debe ser valorado con cautela.
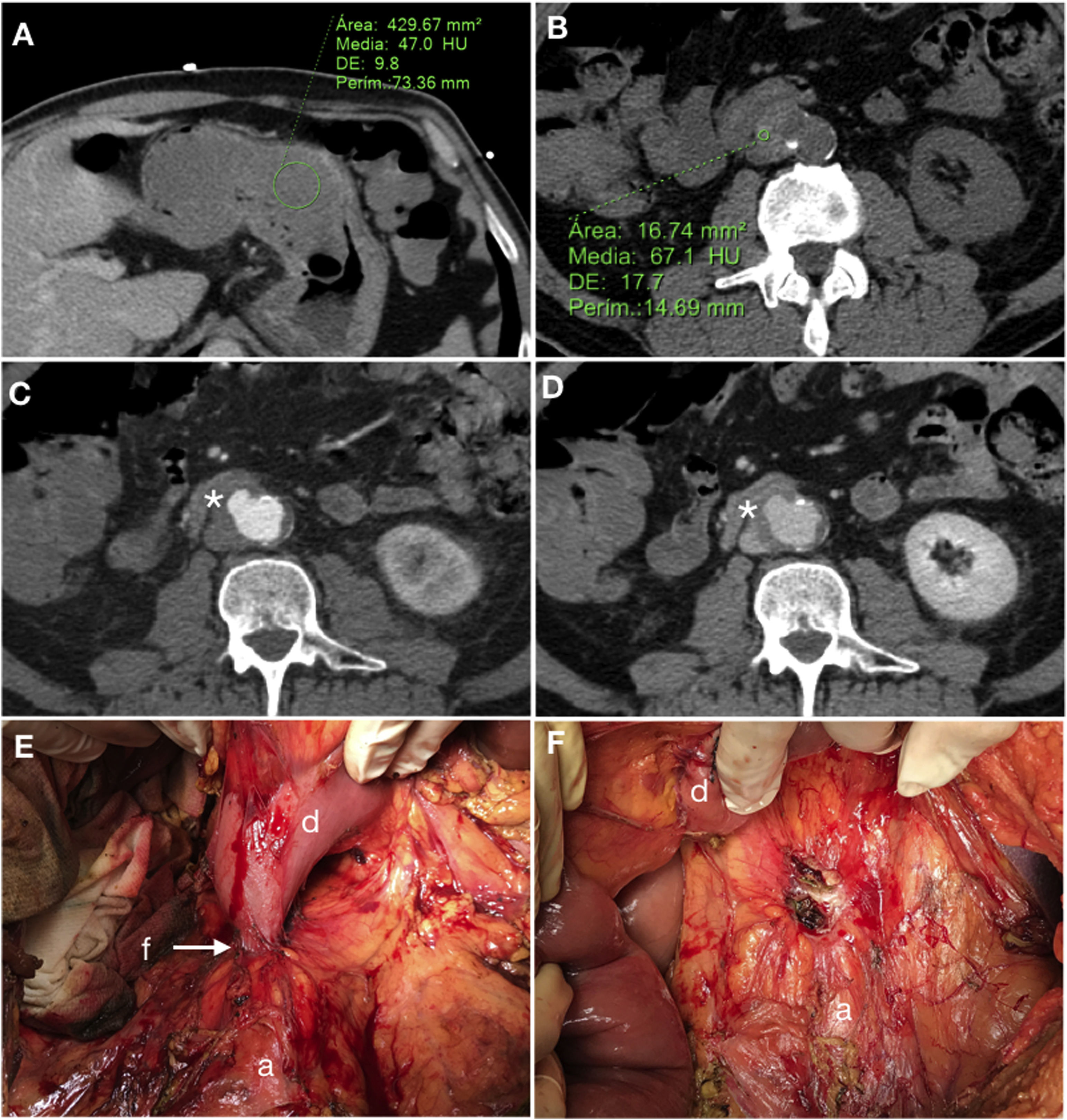
Fístula aortoduodenal primaria en varón de 65 años con episodio de vómitos intermitentes y melenas de 2 semanas de evolución que acude a Urgencias con hematemesis, mareo e hipotensión. La tomografía computarizada basal (A, B) demuestra contenido de alta densidad (47 UH) en la cámara gástrica en relación con coágulo y un aneurisma calcificado en aorta abdominal con hematoma intramural. La fase arterial (C) revela un abombamiento sacular en la cara anterolateral de la aorta con pérdida del plano graso de separación con el duodeno (*). En fase tardía (D) no se demuestra clara extravasación de CIV. La laparoscopia confirmó la presencia de FAE (E) (a: aorta; d: duodeno; f: fístula) que fue reparada en el mismo acto quirúrgico (F) incluyendo resección segmentaria del duodeno.
En la FAE secundaria debe tenerse en cuenta además que las burbujas de gas ectópico más allá de 3-4 semanas desde la cirugía son un hallazgo anormal en el contexto posquirúrgico y debe alertar al radiólogo. Análogamente, el engrosamiento de atenuación de partes blandas, líquido libre y hematoma posquirúrgico deben resolverse en 2-3 meses tras la cirugía21.
Si la sospecha es de erosión del injerto en contexto de FAE secundaria, las técnicas de medicina nuclear como 18-FDG PET-TC o SPECT con leucocitos marcados pueden ser de gran utilidad para detectar la presencia de infección periinjerto22 (fig. 9). Demostrar la existencia de fistulización en ausencia de signos específicos es un verdadero reto diagnóstico, ya que los hallazgos de infección se superponen con los de la FAE. Es precisamente en estos casos donde la gammagrafía con hematíes podría ser de utilidad.
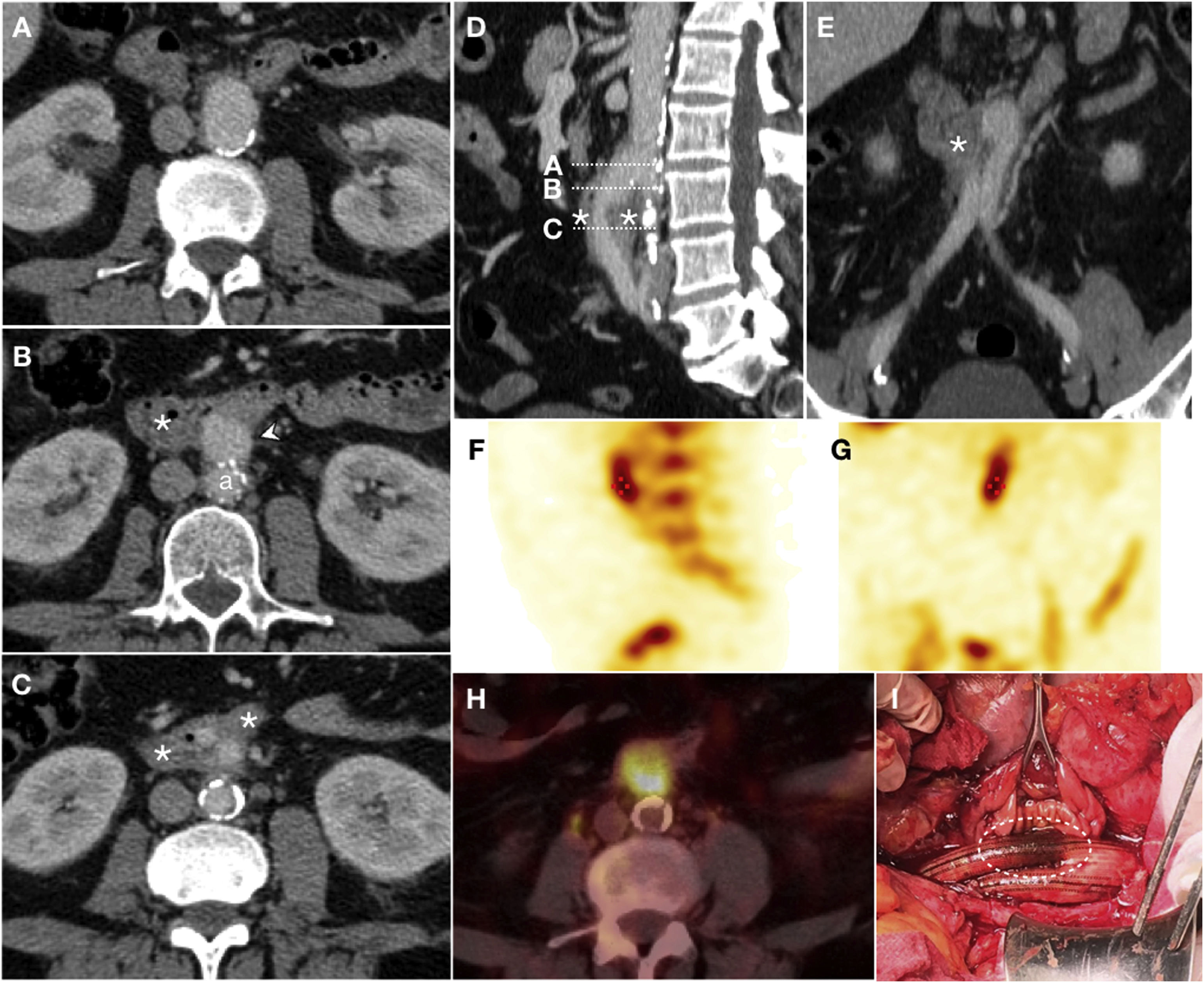
Erosión del injerto en varón de 61 años con antecedente de bypass aortobifemoral que presenta fiebre de largo tiempo de evolución, escalofríos, debilidad y bacteriemia persistente. Ante la sospecha de infección del injerto se realiza TC con CIV en fase portal (A, B, C) que revela edema periinjerto y engrosamiento parietal de la tercera porción del duodeno (*) englobando la rama iliaca derecha del bypass en ausencia de plano graso de separación. La reconstrucción sagital (D) representa el nivel de los cortes axiales y la reconstrucción coronal (E) apoya los hallazgos descritos. No se objetiva extravasación de CIV. Se realiza SPECT con leucocitos marcados (F, G) que demuestra acúmulo de radiotrazador y PET-TC (H) que pone de manifiesto el incremento de la actividad metabólica en la región proximal del injerto, hallazgos sugestivos de infección. La cirugía (I) demostró la presencia de erosión del injerto (elipse discontinua).
La FAE es una entidad rara pero muy grave que requiere un diagnóstico certero y precoz para la supervivencia del paciente. Las FAE primarias suelen ocurrir en pacientes que acuden con un cuadro de hemorragia digestiva en asociación con un aneurisma de aorta abdominal complicado. Las FAE secundarias, mucho más frecuentes, ocurren en pacientes con cirugía previa sobre la aorta y el espectro de presentación abarca desde la hemorragia masiva por una comunicación franca con el lumen entérico hasta formas clínicas más larvadas por erosión del injerto, en cuyo caso la hemorragia es de menor trascendencia. Es un error pensar que la FAE asocia inequívocamente una hemorragia manifiesta, ya que se puede presentar como sepsis, malestar y pérdida de peso (continuum infección periinjerto - FAE).
La TC es esencial para realizar un diagnóstico preciso. La ausencia de extravasación de contraste intravenoso o gas ectópico periaórtico/periprotésico no excluye el diagnóstico de FAE, ya que son signos directos de alta especificidad pero baja sensibilidad. La pérdida del plano graso de separación (en la cirugía se interpone omento) con engrosamiento focal de la pared intestinal, líquido libre y/o edema de los tejidos periaórticos/periprotésicos son hallazgos que deben alertar al radiólogo en contexto clínico adecuado.
Ante la sospecha de infección de prótesis aórtica no siempre podremos determinar la existencia de fistulización, en cuyo caso las pruebas de medicina nuclear podrían ser de utilidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.