La hipertensión pulmonar (HP) es una enfermedad caracterizada por la progresiva afectación de los vasos pulmonares, lo que produce aumento de las resistencias vasculares y, como consecuencia, fallo ventricular derecho. La lesión vascular es el factor común a un amplio abanico de patologías y su resultado, la HP, un cuadro clínico grave de mal pronóstico, que agrava el curso normal de las enfermedades a las que se asocia (EPOC, colagenosis, sarcoidosis, cardiopatías congénitas o adquiridas…).
El interés por diagnosticarla lo más precozmente posible se debe a que, actualmente, se dispone de fármacos que mejoran la calidad de vida y han disminuido la mortalidad de estos pacientes y que existen posibilidades quirúrgicas para algunos tipos de hipertensión como la tromboembólica crónica o la asociada a algunas cardiopatías congénitas con cortocircuitos izquierda-derecha.
Ante una sospecha clínica de HP los métodos de imagen son los que confirman el diagnóstico, sugieren una causa, ayudan a seleccionar el tratamiento más adecuado y monitorizan la respuesta. En la actual revisión del tema se presenta la aportación de los diferentes métodos de imagen para el diagnóstico de la enfermedad, haciendo especial hincapié en la TC multidetector (TCMD), que ofrece la posibilidad de estudiar con una sola adquisición todos los órganos torácicos.
Se revisan los signos radiológicos de HP y se establecen los criterios radiológicos actuales para etiquetar el tipo de hipertensión, según la clasificación de Dana Point, basados en el estudio de las alteraciones del parénquima pulmonar, mediastino, espacios pleurales y pericardio y en el estudio de las cámaras cardíacas.
Pulmonary hypertension is characterized by progressive involvement of the pulmonary vessels that leads to increased vascular resistance and consequently to right ventricular failure. Vascular lesions are a common factor in a wide spectrum of diseases, and their result, pulmonary hypertension, is a severe clinical condition with a poor prognosis that worsens the normal course of the diseases to which it is associated (COPD, collagen disease, sarcoidosis, and congenital or acquired heart disease).
It is important for pulmonary hypertension to be diagnosed as early as possible because nowadays drugs can reduce mortality and improve the quality of life; furthermore, some types of pulmonary hypertension (e.g., chronic thromboembolism and those associated with some congenital heart diseases like left-to-right shunt) can be treated surgically.
In cases of suspected pulmonary hypertension, imaging methods can confirm the diagnosis, suggest a cause, help choose the most appropriate treatment, and monitor the response to treatment. This review describes the approach to pulmonary hypertension using different imaging techniques; special emphasis is given to the role of multidetector CT (MDCT), which makes it possible to study all the organs in the thorax in a single acquisition.
We review the radiological signs of pulmonary hypertension and the current (Dana Point) radiological criteria for classifying the type of hypertension based on alterations in the lung parenchyma, mediastinum, pleural spaces, and pericardium, as well as on the study of the chambers of the heart.
La hipertensión pulmonar (HP) se define como un grupo de enfermedades caracterizadas por un incremento progresivo de la resistencia vascular pulmonar que lleva al fallo del ventrículo derecho (VD) y muerte. La capacidad funcional del VD es el mayor determinante pronóstico en la HP1,2.
La HP idiopática es una enfermedad rara, con una incidencia entre 2,5 y 3,5 casos por millón de habitantes en los países occidentales. Es 2 o 3 veces más frecuente en mujeres que en varones, a cualquier edad, con la mayor frecuencia en la 4.a, 5.a y 6.a décadas. Es más frecuente la HP asociada a otras patologías, aunque su incidencia real, en esos casos, no se conoce3.
Se considera HP cuando el valor medio de la presión en la arteria pulmonar (AP), medido con cateterismo cardíaco derecho, es igual o superior a 25mmHg en reposo. Además de esta cifra, la combinación de distintos parámetros hemodinámicos como gasto cardíaco normal o reducido, presión de enclavamiento capilar normal o, lo que es lo mismo, presión en aurícula izquierda normal (menor o igual a 15mmHg) y resistencia vascular pulmonar elevada (mayor o igual a 240dynas/sg/cm−5, o mayor de 3 unidades Wood), permiten diferenciar la HP precapilar (grupos clínicos 1, 3, 4 y 5) de la poscapilar (grupo clínico 2) (tabla 1)3,4.
Clasificación actualizada de la hipertensión pulmonar (Dana Point, 2008)6
|
| 1′. Enfermedad venooclusiva pulmonar y/o hemangiomatosis capilar pulmonar |
|
ALK-1: cinasa tipo 1 similar a los receptores de activina; BMPR2: receptor de proteínas morfogenéticas óseas tipo 2; VIH: virus de la inmunodeficiencia humana.
La clasificación clínica es clave para identificar el tipo de HP y planificar el tratamiento. La última clasificación se estableció en el 4.o Congreso Mundial sobre Hipertensión Pulmonar celebrado en Febrero de 2008 en Dana Point (tabla 1). Agrupa enfermedades que causan o pueden cursar con HP y que muestran similitud en la presentación clínica, en su patofisiología y en las opciones terapéuticas3,5.
Cambios histológicosTodos los tipos de HP muestran idénticos cambios patológicos obstructivos en la microcirculación pulmonar, definidos como enfermedad vascular pulmonar hipertensiva. Esta similitud sugiere un proceso patobiológico compartido por el espectro de enfermedades de HP2,6. No se conoce el proceso exacto que inicia los cambios patológicos, pero se sabe que la patobiología es multifactorial y que al incremento de las resistencias vasculares que caracteriza la enfermedad se llega a través de: vasoconstricción, remodelado obstructivo de la pared del vaso, inflamación y trombosis1,7.
El remodelado proliferativo vascular afecta a todas las capas de la pared. El principal hallazgo patológico es una proliferación celular anormal y desorganizada, que causa un marcado engrosamiento parietal. Se desarrollan lesiones vasculares complejas como las lesiones plexiformes, que producen obstrucción de arterias pequeñas e incremento de resistencias.
La presencia de microtrombos en arteriolas pulmonares no se sabe si es la causa o la consecuencia de la HP, pero parece indudable que su presencia contribuye a la progresión de la enfermedad; aparecen hasta en el 50% de los casos de HP idiopática8 y frecuentemente en el síndrome de Eisenmenger9.
Técnicas de imagen para el diagnóstico y evaluación de la enfermedadAnte la sospecha clínica, debe seguirse una estrategia diagnóstica de utilización de distintas pruebas técnicas dirigidas a confirmar el diagnóstico, identificar su tipo según la clasificación clínica de Dana Point para, finalmente, realizar una evaluación funcional y terapéutica de la enfermedad3,6.
EcocardiografíaEs el primer método diagnóstico que debe emplearse ante la sospecha de HP y, posteriormente, para evaluar la respuesta al tratamiento. También se utiliza como método de cribado en los grupos de riesgo: familiares de primer grado de HP, colagenosis (sobre todo esclerodermia y CREST), cardiopatías congénitas, infección por el virus de la inmunodeficiencia humana (VIH). En la hipertensión portal es imprescindible la valoración antes del trasplante hepático, ya que la HP, en la hepatopatía crónica, contraindica el trasplante hepático2.
Los objetivos de la ecocardiografía en la HP son:
- •
Detectar la presión pulmonar elevada.
- •
Evaluar la función del VD.
- •
Realizar el diagnóstico diferencial, ya que se valoran el tamaño de las cavidades cardíacas, la función valvular, el grosor y funcionamiento de las paredes ventriculares. Además se pueden estudiar cortocircuitos intracardíacos y, con ecocardiografía transesofágica, la presencia de ductus u otros cortocircuitos extracardíacos.
Por todo ello, la ecocardiografía permite el estudio etiológico de la HP en los casos de enfermedad congénita y enfermedad de corazón izquierdo2,6, aporta una valiosa información sobre la gravedad y pronóstico de la HP y puede controlar el resultado terapéutico4,11.
Existen distintos métodos de estimación de la cifra de presión en la AP con ecocardiografía y, en general, existe una buena correlación con la presión pulmonar medida con Doppler con contraste (en un 10% de casos no puede medirse), pero no hay una correlación exacta con las cifras obtenidas con el cateterismo cardíaco derecho, ya que la ecocardiografía tiene tendencia a sobreestimar las presiones2–4,6.
Estudio hemodinámicoEs el único método que puede establecer un diagnóstico definitivo de HP, ya que mide directamente la presión de la AP, por lo que es el patrón de referencia para el diagnóstico de la enfermedad e indispensable antes de iniciar cualquier tratamiento específico3,4,11,12.
Tiene tres misiones fundamentales:
- •
Determinar la hemodinámica del VD y de la AP, midiendo directamente la presión de la AP, la presión capilar enclavada y estimar la resistencia vascular. Medir el gasto cardíaco y determinar las saturaciones de oxígeno de las distintas cavidades.
- •
Medir la respuesta vasodilatadora de los agentes terapéuticos (óxido nitroso, epoprostenol).
- •
Excluir un cortocircuito izquierda-derecha, así como cualquier lesión izquierda significativa y valorar el ostium de salida de las arterias coronarias12.
Ante la sospecha de tromboembolismo pulmonar crónico (TEPC), la arteriografía pulmonar también se utiliza para establecer la localización del trombo, extensión, tamaño y seleccionar los candidatos a tromboendarterectomía.
Gammagrafía pulmonar de ventilación/perfusiónDurante muchos años ha sido la prueba principal para diagnóstico de émbolos pulmonares agudos, pero actualmente se utiliza más como cribado de HP tromboembólica crónica (HPTEC), al finalizar el tratamiento anticoagulante, tras un episodio de tromboembolismo pulmonar agudo, para establecer el estado de la perfusión pulmonar y rescatar los casos de posible evolución hacia HPTEC6,16.
Una gammagrafía de ventilación- perfusión (V/Q) normal, prácticamente excluye la HPTEC. Una gammagrafía de alta probabilidad muestra múltiples defectos de perfusión bilaterales, segmentarios o mayores, con ventilación normal, aunque esta imagen no es específica de HPTEC y ocasionalmente, puede aparecer en otros tipos de HP como la enfermedad venooclusiva, o en otras patologías como el sarcoma de la AP, las vasculitis de la AP o la mediastinitis fibrosante13,14. En el caso de HP asociada a cardiopatía congénita o en la HP idiopática, la perfusión es normal o aparecen defectos mínimos14,15.
Resonancia magnética (RM)Tiene la ventaja de ser un método morfológico y funcional, por lo que algunos autores lo proponen como patrón de referencia en la HP2 para la valoración del VD.
Realizada con contraste intravenoso permite visualizar los vasos mediastínicos y pulmonares y realizar un estudio funcional de las cámaras cardíacas4,11,15. El estudio planimétrico en modo cine permite medir los volúmenes ventriculares sistólico y diastólico finales, fracción de eyección, volumen por latido, masa muscular, alteraciones en el movimiento de la pared ventricular o del septo interventricular. También puede medir el flujo sistémico y pulmonar en la estimación de cortocircuitos derecha-izquierda o izquierda-derecha y se ha encontrado buena correlación entre los parámetros de la curva de velocidad de la sangre en la AP y el grado de hipertensión y resistencias pulmonares17. La RM es superior a la ecocardiografía para valorar el remodelado de la pared ventricular derecha.
Su mayor ventaja es la ausencia de radiación ionizante, por lo que es la técnica ideal para jóvenes o enfermos que requieran estudios seriados. La mayor desventaja del método es una resolución espacial inferior a la de la tomografía computarizada (TC) y la angiografía, lo que impide valorar adecuadamente los vasos más allá del nivel segmentario y el parénquima pulmonar. También son inconvenientes de la RM, comparada con la TC, la menor disponibilidad de resonancias, así como la mayor duración del examen y el gantry cerrado que requieren mayor colaboración del enfermo y que pueden hacer el examen imposible por claustrofobia16. Ya que no es un método invasivo puede utilizarse repetidamente para valorar la progresión de la enfermedad o la respuesta al tratamiento2,6.
Tomografía axial computarizada multidetector (TCMD)Con la Tomografía Computarizada Multidetector (TCMD) se consigue una adquisición volumétrica. Utilizando una colimación inferior a 1mm en la adquisición, se pueden realizar reconstrucciones multiplanares de gran fiabilidad, en cualquier plano del espacio. La creación de slabs o rodajas de espesor variable con selección de puntos de Máxima Intensidad de Proyección (slab-MIP) es de gran ayuda para: seguir vasos arteriales de muy pequeño calibre como los subsegmentarios o arterias bronquiales o intercostales, valorar las cámaras cardíacas, la pared ventricular, el drenaje venoso pulmonar y realizar un estudio de alta resolución del parénquima pulmonar. Todo ello nos aproxima a un diagnóstico etiológico de la HP y por ello, las nuevas «guías de la ESC/ERS»6 proponen la realización de una TC torácica desde el momento de sospecha de la enfermedad2,4.
Concretamente, en el caso de la HPTEC, la angioTC (ATC) ofrece un mapa fiable de la localización y extensión de los trombos, membranas intraarteriales y estenosis. En la valoración de los trombos murales no oclusivos o en los calcificados, supera a la angiografía. Además, es un buen método no invasivo para estudiar los resultados de los tratamientos quirúrgicos, como endarterectomía u otros.
El estudio con TC es únicamente morfológico pero, últimamente, se está proponiendo el estudio dinámico de TCMD con sincronización cardíaca para el estudio funcional de volúmenes sistólico y diastólico ventriculares, fracción de eyección y masa ventricular18 e, incluso, para valorar la gravedad de la HP midiendo la distensibilidad de la AP en sístole y diástole y relacionándola con la presión media de la AP19.
Técnica de TCMDSe utilizan equipos de TC con paneles de 4, 8, 16 y 64 detectores. La exploración siempre se realiza en apnea y puede realizarse en dirección cráneo-caudal, siguiendo la dirección de entrada del contraste intravenoso, o caudo-craneal para visualizar de forma precoz los vasos distales de los lóbulos inferiores, donde son más frecuentes los émbolos subsegmentarios. Este último dato tiene mayor importancia en el estudio del TEP agudo que en el de la HPTEC. El estudio debe incluir desde los troncos supraaórticos hasta la desembocadura de las venas suprahepáticas en la vena cava inferior. La colimación del corte debe ser la menor que permita el aparato, con reconstrucciones de 1mm o menores y solapamiento del 50%, lo que permite reconstrucciones multiplanares de alta calidad. La dosis de radiación es de 100–120KV y 70–200mAs con modulación de dosis y se han propuesto distintos protocolos de exploración para minimizar el riesgo de radiación20.
Se utiliza contraste intravenoso no iónico, con una concentración de Iodo de 350–370mgr/cc y tasa de inyección de 4cc/s. El tiempo óptimo de adquisición de las imágenes se calcula con el método de «bolus-tracking», poniendo el cursor en la AP21 con un umbral de disparo en 150–180 unidades Hounsfield. El estudio de las imágenes se realiza en la consola de trabajo con ventanas de: parénquima pulmonar (W 1600/ L-600), partes blandas (W500/L 35) y angiográfica (W 700/L 100). Se realizan reconstrucciones multiplanares con técnica de proyección Máxima Intensidad de Proyección (MIP) y proyección Mínima Intensidad de Proyección (minIP) de distintos grosores y reconstrucción volumétrica.
Diagnóstico de HP con TCMD- 1.
Alteraciones vasculares
- •
El calibre de la AP fue el primer signo radiológico que se valoró. El diámetro de la AP principal debe medirse en el plano de su bifurcación en ángulo recto a su eje largo y justo lateral a la aorta ascendente. Para Kuriyama22, cuando es mayor o igual a 29mm tiene un VPP de 0,97, un 87% sensibilidad y 89% de especificidad para HP, por lo que esta cifra se ha venido usando como indicadora de HP8,9. Pero actualmente está comprobado que las medidas absolutas no son totalmente fiables, pues hay que tener en cuenta que la presión y el tamaño de la AP dependen de la masa corporal, del sexo y de la edad. Aparece aumentada en un 6% de individuos normales mayores de 50 años y en personas obesas. Aumenta con el ejercicio y en atletas2.
- •
La especificidad sube a 100% cuando, además de un diámetro igual o mayor a 29mm, se encuentra una relación arteria-bronquio segmentario mayor de 1:1 en la mayoría de los lóbulos pulmonares8,9.
- •
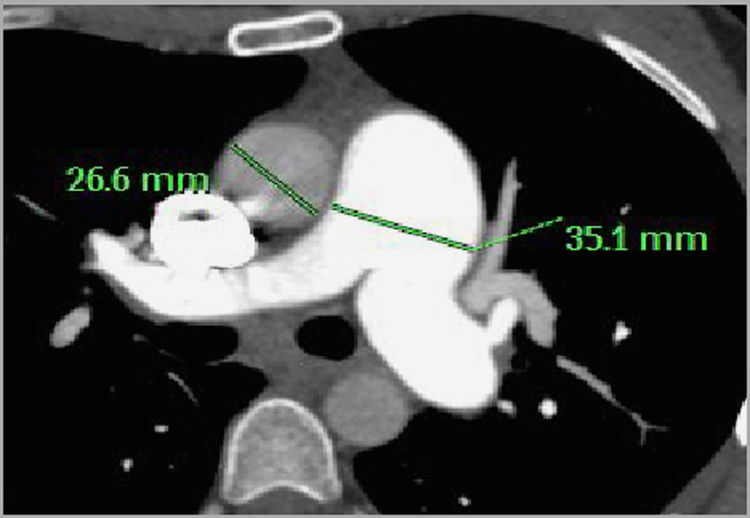
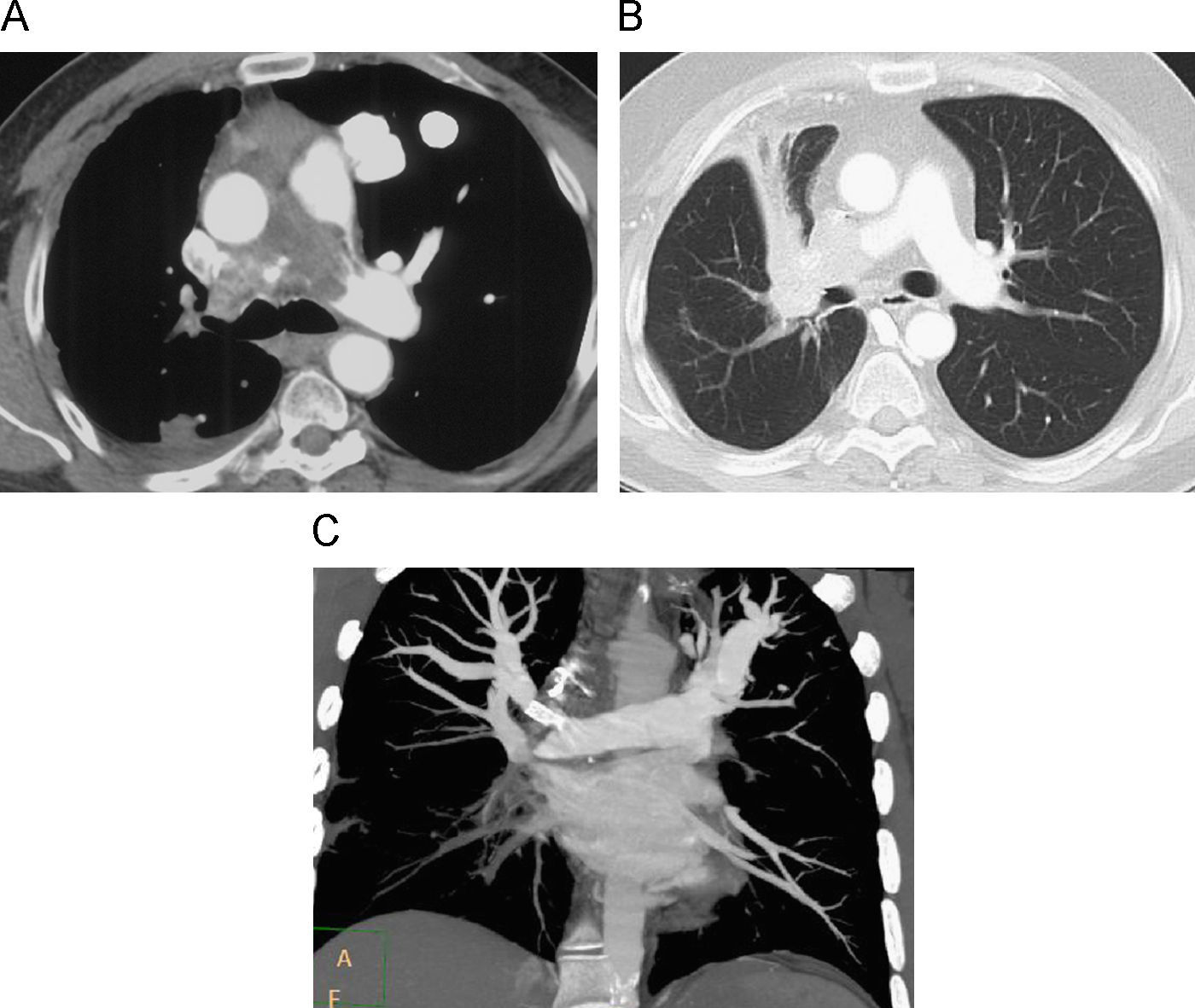
Es preferible comparar la AP principal con la aorta (Ao) adyacente y, si el cociente AP/Ao es mayor de 1, es muy probable la HP, sobre todo en pacientes menores de 50 años23 (fig. 1).
- •
Otro parámetro reciente es el reconocimiento de la AP a nivel del cayado aórtico (signo del huevo –AP- y la banana –Ao)9; se observa en casos de HP severa (fig. 2A).
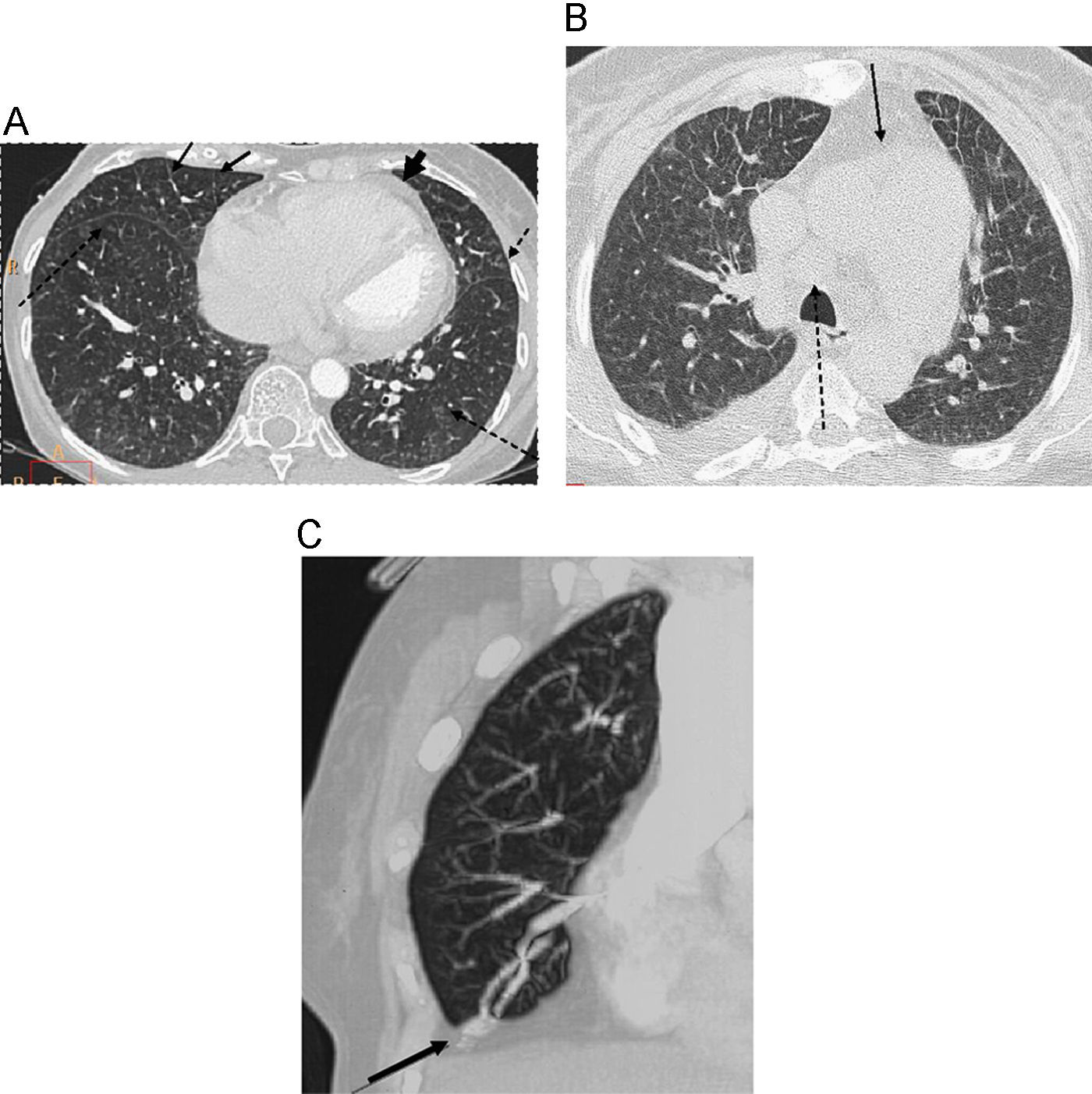
Figura 2.Cambios vasculares (Cortes axial y axial oblicuo con reconstrucción MIP). A) En el mediastino se observa la AP (AP) a la misma altura que el cayado aórtico (signo del huevo y la banana).Discordancia entre el calibre de los vasos centrales y periféricos. Vasos neoformados en la periferia pulmonar. Se originan en el centro del lóbulo pulmonar secundario y tienen un trayecto serpiginoso e irregular (flechas negras). B) Vasos periféricos con morfología en sacacorchos. Anastomosis (flecha) entre un vaso periférico y un vaso sistémico (intercostal).
(0.12MB). - •
Dentro de los vasos parenquimatosos Sheehan10 ha señalado el fenómeno de la «neovascularización» que describe vasos periféricos, serpiginosos, finos que frecuentemente emergen de arteriolas centrilobulares, sin seguir la anatomía habitual de los vasos pulmonares. Los describió en la HP idiopática y en el síndrome de Eisenmenger pero parecen una manifestación de HP grave de cualquier causa9 (fig. 2A).
- •
Anastomosis periféricas de vasos sistémicos, intercostales, que irrigan la periferia pulmonar8,10 (fig. 2B).
- •
- 2.
Alteraciones cardíacas
La alteración funcional del VD parece ser el mayor determinante de progresión de la enfermedad y del pronóstico. Aunque el lecho vascular pulmonar es la causa primaria de la enfermedad, los síntomas y el pronóstico están fuertemente relacionados con la función de bomba del VD. La sobrecarga crónica del VD produce cambios en la morfología y función cardíacas que afectan a los dos ventrículos. Los cambios estructurales de las cámaras derechas incluyen hipertrofia y dilatación del VD, agrandamiento de la aurícula derecha (AD) y regurgitación funcional tricúspida, causada por dilatación del anillo valvular. El incremento progresivo de la presión del VD perjudica la estructura y función del ventrículo izquierdo (VI), que disminuye de tamaño y se distorsiona24.
- •
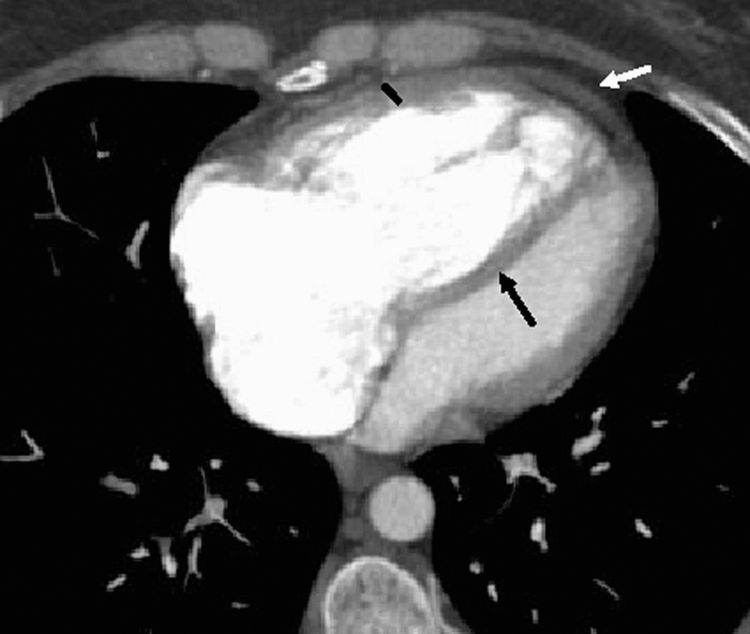
Hay que medir la relación de tamaño entre los dos ventrículos. La medida puede realizarse en cortes axiales, pero la realizada en un plano de cuatro cámaras se correlaciona mejor con la obtenida en la ecocardiografía. En condiciones normales el diámetro del VI es mayor que el derecho (fig. 3).
Figura 3.Signos cardíacos. Medición de las cámaras cardíacas en un plano cuatro cámaras: Ventrículo derecho mayor que el izquierdo con pared engrosada (guión negro), inversión del tabique interventricular (flecha negra) y pequeño derrame pericárdico (flecha blanca). Estos dos últimos hallazgos son signos de mal pronóstico.
(0.05MB). - •
Posición del tabique interventricular: el incremento de la presión en VD va modificando la posición normal del tabique interventricular y cuando se alcanzan presiones muy altas se invierte el septo interventricular y produce disfunción del VI, con disminución de su volumen/minuto (gasto), situación muy grave. La inversión del septo es signo de mal pronóstico (fig. 3).
- •
Aumento del espesor de la pared de VD. Se considera patológico por encima de 4mm24 (fig. 3).
- •
El aumento de tamaño de la AD y la regurgitación de contraste a la VCI y suprahepáticas indica insuficiencia tricuspídea con 90% de sensibilidad y 100% de especificidad; el reflujo hacia las suprahepáticas significa mayor grado de HP que el reflujo hacia la VCI9,16,24, que también puede observarse en individuos normales cuando la tasa de inyección del contraste es muy alta25.
- •
La dilatación de las venas cavas y de la ácigos se ha valorado como marcador de hipertensión en el lado derecho; Isaacs propone valorar también la distensión del seno coronario, fácilmente identificable en casi todos los estudios de TC. Por encima de 11mm la dilatación del seno coronario se asocia con aumento de la presión en la AP, comprobado con cateterismo26.
- •
Engrosamiento o derrame pericárdico. Es más frecuente y más precoz observarlo en el receso anterior o aorto-pulmonar, donde forma la imagen de la parte inferior de un «bikini». Puede considerarse un signo indirecto de HP, particularmente si se asocia con aumento del diámetro de la AP. No tiene por qué asociarse a derrame pleural9,27. También es un signo de disfunción del VD y de mal pronóstico (figs. 2A, 3 y 5B).
- •
Además de sugerir el diagnóstico, por los signos ya comentados, la TCMD es la herramienta más completa para hacer un diagnóstico diferencial del grupo de HP, siguiendo la clasificación clínica de Dana Point 2008 (tabla 1).
Valorando cuidadosamente los distintos órganos torácicos (parénquima pulmonar, mediastino y cámaras cardíacas), no solamente podemos diferenciar entre los distintos tipos de HP, sino también diagnosticar sus complicaciones o los resultados posquirúrgicos (tromboendarterectomía y corrección de cortocircuitos).
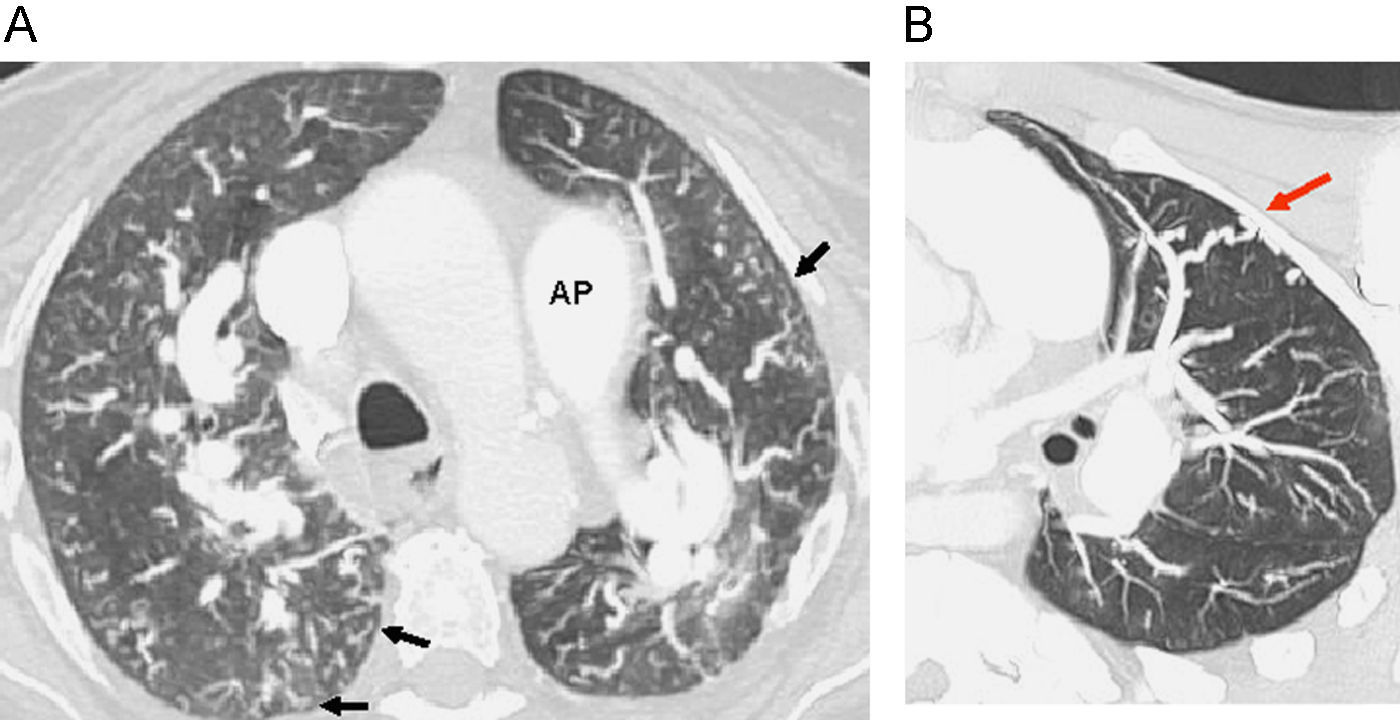
Alteraciones del parénquima pulmonarAsimetría en el calibre vascularEs típica de la HPTEC y no aparece en otros tipos de HP. La variación regional marcada del tamaño de los vasos segmentarios ayuda a distinguir la HPTEC del patrón más difuso del resto de causas de HP3. Pueden observarse también cambios de calibre bronquiales que acompañan a los vasculares en el caso de HPTEC como dilatación de la luz bronquial junto al vaso ocluido33,34 (fig. 4).
Asimetría del calibre de los vasos en los distintos lóbulos pulmonares. Imagen en mosaico con áreas hiperatenuantes en LII que contienen vasos de mayor calibre. Obsérvense las dilataciones de bronquios subsegmentarios en el LSI hipoatenuante (flechas). La imagen en mosaico no sirve para el diagnóstico diferencial del tipo de HP. La asociación con vasos de distinto calibre y alteraciones de la vía aérea sugieren HPTEC.
- •
En algunos casos, la TC descubre nódulos pequeños o medios, difusos, sin predominio zonal y en número variable. Típicamente tienen una localización centrilobular y el estudio histológico demuestra su vecindad con arteriola/bronquiolo. La etiología de estos nódulos es diversa, pueden ser debidos a granulomas de colesterol, acúmulo de lesiones plexiformes o quizás a anastomosis de vasos sistémicos con pulmonares. Plantean el diagnóstico diferencial con sarcoidosis, neumonitis por hipersensibilidad, bronquiolitis o aspiración crónica por reflujo gastroesofágico28,29.
- •
Cuando los nódulos tienen densidad en vidrio deslustrado y se acompañan de engrosamiento de septos en alguno de los cortes, debe sugerirse la posibilidad de enfermedad venooclusiva o hemangiomatosis capilar. Las adenopatías mediastínicas (raras en la HP idiopática) tienen una especificidad del 100% para el diagnóstico de enfermedad venooclusiva, siempre que puedan excluirse la HPTEC y la insuficiencia cardíaca congestiva30. Aumenta la especificidad en el diagnóstico si aparecen 2 o 3 de estos signos (nódulos, septos y adenopatías) (fig. 5A y B). Estos datos radiológicos deben valorarse junto con datos clínicos: en comparación con los enfermos con HP idiopática, aquellos con enfermedad venooclusiva presentan menor saturación de O2, mayor desaturación en el test de la marcha de 6min, alteración en la difusión de CO y restos de hemorragia en el lavado broncoalveolar.
Figura 5.Nódulos parenquimatosos. A) Nódulos milimétricos en vidrio deslustrado, centrilobulares (flechas discontinuas), septos interlobulillares engrosados (flechas negras) y pequeño derrame pericárdico (flecha gruesa). B) Septos interlobulillares engrosados, adenopatía mediastínica (flecha discontinua), derrame pleural derecho y derrame pericárdico en el receso anterosuperior (flecha). Las figuras A y B reúnen los signos radiológicos de la HP venooclusiva. C) Reconstrucción coronal oblicua MIP que muestra una fístula arteriovenosa en un paciente con HP: Enfermedad de Rendu-Osler.
(0.22MB).La enfermedad venooclusiva y la hemangiomatosis capilar son causas raras de HP. Se clasifican como grupo 1’ en la nueva clasificación clínica5 (tabla 1). Desde las primeras descripciones se especula sobre si son dos enfermedades o distintas manifestaciones de la misma30–32. Clínicamente son indistinguibles de la HP idiopática, al menos en su inicio. Histológicamente la afectación es de vénulas septales y el pronóstico es muy malo. Se caracterizan por un empeoramiento clínico rápido con vasodilatadores, por lo que se incluyen precozmente en lista de trasplante pulmonar o cardiopulmonar. Descartar este tipo de HP es una de las razones por las que las nuevas guías de práctica clínica6 recomiendan realizar una TC antes de iniciar el tratamiento. Cada vez se describe asociada a un mayor número de enfermedades: colagenosis, tiroiditis de Hashimoto, sarcoidosis, trasplante de médula ósea, infección por VIH, tratamientos de quimioterapia/radioterapia y procesos mieloproliferativos.
- •
Los nódulos subpleurales y las bandas parenquimatosas sugieren infartos en distinta fase de evolución y son significativamente más frecuentes en la HPTEC33,34.
- •
Las fístulas arteriovenosas tienen una morfología característica, con un vaso nutricio aferente y otro eferente de drenaje y sugieren enfermedad de Rendu-Osler-Weber y la posibilidad de embolización percutánea como parte del tratamiento (fig. 5C).
El patrón en mosaico, visto en cualquier forma de HP, traduce la alteración vascular de pequeño vaso o alteraciones regionales de la perfusión. Se describió en la HPTEC, pero aparece con frecuencia en la HP idiopática y en el síndrome de Eisenmenger y, aunque es más frecuente en la HPTEC, no sirve para el diagnóstico diferencial de otros tipos. En el caso de la HPTEC las zonas hiperatenuantes muestran vasos de mayor calibre (fig. 4).
Enfermedad parenquimatosa difusaCon los cortes de alta resolución obtenidos para el estudio de la HP pueden reconocerse alteraciones parenquimatosas de neumonía intersticial usual (NIU) o de colagenosis, (Grupo 1.4.1) (tabla 1), que representan la segunda causa de HP por frecuencia, después de la idiopática3. Clínicamente tienen peor pronóstico global y detectar signos de HP tiene implicaciones terapéuticas si se contempla el trasplante pulmonar como tratamiento de la patología pulmonar. La HP en estos casos no se debe a la destrucción del lecho vascular, sino a la lesión vascular con lesiones plexiformes. No existe relación entre el diámetro de la AP y la cifra de presión media en la AP y es poco valorable la relación arteria/bronquio segmentario por la existencia de bronquiectasias de tracción. Se recomienda valorar la relación AP/aorta9,35 que se reconoce sin dificultad en los estudios seriados de enfermedad difusa pulmonar y puede ser nuestra aportación radiológica al cribado de la HP.
Lo mismo puede recomendarse en los casos de EPOC, sarcoidosis o histiocitosis X propuestos para trasplante de pulmón o en controles de TC, ya que la aparición de HP en todos ellos empeora el pronóstico de manera significativa y puede contraindicar el trasplante pulmonar36.
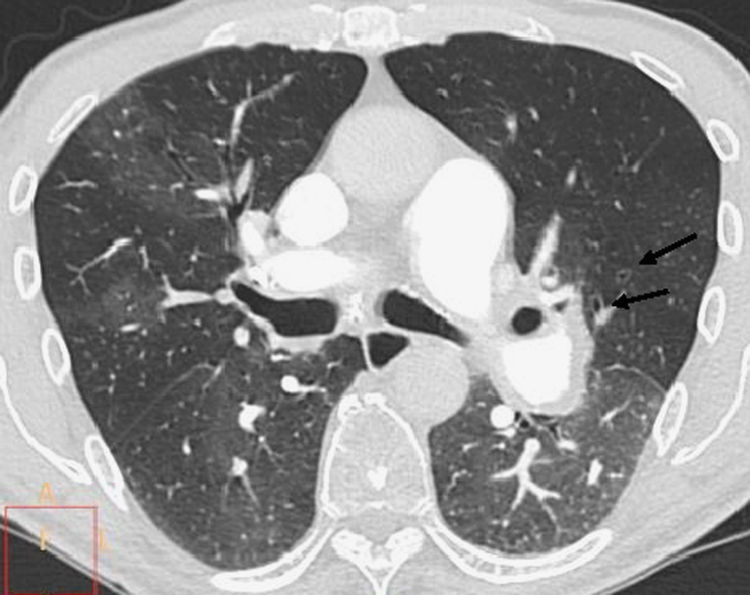
Alteraciones mediastínicasAdenopatíasPueden verse en la HPTEC y en la enfermedad venooclusiva. Son raras en la idiopática. Deben valorarse con el resto de hallazgos para establecer el diagnóstico entre las dos primeras30,31 (fig. 5B).
Hipertrofia de arterias sistémicas:Las arterias bronquiales nacen de la aorta torácica; en su origen tienen un diámetro de hasta 1,4mm y establecen anastomosis con el árbol arterial pulmonar a través de múltiples conexiones microvasculares. Estas anastomosis ocurren no solamente a lo largo de los bronquios mayores sino más allá del lóbulo pulmonar, sobre las mismas paredes alveolares. La circulación bronquial responde a la disminución del flujo pulmonar con un aumento, hipertrofia y proliferación vascular a lo largo de esta maraña de canales anastomóticos10,37.
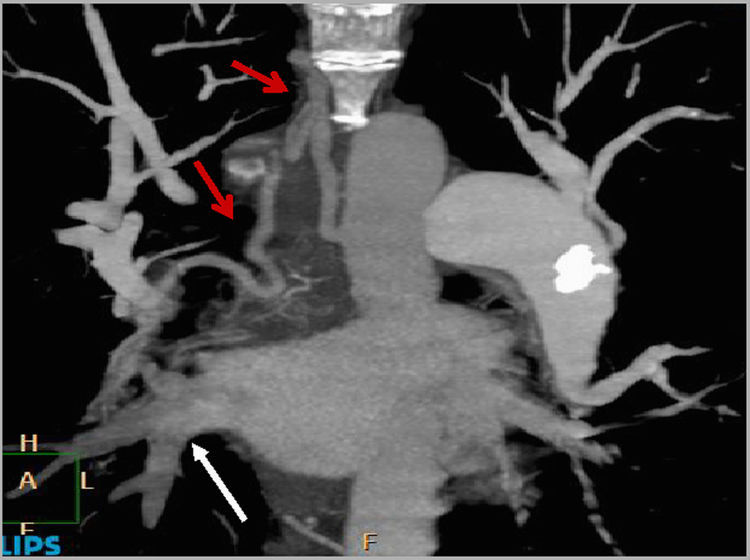
Pueden verse hipertróficas en la HP idiopática, pero es un hallazgo más frecuente en la tromboembólica. Además de las bronquiales, no es raro encontrar aumentadas otras arterias sistémicas como las del ligamento pulmonar, pleurales, intercostales, ramas de la subclavia, de la axilar, o frénicas; la hipertrofia de estas arterias sistémicas no bronquiales es casi exclusivo de la HP tromboembólica37 (fig. 6).
Circulación sistémica hacia el parénquima pulmonar. Reconstruccion MIP en coronal. Hipertrofia de la arteria bronquial derecha y del tronco vertebrocostal derecho (originados en la aorta torácica) (flechas rojas) en una obstrucción prácticamente total de la AP derecha. Obsérvese la falta de contraste en la vena pulmonar inferior derecha (flecha blanca). La AP izquierda presenta calcificación en su pared, signo de hipertensión pulmonar grave.
- •
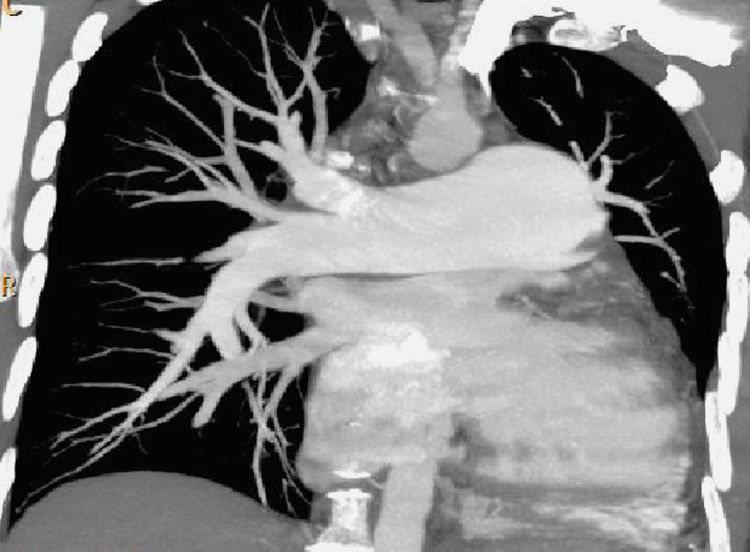
La HP idiopática afecta de forma generalizada a todo el árbol arterial, aumentando el calibre de las arterias centrales y produciendo un cambio progresivo y rápido del calibre de las arterias periféricas que pueden mostrar morfología en sacacorchos (fig. 2A y B). El número de ramificaciones arteriales está disminuido pero las paredes arteriales son lisas (fig. 7).
- •
En la HPTEC la morfología de las paredes arteriales es completamente distinta. Los trombos crónicos que se observan en este grupo de pacientes se adhieren a la pared del vaso produciendo un contorno festoneado cuando se observa el vaso en su eje longitudinal o un ángulo obtuso con las paredes arteriales cuando se observa en su eje transversal. La recanalización incompleta de los trombos produce imágenes de membranas intraarteriales, y distales a ellas se ven dilataciones postestenóticas. Los trombos que no se reabsorben o recanalizan producen estenosis completa de ramas con imagen de fondo de saco. Al final, el árbol arterial presenta una imagen de arterias con múltiples cambios de calibre, absolutamente típico de este tipo de hipertensión. Por lo general es bilateral y afecta tanto a ramas principales como lobares y segmentarias. Su diagnóstico permite plantear la posibilidad de tromboendarterectomía como tratamiento de estos pacientes33,34,38–40 (fig. 8A y B).
Figura 8.Morfología de los vasos en HPTEC. A) Trombo mural que produce un contorno festoneado visto en longitudinal (AP derecha) y una imagen en semiluna de ángulos obtusos (visto en axial) en la rama del LII (Reproducida con permiso Ref.34). B) Reconstrucción coronal MIP que muestra recanalización de trombos con membranas intraarteriales (flechas de puntos), dilataciones postestenóticas (asteriscos), obstrucciones vasculares en fondo de saco (flechas gruesas) y estenosis longitudinal (punta de flecha).
(0.07MB).
El papel fundamental de la TC, ante la obstrucción arterial, es excluir otras causas de alteraciones gammagráficas similares a la HPTEC como la enfermedad venooclusiva, el sarcoma de la AP, las vasculitis de grandes vasos, una compresión extrínseca vascular por carcinoma mediastínico, linfadenopatías, fibrosis mediastínica o trombosis venosa pulmonar38 (fig. 9A–C).
Utilidad de la TCMD en el diagnóstico diferencial de la obstrucción arterial. A) Sarcoma de AP con metástasis parenquimatosas calcificadas y derrame pleural. El tumor supera los límites del vaso en el mediastino y presenta captación heterogénea de contraste y áreas calcificadas. B) Mediastinitis fibrosante. La fibrosis engloba la arteria derecha, la vena cava superior, pleura mediastínica y anterior, y el bronquio del lóbulo medio. C) Arteritis de Takayasu. Se observa la obstrucción completa de las arterias de ambos lóbulos inferiores y dilataciones postestenóticas en los superiores. Endoprótesis permeable en la rama del LSD (Reproducida con permiso Ref.34).
Como en el caso de la hipertensión arterial sistémica, las complicaciones de la HP son calcificación de la pared arterial, formación de trombos, aneurismas y disección.
- •
En la HP mantenida no es raro observar ateroesclerosis prematura de arterias centrales elásticas y musculares8 (figs. 6 y 11C).
- •
Una complicación infrecuente de la HP crónica son los aneurismas de las ramas principales de la AP (diámetro mayor de 4cm)8. La gran mayoría de estos aneurismas ocurren en presencia de otros cofactores de riesgo, como cardiopatía congénita o vasculitis y son raros los pacientes que únicamente presentan HP41. Los aneurismas centrales (tronco y las dos ramas principales) pueden producir síntomas clínicos debidos a la compresión bronquial (fig. 10A), angina asociada a la compresión de la coronaria izquierda por el tronco de la AP42,43, disección y/o ruptura de la AP o trombo en la arteria; más raramente pueden verse aneurismas en ramas periféricas o intrapulmonares. La mayor supervivencia de los pacientes con HP está aumentando el número de casos con aneurismas centrales y periféricos de arterias pulmonares; hay que tener en cuenta que son pacientes portadores de catéteres reservorio, por lo que también cabe la posibilidad de aneurismas micóticos. Clínicamente se manifiestan con hemoptisis44,45.
Figura 10.Complicaciones de la HP. A) y B) Aneurisma en AP en un caso de HP idiopática que, en su evolución, desarrolla un trombo. El síntoma que motivó el nuevo estudio era una tos intensa. Obsérvese la compresión del bronquio intermediario por el aneurisma. (Reproducida con permiso Ref.34). C) Disección de la AP izquierda que se extiende a la rama lobar inferior en una paciente diagnosticada previamente de HP.
(0.3MB). - •
Los trombos «in situ», en el curso de la HP, pueden aparecer en el tronco de la arteria principal y de sus ramas. Hemodinámicamente no son significativos y no dan signos en la gammagrafía de perfusión46. Ante un trombo, es importante hacer el diagnóstico diferencial con la HPTEC, que se basa en la falta de signos de trombos crónicos en ramas lobares y segmentarias, falta de signos parenquimatosos como nódulos subpleurales, bandas o mosaico, adenopatías o circulación bronquial. Hasta ahora la gammagrafía era clave para el diagnóstico diferencial46,47; actualmente el estudio vascular con la TC puede mostrar la morfología arterial.
Trombos agudos o crónicos pueden encontrarse en el 50% de los casos de HP idiopática (fig. 10B) y el papel de la trombosis tanto en la HP idiopática como en la asociada permanece controvertido47. Para Auger y Fedullo pueden encontrarse trombos centrales en procesos distintos de TEPC como la HP idiopática, síndrome de Eisenmenger y EPOC38. La presencia de microtrombos en arteriolas pulmonares no se sabe si es la causa o la consecuencia de HP, pero parece indudable que su presencia contribuye a la progresión de la enfermedad.
- •
La disección de la AP es una complicación rara y fatal. Además de la HP otras causas raras de esta complicación incluyen inflamación crónica de las arterias, endocarditis derecha, amiloidosis, traumatismo y ateroesclerosis grave. Parece más frecuente en la HP asociada a cardiopatías congénitas que en la idiopática48,49. La TC permite el estudio de la localización, tamaño y extensión del aneurisma y de la disección50 (fig. 10C). Es excepcional diagnosticarla en enfermos vivos ya que suele ser un hallazgo de autopsia48. Es más frecuente a partir de la válvula pulmonar o en las dos ramas principales pero se ha descrito un caso en una rama segmentaria48.
Aunque generalmente el paciente viene remitido a la TC tras un estudio ecocardiográfico, la TCMD es una buena herramienta para el estudio morfológico de las cavidades cardíacas y de los septos interauricular e interventricular51,53. Es muy importante en todos los estudios valorar de forma sistemática el tamaño y morfología de las cámaras cardíacas, septos, el grosor de las paredes y las conexiones venosas y arteriales.
En el estudio de las cavidades izquierdas:
La aurícula aumentada de tamaño, el aumento de tamaño de las venas pulmonares o una pared del VI patológica pueden ser datos indicativos de HP asociada a cardiopatía izquierda, en algunos centros la causa más frecuente de HP.
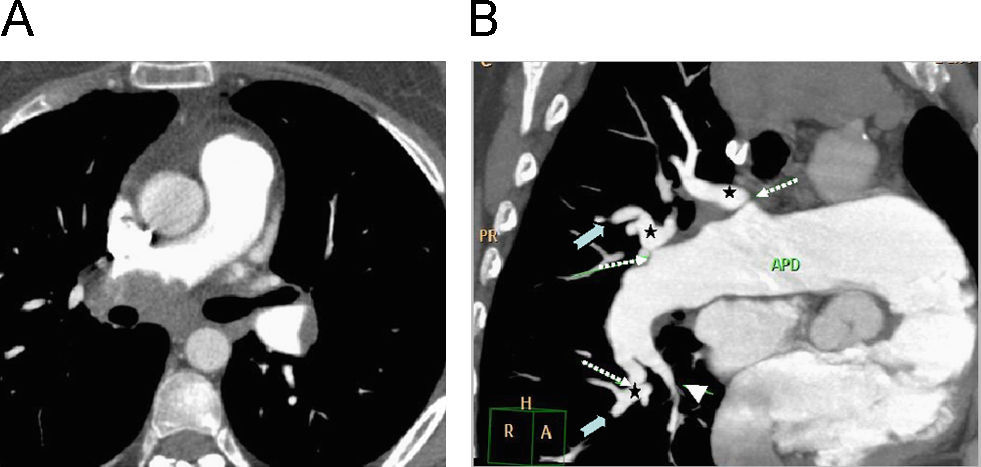
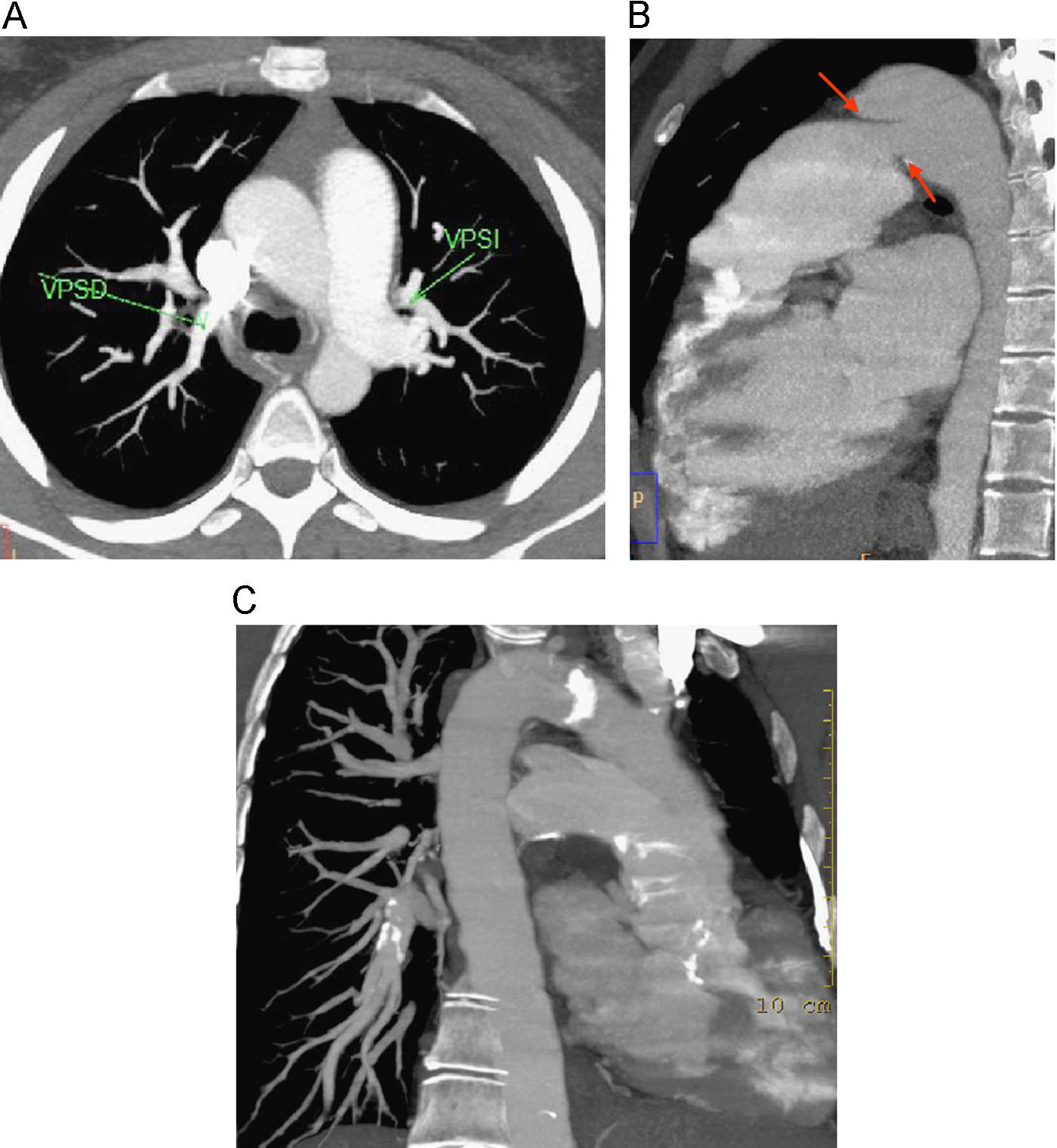
Es imprescindible el estudio de la desembocadura de las venas pulmonares para descartar drenajes venosos anómalos parciales aislados o asociados a defectos del tabique interauricular, aunque el estudio ecocardiográfico haya sido negativo16 (fig. 11A). Hay que tener en cuenta que el defecto del septo interauricular de tipo seno venoso y el drenaje venoso anómalo parcial pueden pasar desapercibidos en la ecocardiografía transtorácica53.
Utilidad de la TCMD en el estudio de malformaciones congénitas cardíacas y vasculares que cursan con HP. Reconstrucciones MIP en axial, sagital y coronal. A) Drenaje venoso anómalo de vena pulmonar superior derecha en la vena cava superior. B) Ductus aorto-pulmonar en una paciente diagnosticada previamente de HP idiopática. C) Cardiopatía compleja con comunicación interventricular, tronco común aorto-pulmonar, agenesia de AP izquierda. Se observa calcificación de la AP derecha y paquipleuritis izquierda calcificada. Presentaba también una abundante circulación sistémica en el lado izquierdo (no mostrada), datos todos que influyen en la valoración quirúrgica del paciente.
No podemos terminar un estudio de HP sin informar de la aorta torácica, ya que el ductus es un cortocircuito extracardíaco no excepcional, que se puede diagnosticar fácilmente y puede no reconocerse en la ecocardiografía transtorácica (fig. 11B).
En el caso de cardiopatías complejas la TC no solamente muestra la anatomía cardíaca, sino que permite la valoración conjunta de otros hallazgos (pulmonares, pleurales o mediastínicos) que pueden ser relevantes a la hora de planificar un tratamiento quirúrgico18,52,53 (fig. 11C).
Conflicto de interesesLa autora declara no tener ningún conflicto de intereses.
Agradezco muy especialmente a las doctoras P. Escribano Subías y C. Jiménez López-Guarch de la Unidad de Hipertensión Pulmonar del Servicio de Cardiología del Hospital Universitario Doce de Octubre, su colaboración en la valoración de los casos y su esfuerzo constante para crear y mantener una unidad multidisciplinar en la que cada especialista se sienta estimulado.