Los principales avances en el campo de las técnicas convencionales de imagen diagnóstica se habían centrado tanto en mejorar la resolución espacial y la velocidad de adquisición de los datos como en la introducción de nuevos medios de contraste. Sin embargo, los tumores representan modelos biológicos tremendamente complejos y existe una serie de características (hipoxia, metabolismo, celularidad, angiogénesis o funcionalismo de los ganglios linfáticos) de gran importancia en el campo de la oncología que no pueden estudiarse adecuadamente con estos métodos diagnósticos. En este trabajo se presenta la posible aportación de distintas técnicas de imagen funcional basadas en el uso de la tomografía computarizada, la resonancia magnética o la tomografía por emisión de positrones para obtener información de características y procesos biológicamente muy importantes para el diagnóstico, la estadificación, la planificación terapéutica, la valoración de respuesta o el seguimiento evolutivo de los pacientes oncológicos, así como para el desarrollo de nuevos fármacos.
Most advances in conventional diagnostic imaging techniques have focused on improving the spatial resolution and speed of acquisition of images or on new contrast agents. However, tumors are extremely complex biological models with a series of characteristics like hypoxia, metabolism, cellularity, angiogenesis, and functionality of the lymph nodes that are very important in oncology but cannot be adequately studied with these diagnostic imaging methods. In this article, we discuss the possible contributions of different functional imaging techniques based on computed tomography, magnetic resonance imaging, or positron emission tomography to obtain information about different biological processes and characteristics that are very important for diagnosing, staging, planning treatment, evaluating the response to treatment, and monitoring the evolution of cancer patients, as well as for the development of new drugs.
Los tumores presentan múltiples características intrínsecas que van a contribuir de un modo muy importante en su comportamiento. El desarrollo de las técnicas de imagen funcional permite el estudio in vivo de muchos de estos procesos fisiológicos tumorales. En este sentido, ya se ha realizado un repaso de la importante aportación de estas técnicas para valorar la perfusión tumoral (angiogénesis) y la difusión de las moléculas de agua en los tejidos1. En este artículo se revisará la aportación de distintas técnicas funcionales a la valoración de otros importantes elementos en el estudio de las neoplasias, como el metabolismo tumoral, el funcionalismo de los ganglios linfáticos o la hipoxia. Por otra parte, se evaluará el papel de estas técnicas en el desarrollo de nuevos fármacos. Y, finalmente, se abordará la necesidad y la utilidad de desarrollar estrategias de imagen multimodalidad que permitan un estudio global que aporte información sobre todos estos factores tumorales.
Metabolismo: tomografía por emisión de positrones y espectroscopiaExisten 2 técnicas fundamentales en el estudio de distintas vías metabólicas de los tumores, la tomografía por emisión de positrones (PET) y la espectroscopia mediante resonancia magnética (eRM).
Tomografía por emisión de positrones o tomografía por emisión de positrones-tomografía computarizadaEl principal medio diagnóstico usado para estudiar la actividad metabólica de las lesiones es la PET o la PET-tomografía computarizada (TC) (que combina la detección de áreas con metabolismo anormal de la glucosa junto con la capacidad anatómica y de resolución espacial aportada por las imágenes de la TC). La imagen se basa en la detección del acúmulo de glucosa marcada, 18F-fluorodeoxiglucosa (18F-FDG). Los tumores malignos son el principal lugar de acumulación de fluorodeoxiglucosa, debido al aumento de las proteínas de membrana transportadoras de glucosa y a una actividad intracelular aumentada de hexocinasa y fosfofructocinasa que promueven la glucólisis (fig. 1). Sin embargo, la glucólisis también ocurre en tejidos normales (el corazón, los músculos, etc.) y en procesos inflamatorios, lo que puede ser fuente de falsos positivos.
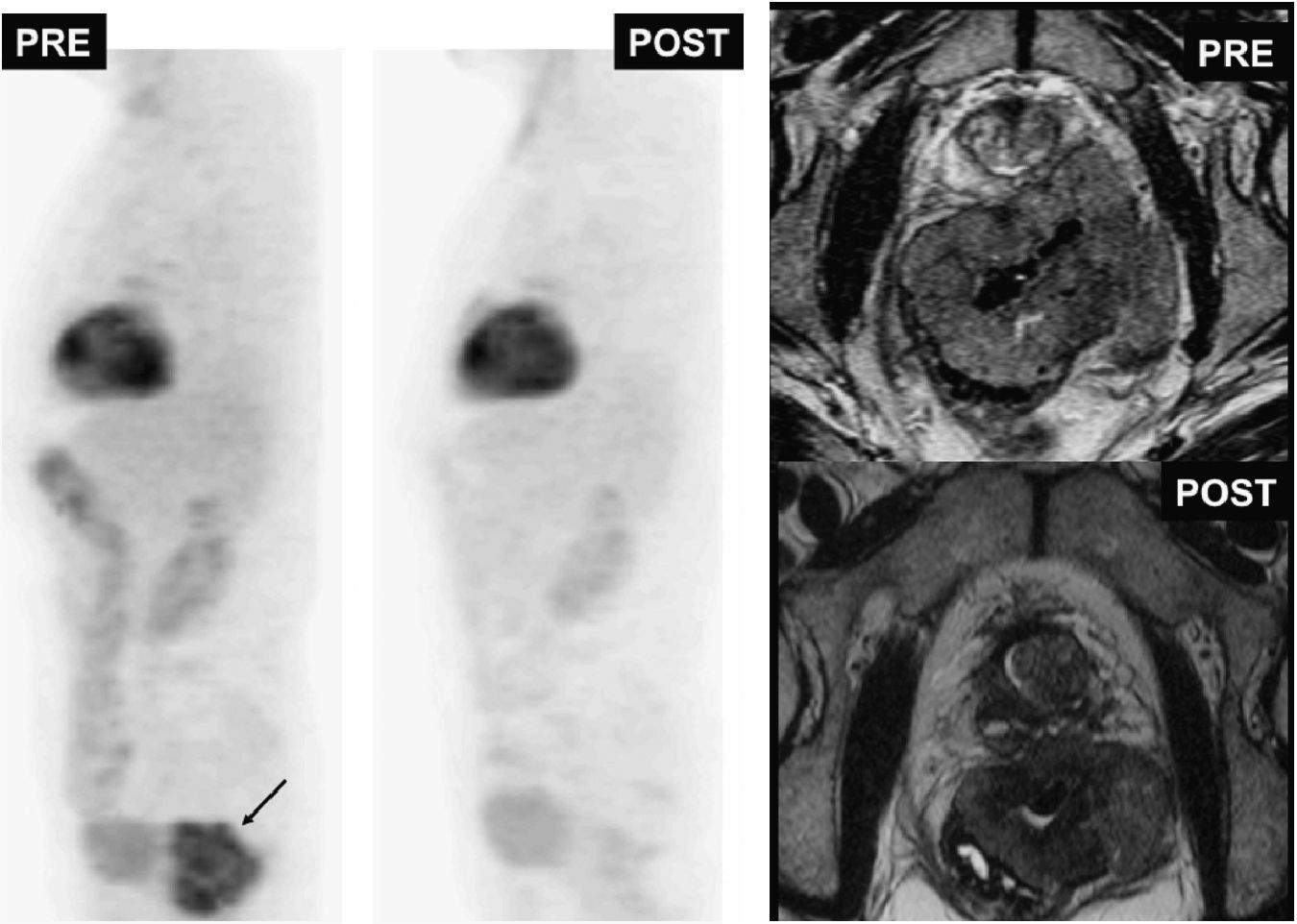
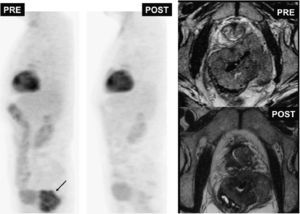
Tumor estromal gastrointestinal (GIST) rectal (flecha negra). Imágenes de tomografía por emisión de positrones (izquierda) y de resonancia magnética potenciadas en T2 antes y después del tratamiento. El estudio de tomografía por emisión de positrones postratamiento demuestra la respuesta total metabólica tumoral con persistencia de masa a nivel rectal (imagen potenciada en T2 postratamiento).
Estas técnicas proporcionan una valoración corporal total en un solo examen. Su papel en las neoplasias varía según el tipo histológico y será limitado en ciertos tipos tumorales, como los carcinomas mucinosos, los tumores de crecimiento lento o los que no muestran actividad metabólica intensa (próstata, tiroides, tumores neuroendocrinos y carcinoma bronquioloalveolar)2–4.
La imagen basada en la 18F-FDG presenta importantes aplicaciones en el diagnóstico de nódulos pulmonares solitarios, neoplasias de origen desconocido, estadificación y seguimiento de neoplasias de cabeza y cuello, cáncer de mama localmente avanzado, cáncer de pulmón no microcítico (CPNM), cáncer de esófago, cáncer de páncreas, carcinoma colorrectal (CCR), linfoma y melanoma5. Al considerar globalmente todos estos tumores, la PET-TC puede modificar el tratamiento de los pacientes hasta en el 15% de los casos en relación con los hallazgos de la TC únicamente5. Además, en el CPNM, el CCR y el linfoma podría ayudar a establecer el pronóstico del paciente6.
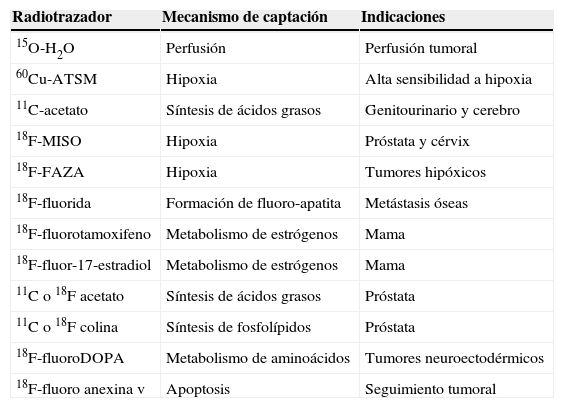
Una serie de nuevos radiotrazadores están en investigación y pueden ampliar el abanico de episodios metabólicos o fisiológicos estudiados mediante la PET (tabla 1). Se incluyen trazadores que reflejan proliferación celular (18F-3-deoxi-3-fluorotimidina [18F-FLT]), hipoxia (18F-fluoroimidazol [18F-FMISO]), perfusión (agua marcada con oxígeno [150]) y metabolismo de membranas (18F-colina [Ch]), etc7. De todos éstos, la 18F-Ch (para el cáncer de próstata) y el 68Ga-somatostatina (para los tumores neuroendocrinos) parecen los más prometedores4.
Principales radiotrazadores de la tomografía por emisión de positrones en Oncología
| Radiotrazador | Mecanismo de captación | Indicaciones |
| 15O-H2O | Perfusión | Perfusión tumoral |
| 60Cu-ATSM | Hipoxia | Alta sensibilidad a hipoxia |
| 11C-acetato | Síntesis de ácidos grasos | Genitourinario y cerebro |
| 18F-MISO | Hipoxia | Próstata y cérvix |
| 18F-FAZA | Hipoxia | Tumores hipóxicos |
| 18F-fluorida | Formación de fluoro-apatita | Metástasis óseas |
| 18F-fluorotamoxifeno | Metabolismo de estrógenos | Mama |
| 18F-fluor-17-estradiol | Metabolismo de estrógenos | Mama |
| 11C o 18F acetato | Síntesis de ácidos grasos | Próstata |
| 11C o 18F colina | Síntesis de fosfolípidos | Próstata |
| 18F-fluoroDOPA | Metabolismo de aminoácidos | Tumores neuroectodérmicos |
| 18F-fluoro anexina v | Apoptosis | Seguimiento tumoral |
18F-MISO: 18F-fluoromisonidazol.
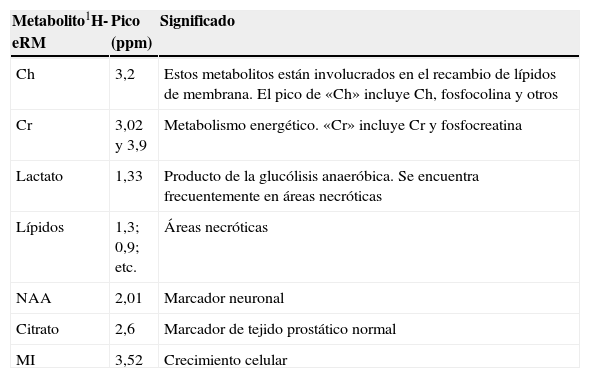
Existe un interés creciente sobre el papel de la eRM para el estudio de las alteraciones bioquímicas en cánceres. Muy pocos núcleos con presencia biológica importante son susceptibles de estudiarse mediante espectroscopia, básicamente 1H, 31P y, más raramente, 19F. La utilidad de la eRM se basa en detectar metabolitos presentes o aumentados en los tejidos cancerosos, o detectar la desaparición o disminución de metabolitos normales en los tejidos sanos. Los metabolitos para estudiar varían según el tipo tumoral, pero para poder detectarse deben estar presentes en una concentración en el rango de lo milimolar a lo micromolar. Afortunadamente, diversos metabolitos de importancia biológica cumplen este requisito: ATP, Ch, creatina (Cr), lactato, citrato (Ci) o N-acetil-aspartato (NAA)8 (tabla 2).
Principales metabolitos en espectroscopia por resonancia magnética
| Metabolito1H-eRM | Pico (ppm) | Significado |
| Ch | 3,2 | Estos metabolitos están involucrados en el recambio de lípidos de membrana. El pico de «Ch» incluye Ch, fosfocolina y otros |
| Cr | 3,02 y 3,9 | Metabolismo energético. «Cr» incluye Cr y fosfocreatina |
| Lactato | 1,33 | Producto de la glucólisis anaeróbica. Se encuentra frecuentemente en áreas necróticas |
| Lípidos | 1,3; 0,9; etc. | Áreas necróticas |
| NAA | 2,01 | Marcador neuronal |
| Citrato | 2,6 | Marcador de tejido prostático normal |
| MI | 3,52 | Crecimiento celular |
Ch: colina; Cr: creatina; NAA: N-acetil-aspartato; MI: mio-inositol; ppm: partes por millón.
Un panel de expertos del National Cancer Institute9 ha establecido en un documento de consenso que la eRM basada en el 1H es una técnica suficientemente madura para su uso clínico en el cerebro, la próstata y la mama. Las principales aplicaciones de la técnica se centran en la caracterización de las lesiones, la selección de la zona tumoral más adecuada para la realización de una biopsia, y la monitorización y el control de la respuesta al tratamiento8.
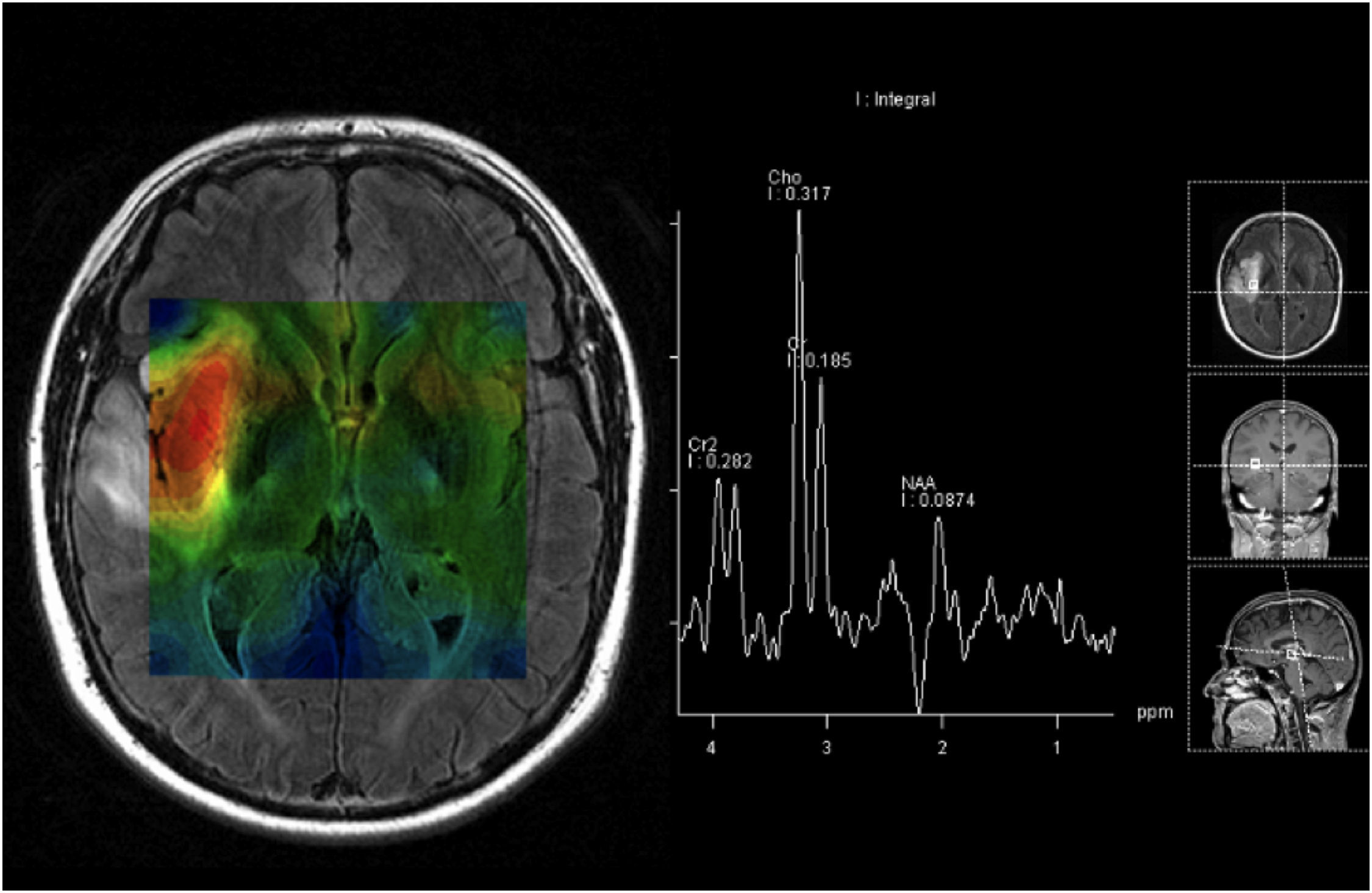
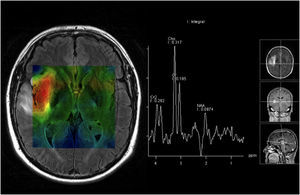
En los tumores cerebrales se ha descrito una reducción de los niveles de NAA (un marcador neuronal) y de Cr (un marcador de procesos energéticos celulares) y un aumento de Ch (un marcador de proliferación celular) (fig. 2).
Para optimizar la adquisición del espectro se pueden variar diferentes parámetros. Uno de los más relevantes es el tiempo de eco (TE). Un TE largo permite observar un número reducido de metabolitos con menor distorsión de la línea de base. El resultado es un espectro más sencillo de procesar, analizar e interpretar. Por otro lado, en el TE corto son visibles un mayor número de resonancias, debido a que la señal de compuestos con fuerte modulación (como por ejemplo lípidos, mio-inositol, glutamina o glutamato) puede perderse a TE largo. La espectroscopia puede distinguir con buena fiabilidad entre tumor y parénquima cerebral normal; sin embargo, un aspecto de mayor dificultad es la distinción entre tumor y proceso patológico no tumoral10,11. La eRM es también una técnica muy sensible en la diferenciación de gliomas de alto y de bajo grado. La combinación de secuencias de resonancias magnéticas (RM) clásicas con espectroscopia permite un aumento del 15% en la fiabilidad del tipo y del grado tumoral8,10,11. Sin embargo, en presencia de una lesión única, el distinguir entre tumor cerebral primario y secundario es frecuentemente difícil (si no imposible) sin histología, dado que la mayoría de las metástasis muestran hallazgos idénticos a los de algunos astrocitomas. La eRM es también capaz de distinguir un tumor viable de necrosis y de detectar respuesta tumoral con disminución de los picos de la Ch y del NAA y un aumento de los picos correspondientes a los lípidos y al lactato (marcador de anaerobiosis)11.
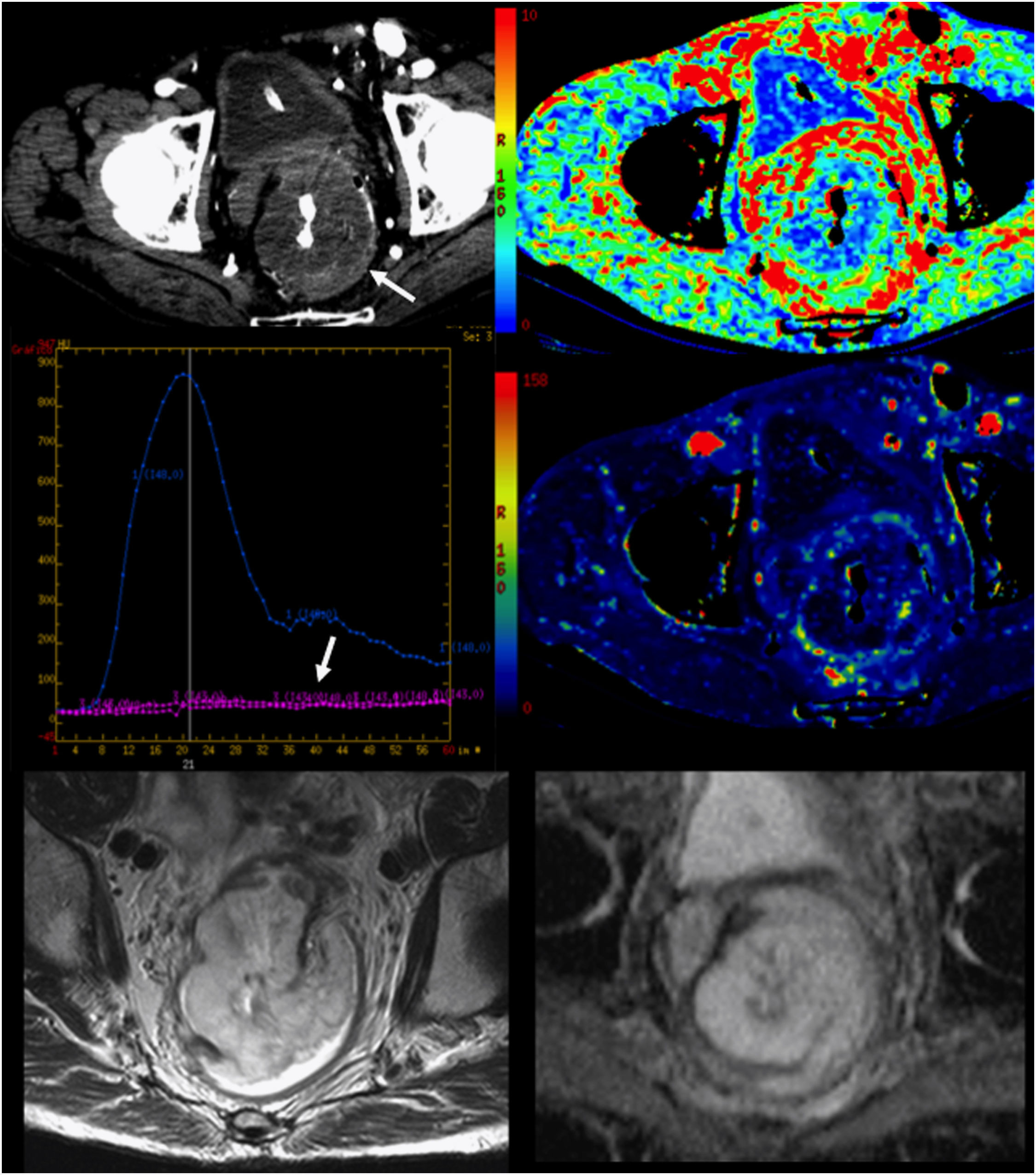
En la próstata se ha demostrado que la valoración de los niveles de Ch, Cr y Ci puede predecir la existencia de cáncer en la zona periférica de la glándula12. Además, las ratios de Ch+Cr/Ci se han correlacionado con el grado de Gleason de las lesiones (uno de los factores pronóstico más importantes)13 y permiten realizar una valoración de la intensidad de las lesiones y la selección de las áreas de la glándula más adecuadas para la realización de la biopsia. La espectroscopia desempeña también un papel en el diagnóstico de los pacientes con sospecha de recidiva tras prostatectomía radical, radioterapia o crioterapia.
La eRM muestra también un papel emergente en el estudio de la mama. Se ha publicado que se puede detectar a 3,2ppm un pico conjunto de Ch y compuestos que contienen Ch, denominado Ch total, en las lesiones malignas. Por el contrario, en las lesiones benignas o en el tejido mamario normal los niveles encontrados son bajos o indetectables14–16. La técnica presenta aproximadamente un 92% de sensibilidad y de especificidad para distinguir las lesiones benignas de las lesiones malignas, si bien existen factores limitantes de su sensibilidad o de su especificidad, como el tamaño del tumor, con resultados peores en las lesiones menores de 2cm o en las mujeres lactantes, debido a la existencia de un pico de Ch en el tejido mamario normal y en las lesiones benignas, como los adenomas tubulares16.
El papel de la espectroscopia en otros tipos tumorales sigue siendo escaso, si bien se ha publicado cierta utilidad en el estudio de las metástasis ganglionares de tumores de cabeza y cuello y en el cáncer de cérvix uterino9,17–19.
La espectroscopia basada en el 31P es técnicamente más compleja y apenas hay literatura médica de su uso clínico, si bien su interés se centraría en la posibilidad de estudio del ATP (molécula fundamental del metabolismo energético) o de los metabolitos fosfolipídicos que conforman las membranas («turn-over» de membranas).
Imagen funcional ganglionarEl factor «T» (tumor) generalmente domina el interés en la imagen del cáncer; sin embargo, las metástasis ganglionares (el factor «N») son un indicador pronóstico en múltiples neoplasias sólidas y pueden ser un factor decisivo en el tratamiento de los pacientes. La capacidad diagnóstica de las técnicas convencionales a la hora de valorar la afectación metastásica es muy limitada (alrededor del 30%)20. Con estas técnicas, el principal elemento para considerar en el análisis de los ganglios es su tamaño medido en el eje menor. Pero debemos recordar que en los ganglios pequeños pueden existir micrometástasis21 (principalmente en el caso de los adenocarcinomas) y que las adenopatías de tamaño significativo pueden ser inflamatorias.
Otros elementos, como la señal, el contorno22 o la presencia de calcificaciones o necrosis, pueden ser útiles a la hora de definir la naturaleza de las adenopatías. A pesar de todas estas consideraciones, hay un alto porcentaje de adenopatías positivas para malignidad en pacientes con estudios de imagen negativos.
Muchas de las técnicas funcionales previamente descritas muestran también una capacidad limitada en el estudio de los ganglios. La difusión está fisiológicamente restringida en los ganglios «normales», si bien se ha propuesto la posibilidad de valorar la señal de las adenopatías sospechosas en imágenes obtenidas con valores «b» elevados y compararlas con adenopatías que no se «espera» que sean patológicas (como las inguinales o axilares) o con la del propio tumor23. Se han publicado también varios estudios que muestran que las adenopatías metastásicas cervicales tienen un valor de coeficiente de difusión aparente (ADC) mayor que las benignas o las linfomatosas24. Esto podría estar en relación con la tendencia a presentar necrosis de las metástasis ganglionares de los tumores escamosos. Sin embargo, otros estudios no encuentran esta relación, sino que señalan que el ADC se encuentra disminuido en adenopatías metastásicas en tumores de cabeza y cuello25. Además, la reproductibilidad de las mediciones del ADC parece ser muy variable, lo que limitaría su utilidad25,26. Los patrones de perfusión tampoco parecen aportar nada, con curvas de captación con lavado rápido (washout) en ganglios normales. La PET-TC es un buen método en la evaluación de la afectación ganglionar en cáncer de pulmón, melanoma y linfoma, pero presenta importantes limitaciones en neoplasias de poca actividad metabólica, como el cáncer de próstata y otros tumores pélvicos5, y presenta un problema de resolución en pequeñas adenopatías que pueden ser patológicas.
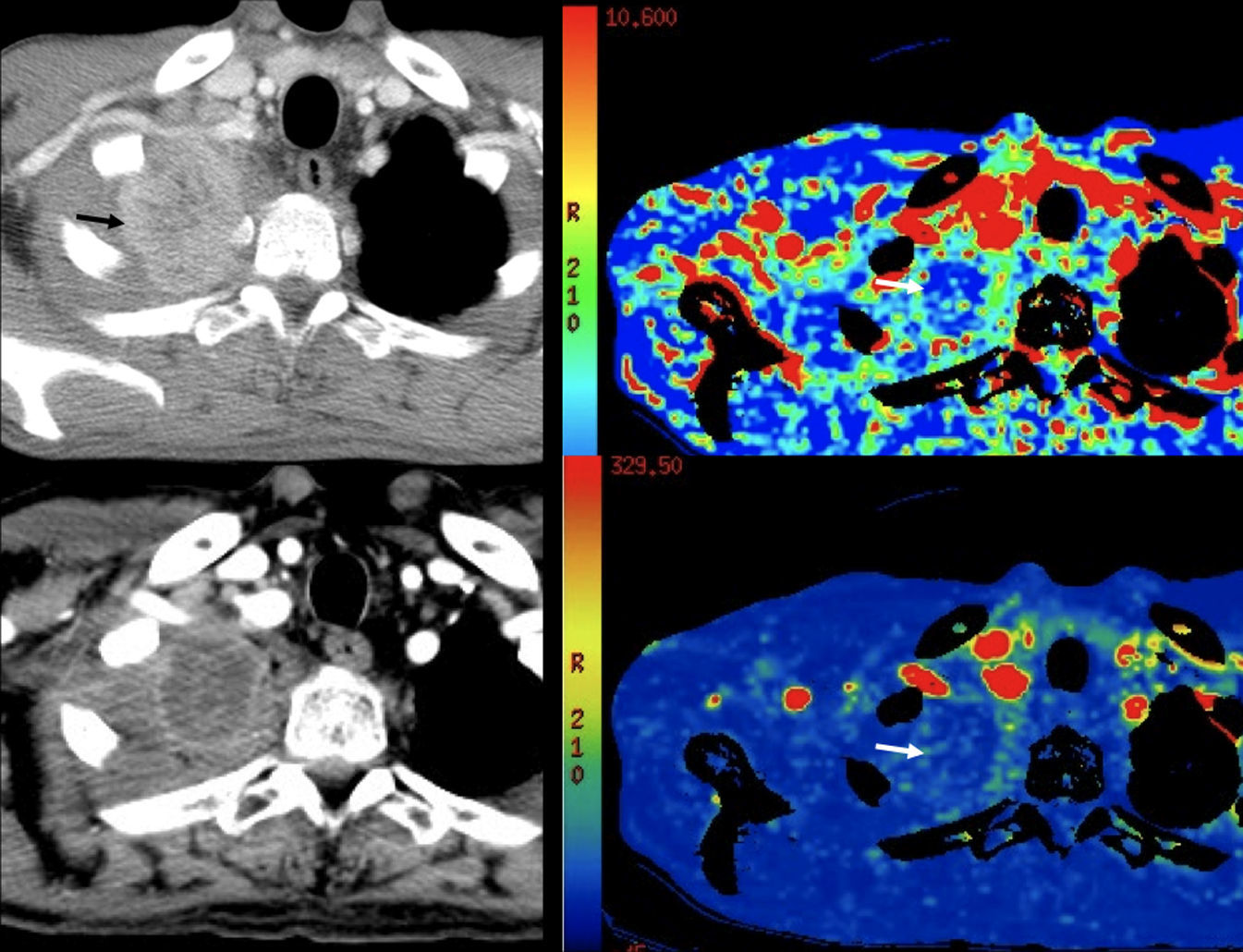
Están en desarrollo diversos medios de contraste específicos ganglionares27, pero aquellos que se basan en el uso de partículas de hierro, ultrasmall superparamagnetic particles of iron oxide, son los que más se han estudiado. Estos contrastes tienen como diana el sistema reticuloendotelial. Un estudio en cáncer de próstata muestra una sensibilidad y una especificidad por paciente del 100 y del 96% y de ganglio a ganglio del 90,5 y del 97,8%, respectivamente28. Las células del sistema reticuloendotelial de los ganglios o de las zonas ganglionares sanas captan las partículas férricas, lo que provoca una marcada disminución de señal de éstos (fig. 3). Este contraste aún no se encuentra disponible comercialmente y la interpretación de los estudios y la curva de aprendizaje son largas. Además, la sensibilidad de la técnica disminuye en las adenopatías menores de 5mm, las micrometástasis ganglionares, los ganglios reactivos hiperplásicos o fibróticos y las enfermedades granulomatosas28,29. El contraste se ha evaluado en distintas neoplasias y ha mostrado una alta sensibilidad y especificidad en la detección de metástasis ganglionares30. Recientemente, Thoeny et al31 han propuesto la combinación de ultrasmall superparamagnetic particles of iron oxide y difusión para, con el mantenimiento de la fiabilidad de la técnica, simplificar su interpretación. Estos autores se basan en que las partículas férricas alteran el T2/T2¿ de los ganglios que las captan; lo que hace que estas adenopatías no sean visibles en las secuencias de difusión y sólo sean visibles los ganglios sospechosos para malignidad.
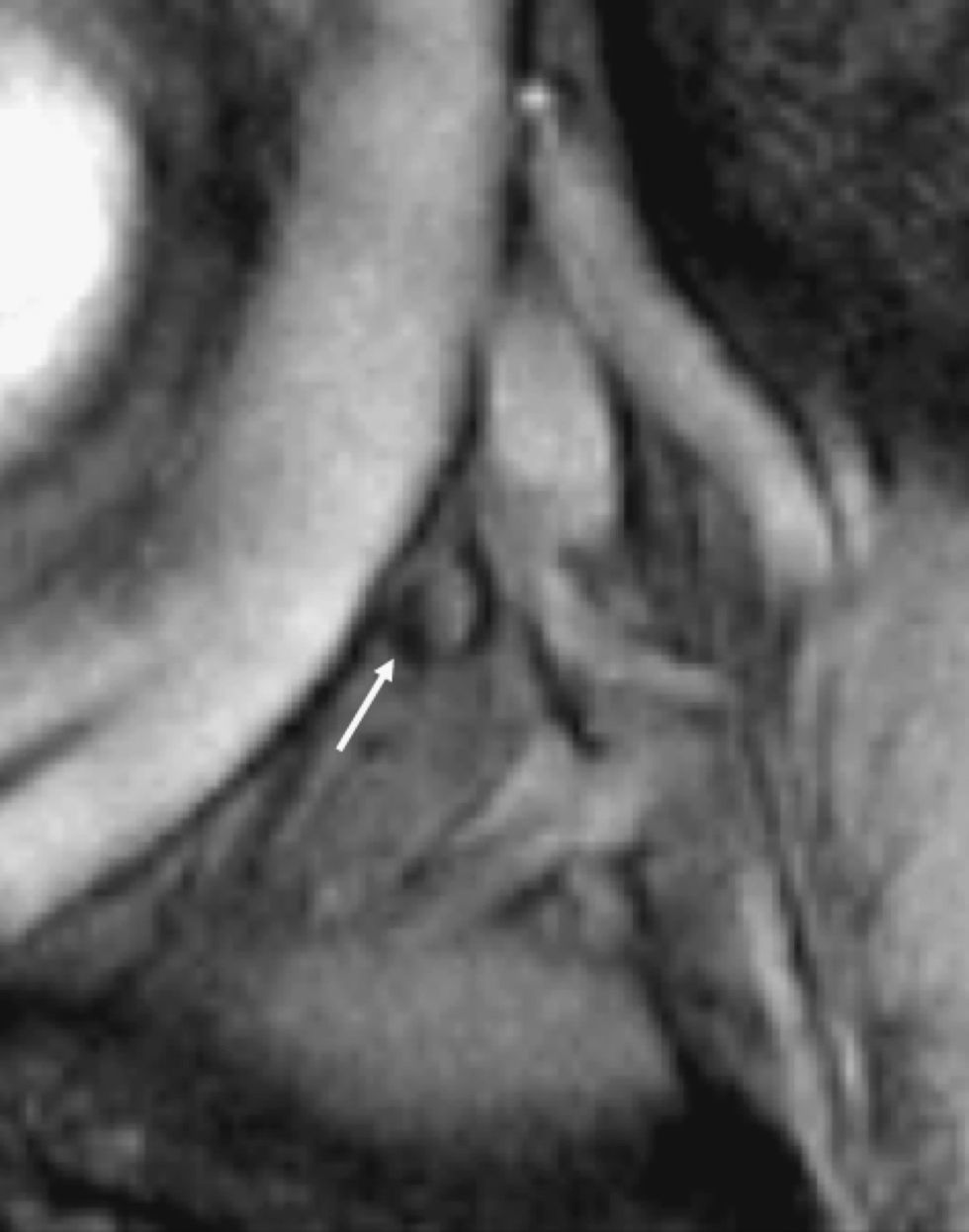
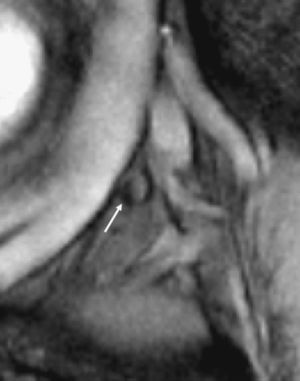
Resonancia magnética pélvica. Secuencia eco de gradiente T2* tras la administración de ultrasmall superparamagnetic particles of iron oxide para determinar metástasis ganglionar de carcinoma de origen prostático (cortesía de Dres. Jelle Barentsz y Jurgen Fütterer, University Medical Center, Nijmegen, Holanda). Imagen que muestra un ganglio (flecha) en la bifurcación ilíaca con áreas que no han perdido señal.
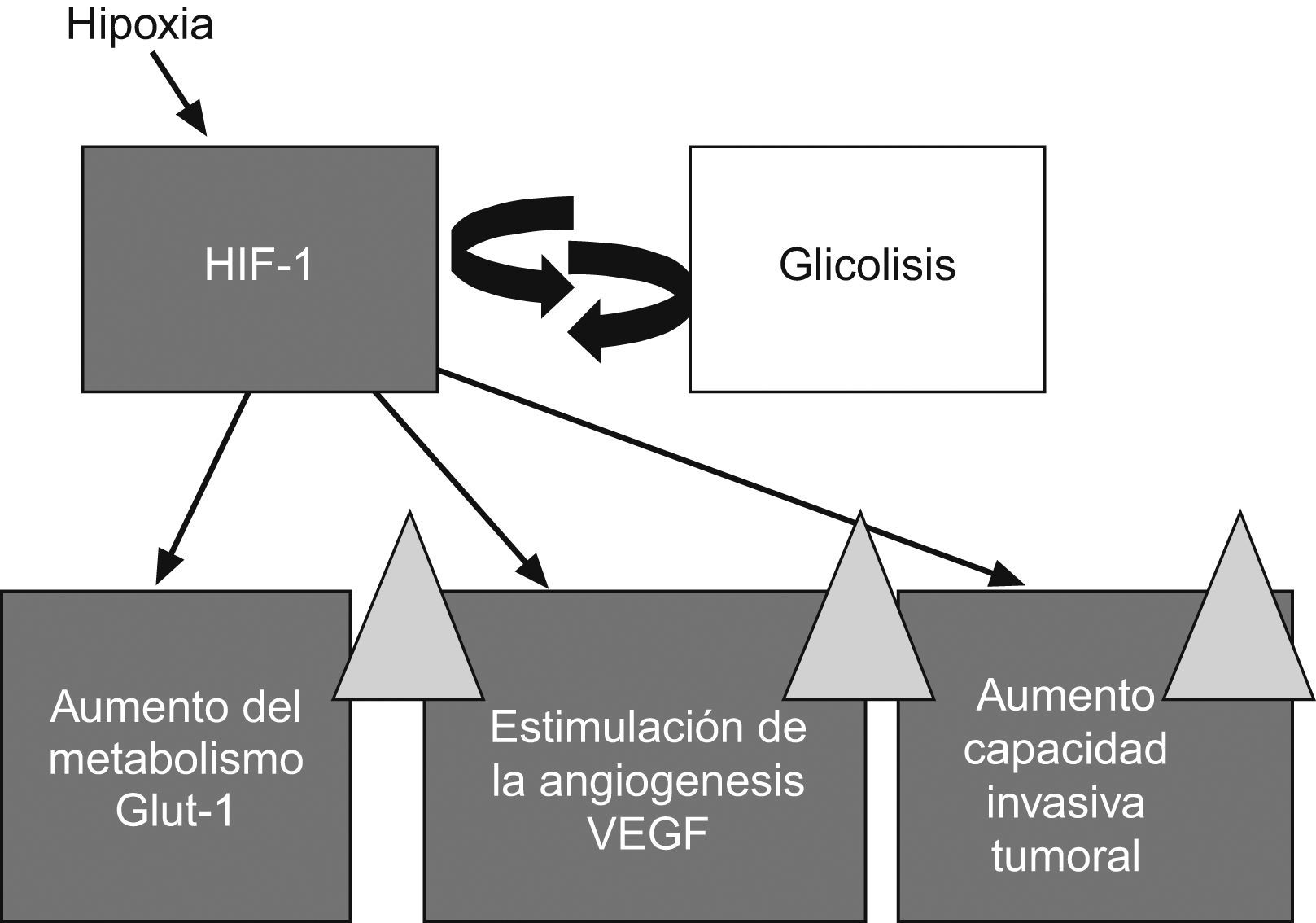
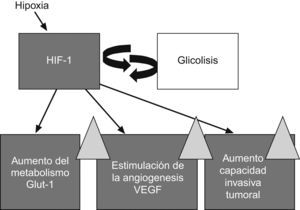
Cuando un tumor crece desarrolla una hipoxia crónica al aumentarse las distancias de difusión del O2 desde los vasos tumorales. Como adaptación a este estrés hipóxico, se produce la transcripción del hypoxic induced factor-1 (HIF-1, ‘factor inducido por la hipoxia-1’) que promueve la angiogénesis a través del vascular endothelial growth factor (VEGF, ‘factor de crecimiento endotelial vascular’) y una sobrerregulación de las vías glucolíticas mediada por un aumento de la expresión del transportador de glucosa32–34 (fig. 4). Además de provocar estas adaptaciones metabólicas y vasculares, el HIF-1 promueve la supervivencia celular e inhibe la diferenciación celular y la apoptosis. La hipoxia es, por lo tanto, un factor muy importante sobre el que pivotan la angiogénesis y el metabolismo de los tumores y se ha demostrado que aumenta la resistencia a la radioterapia y produce la selección de clones tumorales más agresivos35.
Pese a ser un factor tan trascendente, no es fácil estudiar clínicamente su presencia in vivo mediante la imagen. Los estudios de perfusión con TC o RM no muestran una correlación clara entre los parámetros de esta y la presencia de hipoxia tumoral, salvo en cáncer de cérvix y de cabeza y cuello36,37. De las técnicas disponibles, la RM blood oxygen level-dependent (RM-BOLD, ’RM dependendiente del nivel de oxígeno sanguíneo’) y los estudios de la PET basados en el 18F-fluoromisonidazol (18F-MISO) y en el cobre(II)-diacetil-bis(N4-metil-tiosemicarbazina) son las que se han demostrado más apropiadas para representar la hipoxia34,35.
En la RM-BOLD el contraste en la imagen se debe a la deoxihemoglobina endógena, que al ser paramagnética incrementa la relajación transversal (R2*) del agua en la sangre y en los tejidos contiguos. Por lo tanto, es una secuencia sensible a la presión parcial de oxígeno (pO2) en los vasos y en los tejidos cercanos a los vasos perfundidos. Es por esto importante determinar a la vez perfusión con el fin de saber si la señal BOLD es secundaria a deoxihemoglobina o a ausencia de flujo sanguíneo. La técnica de RM-BOLD refleja principalmente la hipoxia aguda (relacionada con la perfusión) porque los niveles bajos de pO2 afectan al estatus de oxigenación de los glóbulos rojos, pero la hipoxia crónica también puede detectarse. Esta técnica ha demostrado su validez en la próstata38 y permitiría realizar mapas paramétricos de hipoxia que pueden dirigir el tratamiento (radioterapia).
Existen también técnicas muy interesantes, como los estudios de la PET con el 18F-MISO (que evaluaría la presencia de hipoxia en células viables, no en necrosis)39, o con el cobre(II)-diacetil-bis(N4-metil-tiosemicarbazina) (que marcaría áreas con baja tensión de O2)40, pero que exigen la presencia de un ciclotrón para producir los radiotrazadores.
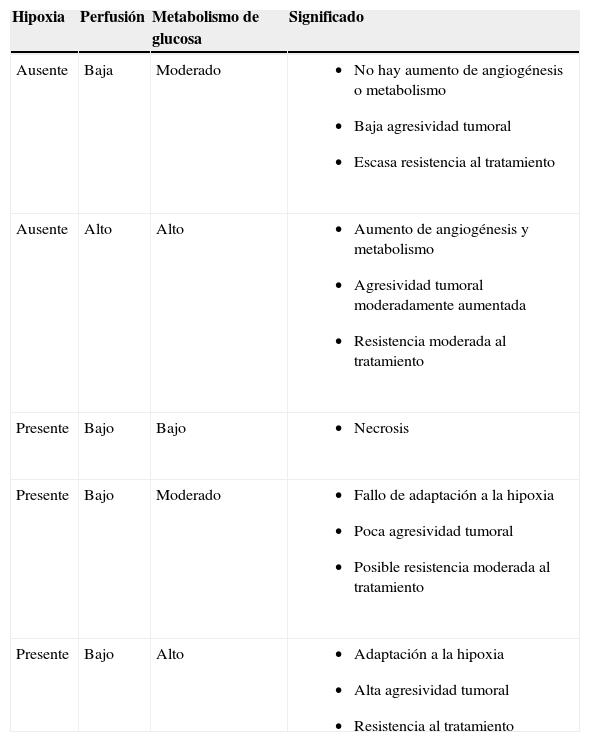
Imagen funcional: un abordaje multimodalidadUn ámbito en el que comienzan a surgir hallazgos interesantes es mediante la combinación de datos de distintas técnicas. Existen estudios que valoran la distribución espacial de la perfusión, la hipoxia y el metabolismo de la glucosa en tumores y que nos ayudarían a entender la biología de éstos (tabla 3). Pese a lo que cabría esperar, los estudios de imagen multifuncional han mostrado una gran heterogeneidad en la relación de estos 3 factores. Thorwarth et al39 y Komar et al40 estudiaron las relaciones entre perfusión e hipoxia en pacientes con cánceres de cabeza y cuello mediante el uso de técnicas de PET. Thorwarth et al usan 18F-MISO, mientras que Komar et al utilizan 2-(2-nitro-1H-imidazol-1-il)-N-(2,2,3,3,3-pentafluoropropil)-acetamida marcada con 18F-fluor. Ambos grupos demuestran una marcada heterogeneidad en las correlaciones entre flujo sanguíneo e hipoxia, con áreas de buena perfusión sin hipoxia, áreas perfundidas pero hipóxicas y áreas con escasa perfusión e hipoxia. No se ha conseguido demostrar la existencia de una correlación entre hipoxia y perfusión, lo que indicaría que la hipoxia ocurre en los tumores independientemente del grado de perfusión. Además, Thorwarth et al39 demuestran que estos patrones de relación hipoxia-perfusión pueden predecir la evolución del paciente tras la radioterapia.
Relaciones entre hipoxia tumoral, perfusión y metabolismo de la glucosa y probable significado biológico de estas. La adaptación a la hipoxia con perfusión baja y con metabolismo aumentado representa el tipo tumoral más agresivo
| Hipoxia | Perfusión | Metabolismo de glucosa | Significado |
| Ausente | Baja | Moderado |
|
| Ausente | Alto | Alto |
|
| Presente | Bajo | Bajo |
|
| Presente | Bajo | Moderado |
|
| Presente | Bajo | Alto |
|
La correlación entre hipoxia (18F-MISO-PET) y metabolismo de glucosa (18FDG-PET) muestra resultados también muy variables entre tumores. Así, Rajendran et al34 indican que algunos tumores hipóxicos presentan una captación modesta de glucosa, mientras otros con un metabolismo elevado no son hipóxicos e indican que tal desacople es específico de cada tipo tumoral. Thorwarth et al39 describen distintos patrones de relación e indican que una captación elevada de fluorodeoxiglucosa (18FDG) y de 18F-MISO representaría una situación de estrés hipóxico con adaptación mediante metabolismo de la glucosa aumentado. Además, una mala correlación entre 18FDG y 18F-MISO podría predisponer hacia un fenotipo tumoral más agresivo, puesto que se asocia a peor respuesta a radioterapia en pacientes en neoplasias de cabeza y cuello.
La relación entre flujo sanguíneo tumoral y metabolismo de la glucosa es también muy variable en distintas partes de un tumor. Esto dependerá del tipo tumoral y de su tamaño y estadio. Miles y Williams41 indican que una situación adaptativa con bajo flujo y alta captación de glucosa se asocia a una peor respuesta en pacientes con cáncer de mama y CPNM, presuntamente porque estos tumores son hipóxicos. Mientras que las áreas hipometabólicas y pobremente perfundidas representarían zonas de necrosis, tumor tratado o fibrosis.
Por lo tanto, las relaciones entre hipoxia, flujo y metabolismo de la glucosa en tumores son complejas y variables, pero muy importantes. La hipoxia, la glucólisis y el flujo aumentados son manifestaciones comunes y, probablemente, independientes del fenotipo tumoral. La evolución del paciente va a depender del equilibrio de éstos y, por supuesto, de otros factores. Podemos, mediante la evaluación de todos éstos, identificar aquellos fenotipos de cáncer que pudieran responder en mayor o en menor medida a un tratamiento determinado.
Además, este abordaje basado en múltiples factores tumorales empezaría a explicar, en parte, la variabilidad del comportamiento de aquellos tumores que pudieran parecer iguales. Goh et al42, mediante la combinación del estudio de la perfusión con TC y del metabolismo con la PET en tumores colorrectales, muestran que los tumores con una perfusión disminuida y un metabolismo alto presentarían un mayor riesgo de desarrollar metástasis. Las implicaciones terapéuticas de estos datos, de confirmarse en amplias series, serían importantes y podrían modificar el tratamiento de ciertos pacientes.
Fuera de las técnicas de la PET, se puede realizar un abordaje multifuncional al combinar las técnicas (fig. 5) o sólo con RM (fig. 6), con la evaluación de múltiples parámetros (eRM, RM dinámica, DWI e imagen anatómica), lo que aumenta la fiabilidad diagnóstica43. Además, los progresos en el software han permitido el análisis de volúmenes grandes de datos, el desarrollo de las técnicas de diagnóstico asistido por ordenador44, que facilitan la valoración conjunta de las imágenes morfológicas (de mayor resolución espacial) con las obtenidas con técnicas funcionales, y la creación de imágenes de fusión, que ayudan a representar mejor la heterogeneidad intratumoral (fig. 7).
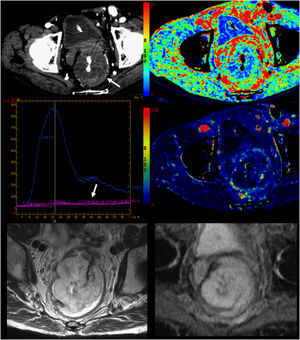
Análisis multifuncional tumoral. Tumor rectal mucinoso. De arriba hacia abajo y de izquierda a derecha. Imagen de adquisición, mapa paramétrico de volumen sanguíneo, gráfica de captación, mapa paramétrico de flujo sanguíneo e imágenes de resonancia magnética de secuencia rápida de eco de espín potenciada en T2 (FSE-T2) y mapa de coeficiente de difusión aparente (ADC) que muestran un tumor con perfusión prácticamente ausente (mapas paramétricos y gráfica) y sin restricción de la difusión, compatible con lesión hipovascular e hipocelular.
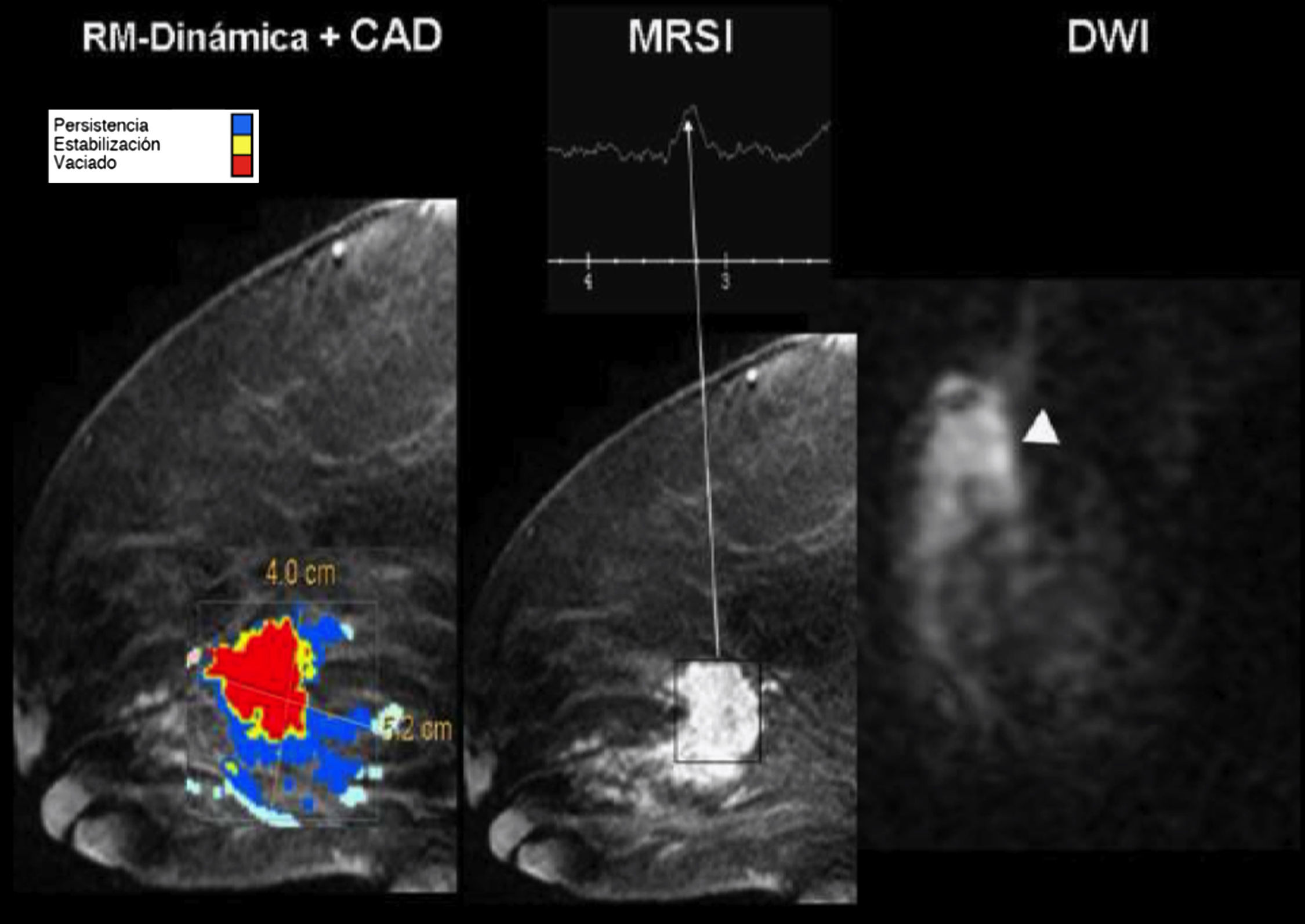
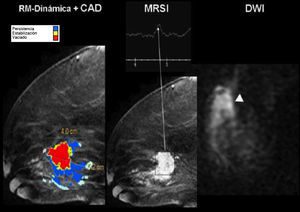
Estudio multimodalidad con resonancia magnética. Cáncer de mama. Mapa paramétrico de captación de gadolinio (izquierda) con diagnóstico asistido por ordenador, gráfica de espectroscopia y secuencia de difusión que demuestran una masa con áreas de marcada captación de gadolinio (pixeles rojos), con clara elevación del pico de colina y restricción de la difusión.
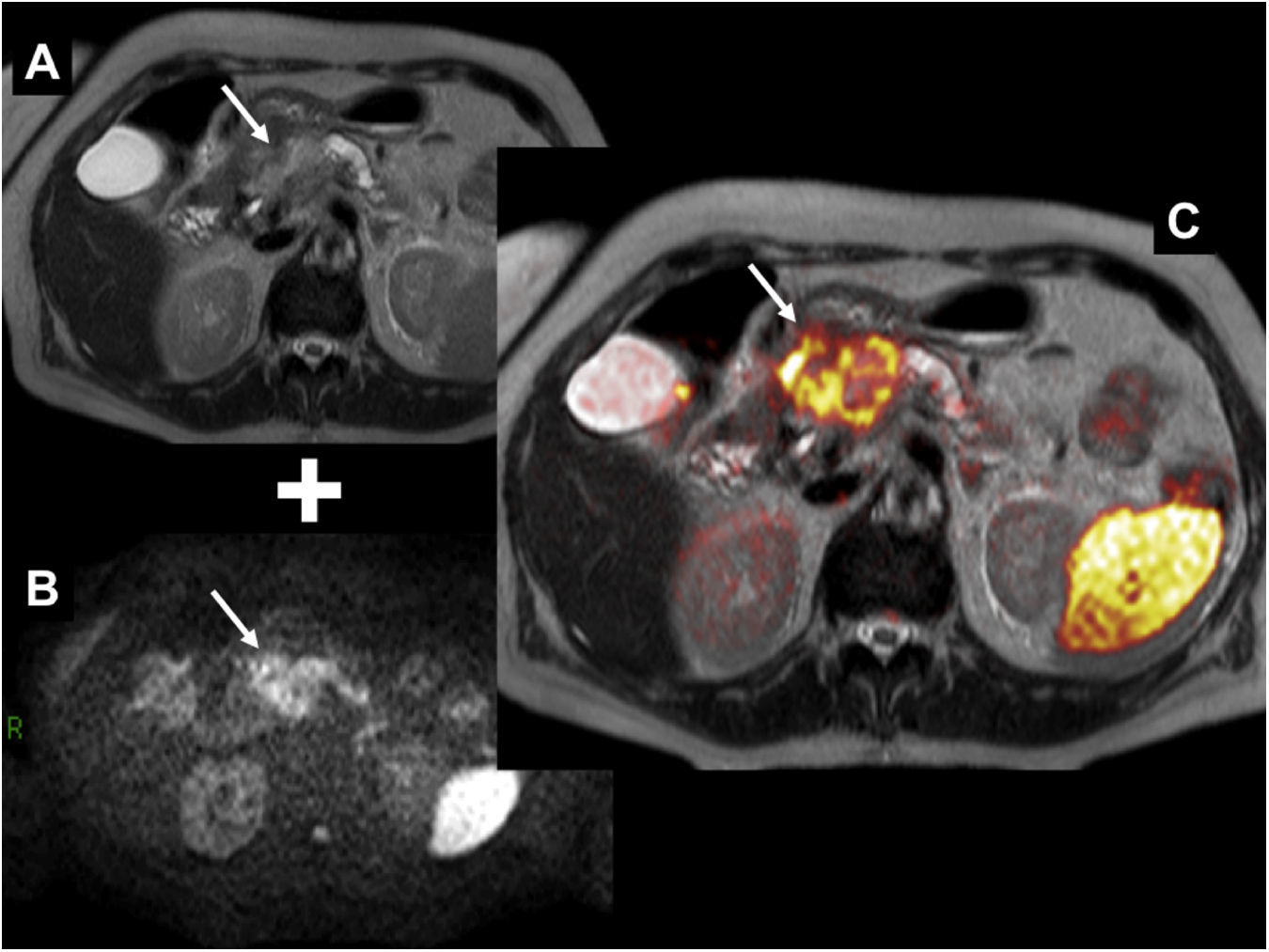
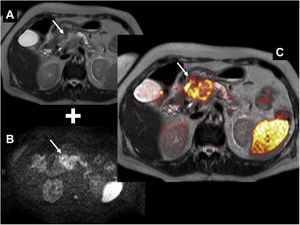
Fusión de secuencia rápida de eco de espín con disparo simple (SS-FSE) potenciada en T2 (A) con imagen de difusión b=1.000 (B). Cáncer de páncreas. La imagen de fusión (C) muestra una masa en la cabeza pancreática con marcada restricción de la difusión (representada en falso color en donde el rojo representa mayor restricción) (flecha). Nótese, además, la restricción fisiológica que presenta normalmente el bazo.
A la hora de evaluar la respuesta terapéutica de los tumores hay distintas cuestiones que debemos considerar. La valoración morfológica, la cuantificación de la disminución de tamaño usada en los criterios RECIST (Response Criteria in Solid Tumors)45, ha sido nuestra máxima preocupación a la hora de valorar la respuesta tumoral. Este abordaje parece funcionar de un modo adecuado en el caso del uso de fármacos citotóxicos. Sin embargo, esta evaluación es limitada, dado que los cambios macroscópicos tardan tiempo en evidenciarse, en muchas ocasiones no son específicos y no aportan información sobre el componente fisiológico y molecular de los tumores4,46. Los avances en el campo de la oncología han llevado al desarrollo de nuevos fármacos dirigidos a distintas dianas terapéuticas, como la vía VEGF/platelet-derived growth factors (PDGF), la epithelial growth factor receptor (EGFR, ‘receptor ErbB-1’), la human epidermal growth factor receptor 2 (Her2/ErbB ‘receptor ErbB-2’), la de receptores hormonales, la cascada de tirosina cinasas de transducción de señal (receptor KIT O CD117, mTORo mammalian target of rapamycin, etc.) y los fármacos antivasculares47. En estos fármacos, de acción básicamente citostática y que causan un escaso cambio de tamaño de las lesiones, el uso de los criterios RECIST no sirve para evaluar adecuadamente la respuesta tumoral y las técnicas para utilizar variarán según el mecanismo de actuación del fármaco. Así, por ejemplo, las técnicas dinámicas (RM o TC) parecen las más adecuadas para evaluar la respuesta a fármacos antivasculares48 o a las que actúan en la vía del VEGF/platelet-derived growth factors, como el bevacizumab cuyo mecanismo de acción parece centrarse en la normalización de la vascularización tumoral49, mientras la PET parece hacerlo mejor en el caso de los fármacos que, como el cetuximab, actúan en la vía del epithelial growth factor receptor47.
Existen ya datos iniciales que nos muestran que se pueden demostrar cambios significativos y muy precoces en el flujo, el volumen de sangre y la perfusión tumoral con el tratamiento (fig. 8). Cambios en Ktrans, Kep y en el área bajo la curva se relacionan con la respuesta en distintos tumores50 y existe un cambio funcional muy acentuado en el aporte vascular al tumor51. Así, en el cancer de mama, por ejemplo, se ha demostrado que una disminución progresiva de la permeabilidad transendotelial en respuesta a la quimioterapia se asocia a respuesta tumoral, mientras que un aumento o la ausencia de cambio en la permeabilidad puede predecir ausencia de respuesta52.
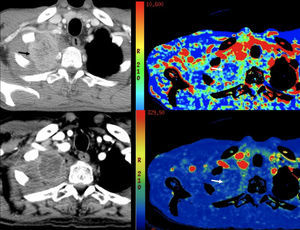
Tomografía computarizada de perfusión. Tumor de Pancoast. Imagen de pretratamiento y después de quimoterapia y radioterapia (izquierda, arriba y abajo, respectivamente) e imágenes paramétricas de volumen y flujo sanguíneo (derecha, arriba y abajo, respectivamente) que muestran después del tratamiento una disminución del tamaño, del realce y práctica ausencia de perfusión en los estudios paramétricos.
Es por esto que estas técnicas podrían valer para seleccionar a aquellos pacientes que van a responder a los fármacos con una evaluación precoz de la respuesta mediante una imagen funcional, lo que permitiría no continuar con tratamientos inadecuados y costosos.
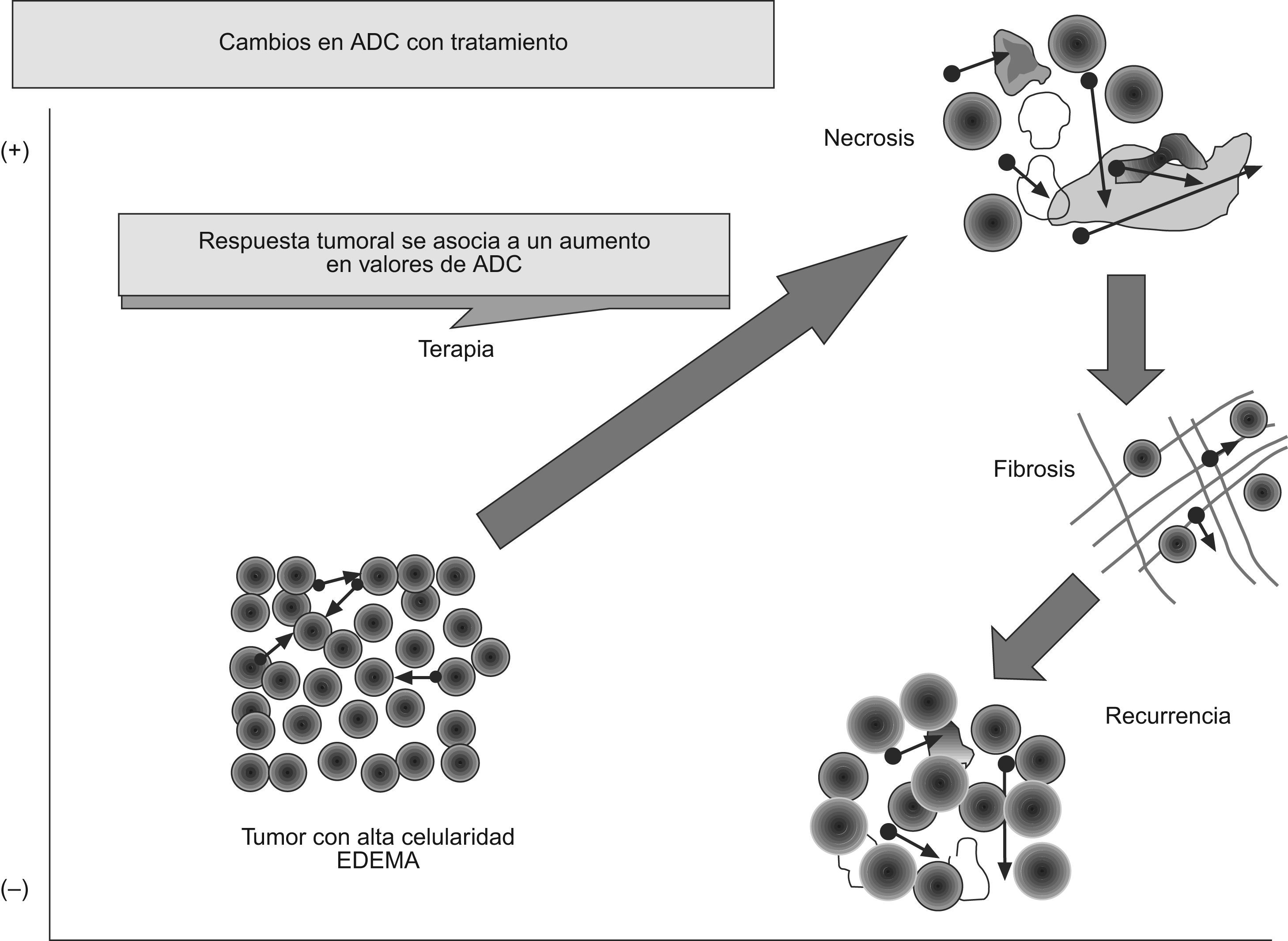
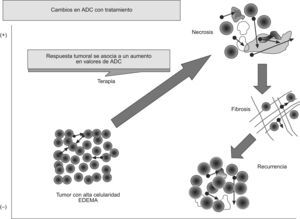
La RM potenciada en difusión también parece poder predecir una posible respuesta tumoral al tratamiento. Se ha publicado que los tumores con un ADC disminuido pretratamiento muestran mejor respuesta al tratamiento con quimioterapia o con radioterapia53–57. Una posible explicación a este fenómeno podría ser que los tumores necróticos suelen mostrar un ADC mayor y que estos tumores suelen mostrar hipoxia y pobre perfusión, lo que disminuye su sensibilidad al tratamiento. Por otra parte, una elevación precoz del ADC tras el tratamiento se ha asociado a una mejor respuesta a ésto. Sin embargo, debemos considerar que, en ocasiones, se produce una disminución temporal del ADC en tumores, que se cree que estaría motivada por un edema celular preapoptótico, disminución de flujo o del espacio extracelular. La respuesta a tratamientos oncológicos puede conllevar un aumento del ADC que reflejaría un incremento en la movilidad de las moléculas de agua, bien por un aumento del fluido extracelular, consecuencia de la disminución de la celularidad de la lesión, o por una pérdida de integridad de las membranas celulares, como se vería en la necrosis o en la apoptosis57–59. Por el contrario, una disminución del ADC traduciría una disminución del espacio extracelular por un aumento del tamaño o del número de las células, lo que se puede ver en los casos de progresión tumoral, edema o fibrosis. Estos cambios en el ADC aparecen precozmente, lo que permitiría que la difusión sea un biomarcador de respuesta tumoral (fig. 9).
En cuanto al uso de la PET en la valoración de la respuesta tumoral, se necesitarían datos cuantitativos de los cambios del valor de captación estandarizado de los tumores con 18F-FDG-PET (fig. 1). Sin embargo, los métodos para calcular los índices semicuantitativos de actividad (SUV o “standard uptake value”) no están estandarizados60. Se han publicado los criterios PERCIST (PET Response Criteria in Solid Tumors 1.0)61 como punto de partida para un informe cuantitativo de la respuesta y para ensayos clínicos de fármacos. También la European Organisation for Research and Treatment of Cancer ha publicado criterios para determinar la respuesta metabólica mediante fluorodeoxiglucosa–PET62.
Por último, la espectroscopia también podría desempeñar un papel en la valoración de la respuesta al tratamiento y se ha evidenciado una disminución precoz de Ch en los pacientes que van a responder15.
Existe un interés creciente en el uso de los medios de imagen para el desarrollo de nuevos fármacos. Un biomarcador se definiría como un parámetro fisiológico, anatómico, bioquímico o molecular asociado a la presencia y al grado de gravedad de una enfermedad63. Para que la imagen pueda usarse como biomarcador en la evaluación de respuesta a estos fármacos debe ser sensible a los cambios secundarios al tratamiento, poder demostrar la heterogeneidad tumoral y ser reproducible64. Actualmente existe, sin embargo, demasiada variabilidad entre los métodos de cuantificación de las medidas obtenidas con la RM dinámica, la PET o la difusión. La metodología debería estandarizarse, tanto en los parámetros técnicos como en el momento de la evaluación de la respuesta, y el valor de las distintas técnicas debería demostrarse para cada tipo tumoral y para cada localización de la enfermedad. Se ha visto la utilidad de la imagen en las fases i y ii del desarrollo de los fármacos a la hora de guiar la selección de fármacos, evaluar sus efectos in vivo en animales y en humanos, y en la dosificación y beneficio de estos4,51,65, pero lamentablemente estos datos positivos no han tenido una traslación a muchos de los estudios en fase iii, salvo en el caso de los anti-VEGF y los cánceres de colon y de riñón47.
Sin embargo, múltiples datos parecen prever una importancia creciente de la imagen en la evalución de respuesta tumoral y en el desarrollo de nuevos fármacos51,63,65. Quedan, sin embargo, por dilucidar cuestiones tan importantes como el definir qué se considera respuesta con cada técnica y en cada tipo tumoral y correlacionar el grado de variación de los biomarcadores medidos por imagen con la variación de otros biomarcadores66 o con los beneficios clínicos del tratamiento como, por ejemplo, la supervivencia de los pacientes67.
Conclusiones: la imagen funcional toma el relevo en tumoresLa imagen oncológica ha entrado en un momento en el que su razón de ser y su necesaria aportación desbordan la clásica función de análisis morfológico de los tumores. El mejor entendimiento de los mecanismos del cáncer y de todos los elementos que influyen en éste debe tener una adecuada respuesta en el campo de la imagen. Necesitamos profundizar en la imagen funcional tumoral para ser capaces de estudiar en profundidad la fisiología y la composición celular o molecular de los tumores, definir parámetros de respuesta tumoral y seleccionar precozmente a aquellos pacientes que van a responder a un determinado tratamiento. Y en este entorno, la evaluación simultánea de múltiples factores (angiogénesis, metabolismo, celularidad, etc.) asociados al cáncer, el uso de técnicas híbridas (como la PET-TC) y el abordaje de dianas moleculares parecen marcar el futuro de la imagen oncológica.
AutoríasLos Dres. Roberto García Figueiras, Anwar Padhani, Joan Carles Vilanova Busquets, Vicky Goh y Carmen Villalba Martín han contribuido en la concepción y en el diseño del estudio, en la obtención de los datos o en su análisis e interpretación. Además, han intervenido en la redacción del trabajo o en su revisión crítica, hicieron aportaciones intelectuales relevantes y dieron su aprobación final a la versión que se envía para publicar.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.