La resonancia magnética (RM) de columna es la exploración de elección para el manejo de la patología de la médula ósea. La RM incluye secuencias morfológicas y funcionales para poder integrar la información en el estudio de la patología infiltrativa del mieloma múltiple y metástasis óseas del raquis, desde la detección, estadificación y monitorización terapéutica. En la actualidad, la RM de cuerpo entero se está integrando en las distintas guías como la técnica de elección en el manejo del mieloma múltiple y enfermedad metastásica ósea. Los cambios fisiológicos de la médula amarilla y roja suponen un reto en el análisis para diferenciar hallazgos clínicamente significativos de los hallazgos clínicamente no significativos. El presente artículo describe las características en RM de los hallazgos fisiológicos, variantes y procesos infiltrativos de la médula ósea para el manejo del mieloma múltiple y las metástasis óseas.
Magnetic resonance imaging (MRI) of the spine is the imaging study of choice for the management of bone marrow disease. MRI sequences enable us to integrate structural and functional information for detecting, staging, and monitoring the response the treatment of multiple myeloma and bone metastases in the spine. Whole-body MRI has been incorporated into different guidelines as the technique of choice for managing multiple myeloma and metastatic bone disease. Normal physiological changes in the yellow and red bone marrow represent a challenge in analyses to differentiate clinically significant findings from those that are not clinically significant. This article describes the findings for normal bone marrow, variants, and invasive processes in multiple myeloma and bone metastases.
La médula ósea es un órgano dinámico localizado en los huesos en continuo cambio desde el nacimiento, que muestra un aspecto variable en la resonancia magnética (RM) en relación con la edad o los cambios fisiopatológicos. La frecuente utilización de la RM de columna en el tratamiento de la patología infiltrativa, especialmente metástasis, supone un reto para el radiólogo a la hora de decidir si existe o no patología, e influye en el manejo y las decisiones dependientes de los hallazgos en imagen. El análisis de la columna vertebral en RM requiere conocer la fisiología de la médula ósea que se describe en el siguiente apartado.
Las nuevas terapias precisan monitorizar la respuesta de forma eficaz según los hallazgos de las técnicas de imagen, especialmente la RM y la tomografía computarizada por emisión de positrones (PET-TC)1.
La reciente optimización de la técnica de RM de cuerpo entero con difusión (RM-CCD) está condicionando la inclusión de la RM-CCD en las actualizaciones de las distintas guías oncológicas para el manejo y la estadificación tanto del mieloma múltiple como de las metástasis óseas2.
El presente artículo analiza la infiltración de la médula ósea en la enfermedad metastásica y el mieloma múltiple del raquis con especial énfasis en la imagen mediante RM.
Médula óseaLa médula ósea está constituida por grasa, agua y células; su composición varía en relación no solamente con las condiciones fisiológicas individuales, sino en función de la edad. La médula ósea normal está constituida en diferentes proporciones por la médula roja (médula ósea hematopoyética) y médula amarilla (médula hematopoyética inactiva), con diferente contenido en relación con la proporción de células hematopoyéticas, agua y grasa. La médula roja contiene un 40% de células de grasa, un 40% de agua y un 20% de células hematopoyéticas, mientras que la médula ósea amarilla se compone de un 80% de células de grasa, un 15% de agua y un 5% de células hematopoyéticas. Después de la infancia, la médula ósea roja es sustituida por médula amarilla mediante un proceso de conversión progresiva desde la periferia (esqueleto apendicular) al centro (esqueleto axial) y de las epífisis distales a las diáfisis hasta las metáfisis proximales de los huesos largos3. En los huesos largos es frecuente observar restos de médula roja subcondral, especialmente en la cabeza del húmero y el fémur. En el adulto, la médula roja se encuentra principalmente en la metáfisis del esqueleto apendicular y subcortical de la plataforma vertebral (el equivalente metafisario), debido a la propia vascularización.
La reconversión de la médula ósea amarilla a roja sucede en determinadas circunstancias por aumento de la demanda de la hematopoyesis (fig. 1). Este proceso sucede en sentido inverso a la conversión, empezando en el esqueleto axial hasta las extremidades. Las distintas causas que pueden producir reconversión de la médula ósea se detallan en la tabla 1.
Causas de reconversión de médula amarilla a médula roja
| Infiltración de la médula ósea (metástasis, enfermedades hematológicas) |
| Anemia grave |
| Insuficiencia cardíaca crónica |
| Factores estimulantes hematopoyéticos |
| Irradiación extensa (reconversión en la médula no irradiada) |
| Corredores de fondo |
| Residencia en altitud |
| Tabaquismo en exceso |
| Obesidad |
La médula ósea roja residual se encuentra frecuentemente en una RM de rutina, y puede dar lugar a patrones inusuales de médula roja que podrían ser malinterpretados como un proceso maligno si no se analizan de forma cuidadosa. La médula roja de distribución extensa, difusa, puede ser difícil de diferenciar de un proceso maligno hematológico difuso. En el apartado de RM se analizarán los hallazgos y patrones normales en las distintas secuencias.
El radiólogo debe reconocer y entender los cambios fisiológicos y patológicos de la médula ósea en relación con la edad, variantes y patrones normales e identificar procesos patológicos en relación con las distintas causas4. Será imprescindible la correlación de los hallazgos de imagen con los parámetros clínicos para una correcta interpretación.
TécnicasEn este apartado se describen las principales características de las técnicas de imagen disponibles en la valoración de la médula ósea, de las cuales la RM es la técnica de elección5, por lo que se dedica el apartado siguiente para describir específicamente el análisis de la médula ósea en RM.
- •
Radiografía simple. Es accesible y de bajo coste. Ofrece la ventaja de una buena detección de lesiones corticales pero precisamente con limitaciones en la detección de patología de la médula ósea. Debe reducirse la masa ósea en un 30-50% para poder ser visualizada en la radiografía simple6. Además, para poder realizar un análisis completo de la médula ósea es necesario realizar una seriación ósea incluyendo cráneo, columna, costillas, húmeros, fémures y pelvis. La radiografía simple presenta limitación por la superposición de estructuras, especialmente con densidad aire sobre estructuras óseas que simulan lesiones osteolíticas7.
- •
Tomografía computarizada (TC). La TC es sensible en la detección de lesiones óseas, evita la superposición de estructuras en comparación con la radiografía simple y permite realizar un estudio completo de cuerpo entero, especialmente mediante TC multidetector con dosis baja (TCMD)8. La TC es útil en el mieloma múltiple como técnica para estimar el riesgo de fracturas y detectarlas de forma precoz. La TC presenta limitación en el análisis de las partes blandas y, en consecuencia, de la médula ósea9. De todas formas, el análisis de la médula ósea puede realizarse mediante la cuantificación basada en las unidades Hounsfield. Así mismo, se puede realizar la monitorización de respuesta al tratamiento cuantificando los cambios de densidad de la médula ósea.
- •
Medicina nuclear. La gammagrafía ósea se ha utilizado ampliamente en el manejo de la patología ósea, pero presenta escasa utilidad en las lesiones líticas, ya que su mecanismo de acción se basa en la actividad osteoblástica de las lesiones10, de ahí su poca utilidad en el manejo del mieloma múltiple. La tomografía computarizada por emisión de fotón simple (SPECT) permite mejorar los resultados, especialmente con lesiones de mayor tamaño y extensión cortical.
- •
La PET/TC es una técnica de medicina nuclear útil en la valoración de la médula ósea, ya que obtiene información metabólica y estructural mediante las dos técnicas: PET y TC. El radiotrazador utilizado con más frecuencia es el 18F-fluorodesoxiglucosa (FDG). La PET/TC proporciona información de la actividad en la médula ósea y permite la cuantificación mediante el SUV (Standardized Uptake Value). Presenta limitación en lesiones de tamaño inferior a 5mm y menor captación en lesiones osteoblásticas11, aunque los nuevos equipos están disminuyendo el umbral de detección. La PET/TC permite la detección de la patología de la médula ósea y su extensión extramedular con significado pronóstico en el manejo de la patología infiltrativa tanto en el mieloma múltiple como en las metástasis óseas, especialmente en la monitorización terapéutica12. La PET/TC sigue siendo la técnica de elección en el seguimiento de la neoplasia de pulmón y linfoma, aunque el potencial de la RM de cuerpo entero puede ser alternativa de coste/eficacia al mostrarse ambas técnicas de similar eficacia, y especialmente su consideración en edad pediátrica13,14. La PET/TC muestra falsos positivos en procesos inflamatorios, infecciosos, quimioterapia (en las primeras 4 semanas) o post-radioterapia (durante los 2-3 meses posteriores).
- •
La gammagrafía con 99mTc sestamibi (MIBI) es una técnica útil y alternativa cuando no exista disponibilidad de PET/TC para el manejo del mieloma múltiple.
- •
La combinación de la RM con la PET, PET/RM, como nueva técnica híbrida hacen prever la posibilidad de que en el futuro sea la técnica más eficaz para el manejo de la patología infiltrativa de la médula ósea15.
La RM es la técnica de elección en el manejo de la médula ósea y especialmente en el raquis por su capacidad de identificar la fisiología y los cambios de la médula ósea en relación con las distintas características proporcionadas por las secuencias utilizadas16,17.
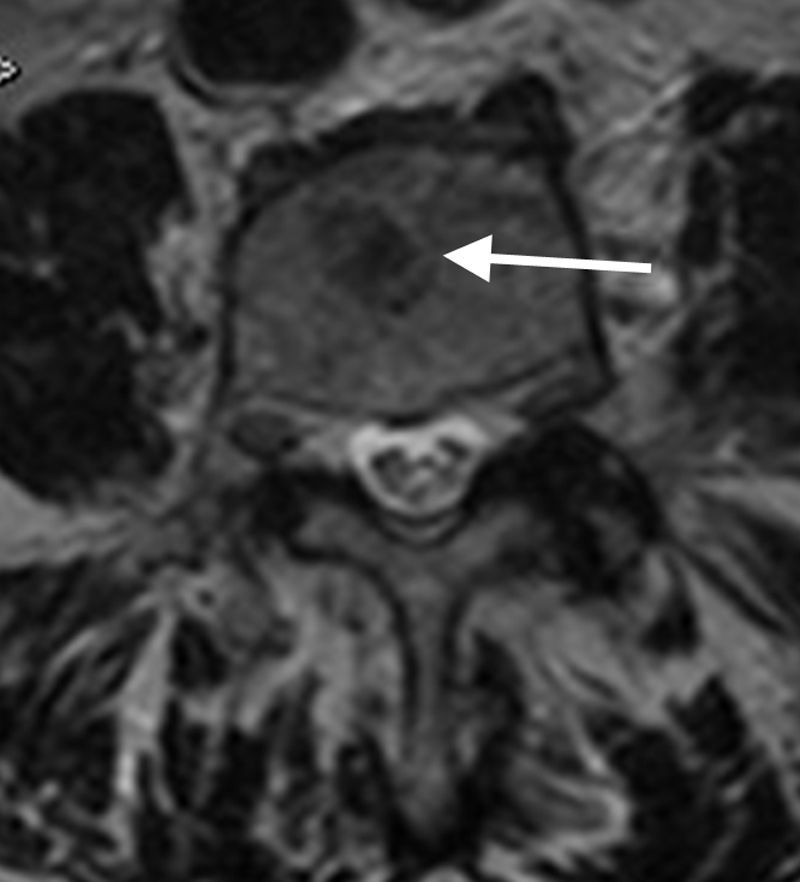
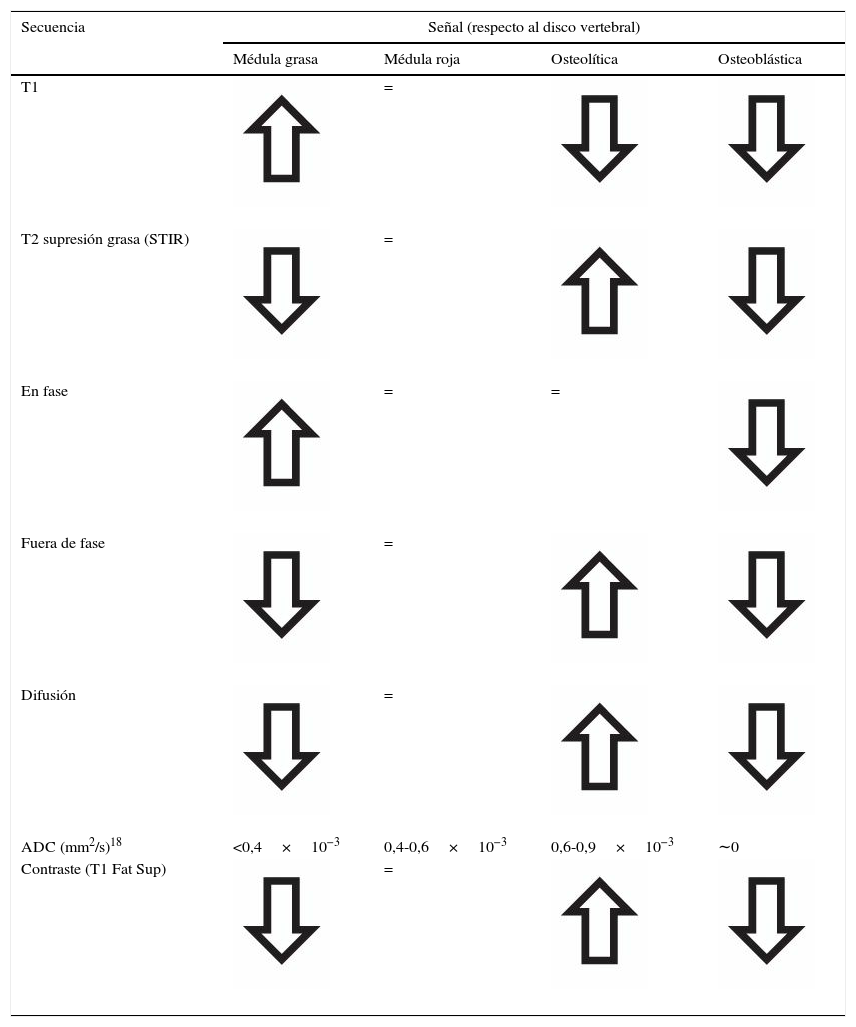
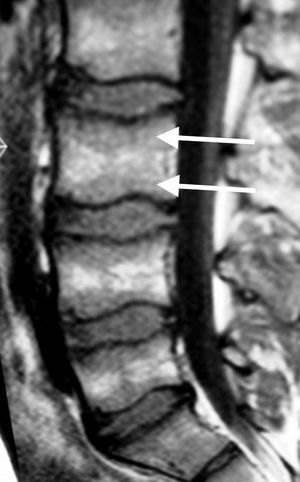
SecuenciasEs imprescindible conocer el aspecto normal de la médula ósea en relación a las distintas secuencias (espín eco T1, T2 con supresión grasa-STIR, desplazamiento químico–fase/fuera de fase–, difusión y contraste intravenoso) para diferenciar entre normalidad, variantes y cambios fisiológicos de la médula amarilla y roja. En la tabla 2 se describen los patrones de señal según las distintas secuencias y los hallazgos en relación con la médula grasa, roja y el proceso infiltrativo lítico o blástico. Las secuencias imprescindibles para el análisis de la médula ósea son espín eco T1 y supresión grasa en T2 o STIR. La facilidad a la hora de detectar hiposeñal de las lesiones infiltrativas de la médula ósea en T1 rodeado de hiperseñal normal de médula grasa explican la utilidad de la secuencia T1 como método de detección. En general, la afectación difusa hipointensa respecto al disco en T1 suele ser patológica, con una fiabilidad del 98%. Por otra parte, la presencia de focos hiperintensos (grasa) en el centro de una lesión de la médula ósea en T1 (signo del ojo de buey) tiene una especificidad del 99,5% y una sensibilidad del 98%18. En secuencias T2 (supresión grasa o STIR) resulta útil identificar un anillo hiperintenso perilesional (signo del halo) (fig. 2) como signo específico (99,5%) de proceso infiltrativo metastásico19.
Señal de la médula ósea en los distintos procesos en relación con la secuencia en RM
| Secuencia | Señal (respecto al disco vertebral) | |||
|---|---|---|---|---|
| Médula grasa | Médula roja | Osteolítica | Osteoblástica | |
| T1 | = | |||
| T2 supresión grasa (STIR) | = | |||
| En fase | = | = | ||
| Fuera de fase | = | |||
| Difusión | = | |||
| ADC (mm2/s)18 | <0,4×10−3 | 0,4-0,6×10−3 | 0,6-0,9×10−3 | ∼0 |
| Contraste (T1 Fat Sup) | = | |||
Hoy en día resulta útil incluir la secuencia de difusión y el cálculo del coeficiente de difusión aparente para la valoración de la médula ósea en los procesos infiltrativos2. Para el análisis de la médula ósea en RM-difusión (RM-D) es preciso considerar la presencia del contenido de médula grasa con el análisis de la secuencia T1 y supresión grasa en T2 o STIR. El aumento del contenido adiposo dentro de la médula ósea con la edad presenta una correlación negativa con los valores de ADC; por lo tanto, cuanto mayor es el contenido graso, más negativo es el valor de ADC. Los valores de ADC presentan una correlación negativa con la celularidad de la médula ósea, aunque paradójicamente, el ADC de la médula amarilla hipocelular es menor que el ADC de médula normal normocelular de los adultos y que la médula hipercelular de los niños. A nivel microscópico, los adipocitos de la médula amarilla presentan una mayor restricción a la difusión del agua que las células hematopoyéticas normales. Debe tenerse especial precaución cuando se utiliza la RM-D en la valoración de la patología ósea en los niños, ya que las áreas de hiperseñal en valores b altos (b>500 s/mm2) son comunes en la pelvis y en la columna lumbar20.
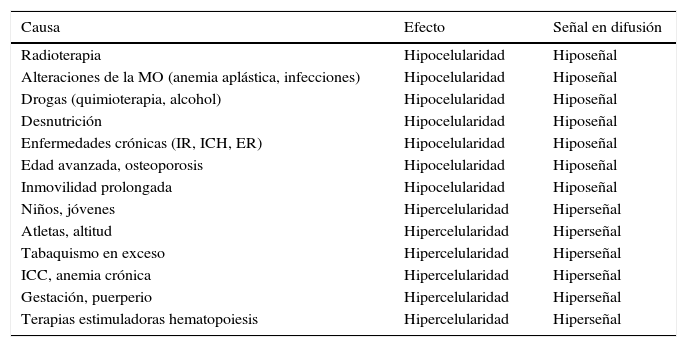
El aumento de celularidad en la médula ósea puede ser debido a una hiperplasia de la médula ósea o a una infiltración tumoral21. Este hecho se manifiesta como un aumento progresivo de la intensidad de señal en las adquisiciones de RM-D con valores altos del factor b y con una disminución de los valores de ADC. Deben conocerse el efecto de la médula ósea en relación con distintos procesos fisiológicos o patológicos (tabla 3) para identificar la señal esperada en la secuencia difusión, e interpretar de forma correcta la exploración RM. La RM-D ha mostrado ser superior a la gammagrafía ósea en la detección de las metástasis22.
Cambios en la médula ósea producidos por distintas causas y que afectan a la señal de difusión
| Causa | Efecto | Señal en difusión |
|---|---|---|
| Radioterapia | Hipocelularidad | Hiposeñal |
| Alteraciones de la MO (anemia aplástica, infecciones) | Hipocelularidad | Hiposeñal |
| Drogas (quimioterapia, alcohol) | Hipocelularidad | Hiposeñal |
| Desnutrición | Hipocelularidad | Hiposeñal |
| Enfermedades crónicas (IR, ICH, ER) | Hipocelularidad | Hiposeñal |
| Edad avanzada, osteoporosis | Hipocelularidad | Hiposeñal |
| Inmovilidad prolongada | Hipocelularidad | Hiposeñal |
| Niños, jóvenes | Hipercelularidad | Hiperseñal |
| Atletas, altitud | Hipercelularidad | Hiperseñal |
| Tabaquismo en exceso | Hipercelularidad | Hiperseñal |
| ICC, anemia crónica | Hipercelularidad | Hiperseñal |
| Gestación, puerperio | Hipercelularidad | Hiperseñal |
| Terapias estimuladoras hematopoiesis | Hipercelularidad | Hiperseñal |
ER: enfermedades reumáticas; ICC: insuficiencia cardíaca crónica; ICH: insuficiencia crónica hepática; IR: insuficiencia renal; MO: médula ósea.
La administración de contraste puede ser útil para mejorar la detección de lesiones y en la monitorización terapéutica23. Debe utilizarse secuencia espín eco T1 en supresión grasa tras administrar contraste, imprescindible ante sospecha de afectación leptomeníngea o para valorar de forma precisa la extensión al canal del componente expansivo, de partes blandas, e imprescindible también para la compresión medular.
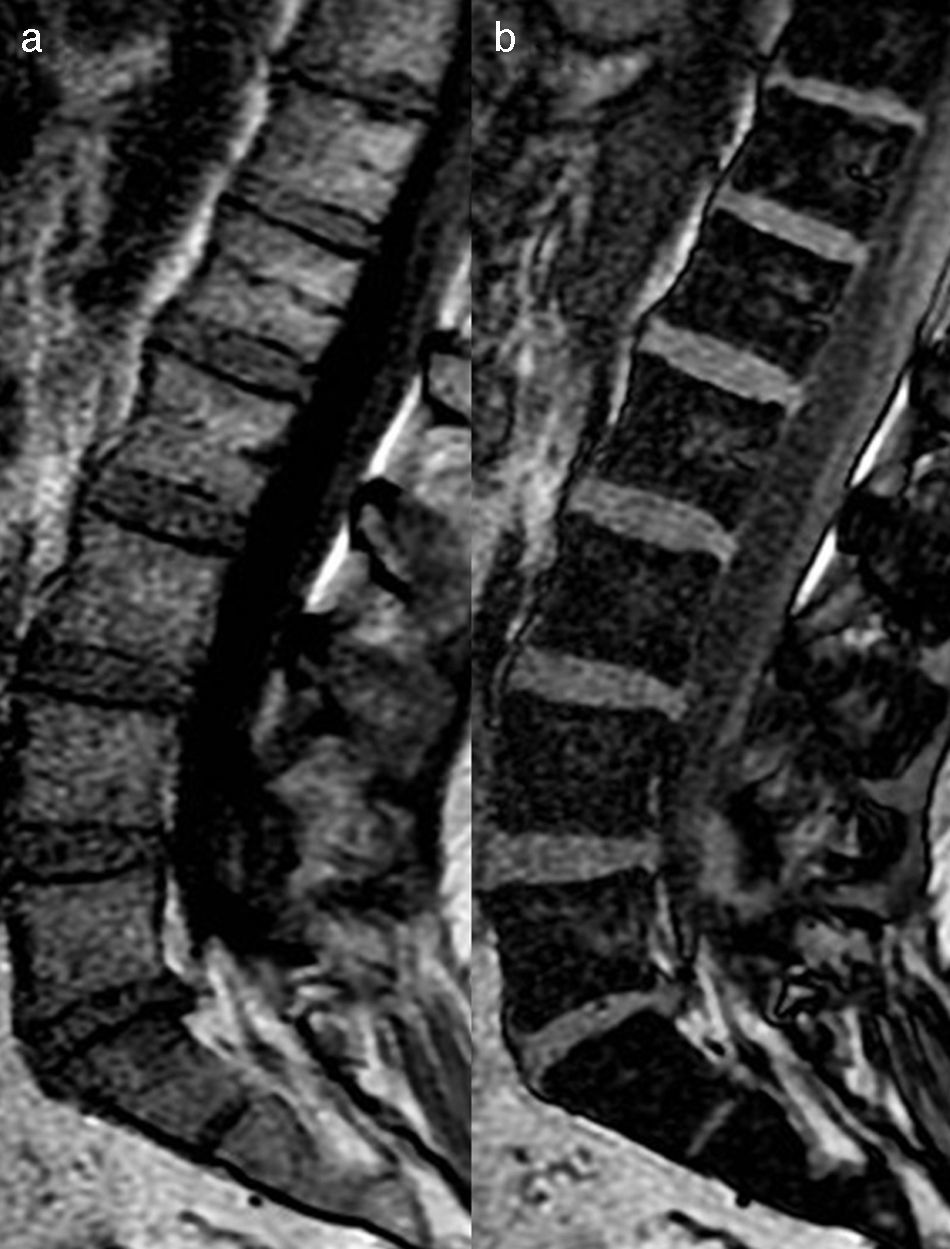
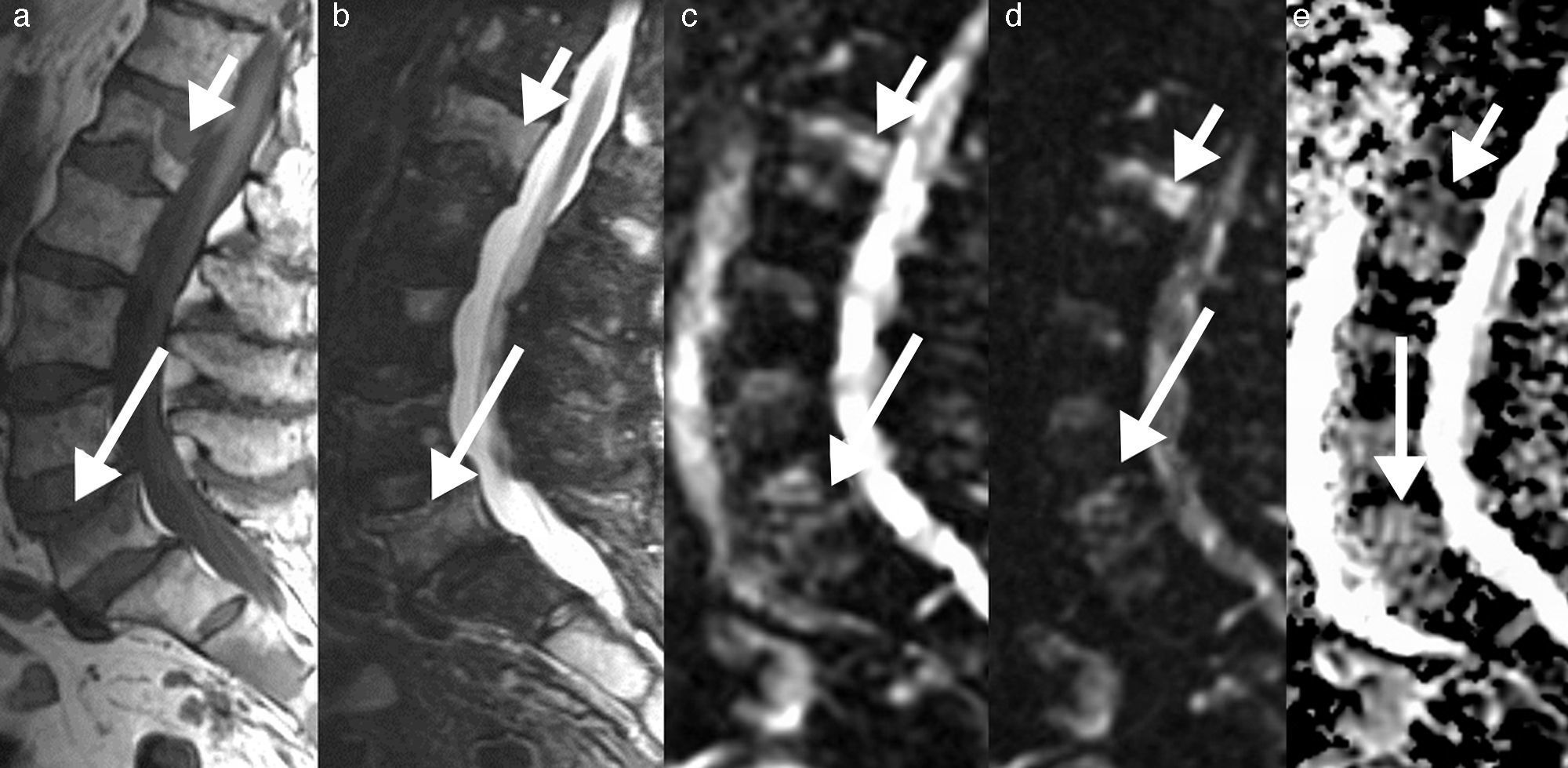
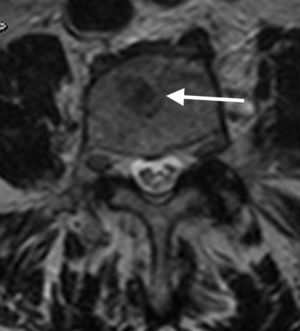
Así mismo, puede ser de utilidad la inclusión de la secuencia de desplazamiento químico en fase/fuera de fase para valorar la médula ósea. La técnica en adquisición en fase y fuera de fase proporciona información de la grasa microscópica, y hace que sea especialmente útil a la hora de diferenciar la médula ósea normal con abundante grasa de una condición patológica que puede reemplazar la médula ósea. Por otro lado, en un proceso donde no se sustituye la grasa ósea (como edema o médula roja mezclada con médula amarilla), habrá una disminución en la intensidad de señal en la imagen opuesta de fase en comparación con la imagen en fase (fig. 3). Se puede calcular el cociente de la intensidad de señal (IS) de la médula ósea en la imagen opuesta de fase en relación con la de fase mediante la colocación de una región de interés (ROI). Se ha demostrado que un cociente IS>0,8 es sugestivo de un proceso maligno y un IS<0,8 es sugestivo de proceso benigno24.
Los avances en RM permiten integrar las distintas secuencias en un único estudio de cuerpo entero para la valoración completa de la médula ósea25,26.
Mieloma múltipleEl mieloma múltiple (MM) es una enfermedad maligna de las células plasmáticas que se caracteriza por la infiltración de la médula ósea con células plasmáticas clonales, producción de inmunoglobulina monoclonal (paraproteína), lesión orgánica, lesiones líticas en los huesos, insuficiencia renal, hipercalcemia y anemia. El mecanismo fisiopatológico del MM consiste en la estimulación de osteoclastos y la inhibición de osteoblastos por parte de las células mielomatosas, lo que explica la imagen lítica del MM en las distintas técnicas de imagen22. El MM forma parte de las enfermedades de las células plasmáticas caracterizadas por la producción de una paraproteína, donde se incluyen el mieloma múltiple sintomático, el MM latente (asintomático), la gammapatia monoclonal de significado indeterminado (GMSI), el plasmocitoma solitario, la amiloidosis sistémica, el síndrome de POEMS y la macroglobulinemia de Waldestrom. Tanto el MM latente como la GMSI se consideran precursores del MM sintomático. El plasmocitoma es la variante focal del MM. El MM puede ser causa de la amiloidosis primaria. El diagnóstico de MM incluye: más del 10% de células plasmáticas en médula ósea, diagnóstico de plasmocitoma en biopsia, detección de proteína monoclonal en suero u orina y la presencia de lesión orgánica (hipercalcemia, insuficiencia renal, anemia o lesiones líticas óseas)27.
DetecciónLa evaluación del esqueleto en el MM es necesaria, no solo para la estadificación, sino también para detectar complicaciones graves, como fracturas, y como indicador pronóstico22. Aunque el estudio mediante seriación ósea sigue vigente28, las técnicas de imagen de elección en el manejo del MM son la RM y la PET/TC29,30. La imagen de la radiografía simple del MM puede incluir: osteoporosis difusa, múltiples aplastamientos vertebrales, lesiones líticas bien delimitadas de tamaño uniforme (imagen en sacabocados en el cráneo), a diferencia de las metástasis, que suelen mostrar tamaño variable. La infiltración de la médula ósea adyacente a la cortical suele mostrar aspecto de festoneado en la radiografía, a diferencia de la destrucción del córtex, más propio de las metástasis.
Se utiliza la nueva estadificación de Durie-Salmon PLUS (a diferencia de la previa de Durie-Salmon, sustituyendo la valoración de la radiografía simple por la RM o la PET-TC) como valor pronóstico basado en la identificación de lesiones focales y afectación difusa de la médula ósea:
- •
Estadio IA: esqueleto normal o lesión única.
- •
Estadio IB: menos de cinco lesiones o enfermedad difusa leve.
- •
Estadio IIA/B: entre cinco y veinte lesiones o enfermedad difusa moderada.
- •
Estadio IIIA/IIIB: más de veinte lesiones focales o enfermedad difusa grave.
Los sufijos A y B indican lo siguiente: A, función renal normal, y B, función renal alterada.
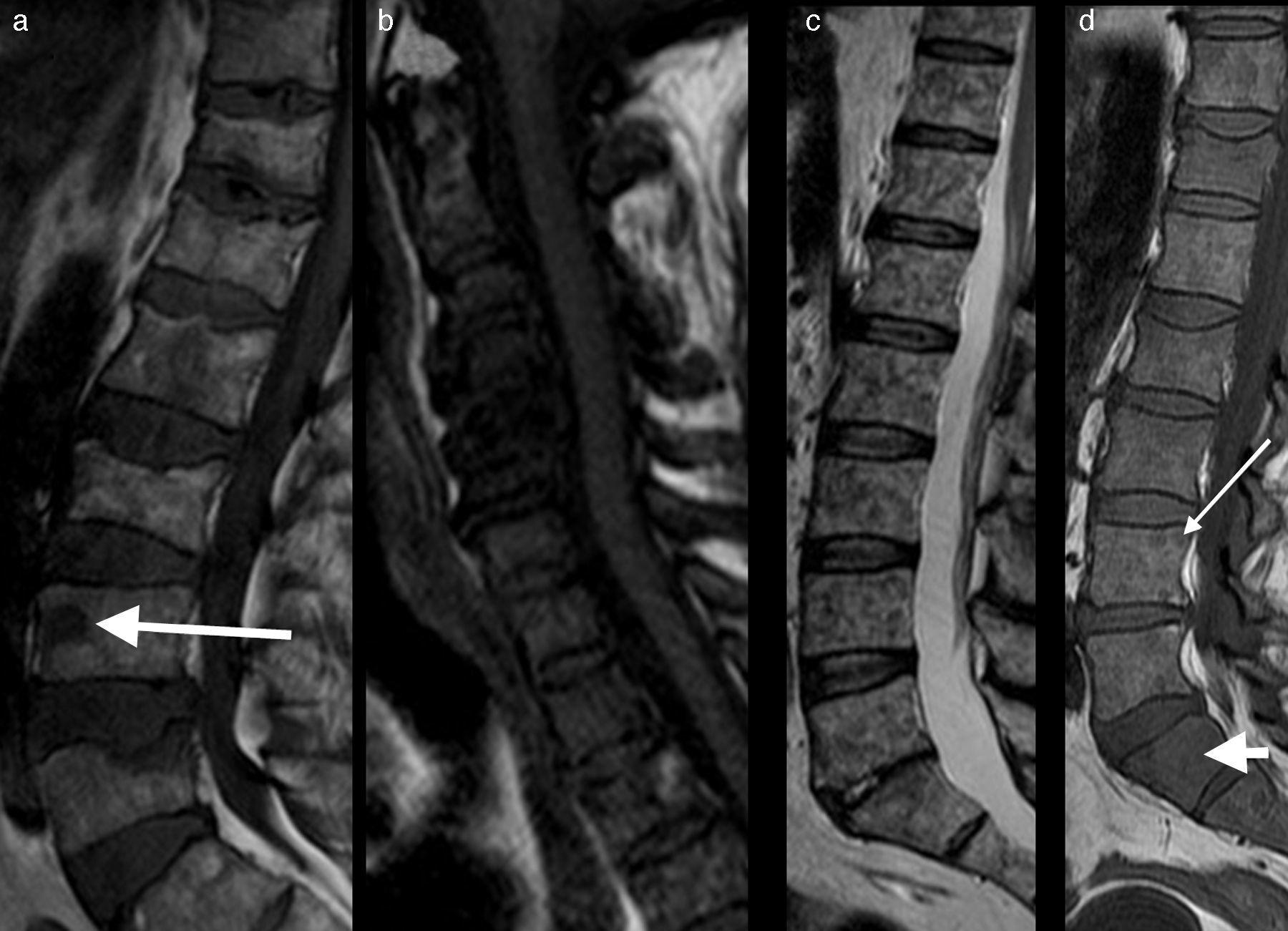
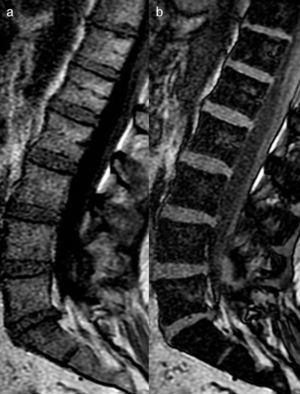
Se han descrito tres patrones de infiltración en el MM: focal, moteado o variegato («sal y pimienta») y difuso; aunque es frecuente la presencia de un patrón mixto, combinado, difuso-multifocal (fig. 4). Existe valor pronóstico en el patrón difuso al mostrar menor tiempo de supervivencia en el MM. Así mismo, el patrón difuso tiende a progresar más rápidamente que aquellos con patrón moteado. Precisamente la utilidad de la RM es poder identificar a los pacientes de mayor riesgo según los patrones de RM y prevenir complicaciones. Al mismo tiempo, la RM permite valorar la evolución de las lesiones.
Patrones en RM del mieloma múltiple. a) Imagen sagital en FSE T1 que muestra lesión nodular en L4 (flecha) en relación con patrón focal. b) Imagen sagital en FSE T1 que muestra infiltración difusa de la médula ósea en los cuerpos vertebrales cervicales en relación con patrón difuso, con artrosis sobreañadida de C3 a C6. c) Imagen sagital en FSE T1 que muestra patrón moteado, variegato o «en sal y pimienta», representado por lesiones micronodulares en la médula ósea de forma difusa. d) Imagen sagital en FSE T1 que muestra patrón micronodular en los cuerpos vertebrales del raquis lumbar, similar al que se observa en L4 (fecha larga) conjuntamente a infiltración difusa de S1 (flecha corta), en relación con patrón combinado-mixto.
La RM es útil en el manejo del plasmocitoma, GMSI y MM latente para descartar lesiones óseas y excluir MM31. La RM permite valorar los subgrupos de pacientes que tienen un alto riesgo de progresión a enfermedad de MM, especialmente el plasmocitoma32. El TCMD se está mostrando como técnica alternativa a la seriación ósea en la valoración del riesgo de fracturas y la pérdida de masa ósea, de forma conjunta con los datos clínicos-analíticos para el control de este subgrupo de pacientes.
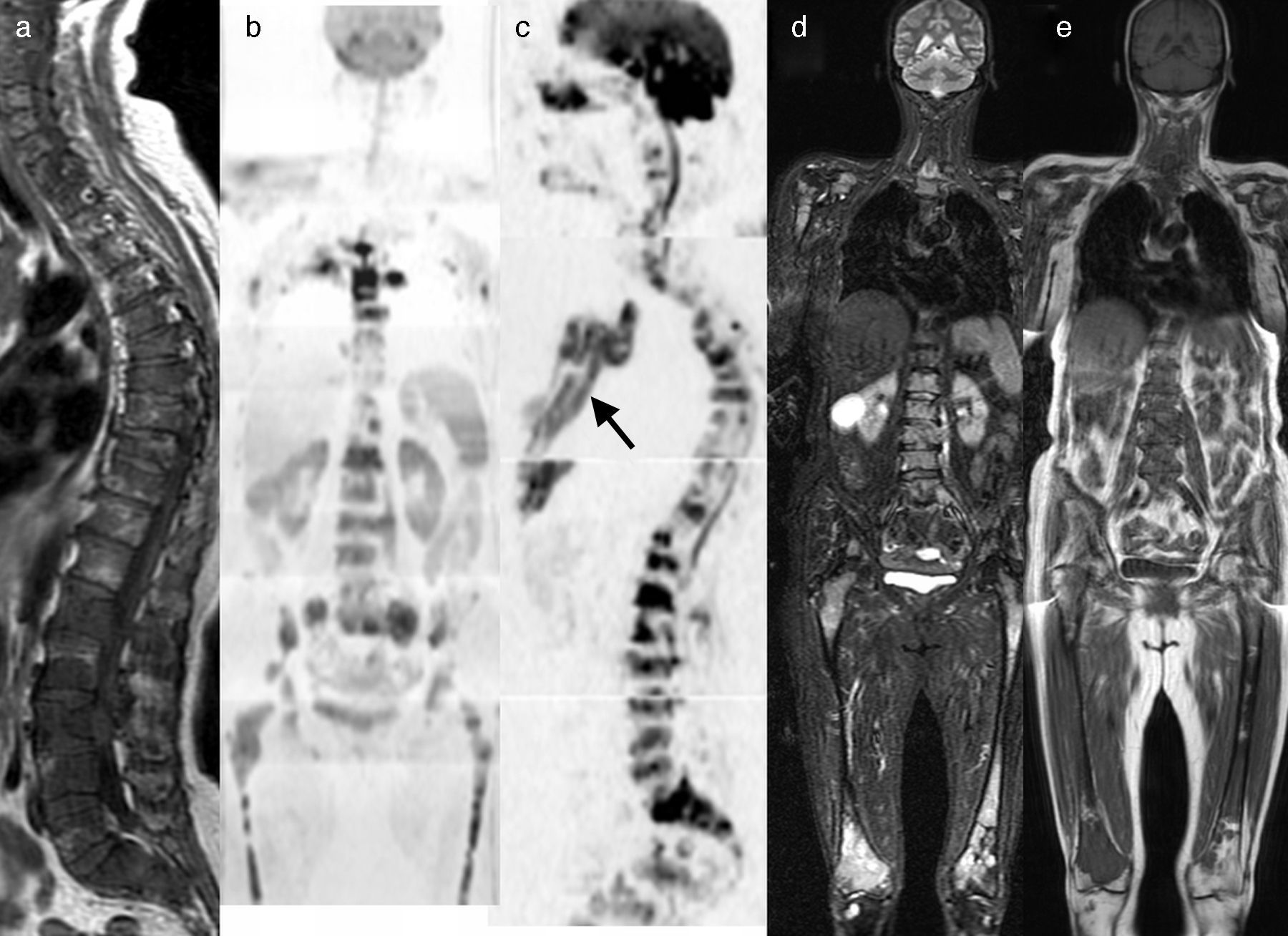
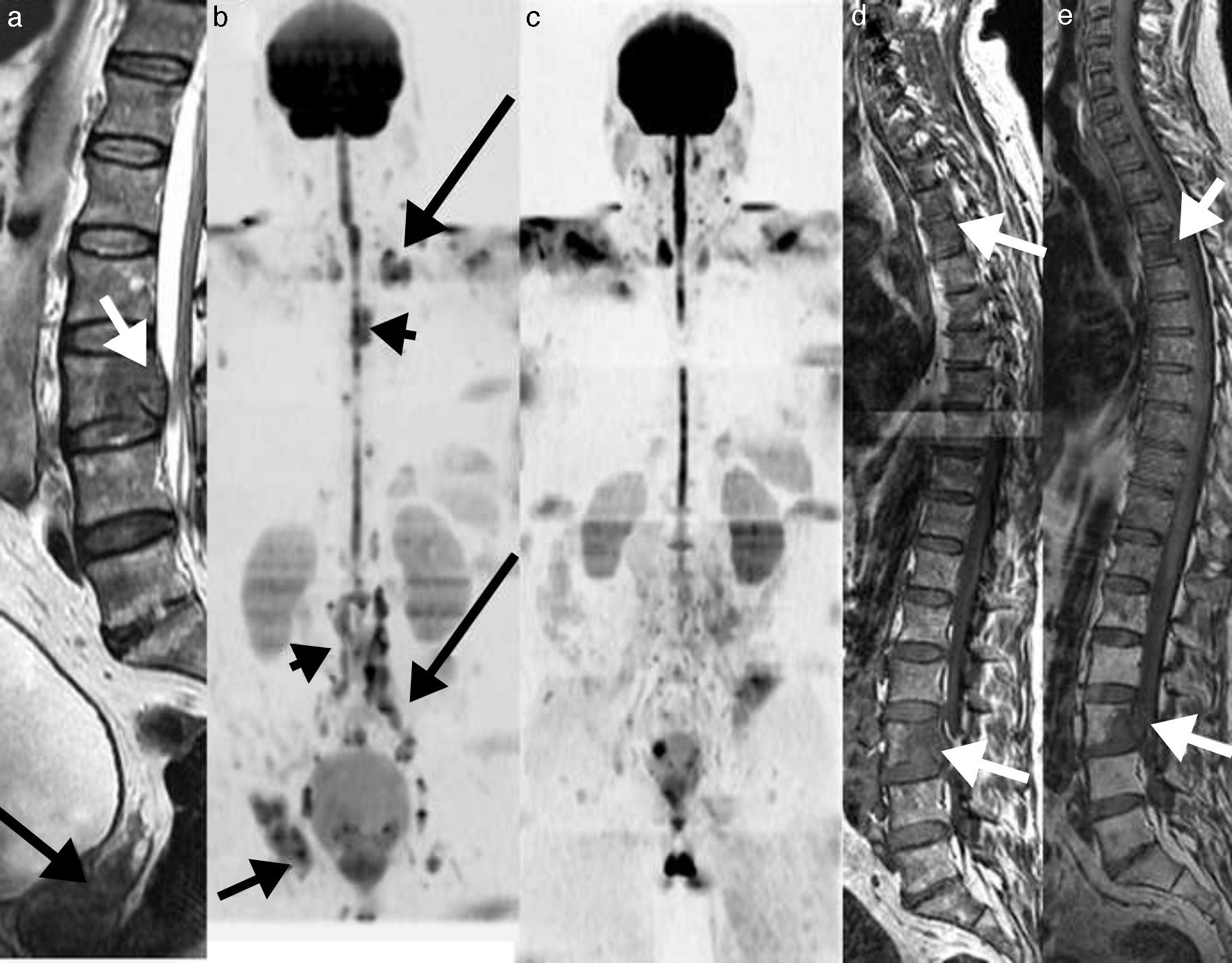
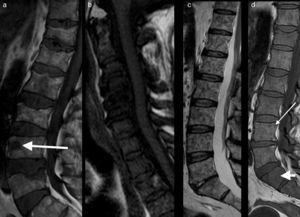
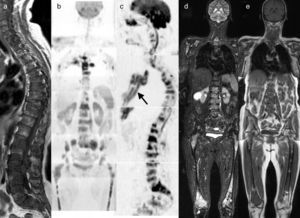
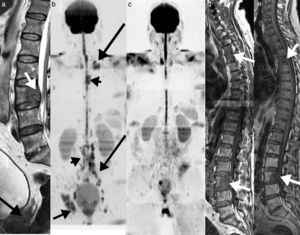
La última declaración de consenso del grupo de trabajo internacional del mieloma múltiple ha incluido el papel de la RM de cuerpo entero en el manejo de los pacientes con mieloma múltiple33,34 (fig. 5).
RM de cuerpo entero con difusión en el mieloma múltiple. a) Imagen sagital T1 de la columna que muestra un patrón infiltrativo difuso. b) Reconstrucción coronal en difusión con inversión de la escala de grises, que muestra infiltración difusa de toda la médula ósea del cuerpo como hipointensidades desde el raquis, pelvis y ambos fémures. c) Reconstrucción sagital de la misma adquisición que b, que muestra además la infiltración de la región esternal (flecha). Las adquisiciones coronales STIR (d) y T1 (e) detectan de forma clara la infiltración de la médula ósea desde el raquis a los fémures.
El tratamiento actual del MM consiste en la quimioterapia con o sin trasplante autólogo de células madre (ASCT). Los criterios de respuesta al tratamiento consisten únicamente en parámetros clínicos-analíticos. Las técnicas de imagen no se utilizan en la rutina clínica en la monitorización terapéutica, aunque se ha descrito su utilidad en el manejo de la respuesta en distintos estudios de investigación30.
La RM se ha mostrado útil en la evaluación de la respuesta a la terapia35. Una respuesta completa (RC) en la RM incluye la desaparición completa de las lesiones de la médula ósea, y la remisión parcial (PR) sería un cambio de patrón difuso a focal o moteado. La reducción de la intensidad de señal en las imágenes ponderadas en T2 y la ausencia de realce de las lesiones, si previamente estaba presente, sugieren respuesta al tratamiento. A veces, las lesiones focales pueden persistir o ser más intensas, lo que podría deberse a la inflamación o a necrosis inducida por el tratamiento. Sin embargo, hay ciertas limitaciones, ya que el tiempo aproximado para la resolución de las lesiones es de 9-12 meses. Debe valorarse la posibilidad de haber recibido factor estimulante de granulocitos (GCSF) durante el trasplante autólogo de células madre (ASCT), condicionando cambios en la médula ósea que pueden ser difíciles de diferenciar de la enfermedad36. En estos casos, la RM debe hacer por lo menos un mes después del ASCT37.
Los pacientes con MM y ausencia de lesiones en la médula ósea por RM tienen mayor supervivencia que aquellos con lesiones en RM. Por otra parte, la presencia de más de siete lesiones focales en la RM se asocia con peor supervivencia, y la resolución de las lesiones focales en la RM después del tratamiento indica un mejor pronóstico. La RM utilizando la difusión permite valorar los cambios mediante la medición del ADC comparativamente con las mediciones basales antes del tratamiento38.
En la actualidad, la RM de cuerpo entero y la PET/TC pueden ser útiles en el manejo del tratamiento con transplante ASCT del mieloma múltiple37, aunque no se utilizan de rutina ante la falta de estandarización y consenso en la interpretación y descripción de los hallazgos, similar a la variabilidad de la estadificación inicial con técnicas de imagen. En la PET/TC se utilizan los valores SUV; y en RM existe variabilidad en la utilización de parámetros en relación con la señal RM, la cuantificación de los cambios de contraste intravenoso y/o los valores de ADC. Se requieren más estudios para poder definir el valor de las técnicas de imagen en la monitorización terapéutica.
Metástasis óseasEl hueso es la localización más frecuente de metástasis después del hígado y los pulmones. Las metástasis son la causa más frecuente de los tumores óseos, que representan el 25% de los casos7. Además, la columna vertebral representa la localización más frecuente de metástasis del esqueleto. Precisamente, la localización más frecuente de las metástasis es el esqueleto axial y el extremo proximal de los huesos largos, debido a la presencia de abundante médula roja. Las células malignas pueden difundirse a la columna vertebral por diversos mecanismos: a través del sistema arterial, a través del drenaje venoso, por líquido cefalorraquídeo, o por extensión directa. La principal vía de diseminación para las metástasis en la columna es la hematógena, a través del plexo venoso paravertebral de Batson, justificado por la ausencia de valvas y especialmente por la localización anatómica del plexo; evitando así el filtro pulmonar. La mayor presencia de médula roja, conjuntamente a la mayor vascularización en el segmento lumbar también explica la mayor frecuencia de las metástasis en esta localización del raquis, así como la afectación con más frecuencia del pedículo, a diferencia del mieloma múltiple6.
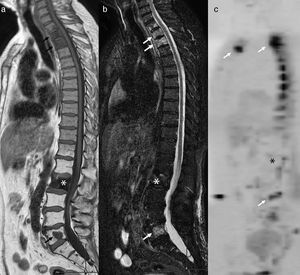
Durante la proliferación celular metastásica en el hueso suceden dos fenómenos simultáneos o secuenciales: proliferación y destrucción ósea, influenciados por la activación-estimulación de osteoblastos y osteoclastos, lo que condiciona un fenómeno de reabsorción o producción de matriz ósea, y origina metástasis osteoblástica, osteolítica o mixta, dependiendo del grado de activación de los distintos factores estimulantes osteoclásticos u osteoblásticos. Las células neoplásicas primarias estimulan los distintos factores de activación blásticos o líticos de forma diferente según el tumor primario, pero de forma heterogénea en las distintas regiones óseas6. De esta forma, las metástasis suelen ser de aspecto más o menos lítico o blástico en relación al tumor primario, y mayoritariamente tienen un aspecto mixto en un mismo paciente (fig. 6). Además, existe influencia de factores angiogénicos que explican las metástasis vascularizadas con aspecto expansivo en imagen, como ocurre en el cáncer renal.
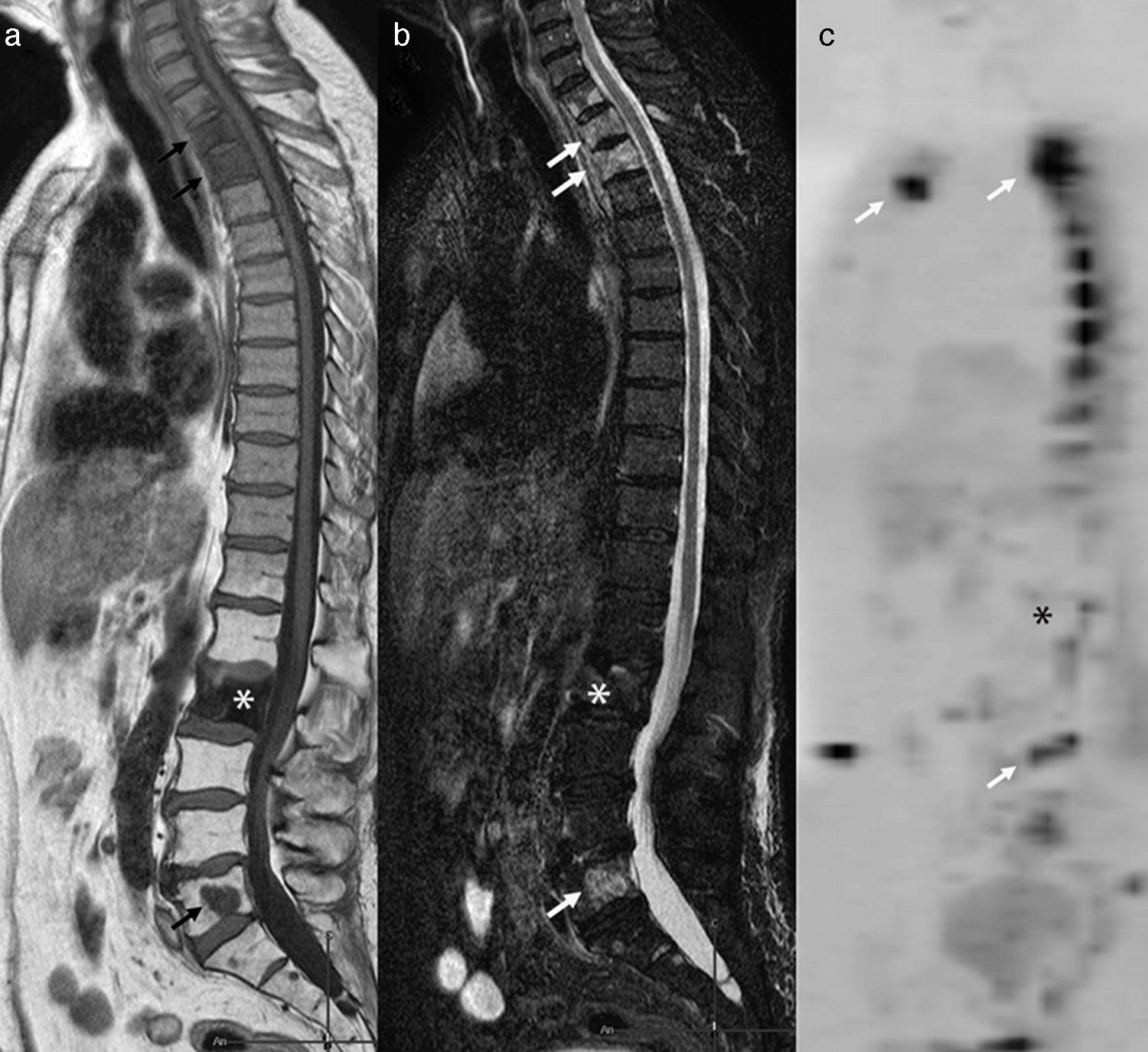
Metástasis vertebrales osteolíticas y osteoblásticas de carcinoma de próstata. Se observan metástasis osteolíticas con restricción de la difusión a nivel dorsal superior, L5 y esternal (flechas) y una metástasis osteoblástica en L2 (asterisco), que no presenta restricción de la difusión y es marcadamente hipointensa en T1 (a) y STIR (b). En la secuencia de difusión con mapa ADC no se observa afectación de la vértebra blástica (asterisco) (c).
El diagnóstico de metástasis óseas es decisivo para determinar el pronóstico y para optimizar la terapia. Como se ha descrito, las lesiones óseas metastásicas pueden ser osteolíticas, osteoblásticas o–más frecuentemente–mixtas. Las distintas técnicas de imagen descritas previamente pueden ser útiles para valorar metástasis óseas, pero la RM se muestra como la técnica más fiable para su detección precisamente por su eficacia en valorar la médula ósea39 y permite valorar tanto lesiones blásticas como líticas. Las metástasis líticas muestran típicamente hiposeñal en T1, e hiperseñal en STIR o supresión grasa en T2 (tabla 2). Las metástasis osteoblásticas aparecen como áreas hipointensas en las distintas secuencias, especialmente en RM-D debido a su bajo contenido en agua40. De todas formas, es habitual la presencia de metástasis mixtas, con lo que en secuencias de supresión grasa/STIR pueden verse con hiperintensidad en relación con la proporción de componente blástico o lítico, es decir, celular (fig. 6).
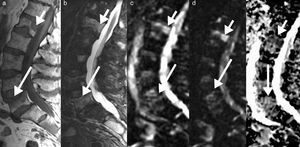
El análisis de las metástasis requiere la valoración morfológica y funcional de forma global. De esta forma es necesario realizar siempre el análisis de la RM-D conjuntamente con las otras secuencias morfológicas T1, T2, supresión grasa o STIR. La médula ósea grasa muestra un valor muy bajo de ADC. En las fracturas vertebrales, la influencia de la grasa disminuye; así, las fracturas malignas muestran valores de ADC más bajos (entre 0,7 y 1×10−3 mm2/s) que las fracturas osteoporóticas o de insuficiencia (1-2×10−3 mm2/s) (fig. 7). Existe superposición de los valores de ADC entre los procesos malignos que afectan a la médula ósea y la espondilitis infecciosa, que muestra por lo general valores bajos de ADC41.
Edema benigno y maligno en el mapa ADC. RM lumbar en paciente con metástasis ósea conocida por cáncer de mama, que presenta en la actualidad lumbalgia aguda. a) Imagen sagital en FSE T1 que muestra múltiples lesiones focales, especialmente en L1 y edema difuso en L5 (flechas). b) El sagital STIR correspondiente muestra un edema más difuso en ambos niveles, difícil de diferenciar si es infiltrante o no infiltrante. c) Imagen sagital en difusión en b=0 mm2/s y d) en b=800 mm2/s que muestra la persistencia de hiperseñal de la lesión a nivel de L1 (flecha corta) y menor señal en L5 (flecha larga). e) El corte sagital en el mapa ADC confirma la hiposeñal en L1 (flecha corta) con valor ADC de 0,7×10-3 mm2/s e hiperseñal en L5 con un valor de ADC de 1,6×10-3 mm2/s. La lesión en L1 es debido a una metástasis y en L5 debido a una fractura de insuficiencia, donde en la imagen en sagital FSE T1 (a) se visualiza línea horizontal subcortical (flecha), lo que justifica los síntomas actuales.
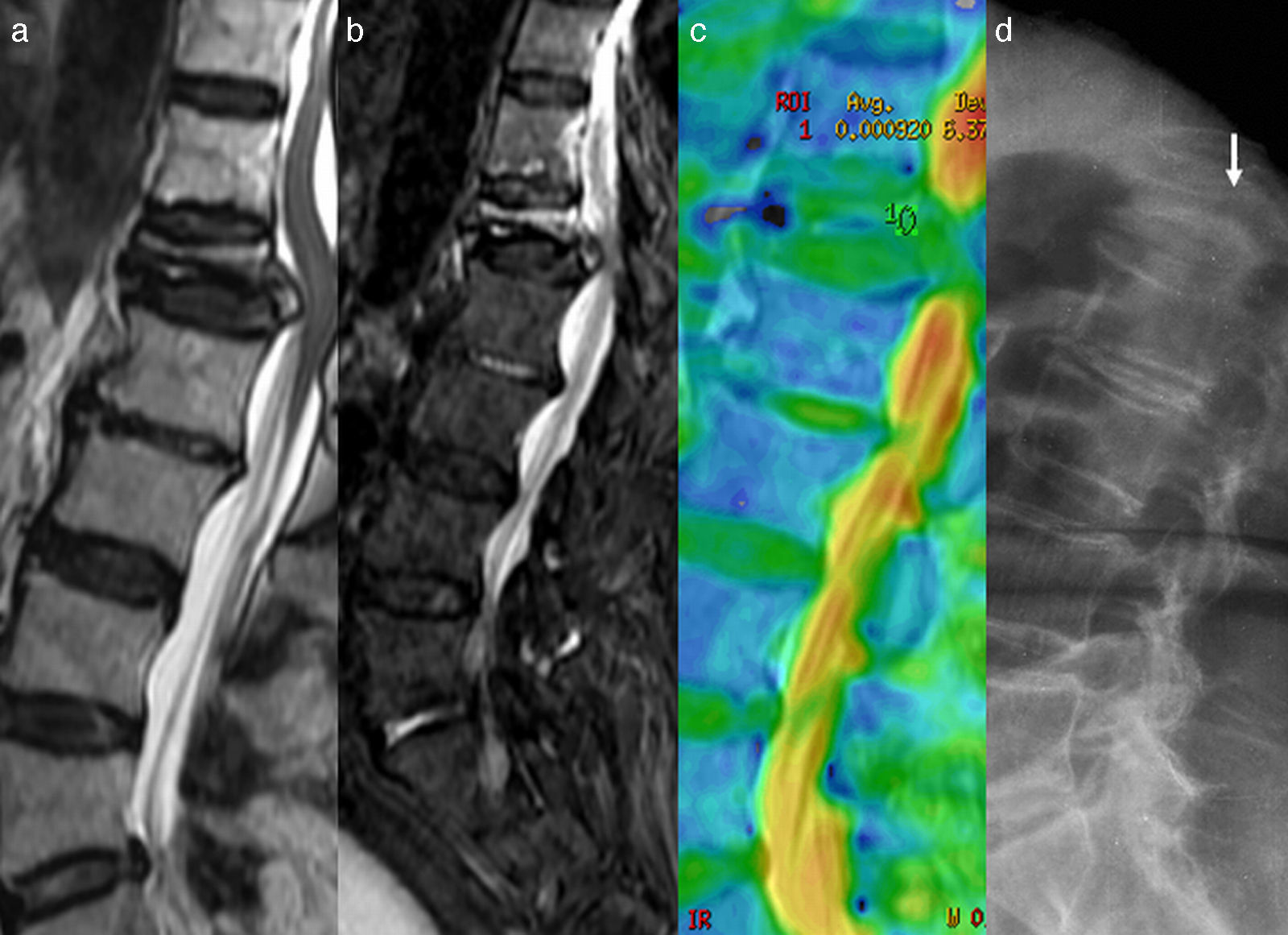
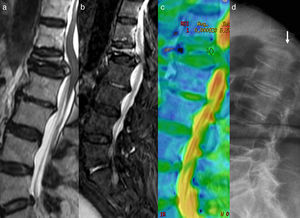
Diferentes trabajos han demostrado que la RM-D permite distinguir las fracturas vertebrales benignas de las fracturas patológicas, realizando solo una inspección cualitativa42. Las fracturas «benignas» son generalmente hipointensas y las fracturas patológicas tumorales son hiperintensas en RM-D con b elevado. En el análisis del valor del ADC debe considerarse el tiempo de evolución de la lesión. Una fractura benigna mostrará un valor ADC elevado en fase aguda en relación con edema vasogénico. Pero si analizamos la fractura en fase subaguda en tiempo superior a 3-5 semanas, el valor del ADC se habrá ido reduciendo y probablemente con cifra<1×10−3 mm2/s, que nos podría sugerir restricción de la difusión. Simplemente se trata de un valor normal en descenso progresivo hasta alcanzar prácticamente el valor 0 del ADC de la médula grasa normal (fig. 8).
Valoración de la temporalidad en el análisis del ADC. a) Imagen sagital en T2 que muestra fractura de L1 con retropulsión del muro posterior. b) Imagen sagital en DWI que muestra aumento de señal por edema del cuerpo vertebral de L1. c) El mapa ADC en color muestra valor 0,9×10−3 mm2/s que podría indicar edema sospechoso de malignidad. d) El estudio radiológico 3 meses antes de la RM muestra la presencia de la fractura, indicativo de que se trata de un edema subagudo. El proceso evolutivo del edema de la médula ósea de la fractura benigna tenderá al valor normal del ADC cercano a 0 en las próximas semanas de realizarse el análisis con DWI. De haberse realizado el análisis del ADC en el momento de la fractura probablemente sería>2×10−3 mm2/s. El lector puede ver esta figura a color en la versión electrónica del artículo.
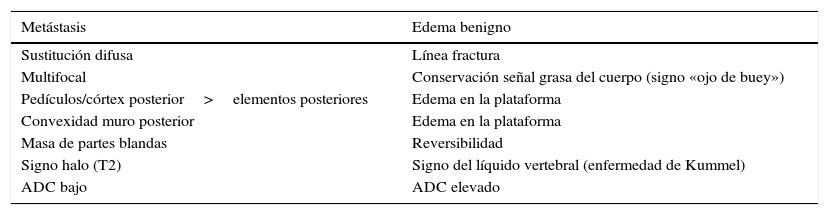
Es preciso utilizar y combinar toda la información morfológica y funcional de las distintas secuencias en RM para una correcta interpretación y diferenciar una lesión metastásica de una fractura benigna. En la tabla 4 se detallan los criterios combinados para un correcto análisis de las lesiones metástasicas. En casos no concluyentes será necesario realizar un control por imagen o la biopsia.
Características diferenciales de proceso metastásico y edema benigno del raquis
| Metástasis | Edema benigno |
|---|---|
| Sustitución difusa | Línea fractura |
| Multifocal | Conservación señal grasa del cuerpo (signo «ojo de buey») |
| Pedículos/córtex posterior>elementos posteriores | Edema en la plataforma |
| Convexidad muro posterior | Edema en la plataforma |
| Masa de partes blandas | Reversibilidad |
| Signo halo (T2) | Signo del líquido vertebral (enfermedad de Kummel) |
| ADC bajo | ADC elevado |
El manejo de las distintas técnicas de imagen para la detección de metástasis óseas estará influenciado por distintos factores: tumor primario, disponibilidad de la técnica, historia clínica y la decisión consensuada en los distintos comités oncológicos43.
Monitorización terapéuticaLa monitorización terapéutica empleando técnicas únicamente morfológicas es ineficaz debido a que precisamente cambios de esclerosis de respuesta al tratamiento no tendrán traducción en RM en las secuencias en T144, al poder mostrar hallazgos similares antes y después del tratamiento (fig. 9). La utilización de criterios RECIST o los de Anderson se han mostrado ineficaces, al no poder medir aspectos fisiopatológicos de respuesta en la imagen morfológica45. Resulta necesaria y eficaz su valoración con secuencias funcionales como la RM de difusión (fig. 9). Un criterio utilizado de respuesta en RM es la presencia de médula grasa en el seno o rodeando la lesión, signo del halo en T15, además de poder utilizar la RM-D46. En el cáncer de próstata, la disminución de los niveles de PSA se corresponde con un aumento de la media del ADC47. La evaluación de la respuesta al tratamiento se puede realizar utilizando un método cualitativo o cuantitativo. El tratamiento eficaz de la patología tumoral en la médula ósea muestra valores ADC aumentados debido al incremento de la difusión del agua secundario a la muerte celular. La médula ósea normal también muestra una atrofia grasa secundaria a la radioterapia, lo que disminuye su señal en RM-D con valores b elevados45.
Varón de 61 con lumbalgia aguda. a) Detección de metástasis lumbar en imagen sagital FSE T1 (flecha blanca) de tumor primario desconocido. b) El estudio de detección del tumor primario y estadificación en imagen coronal de reconstrucción multiplanar con inversión del contraste en escala de grises de difusión de cuerpo entero muestra la detección primaria de neoplasia de próstata (flecha gruesa en a), metástasis óseas del raquis (cabezas de flecha), pelvis derecha (flecha corta) y múltiples adenopatías a nivel retroperitoneal y torácico (flechas largas). c) El control en imagen RM coronal de reconstrucción multiplanar con inversión del contraste en escala de grises en difusión de cuerpo entero a los 4 meses posterior al tratamiento con bloqueo hormonal y radioterapia demuestra ausencia de lesiones, en relación con respuesta completa. d) Imagen sagital FSE T1 en el estudio inicial, mostrando la afectación de D4 y L3 (flechas). e) Imagen sagital en FSE T1 a los 4 meses postratamiento en radioterapia y bloqueo hormonal que muestra morfológicamente estabilidad (flechas), mientras la difusión (c) permite valorar la respuesta completa por ausencia de restricción de la difusión (resolución de las lesiones en b; cabezas de flecha), en correlación con la respuesta clínica de descenso del PSA. El criterio únicamente morfológico hubiera interpretado de forma incorrecta la respuesta terapéutica.
La interpretación de los cambios de señal en la médula ósea después del tratamiento efectivo es complejo por su variabilidad y aspecto en general parcheado46. De esta forma, es imprescindible la integración y el análisis de todas las secuencias en RM, morfológicas y funcionales para una correcta valoración de la médula ósea.
ConclusiónEn el manejo del mieloma múltiple y de las metástasis óseas pueden utilizarse distintas técnicas de imagen. En la actualidad, las técnicas de elección para valorar la infiltración de la médula ósea son la RM, conjuntamente con la RM-D y la PET-TC, por su mejor fiabilidad en la detección de la patología infiltrativa de la médula ósea. Ambas técnicas permiten integrar la información en los distintos procesos patológicos, desde la detección, la estadificación y la monitorización terapéutica. La selección de la técnica en el manejo de la patología infiltrativa ósea dependerá de distintos factores clínico-radiológicos, coste-eficacia y de la propia disponibilidad.
Autoría- 1.
Responsable de la integridad del estudio:
- 2.
Concepción del estudio:
- 3.
Diseño del estudio:
- 4.
Obtención de los datos:
- 5.
Análisis e interpretación de los datos:
- 6.
Tratamiento estadístico:
- 7.
Búsqueda bibliográfica:
- 8.
Redacción del trabajo:
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes:
- 10.
Aprobación de la versión final:
Los autores declaran no tener ningún conflicto de intereses.