Congreso Nacional SERAM Málaga 2022: Informe radiológico: ¿qué y cómo?
Más datosEl informe estructurado radiológico es el principal medio de comunicación entre el clínico y el radiólogo. Su implementación en los tumores abdominales pediátricos más frecuentes (neuroblastoma y nefroblastoma) se ha visto facilitada por el desarrollo de protocolos por parte de las sociedades científicas internacionales de oncología pediátrica. En ellos se promueve el uso de un léxico estandarizado, se establecen consensos en las técnicas y hallazgos de imagen, y se facilita el almacenamiento de datos permitiendo una revisión centralizada de los mismos.
Presentamos el informe estructurado de los 2tumores abdominales pediátricos más frecuentes: neuroblastoma y nefroblastoma.
The structured radiology report is the main means through which radiologists communicate with clinicians. The implementation of structured reports for the most common abdominal tumors in children (neuroblastoma and nephroblastoma) has been made easier by international pediatric oncology societies’ development of protocols that promote the use of standardized terms, establish consensuses about the imaging techniques and findings, and facilitate data storage to enable their centralized review.
We present the structured reports for the two most common abdominal tumors in children: neuroblastoma and nephroblastoma.
La introducción del informe estructurado (IE) radiológico en los tumores pediátricos favorece la comunicación entre el radiólogo y el oncólogo pediátrico, demuestra la calidad del servicio de imagen médica y sitúa al radiólogo pediátrico como consultor especialista.
El nivel máximo de estandarización se logra cuando un IE es usado por toda la sociedad científica. Para ello el formato, el contenido y el léxico empleado deben estar estandarizados, facilitando la revisión y la evaluación de las imágenes por un sistema centralizado de radiólogos y permitiendo el avance en estudios multicéntricos y en ensayos clínicos1–3.
Las sociedades científicas internacionales de Oncología Pediátrica (International Society of Pediatric Oncology [SIOP]; European International Society of Pediatric Oncology for Neuroblastoma [SIOPEN]; Children Oncology Group [COG]; Renal Tumor Study Group of the International Society of Pediatric Oncology [SIOP-RTSG]), entre otras, han elaborado protocolos unificando criterios diagnósticos y terapéuticos, estandarizando técnicas de imagen, definiendo las lesiones y su manejo quirúrgico, facilitando así la implantación de un IE en la mayoría de los tumores pediátricos.
Presentamos el IE de los 2tumores abdominales pediátricos más frecuentes: neuroblastoma y nefroblastoma.
Informe estructurado del neuroblastomaIntroducciónEl neuroblastoma (NB) es el tumor sólido extracraneal más frecuente en niños con una incidencia anual del 7-10%, ocurriendo el 75% en menores de 5 años4,5. Se origina de células de la cresta neural, apareciendo en cualquier punto de la cadena del sistema nervioso simpático desde la base de cráneo hasta la pelvis, además de la médula suprarrenal. La presentación clínica varía en función de su localización, de la presencia de síndromes paraneoplásicos (opsoclono-mioclonos, diarrea por producción de péptido vasoactivo intestinal) o por la afectación metastásica osteomedular presente en el 50% de los casos en el momento del diagnóstico4,6.
La combinación de técnicas de imagen morfológicas y funcionales es necesaria para el diagnóstico, la estadificación y el seguimiento del NB.
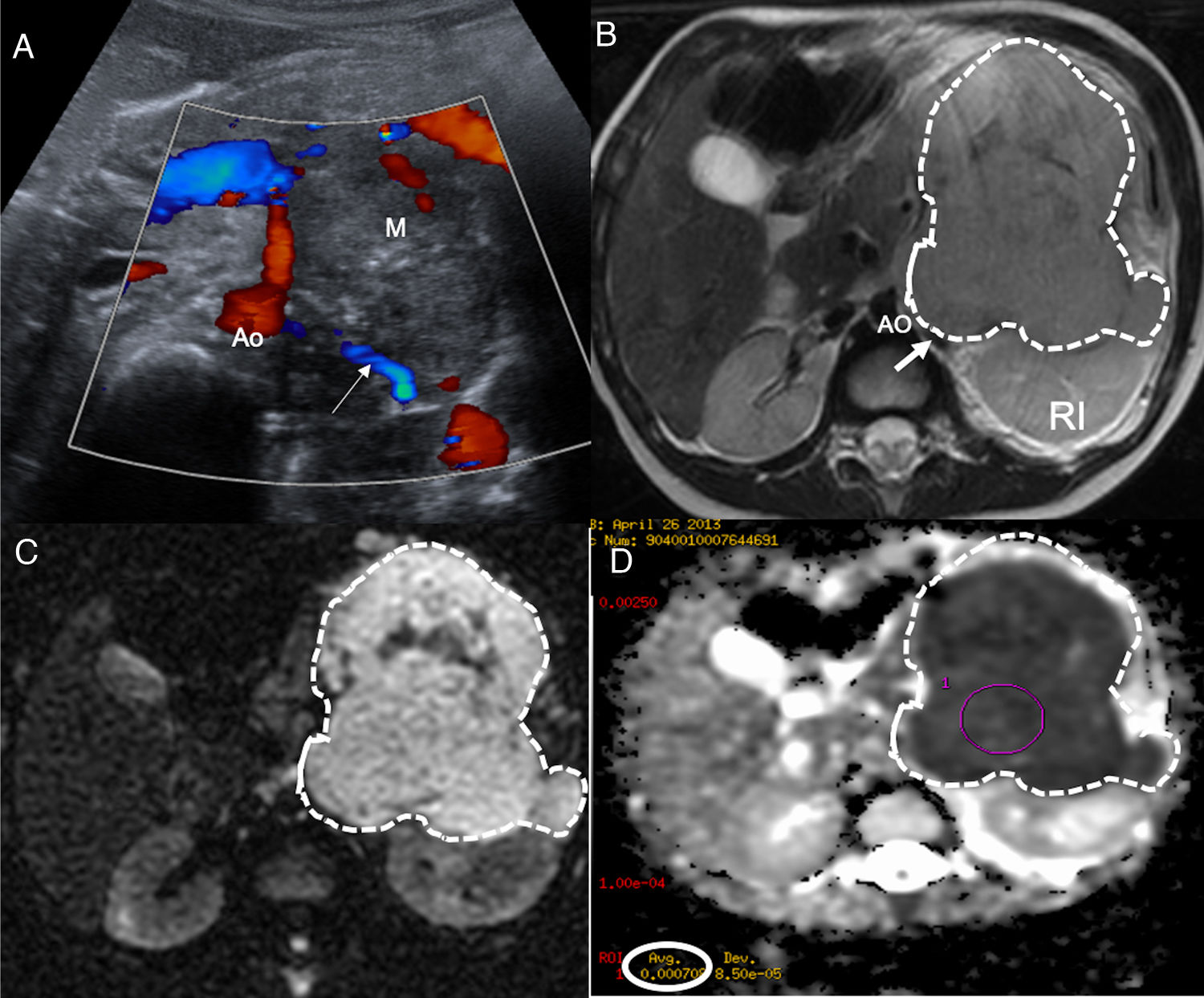
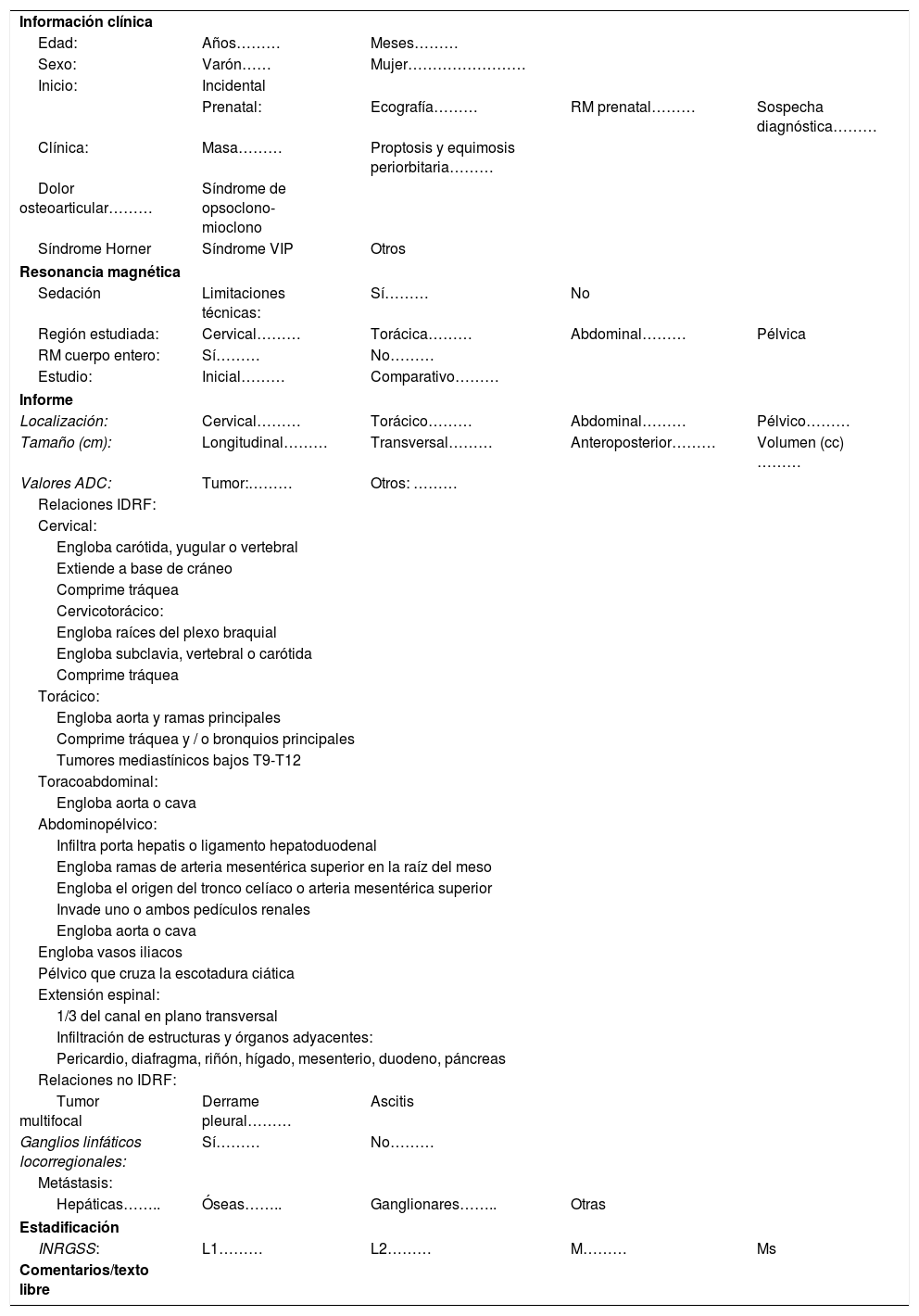
La aproximación inicial por la imagen es mediante una radiografía de tórax cuando la localización es cervicotorácica o torácica y con una ecografía si es abdominal o pélvica. El NB se muestra como una masa sólida, heterogénea con calcificaciones entre el 30-90% de los casos y presencia de vascularización intratumoral en el estudio Doppler4,5. La extensión local se realiza de forma óptima con tomografía computarizada (TC) o resonancia magnética (RM). En caso de disponibilidad, es preferible la RM por su ausencia de radiación ionizante, mejor resolución anatómica, adecuada valoración de la extensión intrarraquídea y de la invasión de la pared costal. El NB se muestra como una lesión hipointensa en T1, hiperintensa en T2 con realce heterogéneo de contraste que engloba o desplaza los vasos. Además de morfológica, la RM es una técnica funcional que permite obtener biomarcadores del tumor mediante los estudios de perfusión y difusión para el diagnóstico, respuesta al tratamiento y pronóstico. Todavía los valores del coeficiente de difusión aparente (ADC) presentan problemas de validación entre equipos de RM y entre hospitales, existiendo solapamientos para el NB, ganglioneuroblastoma y ganglioneuroma, aunque un valor menor de 0,9 orienta a NB4,5,7 (fig. 1).
Paciente de 2 años de edad con vómitos y presencia de una masa abdominal a la exploración física. a) Ecografía abdominal corte transversal mostrando masa retroperitoneal (M) heterogénea con focos puntiformes ecogénicos en el interior en contacto con la aorta (Ao) y con los vasos renales izquierdos (flecha blanca). b) RM abdominal corte transversal potenciada en T2 muestra masa (líneas punteadas) retroperitoneal que desplaza posteriormente el riñón izquierdo (RI) contactando con los vasos renales (flecha blanca) y la aorta (Ao). Tumor estadio L2. c) Estudio de difusión en el plano transversal, b 800. d) Mapa de ADC. Restricción a la difusión de la masa con toma de valores de ADC obteniendo media de 0,7×10-3mm2/s. El resultado de la biopsia del tumor es de neuroblastoma pobre en estroma, pobremente diferenciado.
La extensión a distancia se realiza mediante TC por emisión de fotones (MIBG-SPECT) con metayodobencilguanidina, que tiene una sensibilidad del 90% y una especificidad del 100%. La SIOPEN ha creado un sistema de puntuación semicuantitativo en el que se divide el cuerpo en 12 segmentos asignando grados de absorción de MIBG a cada segmento8. La tomografía por emisión de positrones con fluorodesoxiglucosa (PET-FDG) está indicada cuando la MIBG-SPECT es negativa o existen discrepancias en las pruebas radiológicas, y aunque aún no aparece todavía implementada en las guías, tiene mayor sensibilidad para detectar afectación en médula ósea que la biopsia y la citología que se encuentran limitadas a ambas crestas ilíacas. La RM de cuerpo entero presenta elevada sensibilidad, sin embargo, es menos específica que la MIBG-SPECT, discierne mal entre lesión tratada o no tratada y resulta una exploración larga para un niño4,9.
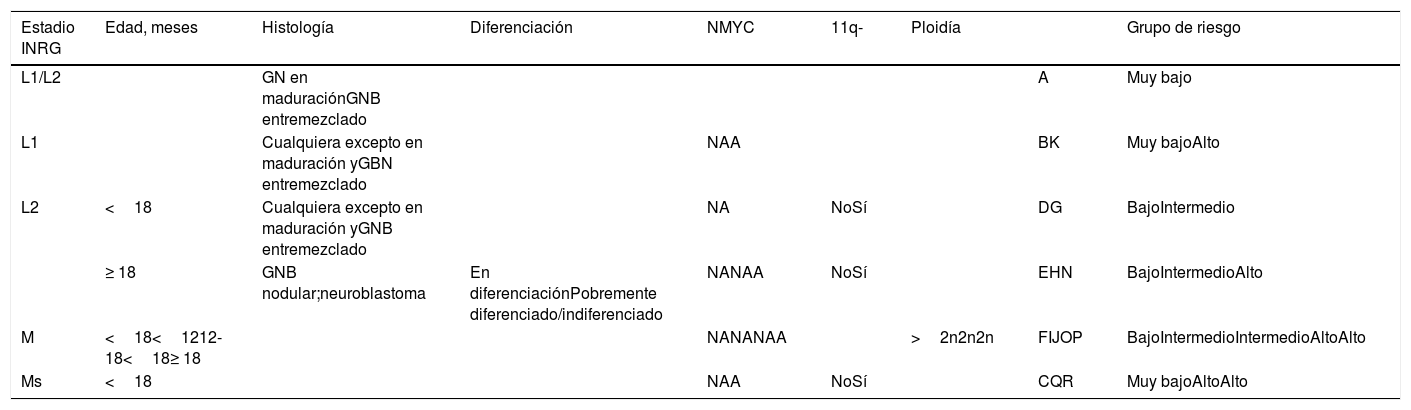
El NB presenta una conducta biológica muy compleja. Ciertos tumores regresan espontáneamente sin terapia, algunos maduran hacia ganglioneuroblastoma o ganglioneuroma y otros, a pesar de un tratamiento intenso y agresivo, tienen un pronóstico infausto. Los factores que se ha visto que están implicados en el pronóstico del NB son: edad, estadio, histología, grado de diferenciación, amplificación o no del protooncogén N-myc, alteración cromosómica segmentaria del 11q y ploidía. La combinación de los mismos determina 4grupos de riesgo (muy bajo, bajo, intermedio y alto) con un protocolo estratificado de tratamiento10 (tabla 1).
Grupos de riesgo International Neuroblastoma Risk Group Staging System (INRGSS)
| Estadio INRG | Edad, meses | Histología | Diferenciación | NMYC | 11q- | Ploidía | Grupo de riesgo | |
|---|---|---|---|---|---|---|---|---|
| L1/L2 | GN en maduraciónGNB entremezclado | A | Muy bajo | |||||
| L1 | Cualquiera excepto en maduración yGBN entremezclado | NAA | BK | Muy bajoAlto | ||||
| L2 | <18 | Cualquiera excepto en maduración yGNB entremezclado | NA | NoSí | DG | BajoIntermedio | ||
| ≥ 18 | GNB nodular;neuroblastoma | En diferenciaciónPobremente diferenciado/indiferenciado | NANAA | NoSí | EHN | BajoIntermedioAlto | ||
| M | <18<1212-18<18≥ 18 | NANANAA | >2n2n2n | FIJOP | BajoIntermedioIntermedioAltoAlto | |||
| Ms | <18 | NAA | NoSí | CQR | Muy bajoAltoAlto |
Supervivencia libre de eventos (a 5 años del diagnóstico) por grupo: muy bajo:> 85%; bajo: 75-85%; intermedio: 50-75%; alto: <50%.
A: amplificado; GN: ganglioneuroma; GNB: ganglioneuroblastoma; INRG: International Neuroblastoma Risk Group; NA: no amplificado;> 2n: hiperdiploide; 2n: diploide.
Fuente: Cohn et al.10.
Uno de estos factores, el estadio, depende desde 2009 de los hallazgos de imagen. Los tumores se clasifican en localizados (L1 y L2) y metastásicos (M y MS)10 (tabla 2). Los localizados son clasificados en L1 o L2 de acuerdo con unos factores de riesgo definidos por imagen (IDRF) vistos con TC o RM que marcan la dificultad de una cirugía completa en el momento del diagnóstico, consiguiendo estadificar el tumor de forma más objetiva. La estandarización de términos para evaluar la relación del tumor con las estructuras vecinas disminuye la variabilidad interobservador: separación (existe un plano de separación, generalmente graso, entre el tumor y estructuras vecinas), compresión (se refiere a la relación del tumor con la vía aérea en caso de NB cervicotorácico/torácico), contacto (ausencia de separación, en relación del tumor con los vasos: para una arteria menos de un 50% de su circunferencia y en una vena persiste la luz aunque esté aplanada), englobado (el tumor rodea una arteria más del 50% de la circunferencia y en una vena la luz no es visible), infiltración (extensión del tumor alterando sus márgenes)11,12 (tabla 3).
Estadios INRG (International Neuroblastoma Risk Group [INRG])
| L1: tumor localizado |
| L2: tumor localizado con uno o más IDRF |
| M: metástasis a distancia. Excepto MS |
| MS: enfermedad metastásica en niños menores de 18 meses, con metástasis en piel, hígado o médula ósea |
L: localizado; M: metastásico; MS: metastásico especial.
Fuente: Monclair et al.11.
Factores de riesgo definidos por imagen (IDRF)
| Tumor ipsolateral extendiéndose a 2 compartimentos contiguos |
| Cuello-tórax, tórax-abdomen, abdomen-pelvis |
| Cuello |
| Engloba carótida, yugular o vertebral |
| Extiende a base de cráneo |
| Comprime tráquea |
| Cérvico-torácico |
| Engloba raíces del plexo braquial |
| Engloba subclavia, vertebral o carótida |
| Comprime tráquea |
| Torácicos |
| Engloba aorta y ramas principales |
| Comprime tráquea o bronquios principales |
| Tumores mediastínicos bajos T9-T12 |
| Toraco-abdominal |
| Engloba aorta o cava |
| Abdominopélvico |
| Infiltra porta hepatis o ligamento hepatoduodenal |
| Engloba ramas de la arteria mesentérica superior en la raíz del meso |
| Engloba el origen del tronco celíaco o la arteria mesentérica superior |
| Invade uno o ambos pedículos renales |
| Engloba aorta o cava |
| Engloba vasos iliacos |
| Pélvico que cruza la escotadura ciática |
| Extensión espinal en cualquier localización |
| 1/3 del canal en plano transversal |
| Infiltra estructuras/órganos adyacentes |
| Pericardio, diafragma, riñón, hígado, mesenterio, duodeno, páncreas |
Fuente: Monclair et al.11.
El seguimiento del NB sigue el consenso elaborado por diferentes grupos oncológicos (SIOPEN, COG, Japan Childreńs Cancer Group, German Pediatric Oncology Hematology) llamado International Neuroblastoma Response Criteria (INRC), del 2017, que determina la respuesta del NB tras la quimioterapia, tras la cirugía y tras las recaídas. Sigue criterios morfológicos (TC o RM) de acuerdo con Response Evaluation Criteria in Solid Tumor (RECIST) y funcionales (MIBG-SPECT o PET-TC) de acuerdo con la puntuación semicuantitativa de SIOPEN, evaluando el tumor primario, las metástasis de partes blandas y óseas y la medula ósea; determinado si existe una respuesta completa, parcial, estable, progresión de enfermedad o enfermedad mínima residual13. Estos grupos de trabajo han introducido un IE quirúrgico (International Neuroblastoma Surgical Report Form) que estandariza todos los procedimientos realizados: biopsia, resección quirúrgica y las complicaciones desarrolladas los 30 días siguientes a la cirugía, incluyendo los conceptos de resección completa, incompleta y resto mínimo residual14.
Informe estructuradoEl IE del NB debe incluir los datos que contribuyen a la estadificación y al manejo del mismo. En el NB se tienen las herramientas de consenso (IDRF) para implementar un IE con impacto tanto a nivel intra como interhospitalario, ya que las diferentes sociedades científicas han establecido un léxico común.
En el Hospital Universitario y Politécnico La Fe de Valencia se ha desarrollado un IE del NB en forma de documento autoejecutable que sigue un formato estándar en lista de chequeo. Contiene los datos demográficos del niño, la información clínica esencial, la técnica utilizada con los datos más relevantes de la exploración, el detalle categorizado de los hallazgos de imagen y una conclusión. Cuenta con desplegables a modo de ayuda donde se muestran los esquemas IDRF de acuerdo con la guía de NB12. Obtiene, de acuerdo con los datos introducidos, el estadio del tumor en el momento del diagnóstico. Permite realizar el seguimiento de imagen morfológica tras la quimioterapia y la cirugía, y en caso de recaídas (tabla 4).
Informe estructurado del neuroblastoma
| Información clínica | ||||
| Edad: | Años……… | Meses……… | ||
| Sexo: | Varón…… | Mujer…………………… | ||
| Inicio: | Incidental | |||
| Prenatal: | Ecografía……… | RM prenatal……… | Sospecha diagnóstica……… | |
| Clínica: | Masa……… | Proptosis y equimosis periorbitaria……… | ||
| Dolor osteoarticular……… | Síndrome de opsoclono-mioclono | |||
| Síndrome Horner | Síndrome VIP | Otros | ||
| Resonancia magnética | ||||
| Sedación | Limitaciones técnicas: | Sí……… | No | |
| Región estudiada: | Cervical……… | Torácica……… | Abdominal……… | Pélvica |
| RM cuerpo entero: | Sí……… | No……… | ||
| Estudio: | Inicial……… | Comparativo……… | ||
| Informe | ||||
| Localización: | Cervical……… | Torácico……… | Abdominal……… | Pélvico……… |
| Tamaño (cm): | Longitudinal……… | Transversal……… | Anteroposterior……… | Volumen (cc) ……… |
| Valores ADC: | Tumor:……… | Otros: ……… | ||
| Relaciones IDRF: | ||||
| Cervical: | ||||
| Engloba carótida, yugular o vertebral | ||||
| Extiende a base de cráneo | ||||
| Comprime tráquea | ||||
| Cervicotorácico: | ||||
| Engloba raíces del plexo braquial | ||||
| Engloba subclavia, vertebral o carótida | ||||
| Comprime tráquea | ||||
| Torácico: | ||||
| Engloba aorta y ramas principales | ||||
| Comprime tráquea y / o bronquios principales | ||||
| Tumores mediastínicos bajos T9-T12 | ||||
| Toracoabdominal: | ||||
| Engloba aorta o cava | ||||
| Abdominopélvico: | ||||
| Infiltra porta hepatis o ligamento hepatoduodenal | ||||
| Engloba ramas de arteria mesentérica superior en la raíz del meso | ||||
| Engloba el origen del tronco celíaco o arteria mesentérica superior | ||||
| Invade uno o ambos pedículos renales | ||||
| Engloba aorta o cava | ||||
| Engloba vasos iliacos | ||||
| Pélvico que cruza la escotadura ciática | ||||
| Extensión espinal: | ||||
| 1/3 del canal en plano transversal | ||||
| Infiltración de estructuras y órganos adyacentes: | ||||
| Pericardio, diafragma, riñón, hígado, mesenterio, duodeno, páncreas | ||||
| Relaciones no IDRF: | ||||
| Tumor multifocal | Derrame pleural……… | Ascitis | ||
| Ganglios linfáticos locorregionales: | Sí……… | No……… | ||
| Metástasis: | ||||
| Hepáticas…….. | Óseas…….. | Ganglionares…….. | Otras | |
| Estadificación | ||||
| INRGSS: | L1……… | L2……… | M……… | Ms |
| Comentarios/texto libre | ||||
El futuro está en la elaboración de un IE del NB completo, que aúne los hallazgos de la TC o la RM con los de la medicina nuclear (MIBG-SPECT/PET-TC) permitiendo la evaluación de la extensión local, la extensión a distancia y la respuesta al tratamiento de forma conjunta, tal como se realiza en la práctica clínica. De este modo, se integrará toda la información de la imagen del NB agilizando su seguimiento en los comités de oncología y permitiendo obtener datos pronósticos desde los parámetros funcionales.
Informe estructurado del nefroblastomaIntroducciónLos tumores renales son uno de los tumores sólidos extracraneales más frecuentes en niños y el 6-7% de todos los tumores en la edad pediátrica15. El nefroblastoma o tumor de Wilms (TW) es el tumor renal maligno más frecuente en niños (90%)16. El diagnóstico diferencial debe establecerse con otros tumores renales como el tumor rabdoide renal, el sarcoma renal de células claras y el carcinoma renal, y con otras masas retroperitoneales como el NB. Además, junto con el TW pueden coexistir remanentes de tejido renal embrionario persistente (restos nefrogénicos [RN]/nefroblastomatosis), precursores de malignidad17.
El 95% de los TW ocurren en niños menores de 10 años y la mayoría de ellos durante los primeros 5 años de vida, con un pico de incidencia en los 3,5 años18. La mayoría de los niños presentan un tumor único al diagnóstico, pero pueden presentar tumores sincrónicos o afección bilateral. Generalmente, se trata de una enfermedad esporádica pero el 10% de casos pueden tener predisposición genética como los pacientes afectados de síndrome de Beckwith-Wiedemann, Denys-Drash o WAGR (Wilms, aniridia, anomalías genitourinarias y retraso mental). Cuando existe predisposición genética, la edad de presentación suele ser más temprana y con mayor frecuencia los tumores son sincrónicos, bilaterales o multifocales18. En estos casos, con el fin de reducir la alta incidencia de enfermedad renal terminal, la cirugía conservadora de nefronas debe ser una prioridad. La clasificación histológica del COG clasifica los TW en 3 categorías principales basadas en el grado de anaplasia: histología favorable (no anaplasia), anaplasia focal y anaplasia difusa. El 75% de los TW presentan histología favorable. Además, el TW se asocia con diversas mutaciones genéticas, como son WT1, p53, FWT1, FWT2 y mutaciones en el loci 11p15.5. También se han descrito marcadores moleculares con implicaciones pronósticas como, por ejemplo, la pérdida de heterogeneidad 1p y 16q19.
Las técnicas de imagen son imprescindibles para realizar un correcto diagnóstico diferencial, establecer un diagnóstico de presunción, orientar un plan de abordaje inicial apropiado para cada paciente y realizar un correcto seguimiento. La primera técnica de imagen a realizar ante la sospecha de una masa renal es la ecografía abdominal. Se realizará una valoración completa de la lesión y de la extensión locorregional. También se valorará minuciosamente el riñón contralateral y el resto del abdomen. El siguiente paso es confirmar la localización intrarrenal en casos complejos y realizar una correcta estadificación locorregional y a distancia mediante TC o RM. No existen características específicas de las masas renales en niños que se beneficien de la realización de una TC multifásica, por lo que generalmente se realizará una TC abdominal con contraste por vía intravenosa en fase venosa, excepto en el estudio prequirúrgico de un paciente complejo donde se realizará además una fase arterial o en el estudio de trombosis venosas tumorales dudosas, donde será de utilidad una fase venosa tardía. Se ha descrito una capacidad de estadificación locorregional de los tumores renales similar por TC y RM20. En niños, como se ha mencionado anteriormente, siempre que sea posible debe realizarse una RM ya que no utiliza radiaciones ionizantes. Además, la RM ofrece herramientas de imagen funcionales como valores del ADC que se han demostrado útiles en la valoración de los tumores renales y que se pueden relacionar con tipos histológicos agresivos y factores pronósticos desfavorables21–24. El 20% de los pacientes presentará metástasis al diagnóstico, siendo el parénquima pulmonar la localización más frecuente (80%), por lo que deberá realizarse una TC torácica con o sin contraste por vía intravenosa. La segunda localización más frecuente de metástasis es el hígado siendo el hueso, una localización posible pero poco frecuente21.
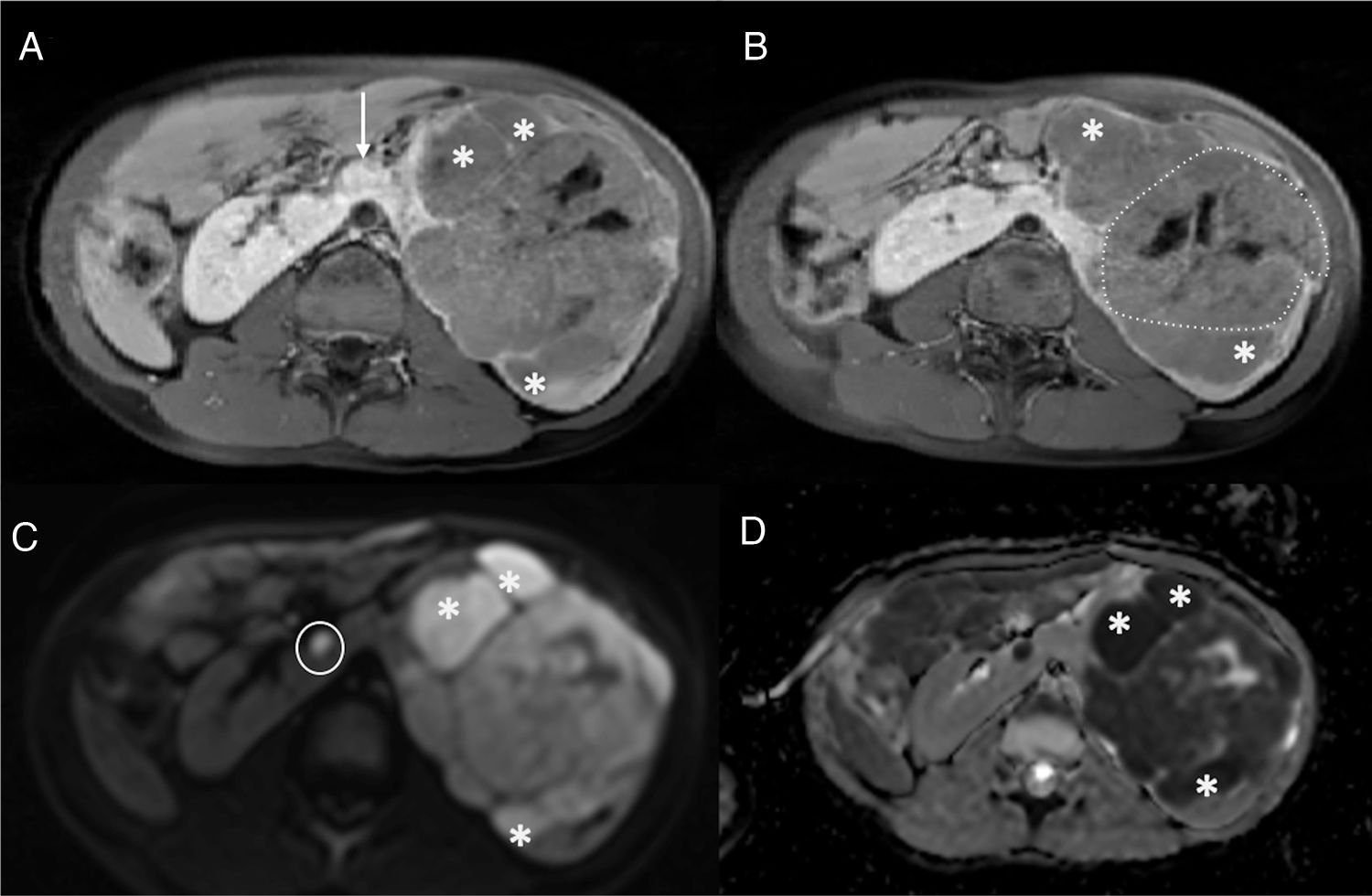
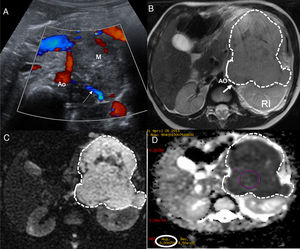
El TW suele presentarse como una masa sólida intrarrenal bien encapsulada. Los tumores pequeños suelen ser homogéneos, sin embargo, este hallazgo depende de la cantidad de necrosis, hemorragia y áreas quísticas por lo que las grandes masas pueden ser muy heterogéneas. El TW es generalmente hipointenso en T1 e hiperintenso en T2, presenta valores bajos en el estudio de difusión y realza tras la administración del contraste. La extensión intravascular mediante un trombo tumoral se identifica en el 10% de los casos de TW18. Se visualiza mediante el estudio Doppler de la ecografía, mediante TC con contraste por vía intravenosa o en secuencias potenciadas en T2, secuencias difusión y estudio poscontraste de la RM20,23. La presencia de restos nefrogénicos/nefroblastomatosis o un tumor renal bilateral son características específicas para el diagnóstico de un TW21. Los restos nefrogénicos (lesiones nodulares) y la nefroblastomatosis (afectación renal difusa) se localizan en la región subcapsular, aunque su localización exacta depende de si son restos intralobales o perilobares. Se clasifican histológicamente en inactivos, esclerosos, hiperplásicos o neoplásicos y sus características varían ligeramente en cada uno de ellos. Generalmente, suelen ser homogéneos, hipointensos en T1 y no realzan o realzan de manera escasa en las secuencias ponderadas en T1 con supresión grasa tras la administración del contraste. Aunque los nefroblastomas de pequeño tamaño pueden confundirse con restos nefrogénicos, la RM se describe como una técnica útil en la discriminación entre la nefroblastomatosis y los tumores malignos21 (fig. 2).
Paciente de 5 años de edad afectada de síndrome de Beckwith-Wiedemann. Un control ecográfico realizado 6 meses no mostró alteraciones. La RM abdominal detecta un nefroblastoma izquierdo y focos de RN/nefroblastomatosis bilaterales en un riñón en herradura. a y b) Secuencias ponderadas en T1 con supresión grasa y contraste intravenoso en el plano axial sobre los riñones. Se identifica un riñón en herradura con unión de riñones por delante de la aorta abdominal (flecha en a) y múltiples lesiones confluentes en el hemirriñón izquierdo (asteriscos en a y b) compatibles con RN/nefroblastomatosis. Destaca una de las lesiones de mayor tamaño, con características discretamente distintas, más heterogénea (línea punteada en b) compatible con nefroblastoma. c) Estudio de difusión en el plano axial, b 1.000. d) Mapa de ADC. Restricción a la difusión de las múltiples lesiones del hemirriñón izquierdo (asteriscos en c y d) y restricción ligeramente distinta, menor, de la lesión de mayor tamaño. Destaca la presencia de un foco milimétrico en el hemirriñón contralateral (círculo en c) con restricción a la difusión.
El Comité Americano de Tumores Renales del COG considera como tratamiento de elección inicial la resección quirúrgica del tumor renal, mientras que la quimioterapia adyuvante se realizará con base en la clasificación histológica posquirúrgica. En cambio, el Grupo Europeo de Tumores Renales de la SIOP (SIO-PRTSG) prefiere la quimioterapia prequirúrgica seguida de la cirugía, evitando, con algunas excepciones, los procedimientos invasivos para determinar la histología. Las tasas de supervivencia son las mismas en ambos protocolos25.
Cada uno de los tumores que se incluyen en el diagnóstico diferencial del TW requiere un abordaje terapéutico diferente. Una guía estructurada en el informe radiológico con énfasis en los hallazgos radiológicos claves es imprescindible para una correcta aproximación diagnóstica. Para ello, el SIOP-RTSG describe en el protocolo UMBRELLA26 las características necesarias en las técnicas de imagen (protocolos de TC y secuencias de RM) y los hallazgos claves a detallar en el informe (tabla 5).
Informe estructurado del nefroblastoma basado en el protocolo UMBRELLA del SIOP-RTSG
| Información clínica |
| Edad, sexo y datos clínicos (hallazgo incidental, masa abdominal, hematuria, hipertensión arterial, dolor, fiebre u otros) |
| Técnica de RM O TC abdominal |
| Fecha del estudio |
| Sedación |
| Estudio inicial, prequirúrgico o de seguimiento. |
| Protocolo utilizado en la TC con la región estudiada, el grosor de corte, la administración o no de contraste intravenoso y la fase de adquisición, así como la dosis de radiación recibida si es posible |
| Protocolo utilizado en la RM con la región estudiada, las secuencias y los planos realizados y la administración o no de contraste intravenoso |
| Informe |
| Localización, número, medidas del tumor/tumores (tamaño L×T×AP y volumen) y valores de ADC |
| Características del tumor: sólido, necro-hemorrágico, quístico |
| Estado del riñón contralateral/afección bilateral |
| Lesiones renales no neoplásicas |
| Extensión del tumor: cruza la línea media, dilata el sistema colector, afecta el hilio, presenta trombosis venosa tumoral |
| Presencia y localización de adenopatías patológicas |
| Lesiones hepáticas metastásicas |
| Lesiones sólidas intraperitoneales |
| Líquido libre intraabdominal: localización intraperitoneal o retroperitoneal y características (hemorrágico o no) |
| Otros hallazgos |
| Conclusión |
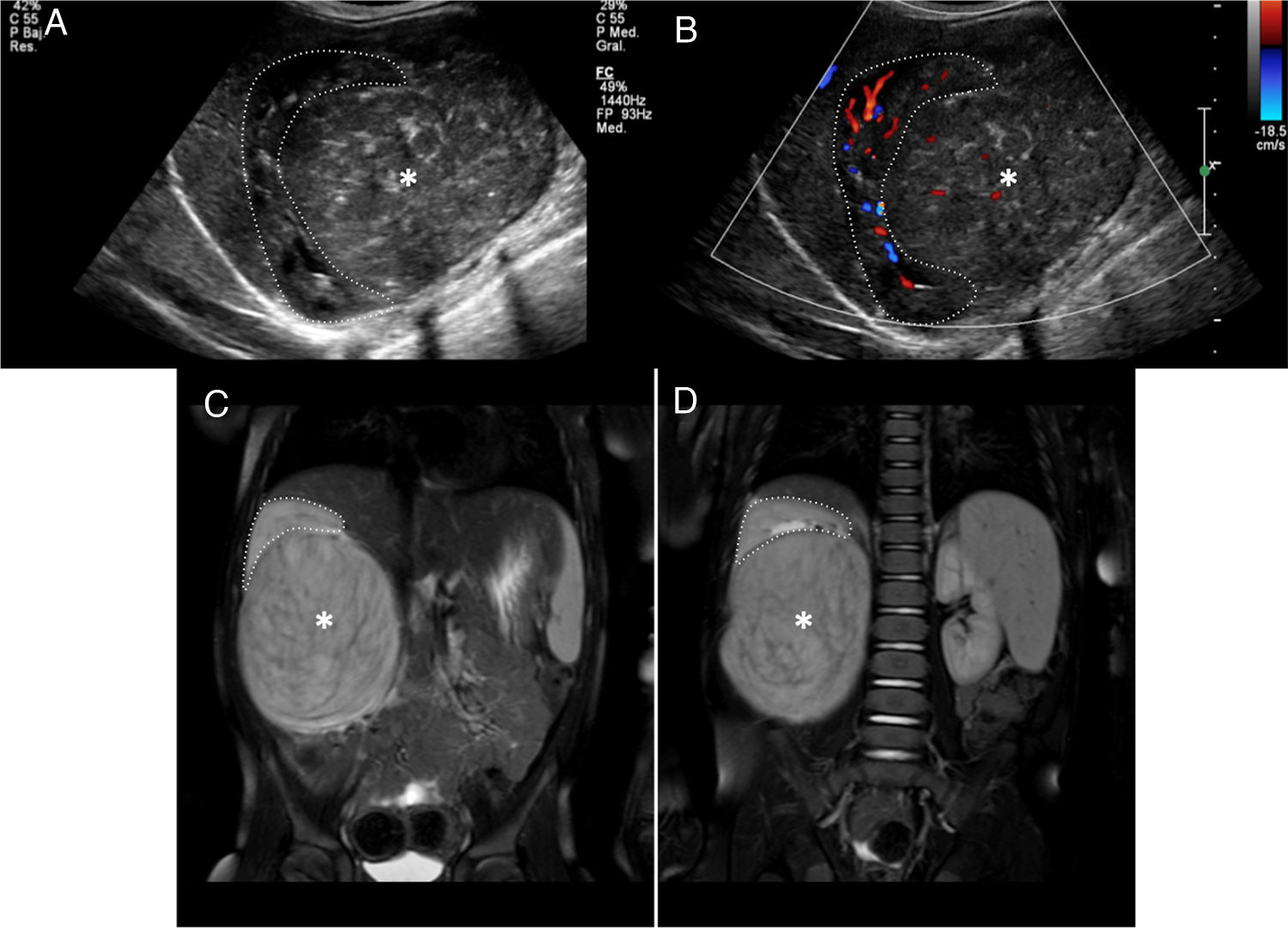
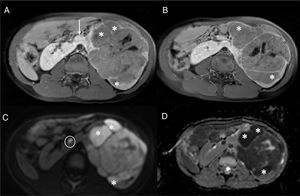
En el estudio inicial de la masa abdominal debe confirmarse la localización intrarrenal. La diferenciación entre lesión intrarrenal o extrarrenal no siempre es fácil. Las masas intrarrenales como el TW distorsionan o «abren» el parénquima renal (signo de «cangrejo») (fig. 3), mientras que las masas extrarrenales como el NB desplazan el riñón. Las características por imagen que deben valorarse son la homogeneidad, la densidad (TC) o la intensidad (RM) de la lesión para valorar áreas quísticas, de necrosis o de hemorragia, la definición de sus márgenes (seudocápsula) y la presencia de calcificaciones (más evidentes por ecografía y TC). En cuanto a la localización y la extensión local, son claves la valoración del hilio renal, la invasión de la vía urinaria, la extensión extrarrenal y la valoración de la extensión intravascular a la vena renal y la vena cava inferior (VCI). Los hallazgos que pueden indicarnos una rotura capsular son la ascitis en el fondo de saco de Douglas o el espacio recto-vesical, el líquido retroperitoneal y la trabeculación de la grasa alrededor del tumor. Discreta cantidad de líquido intraabdominal no siempre indica rotura capsular puesto que puede ser reactivo al efecto compresivo de la masa sobre la VCI. La hemorragia intralesional o subcapsular tampoco es indicativo de rotura18. Aunque siempre se realizará un estudio ganglionar en la cirugía, es relevante localizar y describir los ganglios linfáticos sospechosos (eje menor ≥ 10mm). Tampoco debemos olvidarnos del estudio de lesiones sincrónicas en el mismo riñón y en el riñón contralateral. El estudio mediante difusión es especialmente útil en la valoración del TW y de las lesiones precursoras de malignidad (RN/nefroblastomatosis)23–27. En el estudio de extensión valoraremos los nódulos pulmonares mayores de 3mm mediante TC, las lesiones hepáticas mediante TC o RM y las lesiones óseas (identificadas con mayor facilidad mediante secuencias de RM poscontraste)21.
Paciente de 2 años de edad asintomático con hipertensión arterial en la revisión pediátrica. a y b) La ecografía abdominal en el plano sagital sobre el riñón derecho confirma, tanto en el estudio morfológico (a) como en el estudio Doppler (b), una masa renal derecha bien delimitada y heterogénea que depende del tercio inferior del riñón derecho (asteriscos). Las imágenes puntiformes ecogénicas intralesionales podrían corresponder a pequeñas calcificaciones. El diagnóstico diferencial debería incluir el neuroblastoma, pero la relación con el parénquima renal (distorsionado y «abierto») (líneas punteadas) confirma la lesión intrarrenal y sugiere como primera opción un nefroblastoma. c y d) Secuencias RM ponderadas en T2 con supresión grasa en el plano coronal sobre los riñones. Se confirma la presencia de una masa intrarrenal derecha (asteriscos) condicionando el signo del «cangrejo» sobre el riñón derecho (línea punteada).
El desarrollo de protocolos por parte de las sociedades científicas internacionales ha favorecido la implementación del IE en el NB y el TW. En el IE se incluyen datos clínicos, parámetros de las técnicas de imagen empleadas y los hallazgos por imagen. El IE facilita la revisión y la evaluación de las imágenes por un sistema centralizado de radiólogos permitiendo obtener datos homogéneos para la evaluación de los diferentes estudios multicéntricos y ensayos clínicos. El IE debe estar en constante evolución e incluir progresivamente además de los hallazgos de imagen los biomarcadores obtenidos a partir de los mismos.
Autoría- 1.
Responsable de la integridad del trabajo: CSN y ACM.
- 2.
Concepción del trabajo: CSN y ACM.
- 3.
Diseño del estudio: CSN y ACM.
- 4.
Obtención de los datos: no aplica.
- 5.
Análisis e interpretación de los datos: no aplica.
- 6.
Tratamiento estadístico: no aplica.
- 7.
Búsqueda bibliográfica: CSN y ACM
- 8.
Redacción del trabajo: CSN y ACM
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: CSN y ACM.
- 10.
Aprobación de la versión final: CSN y ACM
Los autores declaran no tener ningún conflicto de intereses.