Amplia disponibilidad, rapidez, seguridad y precisión diagnóstica hacen de la tomografía computarizada multidetector la herramienta diagnóstica de primera línea en el estudio de la hemorragia digestiva baja aguda. Su empleo tras la estabilización inicial permite identificar la presencia de sangrado activo, su origen y posible etiología, incluso cuando la hemorragia ha cesado, aportando información clave para seleccionar la alternativa terapéutica idónea: colonoscopia, embolización, cirugía o seguimiento clínico. Orienta la intervención, quirúrgica o intravascular, minimizando tiempos, riesgos, dosis de radiación y de constraste, y evita resecciones «ciegas», con mayor morbimortalidad. La presencia activa del radiólogo en Urgencias, si bien asocia algunos inconvenientes horarios, lo sitúa en una posición de privilegio en relación con otras técnicas y profesionales implicados en el manejo de la hemorragia digestiva baja aguda.
The wide availability, speed, safety, and diagnostic accuracy of multidetector computed tomography (MDCT) make it the first-line diagnostic tool in the study of acute bleeding of the lower digestive tract. The use of MDCT after the initial stabilization of the patient makes it possible to identify active bleeding and to determine its origin and possible cause, even when bleeding has stopped. MDCT provides information that is key to selecting the most appropriate treatment option: colonoscopy, embolization, surgery, or clinical follow-up. MDCT orients the surgical or endovascular intervention, minimizing the time, risks, and doses of radiation and of contrast agents involved in the intervention and avoiding “blind” resections associated with greater morbimortality. Although the active presence of radiologists in the Emergency Department involves some disadvantages in scheduling, it also places radiologists in a privileged position in their relations with other techniques and professionals involved in the management of acute lower digestive tract bleeding.
La hemorragia digestiva (HD) aguda constituye una situación urgente, que puede devenir crítica, precisando tratamiento inmediato1. Requiere un enfoque clínico multidisciplinar, donde el radiólogo, en sus vertientes diagnóstica e intervencionista, juega un papel clave1–3. El origen de la hemorragia, proximal o distal al ligamento de Treitz, delimita dos entidades diferenciadas en cuanto a su epidemiología, manejo clínico y pronóstico4, cuya tipificación no siempre es factible clínicamente. La identificación del punto de sangrado y su etiología constituyen objetivos primarios en el diagnóstico de la HD, siendo clásicamente la endoscopia la técnica de elección, por asociar elevado rendimiento diagnóstico y posibilidad de hemostasia local. Este hecho, indiscutible en la HD alta, es controvertido en la HD baja aguda, donde la colonoscopia precoz mejora el control de la hemorragia, disminuye la tasa de resangrado y reduce la estancia hospitalaria, pero su realización inmediata presenta importantes limitaciones, tanto de tipo logístico como técnico, en relación con la disponibilidad de personal, necesidad de preparación intestinal, infrecuencia de estigmas hemorrágicos en el colon, carácter intermitente de la HD baja o posibilidad de origen extracolónico, entre otras5. Además, aproximadamente la mitad de las HD bajas provienen de lesiones no tratables endoscópicamente (por ejemplo, colitis)5. Una preparación intestinal adecuada suele llevar 4-6 horas, y el término «colonoscopia urgente» suele incluir aquellas realizadas en las 12 primeras horas tras la admisión5. Acortar el tiempo implica empeorar la preparación, con hasta un 30-40% de estudios negativos o no diagnósticos, en pacientes cuya situación hemodinámica puede hacer inasumible la espera o directamente inviable la exploración5–10. En este grupo, la angiografía diagnóstica ha sido la única opción para orientar la cirugía, identificando el punto de sangrado, con el fin de minimizar las resecciones quirúrgicas «ciegas», más extensas y con mayor morbimortalidad y probabilidad de error, que las selectivas1,5. La angiografía permite aplicar técnicas de hemostasia intravascular, pero es invasiva, rara vez identifica etiología y requiere la presencia de sangrado activo por encima de 0,5ml/min, lo que limita su aplicabilidad1,2,5. Como procedimiento diagnóstico es laborioso, pues para alcanzar niveles de sensibilidad aceptable requiere panangiografía y posterior cateterización superselectiva; por ello, la tendencia actual es a limitarla a la terapia intravascular, en los casos con sangrado grave2,11. Al igual que la endoscopia, está disponible únicamente en los grandes centros especializados, y no siempre de forma inmediata7,12,13. Otras técnicas diagnósticas habituales en la HD crónica (gammagrafía, videocápsula, enteroscopia o estudios radiológicos baritados) tienen una limitada aplicabilidad en el ámbito urgente por razones de accesibilidad, inmediatez en la respuesta o precisión diagnóstica, etiológica y topográfica14. La rapidez de los equipos de tomografía computarizada multidetector (TCMD) permite mantener la concentración intravascular del medio de contraste durante el estudio, y su resolución submilimétrica e isotrópica, junto con las mejoras en el posprocesado de imágenes, permiten la visualización de alteraciones vasculares sutiles7, con rendimiento diagnóstico igual o superior a la angiografía convencional, en el estudio de la HD aguda7,15,16. Creciente disponibilidad en Urgencias, precisión diagnóstica, rapidez, carácter no invasivo y hallazgos reproducibles, han llevado a proponer a la TCMD como herramienta de primera fila en el diagnóstico de la HD grave.
Contexto clínicoLa incidencia anual de la HD baja aguda grave es de 20-25 episodios/100.000 habitantes, aproximadamente uno de cada cuatro episodios relevantes de HD y el 1% de los ingresos hospitalarios urgentes4,5,9,17. Un 80% de HD baja aguda cesan espontáneamente, pero el 25% recurrirá1. Su mortalidad global no suele superar el 5%, aunque aumenta con la edad y la presencia de comorbilidad, especialmente en casos de sangrado persistente o recidivante con repercusión hemodinámica1,4,5,13,17. El origen de la HD baja aguda suele situarse en el colon y recto, pero entre un 10-25% de casos tienen su origen en tramos proximales9, incluso altos, con tendencia actual a diferenciar un tercer grupo («HD media»), procedente del intestino delgado4. La HD baja aguda habitualmente se controla con tratamiento conservador (reposo, sedación, reposición de volemia/transfusiones) y aunque rara vez necesita cirugía, con frecuencia requiere cuidados intensivos. Es difícil predecir clínicamente cuándo un episodio va a ser o no autolimitado, es decir, subsidiario de observación clínica o de medidas agresivas de hemostasia. Estabilidad hemodinámica, cuantía del sangrado y presencia de comorbilidad son los parámetros pronósticos incluidos en las escalas de riesgo de la HD grave y marcan las prioridades diagnósticas1,5,17. Se define el sangrado masivo como aquel que necesita 4 unidades de sangre diarias para mantener las constantes vitales9. La HD baja incrementa su incidencia con la edad, con un factor 1:200, entre los 20 y 80 años4, pudiendo ésta orientar su posible etiología: divertículo de Meckel, patología inflamatoria y pólipos en adolescentes y jóvenes; divertículos, patología inflamatoria y neoplasias en adultos hasta 60 años; y divertículos, angiodisplasias y cáncer colorrectal, por encima de esa edad9.
Evolución históricaLa efectividad de la tomografía computarizada (TC) en el estudio de la patología vascular y la hemorragia ha ido pareja con el desarrollo tecnológico y existen hoy múltiples estudios publicados que encuentran una buena correlación entre los hallazgos de la TC y la endoscopia, la angiografía y la cirugía en el estudio de pacientes con HD baja3,5–8,12–15,18–25,8,26–29. En uno de los primeros, realizado por Ettore et al18, con un equipo monocorte, inyectan medio de contraste intraaórtico y consideran resultado positivo su identificación intraluminal, con buena correlación con la angiografía convencional. Con equipos de dos detectores, empleando agua como medio de contraste oral y la angiografía como estándar de referencia, Junquera et al19 visualizan 90% de angiodisplasias, pero han de limitar la exploración al colon derecho. Con los primeros estudios multifásicos comienza a identificarse, además de la lesión responsable o indicios de hemorragia reciente, la extravasación de medio de contraste como signo directo de sangrado activo, si bien será la llegada de la tecnología multidetector la que permitirá explorar el abdomen completo e investigar sistemáticamente la presencia de sangrado. Ernst et al20 evalúan, además de la extravasación del medio de contraste, la presencia de otros signos orientadores de patología hemorrágica como engrosamiento mural, pólipos o realce parietal anómalo, con buena correlación para la localización de la fuente de sangrado. En modelos animales la TC helicoidal identificó hemorragia colónica activa con flujo a partir de 0,3ml/min, inferior al umbral de la angiografía convencional15. Tew et al6 estudian 14 pacientes mediante TC de 4 filas de detectores, administrando medio de contraste intravenoso y con adquisición en fase arterial. Diagnostican HD en presencia de material intraluminal hiperdenso (media: de 175 UH), con excelente correlación con angiografía y/o cirugía, sin falsos positivos o negativos. Yoon et al21, estudian 26 pacientes consecutivos con HD baja grave, obteniendo sensibilidad de 90,9% y especificidad de 99% en la detección y localización del sangrado. El aumento progresivo del número de filas de detectores mejora la rapidez del estudio, la calidad de sus imágenes y su cobertura anatómica, permitiendo los equipos de 64 coronas la exploración de todo el abdomen con vóxel isotrópico submilimétrico. El perfeccionamiento paralelo de las técnicas de posprocesado de imágenes incrementa la precisión diagnóstica13,22 y mejora la identificación de sangrado activo y anomalías vasculares sutiles o el reconocimiento de la dependencia vascular12. En general, los estudios son retrospectivos y con un número de casos limitado, pero apuntan hacia la posibilidad real de la técnica para identificar el punto de sangrado y, en muchos casos, su etiología22. Revisiones y metaanálisis de los estudios publicados encuentran correlación positiva de 85% comparando los resultados de la angio-TCMD con los de la cirugía y colonoscopia con preparación, y del 72% comparando con la angiografía convencional23,24. De forma similar, se han sintetizado las cifras de sensibilidad (86%) y especificidad (95%) de la angio-TCMD en la detección de HD24,25. En este contexto, comienza a replantearse el papel de la TCMD en el algoritmo diagnóstico de la HD aguda, especialmente de origen bajo, proponiéndose la angio-TCMD cuando la colonoscopia no es diagnóstica23 o, como alternativa, en las hemorragias masivas y graves, donde ésta no es factible de forma inmediata6,21.
TécnicaEl diagnóstico de HD aguda se establece tras la identificación de material hiperatenuante extravasado en la luz intestinal. Suele adoptar morfología lineal, en jet, espiral o de nube, o bien ocupar toda la luz intestinal3,8 (fig. 1). Mientras algunos autores aplican umbrales de atenuación luminal (90 UH) para el diagnóstico de HD14,21, otros prefieren la comparación secuencial de las diferentes fases del estudio3, en busca de pequeñas opacidades lineales u otros signos sutiles. En general, la presencia en la angio-TC de material hiperatenuante intraluminal, no evidente en el estudio precontraste, es diagnóstica de HD aguda3 (fig. 2). Para obtener unos resultados óptimos, con sensibilidad igual o superior a la angiografía convencional en la detección de sangrado activo8, se requiere una adecuada selección de pacientes y una técnica meticulosa. Debido al carácter intermitente de la HD el estudio debe realizarse preferiblemente cuando existen indicios clínicos de hemorragia, asumiendo que un hallazgo verdadero positivo requiere sangrado activo en el momento mismo en que se inyecta el medio de contraste. Se emplean como criterios de selección: 1) la presencia de inestabilidad hemodinámica definida por: presión sistólica < 90mmHg y taquicardia > 100 lpm, y 2) requerimientos transfusionales superiores a 4 unidades/24h23,24. Otro objetivo esencial es identificar la causa del sangrado, que permitirá establecer el tratamiento definitivo, incluso orientar sobre el posible origen de la hemorragia cuando esta ha cesado. En ausencia de extravasado intraluminal inequívoco, se requiere cautela a la hora de señalar como responsables del sangrado a algunas lesiones digestivas potencialmente hemorrágicas pero muy prevalentes, como divertículos o hemorroides9,20. La angio-TCMD aporta un mapa vascular de gran utilidad en la planificación angiográfica/quirúrgica, dada la variabilidad anatómica de la vascularización gastrointestinal, evita la colonoscopia urgente cuando el sangrado ha cesado o procede de tramos altos, y la orienta en el resto3.
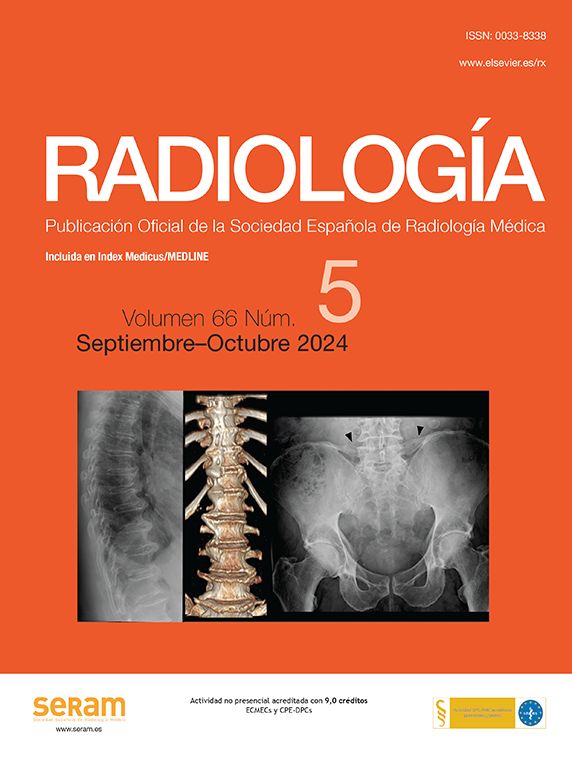
Úlcera rectal. Mujer de 33 años VIH positivo con rectorragia profusa e inestabilidad hemodinámica en tratamiento actual. Tomografía computarizada multidetector con cortes axiales de la pelvis sin contraste (A) que muestra luz rectal distendida e hiperdensa. Imagen de jet en fase arterial (flecha en B) que pasa a imagen «de charco» en la fase venosa (flecha en C). Reformateo coronal MIP (D) y angiografía selectiva (E) que muestran el punto de sangrado (flecha). La embolización solucionó el episodio hemorrágico.
Angiodisplasia. Mujer de 72 años con episodio de rectorragia masiva (hemoglogina: 7,6g/dl, hematocrito: 22%). Angio-tomografía computarizada multidetector abdominal: área de extravasado intraluminal de contraste en ciego e íleon terminal en fase arterial (B), no evidente en la fase basal (A), que aumenta en la fase venosa (C) (flechas). Vena de drenaje prominente (punta de flecha en C). Los hallazgos se confirmaron por angiografía y la embolización detuvo el sangrado, con posterior recidiva y tratamiento quirúrgico. El estudio anatomopatológico confirmó la angiodisplasia de ciego.
Un estudio precontraste abdominal que incluya el margen anal, preferiblemente con baja dosis, resulta de utilidad para el reconocimiento de material radiodenso intraluminal preexistente (figs. 1 y 3) o artefactos, que puedan simular un sangrado en la fase arterial3,6–8,13,19,22. La fase arterial tiene por objeto obtener un mapa vascular para orientar una posible embolización y requiere la inyección intravenosa rápida (4 cc/s) de medio de contraste yodado, de concentración alta (≥ 300mg/ml), con volumen total ajustado al peso. Suelen emplearse sistemas de detección automática del bolo, sobre la aorta abdominal superior, para maximizar el realce vascular mesentérico y parietal, mejorando la detección de sangrados con flujo lento o fino8. Otros autores retrasan la adquisición a la fase capilar tardía3. La fase venosa se obtiene entre 70 y 90 s después del comienzo de la inyección y en ella se reconoce la presencia de extravasación de medio de contraste y/o patología responsable mejor que en ninguna otra23,24. El extravasado suele ser más evidente en esta fase, aunque su densidad puede mantenerse, incluso diluirse23. Algunos autores no incluyen esta fase21, pero la mayoría la considera fundamental y, de forma aislada o, preferiblemente, en combinación con las otras, aumenta la sensibilidad para el reconocimiento del extravasado y el rendimiento global del estudio3,6,7,12,13,20,21,23,8,26–30. No suele administrarse medio de contraste oral de alta densidad porque enmascara los signos de hemorragia, ni de baja densidad (agua) porque puede diluir el extravasado, dificultado el reconocimiento de un sangrado fino31,32; algunos trabajos22 recomiendan el empleo de agua para distender las asas, evitando posibles errores con una mucosa hipercaptante. Si existe insuficiencia renal leve se recomienda hidratación previa, asociada o no a n-acetil cisteína, que se mantendrá 24 horas21,32.
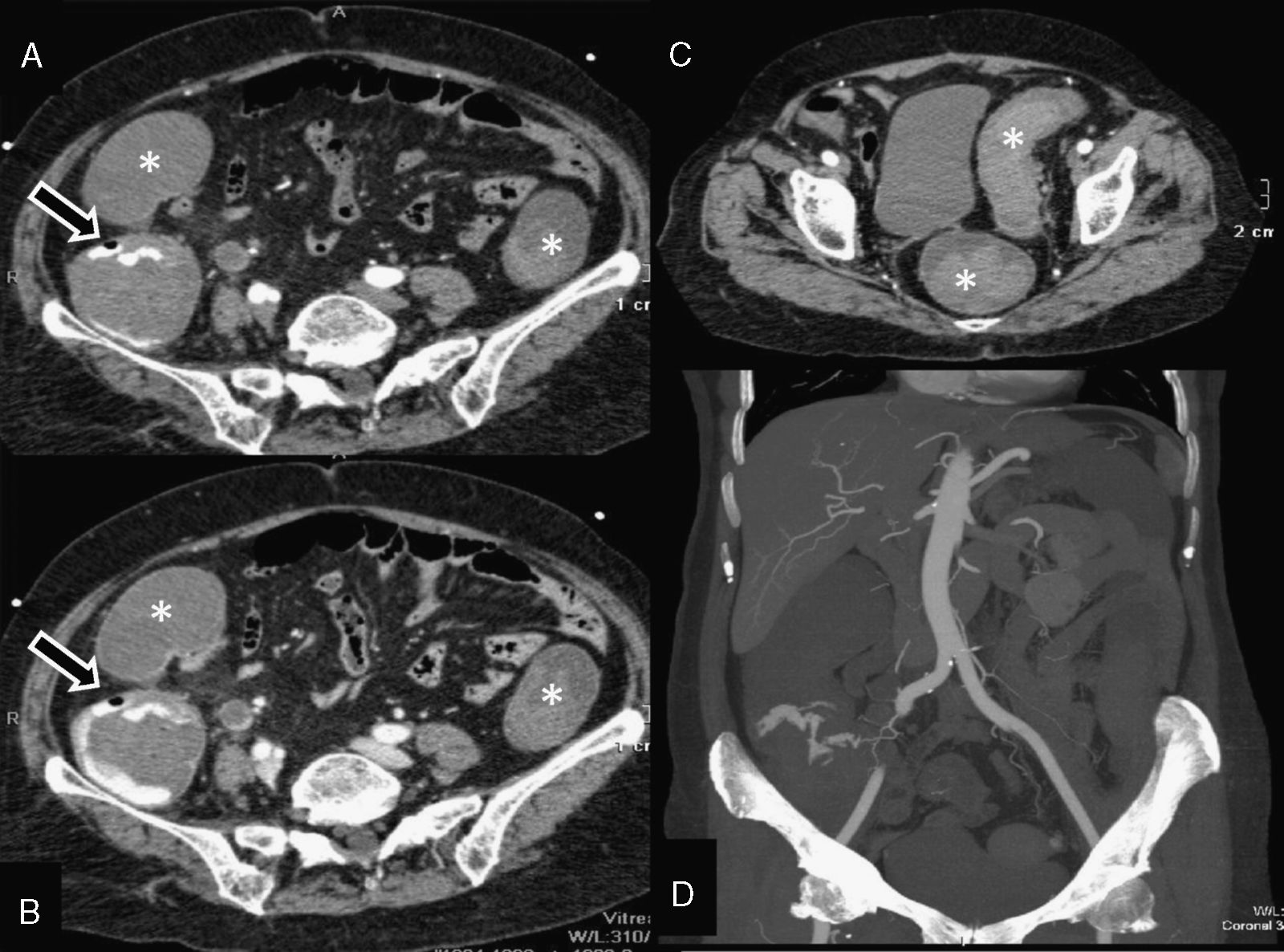
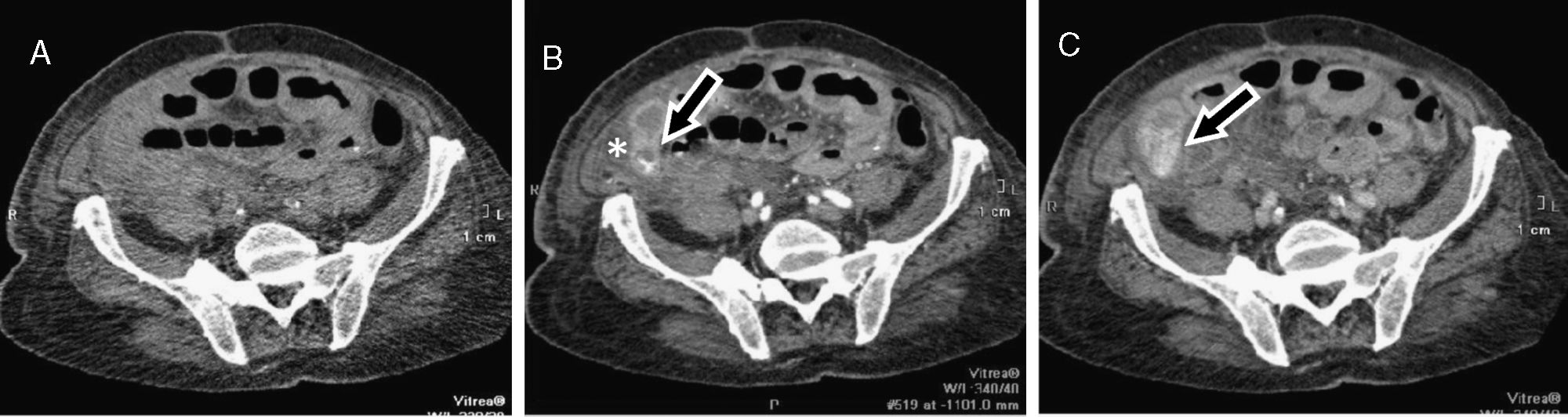
Neoplasia de ciego. Mujer de 89 años. Rectorragia (hemoglobina: 8,5g/dl; hematocrito: 27%) que requirió estabilización hemodinámica. Tomografía computarizada multidetector de abdomen, planos axiales a nivel del ciego, mostrando sangrado arterial en colon ascendente proximal (A) que aumenta en la fase venosa (B). Desflecamiento de la grasa perivisceral, con distensión de la luz del colon e hiperdensidad intraluminal (asteriscos) por restos hemáticos, que alcanza recto y sigma (C). El reformateo coronal MIP mejora la visualización del extravasado y de los vasos responsables (D). La cirugía confirmó un adenocarcinoma de colon con restos hemáticos.
Se realiza un diagnóstico positivo de HD identificando un realce intraluminal > 90 UH en las fases venosa y/o arterial, ausente en las imágenes precontraste3,7,21,27. Su morfología puede ser variable, dependiendo de la fase del estudio o de la localización del punto de sangrado; una morfología en jet es típica de la fase arterial, que se transforma en una mancha hiperdensa en la fase venosa, como consecuencia de la difusión y dilución del medio de contraste (fig. 1). Si el punto de sangrado se localiza en la pared anterior es más probable el jet, mientras que la colección dorsal (a modo de «charco») es más típica de la pared posterior8. Para la localización del extravasado, son de utilidad los reformateos multiplanares (MPR)13 (figs. 1 y 3). Un retardo adecuado de la fase venosa favorece el acúmulo intraluminal de contraste extravasado que mejora su identificación (fig. 4); por el contrario, su obtención precoz favorece los falsos negativos. Un verdadero negativo aparece cuando el sangrado ha cesado espontáneamente en el momento de la adquisición23. La extravasación intraluminal de medio de contraste asocia sensibilidad de 90%, especificidad del 99%21 y precisión en la localización del sangrado de 100%3. Una vez detectada la extravasación de contraste, se intenta identificar el vaso sangrante en la fase arterial, para orientar la intervención intravascular o quirúrgica, siendo para ello igualmente útiles los MPR o con proyección de máxima intensidad, en cualquier plano que oriente sobre el origen del sangrado, técnicas de posprocesado de angio-TCMD o algoritmos para eliminación automática del hueso13 (figs. 1 y 3).
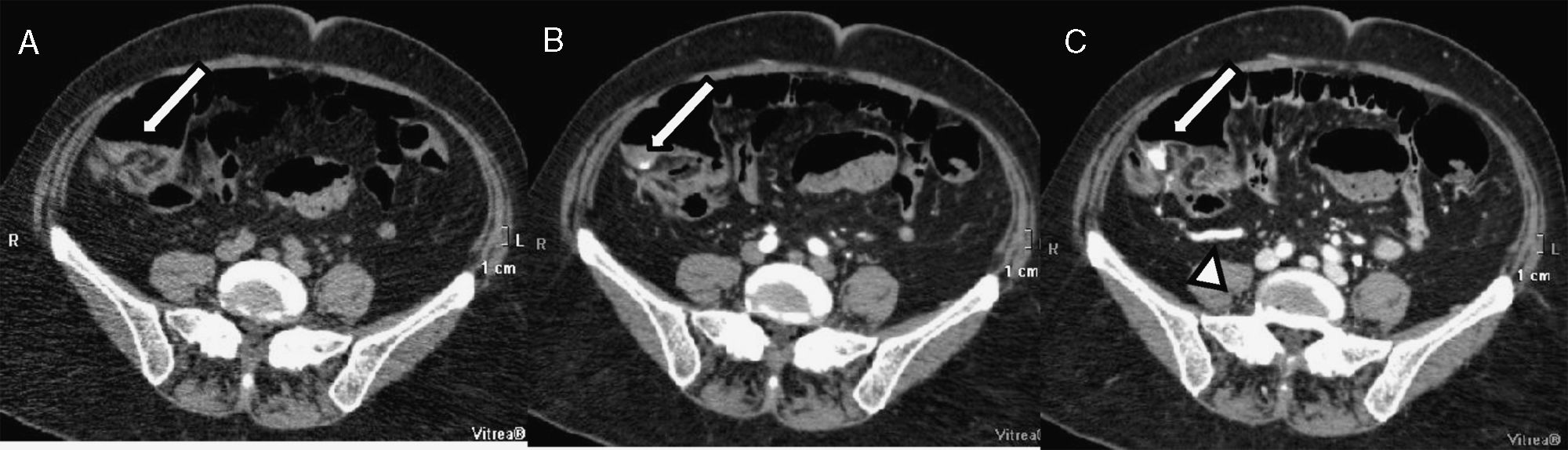
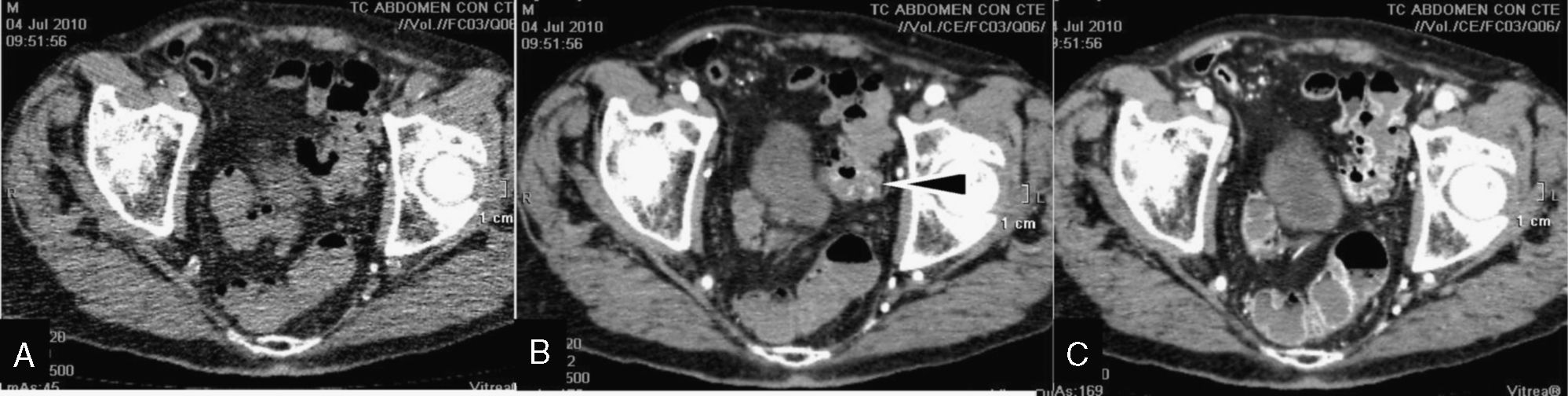
Hemorragia digestiva (HD) baja con origen en intestino delgado. Varón de 80 años diagnosticado de linfoma intestinal e intervenido hace 3 años, actualmente en tratamiento quimioterápico. Rectorragia aguda con repercusión analítica. Estudio con tomografía computarizada multidetector según protocolo de HD que muestra extravasación intraluminal del contraste intravenoso en el íleon distal, en la fase arterial (flecha en B), que aumenta en la fase venosa-portal (flecha en C), y no estaba presente en el estudio basal (A). Múltiples adenopatías retoperitoneales mejor visualizadas en planos más craneales. Líquido intraperitoneal libre (asterisco en B). El episodio de sangrado cesó tras la embolización arterial.
La presencia de material hiperdenso intraluminal con valores de atenuación por encima de 60-90 UH, sugiere la presencia de coágulos o restos hemáticos secundarios a un sangrado previo21 (figs. 1 y 3), especialmente cuando se sitúan próximos a un segmento patológico, a modo de «coágulo centinela», y se han excluido otras causas de hiperdensidad12,20,27. Aunque puede inducir a error31, puede también orientar el diagnóstico o el segmento sangrante, incluso cuando la hemorragia ha cesado26,32. La presencia de un segmento intestinal dilatado, de contenido denso, refuerza la sospecha21 (figs. 1 y 3).
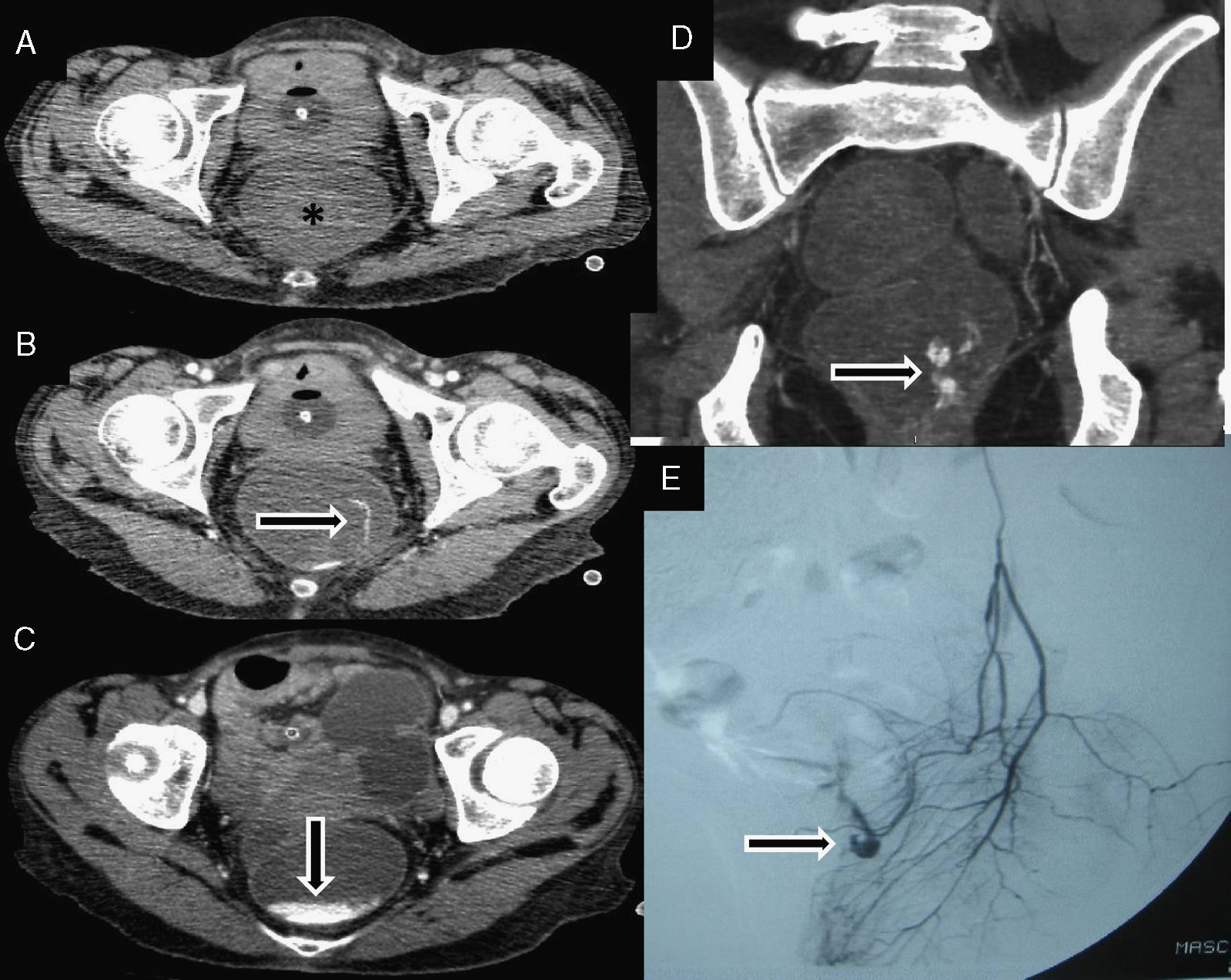
Lesiones potencialmente hemorrágicasEl carácter intermitente de la HD, incluso grave, dificulta la identificación de extravasación activa, pero además de este signo directo, la TCMD puede identificar lesiones con capacidad de sangrar (anomalías vasculares, pólipos, tumores, divertículos) (fig. 5), incluso hallazgos inespecíficos per se, pero orientadores en el contexto clínico de una HD baja, como engrosamiento y/o hipercaptación parietal o hiperdensidad de la grasa perivisceral, especialmente cuando asocian extravasado de contraste o hiperdensidad intraluminal en su proximidad12,20,27 (fig. 3). Bajo el epígrafe de angiodisplasia se incluye un grupo heterogéneo de lesiones vasculares del tracto digestivo, que son identificadas como causa de HD baja con frecuencia creciente13. La angiodisplasia típica se caracteriza por un acúmulo de venas y capilares ectásicos que puede encontrarse en cualquier punto del tubo digestivo, incluso ser múltiple, afectando principalmente al colon derecho de pacientes ancianos. Produce sangrado masivo en el 15% de pacientes, pero su escenario habitual es el de un sangrado intermitente, subagudo, que cede espontáneamente hasta en el 90% de casos, para recidivar hasta en el 85%3,33. Su diagnóstico habitual se realiza por colonoscopia que puede, además, tratar la lesión, pero mediante TC pueden identificarse signos angiográficos típicos como acúmulo de vasos murales, relleno venoso precoz o arteria aferente aumentada de calibre, que asocian sensibilidad, especificidad y valor predictivo positivo de 70, 100 y 100%, respectivamente19 (fig. 2).
Diverticulosis. Varón de 72 años que presenta dolor hipogástrico y rectorragia. El estudio con tomografía computarizada basal muestra diverticulosis sigmoidea florida, sin indicios de material de contraste antiguo retenido en la luz diverticular. Sangrado diverticular en fase arterial (punta de flecha en B), parcialmente oscurecido por el realce mucoso intenso en la fase venosa (C). Confirmación quirúrgica/anatomopatológica.
Un verdadero negativo tiene lugar cuando el sangrado cesa espontáneamente. Ante una nueva evidencia clínica de sangrado activo puede repetirse el estudio, debido a su carácter no invasivo. Las causas más frecuentes para no identificar sangrado activo son su naturaleza intermitente o un caudal por debajo del umbral detectable. La dilución del extravasado en el líquido intestinal preexistente dificulta su detección, por lo que no se recomienda administrar medio de contraste negativo o positivo3,29–31.
Falsos positivosArtefactos de imagen generados por implantes metálicos como clips o prótesis de cadera o la presencia de material intraluminal hiperdenso (medicación, material de sutura o embolización, cuerpos extraños, medio de contraste antiguo) pueden condicionar falsos positivos, siendo de utilidad la comparación con el estudio basal23,24. Es particularmente frecuente la presencia de bario intradiverticular que puede simular coágulos. Las paredes hiperatenuantes de la luz intestinal colapsada constituyen otra potencial causa de error3, así como la hiperdensidad lineal marginal artefactada que aparece en algunas interfases mucosa-aire24,31.
Limitaciones y ventajasLa principal limitación, especialmente en pacientes jóvenes, es la elevada dosis de radiación, siendo el resto comunes al empleo de medios de contraste yodados (nefrotoxicidad, anafilaxia, hipertiroidismo). En relación con otras alternativas diagnósticas, la TC es una técnica estrictamente diagnóstica, sin capacidad terapéutica30, pero más rápida, accesible y precisa que la colonoscopia urgente, y menos invasiva y más informativa que la angiografía. En relación con la gammagrafía, su accesibilidad en Urgencias y capacidad para localizar la HD aguda y definir su etiología de forma inmediata, son superiores30. La TCMD es un método de diagnóstico accesible, no invasivo, sencillo, rápido, preciso, reproducible, de bajo coste y que no requiere preparación, capaz de mostrar todo el tubo digestivo en una sola exploración3. En pacientes hemodinámicamente estables la probabilidad de identificar extravasación por TCMD es baja. En pacientes inestables permite orientar directamente hacia angiografía o cirugía, evitando alternativamente los riesgos de una u otra técnica34. En los pacientes subsidiarios de angiografía/embolización, detecta el sangrado activo y dirige la exploración, reduciendo las dosis de medio de contraste y de radiación, y facilitando la intervención superselectiva terapéutica8,20,22,30. Cuando la alternativa sea quirúrgica, la TCMD identifica el origen y la causa del sangrado, ayuda en la indicación y minimiza el número de resecciones ciegas. Un resultado TCMD negativo refuerza la decisión de tratamiento conservador6,12,34. Aunque está por definir su momento óptimo de realización, puede indicarse en cuanto exista sospecha de sangrado activo, pero su empleo es obligado cuando la colonoscopia es negativa o no concluyente, antes de la cirugía o la arteriografía, y como complemento de la observación clínica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.