Radiología mamaria: Nuevos horizontes en tiempos de pandemia
Más datosEl linfoma anaplásico de célula grande asociado a implantes mamarios (LACG-AIM) es una patología poco frecuente, reconocida recientemente y relacionada sobre todo con los implantes de superficie texturizada. La mayoría de los casos se presentan con derrame/colección periprotésica de inicio tardío que se desarrolla más de un año después de la colocación del implante. El diagnóstico se realiza con punción-aspiración con aguja fina del líquido, bajo guía ecográfica, y análisis citológico. Estas pacientes suelen tener buen pronóstico con la retirada quirúrgica del implante. Un pequeño porcentaje de pacientes desarrolla tardíamente un nódulo/masa adyacente al implante. En estos casos, el diagnóstico se realiza con biopsia con aguja gruesa y análisis histológico. Estas pacientes tienen peor pronóstico, siendo necesaria la combinación de cirugía y quimioterapia sistémica. Las características inmunofenotípicas principales de este linfoma son la intensa expresión de CD30 y la ausencia de expresión de la proteína linfoma anaplásica kinasa (ALK). Se presenta un caso de LACG-AIM, subtipo derrame periprotésico con incipiente formación nodular milimétrica, que se trata con retirada de prótesis y capsulectomía bilateral en paciente portadora de implantes texturizados. Cabe destacar el manejo multidisciplinar de la enfermedad. Una vez obtenido el diagnóstico positivo confirmado por histopatología de LACG-AIM, los profesionales sanitarios deben notificar este incidente a la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS).
Breast-implant-associated anaplastic large-cell lymphoma (BIA-ALCL) is an uncommon, recently recognized disease that seems to occur only in relation with implants with textured surfaces. Most cases present with late-onset peri-implant effusion or fluid collections that develop more than 12 months after insertion of the implant. The diagnosis is reached by cytological analysis of fluid samples obtained by ultrasound-guided fine-needle aspiration. These patients usually have a good prognosis after surgical removal of the implant. A small percentage of patients present with a nodule or mass adjacent to the implant that usually develops late. In these cases, the diagnosis is reached by the histological analysis of core-needle biopsy specimens. These patients have a worse prognosis and require a combination of surgery and systemic chemotherapy. The main immunophenotypic characteristics of this lymphoma are intense expression of CD30 and a lack of expression of anaplastic lymphoma kinase (ALK). Here we present a case of BIA-ALCL in a patient with implants with a textured surface that presented with peri-implant effusion and incipient formation of a millimetric nodule and was treated with removal of the implant and bilateral capsulectomy. It is important to point out that the disease requires multidisciplinary management and that the Spanish Agency of Medicines and Medical Devices (AEMPS) should be notified when the diagnosis is confirmed.
El linfoma anaplásico de célula grande asociado a implantes mamarios (LACG-AIM) es un subtipo de linfoma T que fue descrito por primera vez en 1997 por Keech y Creech1. Desde entonces, hasta la última actualización de la Sociedad Americana de Cirujanos Plásticos, con fecha 24 de abril de 2020, se registran 322 casos tanto sospechados como confirmados en Estados Unidos y un total de 903 en todo el mundo2. En el año 2008, Jong y Roden establecieron la relación entre el linfoma y los implantes mamarios. En 2011, la Food and Drug Administration (FDA) lanzó una alerta sanitaria que determinaba el riesgo aumentado de LACG en pacientes portadoras de implantes mamarios con superficies texturizadas3. Es una entidad poco frecuente, introducida en el año 2016 en la clasificación de las neoplasias linfoides de la Organización Mundial de la Salud (OMS) como linfoma anaplásico de células grandes T, ALK negativo1. Tiene dos subtipos clinicopatológicos: derrame periimplante y nódulo/masa periimplante. El diagnóstico se realiza en comités multidisciplinares y son fundamentales la ecografía, la resonancia magnética y la anatomía patológica.
Caso clínicoMujer de 29 años con prótesis bilateral de mama (NAGOTEX® textured surface, referencia: IMP-EHR 360), intervenida en 2015, que acude a urgencias en junio de 2020 por dolor y aumento del volumen mamario izquierdo. Analítica dentro de la normalidad. Ante la sospecha de proceso inflamatorio agudo, se pauta empíricamente amoxicilina/ácido clavulánico (875 mg/125 mg durante 10 días) y se deriva a la unidad de mama. Regresa por persistencia de la clínica, aumento del volumen mamario y picos febriles.
Presenta una mama izquierda aumentada de volumen, congestiva, blanda y difusamente dolorosa. No presenta alteraciones cutáneas. Axila izquierda sin hallazgos patológicos. Mama derecha normal. Analítica sin leucocitosis.
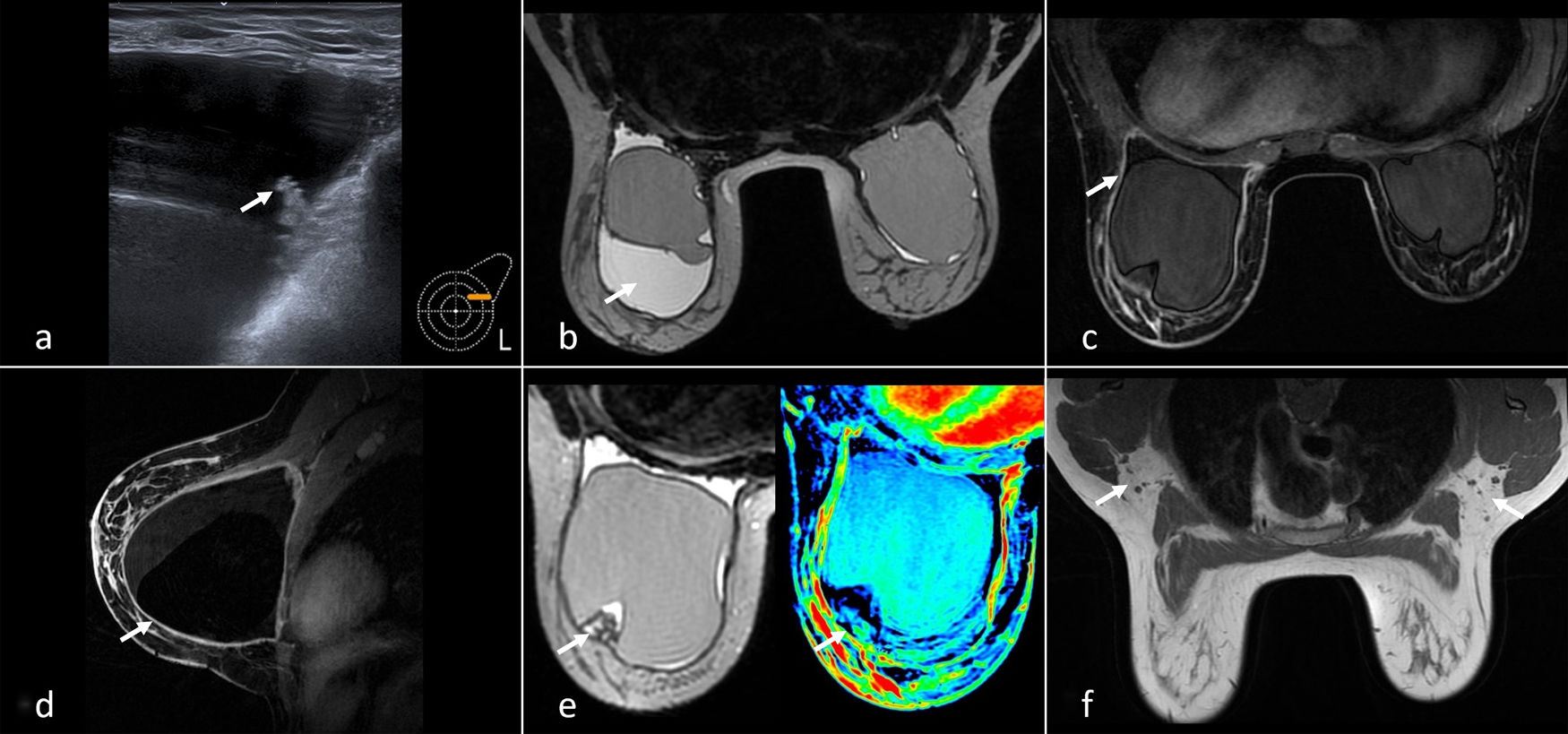
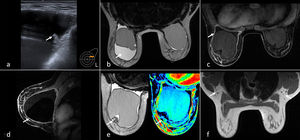
Se solicita ecografía complementaria donde se visualizan implantes retropectorales bilaterales, destacando la presencia de importante cantidad de líquido periprotésico izquierdo, con marcada irregularidad de la superficie interna de la cápsula del implante, sin registro Doppler y con algún área de contenido ecogénico en el interior del líquido (fig. 1a). Se punciona con aguja fina obteniendo 250 cc de líquido turbio, no hemático, que se remite para citología y cultivo bacteriológico.
a) Ecografía en cuadrante superoexterno izquierdo. Colección periprotésica con algún área de contenido ecogénico en el líquido (flecha) y una superficie interna de la cápsula fibrosa marcadamente irregular. b) Resonancia magnética (RM) axial potenciada en T2. Se muestra colección líquida periprotésica en mama izquierda (flecha). Mínima cantidad normal de líquido periprotésico derecho. c) RM axial potenciada en T1 con saturación grasa y tras administración de contraste. Intensa captación irregular de la cápsula periprotésica izquierda (flecha). No hay masas ni adenopatías. d) RM sagital potenciada en T1 con saturación grasa y tras administración de contraste que muestra captación difusa e irregular de la cápsula periprotésica (flecha). e) RM axial T2 que muestra un área seudonodular de tejido de baja intensidad de señal adyacente a la cápsula fibrosa (correlación Figura 1a) y mapa de color que demuestra su ausencia de vascularización (flecha). f) RM axial T1 que demuestra la ausencia de adenopatías (flechas).
La paciente presenta clínica persistente, motivo por el cual se repite el drenaje del líquido periprotésico, obteniendo 600 cc.
Se realiza resonancia magnética para valorar la integridad del implante y descartar rotura de la prótesis, confirmando la colección líquida periprotésica izquierda. En menor medida, y dentro de límites normales, también se aprecia en el lado derecho (fig. 1b). Tras administrar contraste intravenoso, se observa una cápsula periprotésica izquierda engrosada e irregular, que realza de forma difusa (fig. 1c y d), compatible con proceso inflamatorio (correlación ecográfica). El contenido ecogénico descrito previamente en la colección se identifica como un área seudonodular de tejido, ligeramente hipointenso y avascular adyacente a la cápsula (fig. 1e). No se aprecian masas que capten contraste ni adenopatías que sugieran afectación tumoral (fig. 1f). Hallazgos Bi-rads 3.
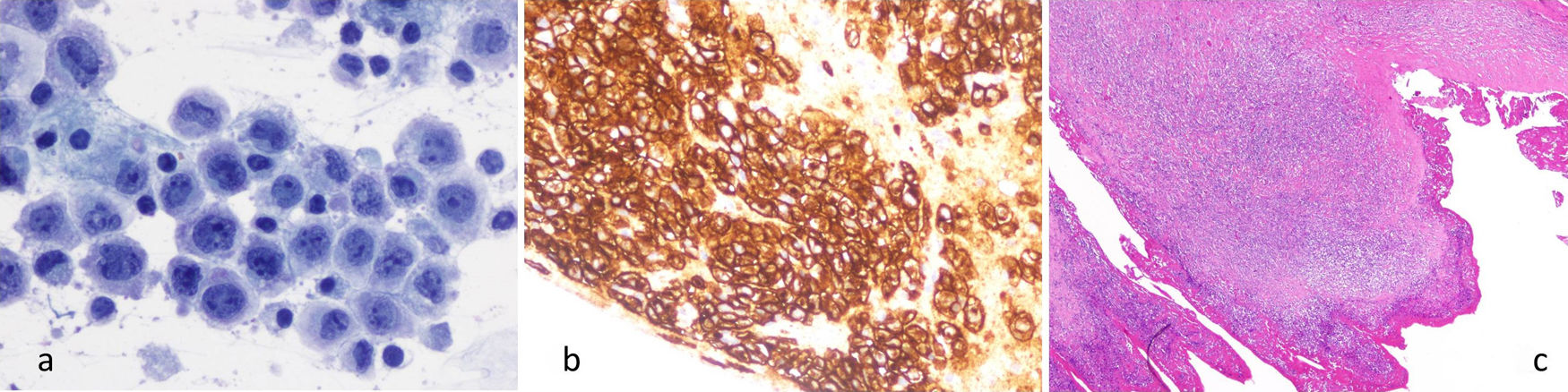
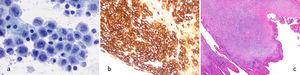
El cultivo bacteriológico es negativo. La anatomía patológica evidencia importante celularidad a expensas de células grandes, con citoplasmas visibles y núcleos irregulares, con formas en herradura y reniformes de tipo “Hall Mark” (fig. 2a). Expresan marcadores característicos, destacando intensa positividad para CD30 de forma difusa (fig. 2b), CD43+, CD4+en un 60-70%, CD8- y marcadores citotóxicos positivos TIA-1 y Granzima B. El antígeno epitelial de membrana (EMA) es positivo. Además, se identifica receptor ALK-1-. Este inmunofenotipo es característico de LACG T asociado a prótesis mamaria.
a) Preparación de cytospin con celularidad neoplásica. Células grandes, atípicas, con formas “Hall Mark”. (Papanicolaou x400). b) Bloque celular citológico. Difusa e intensa expresión de CD30 citoplásmica y paranuclear en celularidad neoplásica. (IHQ-CD30 x200).c) Cápsula periprotésica con un nódulo de células tumorales de 3×2 mm de diámetro (correlación figuras 1a, 1e y 3b). (HE, x40).
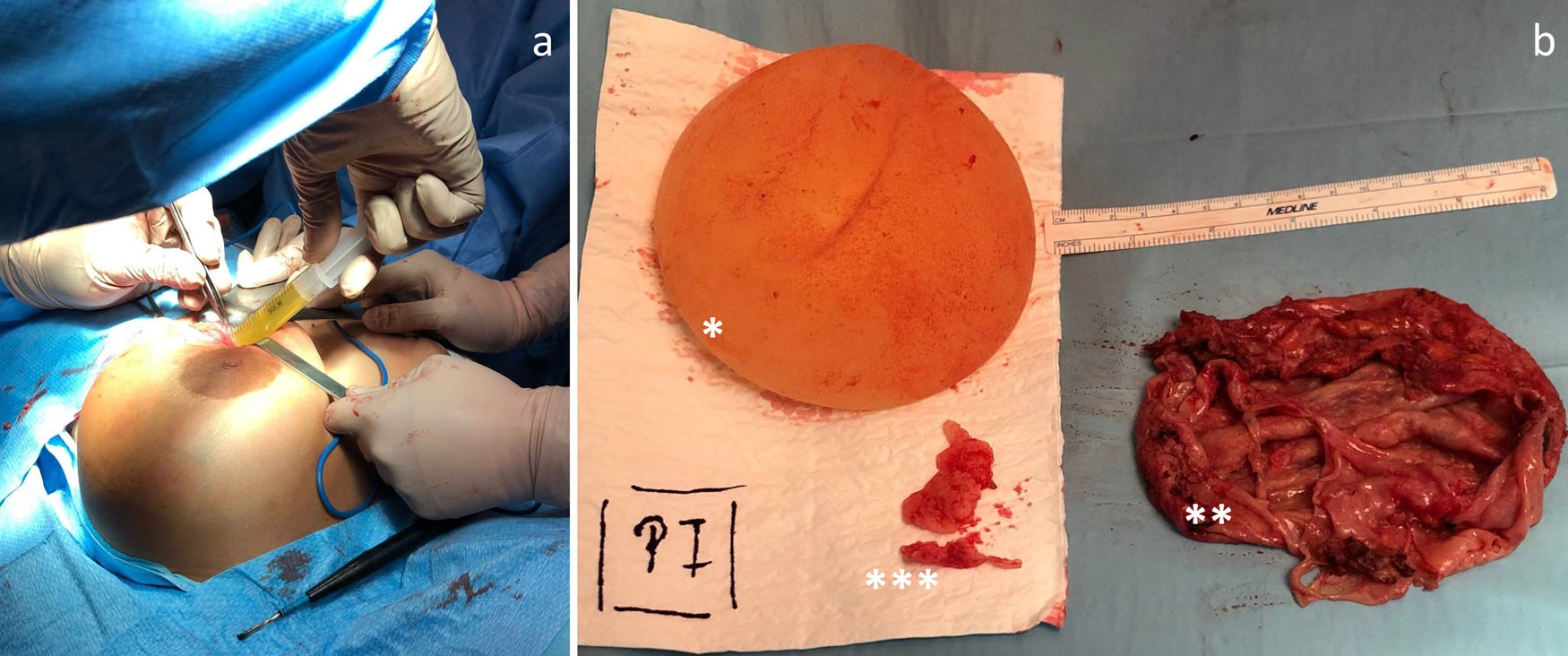
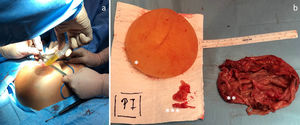
Se presenta el caso en sesión multidisciplinar y se decide la retirada de la prótesis y capsulectomía bilateral (fig. 3a y b). La paciente evoluciona favorablemente.
El análisis histológico de la pieza de resección quirúrgica identifica un nódulo tumoral de 3×2 mm asentado en la cápsula, constituido por abundante celularidad neoplásica tipo “Hall Mark” (fig. 2c). No se observa extensión más allá de la cápsula y los márgenes quirúrgicos están respetados. Basándose en estos hallazgos y según la clasificación TNM de la National Comprehensive Cancer Network (NCCN) del año 2019, se considera T3N0M0, estadio IC4.
DiscusiónEl linfoma anaplásico de células grandes asociado a implantes mamarios es una entidad recientemente reconocida por la OMS como un subtipo de linfoma T ALK negativo1.
La presentación típica consiste en aumento brusco y unilateral del volumen mamario, secundario en la mayoría de las ocasiones al desarrollo de una colección periprotésica (85%) y menos frecuentemente debido al desarrollo de un nódulo/masa adyacente a la prótesis (15%). Esto suele ocurrir 5-10 años después de la colocación de los implantes4,5. Se ven afectadas pacientes con mamoplastias tanto estéticas como por cirugía de reconstrucción después de un cáncer de mama.
Se postula un origen multifactorial del LACG-AIM, que podría estar relacionado con tres factores: tipo de implantes, base genética y contaminación. Se ha identificado asociación significativa entre el LACG y los implantes mamarios con cubierta texturizada frente a los de cubierta lisa. Además, se cree que la contaminación bacteriana podría producir una estimulación crónica de los linfocitos que favorecería su desarrollo6.
Respecto al diagnóstico de esta entidad, la prueba de elección es la ecografía. Se debe evaluar la integridad del implante, presencia de seroma o masa/nódulo y los ganglios axilares. Cuando la ecografía es indeterminada, la resonancia magnética es la segunda técnica de elección para valorar la integridad de la cápsula, contractura capsular, rotura del implante, edema tisular y presencia de colección periprotésica o nódulo/masa1,4.
Respecto al diagnóstico diferencial, en el subtipo LACG con seroma periprotésico tardío hay que tener en cuenta entidades como: hematoma (espontáneo o traumático), infección, rotura del implante, sangrado de la cápsula, causas idiopáticas, etc. El análisis citológico del líquido periprotésico mediante punción-aspiración con aguja fina (PAAF) es la prueba diagnóstica de mayor sensibilidad7. Los criterios mínimos para establecer un diagnóstico de LACG-AIM deben incluir: presencia de células malignas grandes y pleomórficas de tipo “Hall Mark” que infiltran la cápsula periprotésica o el líquido, fuerte expresión de CD30 y ausencia de expresión de ALK1. En el subtipo LACG con formación de nódulo o masa se debe incluir en el diagnóstico diferencial el cáncer de mama primario, otros subtipos de linfoma y metástasis. En estos casos es necesaria biopsia con aguja gruesa (BAG) o biopsia escisional para confirmación histológica8.
Es importante determinar la extensión de la enfermedad, especialmente en el contexto de LACG con formación de nódulo o masa; para ello, destaca el papel de la tomografía por emisión de positrones-tomografía computarizada (PET-TC).
La mayoría de los casos de LACG-AIM tienen buen pronóstico, siendo el tratamiento quirúrgico curativo y de primera elección. Se realiza explantación bilateral de implantes mamarios con capsulectomía completa. La presencia de nódulo o masa es el único factor determinante de peor pronóstico. En estos casos se debe complementar el tratamiento quirúrgico con una combinación de quimioterapia sistémica. Después del tratamiento quirúrgico se procede a la reconstrucción mamaria inmediata o diferida9.
En los casos sin enfermedad residual, en los que se realizó escisión completa, no existe suficiente evidencia demostrada que indique que el seguimiento rutinario por imagen mejore el pronóstico1. No obstante, se recomienda seguimiento cada 3-6 meses durante 2 años, valoración de realizar TC o PET-TC y después seguimiento en función de la clínica10.
Autoría- 1.
Responsable de la integridad del estudio: SOS.
- 2.
Concepción del estudio: SOS, CBS.
- 3.
Diseño del estudio: SOS, CBS.
- 4.
Obtención de los datos: SOS, GMS, MSD, CBS.
- 5.
Análisis e interpretación de los datos: SOS, GMS, MSD, CBS.
- 6.
Tratamiento estadístico: N/A.
- 7.
Búsqueda bibliográfica: SOS, CBS.
- 8.
Redacción del trabajo: SOS.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: SOS, CBS.
- 10.
Aprobación de la versión final: SOS, CBS.
Este trabajo tiene la aprobación del comité ético de nuestro centro. Disponemos del consentimiento informado escrito del paciente cuyas imágenes de distintas pruebas de imagen se muestran en el presente trabajo.
FinanciaciónEl presente estudio no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.