La hipoacusia neurosensorial pediátrica es una causa mayor de discapacidad. Pese a que solo en el 20-40% de los casos se identifica una malformación del oído interno, su detección es de vital importancia para el tratamiento de estos pacientes. En este artículo se repasan la anatomía y la embriogénesis del oído interno. Se valora el papel de la neuroimagen en la hipoacusia neurosensorial pediátrica y en el estudio preimplante coclear. Se destaca la necesidad de la utilización de un sistema universal de clasificación de las malformaciones del oído interno con implicaciones pronósticas y terapéuticas. Por último, se describen e ilustran de forma concisa los hallazgos radiológicos clave de cada tipo de malformación. La tomografía computarizada y la resonancia magnética desempeñan un papel crucial en la caracterización de las malformaciones del oído interno y permiten la valoración de las estructuras anatómicas que posibilitan la selección del tratamiento y del abordaje quirúrgico idóneos.
Pediatric sensorineural hearing loss is a major cause of disability; although inner ear malformations account for only 20-40% of all cases, recognition and characterization will be vital for the proper management of these patients. In this article relevant anatomy and development of inner ear are surveyed. The role of neuroimaging in pediatric sensorineural hearing loss and cochlear preimplantation study are assessed. The need for a universal system of classification of inner ear malformations with therapeutic and prognostic implications is highlighted. And finally, the radiological findings of each type of malformation are concisely described and depicted. Computed tomography and magnetic resonance imaging play a crucial role in the characterization of inner ear malformations and allow the assessment of the anatomical structures that enable the selection of appropriate treatment and surgical approach.
La hipoacusia neurosensorial pediátrica es una causa mayor de discapacidad. Su diagnóstico precoz es muy importante, ya que el retraso puede afectar al desarrollo del lenguaje, las aptitudes académicas y el desarrollo social y emocional. Puede ser el resultado de anomalías congénitas o adquiridas; al menos la mitad son de causa genética, y entre las adquiridas, la infección por el citomegalovirus es la causa más frecuente1. La prevalencia de malformaciones cocleovestibulares detectables se estima en un 20-40%2.
El implante coclear es el procedimiento terapéutico estándar de la hipoacusia neurosensorial pediátrica de grave a profunda3. Previamente se consideraban las malformaciones del oído interno (OI) una contraindicación para el implante coclear, pero los avances en la técnica quirúrgica y en los dispositivos cocleares han permitido la implantación en cócleas malformadas.
La técnicas de imagen desempeñan un papel crucial en la valoración prequirúrgica de las malformaciones del oído interno, ya que permiten la detección, la evaluación del nervio coclear y la identificación de variantes anatómicas y de potenciales complicaciones quirúrgicas1.
Existen varios esquemas de clasificación de las malformaciones del OI; pese a que ninguno es perfecto, debe realizarse un esfuerzo por adoptar un sistema universal que permita compartir resultados con la comunidad científica.
En este artículo se llevará a cabo un breve repaso de la anatomía y de la embriogénesis del OI. Se valorará el papel de la neuroimagen en la hipoacusia neurosensorial pediátrica y en el estudio preimplante coclear. Se destacará la necesidad de la utilización de un sistema universal de clasificación de las malformaciones del OI con implicaciones terapéuticas y pronósticas. Por último, se describirá la clasificación más aceptada, ilustrando y detallando de forma concisa los hallazgos radiológicos clave de cada tipo de malformación.
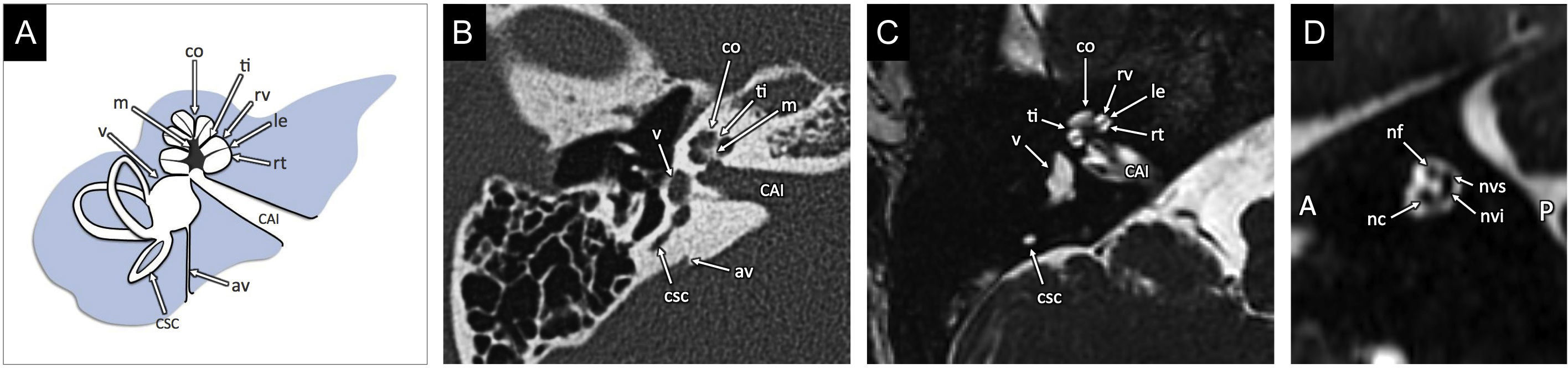
Anatomía y embriología del oído internoEl OI se compone del laberinto membranoso, contenido por el laberinto óseo. La cóclea, órgano de la audición, es una estructura cónica consistente en un canal que da 2,5 a 2,75 vueltas alrededor de un core central denominado modiolo (fig. 1). Desde el modiolo se extiende una lámina espiral ósea fina que divide el canal en rampa vestibular (superior) y rampa timpánica (inferior). Mediante la apertura coclear se comunica la cóclea con el fundus del conducto auditivo interno (CAI), y a su través pasa el nervio coclear. El sistema vestibular está formado por el vestíbulo y los tres canales semicirculares: superior, lateral y posterior.
Anatomía normal del oído interno (OI). A) Gráfico que ilustra el OI, formado por la cóclea (co), el vestíbulo (v) y los canales semicirculares (csc). El modiolo (m) forma la base de la cóclea en el fundus del conducto auditivo interno (CAI). Las espiras cocleares están separadas por el tabique interescalar (ti); la espira se divide en rampa vestibular (rv) y rampa timpánica (rt) por la lámina espiral (le), que surge desde el modiolo. El acueducto vestibular (av) se extiende desde el vestíbulo al espacio epidural de la fosa posterior, con un trayecto por la porción petrosa del hueso temporal perpendicular al CAI. B) Representación de las estructuras anatómicas en una imagen transversal de tomografía computarizada en ventana de hueso. C) Representación de las estructuras anatómicas en una imagen transversal de resonancia magnética (RM) de alta resolución, secuencia eco de gradiente, potenciada en T2, en estado estacionario. D) Reconstrucción sagital oblicua perpendicular al CAI de la secuencia de RM que permite identificar el nervio facial (nf) en el cuadrante superoanterior, el nervio coclear (nc) en el inferoanterior, el nervio vestibular superior (nvs) en el superoposterior, y el nervio vestibular inferior (nvi) en el inferoposterior. En esta imagen, la porción anterior se marca con A y la posterior con P.
El conducto y el saco endolinfáticos están contenidos por el acueducto vestibular, que se extiende desde el laberinto hasta el espacio epidural de la fosa posterior.
El CAI atraviesa la porción petrosa del hueso temporal y comunica la cisterna del ángulo pontocerebeloso con el laberinto; a su través discurren los pares craneales VII y VIII. En un plano sagital oblicuo perpendicular al CAI identificamos el nervio facial en el cuadrante anterosuperior, el nervio coclear en el cuadrante anteroinferior y los nervios vestibular superior e inferior en los cuadrantes posteriores.
El OI surge de la placoda ótica, que comienza su desarrollo en la tercera semana de gestación. El desarrollo de la cóclea se completa en la octava semana, el vestíbulo la semana 11 y los canales semicirculares entre las semanas 19 y 22. El primer canal semicircular en desarrollarse es el superior, seguido del posterior y el lateral4.
Papel de la neuroimagen en las malformaciones del oído internoLa mayoría de los candidatos a implante coclear no tienen anomalías en el hueso temporal identificables por la imagen1, pero en caso de existir, su detección es muy importante. La tomografía computarizada (TC) y la resonancia magnética (RM) permiten una excelente representación de las malformaciones del OI y se utilizan en la práctica sistemática del estudio de la hipoacusia neurosensorial pediátrica y el preimplante coclear. Por su papel complementario es recomendable el uso de ambas técnicas, con lo que además aumenta la tasa de detección de malformaciones5.
La TC permite la detección de malformaciones óseas, del posible trayecto aberrante del nervio facial (más frecuente en esta población6) y de las estructuras vasculares, así como la valoración de anomalías coexistentes del oído externo y medio.
Por su parte, la RM permite la evaluación de los espacios rellenos de líquido del OI, y la valoración del VIII par craneal y de otras posibles anomalías intracraneales.
En conjunto, ofrecen al cirujano la información prequirúrgica necesaria que permitirá la decisión terapéutica, el consejo a los padres y el probable pronóstico del implante coclear, la selección del abordaje quirúrgico y del implante idóneos, y alertará de las variantes anatómicas y de las posibles complicaciones quirúrgicas1.
ClasificaciónExisten muchas clasificaciones de las malformaciones del OI, y esta ausencia de un lenguaje común dificulta el entendimiento en la comunidad científica. Es necesario un sistema de clasificación universal que permita determinar la asociación entre los diferentes tipos de malformación y su pronóstico clínico. La clasificación más ampliamente aceptada es la de Sennaroglu7, en la que se basa este artículo. Se fundamenta en la embriogénesis. Cada tipo de malformación es consecuencia de la detención del desarrollo en un momento determinado. De forma general es útil, y a mayor gravedad de la malformación, mayor es el número de complicaciones quirúrgicas y peor es el resultado del implante coclear2,3,5,6.
En nuestro informe radiológico, además de clasificar la malformación, detallamos el estado de las tres estructuras anatómicas involucradas en el implante coclear: la luz coclear, donde se colocará el cable de electrodos; el modiolo, diana de la estimulación eléctrica; y el nervio coclear, vía por la que se conduce el estímulo2.
A continuación describimos los diferentes tipos de malformación (tabla on line).
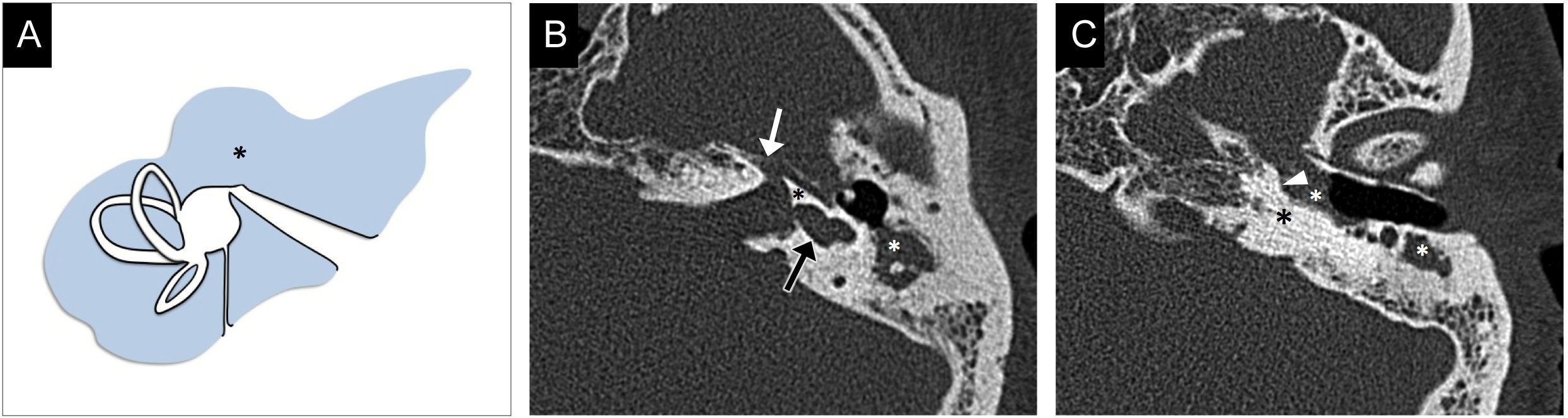
Aplasia laberíntica completaTambién conocida como aplasia de Michel, es el resultado de la detención del desarrollo de la placoda ótica antes de la tercera semana de gestación. Solo supone el 1% de las malformaciones del OI8. Constituye una contraindicación para el implante coclear y la mejor opción terapéutica es el implante troncoencefálico8.
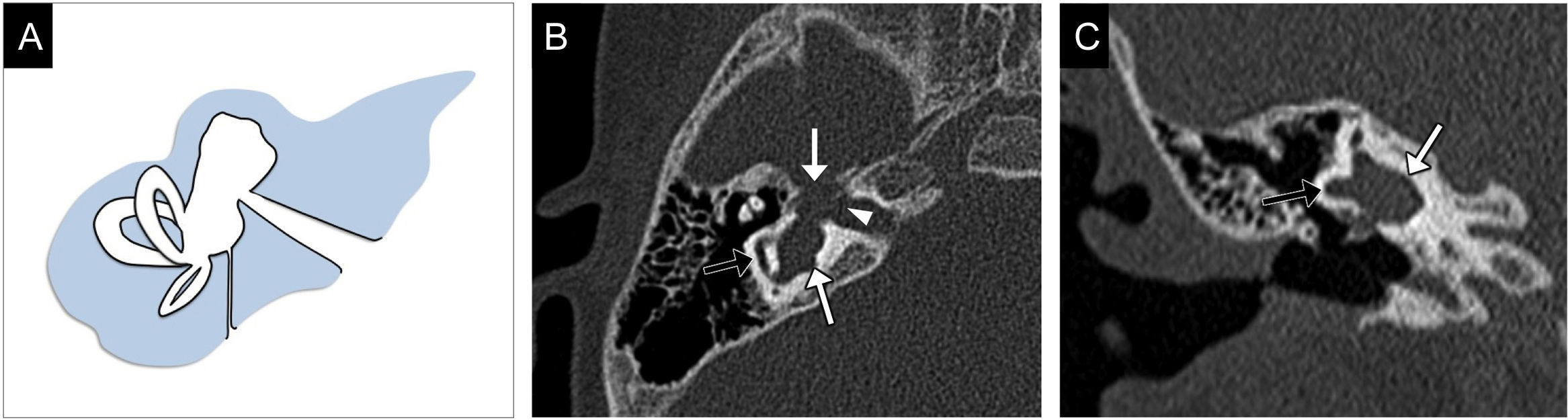
Se caracteriza por la ausencia completa de las estructuras del OI (fig. 2). El CAI es atrésico, existe aplasia del nervio cocleovestibular y el trayecto del nervio facial es aberrante. Se asocia con múltiples anomalías del hueso temporal, de las cuales las más características son la hipoplasia del ápex petroso, la ausencia de las ventanas redonda y oval, y el aplanamiento de la pared medial del oído medio por ausencia del promontorio4,9.
Aplasia laberíntica completa. A) Imagen transversal de tomografía computarizada en ventana de hueso, en la que se identifica la ausencia completa de todos los elementos del oído interno (asterisco). Se observan hipoplasia de la porción petrosa del hueso temporal (flecha blanca), el conducto auditivo interno (CAI) atrésico, con un calibre disminuido (flecha negra), y el aplanamiento de la cara medial del oído medio (punta de flecha). B) Imagen transversal de resonancia magnética, secuencia eco de gradiente, potenciada en T2, en estado estacionario, en la que además de observar todos los hallazgos antes descritos pueden valorarse los pares craneales; en este caso existe una deficiencia completa del nervio vestibulococlear y solo se identifica el nervio facial (punta de flecha) en la cisterna del ángulo pontocerebeloso y el CAI.
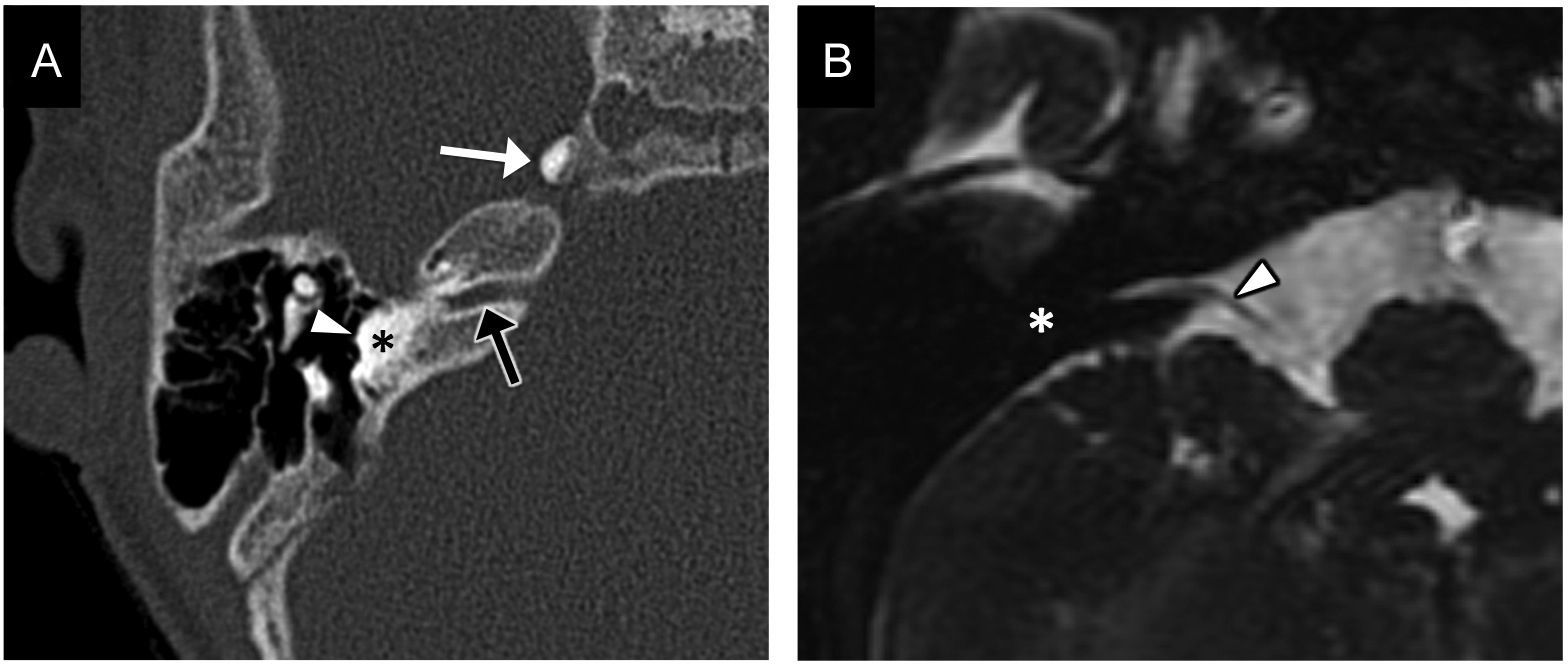
Se debe a una detención del desarrollo al final de la tercera semana de gestación10 y supone el 3% de las malformaciones del OI1. Constituye una contraindicación para el implante coclear.
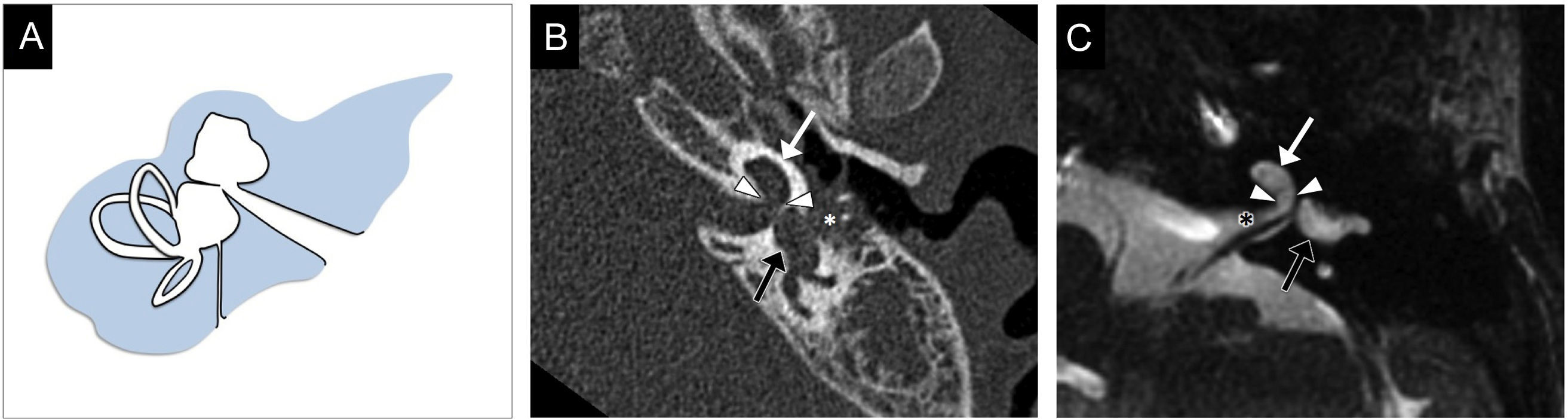
La cóclea está ausente y el sistema vestibular puede ser normal o displásico, diferenciable de la cóclea por su situación posterior al CAI (fig. 3). El segmento laberíntico del nervio facial tiene un recorrido aberrante y la pared medial del oído medio está aplanada.
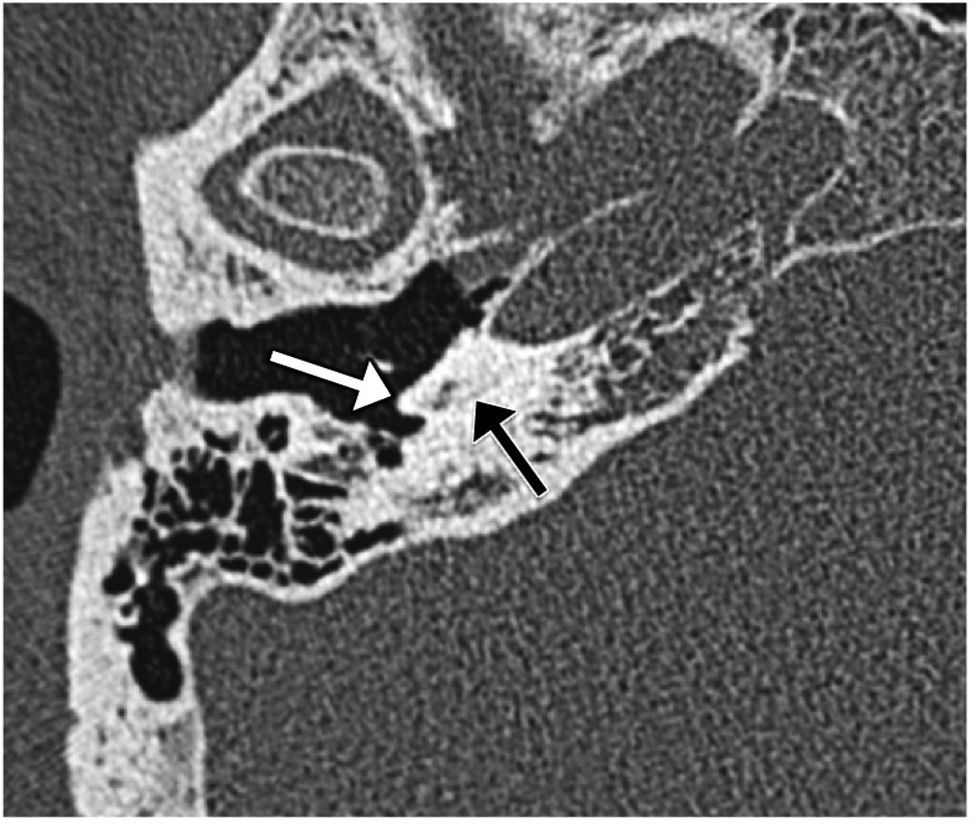
Debe recordarse que: en la aplasia laberíntica y la aplasia coclear existe un aplanamiento de la pared medial del oído medio, hallazgo útil para diferenciarlas de la laberintitis osificante (fig. 4on line). Esta distinción es de gran importancia clínica, ya que en la laberintitis osificante es posible el implante coclear, aunque presente dificultad.
Aplasia coclear. A) El gráfico representa la ausencia completa de la cóclea (asterisco) y la normalidad del resto de las estructuras del oído interno. B y C) Imágenes transversales de tomografía computarizada en ventana de hueso, superior e inferior, respectivamente, en las que puede identificarse la ausencia de la cóclea (asterisco negro). El vestíbulo es displásico (flecha negra) y el nervio facial tiene un recorrido aberrante, con un ensanchamiento de su porción laberíntica (flecha blanca). En C se observa el aplanamiento de la cara medial del oído medio (punta de flecha), hallazgo que permite diferenciar esta malformación de la laberintitis osificante. Este paciente presentaba además otitis media crónica y erosión inflamatoria de la cadena osicular; pueden verse la ocupación del oído medio y de las celdillas mastoideas por un tejido/material de densidad de partes blandas y la erosión casi completa de la cadena osicular (asterisco blanco).
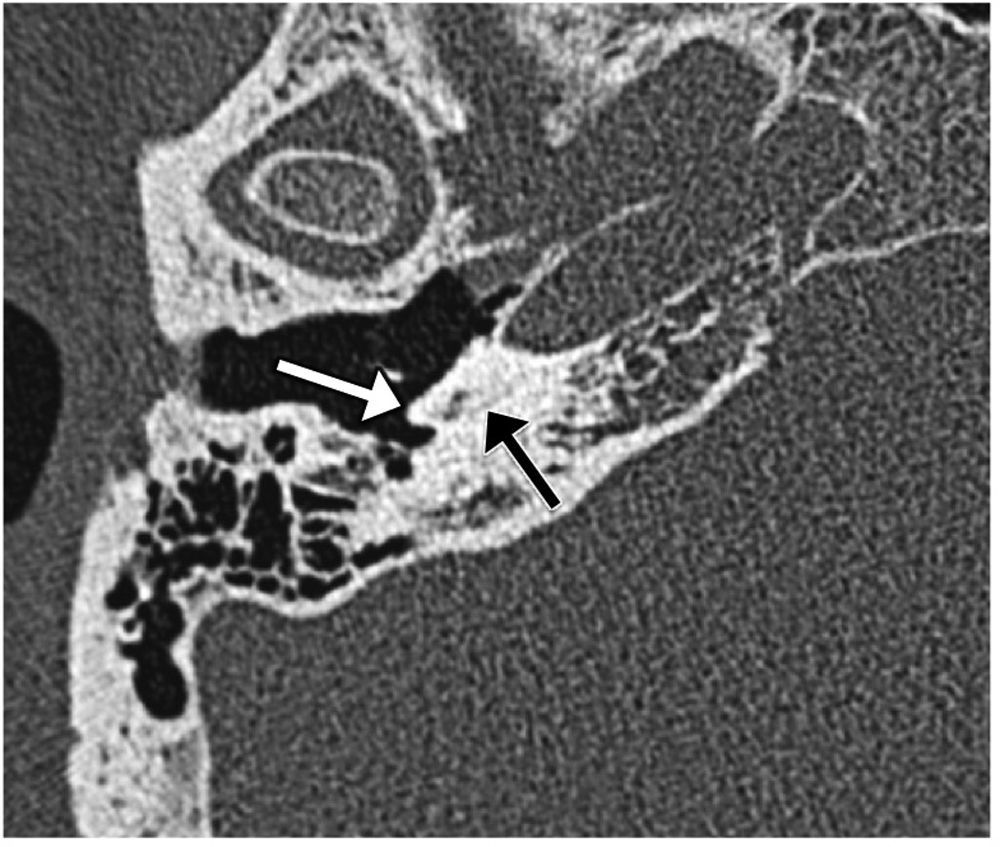
Es el resultado de la detención del desarrollo en la cuarta semana y supone el 25% de las malformaciones4,10. El implante coclear es posible, pero puede resultar complejo y tener una mayor tasa de complicaciones11.
on line Laberintitis osificante. Imagen transversal de tomografía computarizada que muestra una osificación casi completa de la cóclea (flecha negra). La pared medial del oído medio no está aplanada y se identifica el promontorio (flecha blanca), hallazgos que ayudan a diferenciarla de la aplasia laberíntica y coclear.
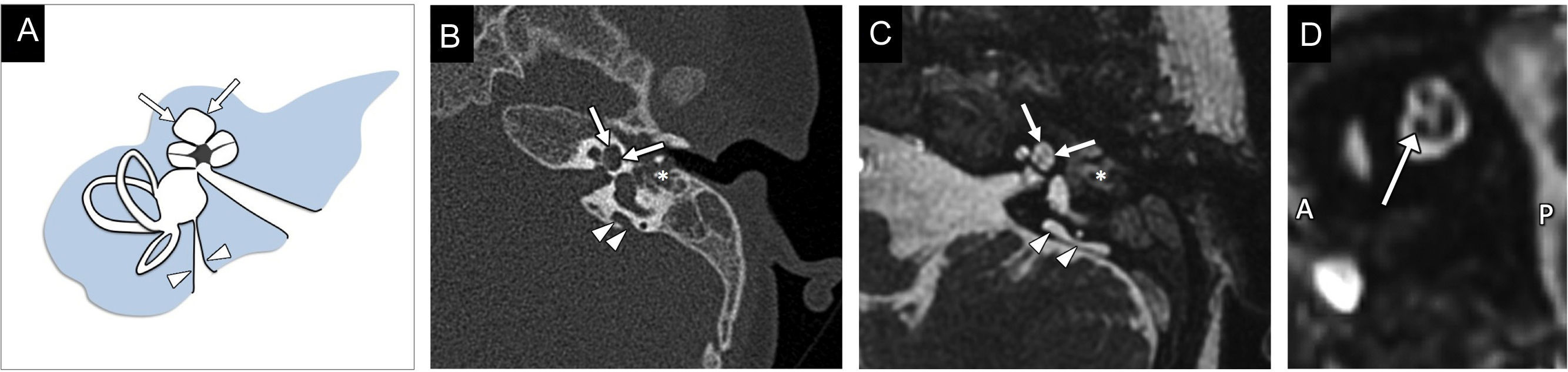
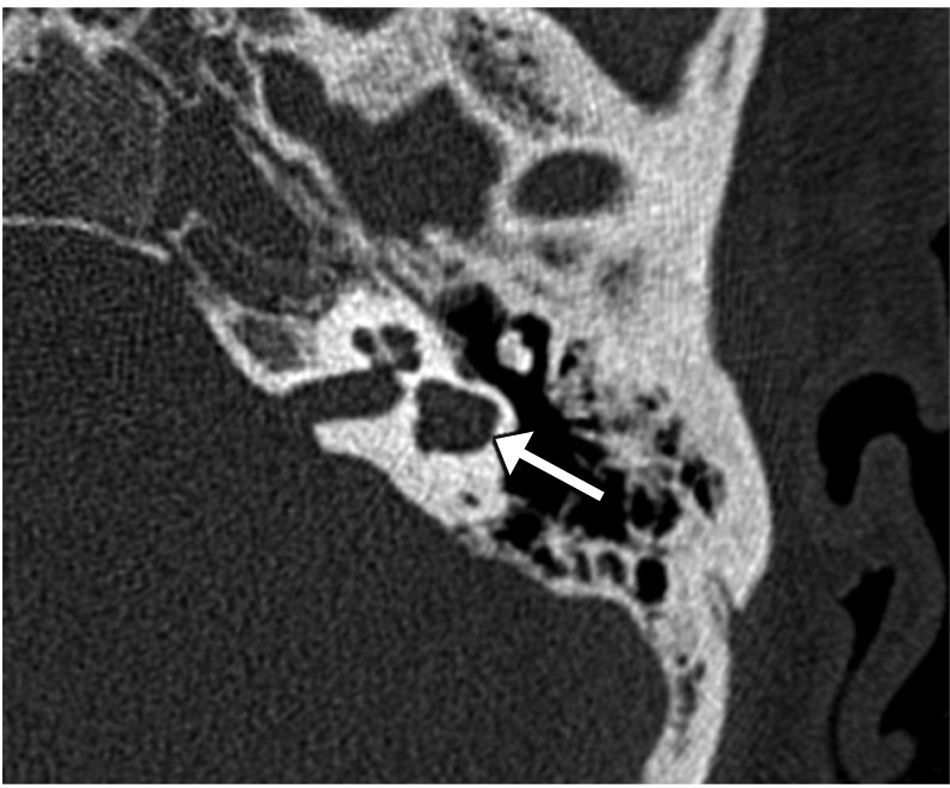
Se caracteriza por la confluencia de la cóclea y el vestíbulo en una cavidad quística única sin arquitectura interna (fig. 5). Hay una ausencia completa del modiolo, con una amplia comunicación entre la cavidad y el CAI12. Los canales semicirculares suelen ser displásicos, aunque en ocasiones son normales4.
Cavidad común. A) El gráfico ilustra la cavidad común quística, sin arquitectura interna, formada por la confluencia de la cóclea y el vestíbulo rudimentarios. B y C) Imagen transversal y reconstrucción multiplanar en coronal de tomografía computarizada en ventana de hueso, respectivamente, en las que se identifican la cavidad común (flechas blancas) y los canales semicirculares ligeramente displásicos, ensanchados y cortos (flechas negras). Se observa que el fundus del CAI, que presenta un defecto de la lámina cribiforme (punta de flecha), entra al centro de la cavidad común; hallazgo que permite diferenciar esta malformación de la aplasia coclear con vestíbulo dilatado displásico, en la que el fundus del CAI se localiza anterior a la cavidad malformada, que es más posterior, en la situación normal del vestíbulo.
También denominada malformación cocleovestibular quística, se debe a una detención del desarrollo durante la quinta semana10.
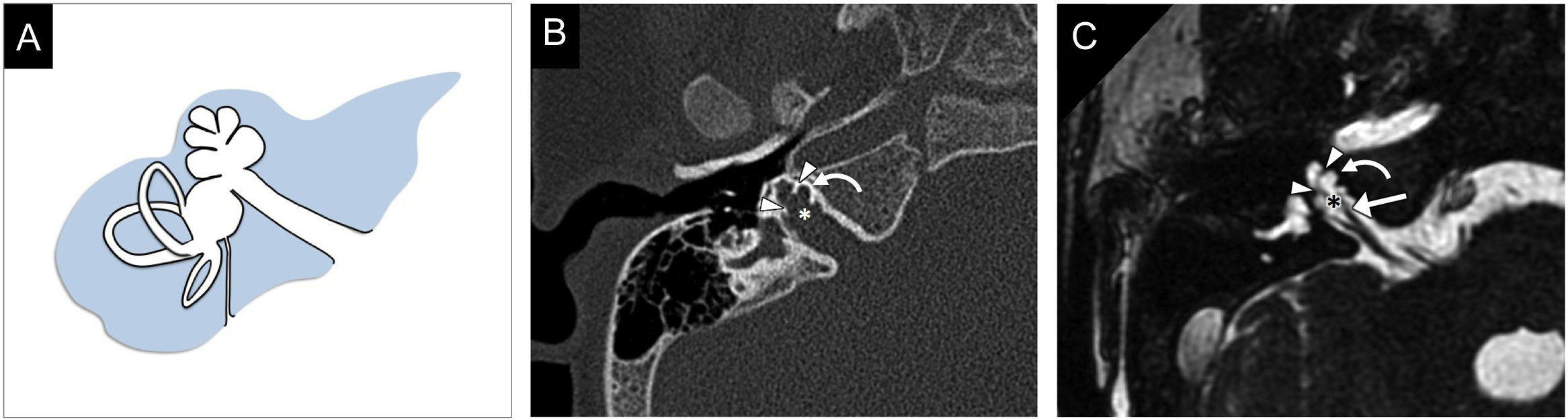
La cóclea presenta una ausencia completa del modiolo y tiene un aspecto quístico, sin arquitectura interna; el vestíbulo está dilatado. El laberinto, en conjunto, adopta una apariencia descrita clásicamente como en 8 (fig. 6). En esta malformación son distinguibles la cóclea y el vestíbulo, lo que permite diferenciarla de la cavidad común. La región cribiforme entre la cóclea y el CAI con frecuencia es defectuosa11,13.
Partición incompleta tipo I. A) En el gráfico se muestra que la cóclea presenta una ausencia completa del modiolo y del tabique interescalar, sin arquitectura interna. El vestíbulo es displásico, ligeramente dilatado, y el laberinto en conjunto adopta una forma de 8. B) Imagen transversal de tomografía computarizada en ventana de hueso. C) Reconstrucción de máxima intensidad de proyección de imagen transversal de resonancia magnética en secuencia eco de gradiente, potenciada en T2, en estado estacionario. En B y C se identifican los hallazgos descritos: cóclea sin arquitectura interna (flecha blanca) y vestíbulo ligeramente dilatado (flecha negra), formando el laberinto un 8. Se observa una deficiencia de la lámina cribiforme (puntas de flecha), con amplia comunicación entre el conducto auditivo interno y la cóclea. En C puede valorarse la deficiencia del nervio coclear (asterisco negro en la teórica localización del nervio). El paciente presentaba otitis media crónica; en B se observa la ocupación del oído medio (asterisco blanco).
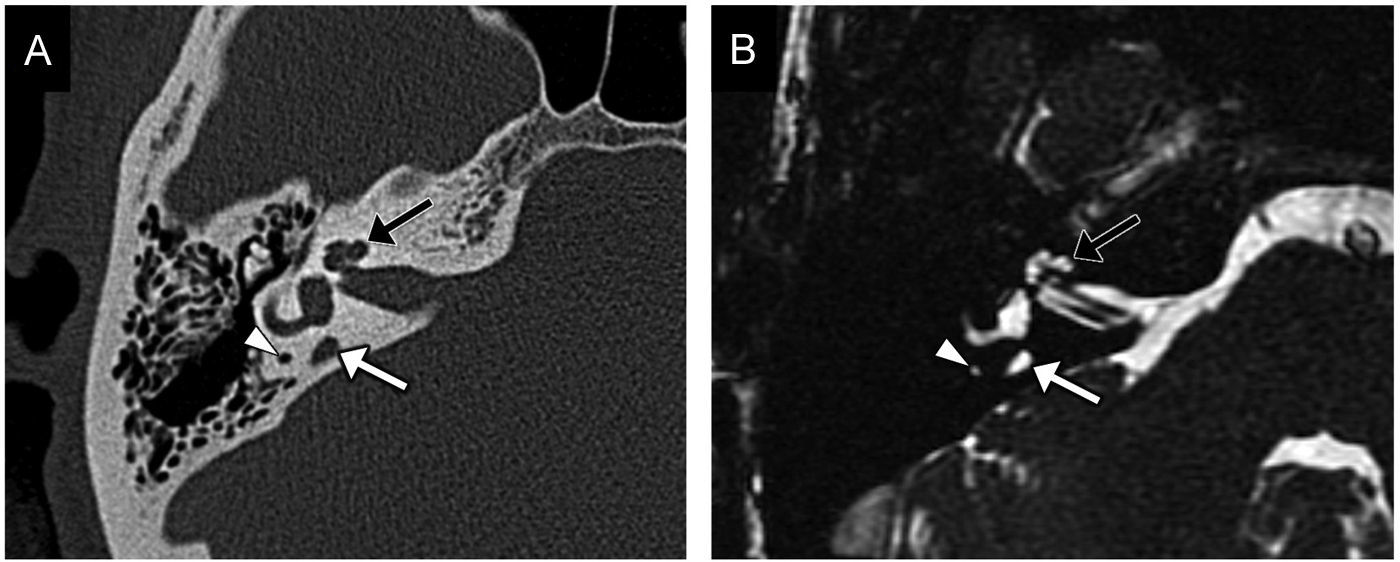
Se debe a una detención del desarrollo en la séptima semana y se trata de la displasia más frecuente (el 50% de las malformaciones)4.
Presenta una fusión de la espira media y apical, con aspecto quístico por un defecto de la porción apical del modiolo, el tabique interescalar y la lámina espiral (fig. 7). La espira basal y la porción basal del modiolo son normales.
Partición incompleta tipo II. A) El gráfico ilustra la confluencia de las espiras media y apical de la cóclea por ausencia de la porción apical del modiolo y del tabique interescalar, dándole al ápex una apariencia quística (flechas). El acueducto vestibular suele estar ensanchado por dilatación del conducto y el saco endolinfáticos (puntas de flecha). B) Imagen transversal de tomografía computarizada (TC) en ventana de hueso. C) Imagen transversal de resonancia magnética (RM) en secuencia eco de gradiente, potenciada en T2, en estado estacionario. En B y C pueden identificarse estos hallazgos: el ápex quístico por fusión de las espiras media y apical (flechas blancas), el acueducto vestibular dilatado en la TC, y la dilatación del conducto y del saco endolinfáticos en la RM (puntas de flecha). D) Reconstrucción sagital oblicua perpendicular al conducto auditivo interno de la secuencia de eco de gradiente, potenciada en T2, en estado estacionario, en la que se observa el nervio coclear de grosor normal (flecha). La parte anterior está marcada con A y la posterior con P. El paciente presentaba otitis media crónica; en B y C se observa la ocupación del oído medio (asterisco).
Se asocia a menudo con el ensanchamiento del acueducto vestibular (por dilatación de conducto y del saco endolinfático)14 y con una mínima dilatación vestibular, constituyendo la tríada de la deformidad de Mondini7.
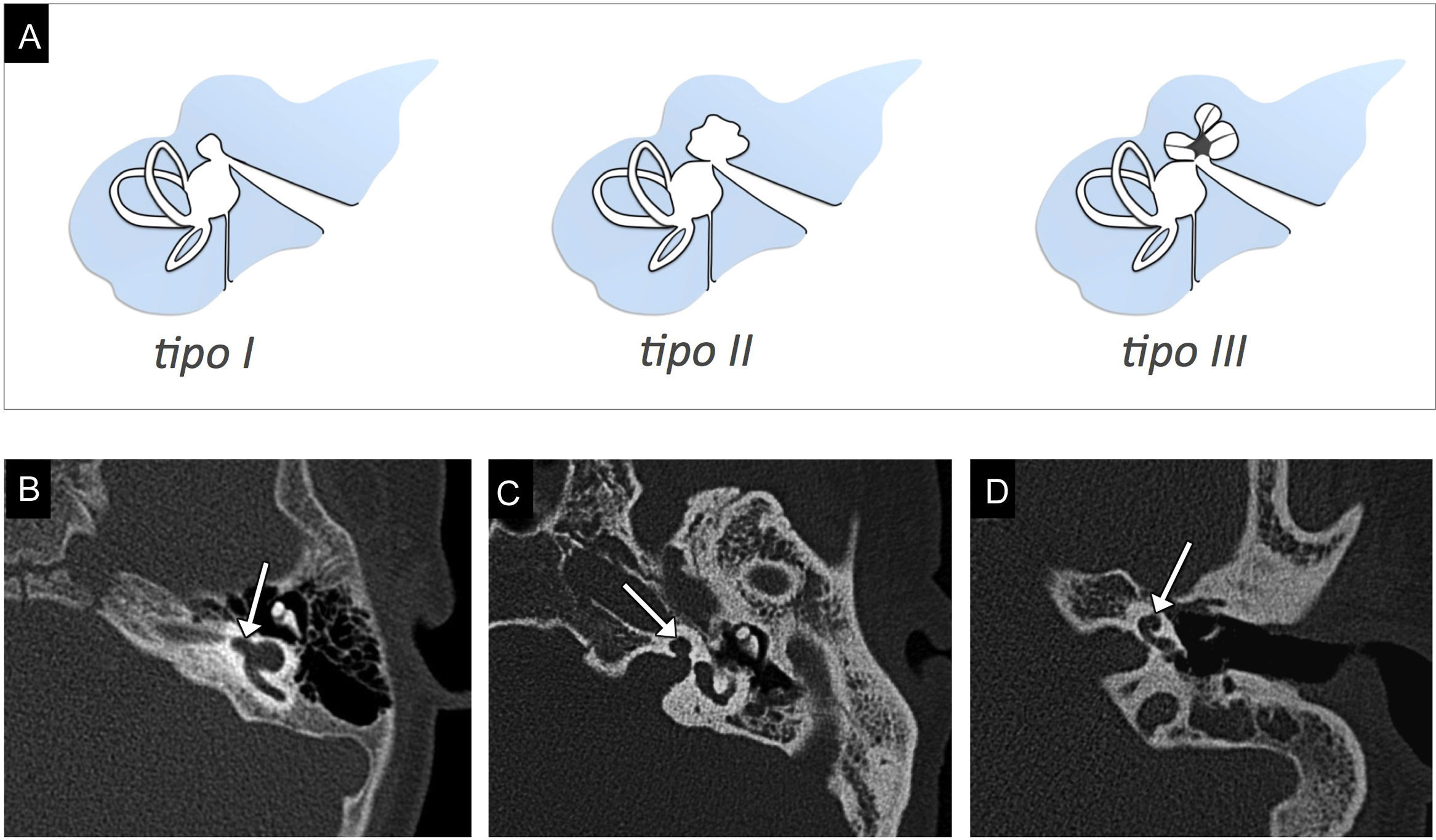
Partición incompleta tipo IIIEs una enfermedad genética de herencia recesiva ligada al cromosoma X y no se debe a la detención del desarrollo de la placoda ótica. Típicamente afecta a los hombres y cursa con hipoacusia mixta rápidamente progresiva15.
Hay una ausencia completa del modiolo, pero el tabique interescalar está presente (fig. 8). La cóclea se localiza directamente lateral al CAI, que está ensanchado, y ambos están ampliamente comunicados por una deficiencia completa de la lámina cribosa15,16.
Partición incompleta tipo III. A) El gráfico representa la cóclea rotada, localizada directamente en el extremo lateral del conducto auditivo interno (CAI), con ausencia completa del modiolo, pero con el tabique interescalar presente. Existe deficiencia de la lámina cribosa, con una amplia comunicación entre el CAI y la cóclea. B) Imagen transversal de tomografía computarizada en ventana de hueso. C) Imagen transversal de resonancia magnética en secuencia eco de gradiente, potenciada en T2, en estado estacionario. En B y C se observa la rotación de la cóclea (flecha curvada, indicando el sentido de rotación) directamente lateral al CAI, que muestra una ausencia completa del modiolo (asterisco), pero el tabique interescalar está presente (puntas de flecha). En C se identifica el nervio coclear de grosor normal (flecha).
Se debe a la detención del desarrollo a lo largo de la sexta semana de gestación4. Las dimensiones de la cóclea son menores, pero existe una buena diferenciación entre ella y el vestíbulo. En caso de falta de experiencia pueden hacerse mediciones para facilitar su detección17.
Es un término genérico y deben distinguirse tres subtipos (fig. 9):
- •
Tipo I, «yema» de cóclea: la cóclea es como una pequeña excrecencia que surge del vestíbulo, sin ninguna arquitectura interna y con ausencia total del modiolo y del tabique interescalar.
- •
Tipo II, cóclea hipoplásica quística: la cóclea es de dimensiones reducidas, sin modiolo ni tabique interescalar, pero su estructura externa es normal. Presenta una amplia comunicación con el CAI, lo que predispone a un mayor riesgo de complicaciones durante la cirugía. El acueducto vestibular suele estar ensanchado y el vestíbulo se encuentra ligeramente dilatado7.
- •
Tipo III, cóclea con menos de dos vueltas: la cóclea presenta menos de dos vueltas, el modiolo es más pequeño y el tabique interescalar es más corto, pero su arquitectura externa e interna es normal. El vestíbulo y los canales semicirculares suelen ser hipoplásicos7.
Hipoplasia coclear. A) El gráfico ilustra los tres tipos de hipoplasia coclear: I, tipo «yema», como una pequeña excrecencia que surge del vestíbulo; II, hipoplásica quística, de arquitectura externa normal, pero de dimensiones pequeñas y sin arquitectura interna por ausencia de modiolo y de tabique interescalar; III, menos de dos vueltas, con arquitectura externa e interna normal, pero el modiolo y el tabique interescalar son más cortos, lo que condiciona una cóclea con menos de dos vueltas. B) Imagen transversal de tomografía computarizada (TC) en ventana de hueso que muestra una cóclea hipoplásica tipo «yema», que surge del vestíbulo como una pequeña excrecencia (tipo I). C) Imagen transversal de TC en ventana de hueso que muestra una cóclea hipoplásica quística, de arquitectura externa normal, pero de dimensiones reducidas y sin arquitectura interna (tipo II). D) Imagen transversal de TC en ventana de hueso que muestra una cóclea hipoplásica con menos de dos vueltas (tipo III).
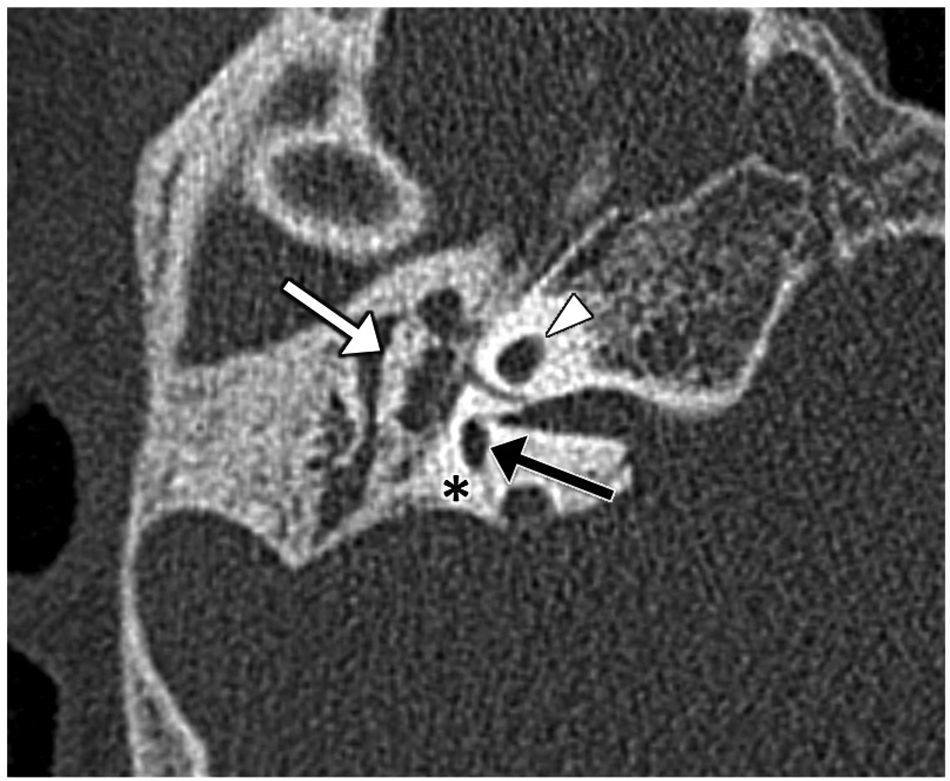
Su etiología es controvertida; podría deberse a una alteración del desarrollo posnatal18. Se trata del ensanchamiento del acueducto vestibular de forma aislada por el crecimiento anormal del conducto y del saco endolinfáticos, siendo el resto del laberinto normal (fig. 10). El acueducto se considera ensanchado cuando su calibre es mayor de 0,8mm en su punto medio en un plano oblicuo a 45° (plano de Pöschl)19.
Síndrome del acueducto vestibular dilatado. A) Imagen transversal de tomografía computarizada en ventana de hueso en la que se observa un ensanchamiento del acueducto vestibular (flecha blanca); es útil tomar como referencia el calibre del canal semicircular superior como límite alto de la normalidad (punta de flecha). B) Imagen transversal de resonancia magnética en secuencia eco de gradiente, potenciada en T2, en estado estacionario, en la que se observa la dilatación del ducto y saco endolinfáticos (flecha blanca), y el canal semicircular posterior como referencia (punta de flecha). La cóclea y el resto del oído interno son normales (flecha negra en A y B).
Se deben a alteraciones del desarrollo entre las semanas 6 y 22 de gestación4. De forma aislada no tienen relevancia en el estudio preimplante coclear; su importancia radica en la fuerte asociación con otras malformaciones del OI y algunos síndromes. La displasia del vestíbulo y del canal semicircular lateral es una de las más frecuentes, y consiste en un canal semicircular lateral corto y ancho fusionado o separado mediante un pequeño islote óseo al vestíbulo, de aspecto globuloso9 (fig. 11). Existe una muy fuerte asociación entre la aplasia de los canales semicirculares y el síndrome de CHARGE20 (fig. 12).
Malformación vestibular. Imagen transversal de tomografía computarizada en ventana de hueso en un paciente con síndrome de CHARGE que muestra hipoplasia del vestíbulo (flecha negra) y aplasia de los canales semicirculares (asterisco). Presenta hipoplasia coclear de tipo II (punta de flecha) y displasia de la cadena osicular fusionada (flecha blanca). El síndrome de CHARGE es una enfermedad genética poliformativa cuyo acrónimo hace referencia a Coloboma ocular, cardiopatía (Heart), Atresia de las coanas, Retraso del crecimiento o del desarrollo, Hipoplasia genital y anomalías del pabellón auricular y sordera (Ear).
La TC y la RM desempeñan un papel crucial en la caracterización de las malformaciones del OI y en la valoración de las estructuras anatómicas que permitirán seleccionar el tratamiento y el abordaje idóneos. Es necesaria la utilización de un sistema de clasificación universal común con los clínicos que permita determinar la asociación entre los diferentes tipos de malformación y su pronóstico clínico. En este trabajo se ha descrito cada tipo de malformación, ilustrando y detallando de forma concisa los hallazgos radiológicos clave.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia
Autoría- 1.
Responsables de la integridad del estudio: MM y EP.
- 2.
Concepción del artículo: MM, EP, AMF, JCP y FME.
- 3.
Diseño del artículo: MM y EP.
- 4.
Obtención de los datos: MM, EP, AMF, JCP y FME.
- 5.
Análisis e interpretación de los datos: No procede.
- 6.
Tratamiento estadístico: No procede.
- 7.
Búsqueda bibliográfica: MM, EP, AMF, JCP y FME.
- 8.
Redacción del trabajo: MM y EP.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: MM, EP, AMF, JCP y FME.
- 10.
Aprobación de la versión final: MM, EP, AMF, JCP y FME.
Los autores declaran no tener ningún conflicto de intereses.