Una de las consecuencias derivadas del uso creciente de las técnicas de diagnóstico por imagen ha sido el notable incremento en la detección de masas renales pequeñas que presumiblemente corresponden a tumores localizados, potencialmente curables con tratamiento quirúrgico.
Ante el hallazgo de una masa renal pequeña incidental se deben plantear varias cuestiones: si es un tumor; si es benigno o maligno y si es maligno a qué subtipo pertenece, y finalmente cómo debe ser manejado, si con tratamiento quirúrgico, con técnicas ablativas o, por el contrario, con actitud expectante mediante vigilancia activa.
En la actualidad, las masas renales pequeñas constituyen una nueva entidad clínica de manejo diferente al establecido hasta ahora para los carcinomas de células renales clásicos. En este escenario, los radiólogos tienen que asumir su importante papel, ya que están implicados en todos los aspectos del manejo de estos tumores, incluido el diagnóstico, el tratamiento y el seguimiento.
One of the consequences of the growing use of diagnostic imaging techniques is the notable growth in the detection of small renal masses presumably corresponding to localized tumors that are potentially curable with surgical treatment.
When faced with the finding of a small renal mass, radiologists must determine whether it is benign or malignant, and if it is malignant, what subtype it belong to, and whether it should be managed with surgical treatment, with ablative techniques, or with watchful waiting with active surveillance.
Small renal masses are now a clinical entity that require management different from the approaches used for classical renal cell carcinomas. In this scenario, radiologists are key because they are involved in all aspects of the management of these tumors, including in their diagnosis, treatment, and follow-up.
La incidencia de carcinoma de células renales (CCR) ha experimentado un incremento anual de un 2-3% a expensas de las masas renales pequeñas (MRP) que representan entre el 48% y el 66%1. Un gran número de estas MRP tratadas carecen de potencial maligno, lo que puede conllevar un sobrediagnóstico y sobretratamiento de este tipo de tumores2,3.
Sorprende que este cambio hacia un diagnóstico en etapa más temprana, con tumores en estadio T1a de pronóstico excelente y supervivencia a los 5 años superior al 95%, no haya tenido impacto en el porcentaje de mortalidad. La mortalidad por CCR permanece estable4,5.
Por lo tanto, no puede justificarse el manejo quirúrgico tradicional de este tipo de tumores con nefrectomía radical, y se hace necesario tanto intentar diagnosticar aquellas MRP más agresivas como el empleo de nuevas modalidades terapéuticas menos radicales.
En esta actualización se comentarán aspectos tanto de la historia natural, como del diagnóstico y posibilidades de tratamiento de los tumores renales sólidos (excluyendo las lesiones quísticas) de pequeño tamaño.
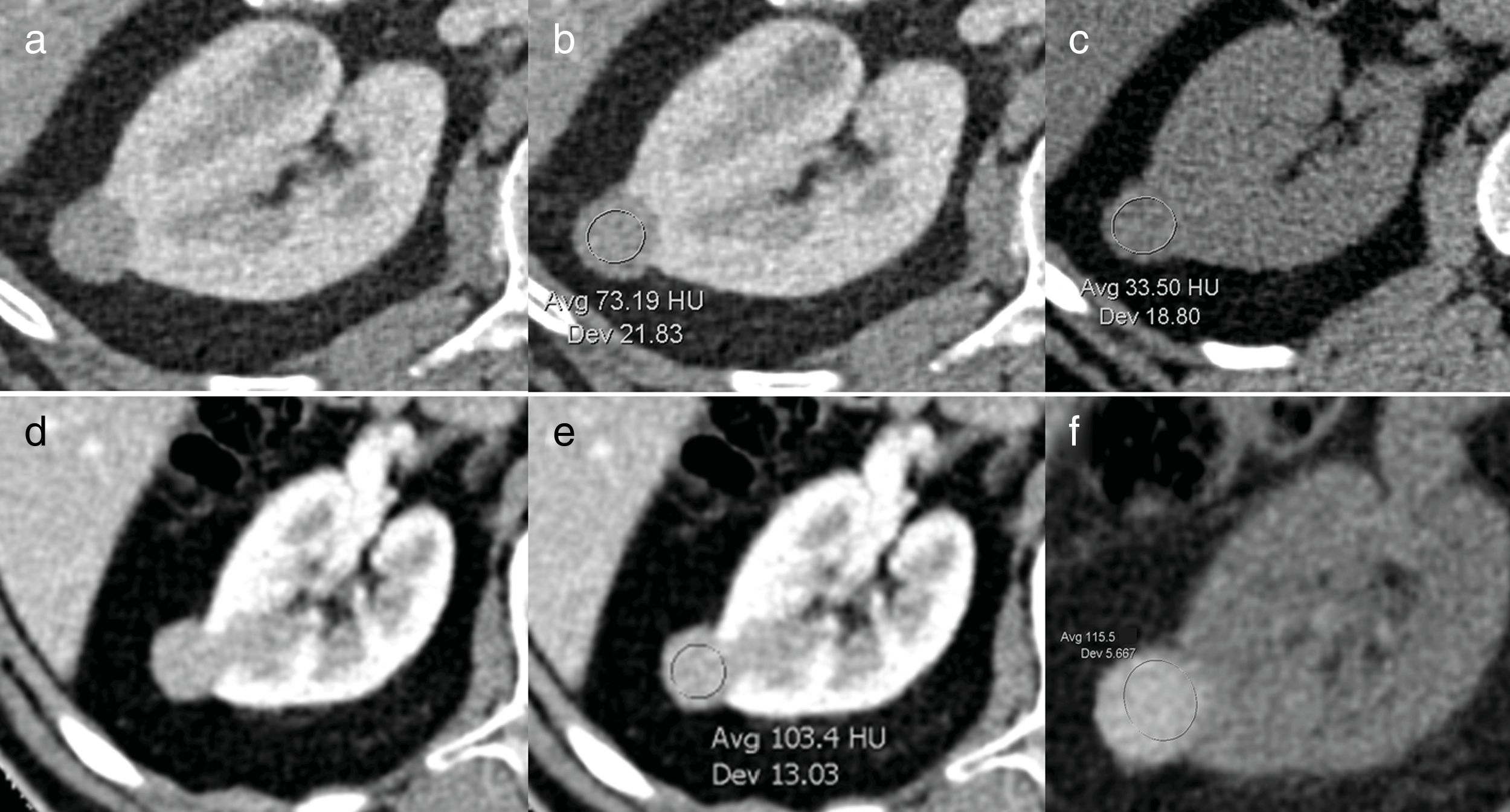
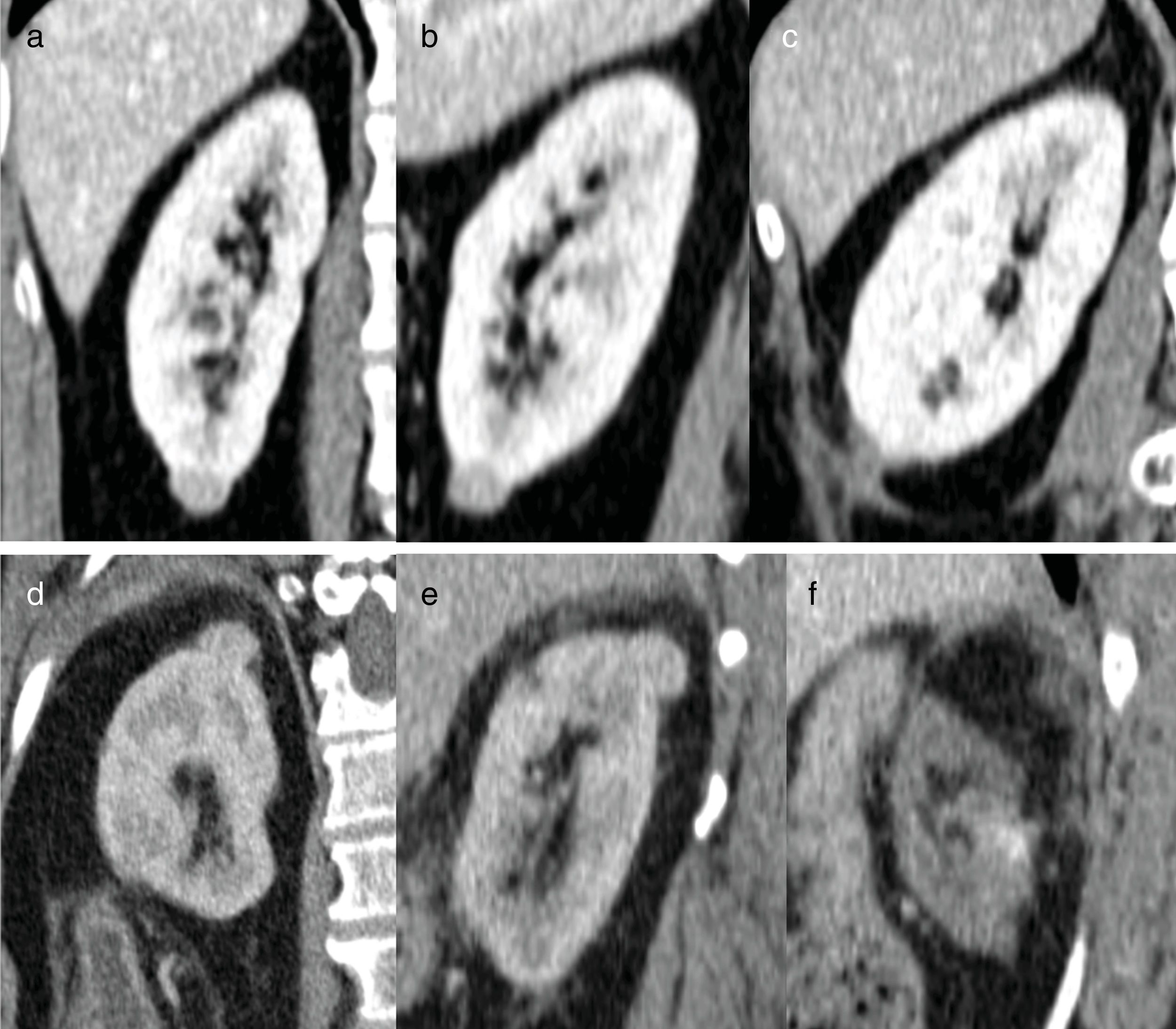
DefiniciónSe define como MRP cualquier lesión sólida de un tamaño igual o inferior a 4cm. Como lesión sólida se entiende cualquier lesión que capta contraste en estudios de tomografía computarizada (TC), comparando la densidad antes y después de la administración de contraste intravenoso (fig. 1). Se considera que un realce igual o superior a 20 unidades Hounsfield (UH) es suficiente para confirmar la naturaleza sólida de una lesión renal; sin embargo, este umbral, que es muy específico, tiene una baja sensibilidad. A la hora de valorar el realce de una lesión, hay que tener en cuenta dos aspectos: 1) el fenómeno de seudorrealce y 2) el porcentaje, no despreciable, de CCR que muestran escaso realce.
Masa renal pequeña (A-C) y quiste hemorrágico (D-F). En el estudio con contraste, ambas lesiones son densas (A y B: 74 UH y D y E: 103 UH). Para confirmar si se trata de una lesión sólida hay que realizar un estudio basal sin contraste (C y F) y medir la captación: si realza más de 20 UH se asume que es sólida. La lesión superior capta, pasa de 33 UH en el estudio basal (C) a 74 UH en el estudio con contraste (B); en la cirugía se confirmó un carcinoma papilar de tipo 2. La lesión inferior no capta, no hay variación entre el estudio basal (F): 115 UH y el estudio con contraste (E): 103 UH, corresponde a un quiste hemorrágico.
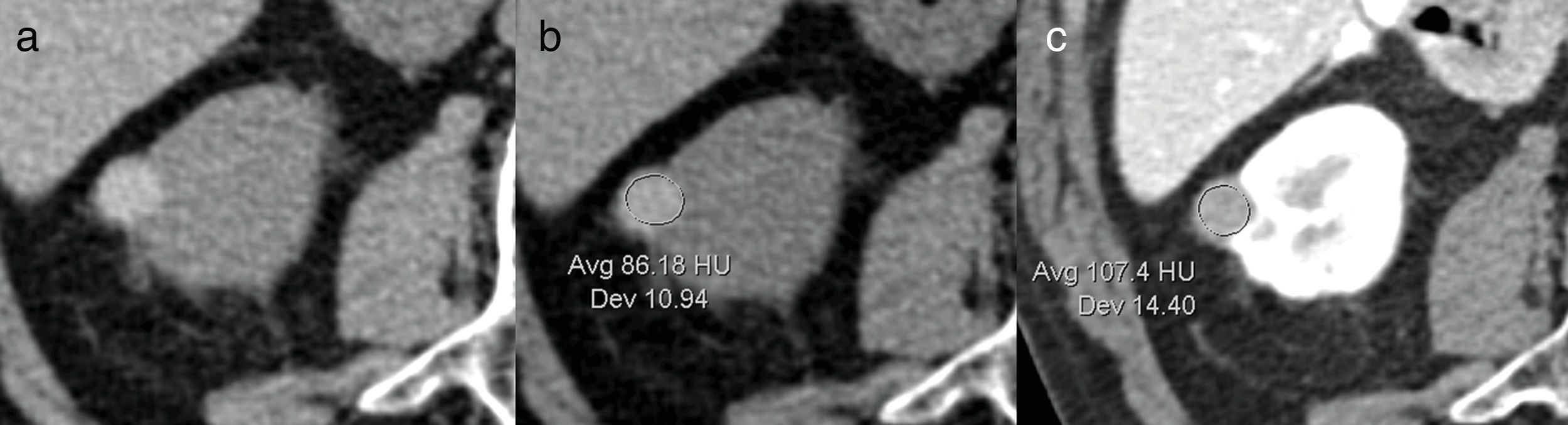
1. El fenómeno de seudorrealce (fig. 2) se refiere a un incremento artificial en la densidad de una lesión en el estudio con contraste que nos puede llevar a clasificar, erróneamente, como masa sólida un quiste6,7. El seudorrealce tiende a ocurrir sobre todo en lesiones endofíticas pequeñas8.
Fenómeno de seudorrealce. A y B) Tomografía computarizada basal donde claramente se ve un pequeño quiste hemorrágico en el riñón derecho, con densidad de 86 UH. En el estudio con contraste (C) mide 107 UH; se ha producido un incremento artificial de la densidad que se conoce como fenómeno de seudorrealce.
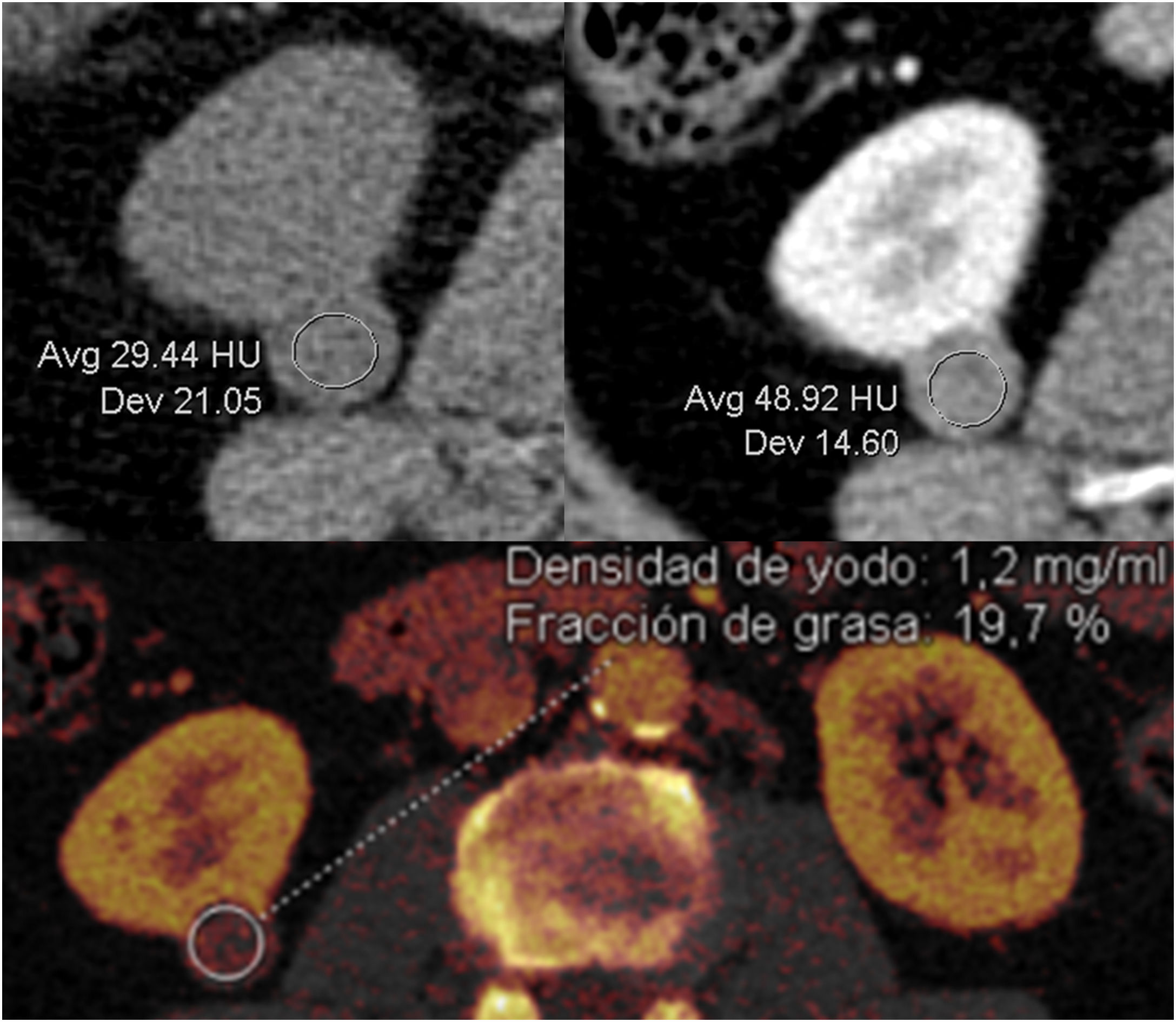
Recientemente se ha postulado que los equipos de TC con energía dual, mediante el empleo de las imágenes monoenergéticas o de los mapas de iodo, mejora la seguridad diagnóstica en el estudio de lesiones renales, ya que no es tan sensible al fenómeno de seudorrealce8,9. Asimismo, el análisis de la cuantificación de la concentración de yodo parece que puede ser útil10,11 cuando la captación es indeterminada o equívoca (fig. 3), aunque se necesitan más estudios que lo corroboren. Por otra parte, los estudios con energía dual permiten obtener imágenes “sin contraste virtual” a partir del estudio con contraste, evitando la adquisición basal sin contraste, con la consiguiente reducción de la dosis de radiación.
Cuantificación de la captación de iodo. Masa renal pequeña de 1,6cm en riñón derecho con poca captación de contraste. En la tomografía computarizada (TC) basal (imagen superior izquierda), la densidad es de 29 UH. En la TC con contraste (imagen superior derecha) es de 48 UH. La TC con energía dual (imagen inferior) permite cuantificar la captación de iodo (1,2mg/ml) y confirmar que corresponde a un tumor. Se establece como posible valor de corte una concentración de iodo mayor de 0,5mg/ml11. La anatomía patológica informa de carcinoma papilar.
Ante la sospecha de seudorrealce se deben emplear otros métodos de imagen, como la ecografía con contraste o la resonancia magnética (RM) para confirmar la naturaleza sólida de la lesión antes de realizar biopsia7,8,12.
2. Una minoría de MRP no alcanzan el umbral de realce de 20 UH, por lo que puede interpretarse erróneamente como quiste denso. La mayoría de las MRP que se encuentran por debajo de estos umbrales son CCR papilares (CCRp). La combinación de imágenes en fase corticomedular y nefrográfica mejora la sensibilidad de la TC para confirmar la naturaleza sólida de una MRP13.
Historia naturalNo todas las MRP son iguales. El 80% representan tumores malignos y aproximadamente el 20% son benignos, habitualmente oncocitomas, angiomiolipomas (AML) pobres en grasas y adenomas papilares14. Dentro de los malignos, un alto porcentaje (60-70%) son de bajo grado y muy raramente metastatizan: se habla de lesiones indolentes. Entre el 20% y el 30% son tumores potencialmente agresivos, con un 15-35% de alto grado, un 10-40% localmente avanzados y un 3-12% tienen metástasis sincrónicas15,16.
Hay varios subtipos de CCR: el CCRp, el cromófobo (CCRcro) y el de células claras (CCRcc). El CCRp y CCRcro tienen un grado celular y estadio patológico más bajo, así como menor riesgo de metástasis. La supervivencia a los 5 años es del 43-83% para los CCRcc, entre el 61-90% para el CCRp y entre el 80-100% para el CCRcro17.
El tamaño inicial de las MRP se correlaciona con el riesgo de malignidad y la probabilidad de malignidad es proporcional al tamaño de la lesión. Se ha calculado que por cada centímetro de incremento en el tamaño del tumor aumenta un 16% las probabilidades de malignidad18. La invasión local también aumenta con el tamaño de la lesión15, así como las metástasis a distancia19, aunque la posibilidad de desarrollar enfermedad metastásica es baja, inferior al 2%.
El crecimiento de una MRP se relaciona con el tamaño del tumor: a mayor tamaño inicial más rápido crecimiento. Mason et al.20 observan que las masas menores de 2,45cm crecen a un ritmo de 0,13cm/año, mientras que aquellas mayores o iguales a 2,45cm al diagnóstico crecen significativamente más rápido, a 0,40cm/año. El tamaño del tumor en el momento del diagnóstico podría ser una de las variables utilizadas para estratificar razonablemente el manejo de estos pacientes.
De los diferentes parámetros estudiados para prever el potencial maligno de una MRP, la tasa de crecimiento rápido es el que mejor lo predice, mejor incluso que parámetros como el tamaño inicial21. Las MRP que progresan a metástasis muestran un grado de crecimiento que dobla el grado de crecimiento de las que no progresan y, además, también se ha visto que durante la vigilancia activa ninguna de las MRP con crecimiento cero desarrollan metástasis22.
Sin embargo, la ausencia de crecimiento no necesariamente implica ausencia de malignidad, y además no hay diferencias significativas en el grado de crecimiento entre las MRP benignas y malignas23. No se ha encontrado ningún predictor de crecimiento ni clínico ni radiológico para identificar la progresión24.
DiagnósticoAnte el hallazgo de una MRP incidental hay que confirmar que verdaderamente se trata de un tumor y descartar lesiones que pueden simular masa renal, como el absceso, la pielonefritis focal, el infarto y el hematoma. Es fundamental la historia clínica y en caso de duda el control evolutivo.
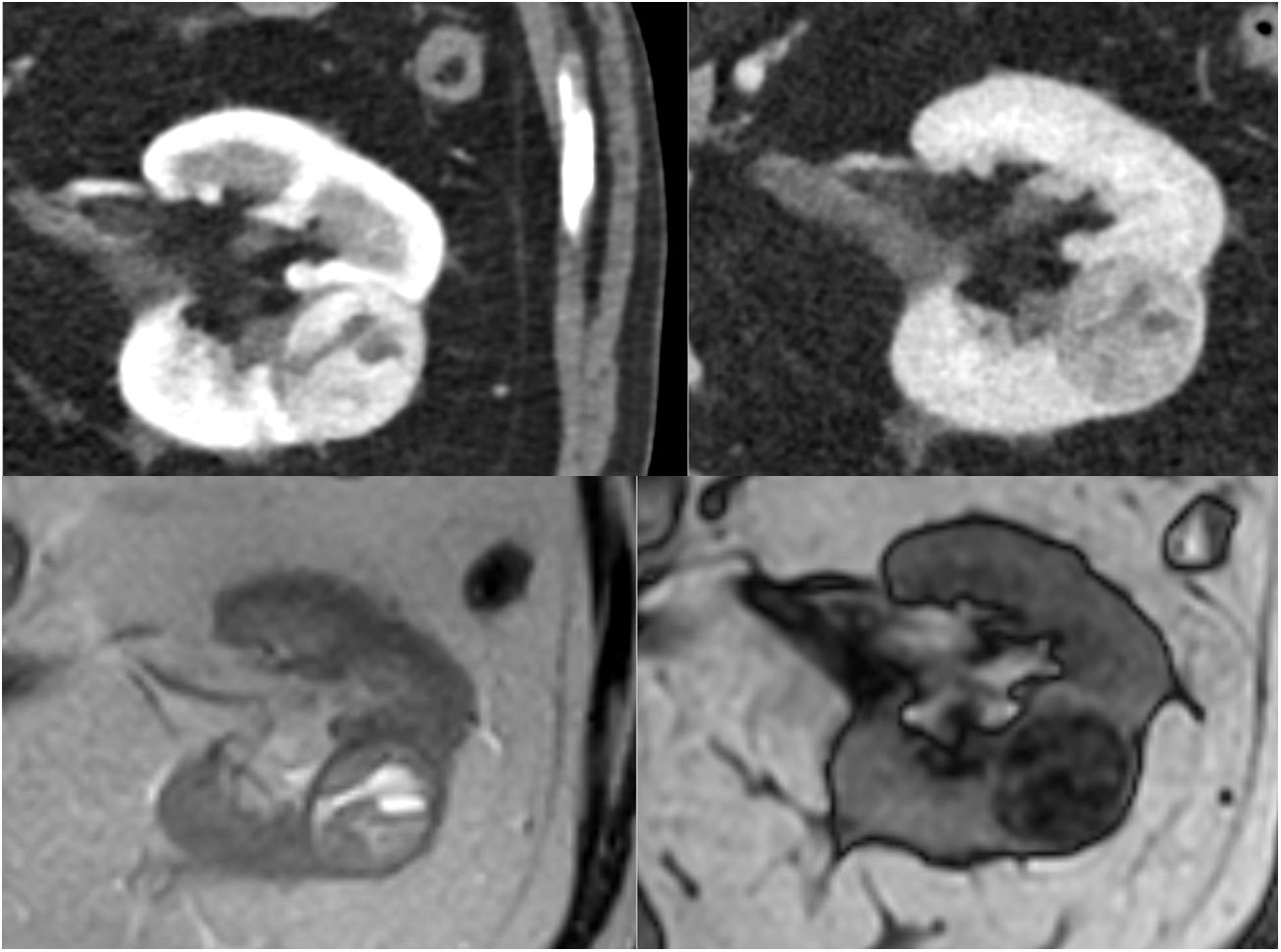
Una vez que se asume que se trata de un tumor renal hay que distinguir si es benigno o maligno7. Entre los tumores benignos se deben considerar el AML y el oncocitoma. La presencia de grasa (densidad <-20 UH) es diagnóstico de AML, aunque hasta un 5% de los AML son pobres en grasa y difíciles de diferenciar del CCR. El estudio sin contraste es preferible a la fase nefrográfica para el diagnóstico de los AML. A pesar de los estudios iniciales, parece ser que la caída de la intensidad de señal en fase opuesta para diferenciar los AML pobres en grasa del CCRcc es poco útil, y se ha visto que la baja intensidad de señal en T2 combinada con el intenso realce temprano con el contraste y el lavado precoz ofrecen mejor seguridad diagnóstica para diferenciar los AML pobres en grasa25. En el caso de los oncocitomas se han descrito como hallazgos típicos la cicatriz central, la inversión segmentaria del realce y la isodensidad en la fase corticomedular; sin embargo, no existe ningún patrón característico26.
Si es maligno hay que establecer el diagnóstico diferencial con otras lesiones malignas como el tumor urotelial, el linfoma y las metástasis de pulmón, melanoma y mama como primarios más frecuentes. Tanto en el linfoma como en las metástasis, las lesiones renales suelen ser múltiples y en el contexto de una extensa afectación sistémica.
Y, por último, si fuera posible, distinguir entre los subtipos histológicos. El CCRcc es el más frecuente (75-80%) y el que metastatiza más a menudo, seguido entre el 10% y el 15% del CCRp tipo 1 y tipo 2 (peor pronóstico) más hipovascular y del CCRcro (5%) más homogéneo y circunscrito, donde es raro encontrar la típica cicatriz central al tratarse de tumores pequeños.
Se han empleado numerosas estrategias de imagen en TC27 y RM28 y se han estudiado numerosos signos radiológicos29,30, para intentar diferenciar de forma no invasiva entre AML pobres en grasa, oncocitomas y CCR, con gran solapamiento de los hallazgos. Como herramienta prometedora no invasiva se ha evaluado el análisis de la textura en TC para distinguir entre los subtipos de CCR y oncocitoma31 con resultados prometedores.
Sin bien todos estos enfoques son halagüeños, siguen siendo subóptimos y las modalidades de imagen actuales no nos permiten distinguir de manera fehaciente entre MRP benignas y malignas, ni se pueden utilizar para diferenciar entre biología tumoral indolente y agresiva, ni para identificar los subtipos histológicos (fig. 4). La especificidad para distinguir MRP malignas de las benignas en la práctica clínica es inferior al 50%32 (fig. 5).
Diferentes subtipos histológicos de carcinoma de células renales (CCR) con semiología similar. Se muestran tres casos diferentes de CCR en fase corticomedular (A, C y E) y en fase nefrográfica (B, D y F). La imagen superior (A y B) corresponde a un CCR cromófobo. La imagen del medio (C y D), a un CCR papilar de tipo 1, y la imagen inferior (E y F), a un CCR de células claras.
Masas renales pequeñas (MRP), benigna y maligna, no distinguibles en imagen. Imagen superior: MPR en el polo inferior del riñón derecho en un varón de 48 años, en coronal (A) y en sagital (B). Tras nefrectomía parcial (C) se confirmó carcinoma de células renales subtipo células claras grado 3 de Fuhrman. Imagen inferior: MRP en polo superior del riñón derecho en un varón de 82 años, en coronal (D) y en sagital (E); tras nefrectomía parcial (F) la anatomía patológica reveló un oncocitoma. Hubo complicación mayor tras la cirugía con infarto renal y atrofia secundaria (F).
La ecografía es una técnica de imagen explorador/paciente dependiente con sensibilidad paralela al tamaño del tumor. En los últimos años, la ecografía con contraste (CEUS) ha demostrado tener un papel muy importante en el diagnóstico y en el diagnóstico diferencial entre MRP benigna y maligna, con una efectividad similar a la de la TC multidetector33. La CEUS puede ser más sensible que la TC en los tumores hipovasculares como los CCRp34 y es fundamental para caracterizar lesiones previamente indeterminadas35,36.
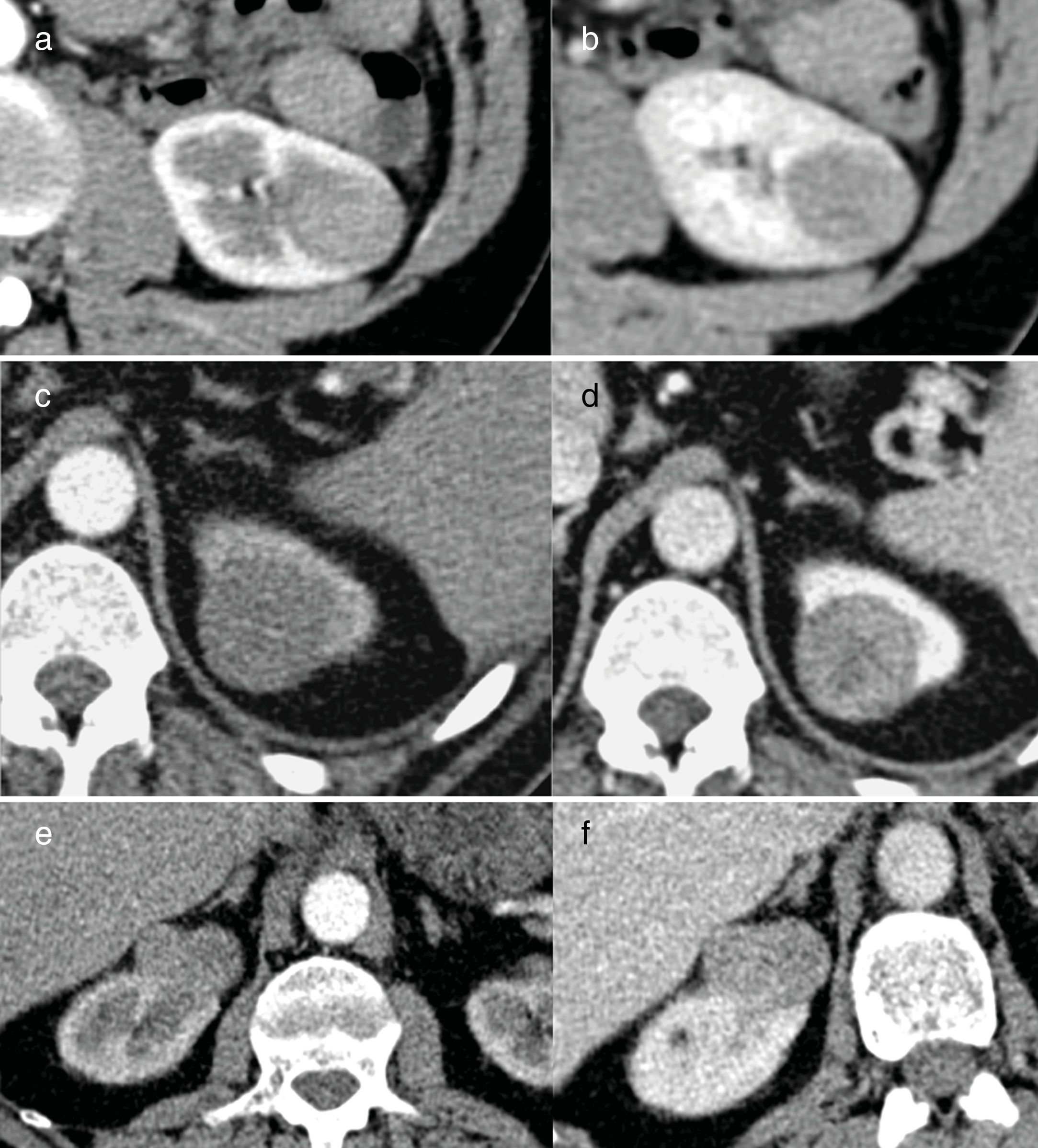
La TC es el patrón de referencia para la detección, caracterización y estadificación de las MRP con una sensibilidad del 94%. Es muy importante el empleo de un protocolo multifase que debe incluir siempre una fase basal sin contraste, esencial para detectar grasa y calcificaciones y para disponer de una medida de la densidad basal, y una fase nefrográfica a los 90-120 s de la administración de contraste, donde el realce del parénquima es homogéneo, lo que va a permitir identificar lesiones que pueden pasar desapercibidas en la fase corticomedular27. Las fases corticomedular y excretora pueden ser útiles para diferenciar los subtipos de CCR, para el diagnóstico diferencial con los tumores uroteliales y para valorar la potencial afectación del sistema colector. El subtipo CCRcc tiene un pico de realce que ocurre en la fase corticomedular y es similar o mayor que la del córtex renal. La variante papilar casi siempre es hipovascular durante la fase corticomedular, mientras que el pico de realce ocurre durante la fase nefrográfica. El CCRcro tiende a ser menos vascular que el CCRcc y muestra un grado de realce intermedio durante la fase corticomedular6. La reconstrucción de la imagen debe ser menor de 2-3mm, con solapamiento del 50% para minimizar el efecto de volumen parcial y conseguir adquisiciones multiplanares sin artefactos.
La RM es la técnica de elección cuando los hallazgos en la TC (fig. 6) o ecografía no son concluyentes o si hay alergia al iodo. Los CCRcc habitualmente tienen hiperintensidad de señal en T2 e intenso realce durante la fase corticomedular; por el contrario, los CCRp muestran más a menudo baja intensidad de señal en T2. El CCRcro manifiesta patrones de intensidad de señal variables y pueden aparecer hipo o hiperintensos en T26,26. Los tumores papilares frecuentemente evidencian marcada restricción en la difusión comparados con los CCRcc37.
Angiomiolipoma pobre en grasa. Imagen superior: tomografía computarizada (TC) en fase corticomedular (izquierda) y en fase nefrográfica (derecha). Imagen inferior: resonancia magnética (RM) en fase (izquierda) y en fase opuesta (derecha). En la TC se objetiva una masa renal pequeña de 3,3cm en la valva posterior del riñón izquierdo sin grasa medible. En la RM, la tumoración pierde señal fuera de fase, lo que indica contenido graso compatible con angiomiolipoma.
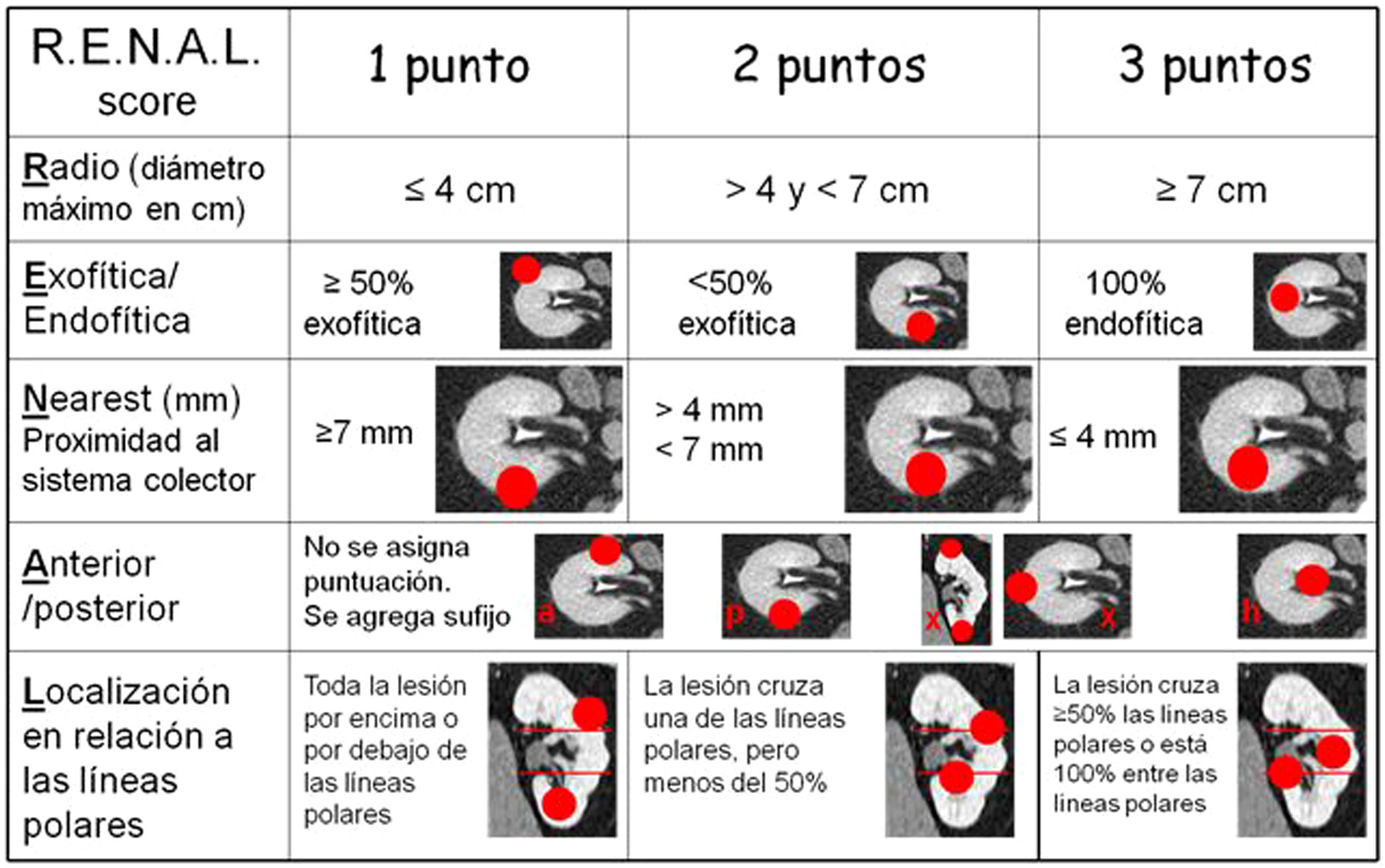
Con el fin de estimar el grado de dificultad quirúrgica, se han desarrollado varios sistemas de puntuación nefrométricos que de forma fácil y objetiva nos permiten cuantificar la complejidad de un tumor renal. Es importante que el radiólogo se familiarice con este sistema de puntuación y lo incluya en sus informes, ya que ofrece información muy completa a los urólogos para la selección de la técnica quirúrgica. Se han descrito tres sistemas de puntuación nefrométricos38: el R.E.N.A.L. score (RS), el PADUA (preoperative aspects and dimensions used for anatomic classification) basado, al igual que el RS, en las características anatómicas del tumor, y el Centrality Index (C-Index) que estima la centralidad del tumor mediante un cálculo matemático dividiendo la distancia entre el centro del tumor y el del riñón por el radio tumoral. Aunque los tres intentan ayudar en la toma de decisiones antes de la cirugía, el RS es el que mejor cuantifica objetivamente la complejidad quirúrgica tumoral39.
El RS valora cinco características (tabla 1). Cada uno de los ítems se puntúa en una escala del 1 al 3 y la suma determina la complejidad quirúrgica. Entre 4 y 6 puntos, se habla de baja complejidad; entre 7 y 9 puntos, de complejidad moderada; y por encima de 10, de alta complejidad (fig. 7).
Sistema de puntuación R.E.N.A.L.*
Se basa en cinco características de la anatomía del tumor sobre una imagen axial o coronal. La R representa el diámetro máximo del tumor en centrímetros (en el caso de las MRP, por definición será siempre menor o igual a 4cm). La E refleja la proporción de la lesión respecto al contorno renal: por fuera (exofítico) o por dentro (endofítico). La N describe la proximidad del tumor al sistema colector y se mide en milímetros. La A indica la localización anterior (a) o posterior (p) y no se le asigna puntuación. Si es puramente central o lateral o apical se le atribuye la letra x, y a las lesiones que improntan la vena o arteria renal, la letra h. La L define la localización del tumor en relación con las líneas polares superior e inferior, delimitadas por el pedículo vascular renal. Nota: La herramienta web para su utilización se puede encontrar en https://www.mdcalc.com/renal-nephrometry-score.
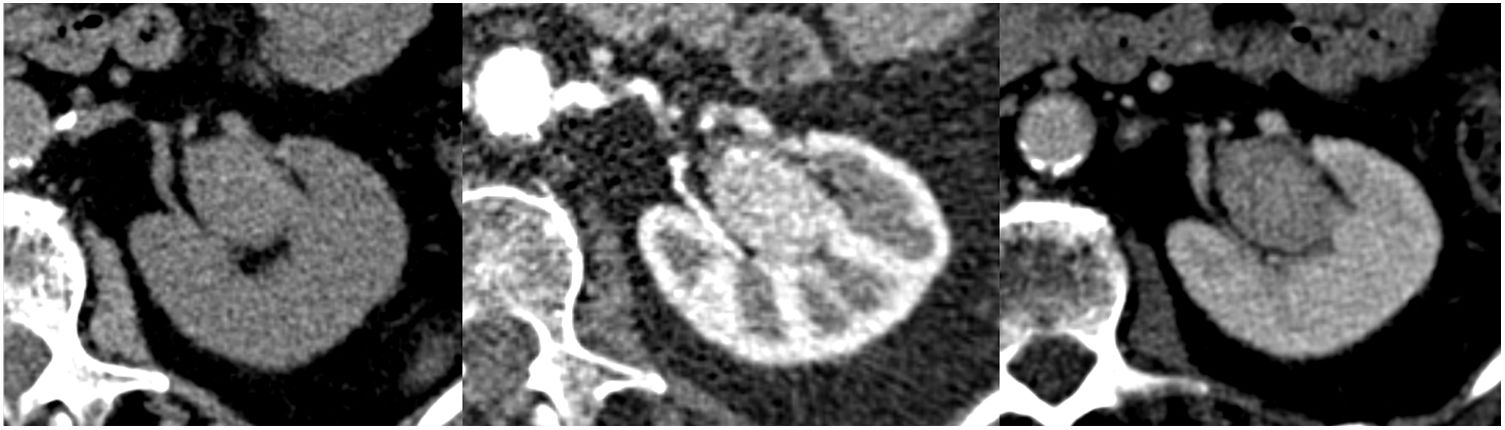
Masa renal pequeña (MRP) con alta complejidad quirúrgica. MRP en hilio renal derecho sin contraste (imagen izquierda), en fase corticomedular (imagen del medio) y en fase nefrográfica (imagen derecha). Puntuación nefrométrica (RS): 1+3+3+h+3=10 h. Al tratarse de un tumor de alta complejidad quirúrgica con localización hiliar, se realizó nefrectomía radical con el resultado de carcinoma de células renales, variante cromófoba, grado II de Fuhrman.
El incremento en el RS y los tumores de localización posterior se asocian a mayores complicaciones postoperatorias. Se ha investigado si cambios en la puntuación del RS en pacientes en vigilancia activa (VA) pueden predecir el grado de malignidad o agresividad, pero no se ha encontrado relación significativa y en la actualidad este enfoque es inadecuado para la toma de decisiones40.
BiopsiaLos tumores renales son de los pocos tumores del organismo que se tratan sin un diagnóstico previo de certeza. Se estima que cada año se extirpan alrededor de 6.000 masas renales benignas41.
En una revisión de la bibliografía42, de un total de 20 estudios con 2.979 pacientes y 3.113 biopsias se concluye que la biopsia renal tiene una excelente especificidad (96,2%), sensibilidad (97,5%) y alto valor predictivo positivo (99,8%), lo que indica una alta precisión diagnóstica. Sin embargo, la utilidad clínica de la biopsia renal es limitada, con un porcentaje significativo de casos no diagnósticos (14-15%), un bajo valor predictivo negativo (63%) que implica que una biopsia benigna no siempre conlleva ausencia de cáncer, una infraestimación del grado de Fuhrman43 y un solapamiento de los hallazgos histológicos entre oncocitoma y CCRcro44. La sensibilidad de la biopsia disminuye a medida que decrece el tamaño de la masa45.
La biopsia repetida establece el diagnóstico en el 80% de pacientes con resultado inicial no diagnóstico, y la biopsia con aguja gruesa es más sensible (97,5%) y específica (96,2%) que la punción aspirativa con aguja fina42.
Los riesgos, aunque infrecuentes, no son despreciables. El hematoma es la complicación más frecuente (4%), seguido del dolor clínicamente significativo (1,2%); la hematuria macroscópica, el neumotórax y la hemorragia son eventos más raros.
La biopsia renal percutánea se recomienda para la caracterización de las MRP cuando el resultado puede alterar el manejo46. Sí está indicada en pacientes mayores con comorbilidades, cuando existen dudas terapéuticas entre cirugía, ablación o vigilancia activa; antes de la realización de tratamiento ablativo (fig. 8); en pacientes con otro tumor primario para diferenciar MRP de metástasis; en caso de tumores sincrónicos múltiples; ante la sospecha de linfoma o incluso para descartar la etiología infecciosa de una MRP47. La biopsia no está indicada en pacientes jóvenes, en pacientes sanos, en aquellos que no están dispuestos a aceptar la incertidumbre que supone la espera y en pacientes mayores o con alto riesgo quirúrgico donde solo se contempla el tratamiento conservador.
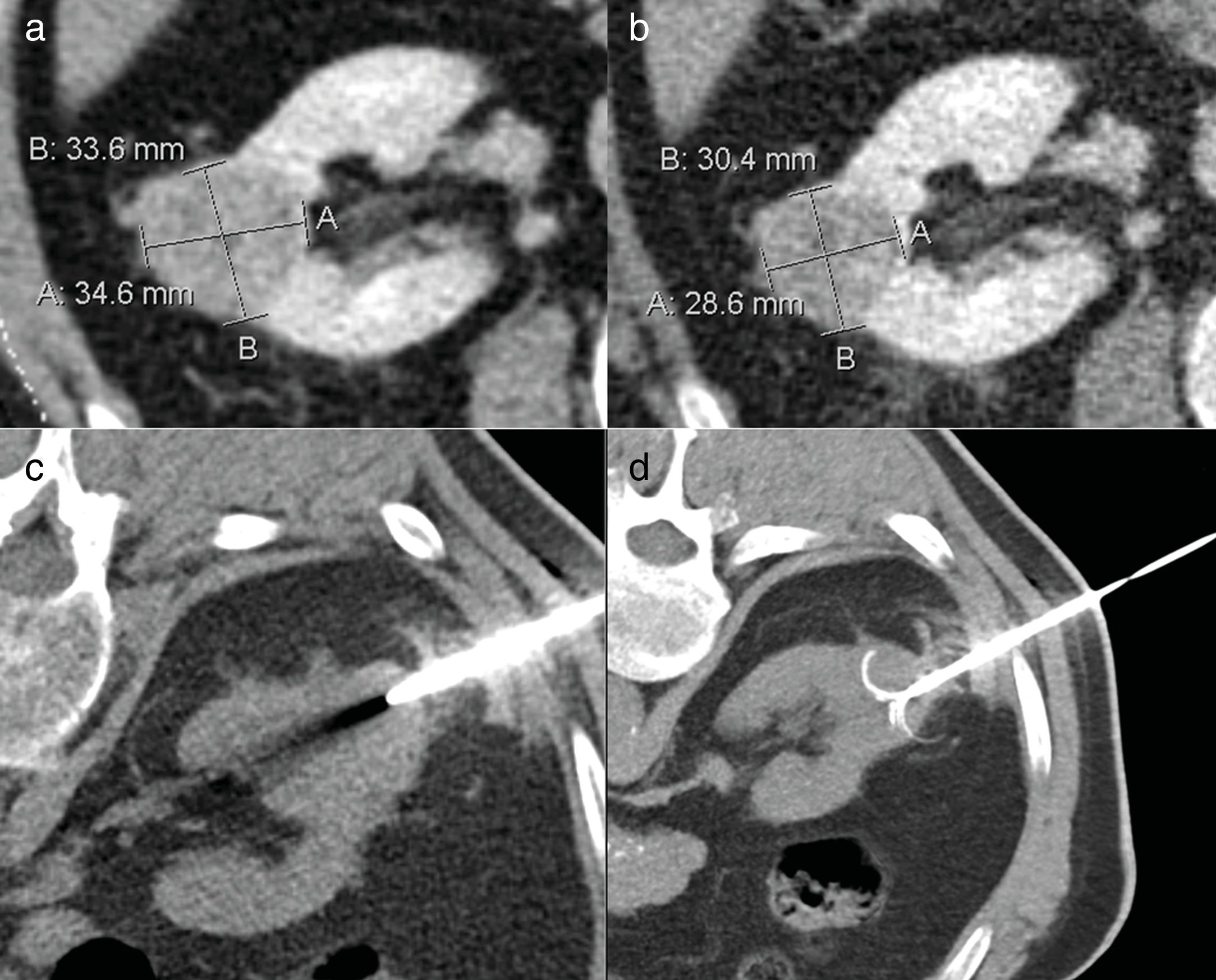
Biopsia y radiofrecuencia. Varón de 61 años con masa renal pequeña (MRP) que crece en 6 meses y pasa de 30,4×28,6mm (B) a 33,6×34,6mm (A). Se constata un crecimiento superior a 5mm en menos de 1 año y un tamaño mayor de 3cm. Al tratarse de un paciente con alto riesgo anestésico-quirúrgico, se decide terapia ablativa con radiofrecuencia (D: imagen en prono) previa biopsia (C: en prono) que confirmó un carcinoma de células renales de células claras.
En la actualidad, hay un papel emergente de la biopsia renal percutánea, que explica la disminución de la incidencia de resultados histológicos benignos en las MRP tras la cirugía48, en los últimos años.
ManejoEl manejo óptimo de las MRP genera mucha controversia y es objeto de debate en la actualidad. Hay una gran heterogeneidad en el tratamiento de estas lesiones, que incluyen la nefrectomía radical (NR), la nefrectomía parcial (NP), las terapias ablativas y la VA.
Un estudio reciente49 compara la efectividad de las cuatro principales opciones de tratamiento en términos de supervivencia, función renal y calidad de vida, con resultados oncológicos excelentes en todos los grupos. En la elección del tratamiento intervienen muchos elementos: factores asociados al tumor (tamaño, número, complejidad quirúrgica o RS, características en imagen), factores asociados al paciente (edad, comorbilidades, esperanza de vida, función renal, paciente monorreno, preferencia personal) y factores asociados a la experiencia y disponibilidad tecnológica del centro. La tendencia es hacia la selección personalizada del tratamiento, que parece que mejora la esperanza de vida50.
Tratamiento quirúrgicoHistóricamente, la NR era el patrón de referencia para el tratamiento de los CCR. En las últimas décadas y debido al mayor riesgo de desarrollar insuficiencia renal crónica, mayor riesgo de eventos cardiovasculares y sobre todo al porcentaje significativo de tumores benignos (20%) extirpados, se ha producido un cambio en el manejo de estos tumores, con aumento de las cirugías electivas conservadoras de nefronas, basado en el resultado oncológico equivalente comparado con la NR y en el beneficio médico de preservar la función renal46,51,52. Por primera vez en 2009, el porcentaje de NP superó el porcentaje de NR realizadas en pacientes con masas renales menores de 4cm53.
Las recomendaciones actuales, tanto de la American Urological Association (AUA) como de la European Association of Urology (EAU), establecen que la NP es el estándar de elección para el tratamiento quirúrgico de las MRP54. La NR se reserva para las MRP técnicamente desfavorables (fig. 7).
La NP puede ser abierta (NPA) o mínimamente invasiva, bien laparoscópica (NPL) o bien asistida por robot. La elección de la técnica no afecta a la supervivencia general55.
La NP tiene mayor grado de complicaciones posquirúrgicas inmediatas (fig. 6) (6,3% si NPA y 9% si NPL), entre las que destacan: hemorragia (3,1% vs. 1,2% NR), fistulas urinarias (4,4% vs. 0% NR) y reintervención (4,4% vs. 2,4% NR). El grado de recurrencia local es del 1-2%56.
Terapias ablativasLas terapias ablativas son técnicas mínimamente invasivas que por vía percutánea o laparoscópica y a través del frío (crioablación) o del calor (radiofrecuencia o microondas) consiguen la necrosis tumoral, con preservación del resto del parénquima renal57. La ablación percutánea guiada por imagen se puede realizar de forma ambulatoria y sin anestesia general, lo que reduce las potenciales complicaciones. La lesión debe ser biopsiada previamente32,58. Las diferentes técnicas ablativas tienen tasas de eficacia y complicaciones similares59.
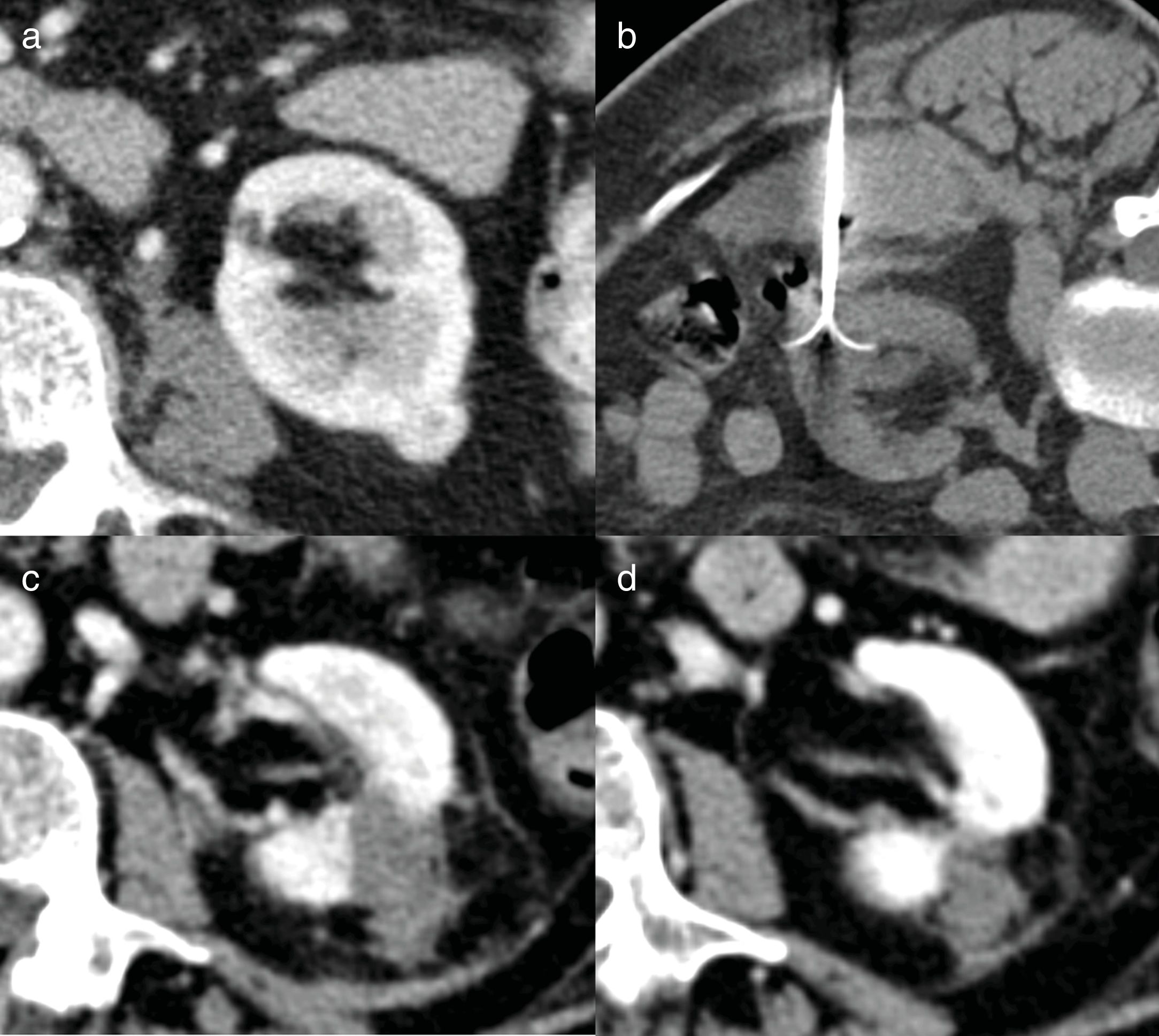
Estas técnicas son particularmente útiles en pacientes de alto riesgo quirúrgico (fig. 9), y malos candidatos a la cirugía por edad avanzada o por múltiples comorbilidades asociadas; si hay enfermedad multifocal o bilateral o CCR hereditario; si el paciente es monorreno o con insuficiencia renal moderada previa o alto riesgo de prediálisis tras la cirugía, y cuando el paciente rechaza la intervención quirúrgica. Otro aspecto a tener en cuenta es el tamaño de la lesión. Las guías recomiendan las terapias ablativas percutáneas para masas renales menores de 3cm y preferiblemente exofíticas. La eficacia está limitada por las estructuras vasculares adyacentes, sobre todo en los tumores de localización central60.
Control postablación de masa renal pequeña (MPR). Mujer de 75 años con MRP en riñón izquierdo (A) a la que se realiza radiofrecuencia (B: imagen en prono). El primer control al mes del tratamiento (C) revela una lesión focal de mayor tamaño que el tumor inicial que corresponde a hematoma. El siguiente control a los 6 meses (D) evidencia una disminución de tamaño y sobre todo una ausencia de captación que representa el mejor indicador de efectividad.
La radiofrecuencia (RF) se asocia a menor grado de complicaciones mayores (3,1%) que la cirugía abierta (7%) o la NP robótica/laparoscópica (7,2%)58. Por el contrario, las complicaciones menores son más frecuentes en la RF (13,8% vs. 7,9-9,5%). Aunque la RF se asocia a menor pérdida de la función renal y menor tiempo de hospitalización comparativamente con la NP, sí parece que hay riesgo de deterioro de la función renal hasta en un 24% de pacientes con función renal previamente alterada y en un 12% de pacientes con función previa normal. Se necesitan más investigaciones para clarificar este hecho61.
La recurrencia local es más alta en la RF, pero la diferencia no es estadísticamente significativa y tampoco hay diferencias en términos de tiempo libre de enfermedad ni en el desarrollo de metástasis58. Es importante la detección temprana de tumores persistentes o recurrentes. Uno de los pocos estudios a largo plazo, en el cual 143 tumores T1a fueron tratados con ablación por RF, encuentra un porcentaje de recurrencia del 4,2% con un tiempo medio de recurrencia de 2,5 años62. Las recurrencias locales se vuelven a tratar con ablación.
No está bien estandarizado, por la escasez de datos, con qué frecuencia y durante cuánto tiempo se deben realizar estudios por imagen después de la ablación. Se sugiere un estudio inicial temprano entre 1 y 3 meses, que permite disponer de una imagen basal, para posteriormente determinar si la ablación fue completa o si hay tumor residual63, con intervalos de 6 a 9 meses durante 2 -3 años y luego vigilancia anual durante al menos 5 a 10 años64. Los criterios de respuesta basados en el tamaño del tumor no son fiables (fig. 9). Inicialmente es posible que no se produzca un cambio significativo en el tamaño e incluso puede haber aumento en las zonas de ablación en el período periprocedimiento65. Posteriormente se tiene que producir la resolución completa o quedar una mínima lesión residual; la ausencia de captación es el mejor indicador de efectividad. Cualquier realce nodular o irregular mayor de 10 UH en el área tratada o crecimiento en la imagen, no visible al inicio de procedimiento, se considera evidencia de enfermedad persistente o recurrencia tumoral63.
Vigilancia activaLa práctica de la VA implica espera y es contraria a las normas de tratamiento convencionales que abogan por la eliminación temprana de todas las lesiones renales sospechosas de malignidad.
¿Por qué? El concepto de VA se basa, por una parte, en el lento crecimiento de la mayoría de las MRP y el limitado riesgo de metástasis, y por otra, en los riesgos asociados al tratamiento invasivo, incluidas las complicaciones inmediatas y el deterioro renal a largo plazo.
¿A quién? En pacientes de 75 años o más con MRP, el riesgo de muerte sin cáncer supera la mortalidad asociada con el cáncer66. La VA puede ser una estrategia de manejo en pacientes con alto riesgo quirúrgico, expectativa corta de vida, comorbilidades significativas o negativa a cualquier tratamiento. La AUA ha destacado la vigilancia como una posible estrategia de manejo inicial, especialmente cuando el tamaño del tumor es menor de 2cm67. También se ha sugerido, independientemente de la edad del paciente, para MR muy pequeñas, menores de 1cm68. La VA no está indicada en pacientes jóvenes, pacientes sanos y en general en cualquier buen candidato a la cirugía.
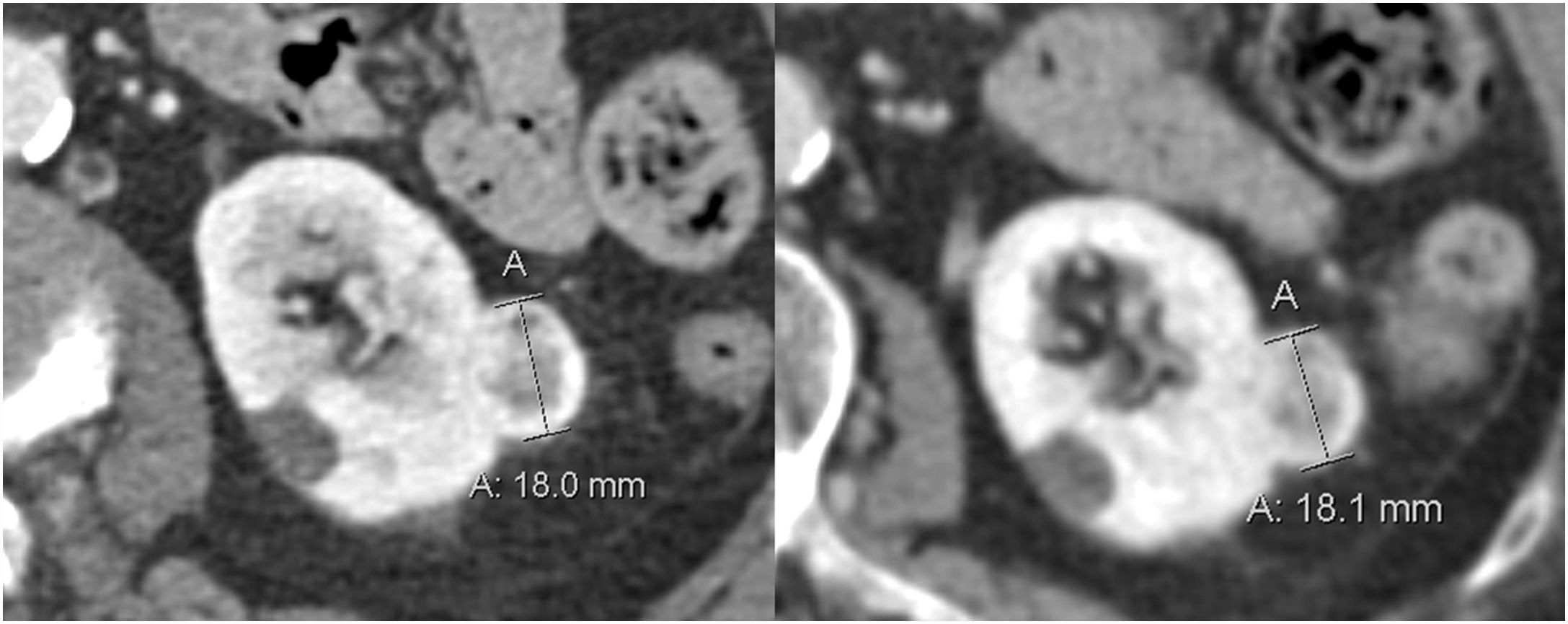
¿Cómo? La imagen, ecografía, TC o RM, tiene un papel crucial, ya que se necesita controlar la progresión en intervalos de 3 a 6 meses durante al menos 2 años, con controles anuales posteriormente68. Debe incluir medidas del tamaño del tumor y cálculo del crecimiento, ya que es el crecimiento el que va a determinar la indicación para una posible intervención adicional. Aunque la medida en 2D y en 3D (que permite estimar el volumen) es preferible a la medida 1D, en la práctica diaria se emplea la medida en una dimensión (fig. 10). Se propone que si la masa crece más de 5mm/año o supera los 3cm de tamaño estaría indicada la intervención tardía32,69 (fig. 8).
Masa renal pequeña estable, sometida a vigilancia activa. Mujer de 83 años con pequeño tumor en riñón izquierdo y múltiples comorbilidades, por lo que se decide vigilancia activa. En la tomografía computarizada inicial (imagen izquierda), la lesión mide 18mm. En el control al año (imagen derecha), la lesión prácticamente no ha variado de tamaño con un crecimiento de 0,1mm, inferior a los 5mm que se considera como límite para una posible intervención tardía.
¿Cuál es el problema en la VA? El mayor riesgo son las metástasis, de forma que la enfermedad pasa de curable a incurable. La progresión a metástasis es baja, del 0-5,7%, y es mayor en los tumores de mayor tamaño y con una tasa de crecimiento lineal más rápido22.
Otro aspecto a tener en cuenta es la ansiedad del paciente. Los que eligen someterse a VA requieren apoyo psicosocial para mitigar los efectos perjudiciales de la incertidumbre diagnóstica y terapéutica70.
Hay estudios que han demostrado que retrasar la intervención no limita o compromete la viabilidad de la NP o del abordaje mínimamente invasivo, ni representa mayor riesgo de progresión de la enfermedad71.
Aunque en la actualidad se ha observado una baja utilización de esta práctica, en torno a un 2,9%72, el manejo conservador de las MRP está creciendo en popularidad. Se debe recordar que durante la VA el riesgo de progresión local y metástasis es posible y no es predecible con precisión, y si bien la VA representa una alternativa razonable a la intervención curativa primaria, todavía requiere de una selección cuidadosa del paciente y de un seguimiento continuo73.
ConclusionesLas masas renales pequeñas constituyen un grupo heterogéneo de lesiones de las que solo el 20% representan CCR agresivos. Ninguna técnica de imagen puede diferenciar entre lesión benigna y maligna, ni entre lesión indolente y agresiva.
La biopsia renal puede ayudar a seleccionar el mejor tratamiento alternativo; sin embargo, es invasiva, no está exenta de complicaciones y puede producir resultados indeterminados, sobre todo en la graduación del tumor.
El patrón de referencia del tratamiento es la nefrectomía parcial. La vigilancia activa y las técnicas ablativas son estrategias de tratamiento válidas en pacientes seleccionados.
El descubrimiento, desarrollo y validación de nuevos marcadores moleculares, que ayuden a caracterizar las masas renales pequeñas y predecir el comportamiento tumoral, constituyen el reto del futuro.
Es de esperar que, en los próximos años, con los rápidos avances tecnológicos se desarrollen nuevas formas de diagnosticar, tratar y seguir a estos pacientes para lograr la curación con el mínimo daño posible.
Autoría- 1.
Responsable de la integridad del estudio: CMR
- 2.
Concepción del estudio: CMR
- 3.
Diseño del estudio: CMR, AMVC, GTF
- 4.
Obtención de los datos: CMR, AMVC, GTF
- 5.
Búsqueda bibliográfica: CMR, AMVC, GTF
- 6.
Redacción del trabajo: CMR, AMVC, GTF
- 7.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: CMR, AMVC, GTF
- 8.
Aprobación de la versión final: CMR, AMVC, GTF
Los autores declaran no tener ningún conflicto de intereses.