Para una mujer residente en Europa occidental, el riesgo de padecer cáncer de mama es de aproximadamente el 9% a lo largo de la vida. El concepto de «alto riesgo» viene definido por la coexistencia de cualquier factor o factores reconocidos como responsables de una probabilidad mayor.
Entre las situaciones que actualmente se aceptan como capaces de incrementar el riesgo de cáncer de mama se encuentran:
- •
Pacientes previamente tratadas de cáncer de mama.
- •
Mujeres en las que tras una biopsia mamaria se obtiene un resultado histológico de hiperplasia ductal atípica, hiperplasia columnar con atipia, lesión lobulillar in situ, papilomatosis o lesión papilar atípica.
- •
Mujeres que presentan mutaciones en los genes BRCA1 o BRCA2.
- •
Familiares de primer grado de mujeres que tienen las mutaciones antes citadas.
- •
Mujeres con antecedentes familiares directos de cáncer de mama que no se hayan realizado los test genéticos o hayan obtenido un resultado negativo, sobre todo si los casos familiares son bilaterales, se asocian a carcinomas de ovario (más relacionado con mutación BRCA 1), se han producido en varones (más relacionado con mutación BRCA 2) o en mujeres por debajo de los 40 años.
Se considera que 10–15% de los cánceres de mama se producen en el contexto de familias de alto riesgo con predisposición hereditaria multifactorial, y suelen aparecer en mujeres jóvenes premenopáusicas. De ellos, aproximadamente el 50% son consecuencia de mutaciones en los genes llamados BRCA1 (localización 17q21) o BRCA2 (localización 13q12), con penetrancia incompleta. Suelen ser tumores de alto grado de malignidad, con receptores hormonales negativos y pronóstico de supervivencia menor que la de los cánceres llamados «esporádicos» o de origen desconocido.
Las pruebas para detectar estas mutaciones tienen un coste elevado y pueden resultar poco concluyentes en muchos casos. Además, muy a menudo, las mujeres afectadas por una posible mutación no desean someterse a las pruebas por miedo a conocer los resultados que, cuando son positivos, producen en ellas una intensa carga emocional negativa. En cuanto a los riesgos exclusivamente derivados de la carga genética personal, de un modo teórico, podemos distinguir tres niveles de riesgo:
Nivel 1: las portadoras de mutaciones en los genes BRCA 1 o BRCA 2, con un riesgo estimado de entre el 50–85% a lo largo de su vida.
Nivel 2: riesgo estimado: 30–50%. Integrado por 2 subgrupos de mujeres:
- A)
Familiares de primer grado de portadoras de mutación BRCA1 o BRCA2, con situación mutacional personal desconocida. Si se realiza el test genético a estas mujeres, en función de un resultado positivo o negativo, pasarían al nivel 1 (si el test es positivo) o al nivel de la población general (si el test es negativo).
- B)
Mujeres con 3 o más familiares de primer o segundo grado afectadas por cáncer de mama antes de los 60 años, cáncer de ovario (sin límite de edad) o cáncer de mama en varón (sin límite de edad).
Nivel 3: mujeres con dos familiares de primero o segundo grado afectadas por cáncer de mama antes de los 60 años, cáncer de ovario (sin límite de edad) o cáncer de mama en varón (sin límite de edad). En este grupo, el riesgo a lo largo de la vida se estima entre el 15–30%.
Se conocen varios modelos teóricos o matemáticos útiles para cuantificar el riesgo relativo de cáncer de mama. Los más conocidos son tres, dos de ellos establecidos con anterioridad a la aplicación de los test BRCA: el Gail-NCI1,2 y el Claus3,4. El tercero, denominado BRCApro, es un modelo informático destinado a conocer la probabilidad de ser portador/a BRCA. Todos estos modelos son forzosamente imperfectos y la correlación entre ellos no es demasiado elevada (55% aproximadamente), dado que toman en consideración factores de riesgo no totalmente coincidentes5.
El manejo global de la problemática relacionada con el cáncer de mama heredofamiliar y otros, como ovario, colon, etc., debe abordarse desde la creación de unidades multidisciplinares de consejo genético, en el seno de las cuales se analice de modo conjunto y se cuantifique —en la medida de lo posible—, el riesgo teórico, se establezcan programas de revisiones periódicas y se estudie detenidamente las distintas medidas preventivas que puedan ser aconsejables en cada caso particular. Estas unidades deberán estar integradas por expertos de diferentes especialidades como la genética clínica, la oncología, la ginecología, etc. Pero sin duda, al menos en el caso del cáncer de mama, el radiólogo mamario deberá ser pieza fundamental y aportar todos sus conocimientos en aras de conseguir las tasas de detección más elevadas y precoces que sean posibles en este grupo de pacientes, utilizando para ello las técnicas de imagen disponibles actualmente y en el futuro.
Programa de revisiones radiológicasHoy en día los criterios de seguimiento radiológico a emplear con las pacientes que demuestran un riesgo elevado de cáncer de mama significativo no están plenamente establecidos en la literatura internacional, y son variables en función de factores como la incidencia y prevalencia de esta enfermedad, el nivel sociosanitario de cada país y la concienciación de los ciudadanos, especialmente de los grupos de mujeres afectadas.
Se considera que las estrategias de seguimiento periódico para mujeres de riesgo normal (mamografía cada 2 años) son insuficientes para mujeres de riesgo elevado, ya que producirían tasas de cáncer de intervalo del 50%. Por ello, algunos autores y sociedades recomiendan mamografía anual desde los 25–35 años de edad para mujeres con mutación BRCA demostrada. Aunque no existe un acuerdo universalmente aceptado en este asunto, podemos admitir algunos criterios orientativos, con carácter general, tales como:
- •
El programa de revisiones periódicas y sistemáticas deberá comenzar a edades más precoces que los de la población de riesgo normal, independientemente de la densidad mamaria. Algunos autores recomiendan comenzar las revisiones 5 años antes de la edad de aparición del caso más precoz detectado en la familia.
- •
La periodicidad de las revisiones será anual, dada la mayor rapidez de crecimiento de los tumores relacionados con mutación de los genes BRCA1 y BRCA2.
- •
La resonancia magnética (RM) comienza a ser considerada como prueba principal en el grupo de mujeres de alto riesgo. Su supremacía sobre las otras técnicas ha quedado demostrada en varios trabajos y algunos autores llegan a recomendarla incluso como única prueba de cribado en estas mujeres6.
- •
La mamografía deberá ser realizada para complementar la sensibilidad de la RM para el carcinoma in situ, ya que es capaz de detectar la posible aparición de microcalcificaciones. Sin embargo, quizás la mamografía puede ser indicada solamente con periodicidad bienal e incluso, de entrada, en proyección única, ya que se invoca una mayor susceptibilidad de las mujeres con riesgo elevado, a la acción de las radiaciones ionizantes.
- •
La ecografía será muy frecuentemente utilizada como adjunta a la mamografía y a la RM, para revisar mamas y axilas, especialmente en mamas de densidad elevada.
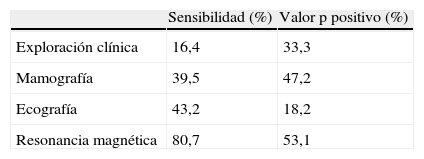
La tabla 1, basada en la revisión realizada por Sardanelli, agrupando los resultados de cuatro estudios prospectivos y los de su propia serie5,6–10, muestra los valores de sensibilidad y valor predictivo positivo de las diferentes técnicas para la detección de cáncer de mama en mujeres de riesgo familiar o genético elevado5. En el citado metaanálisis, sobre un total de 9.652 revisiones realizadas a 3.571 mujeres con 41 años de media de edad a la entrada, la tasa de detección global fue del 1,7% o lo que es lo mismo, 3–4 veces superior a las cifras de los programas poblacionales por mamografía.
Porcentajes de sensibilidad y valor predictivo positivo de las distintas técnicas de detección posibles en pacientes de alto riesgo (tomado de Sardanelli)5
| Sensibilidad (%) | Valor p positivo (%) | |
| Exploración clínica | 16,4 | 33,3 |
| Mamografía | 39,5 | 47,2 |
| Ecografía | 43,2 | 18,2 |
| Resonancia magnética | 80,7 | 53,1 |
Globalmente, los tumores detectados eran de alto grado en casi el 50% de los casos. Las estadificaciones fueron similares a las que se detectan en programas masivos de cribado por mamografía, con 19% de afectación axilar y la tasa de cánceres de intervalo fue de aproximadamente del 5%.
En Alemania, Kuhl et al6, sobre 529 mujeres asintomáticas (1.701 revisiones) con riesgo superior al 20% a lo largo de su vida, consiguieron una tasa de detección del 2,5% y solamente un cáncer de intervalo (2,2%). Los valores de sensibilidad y especificidad de la RM en esta serie alcanzan valores espectaculares (91 y 97%, respectivamente). Además, el 44% de los cánceres diagnosticados solamente eran detectables por RM. En este trabajo se sugiere que el valor de la ecografía en este contexto es escaso, pero puede ser de utilidad para realizar revisiones intermedias entre las exploraciones anuales.
Kriege et al7 compararon sus estadificaciones con las obtenidas en el total de cánceres diagnosticados en Holanda en 1998 y también con las de un estudio prospectivo sobre pacientes de riesgo familiar, sin RM. El tamaño tumoral y el porcentaje de tumores con afectación axilar diagnosticados en las pacientes de alto riesgo a las que se les aplica RM son significativamente menores.
Warner et al8 trabajaron en Canadá sobre una serie pequeña pero muy homogénea y de riesgo muy elevado, formada por 236 portadoras de mutación BRCA, consiguiendo una tasa de detección del 4,8%.
Leach et al9, en un estudio multicéntrico (MARIBS) llevado a cabo en el Reino Unido demostraron una especificidad del 80% para la RM en un grupo de mujeres de riesgo muy elevado, incluso habiendo utilizado dosis de gadolinio dobles que lo habitual y consiguiendo tasas de detección cercanas al 2%.
Finalmente, el grupo multicéntrico de Milán, liderado por Sardanelli10 consiguió una tasa de 4,8%, siendo diagnosticados el 33% de los cánceres solamente por RM.
Se concluye que la RM es capaz de detectar cánceres no visibles por otras técnicas y por tanto es necesaria para realizar una adecuada detección precoz en este grupo de mujeres (jóvenes con riesgo genético o familiar elevado). Con respecto al uso de la RM como técnica principal o única de detección en este grupo de mujeres, hemos visto que son varias las series publicadas con tasas de detección superiores al 2%. Se puede discutir la rentabilidad económica de estos proyectos pero no hay duda sobre su utilidad clínica o de cribado, ya que los tumores malignos detectados en estas series presentan estadios precoces en la misma medida que los detectados en los programas poblacionales de mamografía. Es previsible que los programas específicamente diseñados para mujeres de alto riesgo, consigan del mismo modo reducir la mortalidad en este grupo de mujeres. Por ello, argumentos invocados hasta ahora en contra de la RM, tales como su elevado coste o su disponibilidad escasa, serán sin duda superados en el futuro más o menos inmediato, en aras de su mayor sensibilidad para la detección del carcinoma infiltrante e incluso del carcinoma intraductal, al menos de alto grado.
A fin de incrementar la especificidad, es necesario que los radiólogos responsables adquieran destreza en la técnica de biopsia percutánea dirigida por RM o que se creen unidades de referencia especializadas en este tipo de biopsia percutánea.
Parece razonable pensar que las mujeres consideradas de mayor riesgo debido a factores diferentes a su herencia (diagnosticadas de cáncer, biopsiadas previamente con resultados de atipia, etc.) podrán verse también beneficiadas de la realización de programas de seguimiento que incluyan RM, independientemente de su edad. Del mismo modo, las mujeres con riesgo heredofamiliar incrementado se beneficiarían igualmente de estos programas a cualquier edad.
Las ideas expresadas en las líneas anteriores orientan hacia nuevos escenarios en los que las mujeres que puedan acreditar un incremento de su riesgo teórico de padecer cáncer de mama sean evaluadas de modo diferente al de la población femenina en general, incluso en mujeres con riesgo «moderadamente» elevado.
Permanecen en controversia y deberán ser objeto de futuros estudios, numerosas cuestiones relacionadas con aspectos organizativos o logísticos, tales como el número de técnicas a añadir a la RM (mamografía, ecografía, exploración clínica, etc.) y, sobre todo, el orden y periodicidad con que estas pruebas deberán ser practicadas, así como las edades de inclusión, el nivel de riesgo que debe ser tenido en cuenta para la inclusión de la RM, etc.
Conclusiones y perspectivas futurasDespués del género (femenino) y la edad, la carga genética (o los antecedentes familiares) son el factor de riesgo más reconocido para el cáncer de mama.
La detección precoz del cáncer de mama en mujeres jóvenes con riesgo elevado es posible y deseable y puede resultar eficaz.
La RM debe ser incluida en estos programas de detección como técnica principal, ya que ha demostrado ser la que proporciona mayor sensibilidad y valor predictivo positivo.
Por todo lo anterior, se comienza a vislumbrar un futuro en el que el tipo de técnica o combinación de técnicas utilizadas en el cribado, la edad de comienzo de éste y su periodicidad, variarán sustancialmente en función de una evaluación previa del riesgo personal, no tanto de modo individual, sino en grupos estratificados en función de la concurrencia de factores de riesgo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.