Describir, con estudios funcionales de activación y tractografía en una RM de 3 Teslas (3T), las áreas corticales y vías subcorticales implicadas en el lenguaje, y mostrar la buena correlación de estos estudios funcionales con la estimulación directa cortical y subcortical intraoperatoria.
Material y métodosPresentamos una serie de 14 pacientes con lesiones focales cerebrales junto a áreas elocuentes. Todos los pacientes se evaluaron neuropsicológicamente antes y después de la cirugía, se estudiaron con RM con secuencias estructurales, de perfusión, espectroscopia, resonancia magnética funcional y del lenguaje y tractografía 3D, y se sometieron a un mapeo cortical de estimulación cortical y subcortical y resección de la lesión. Se hizo un control posquirúrgico a las 24h.
ResultadosLa correlación funcional motora y del haz corticoespinal con el mapeo intraoperatorio cortical y subcortical motor fue completa. Las áreas elocuentes del lenguaje expresivo y del lenguaje receptivo presentaron una alta correlación con el mapeo cortical intraoperatorio en todos los casos menos 2, un glioma infiltrativo de alto grado y un glioma de bajo grado frontal. La tractografía 3D identificó los fascículos arcuato, frontoparietal, subcalloso, frontooccipital inferior y las radiaciones ópticas, lo que permitió marcar los límites de la resección. La correlación con el mapeo subcortical en la disposición anatómica de los fascículos con respecto a las lesiones, fue completa.
ConclusiónLa máxima resección tumoral sin déficits asociados es el mejor tratamiento posible ante un tumor cerebral, lo que resalta la necesidad de estudios funcionales de alta calidad en la planificación prequirúrgica.
To describe the detection of cortical areas and subcortical pathways involved in language observed in MRI activation studies and tractography in a 3T MRI scanner and to correlate the findings of these functional studies with direct intraoperative cortical and subcortical stimulation.
Material and methodsWe present a series of 14 patients with focal brain tumors adjacent to eloquent brain areas. All patients underwent neuropsychological evaluation before and after surgery. All patients underwent MRI examination including structural sequences, perfusion imaging, spectroscopy, functional imaging to determine activation of motor and language areas, and 3D tractography. All patients underwent cortical mapping through cortical and subcortical stimulation during the operation to resect the tumor. Postoperative follow-up studies were done 24hours after surgery.
ResultsThe correlation of motor function and of the corticospinal tract determined by functional MRI and tractography with intraoperative mapping of cortical and subcortical motor areas was complete. The eloquent brain areas of language expression and reception were strongly correlated with intraoperative cortical mapping in all but two cases (a high grade infiltrating glioma and a low grade glioma located in the frontal lobe). 3D tractography identified the arcuate fasciculus, the lateral part of the superior longitudinal fasciculus, the subcallosal fasciculus, the inferior fronto-occipital fasciculus, and the optic radiations, which made it possible to mark the limits of the resection. The correlation with the subcortical mapping of the anatomic arrangement of the fasciculi with respect to the lesions was complete.
ConclusionThe best treatment for brain tumors is maximum resection without associated deficits, so high quality functional studies are necessary for preoperative planning.
La principal indicación clínica de los estudios funcionales de activación y de tractografía es la planificación prequirúrgica de las lesiones focales cerebrales en áreas elocuentes. Los paradigmas motores de la resonancia magnética funcional (RMf) son simples y consistentes, fácilmente reproducibles, por lo que se han validado y correlacionado ampliamente en la bibliografía médica con las técnicas de mapeo cortical y subcortical1,2. Sin embargo, el lenguaje es una tarea cognitiva compleja y los paradigmas experimentales utilizados presentan una mayor complejidad y variabilidad entre los individuos, con lo que su aplicación rutinaria no es fácil. Los mapeos quirúrgicos intraoperatorios han evidenciado que no solamente son básicas las clásicas áreas de lenguaje de Broca y de Wernicke3–6, sino que existe una red mucho más compleja que implica mayores áreas de activación cortical7,8 y amplias áreas subcorticales9–12.
El interés de nuestro artículo es la confirmación de que las nuevas secuencias de activación funcional e imagen de tensor de difusión (ITD) en RM de 3T proporcionan, de forma no invasiva, un mapa prequirúrgico fiable cortical y subcortical13–16, al comparar nuestros datos con el mapeo intraoperatorio. Estas técnicas son imprescindibles para una adecuada planificación quirúrgica, especialmente en los centros donde no se realiza mapeo intraoperatorio. Hasta donde sabemos, esta es una de las series más extensas de correlación de pruebas de imagen con un mapeo cortical y subcortical.
Material y métodosPacientesSeleccionamos los pacientes en los que, tanto los estudios funcionales como el mapeo intraoperatorio, fueron satisfactorios (adecuada colaboración del paciente en la realización de los paradigmas, ausencia de alteraciones por movimiento excesivo, ausencia de crisis consecutivas en la estimulación intraoperatoria), y, por ello, nuestra serie se reduce a 14 pacientes con lesiones expansivas tumorales intracerebrales en los que se realizó un estudio prequirúrgico con neuroimagen funcional y, como estándar de referencia, una estimulación eléctrica cortical y subcortical intraoperatoria. Todos los pacientes firmaron su consentimiento informado para pruebas diagnósticas. Por ser un estudio retrospectivo no se solicitó el permiso del comité de ética hospitalario.
Estudio funcional de activaciónParadigmas funcionalesSe realizó un estudio funcional motor con movimientos alternantes de oposición de los dedos al pulgar (finger-tapping), previo al estudio funcional del lenguaje, porque rutinariamente se inicia el abordaje intraoperatorio mapeando el córtex sensitivomotor, identificando el surco central y confirmando la respuesta del paciente.
De los múltiples paradigmas descritos aplicables al estudio del lenguaje17,18, en nuestro centro utilizamos 3 paradigmas para el estudio funcional del lenguaje: 1) paradigma de «generación verbal» (relacionar acciones con los nombres de objetos presentados visualmente. El paciente debe intentar verbalizar sin mover la cara en los períodos de activación. En los períodos de reposo, para realizar una tarea automática, los pacientes cuentan en sentido ascendente); 2) paradigma de «escucha pasiva» (escuchar y entender un texto; al paciente se le informa que posteriormente se le harán preguntas de comprensión. En los períodos de reposo el paciente escucha un texto invertido no comprensible); y 3) paradigma de «lectura de un texto» (lectura de un texto presentado. En los períodos de reposo se le presenta visualmente un texto ilegible). Con el primer paradigma se pretenden activar las áreas expresivas o motoras del lenguaje. Las otras 2 tareas buscan la activación de las áreas receptivas y de lectura del lenguaje.
Obtención de los datosLa adquisición fue realizada en un equipo de 3T (GE Medical Systems, Milwaukee, WI, USA)utilizando una secuencia gradiente eco-planar (TE: 35ms; TR: 3000ms; ángulo 90°; matriz: 64×64; 1 adquisición; FOV: 24cm; grosor de corte: 4,0mm; espaciado:0,0). La imagen anatómica de referencia es un 3D-SPGR-T1 en plano axial. Se utilizó un diseño en bloques alternando períodos de actividad y de reposo, comenzando con actividad. Se hicieron 6 ciclos de actividad-reposo, con 10 fases de reposo y 10 de actividad con una duración de 30 segundos por período, obteniéndose 120 volúmenes.
PosprocesoEl posprocesado de las imágenes funcionales se realizó con el programa de 3D Brainwave (General Electric Health Care, Milwaukee, WI, USA). Las imágenes anatómicas 3D-SPGR T1 se segmentaron automáticamente eliminando las partes blandas. Los volúmenes de imagen funcional obtenidos se alinearon con el método Air de Woods, et al.17 (translación máxima 0,22mm/máxima rotación de 0,07°). Posteriormente se procesaron con un filtro espacial de Gauss (full width at half maximum [FWHM] = 8,8mm). Los datos funcionales se analizaron según un modelo de regresión lineal generando un mapa t-test, que se convierte en un mapa Z de activación. El umbral estadístico utilizado es el de Z=4,51451 con un valor de p=0,05, representándose únicamente las zonas de activación que superan ese umbral. Las zonas activadas se presentaron en un mapa paramétrico fusionado con las imágenes anatómicas y representadas en un volumen 3D.
Estudios 3D-ITDSe utilizó una secuencia de difusión espín-eco eco-planar con 25-45 direcciones en planos axial, sagital y coronal (TE: mínimo; TR: 6000ms; matriz: 128×128; 1 adquisición; FOV: 24cm; grosor: 4mm; espaciado: 1,5mm; valor máximo de b: 1000). La reconstrucción 3D utiliza un programa de FuncTool 3D Fiber Tracking (General Electric Healh Care, Milwaukee, WI, USA). Los haces de sustancia blanca, obtenidos por tractografía con el método de semilla17, fueron: el fascículo frontooccipital inferior, fascículo arcuato, fascículo subcalloso, haz frontooccipital y fascículo longitudinal inferior. Se añadieron rutinariamente el haz corticoespinal y las radiaciones ópticas.
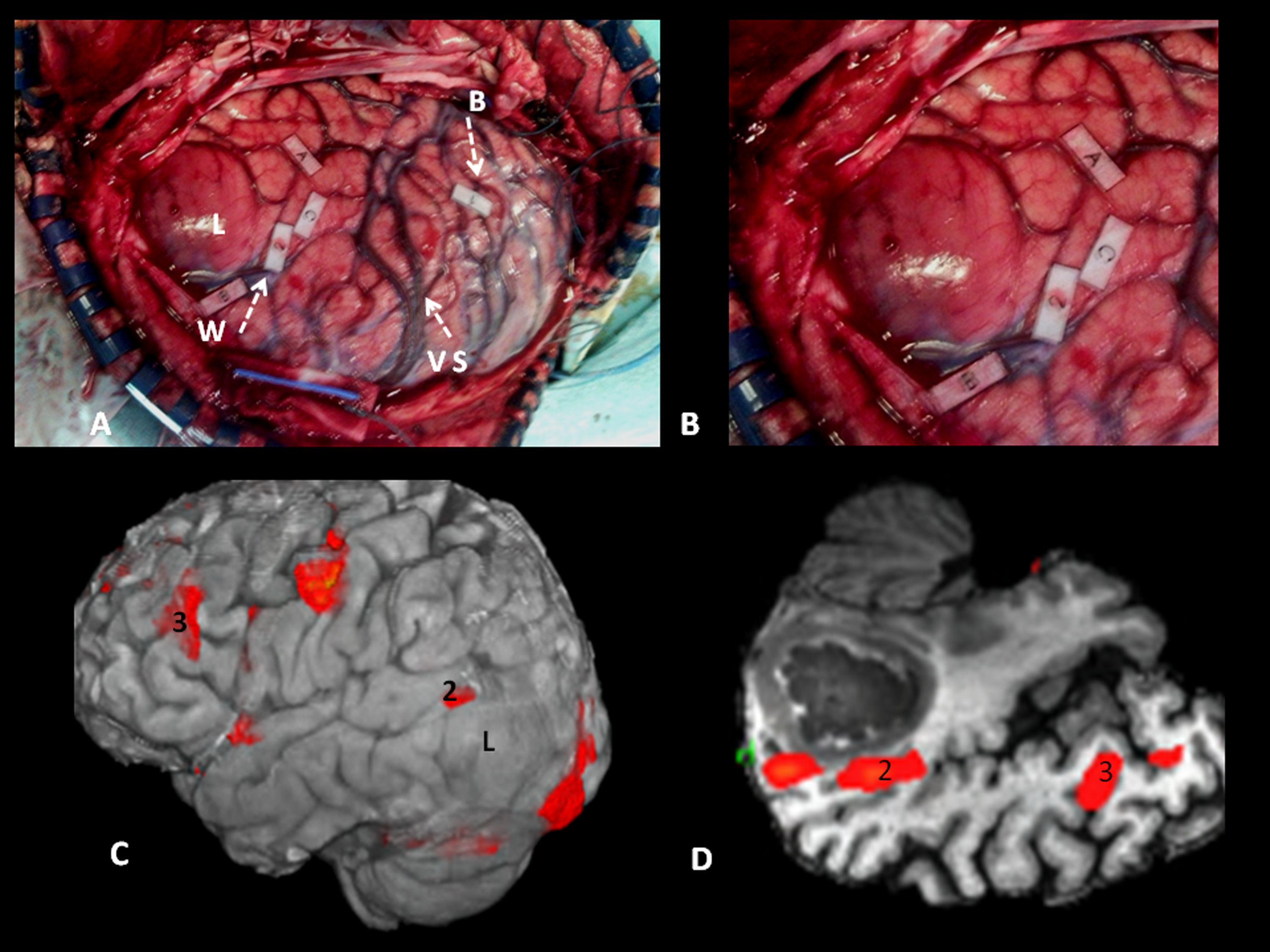
Estimulación eléctrica cortical y subcortical intraoperatoriaEn todos los pacientes se había procedido a la localización del tumor con ecografía intraoperatoria, bajo anestesia local, delimitando los bordes y marcándolos con las letras A, B, C y D. El mapeo con estimulación eléctrica cortical comenzó en el córtex sensitivomotor, alrededor del surco de Rolando. Posteriormente, se procedió al mapeo del lenguaje, con diferentes paradigmas (verbalización, nominación de objetos, lectura de un texto). La intensidad de la estimulación eléctrica osciló entre 1-2mA, hasta un máximo de 8mA, que induce crisis. La estimulación se consideró positiva si se producía una alteración en el discurso verbal tras 3 estimulaciones seguidas en un área de 0,5×0,5cm. Esta se marcaba con etiquetas blancas numeradas. En un segundo tiempo se procedió a la resección de la lesión, llegando a la región subcortical. La estimulación eléctrica de estos haces subcorticales ocasionó alteraciones del lenguaje similares a las áreas corticales. En este momento se siguieron los haces funcionales subcorticales ya mapeados desde su origen cortical y se continuó con la resección hasta que los haces subcorticales elocuentes rodeaban la cavidad quirúrgica.
Se consideraron como marcas anatómicas de referencia en el mapeo del lenguaje, el opérculo rolándico (que delimita el córtex facial motor), las ramas anterior y ascendente de la cisura de Silvio (que delimitan el área de Broca y el córtex premotor ventral), y, finalmente, el ramo horizontal silviano junto con el tercio posterior del surco temporal superior (que marcan el área de Wernicke).
Correlación imagen-mapeo intraoperatorioLa correlación cortical se considero positiva cuando existía concordancia anatómica con las circunvoluciones activadas en el estudio 3D de la RMf con un margen de error menor a 0,5cm. Se utilizaron las marcas anatómicas de referencia en el mapeo del lenguaje, descritas previamente, para identificar las áreas de activación funcional. La correlación subcortical se consideró positiva cuando la disposición espacial de los haces subcorticales (craneal, caudal, medial, lateral, anterior o posterior) se correspondía con la del mapeo subcortical.
Control posquirúrgicoSe realizó un estudio de RM de control a las 24 horas, y un control radiológico y neuropsicológico a los 3 meses.
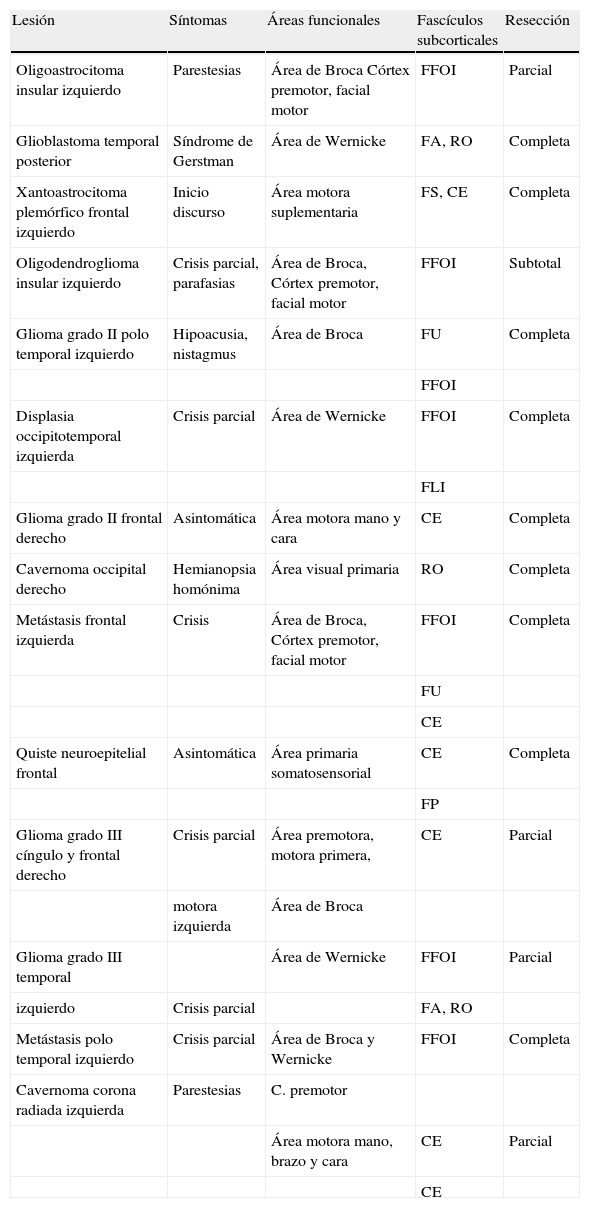
ResultadosLas características clínicas de los estudios funcionales, los fascículos subcorticales, y de los resultados quirúrgicos de los casos correlacionados se muestran en la tabla 1. Se encontró una correlación cortical positiva en 12 de los 14 pacientes estudiados, y sin coincidencia completa en 2 pacientes (glioma grado II frontal y glioma grado III del cíngulo). En el primero, por un falso positivo en el estudio funcional ocasionado por la vena precentral, y en el segundo, por la extensa infiltración tumoral que inhibía la activación funcional. En este último caso, además, el mapeo intraoperatorio fue parcial, al presentar el paciente crisis durante el procedimiento.
Pacientes correlacionados: hallazgos clínico-radiológicos
| Lesión | Síntomas | Áreas funcionales | Fascículos subcorticales | Resección |
| Oligoastrocitoma insular izquierdo | Parestesias | Área de Broca Córtex premotor, facial motor | FFOI | Parcial |
| Glioblastoma temporal posterior | Síndrome de Gerstman | Área de Wernicke | FA, RO | Completa |
| Xantoastrocitoma plemórfico frontal izquierdo | Inicio discurso | Área motora suplementaria | FS, CE | Completa |
| Oligodendroglioma insular izquierdo | Crisis parcial, parafasias | Área de Broca, Córtex premotor, facial motor | FFOI | Subtotal |
| Glioma grado II polo temporal izquierdo | Hipoacusia, nistagmus | Área de Broca | FU | Completa |
| FFOI | ||||
| Displasia occipitotemporal izquierda | Crisis parcial | Área de Wernicke | FFOI | Completa |
| FLI | ||||
| Glioma grado II frontal derecho | Asintomática | Área motora mano y cara | CE | Completa |
| Cavernoma occipital derecho | Hemianopsia homónima | Área visual primaria | RO | Completa |
| Metástasis frontal izquierda | Crisis | Área de Broca, Córtex premotor, facial motor | FFOI | Completa |
| FU | ||||
| CE | ||||
| Quiste neuroepitelial frontal | Asintomática | Área primaria somatosensorial | CE | Completa |
| FP | ||||
| Glioma grado III cíngulo y frontal derecho | Crisis parcial | Área premotora, motora primera, | CE | Parcial |
| motora izquierda | Área de Broca | |||
| Glioma grado III temporal | Área de Wernicke | FFOI | Parcial | |
| izquierdo | Crisis parcial | FA, RO | ||
| Metástasis polo temporal izquierdo | Crisis parcial | Área de Broca y Wernicke | FFOI | Completa |
| Cavernoma corona radiada izquierda | Parestesias | C. premotor | ||
| Área motora mano, brazo y cara | CE | Parcial | ||
| CE |
CE: haz córtico-espinal; FA: fascículo arcuato; FFOI: fascículo frontooccipital inferior; FLI: fascículo longitudinal inferior; FP: haz frontoparietal; FS: fascículo subcalloso; FU: fascículo uncinado; RO: radiaciones ópticas.
La evaluación neuropsicológica postoperatoria de los pacientes fue óptima, y no se apreciaron déficits del lenguaje añadidos a los preoperatorios en ninguno de los 14 pacientes.
Las áreas corticales implicadas en el lenguaje (fig. 1) correlacionadas con la estimulación cortical (tabla 2) fueron:
- 1.
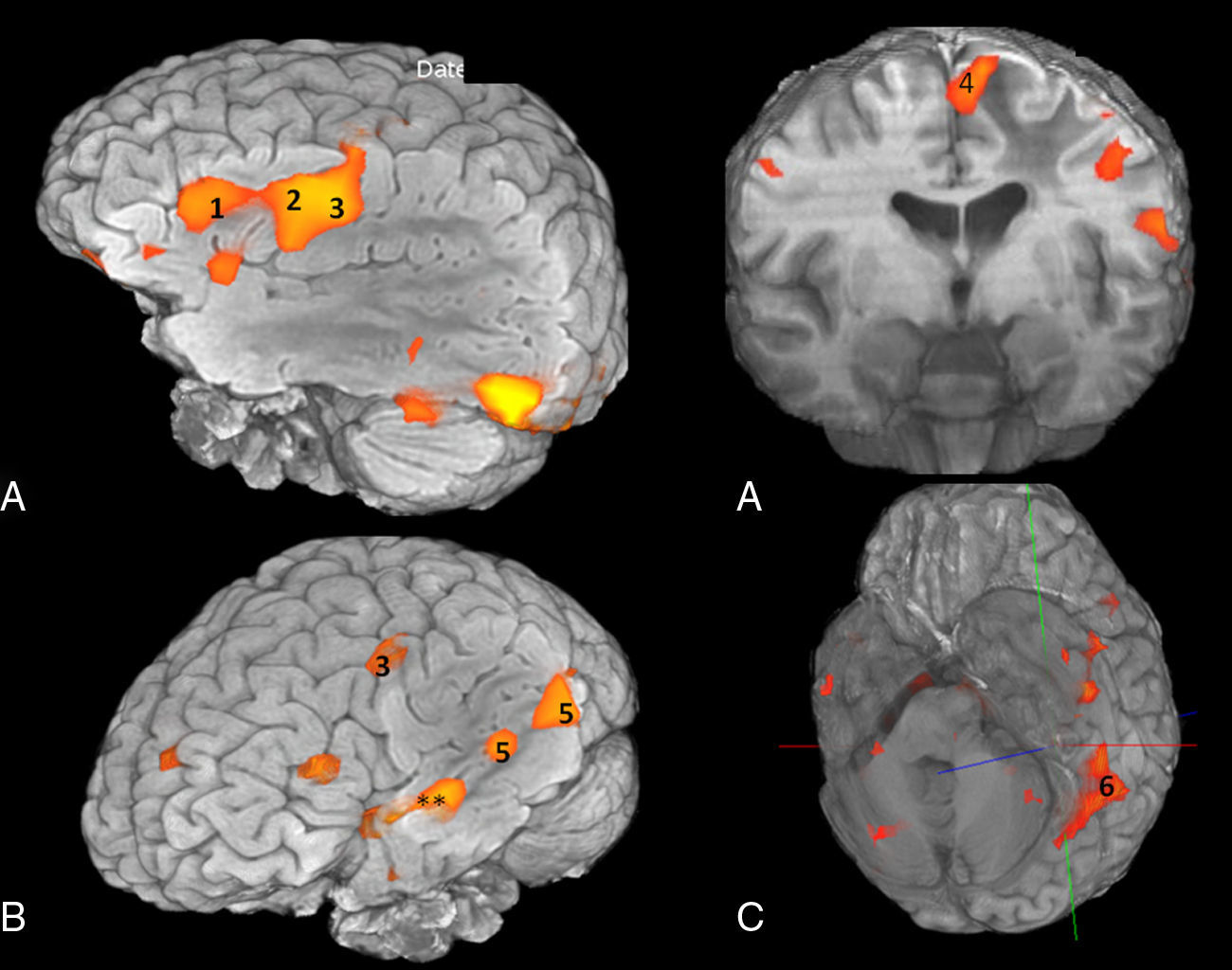
Frontales: circunvolución frontal inferior (área de Broca), pars triangular y opercular; córtex facial motor (margen más inferior de la circunvolución frontal ascendente); córtex premotor (anterior al córtex facial motor); área motora suplementaria (medial a la parte más craneal del surco precentral).
- 2.
Temporoparietales: córtex temporal posterior izquierdo: tercio posterior de las circunvoluciones temporales superior y media; lóbulo parietal inferior izquierdo: circunvoluciones angular y supramarginal.
- 3.
Occipitotemporal basal: circunvoluciones temporal inferior y fusiforme. Son áreas relacionadas con el reconocimiento visual, especializadas en la identificación de la forma de las palabras o de los objetos, como el giro fusiforme izquierdo («visual word form area» y «visual object-form area»).
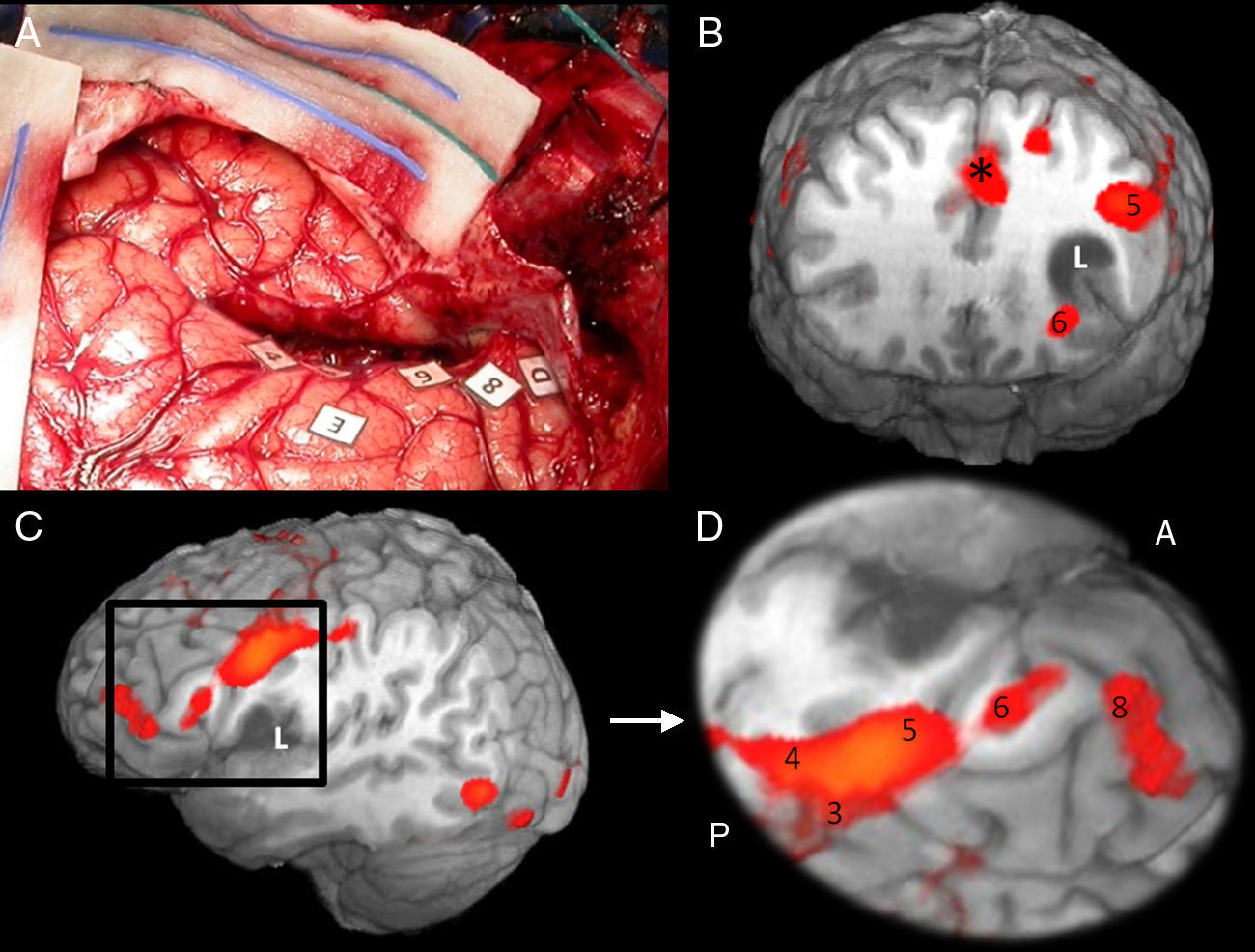
RM funcional volumétrica. A) Áreas corticales frontales, B) temporoparietales y C) occipitotemporal basal implicadas en el lenguaje. 1: Área de Broca; 2: Córtex premotor; 3: Córtex facial motor; 4: Área motora suplementaria; 5: Área de Wenicke; 6: Área visual de la forma de la palabra «Visual word form area». **Áreas de asociación auditiva.
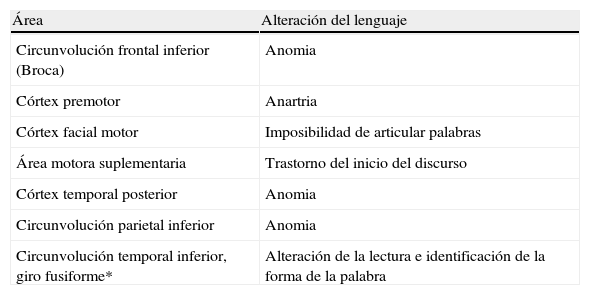
Estimulación eléctrica cortical
| Área | Alteración del lenguaje |
| Circunvolución frontal inferior (Broca) | Anomia |
| Córtex premotor | Anartria |
| Córtex facial motor | Imposibilidad de articular palabras |
| Área motora suplementaria | Trastorno del inicio del discurso |
| Córtex temporal posterior | Anomia |
| Circunvolución parietal inferior | Anomia |
| Circunvolución temporal inferior, giro fusiforme* | Alteración de la lectura e identificación de la forma de la palabra |
*Visual word form area.
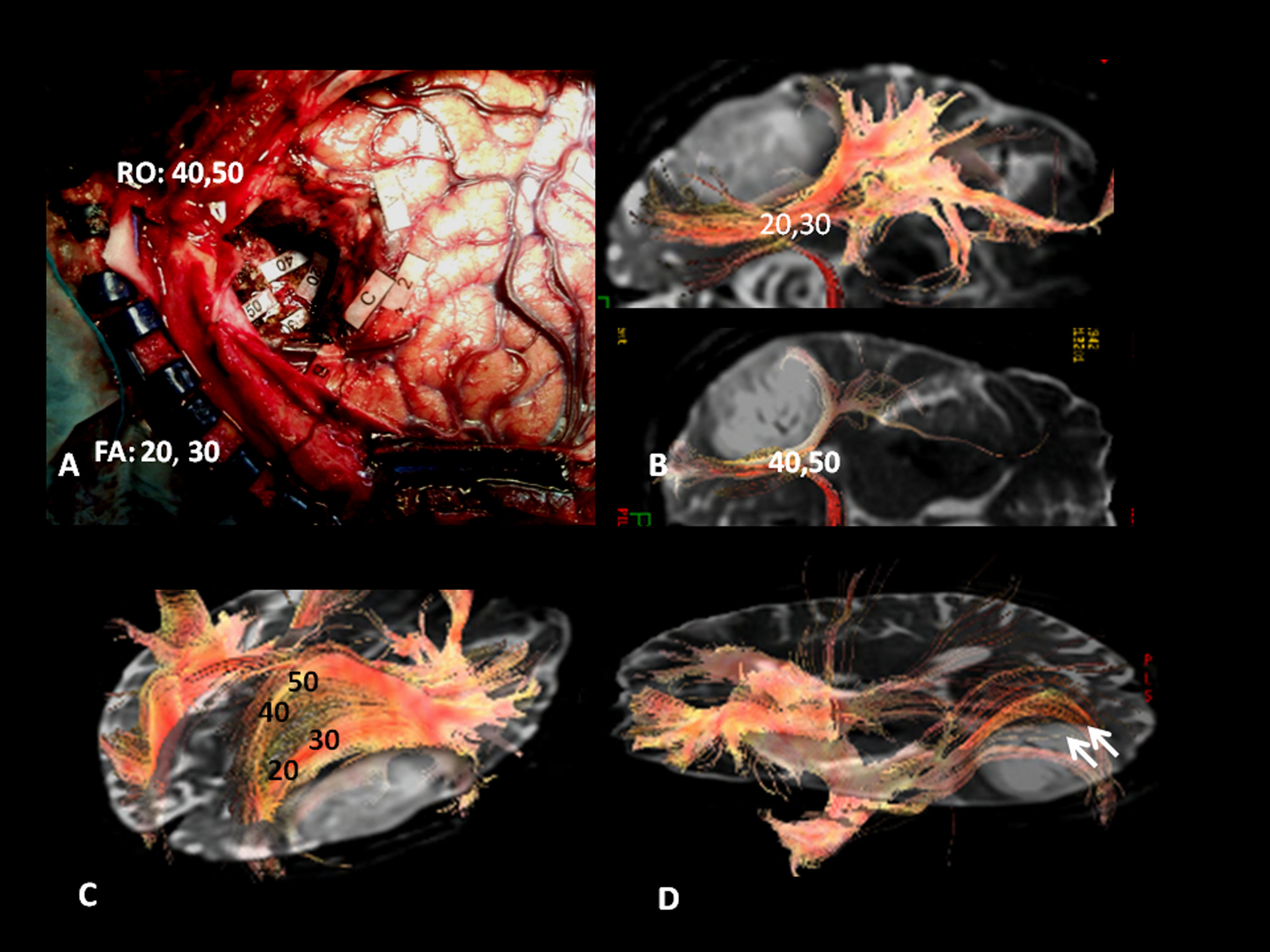
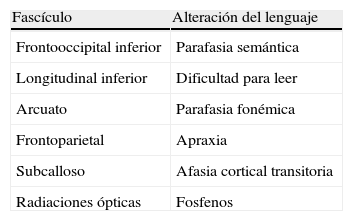
En el caso de los fascículos subcorticales «funcionales» la concordancia fue del 100%. Los haces correlacionados fueron (tabla 3) (fig. 2):
- 1.
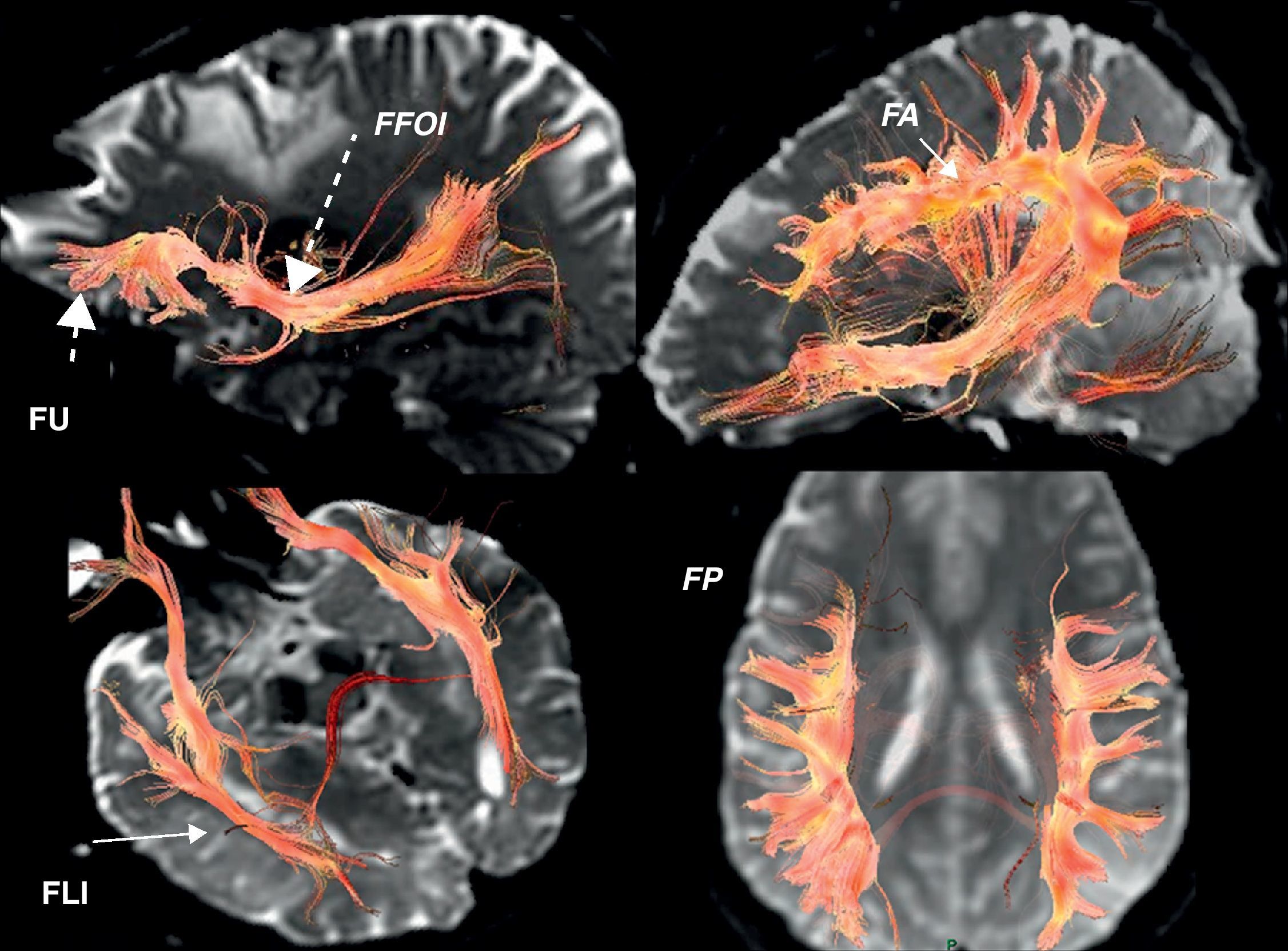
Fascículo arcuato: parte medial del fascículo longitudinal superior, conectando el córtex lateral frontal y parietotemporal.
- 2.
Fascículo o haz frontoparietal: parte lateral del fascículo longitudinal superior, conectando el área de Broca con el lóbulo parietal inferior.
- 3.
Fascículo frontooccipital inferior: conecta áreas prefrontales y occipito-temporoparietales mediales. En su tercio anterior se sitúa craneal al techo del asta temporal y a las radiaciones ópticas. En su segmento temporooccipital posterior es lateral al asta occipital ventricular, entrando a formar parte del stratum sagital. Termina en el córtex medial temporoccipital.
- 4.
Fascículo longitudinal inferior: en su trayecto temporooccipital izquierdo interviene en la identificación de la forma de los objetos o «visual object-form area».
- 5.
Fascículo subcalloso: rodea el cuerno frontal ventricular y conecta el área motora suplementaria con el cíngulo y el núcleo caudado.
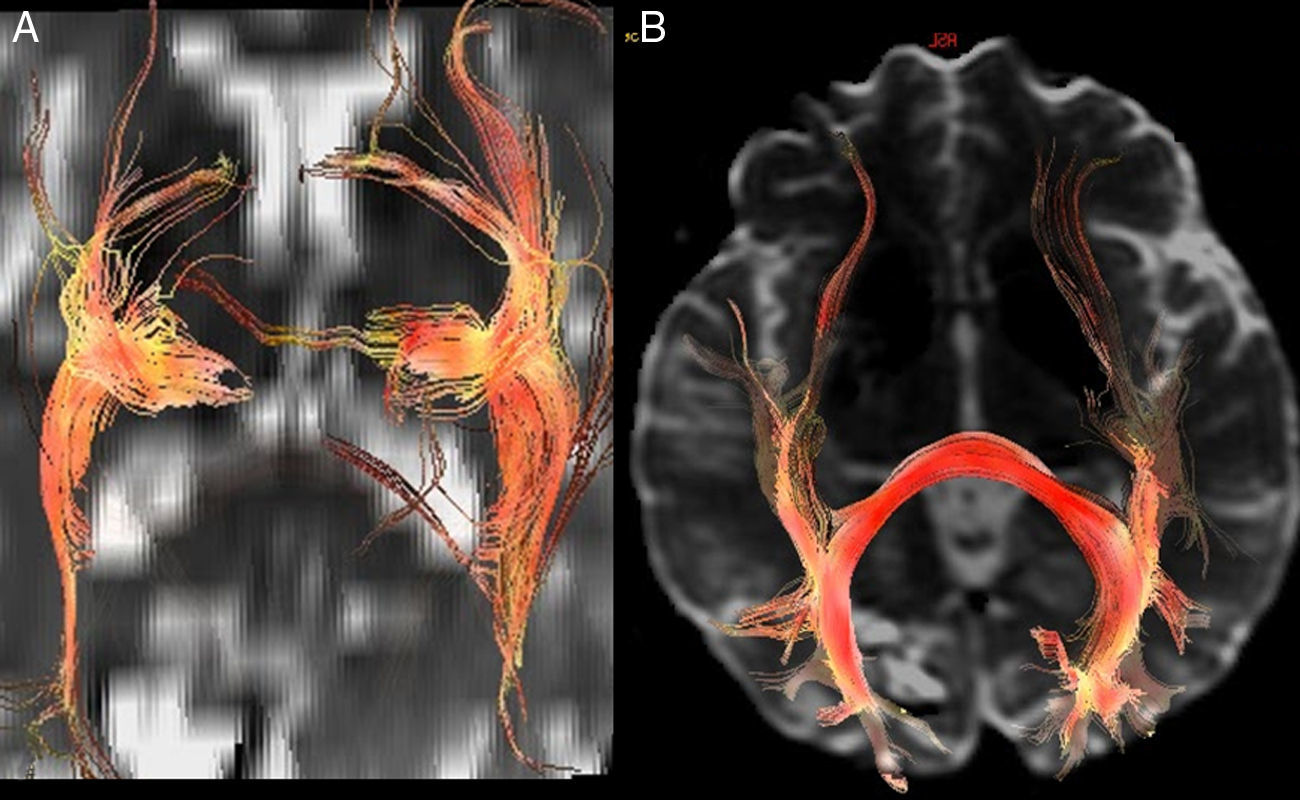
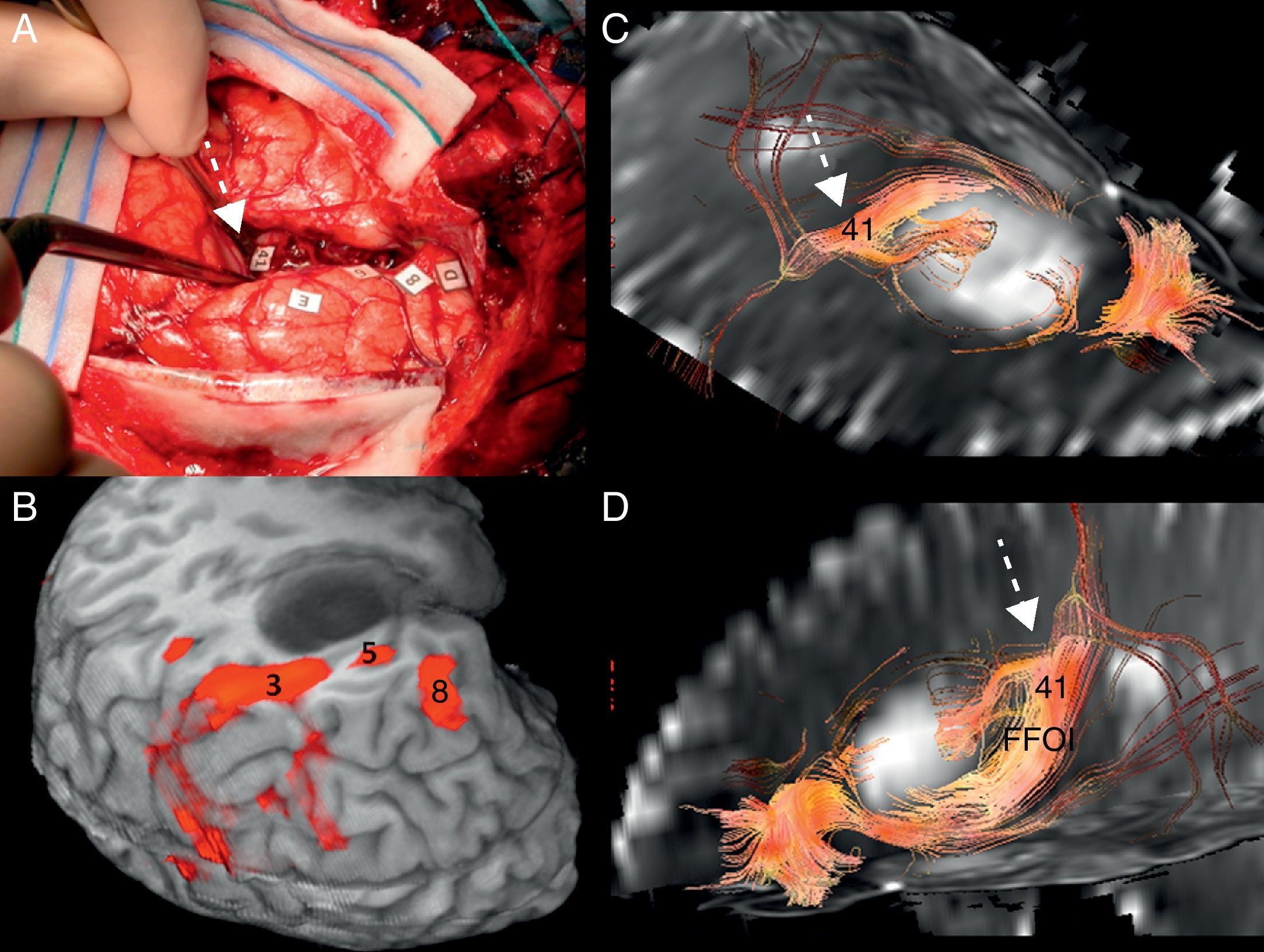
Tractografía 3D. Fascículos subcorticales funcionales implicados en el lenguaje. FA: fascículo arcuato (flecha corta continua); FFOI: fascículo frontooccipital inferior (flecha larga discontinua); FLI: fascículo longitudinal inferior (flecha larga continua); FP: haz frontoparietal; FU: fascículo uncinado (flecha corta discontinua).
Otro haz identificado fue el fascículo uncinado (fig. 2) que conecta el córtex frontotemporal anterior, no implicado aparentemente en el lenguaje. Sirve como punto de referencia en la localización del fascículo frontooccipital inferior y es punto de partida del asa de Meyer y de las radiaciones ópticas (fig. 3) (trayecto temporooccipital posterior formando parte del stratum sagital, en situación lateral al asta occipital, con curvadura medial hacia la cisura calcarina).
Las figuras 4, 5 y 6 muestran un caso representativo de correlación. Más casos pueden encontrarse en las figuras de la 7 a la 14 solo disponibles en la versión on-line.
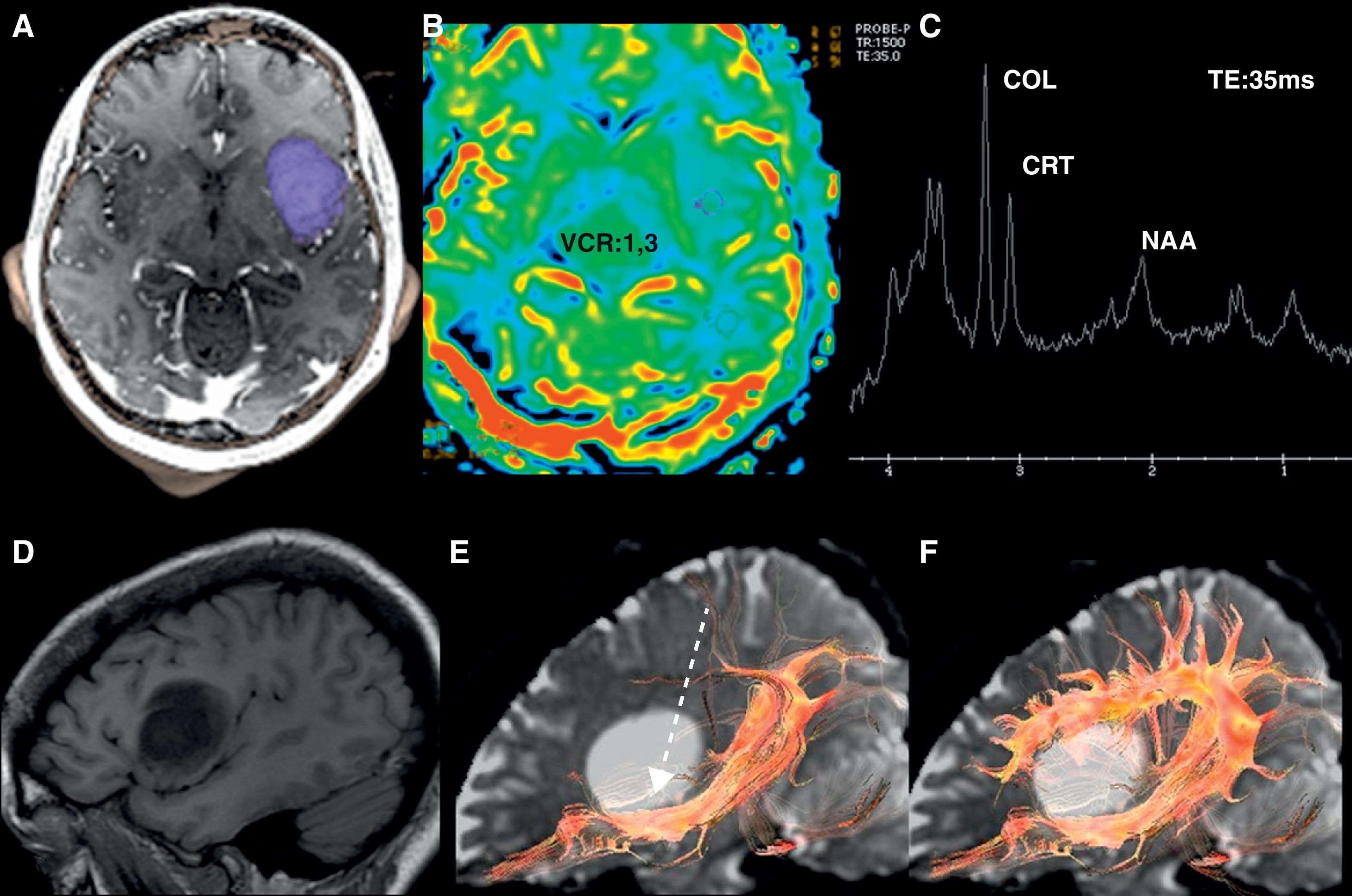
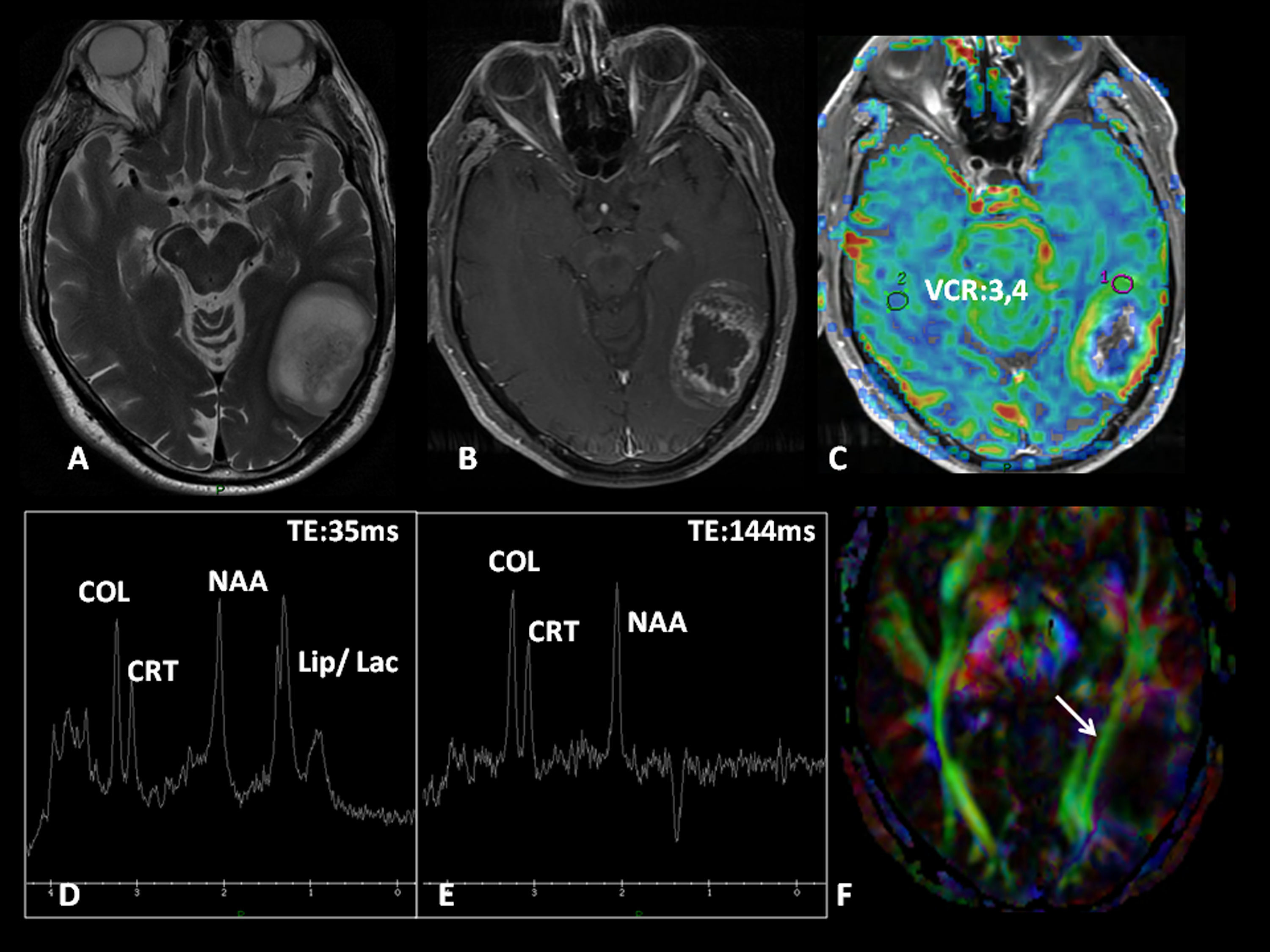
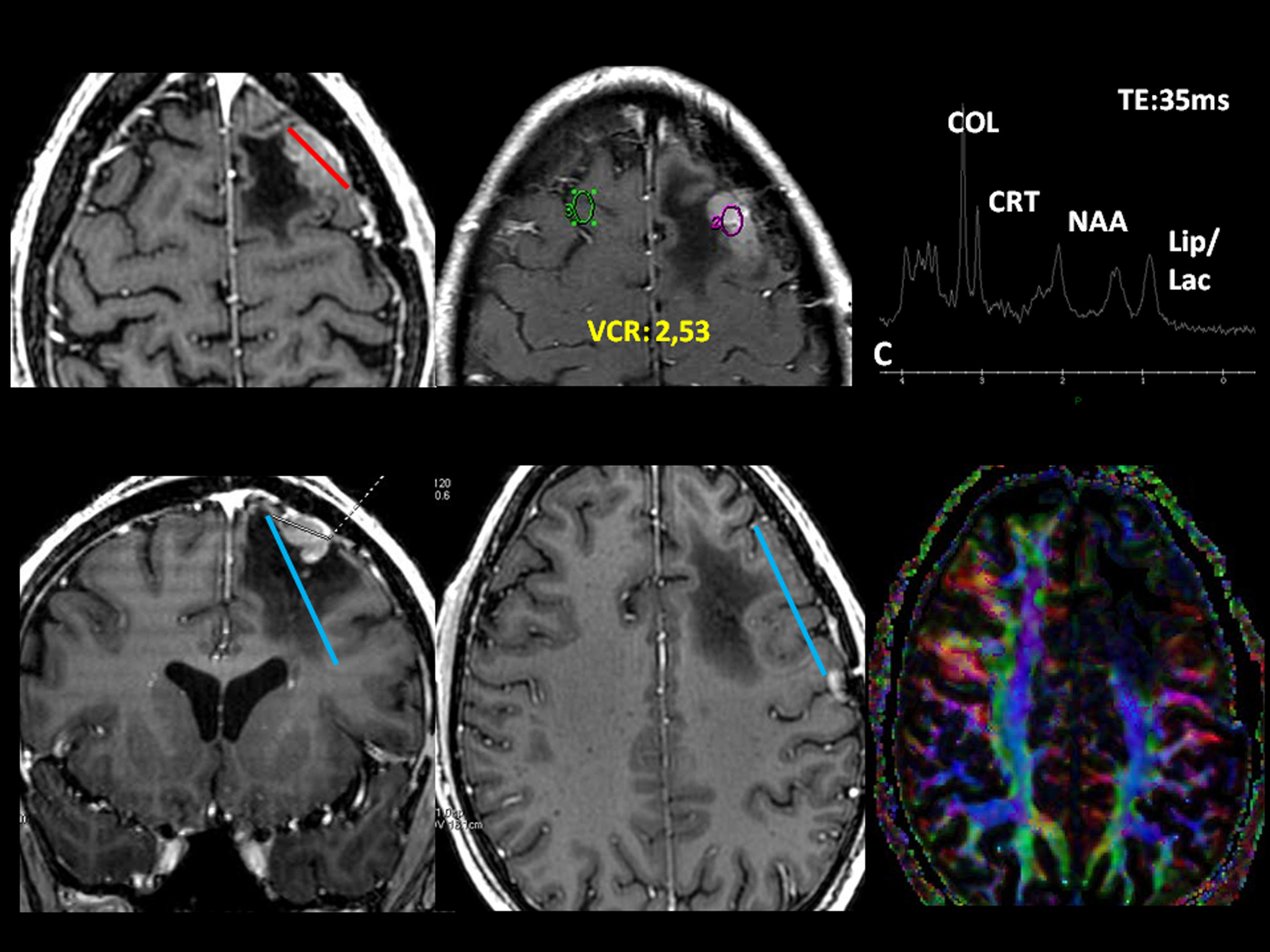
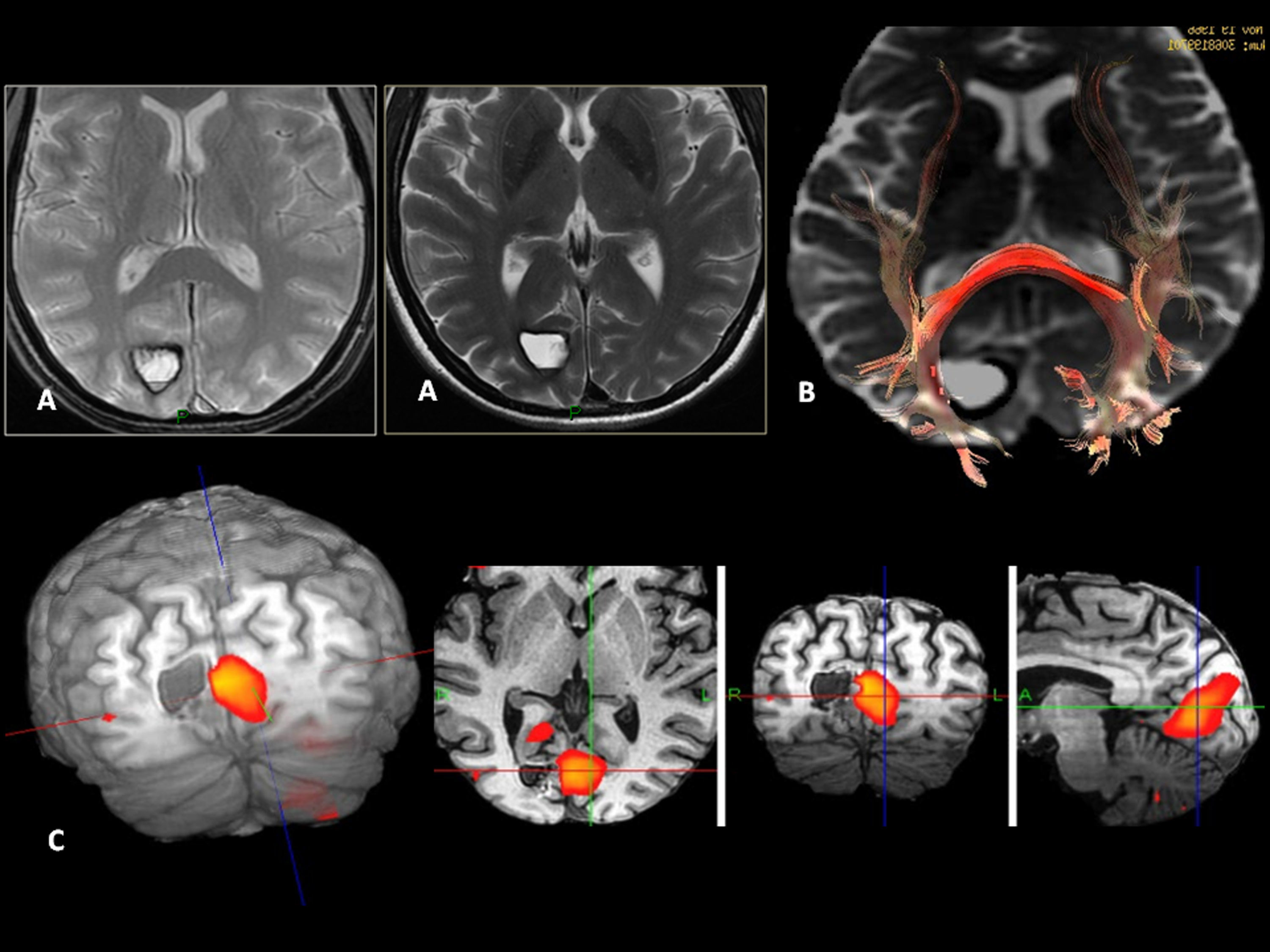
Oligodendroglioma de bajo grado en la región insular izquierda. Paciente de 25 años con antecedente de accidente de tráfico y parestesias en el miembro superior derecho. A) Lesión insular izquierda con un volumen tumoral de 25 cc. B) En el mapa de perfusión tiene un volumen sanguíneo cerebral relativo (VCR) de 1,3. C) En el estudio de espectroscopia-RM presenta incremento de colina y mioinositol, y una discreta reducción de N-acetil-aspartato. Estos son datos sugestivos de un glioma de bajo grado. D) El plano sagital T1 muestra la relación de la lesión con el opérculo frontal. E) La tractografía 3D demuestra una infiltración del tercio anterior del fascículo frontooccipital inferior (flecha discontinua). F) El fascículo arcuato está íntegro.
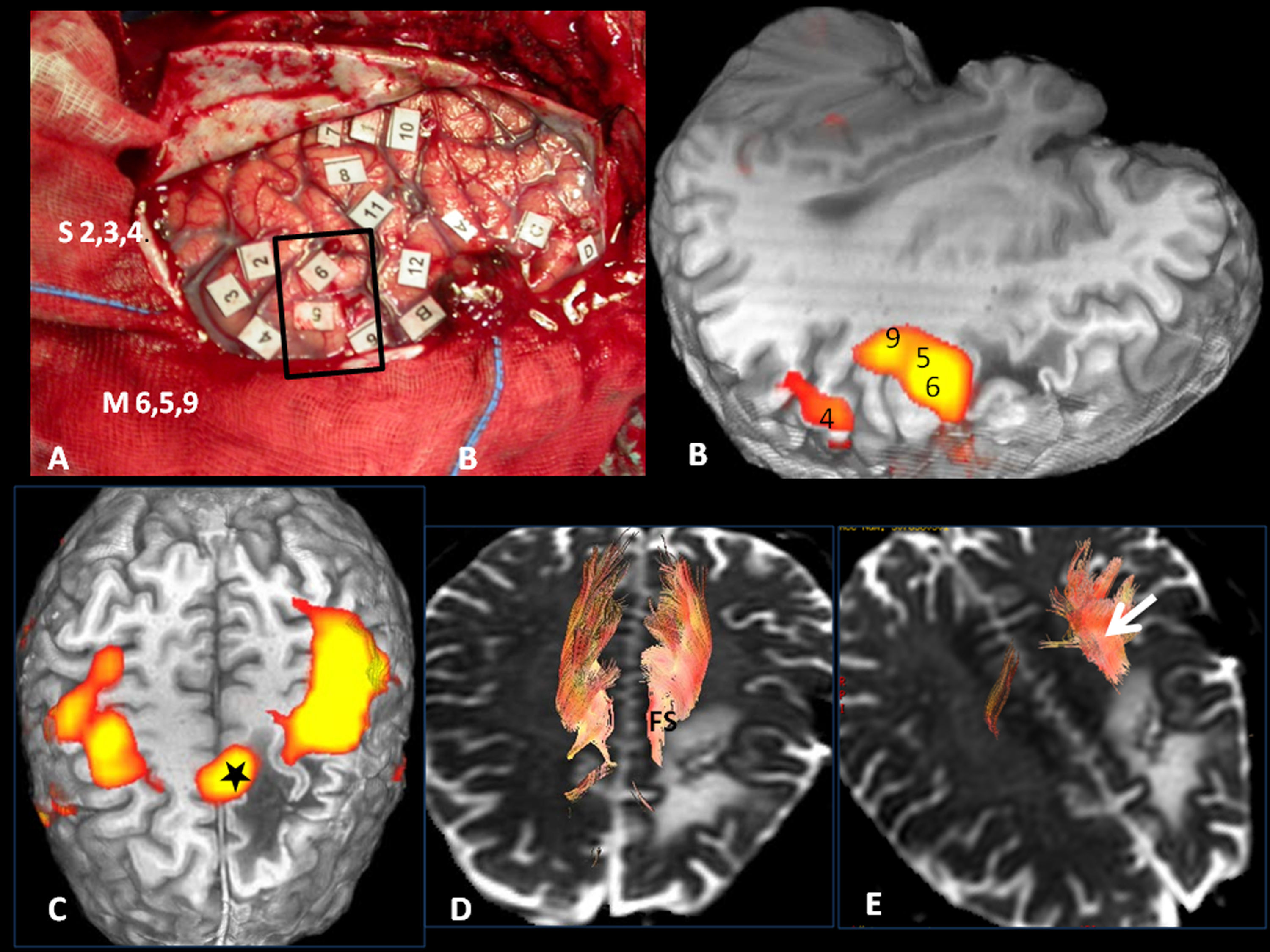
Correlación cortical entre la RM funcional y el mapeo eléctrico quirúrgico en el mismo paciente de la figura 4. A) Mapeo intraoperatorio. Paciente en decúbito lateral derecho. 4: Córtex facial motor; 3: córtex premotor; 5, 6: área de Broca; 8: eye field frontales. Correlación con la RM funcional (B, C y D): áreas de activación coincidentes con el mapeo cortical. *Área motora suplementaria. A: anterior; P: posterior.
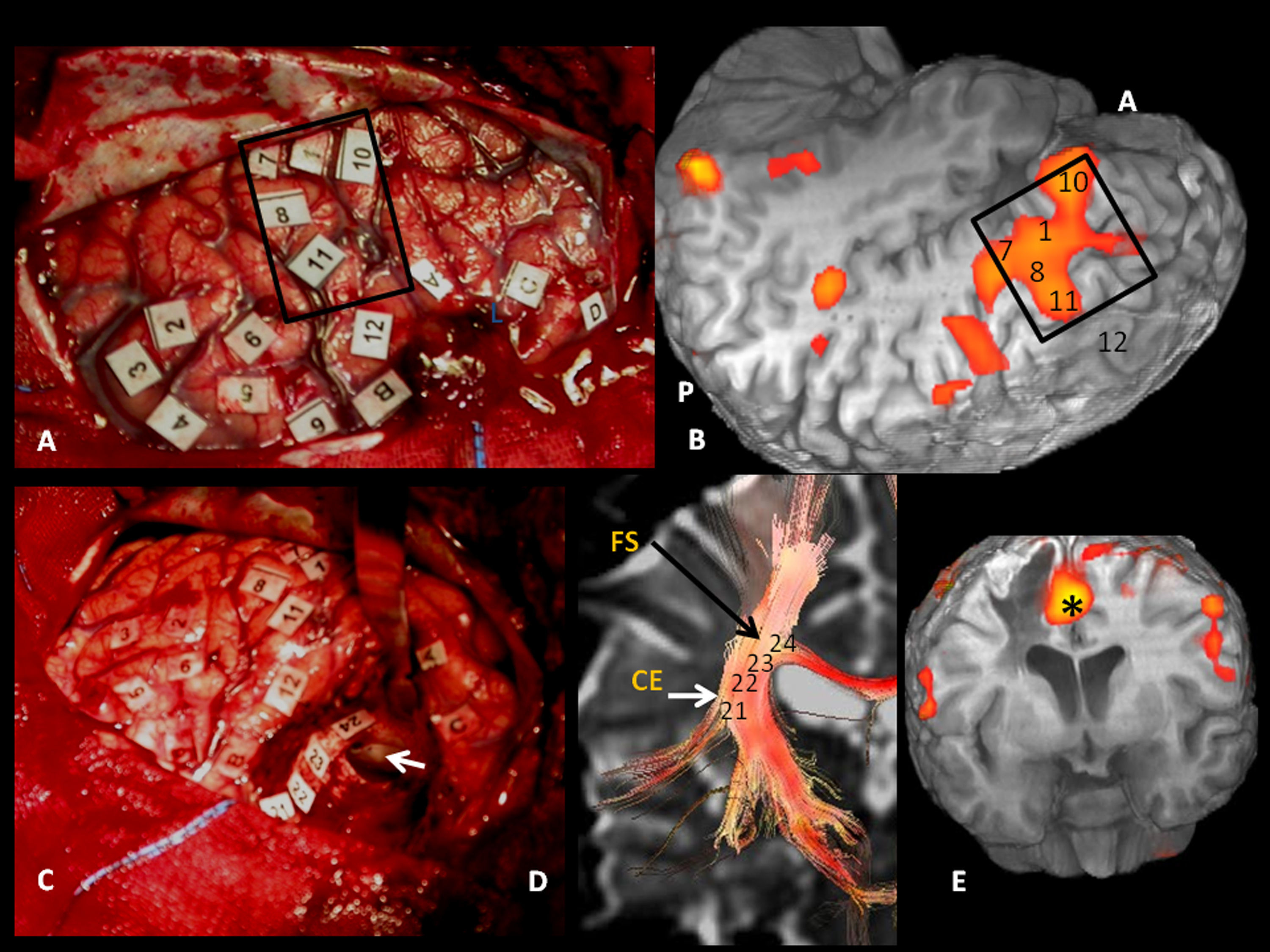
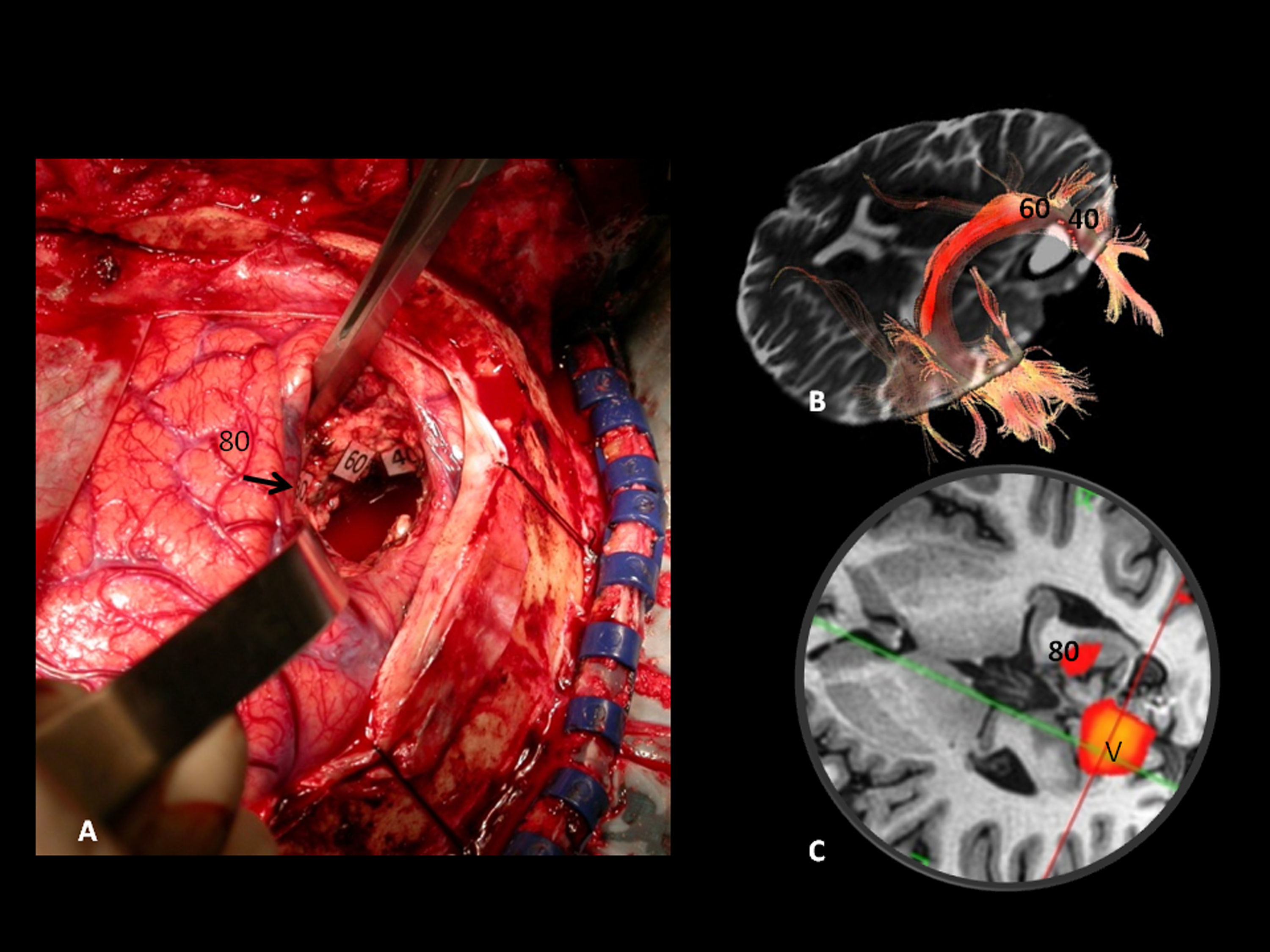
Correlación subcortical entre la imagen de tensor de difusión (ITD) y el mapeo eléctrico quirúrgico en el mismo paciente de las figuras 4 y 5. A) Mapeo subcortical intraoperatorio. Paciente en decúbito lateral derecho. 41: Fascículo frontooccipital inferior (FFOI). B) Correlación cortical con la RM funcional: 3: córtex premotor; 5: área de Broca; 8: eye field frontales. Reconstrucciones sagitales 3D-ITD del FFOI. C y D) El margen posterior del FFOI (41) (flecha) limita la resección posterior del tumor.
El tratamiento quirúrgico es la elección en los tumores cerebrales. Aunque los tumores gliales de bajo grado con volúmenes inferiores a 10cc raramente sufren transformación a alto grado, su tratamiento con terapias adyuvantes como la quimioterapia o la radioterapia es más efectivo. La optimización de los estudios funcionales y de ITD permite una adecuada resolución de las áreas corticales y de los finos haces subcorticales15,18, así como valoración «fiable» de la actividad neuronal.
El interés de nuestro artículo, que muestra una de las series más extensas de correlación de pruebas de imagen con mapeo cortical y subcortical, es la confirmación de que la RMf y la ITD le ofrecen al neurocirujano un mapa cortical y subcortical preoperatorio fiable y real.
Los paradigmas utilizados en nuestro centro son similares a los empleados en la bibliografía, principalmente de fluencia verbal, de lectura y de escucha pasiva19,20, reproducibles en todos los pacientes.
La limitación de los estudios funcionales es aún la incapacidad de cuantificar de forma exacta el área de activación, aunque probablemente este hecho sea cuestión de tiempo. Hay que recordar, que esta cuantificación tampoco es posible en el mapeo cortical ni subcortical. Quizá la mejor validación de estos estudios es la evaluación neuropsicológica pre y posquirúrgica de los pacientes sin que se perciban cambios tras la cirugía, como ocurrió en nuestros pacientes.
En conclusión, la RMf y las secuencias ITD permiten una adecuada planificación prequirúrgica de las lesiones cerebrales cercanas a las áreas elocuentes. La gran correlación de estas técnicas con el mapeo quirúrgico córtico-subcortical es indicativa del gran avance de estas técnicas de imagen.
Autoría- 1.
Responsable de la integridad del estudio: MJP, SGR y MRR.
- 2.
Concepción del estudio: MJP y SGR.
- 3.
Diseño del estudio: MJP, SGR, MRR, VMV y CRO.
- 4.
Obtención de los datos: MJP, SGR y MRR.
- 5.
Análisis e interpretación de los datos: MJP y SGR.
- 6.
Tratamiento estadístico: No procede.
- 7.
Búsqueda bibliográfica: MRR.
- 8.
Redacción del trabajo: MJP.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: MJP, SGR, MRR, VMV y CRO.
- 10.
Aprobación de la versión final: MJP, SGR, MRR, VMV y CRO.
Los autores declaran no tener ningún conflicto de intereses.
Al equipo de Técnicos de Resonancia del Departamento de Diagnóstico por la Imagen.
Roberto García (GE España).