En esta actualización se aborda el manejo de los nódulos pulmonares, solitarios o múltiples, detectados incidentalmente en estudios radiológicos que se realizan por otros motivos. Se describe la técnica de tomografía computarizada más adecuada para su evaluación, y cómo se clasifican y se miden los diferentes tipos de nódulos. También se revisan los criterios que permiten establecer el riesgo de malignidad, tanto asociados al paciente como a las características del nódulo, y, por último, las recomendaciones de manejo y seguimiento para cada tipo de nódulo en función del tamaño y el riesgo de malignidad, siguiendo fundamentalmente las guías recientemente publicadas por la Sociedad Fleischner.
This update covers the management of solitary or multiple pulmonary nodules detected incidentally in imaging studies done for other reasons. It describes the most appropriate computed tomography technique for the evaluation of these nodules, how they are classified, and how the different types of nodules are measured. It also reviews the patient-related and nodule-related criteria for determining the risk of malignancy. It discusses the recommendations in the guidelines recently published by the Fleischner Society for the management and follow-up of each type of nodules according to its size and risk of malignancy.
En estudios realizados por otros motivos se detectan de manera incidental un gran número de nódulos pulmonares, con prevalencias del 25% al 51% en voluntarios sanos y en población de cribado de cáncer de pulmón1,2. La mayoría de estos nódulos tienen baja probabilidad de malignidad3, pero son una importante fuente de ansiedad para el paciente y un reto para los clínicos y los radiólogos, que se enfrentan al desafío de evitar exploraciones y procedimientos invasivos innecesarios, sin pasar por alto el diagnóstico de un nódulo maligno.
Para ayudar en esta toma de decisiones es importante realizar un análisis meticuloso del nódulo en cuanto a su tamaño, morfología y densidad, utilizando una técnica de adquisición adecuada.
Se han elaborado diferentes guías, en permanente actualización, que pretenden estandarizar el manejo del nódulo pulmonar detectado incidentalmente, las cuales, aunque se basan en el tamaño como punto de partida, dan una mayor relevancia a la probabilidad de malignidad asociada al propio nódulo y a otros factores de riesgo del paciente4–9.
Clasificación de los nódulos pulmonaresEl nódulo pulmonar solitario se define como una opacidad redondeada, bien o mal definida, menor o igual a 3cm, rodeada de parénquima pulmonar y no asociada a adenopatías, atelectasia o derrame pleural. Las lesiones mayores de 3cm se denominan masas y se consideran malignas mientras no se demuestre lo contrario.
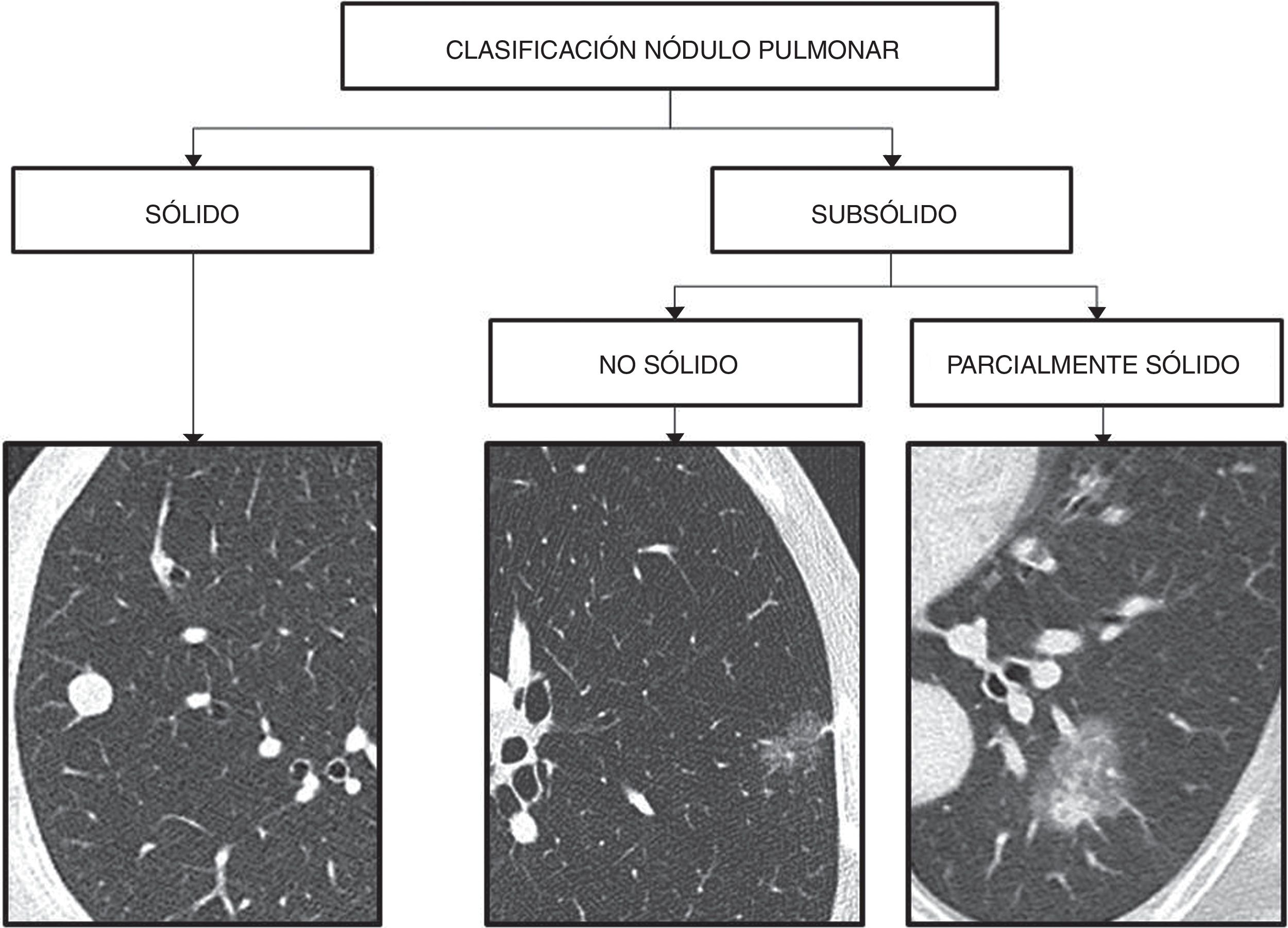
Los nódulos pulmonares se clasifican según su densidad en sólidos y subsólidos, que a su vez se dividen en no sólidos (opacidad “en vidrio deslustrado” que no oculta las estructuras broncovasculares) y parcialmente sólidos (opacidad “en vidrio deslustrado” con una parte sólida)8,10–12 (fig. 1).
Los nódulos sólidos representan granulomas, cicatrices, ganglios linfáticos, neoplasias primarias o metástasis.
La mayoría de los nódulos subsólidos son transitorios y secundarios a infección o hemorragia. Cuando son persistentes, a menudo representan patología en el espectro del adenocarcinoma; los nódulos no sólidos corresponden a adenocarcinomas no invasivos, mínimamente invasivos o de patrón predominantemente lepídico, y la mayoría de los nódulos parcialmente sólidos corresponden a adenocarcinomas invasivos13–15.
Dividir los nódulos en estas categorías no es fácil y está sujeto a una gran variabilidad interobservador con concordancias solo “buenas”, incluso para radiólogos con experiencia, de 0,62 y 0,67 para nódulos sólidos y no sólidos, respectivamente16,17. En un estudio publicado solo se clasificaron correctamente el 58% de los nódulos16 y en otro hubo un 36,4% de discordancias17.
Técnica de tomografía computarizadaEs necesario utilizar estrategias que permitan obtener estudios con dosis de radiación bajas no superiores a 3 mGy de CTDI (Computed Tomographic Dose Index) volumen, pero que a su vez permitan caracterizar correctamente el nódulo.
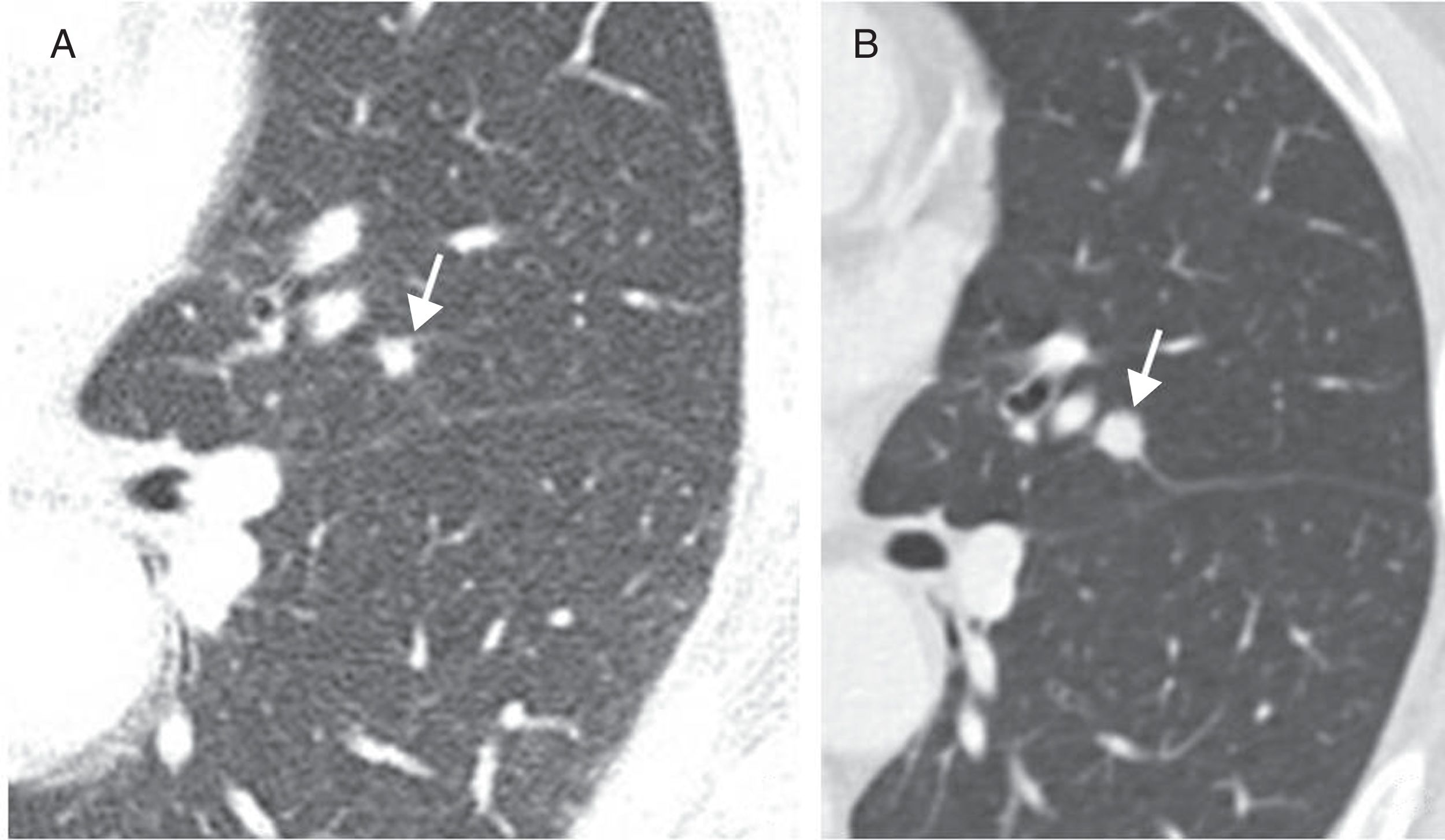
Los factores técnicos más importantes que se han de tener en cuenta son el grosor de corte y el filtro de reconstrucción. Deben utilizarse grosores de corte iguales o superiores a 1,5mm para evitar el efecto de volumen parcial y reconstruir las imágenes con filtros de realce de bordes y de partes blandas, para medir y clasificar correctamente los nódulos como sólidos, no sólidos o parcialmente sólidos, y para identificar la presencia de grasa o calcio, que permiten caracterizar el nódulo y evitar seguimientos posteriores8,9,18,19(fig. 2).
La administración de contraste intravenoso no es necesaria, especialmente en los estudios de seguimiento.
Se deben analizar las imágenes con ventana de pulmón (nivel -700 a -500 unidades Hounsfield [UH], ancho 1.500 a 2.000 UH) y de mediastino (nivel 30-70 UH, ancho 350-400 UH) tanto en el plano axial como en los planos sagital y coronal, que ayudan a diferenciar nódulos de cicatrices.
Cuando un nódulo es detectado incidentalmente en una tomografía computarizada (TC) con grosor de corte mayor, hay que hacer un estudio a corto plazo con un grosor igual o inferior a 1,5mm, que se utilizará como el estudio de referencia para el seguimiento. Los estudios de seguimiento deben hacerse con la misma técnica para evitar la variabilidad (fig. 3).
Varón de 70 años al que se le detecta incidentalmente un nódulo parcialmente sólido en lóbulo superior izquierdo. A) Imagen con grosor de 2mm y filtro de reconstrucción de partes blandas. B) Control de tomografía computarizada a los 3 meses con grosor de 1,5mm y filtro de reconstrucción de realce de bordes que confirma la persistencia del nódulo y permite identificar con mayor claridad los diferentes componentes, además de la presencia de seudocavitación (flecha blanca). La biopsia confirmó la sospecha de adenocarcinoma con patrón de crecimiento lepídico.
Las medidas se han de realizar en las imágenes con ventana de pulmón y filtro de realce de bordes, en el plano donde se vea el diámetro mayor del nódulo, aunque preferentemente en el plano axial. Las medidas en planos oblicuos no se recomiendan porque no son reproducibles8,18.
La práctica estandarizada es la medición manual lineal con calibradores electrónicos. La medida automatizada o semiautomatizada del volumen del nódulo parece que es más sensible a los cambios de tamaño y es la recomendada por los diferentes grupos de cribado de cáncer de pulmón:
Medida manual linealLos nódulos menores de 3mm no tienen que ser medidos y nos referiremos a ellos como micronódulos.
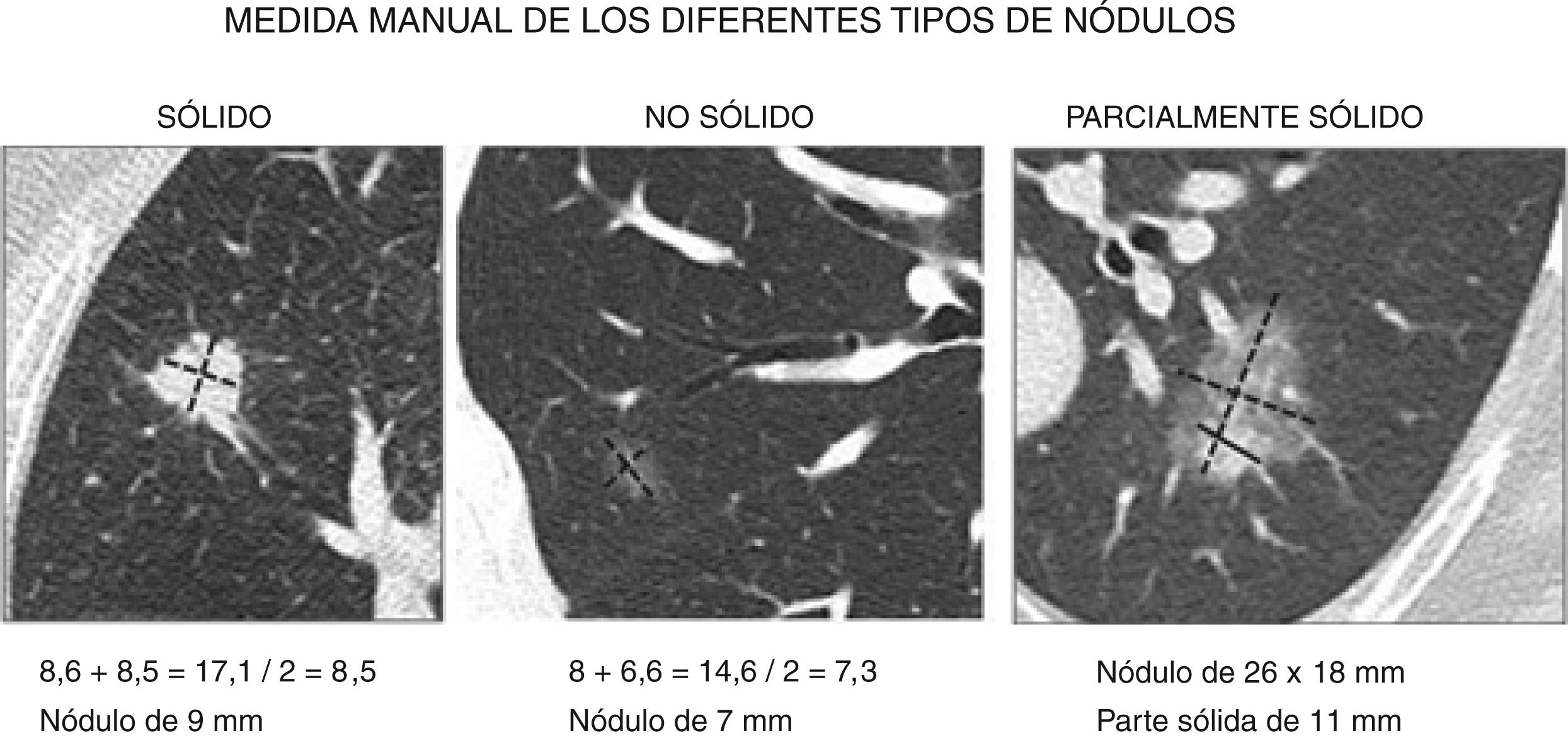
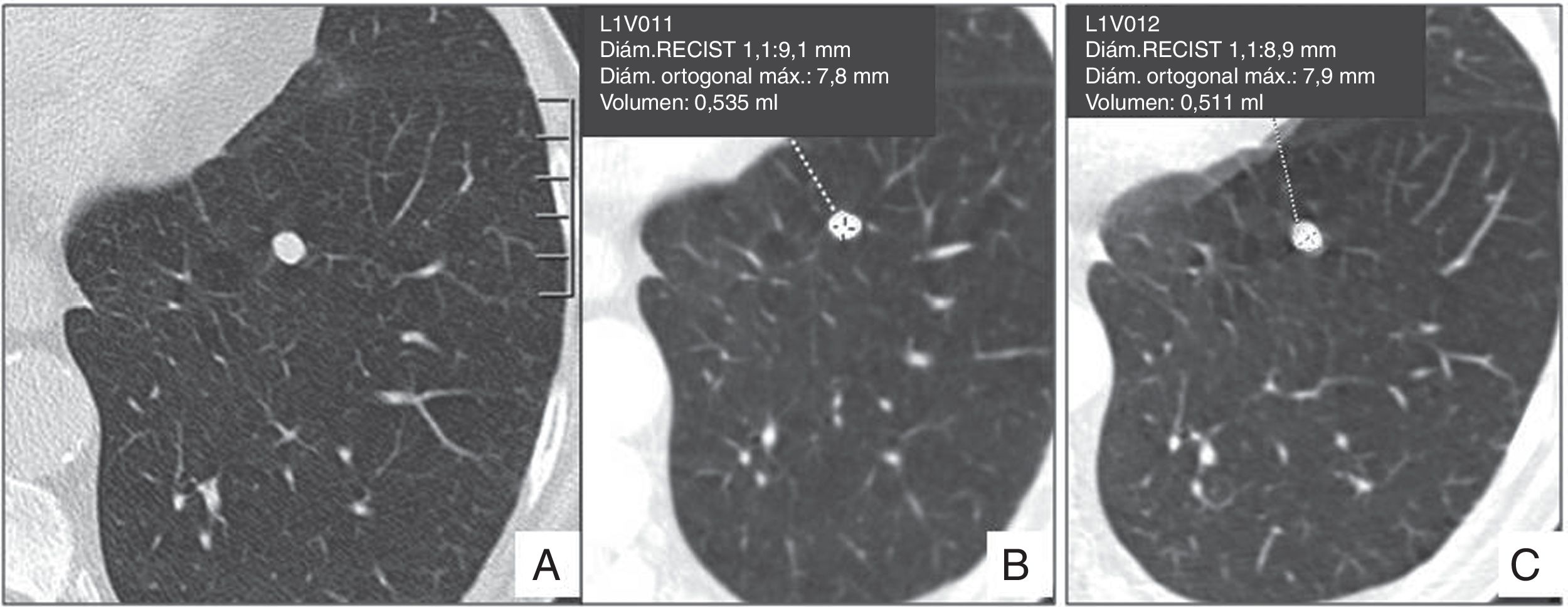
En los nódulos menores de 10mm, la sociedad Fleischner4,8,18 recomienda medir en el mismo plano (axial, coronal o sagital) el diámetro mayor en el eje largo y, perpendicular a este, el diámetro mayor en el eje corto. El tamaño final es la media de estos dos diámetros. Los números decimales se redondean al número entero más cercano, es decir 5,1 a 5mm, 5,5 a 6mm, 5,6 a 6mm, etc. (fig. 4).
Medida manual de los diferentes tipos de nódulos. En los nódulos menores de 10mm el tamaño final corresponde a la media de los diámetros en el eje largo y en el eje corto, y en los mayores de 10mm se proporcionarán ambos diámetros en lugar de la media. En los nódulos parcialmente sólidos se proporcionarán la medida total y el diámetro mayor del componente sólido.
En nódulos menores de 10mm la media de los dos diámetros se correlaciona mejor con el volumen y con la probabilidad de malignidad que la medida del diámetro mayor18. Además, parece que el grado de esfericidad del nódulo se relaciona con el pronóstico, el cual es peor en los más irregulares20.
En los nódulos parcialmente sólidos hay que obtener la medida total, incluida la zona de vidrio deslustrado, igual que en el nódulo sólido, y además el diámetro mayor de la parte sólida cuando sea mayor de 3mm. Si existen varios componentes sólidos se mide el de mayor tamaño y se describen los demás sin medirlos.
Los nódulos parcialmente sólidos también pueden ser analizados comparando las imágenes con ventana de pulmón y mediastino. Cualquier parte del nódulo visible en la ventana de mediastino se considera sólido, y si no es visible es vidrio deslustrado. Este método de análisis mejora la concordancia interobservador y aumenta la especificidad para el diagnóstico de adenocarcinoma invasivo10.
En los nódulos espiculados se debe medir solo el centro sólido excluyendo las espiculaciones.
En los nódulos de más de 10mm se proporcionarán los diámetros en el eje largo y en el eje corto, en lugar de la media. En la estadificación del carcinoma de pulmón, para evaluar el descriptor T y la respuesta al tratamiento se utilizará el diámetro mayor21,22.
Cuando hay múltiples nódulos se medirá únicamente el nódulo de mayor tamaño o el más sospechoso.
Medida volumétrica automática o semiautomáticaEs menos sensible a la variabilidad y por tanto más reproducible, pero las medidas obtenidas están muy influenciadas tanto por la técnica de adquisición como por el tipo de programa utilizado y por las características de la lesión23–25). Por tanto, antes de hacer una recomendación generalizada de su uso, es necesario conocer mejor los factores responsables de la variabilidad entre los estudios de TC y los diferentes programas. En cualquier caso, deben hacerse siempre con el mismo para que la comparación de las medidas sea exacta. Por regla general 100mm3 = 6mm; 100-250mm3 = 6-8mm y más de 250mm3 = 8mm o superior.
La medida de la atenuación es importante para mostrar la presencia de calcio o grasa, lo cual tiene implicaciones en el diagnóstico. Se utilizará una región de interés y no un punto único, y se hará sobre una imagen con el grosor de corte más bajo de que se disponga reconstruida con filtro de partes blandas y ventana de mediastino.
Siempre hay que tener en cuenta la enorme variabilidad inter e intraobservador en las medidas, especialmente importante en los nódulos de morfología compleja y en los parcialmente sólidos, que es debida al observador, a la técnica de la TC, al grado de inspiración que realice el paciente, a otras lesiones en el parénquima adyacente, etc. Esta variabilidad puede dar lugar a falsos positivos y negativos a la hora de evaluar el crecimiento de un nódulo en los controles posteriores. Para evitar este problema, se considerará que hay cambios en el tamaño cuando el diámetro medio haya aumentado o disminuido en al menos 2mm, redondeado al milímetro más cercano6,7,18.
Factores de riesgo para malignidadCuando nos enfrentamos al manejo de un nódulo pulmonar detectado incidentalmente, lo primero que se debe hacer es valorar el riesgo de malignidad asociado a las características del nódulo y al propio paciente. Los pacientes con riesgo preprueba bajo (0-5%) pueden ser manejados de forma conservadora. Los pacientes con riesgo intermedio (5-65%), que representan casi la mitad, requieren estudios adicionales, y los de riesgo alto (más del 65%), deben ser manejados de forma más agresiva. Se han elaborado modelos de estimación de riesgo (véanse en http://www.brocku.ca/cancerpredictionresearch)3,6,7 (tabla 1 y fig. 5).
Factores de riesgo para malignidad
| Probabilidad de malignidad | ||
|---|---|---|
| Baja (<5%) | Intermedia (5-65%) | Alta (>65%) |
| No fumador | Características de los dos grupos | Fumador de ≥ 30 paquetes/año |
| Menor de 40 años | Mayor de 60 años | |
| Sin antecedentes de cáncer | Antecedentes de cáncer | |
| Bordes lisos | Bordes espiculados | |
| Lóbulos medios o inferiores | Lóbulos superiores |
Nódulos de alto riesgo para malignidad. A) Varón de 70 años con nódulo sólido de bordes espiculados en lóbulo superior derecho. B) Nódulo parcialmente sólido con imágenes de seudocavitación (flecha). C) Hombre de 85 años con enfisema extenso y nódulo solido de bordes lobulados en lóbulo superior izquierdo (flecha). En los tres casos se indica biopsia con el resultado de carcinoma epidermoide en A y C, y adenocarcinoma invasivo en B.
Las características del nódulo pulmonar y del paciente que se han de tener en cuenta para determinar el riesgo de malignidad son las siguientes:
TamañoEstá claramente asociado con el riesgo de malignidad y es un factor dominante en el manejo. El riesgo estimado de malignidad es inferior al 1% para los nódulos sólidos menores de 6mm y del 0,5% al 2% para los nódulos de 6-8mm en pacientes de alto riesgo3. En la población de cribado del estudio NELSON, la incidencia de malignidad en los nódulos mayores de 10mm fue del 15,2%26.
Densidad y morfologíaSegún su densidad, los nódulos se clasifican en sólidos y subsólidos (parcialmente sólidos y no sólidos)27–29.
Muchos nódulos subsólidos son transitorios, secundarios a infección o hemorragia. Cuando son persistentes, el tamaño y la presencia de componente sólido se asocia a un comportamiento invasivo. Los nódulos parcialmente sólidos persistentes con una parte sólida mayor de 6mm se consideran malignos mientras no se demuestre lo contrario. Comparados con los nódulos sólidos, tienen un crecimiento más lento y un mayor riesgo de malignidad30,31. En un estudio de Henschke et al. fueron malignos el 63% de los nódulos parcialmente sólidos, el 18% de los no sólidos y el 7% de los sólidos28. En la evolución de estos nódulos, la aparición de un componente sólido se asoció con adenocarcinoma invasivo en el 100% de los casos, mientras que el aumento de tamaño por sí solo se asoció en un 44,4%15.
Los bordes espiculados de un nódulo pulmonar se asocian a una alta probabilidad de malignidad, los bordes lobulados a una probabilidad intermedia y los bordes lisos a baja probabilidad de malignidad. La presencia de broncograma o burbujas aéreas (seudocavitación) en un nódulo es un signo de malignidad que se ve con más frecuencia en adenocarcinomas32.
Las calcificaciones difusas, centrales, en láminas o en palomitas de maíz se consideran patrones de benignidad a no ser que el paciente tenga antecedentes de neoplasia. La calcificación difusa puede verse en metástasis de condrosarcoma y osteosarcoma, y la central y en palomitas de maíz en las de tumores del tracto gastrointestinaI o tratados con quimioterapia19.
La presencia de grasa es un signo de benignidad que puede verse en hamartomas, lipomas o granulomas lipoideos33.
LocalizaciónLa mayoría de los cánceres se localizan en los lóbulos superiores, sobre todo en el lóbulo superior derecho.
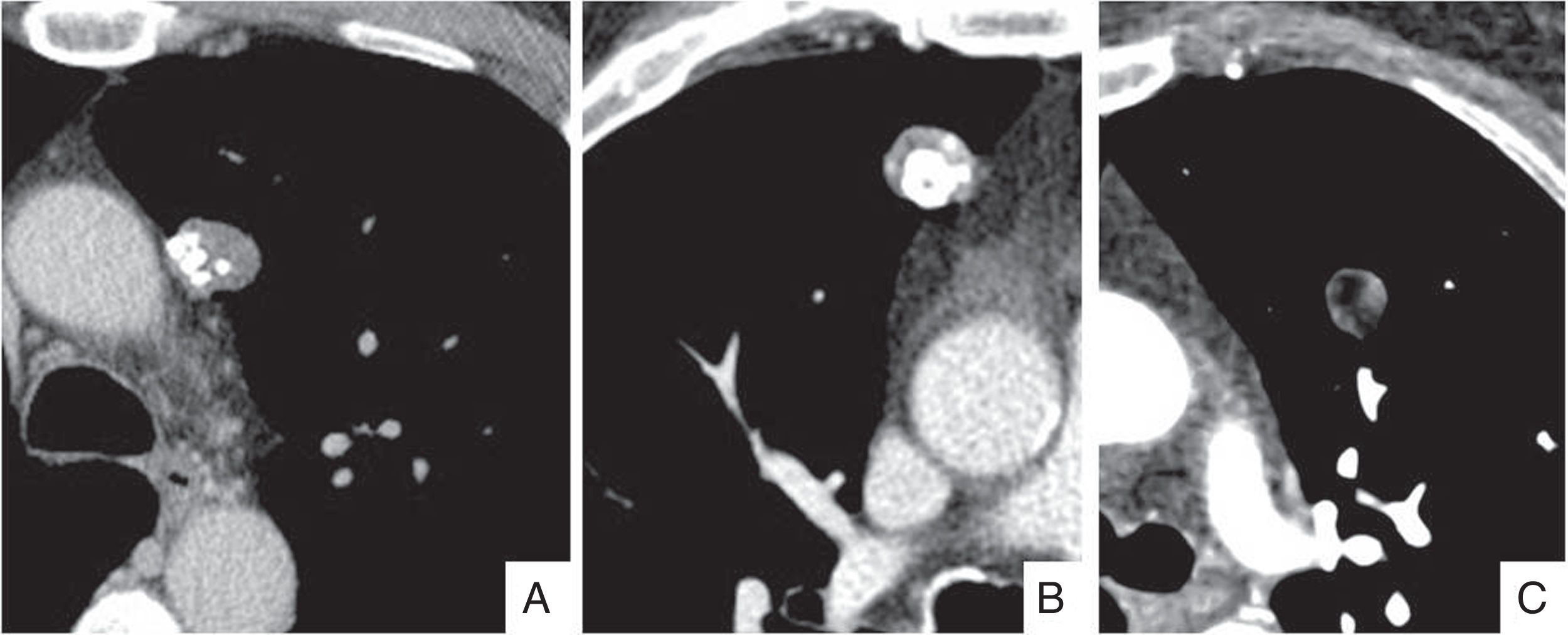
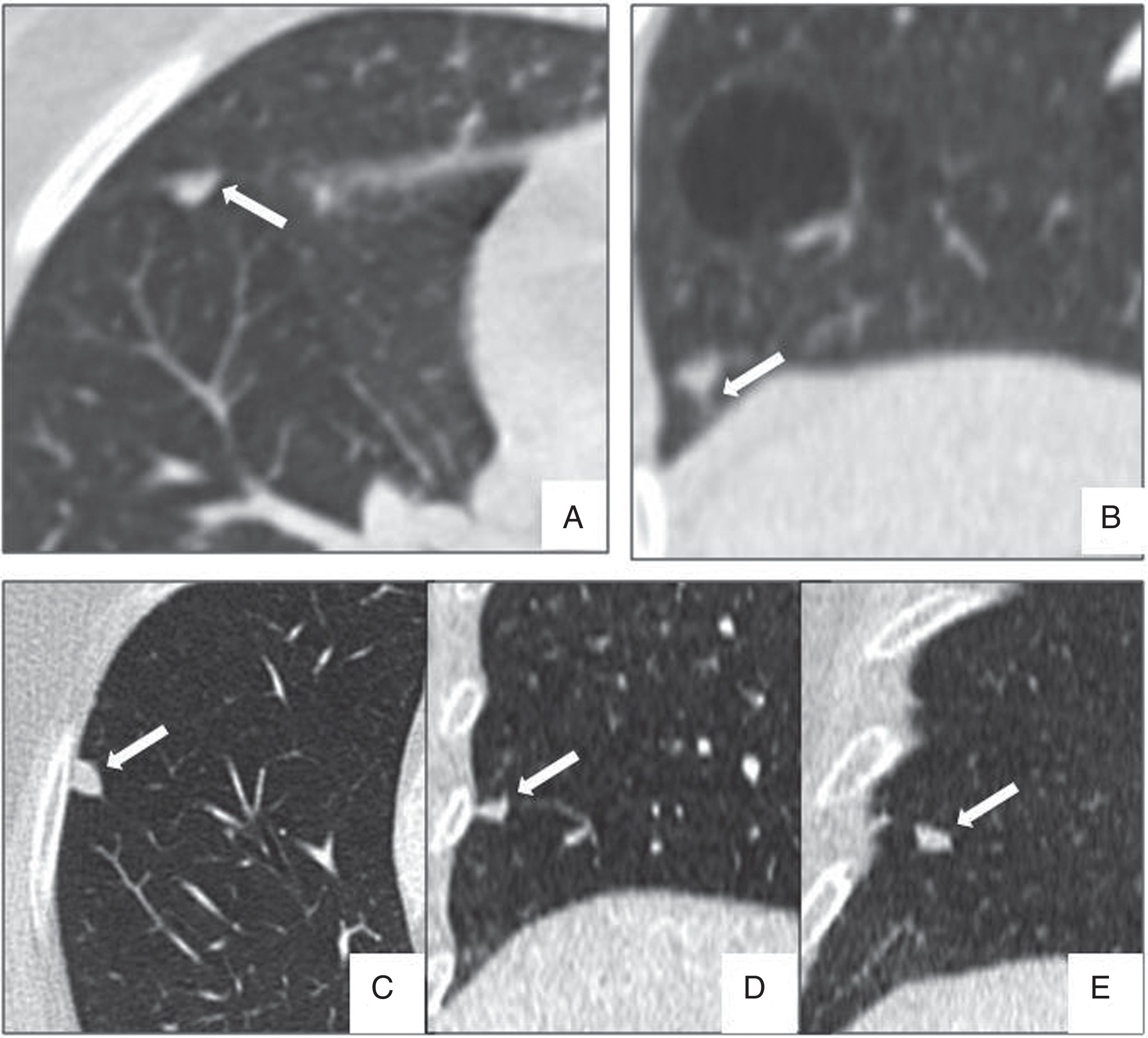
Los ganglios pericisurales e intrapulmonares son nódulos sólidos de densidad homogénea, bordes lisos bien definidos y morfología redondeada, trapezoide, triangular o lentiforme, localizados frecuentemente por debajo de la carina, en contacto con alguna cisura o a menos de 15mm de la superficie pleural, y muchas veces presentan una línea septal que les une a la pleura34–36. En una población de cribado, ninguno de los cánceres diagnosticados asentó sobre un nódulo pericisural tras un seguimiento de 7,5 años34. Las reconstrucciones multiplanares son muy útiles para identificar la morfología típica de estos ganglios intrapulmonares que pueden crecer y no necesitan seguimiento, aunque su tamaño sea superior a 6mm (fig. 6).
Características morfológicas típicas de los ganglios pericisurales e intrapulmonares benignos. A) Imagen axial de nódulo incidental en paciente con fallo cardíaco, que presenta morfología triangular con base en la cisura menor (flecha). B) Septo lineal hacia la pleura diafragmática muy característico (flecha). C-E) Reconstrucciones multiplanares en las que se aprecia un ganglio intrapulmonar en contacto con la pleura, con morfología lenticular en el plano axial (C), triangular en el plano coronal (D) y trapezoide en el plano sagital (E).
En el estudio NELSON de cribado del cáncer de pulmón se vio que el riesgo de malignidad aumenta cuando se pasa de 1 a 4 nódulos, pero disminuye cuando hay más de 5 nódulos, en cuyo caso lo más probable es que sean debidos a enfermedades granulomatosas. La probabilidad de cáncer fue del 3,6% cuando había un solo nódulo, del 4,1% cuando había dos nódulos, del 4,8% para tres nódulos, del 6,3% para cuatro nódulos y del 3,3% para más de cuatro nódulos, si bien estas diferencias no fueron significativas37.
Enfisema y fibrosisEl enfisema y la fibrosis pulmonar idiopática, que pueden asociarse a nódulos incidentales, son factores de riesgo independientes de malignidad.
Tabaco y otros carcinógenos inhaladosFumar cigarrillos es el factor de riesgo más importante para el desarrollo de cáncer de pulmón, con un incremento del riesgo del 10% al 35% con respecto a los no fumadores, asociación que es más fuerte en el carcinoma de célula pequeña y escamoso, y más débil en el adenocarcinoma. Una historia de 30 paquetes año o más, o haber dejado de fumar en los últimos 15 años, se considera un factor de alto riesgo en los nódulos pulmonares sólidos. Los fumadores pasivos también tienen un riego aumentado, aunque menor.
La forma en que el tabaco afecta al desarrollo de adenocarcinoma es incierta y, por ello, las recomendaciones para el manejo de los nódulos subsólidos son independientes de esta categoría de riesgo.
No se ha probado si algún componente de los cigarrillos electrónicos es un factor de riesgo.
Otros carcinógenos inhalados a tener en cuenta son: asbesto, uranio, radón y sílice.
EdadLa edad avanzada es un factor de riesgo. El cáncer de pulmón es muy raro antes de los 35 años y raro antes de los 40 años, pero a partir de esta edad se incrementa la frecuencia en cada década.
SexoEl sexo femenino se ha relacionado con un mayor riesgo en los nódulos subsólidos.
Historia familiarLa historia familiar de cáncer de pulmón aumenta el riesgo de cáncer tanto en fumadores como en no fumadores. Se asocia con un riesgo relativo de 1,5 cuando hay un hermano afectado, que pasa a ser de 1,8 cuando se trata de un gemelo.
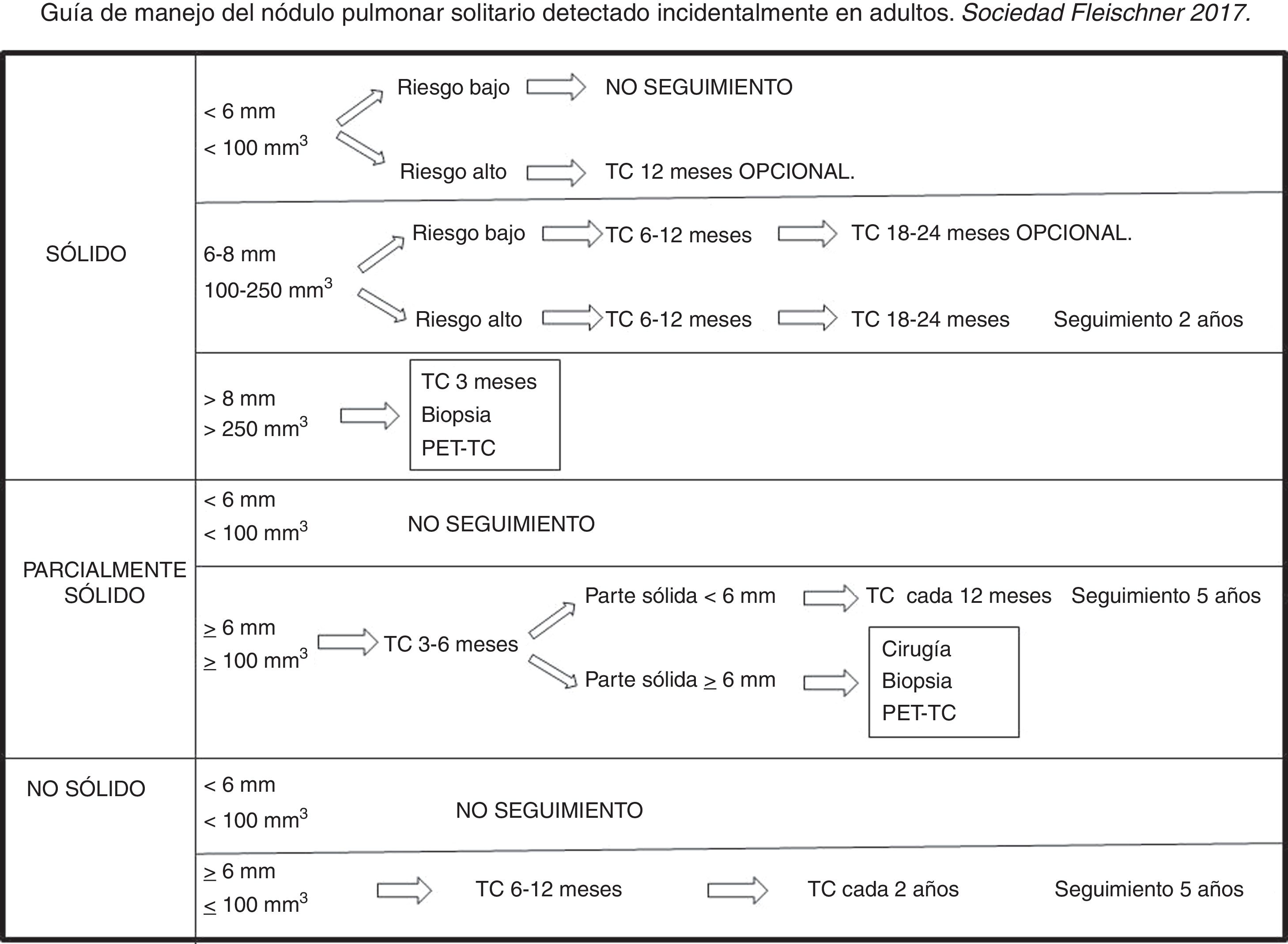
Guías de manejo del nódulo pulmonar solitario incidentalLos cánceres tienen un rango amplio de velocidad de crecimiento dependiendo de la morfología, densidad e histología. Los intervalos de seguimiento recomendados tienen como objetivos, por un lado, minimizar el número de exploraciones, y por otro, evitar que un cáncer en crecimiento avance de estadio durante el intervalo de seguimiento.
El tiempo de duplicación del volumen en los nódulos sólidos está establecido en 100-400 días38. Para los nódulos subsólidos es de 3-5 años, por eso se recomiendan intervalos de seguimiento más largos durante más tiempo39,40.
En 2005, la Sociedad Fleischner publicó las primeras guías de manejo del nódulo pulmonar solitario sólido4; en 2013, las guías de manejo del nódulo subsólido5, y en 2017 se publicaron las últimas guías para el manejo del nódulo pulmonar solitario, sólido y subsólido, detectado incidentalmente8. Las guías de la Sociedad Fleischner son, junto con las guías de la British Thoracic Society, publicadas en 2015, las que tienen un seguimiento más amplio6,7.
El objetivo de estas nuevas guías es reducir el número de exploraciones innecesarias y dar más autonomía en el manejo al clínico, al radiólogo y al paciente. De esta manera, los factores de riesgo y las preferencias del paciente determinarán un manejo más agresivo o más conservador; además, los períodos de seguimiento se expresarán en intervalos de tiempo.
Las guías de la Sociedad Fleischner tienen como ámbito de aplicación los nódulos incidentales encontrados en pacientes mayores de 35 años. No son aplicables en los siguientes escenarios clínicos:
- •
Nódulos detectados en menores de 35 años, que deben ser manejados de forma individualizada debido al bajo riesgo de cáncer, la etiología infecciosa es la más probable y hay que evitar estudios de seguimiento.
- •
Nódulos en pacientes con neoplasias primarias conocidas con un riesgo alto de tener metástasis.
- •
Nódulos en pacientes inmunodeprimidos con riesgo alto de infección.
- •
Nódulos encontrados en estudios de cribado de cáncer de pulmón, para los cuales ya existen guías específicas.
Se asume no hacer seguimiento de rutina cuando el riesgo de cáncer es inferior al 1% (nódulos sólidos menores de 6mm).
Excepcionalmente, los nódulos que se identifican claramente en la radiografía de tórax pueden ser seguidos con radiografía, debido al menor coste y a la menor radiación.
Siempre se deben revisar los estudios previos del paciente ya que, si nos permiten confirmar la estabilidad durante 2 años de un nódulo sólido o durante 5 años de un nódulo subsólido, no serán necesarios más estudios de seguimiento.
Las TC de seguimiento deben hacerse con la misma técnica que el estudio basal para disminuir la variabilidad asociada a la técnica. Se comparará el estudio actual con el último estudio para estimar el intervalo de crecimiento y con el primer estudio en el que se haya detectado el nódulo, lo que aumentará la seguridad en la evaluación del crecimiento o estabilidad a largo plazo.
Estas guías son una sugerencia de manejo general que en ningún caso sustituyen al manejo clínico individualizado para cada paciente (fig. 7).
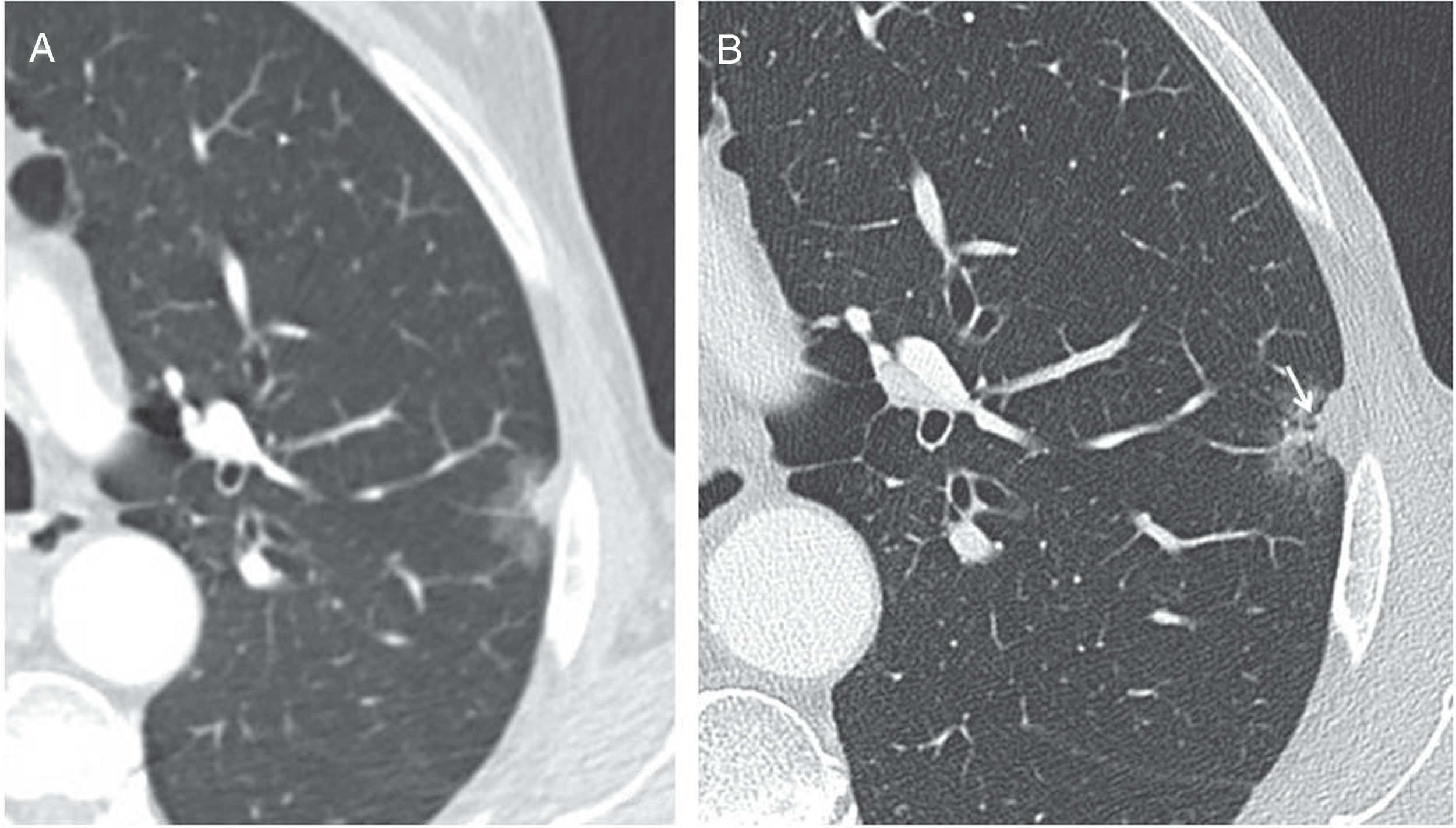
Nódulo menor de 6mm. Los nódulos menores de 6mm en pacientes de bajo riesgo no necesitan seguimiento. El riesgo de cáncer es inferior al 1% en fumadores y todavía más bajo en pacientes de bajo riesgo. En el programa de cribado de cáncer de pulmón NELSON, el riesgo de desarrollar cáncer no fue mayor en los pacientes con nódulos menores de 100mm3 de volumen o menores de 5mm de diámetro que en aquellos sin nódulos26.
Se recomienda control a los 12 meses solo cuando tienen morfología sospechosa y/o se localizan en lóbulos superiores, ya que en este caso el riesgo de cáncer se sitúa entre el 1% y el 5%25 (fig. 8). Un control a más corto plazo no es necesario porque raramente estos nódulos cambian de estadio en un período inferior a 12 meses. Solo será necesario realizar un control más a corto plazo cuando la calidad técnica de la TC no sea adecuada o en pacientes a los que un control a largo plazo les genere ansiedad.
Mujer de 50 años sin factores de riesgo. A) Nódulo sólido de 4mm en lóbulo superior izquierdo (flecha) que presenta unos bordes discretamente espiculados. Dado que se trata de un nódulo sospechoso de malignidad, se aconseja un control en 12 meses. B) En la tomografía computarizada a los 12 meses el nódulo mide 8mm (flecha), motivo por el cual se indica una biopsia con el resultado de adenocarcinoma invasivo.
Nódulo de 6-8mm. En pacientes de bajo riesgo se recomienda control en 6-12 meses, dependiendo de la morfología, el tamaño y las preferencias del paciente. Si el nódulo tiene una morfología benigna, es fácil de medir e inequívocamente estable, no es necesario completar un seguimiento de 2 años y se puede finalizar a los 12-18 meses. Si el crecimiento es incierto o la morfología es sospechosa de malignidad, se hace un segundo control a los 18-24 meses.
En pacientes de alto riesgo, en los que la probabilidad de malignidad es del 0,5-2%, se recomienda un control inicial a los 6-12 meses y un segundo control a los 18-24 meses. Dos exploraciones son suficientes en la mayoría de los pacientes, pero cuando el crecimiento es incierto se puede hacer un control adicional.
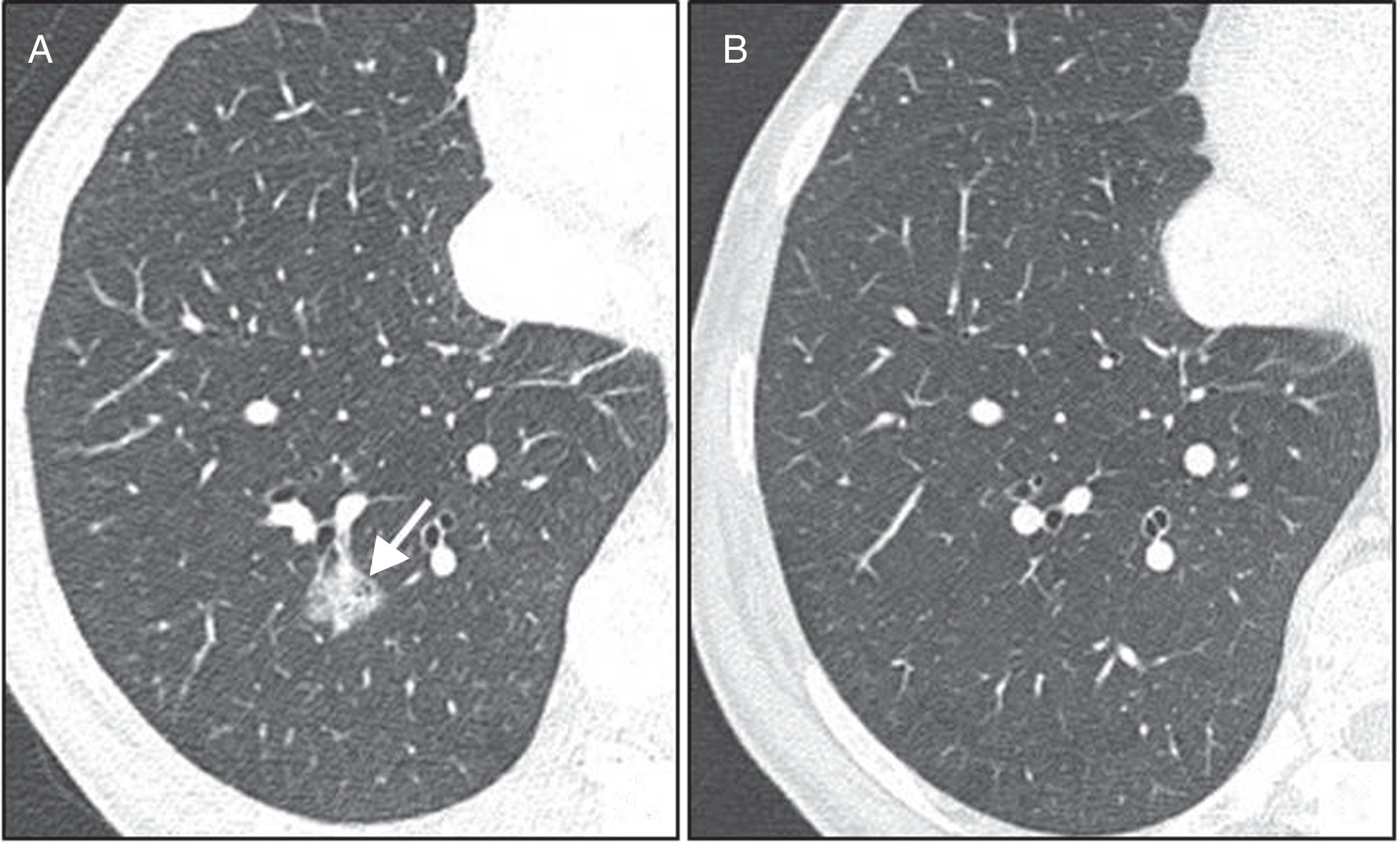
Nódulo mayor de 8mm. El riesgo de malignidad está en torno al 3%, dependiendo de la morfología y la localización. Se puede optar por cualquiera de las siguientes opciones: seguimiento con TC a los 3 meses, tomografía por emisión de positrones-tomografía computarizada (PET-TC) o biopsia en función de preferencias, riesgo individual, morfología, localización del nódulo, comorbilidades, etc. (fig. 9).
Varón de 73 años, fumador. A y B) Enfisema en lóbulo inferior derecho y nódulo sólido de 8mm y 535mm3 que presenta unos bordes lisos. Se trata de un paciente de alto riesgo, pero la morfología y la localización del nódulo no son sospechosos de malignidad por lo que se recomienda una tomografía computarizada de control a los 3 meses (C) que no muestra cambios en el tamaño. Deberán realizarse controles periódicos hasta confirmar estabilidad durante 2 años.
Nódulo no sólido menor de 6mm. No se recomienda seguimiento. En algún caso seleccionado de nódulo próximo a los 6mm con morfología sospechosa o con algún otro factor de riesgo se puede considerar una TC de control a los 2 y a los 4 años.
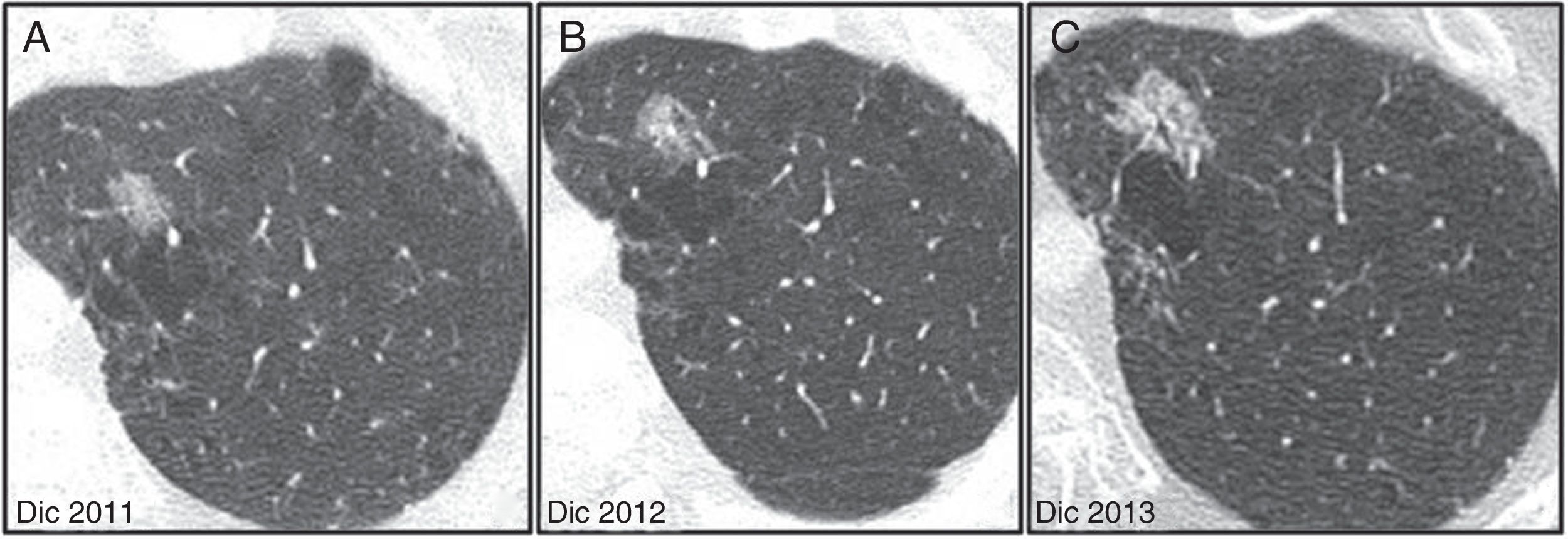
Nódulo no sólido mayor o igual a 6mm. Se recomienda un primer control a los 6-12 meses y después cada 2 años hasta los 5 años (fig. 10).
Varón de 65 años, fumador de 30 paquetes/año. A) Nódulo no sólido en lóbulo superior izquierdo. B y C) En los controles a los 12 y 24 meses, respectivamente, presenta un crecimiento lento y progresivo además de la aparición de broncograma en su interior. Se indica resección quirúrgica y el diagnóstico patológico es de adenocarcinoma no invasivo.
Son lesiones de lento crecimiento en las que un seguimiento más precoz no influye en el resultado final. El control se hará a los 6 meses cuando haya hallazgos sospechosos de malignidad, especialmente tamaño mayor de 10mm y pequeñas burbujas en su interior, o si al paciente le crea ansiedad esperar mucho tiempo, dado que a veces desaparecen.
Nódulo pulmonar solitario parcialmente sólidoNódulo menor de 6mm. No se recomienda seguimiento. Con este tamaño es muy difícil establecer si hay un componente sólido de forma fiable, por lo que se manejan igual que los nódulos no sólidos.
Nódulo mayor o igual a 6mm. Pueden ser secundarios a una infección que se resuelve a corto plazo; por ello, siempre hay que hacer un primer control a los 3-6 meses para confirmar la persistencia39 (fig. 11). Si persisten, se manejan en función del tamaño del componente sólido.
Si el componente sólido es menor de 6mm. La probabilidad de adenocarcinoma es alta, pero la mayoría son adenocarcinomas in situ o mínimamente invasivos. Se recomienda TC de seguimiento cada año durante 5 años.
Si el componente sólido es mayor o igual a 6mm. La probabilidad de invasión y metástasis aumenta a medida que aumenta el tamaño del componente sólido. Un componente sólido de más de 5mm está relacionado con alta probabilidad de invasión local y esto se recoge en la nueva estadificación T del adenocarcinoma de pulmón40. En nódulos con una morfología sospechosa como bordes lobulados, tamaño de la parte sólida mayor de 8mm, componente quístico o crecimiento de la parte sólida, se debe considerar resección quirúrgica, biopsia o PET-TC. Sin embargo, hay que tener en cuenta que la rentabilidad de la PET-TC y de la biopsia para diferenciar benignidad de malignidad en este tipo de nódulos es baja, por lo que se pueden plantear opciones más radicales como la cirugía9 (fig. 12).
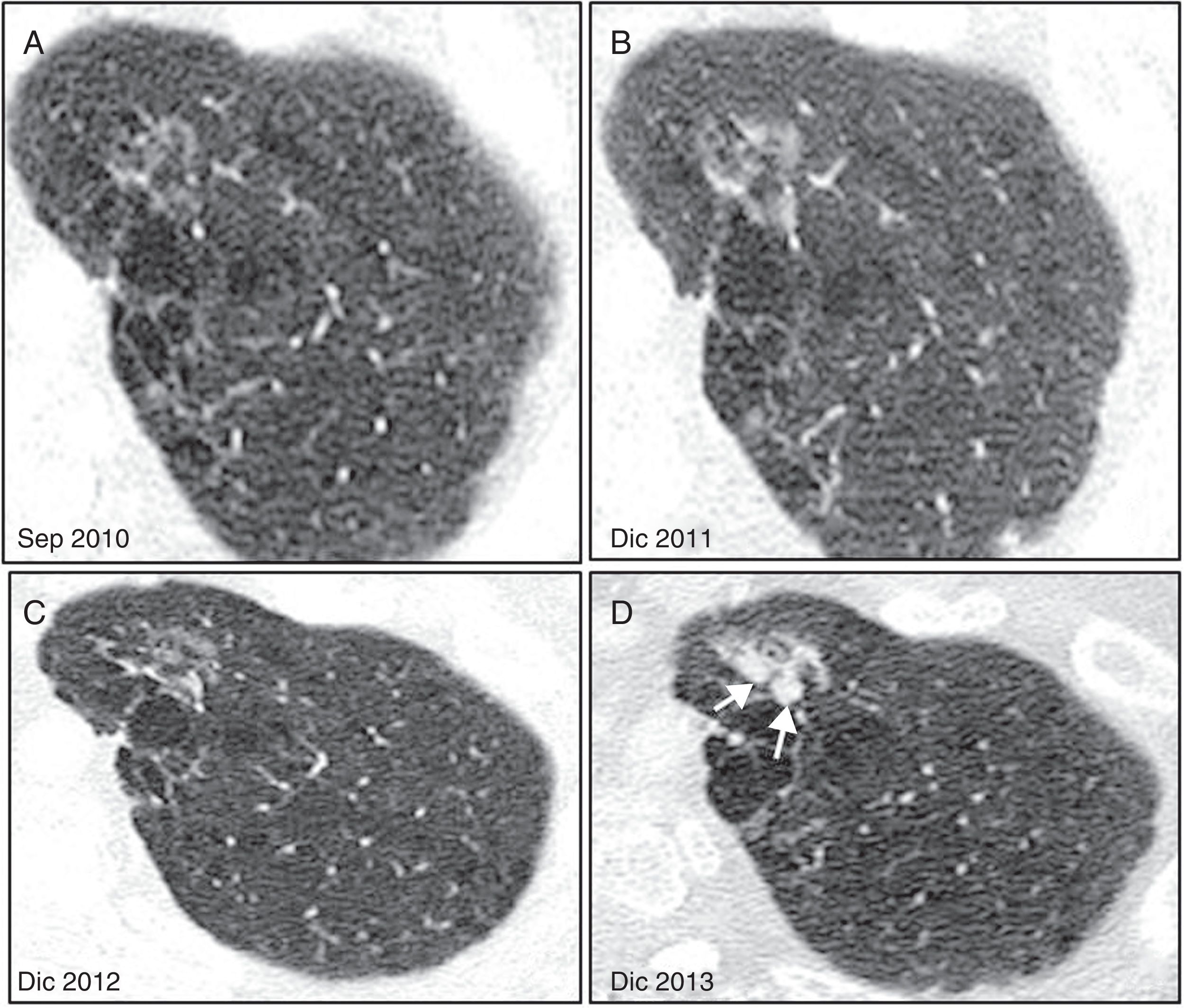
Varón de 57 años en control anual por lesión no sólida en segmento anterior de lóbulo superior izquierdo (A). B y C) En los controles a los 16 y 28 meses, presenta un crecimiento incierto. D) En el control a los 3 años aparecen nódulos sólidos (flechas) por lo que se indica resección quirúrgica, con el resultado de adenocarcinoma papilar no invasivo.
Un aspecto a tener en cuenta es que algunos nódulos malignos presentan una disminución de tamaño inicial asociada a un aumento de la densidad; esto se observa más frecuentemente en los nódulos subsólidos y no debe llevarnos a la conclusión errónea de que se trata de una lesión benigna9 (fig. 13).
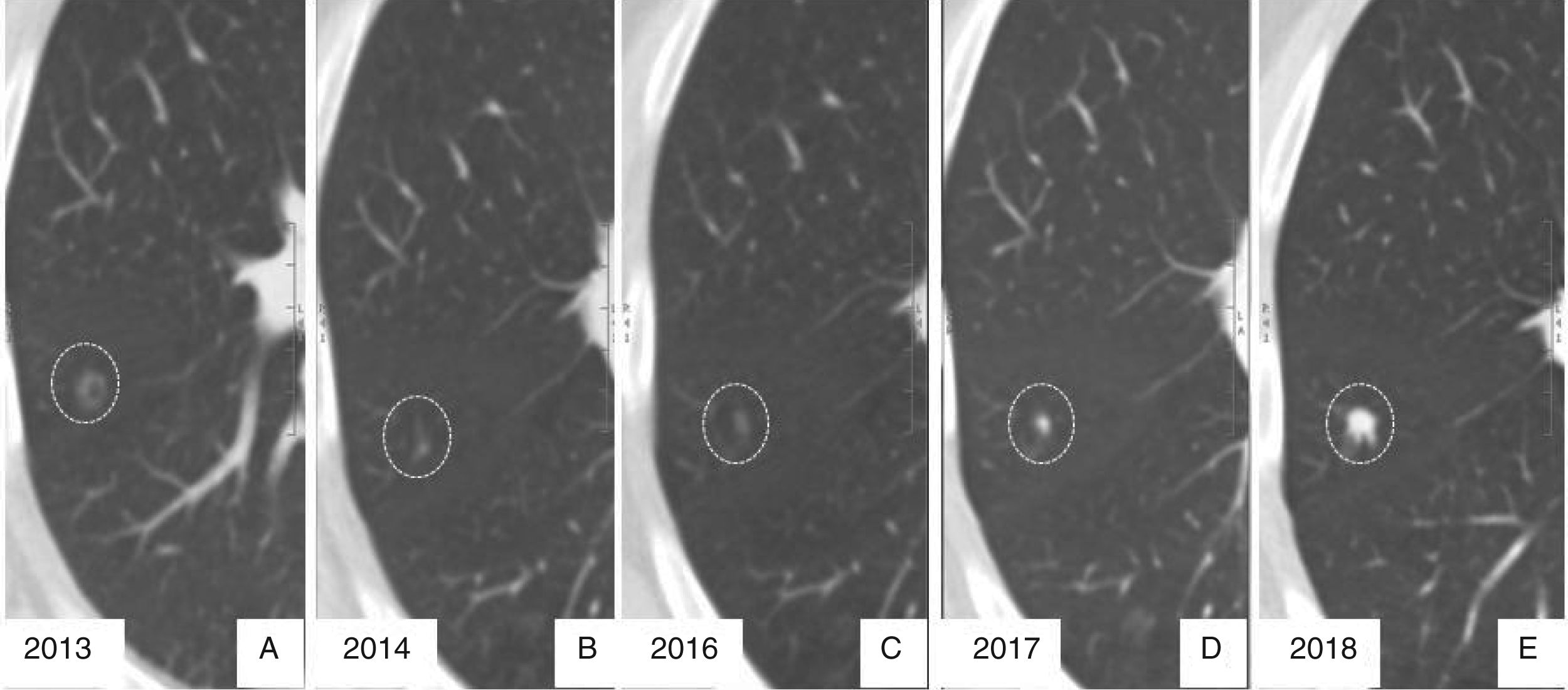
Evolución radiológica de adenocarcinoma invasivo. A) Nódulo no sólido en lóbulo superior derecho, detectado incidentalmente en 2013. B) En el control realizado a los 12 meses se observa una disminución en el tamaño. C) En una nueva tomografía realizada a los 3 años presenta un crecimiento dudoso, por lo que se continúan controles anuales a los 4 y 5 años (D y E), que confirman un crecimiento claro con un aumento de la densidad.
Nódulos menores de 6mm. La causa más frecuente son granulomas secundarios a infección o ganglios intrapulmonares benignos. En pacientes de bajo riesgo no necesitan seguimiento y en pacientes de alto riesgo se puede considerar un control a los 12 meses.
Cuando hay al menos un nódulo mayor o igual a 6mm. Se recomienda un control en 3-6 meses y se considerará repetirlo a los 18-24 meses en función del riesgo estimado.
En estos casos, la etiología más probable son las metástasis, sobre todo cuando se localizan en lóbulos inferiores y en la periferia del pulmón o cuando hay una gran variabilidad de tamaño. El crecimiento de las metástasis suele ser perceptible en un período de 3 meses.
Se llamará nódulo dominante al nódulo de morfología más sospechosa, que quiere decir el más sospechoso de malignidad, pero no tiene por qué ser el más grande. Este nódulo se tomará como referencia y se aplicarán las guías de manejo del nódulo pulmonar solitario, si bien se monitorizará también el crecimiento del resto de nódulos.
Nódulos múltiples subsólidosMenores de 6mm. La causa infecciosa es la más probable, por lo que se recomienda el primer control a los 3-6 meses para confirmar la persistencia. Si persisten, se realizará un control a los 2 y a los 4 años para confirmar la estabilidad, dado que existe la posibilidad de que sean secundarios a múltiples hiperplasias adenomatosas atípicas y/o adenocarcinomas in situ.
Mayores o iguales a 6mm. Cuando hay al menos un nódulo mayor o igual a 6mm, el seguimiento se hará en función del nódulo más sospechoso. Se debe realizar una TC de control a los 3-6 meses por la posibilidad de que se trate de una infección y si persisten, considerar adenocarcinomas primarios múltiples. La presencia de más de un nódulo sospechoso incrementa la probabilidad de malignidad con respecto a un nódulo solitario.
Guías de manejo de los nódulos detectados en otros estudios diferentes de la TC de tóraxEsta situación puede darse en TC de cuello, abdomen o coronarias:
- 1.
Nódulo menor de 6mm. No hacer nada.
- 2.
Nódulo de 6-8mm. Control con TC de tórax en 3-12 meses en función de su morfología y riesgo clínico.
- 3.
Nódulos mayores de 8mm o con alta sospecha de malignidad. Completar el estudio con TC de tórax.
No se recomiendan estudios parciales de TC limitados solo al nódulo para el seguimiento.
Como conclusión, los nódulos pulmonares detectados incidentalmente deben ser estudiados con una técnica de TC adecuada, medidos y clasificados correctamente como sólidos, no sólidos y parcialmente sólidos. Antes de abordar el manejo de un nódulo es importante clasificar al paciente como de riesgo bajo, intermedio o alto para aplicar después las guías de manejo recomendadas. Los nódulos con calcio, grasa o morfología típica de ganglio pericisural o intrapulmonar se consideran benignos y no es necesario realizar seguimiento. Se realizarán controles periódicos hasta demostrar estabilidad durante 2 años en los nódulos sólidos y durante 5 años en los nódulos subsólidos.
Autoría1. Responsable de la integridad del estudio: CTL.
2. Concepción del estudio: CTL.
3. Diseño del estudio: CTL, CDSG.
4. Obtención de los datos: CTL, CDSG, ASV.
5. Análisis e interpretación de los datos: CTL, CDSG, EUP,CJB.
6. Tratamiento estadístico: no procede.
7. Búsqueda bibliográfica: CTL, CDSG, EUP, CJB, ASV.
8. Redacción del trabajo: CTL.
9. Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: CTL, CDSG, EUP, CJB.
10. Aprobación de la versión final: CTL, CDSG, EUP, CJB, ASV.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.