El cribado mediante TC ha aumentado el índice de detección de pequeños nódulos pulmonares solitarios (NPS). La caracterización tisular de los nódulos inferiores al centímetro (NIC), todavía un desafío para los radiólogos, puede hacerse con medidas seriadas de volumen con TC. Tras su localización, el NIC puede extirparse mediante cirugía toracoscópica vídeo-asistida, que actúa como técnica de diagnóstico y tratamiento. Desde esta perspectiva, plantearemos cómo ampliar el conocimiento de las cuestiones clínicas implicadas en el diagnóstico, y cómo guiar otros procedimientos diagnósticos y terapéuticos del NPS.
Los NPS se definen como áreas pulmonares densas, redondeadas u ovales, cuyo diámetro es menor o igual a 3 cm1. La caracterización de un NPS es un problema importante, no sólo para los radiólogos, sino también para los clínicos, porque las lesiones malignas representan sólo el 60-80% de los nódulos resecados2-4. El objetivo de la evaluación radiológica de los NPS es diferenciar las lesiones malignas de las benignas de forma no invasiva, y con la mayor seguridad posible. El análisis morfológico puede ayudar a diferenciar nódulos benignos y malignos cuando éstos tienen características benignas o malignas típicas, pero existe un considerable solapamiento en las características morfológicas de estos nódulos5.
Para diferenciarlos se han aplicado otras estrategias diferentes al mero estudio de la forma del nódulo, como el cálculo del índice de crecimiento6, el análisis Bayesiano7 o las características hemodinámicas en la TC espiral dinámica8-10. El estudio metabólico del nódulo con la 18F-FDG PET11 y el estudio patológico después de una PAAF, una biopsia transtorácica con aguja o la cirugía toracoscópica vídeo-asistida, han sido también usadas para caracterizar el NPS. Sin embargo, no se puede aplicar un único algoritmo diagnóstico en todos los casos. El propósito de este artículo es profundizar en las cuestiones clínicas implicadas en el diagnóstico, y apuntar otros procedimientos diagnósticos y terapéuticos de los NPS.
Detección
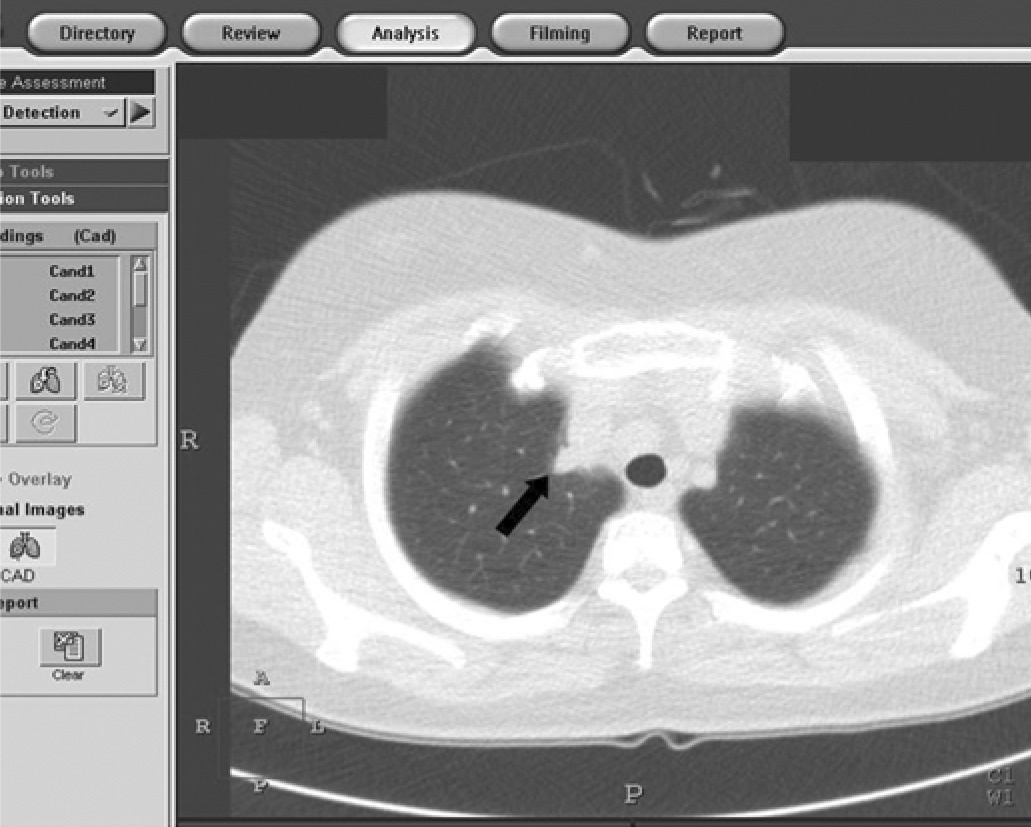
Pese a la introducción de nuevas técnicas diagnósticas, la detección radiológica de los nódulos pulmonares es difícil. El cribado con TC ha aumentado el índice de detección de pequeñas lesiones opacas nodulares, incluyendo las que resultan ser cánceres periféricos tempranos12-14. A pesar de la mayor resolución espacial y de contraste de la TC, hay lesiones nodulares que no son detectadas con la TC. Y esto se debe a circunstancias particulares que provocan errores en la detección. Para Ko et al15 los factores principales que dificultan la detección de los nódulos son el diámetro menor o igual a 5 mm (sensibilidad para la detección de nódulos: menor o igual a 5 mm frente a mayor a 5 mm, 74 y 82% respectivamente), las áreas opacas nodulares en vidrio deslustrado (sensibilidad para la detección de nódulos: opacidades en "vidrio deslustrado" frente a nódulos sólidos, 65 y 83% respectivamente) y la localización de las lesiones (sensibilidad para la detección de nódulos: centrales frente a periféricos, 61 y 80% respectivamente). La detección de nódulos puede incrementarse con los avances en los sistemas de detección asistidos por ordenador (computer-aided detection: CAD) que están en proceso de desarrollo y evaluación para constituirse en un sistema de apoyo en la detección de nódulos con la TC. El uso del CAD puede ser de ayuda para mejorar la detección de cánceres no identificados durante el cribado con TC16,17. Sin embargo, Lee et al18 han mostrado que la sensibilidad del CAD (81%) puede no diferir de forma significativa de la del radiólogo (85%). Los radiólogos mostraron más sensibilidad para detectar los nódulos adyacentes a otras estructuras (fig. 1), mientras que el CAD fue mejor para detectar tanto los nódulos aislados como los de diámetro menor o igual a 5 mm18.
Fig. 1. Imagen congelada de un sistema de detección asistido por ordenador (CAD) en una mujer de 44 años, en la que se observa un nódulo de 7 mm en el vértice pulmonar derecho (flecha), junto a los grandes vasos mediastínicos, que no fue detectado mediante el sistema de detección asistido por ordenador pero sí lo fue por los radiólogos.
Evaluación morfológica
El análisis de la forma de los NPS puede ayudar a diferenciar los nódulos benignos de los malignos. Los nódulos pequeños cuyos bordes están bien definidos son propios, pero no exclusivos, de las lesiones benignas. Por el contrario, un contorno lobulado, o un borde irregular o espiculado con distorsión de los vasos adyacentes, es típico de las lesiones malignas5. Las calcificaciones difusas, nodulares centrales, laminadas, o en palomita de maíz, indican benignidad. Al contrario, las calcificaciones excéntricas o moteadas se describen en los nódulos malignos. Hasta en el 50% de los hamartomas pulmonares se observa grasa o calcificaciones19. Jeong et al10 emplearon un análisis de variables múltiples para identificar qué características morfológicas se asocian, por sí solas, con los nódulos malignos y tienen un cociente de probabilidad (odds ratio) para malignidad mayor que otras. Estas características fueron: el contorno lobulado, el borde espiculado y la ausencia de nódulos satélite. Existe un solapamiento considerable entre los nódulos benignos y malignos en cuanto a sus características internas (broncograma aéreo, cavitación, grosor de pared, atenuación, etc.). La evaluación morfológica inicial de un NPS a menudo proporciona información inespecífica y, por lo tanto requiere de estudios adicionales para excluir malignidad.
Cuando interpreta las imágenes de la TC de cribado, el radiólogo busca nódulos pulmonares, pretende diferenciar los nódulos malignos de los benignos y, finalmente, recomienda una estrategia de seguimiento de las lesiones detectadas. Los resultados de el Early Lung Cancer Action Project (ELCAP)13 sugirieron que los nódulos detectados en los cortes finos de la TC y caracterizados como áreas opacas en vidrio deslustrado puras (no sólidas) o mixtas (parcialmente sólidas), tienen más probabilidades de ser malignos que los que se manifiestan como áreas opacas sólidas. Li et al20 evaluaron de forma más específica las características de los nódulos malignos y benignos en los cortes finos de TC. Entre los nódulos que se mostraban como áreas de vidrio deslustrado, la forma redondeada era más frecuente en las lesiones malignas (65%) que en las benignas (17%). Entre las áreas mixtas en vidrio deslustrado, el subtipo con áreas en vidrio deslustrado en la periferia y una zona de alta atenuación en el centro, se asoció con mucha mayor frecuencia a las lesiones malignas (41%) que a las benignas (7%). Entre los nódulos sólidos la forma poligonal y los bordes lisos fueron mucho menos frecuentes en las lesiones malignas que en las benignas.
Evaluación del índice de crecimiento
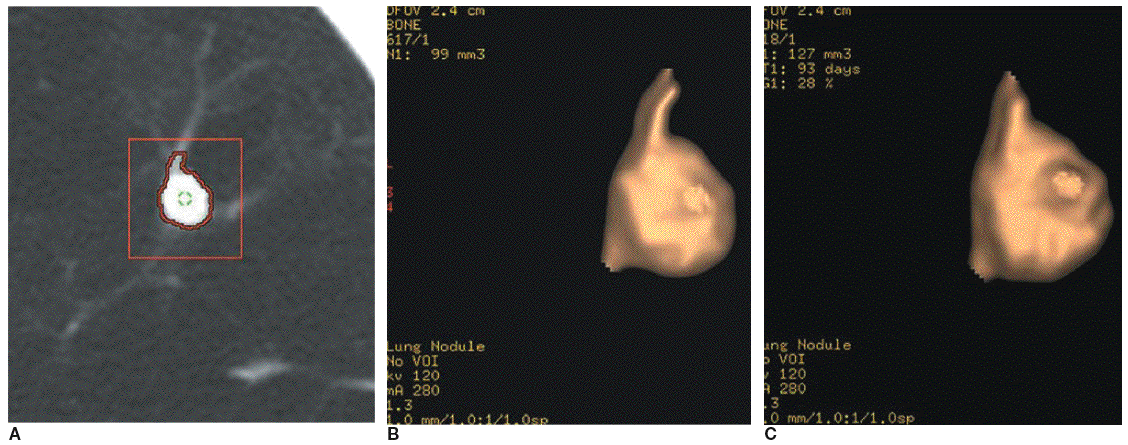
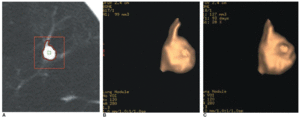
La determinación del índice de crecimiento en dos estudios sucesivos es una herramienta importante y rentable en la evaluación del los NPS. La ausencia de crecimiento en un periodo de dos años es un criterio fiable para establecer que un nódulo pulmonar es benigno21. A pesar de su aceptación, este criterio puede no bastar en el caso de las áreas en vidrio deslustrado y cuando se sospecha un carcinoma bronquioloalveolar22. Además, en nódulos pequeños (menores de 1 cm) es difícil detectar con seguridad el crecimiento. Para vencer esta limitación, se ha propuesto valorar el índice de crecimiento de estos nódulos particulares usando medidas seriadas del volumen en lugar de su diámetro23. Los programas informáticos que permiten el cálculo automático del volumen de un nódulo son fácilmente accesibles. Además, se han desarrollado y aplicado clínicamente métodos de cuantificación del volumen 3D asistidos por ordenador23-25 (fig. 2).
Fig. 2. Medida del volumen de un nódulo pulmonar en un hombre de 47 años con adenocarcinoma de pulmón mediante un sistema de detección asistido por ordenador. (A) La aplicación automática de la región de interés a un nódulo proporciona la medida del volumen con la delineación del contorno y la segmentación del nódulo. (B) Imagen tridimensional del nódulo con un volumen resultante de 99 mm3. (C) La imagen tridimensional muestra un nódulo de 127 mm3 de volumen 93 días después. El tiempo de duplicación del volumen ha sido de 145 días.
Sin embargo, todos esos métodos de cuantificación del volumen están enfocados hacia los nódulos pulmonares sólidos, y son pocas las publicaciones que se han centrado en el desarrollo de métodos para las áreas opacas nodulares en vidrio deslustrado26. La cuantificación del volumen de estas áreas, o de los nódulos semisólidos (nódulos sólidos con un componente de vidrio deslustrado), es más difícil que en el caso de los nódulos puramente sólidos, porque los primeros tienen una menor diferencia de contraste con el parénquima adyacente. Los métodos para la cuantificación precisa del volumen en las áreas opacas en vidrio deslustrado o en los nódulos semisólidos están actualmente en desarrollo.
Otros factores que deberían ser considerados al cuantificar el volumen de un nódulo in vivo son los artefactos debidos al movimiento, la presencia de una estructura normal adyacente al nódulo, y los nódulos de pequeño tamaño. El volumen de un nódulo se modifica con la fase cardiaca. Además, el movimiento cardiovascular no se transmite de forma proporcional a los distintos segmentos pulmonares. El movimiento es importante en las zonas adyacentes a las estructuras vasculares del corazón. La segmentación del nódulo de las estructuras adyacentes normales es importante para conseguir una medida exacta del volumen26.
Análisis Bayesiano
La correlación clínica sigue teniendo un papel primordial en la valoración del NPS. En un intento de definir de forma más exacta varios factores de riesgo conocidos, tanto clínicos como radiológicos, un número creciente de investigadores han usado el análisis Bayesiano7. Utilizando la fórmula del teorema de Bayes, se puede calcular la probabilidad de malignidad de un nódulo estimando previamente los cocientes de probabilidad individuales de diversos rasgos clínicos y radiológicos a partir de lo publicado previamente. El cociente de probabilidad se obtiene dividiendo la probabilidad de un resultado positivo en un test, o un hallazgo, en un paciente con enfermedad, entre la probabilidad de un resultado positivo en un test, o un hallazgo, en un paciente sin enfermedad.
Usando estos cálculos es posible combinar las probabilidades individuales dentro de una estimación global de la probabilidad de malignidad en el NPS. La escala de los cocientes de probabilidad radiológicos y clínicos para malignidad en el NPS incluye, en sentido descendente, una cavidad igual o mayor a 16 mm de grosor, los bordes irregulares o espiculados en la TC, la hemoptisis, los antecedentes de malignidad, la edad superior a 70 años, diámetros de 21-30 mm, un índice de crecimiento de 7-465 días, la mala definición en la radiografía de tórax, el hábito tabáquico activo y la calcificación indeterminada en la TC7. Por desgracia, el análisis Bayesiano tradicional no tiene en cuenta las técnicas de imagen más avanzadas como la TC espiral dinámica y la PET, que son útiles para la estratificación preoperatoria de los nódulos benignos y malignos.
A diferencia del método Bayesiano manual, una red neuronal artificial es un método de procesamiento computarizado de datos que se inspira en el diseño y funcionamiento de los cerebros animales y de sus componentes. La mayoría de las redes neuronales tienen algún tipo de regla por la cual el peso de cada conexión depende del modelo que se presenta. Para incrementar la capacidad de una red neuronal artificial para diferenciar los nódulos malignos de los benignos cuantos más parámetros útiles se introduzcan mejor. Utilizando rasgos objetivos de las radiografías de tórax, e introduciéndolos en un método computarizado, Nakamura et al27 han demostrado que una red neuronal artificial tiene potencial para mejorar la seguridad del radiólogo para distinguir nódulos benignos y malignos. Si se proporcionan características morfológicas obtenidas con estudios de TC, se conseguirá un sistema de red neuronal artificial más sofisticado.
Características hemodinámicas en la TC espiral dinámica
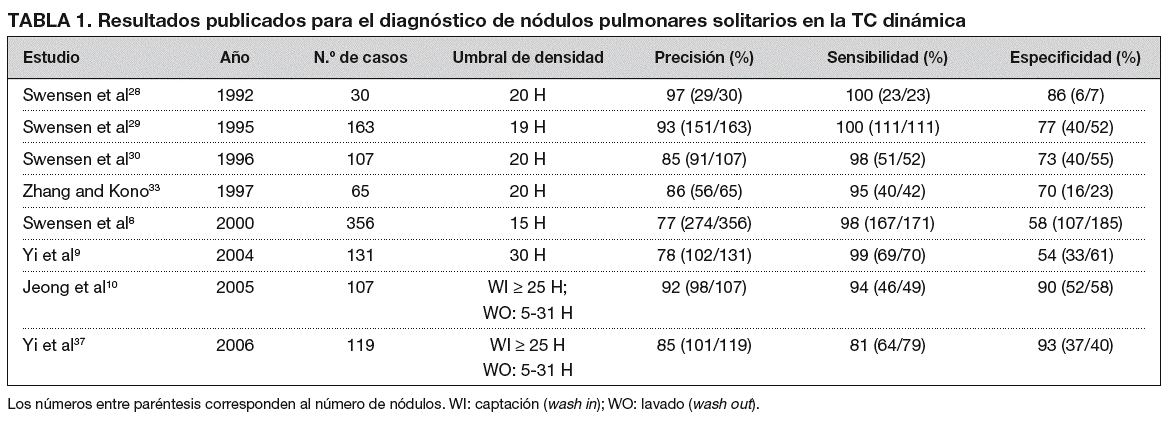
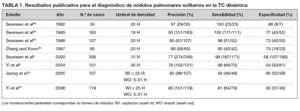
La evaluación de la vasculatura tumoral con TC espiral dinámica ha demostrado ser útil para diferenciar los nódulos benignos de los malignos8,28-33. Se han descrito diversos valores de densidad como referencias útiles para distinguirlos con la TC dinámica8-10,28-33 (tabla 1). Estos valores corresponden al incremento en unidades Hounsfield (UH) del nódulo que, tras la administración intravenosa (iv) de medio de contraste, se constituye en punto de corte para diferenciar los nódulos malignos de los benignos. Para Yamashita et al31 un incremento de 20-60 UH sirve para predecir la malignidad. Y en otro estudio digno de mención, Swensen et al8, en el año 2000, establecieron que un aumento de 15 UH tenía una sensibilidad del 98%, una especificidad del 58% y una precisión del 77% para los nódulos malignos. Desde el año 2000 el valor de corte para diferenciar entre nódulos benignos y malignos ha quedado establecido en 15 UH.
Sin embargo, en estos estudios con TC dinámica, se emplearon sistemas de TC convencional, o espiral de detector único, y los investigadores trabajaron con una sola imagen, o con un número limitado de imágenes centradas en el nódulo, en momentos concretos del estudio dinámico (generalmente a intervalos de un minuto, con barridos obtenidos a los 1, 2, 3 y 4 minutos tras la inyección iv del medio de contraste)8,30. Por tanto, el hecho de obtener tan sólo un pequeño número de imágenes del nódulo en momentos concretos, puede haber dado lugar a fenómenos de volumen parcial, artefactos, y dificultades para reproducir los resultados, debido principalmente a las diferencias en la apnea. Estas mismas limitaciones también pueden interferir en la comparación directa de los valores de atenuación de los nódulos correspondientes a diferentes estudios de TC. Además, como las imágenes se obtuvieron a intervalos de un minuto, los cambios sutiles en los valores de la atenuación que ocurren en esos intervalos hacen difícil determinar el valor máximo de atenuación real y el verdadero tiempo hasta el pico máximo.
Con la llegada del TC multidetector (TCMD) disponemos de tiempos de adquisición más cortos, una cobertura mayor y una resolución superior en el eje Z34. Gracias a esto, es posible, con una técnica espiral después de la inyección iv del medio de contraste, conseguir grupos de imágenes secuenciales, abarcando todo el nódulo, en momentos concretos separados por intervalos de tiempo cortos. Esto permite hacer el mismo barrido, o uno muy similar, para comparar el grado de realce. En un estudio dinámico con MDCT9 se obtuvo un pico de realce mayor que en los estudios previos con TC convencional o espiral de detector único8,28-33, lo que ha permitido usar un incremento de densidad más alto para diferenciar entre nódulos benignos y malignos. En este momento, con valores de 30 UH de realce neto, la precisión diagnóstica (sensibilidad del 99%, especificidad del 54%, valor predictivo positivo del 71%, valor predictivo negativo del 97 y del 78%) es similar a la de los estudios8,9,28-31 realizados usando TC espiral de detector único9. Sin embargo, en estudios previos centrados en la fase temprana del contraste en la TC dinámica, hubo un cierto solapamiento entre nódulos benignos y malignos (por ejemplo, granulomas activos y tumores vasculares benignos). Aunque los resultados de estos estudios dinámicos mostraron una alta sensibilidad para el diagnóstico de nódulos malignos, la especificidad fue demasiado baja. Además, aproximadamente el 50% de los nódulos indeterminados que tuvieron un diagnóstico quirúrgico final de benignidad requirieron hospitalización del paciente para la resección quirúrgica, lo cual es caro y no carece de riesgos de morbilidad y mortalidad35,36. Por todo ello surgió la necesidad de desarrollar técnicas de imagen no invasivas para el diagnóstico específico de nódulos pulmonares indeterminados.
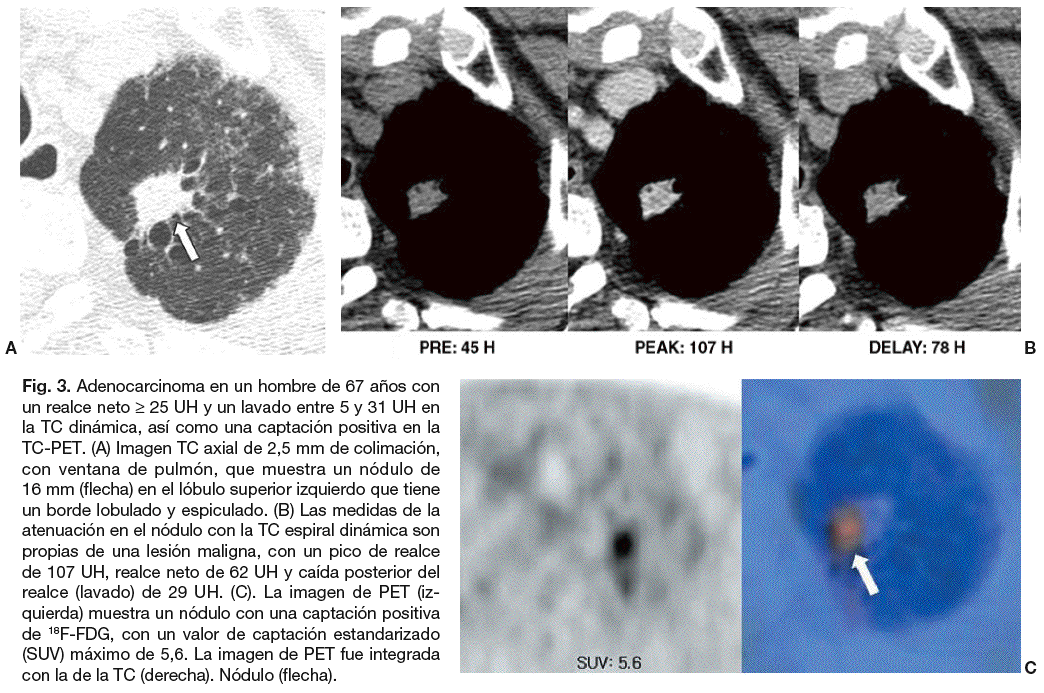
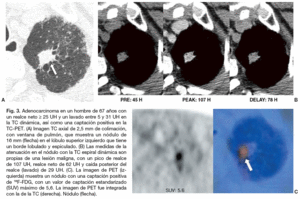
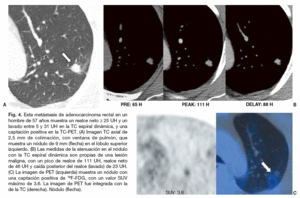
La evaluación del NPS mediante el análisis combinado de las características de realce y lavado en la TC dinámica permite evaluaciones más precisas del comportamiento hemodinámico de los nódulos. Además, la eficacia de la caracterización tisular ha mejorado, y hoy en día se alcanzan sensibilidades y especificidades de más del 90% evaluando los patrones de lavado en la fase dinámica retardada10. Para Jeong et al10 los nódulos malignos se caracterizan por un realce mayor o igual a 25 UH, y un lavado de 5-31 UH (figs. 3 y 4). Los nódulos benignos se caracterizan por un realce menor a 25 UH, por un realce mayor de 25 UH y un lavado mayor a 31 UH, o por un realce mayor o igual a 25 UH y un realce persistente sin lavado10. Cuando los criterios diagnósticos de realce mayor o igual a 25 UH y de lavado de 5-31 UH fueron contrastados con el diagnóstico de malignidad, su sensibilidad, especificidad y precisión fueron de 81-94%, 90-93% y 85-92%, respectivamente10,37. Utilizando un análisis de variables múltiples, y tras controlar los efectos de otros factores diagnósticos, Jeong et al determinaron que los criterios diagnósticos que indican que un nódulo es maligno son: el realce mayor o igual a 25 UH y lavado de 5-31 UH (p = 0,001; cociente de probabilidad, 25,7), el borde lobulado (p = 0,011; cociente de probabilidad, 41,7), el borde espiculado (p = 0,006; cociente de probabilidad, 35,3), y la ausencia de un nódulo satélite (p = 0,004; cociente de probabilidad, 13,8).
Fig. 3. Adenocarcinoma en un hombre de 67 años con un realce neto * 25 UH y un lavado entre 5 y 31 UH en la TC dinámica, así como una captación positiva en la TC-PET. (A) Imagen TC axial de 2,5 mm de colimación, con ventana de pulmón, que muestra un nódulo de 16 mm (flecha) en el lóbulo superior izquierdo que tiene un borde lobulado y espiculado. (B) Las medidas de la atenuación en el nódulo con la TC espiral dinámica son propias de una lesión maligna, con un pico de realce de 107 UH, realce neto de 62 UH y caída posterior del realce (lavado) de 29 UH. (C). La imagen de PET (izquierda) muestra un nódulo con una captación positiva de 18F-FDG, con un valor de captación estandarizado (SUV) máximo de 5,6. La imagen de PET fue integrada con la de la TC (derecha). Nódulo (flecha).
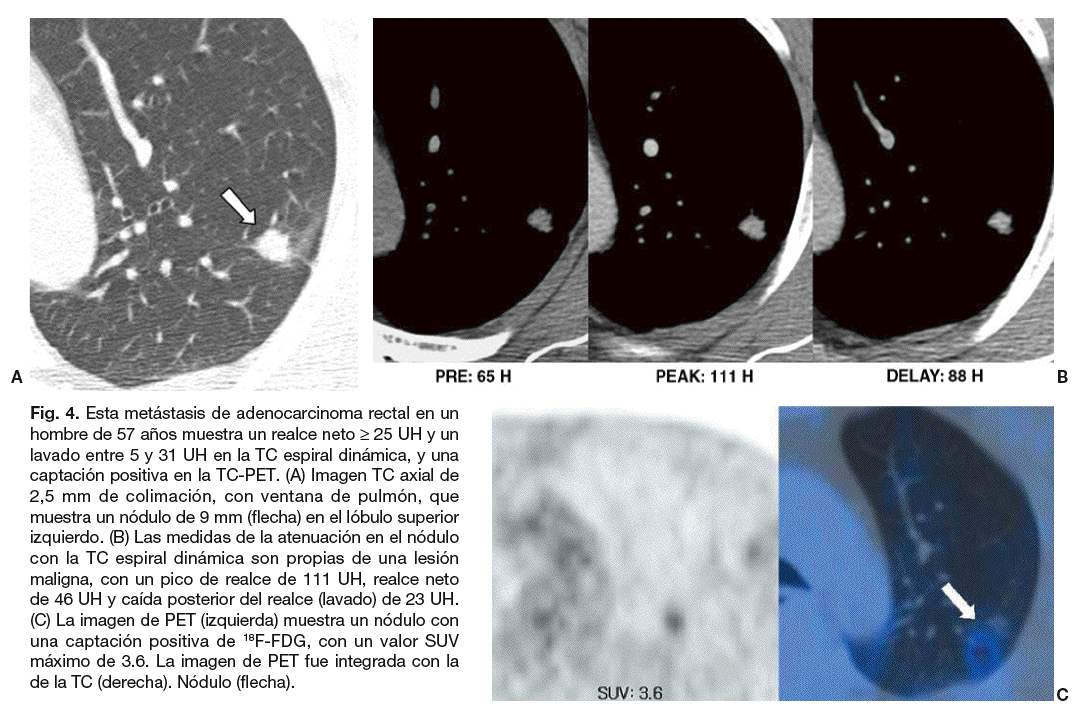
Fig. 4. Esta metástasis de adenocarcinoma rectal en un hombre de 57 años muestra un realce neto * 25 UH y un lavado entre 5 y 31 UH en la TC espiral dinámica, y una captación positiva en la TC-PET. (A) Imagen TC axial de 2,5 mm de colimación, con ventana de pulmón, que muestra un nódulo de 9 mm (flecha) en el lóbulo superior izquierdo. (B) Las medidas de la atenuación en el nódulo con la TC espiral dinámica son propias de una lesión maligna, con un pico de realce de 111 UH, realce neto de 46 UH y caída posterior del realce (lavado) de 23 UH. (C) La imagen de PET (izquierda) muestra un nódulo con una captación positiva de 18F-FDG, con un valor SUV máximo de 3.6. La imagen de PET fue integrada con la de la TC (derecha). Nódulo (flecha).
Características metabólicas en la PET 18F-FDG
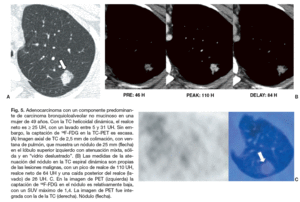
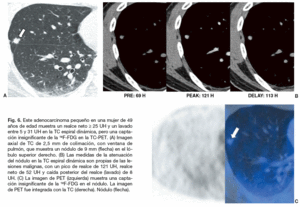
Para mejorar la precisión diagnóstica de la imagen en las lesiones pulmonares también se ha empleado la PET con 18F-FDG. Las células malignas tienen un metabolismo aumentado y proliferan rápidamente. La avidez de las células malignas por la glucosa y la 18F-FDG es similar, y esto ha permitido que la PET sea capaz de detectarlas. La PET en una prueba diagnóstica segura, no invasiva, con una sensibilidad del 88-96% y una especificidad del 70-90% para los nódulos malignos11,38-42 (tabla 2). Comparada con la PET o la TC por separado, la TC-PET proporciona un mayor detalle anatómico y mejora la precisión de la estadificación del cáncer pulmonar no microcítico43. En un estudio reciente sobre el NPS37 la sensibilidad, especificidad y precisión de la TC espiral y la TC-PET para predecir la malignidad de un nódulo fueron 81, 93%, 85 y 96%, 88, 93%, respectivamente. En ese estudio, todos los nódulos malignos se interpretaron correctamente con al menos una de las dos técnicas37 (figs. 3 y 4). Los NPS que muestran un aumento de la captación de 18F-FDG deben ser considerados como malignos, aunque puede haber resultados falsos positivos en pacientes con procesos inflamatorios e infecciosos como la tuberculosis activa, la histoplasmosis y los nódulos reumatoideos6,44. La alta especificidad de la PET 18F-FDG para el diagnóstico de las lesiones benignas tiene una utilidad clínica importante. Las lesiones con una captación baja de 18F-FDG pueden ser consideradas benignas. Sin embargo, también pueden darse resultados falsos negativos en neoplasias pulmonares primarias como los carcinoides, los carcinomas bronquioloalveolares, los adenocarcinomas con un componente bronquioloalveolar predominante (fig. 5) y NPS malignos de diámetro inferior a 10 mm11,45,46 (fig. 6). La PET 18F-FDG presenta falsos negativos en aproximadamente el 5% de todos los cánceres de pulmón en estadio T1, pero sólo en un 3% de los cánceres de pulmón en estadio T1 mayores de 5 mm de diámetro47. La supervivencia prolongada de los pacientes con cáncer de pulmón y un estudio PET negativo, sugiere que el comportamiento de esos tumores es indolente.
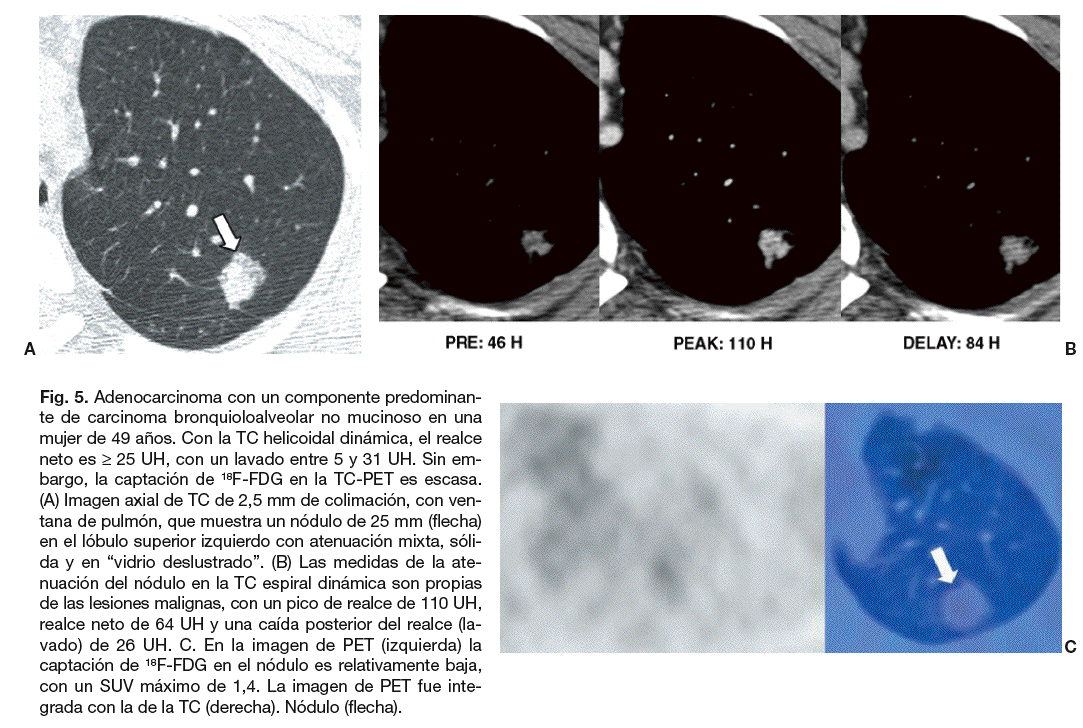
Fig. 5. Adenocarcinoma con un componente predominante de carcinoma bronquioloalveolar no mucinoso en una mujer de 49 años. Con la TC helicoidal dinámica, el realce neto es * 25 UH, con un lavado entre 5 y 31 UH. Sin embargo, la captación de 18F-FDG en la TC-PET es escasa. (A) Imagen axial de TC de 2,5 mm de colimación, con ventana de pulmón, que muestra un nódulo de 25 mm (flecha) en el lóbulo superior izquierdo con atenuación mixta, sólida y en "vidrio propias de las lesiones malignas, con un pico de realce de 110 UH, realce neto de 64 UH y una caída posterior del realce (lavado) de 26 UH. C. En la imagen de PET (izquierda) la captación de 18F-FDG en el nódulo es relativamente baja, con un SUV máximo de 1,4. La imagen de PET fue integrada con la de la TC (derecha). Nódulo (flecha).
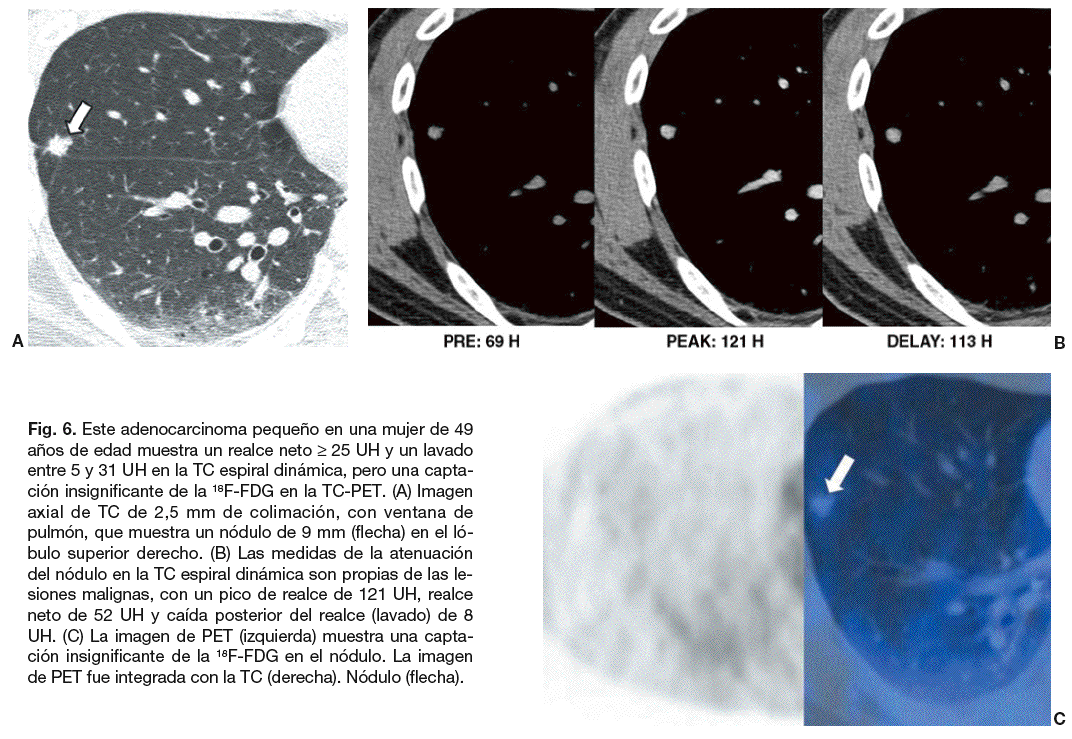
Fig. 6. Este adenocarcinoma pequeño en una mujer de 49 años de edad muestra un realce neto * 25 UH y un lavado entre 5 y 31 UH en la TC espiral dinámica, pero una captación insignificante de la 18F-FDG en la TC-PET. (A) Imagen axial de TC de 2,5 mm de colimación, con ventana de pulmón, que muestra un nódulo de 9 mm (flecha) en el lóbulo superior derecho. (B) Las medidas de la atenuación del nódulo en la TC espiral dinámica son propias de las lesiones malignas, con un pico de realce de 121 UH, realce neto de 52 UH y caída posterior del realce (lavado) de 8 UH. (C) La imagen de PET (izquierda) muestra una captación insignificante de la 18F-FDG en el nódulo. La imagen de PET fue integrada con la TC (derecha). Nódulo (flecha).
Caracterización de los NIC
Desde la introducción de la TCMD se ha hecho habitual la detección de nódulos pulmonares pequeños (menores de 10 mm). La caracterización de estos nódulos es un desafío para el radiólogo porque, aunque dichos nódulos tienen pocas posibilidades de ser malignos, el porcentaje descrito de malignidad varía según los estudios48-51. En uno de ellos48, los nódulos de diámetro inferior a 10 mm situados en lóbulos distintos al del tumor primario en pacientes con cáncer de pulmón, tuvieron sólo un 4% de posibilidades de ser malignos. En otro, basado en pacientes con neoplasias extratorácicas, el 18% de los nódulos de diámetro inferior a 10 mm fueron malignos49. Por otro lado, para Munden et al50 el 58% de todos los nódulos de diámetro inferior a 10 mm son malignos, así como el 41% de los encontrados en pacientes sin neoplasia conocida.
Actualmente, la medida seriada del volumen de los nódulos está considerada como el método más fiable para la caracterización de los nódulos pequeños23. Sin embargo, carecemos de estudios basados en series amplias de pacientes. La TC espiral dinámica es otra técnica fiable para la caracterización de un nódulo. Sin embargo, se requieren cortes finos (de grosor inferior o igual a 1 mm) con una gran cobertura en el eje Z, especialmente para la caracterización de nódulos situados en las zonas inferiores de los pulmones, donde los movimientos respiratorios son amplios. La PET o la TC-PET no pueden caracterizar los NIC porque su resolución espacial (en este momento, 7 mm en el mejor de los casos) es insuficiente para detectar NIC malignos37 (fig. 6). Por lo tanto, es necesario proporcionar pautas para el seguimiento y manejo de nódulos pulmonares indeterminados52.
Con la llegada del TCMD se ha hecho frecuente el hallazgo de nódulos muy pequeños (3-5 mm), bien definidos (a veces llamados "ditzels"). La decisión en cuanto al tipo de tratamiento de estos nódulos varía dependiendo de la edad del paciente, el riesgo de malignidad y el riesgo de desarrollar una enfermedad granulomatosa. En lo que atañe al radiólogo y la toma de decisiones con respecto a estos nódulos53, la mayoría de expertos recomienda el seguimiento a corto plazo, con actitudes menos agresivas en pacientes que tienen una baja probabilidad de malignidad y más agresivas cuando la probabilidad de malignidad es alta.
Aspiración o biopsia transtorácica con aguja
La utilidad de la PAAF o de la biopsia transtorácica con aguja para valorar nódulos solitarios es un hecho54-57. Su indicación más común es un NPS indeterminado que requiera un diagnóstico preoperatorio, especialmente en pacientes que no son aptos para la cirugía y que necesitan un diagnóstico histológico para planificar el tratamiento no quirúrgico58. Los avances recientes en la técnica de la PAAF o biopsia transtorácica con aguja, incluyendo el uso de la TC para guiarla, el análisis citopatológico inmediato, la introducción de técnicas con obtención de un cilindro de biopsia, así como las restricciones posturales tras la biopsia (para evitar la aparición de un neumotórax), la han hecho una opción aún más atractiva. Sin embargo, como se ha demostrado, la precisión de la PAAF para el diagnóstico definitivo de enfermedad benigna es limitada, típicamente menor del 50%56. Y la controversia es mayor, en cierto modo, en el caso de las lesiones de pequeño tamaño (inferior a 15 mm)54,55. Li et al55 hallaron una diferencia significativa en la precisión diagnóstica de la biopsia transtorácica con aguja entre las lesiones pequeñas y las grandes (74% frente a 96%, respectivamente). Sin embargo, en un trabajo más reciente, Wescott et al54 han descrito una sensibilidad del 93%, una especificidad del 100%, y una precisión del 95% en 74 biopsias de 64 lesiones pequeñas (menores de 15 mm). Estas discrepancias en la precisión diagnóstica de la biopsia transtorácica con aguja para lesiones pequeñas reflejan, probablemente, una combinación del grado de experiencia y del número de intentos de biopsia.
Aunque la aspiración y la biopsia transtorácica con aguja son sensibles para el diagnóstico de malignidad intratorácica, su capacidad para diferenciar entre los diferentes tipos de células del carcinoma broncogénico está menos establecida58. Además, la aspiración o la biopsia transtorácica con aguja pueden estar limitadas técnicamente en los NPS localizados en los vértices pulmonares, o en los que están demasiado cerca del diafragma.
La cirugía toracos cópica vídeo-asistida como técnica de diagnóstico y tratamiento de nódulos pequeños
En los pacientes con NPS indeterminados, la cirugía toracoscópica vídeo-asistida está indicada cuando las lesiones son inaccesibles a la biopsia transtorácica con aguja, o cuando es improbable que la biopsia proporcione un diagnóstico definitivo de benignidad o malignidad por las características de la lesión o por las propias limitaciones de la técnica59.
La técnica se lleva normalmente a cabo bajo anestesia general usando un tubo con doble luz endobronquial para permitir la ventilación del pulmón contralateral. Tras el colapso del pulmón homolateral, habitualmente se hacen tres incisiones y se introduce una cámara de vídeo telescópica. La resección de un nódulo con esta técnica, después de localizarlo con un sistema para marcar nódulos pulmonares (arpón o marcaje con tinta), es útil para el diagnóstico y el tratamiento de los NPS pequeños. El sistema de marcaje del nódulo es adecuado para la localización y fijación estable de nódulos pulmonares pequeños (4-15 mm de diámetro) y nódulos subpleurales (generalmente a menos de 2 cm de la pleura o la cisura). La aparición de un neumotórax pequeño es una complicación hasta en un 20% de casos. Una vez localizados, la mayoría de los nódulos son resecados para su diagnóstico o tratamiento. En aproximadamente un 5% de pacientes el cambio de posición del arpón puede dificultar la resección del nódulo60-63.
Pronóstico de los NPS malignos
La prevalencia de adenopatías es baja en los pacientes con un cáncer pulmonar periférico -cáncer de pulmón en estadio T1-, que se manifiesta como un NPS. Sin embargo, varios estudios han descrito una prevalencia relativamente alta de metástasis en los ganglios linfáticos mediastínicos64,65. Para Aoki et al22 los adenocarcinomas que se manifiestan como un área opaca localizada en vidrio deslustrado crecen lentamente, y Kim et al66 publicaron que la extensión del área opaca en vidrio deslustrado es significativamente mayor en pacientes sin recurrencia, metástasis ganglionares o metástasis a distancia. Además, Jung et al67 sugieren que la prevalencia de metástasis extratorácicas es significativamente menor en cánceres pulmonares periféricos pequeños en forma de área opaca en vidrio deslustrado que en lesiones similares sin áreas de vidrio deslustrado. Aoki et al68 evaluaron la importancia pronóstica de los hallazgos preoperatorios de la TC con cortes finos en el adenocarcinoma pulmonar periférico. Todos los adenocarcinomas inferiores a 2 cm en los que el área opaca en vidrio deslustrado suponía más del 50% del volumen tumoral estaban libres de metástasis ganglionares y de invasión vascular, y todos esos pacientes seguían vivos y sin recurrencia a los 10 años. Los autores observaron una mayor incidencia de espiculación grosera y de engrosamiento de las estructuras broncovasculares vecinas en los tumores con metástasis en ganglios linfáticos o invasión vascular.
La relación entre el tamaño tumoral y la supervivencia en pacientes con carcinomas no microcíticos en estadio IA es objeto de debate. Patz et al69 y Heyneman et al70 no encontraron una correlación significativa entre el tamaño del cáncer pulmonar primario y la supervivencia o el estadio de la enfermedad. Sin embargo, para Port et al71 y Martín et al72, el tamaño tumoral afecta a la supervivencia en los pacientes con tumores en estadio IA.
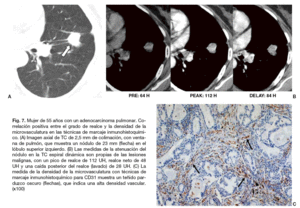
El crecimiento de un nódulo maligno depende de la sangre que recibe desde los tejidos adyacentes; el aporte sanguíneo es imprescindible para el crecimiento tumoral y la diseminación metastática. El desarrollo de su vasculatura, con el aumento subsiguiente de la microcirculación, puede estar inducido por la liberación de factores angiogénicos (factor de crecimiento del endotelio vascular) desde un nódulo maligno9,73. El incremento de la densidad de estos pequeños vasos en los nódulos malignos aumenta la perfusión y la permeabilidad capilar, lo que frecuentemente lleva consigo un realce intenso en la TC9,74. Por lo tanto, el grado de realce puede ser interpretado como un reflejo de la vasculatura tumoral (fig. 7). El análisis histológico de la microvasculatura tumoral y de la expresión de los factores de crecimiento del endotelio vascular son factores pronósticos importantes en cánceres no microcíticos75,76. En otras palabras, la probabilidad de enfermedad metastática se incrementa cuando la densidad de la microvasculatura en los cánceres pulmonares aumenta. Recientemente, Guo et al77 han estudiado la densidad de la microvasculatura empleando varios anticuerpos endoteliales (métodos de marcaje inmunohistoquímico) para detectar la presencia de CD31, CD105, CD34, o *-actina del músculo liso, e investigaron la correlación entre la densidad de la microvasculatura y la captación de 18F-FDG. Los autores compararon el valor pronóstico de cada uno de los factores inmunohistoquímicos en los adenocarcinomas de pulmón. Su conclusión fue que la densidad microvascular de CD105 traduce una angiogénesis activa, y que, en pacientes con adenocarcinoma de pulmón es mejor indicador pronóstico que otros anticuerpos (la extensión de la densidad microvascular determinada con el CD105 mostró una correlación negativa con el pronóstico del paciente). Además, la captación de 18F-FDG se correlacionó significativamente con la angiogénesis activa determinada por la densidad microvascular de CD105.
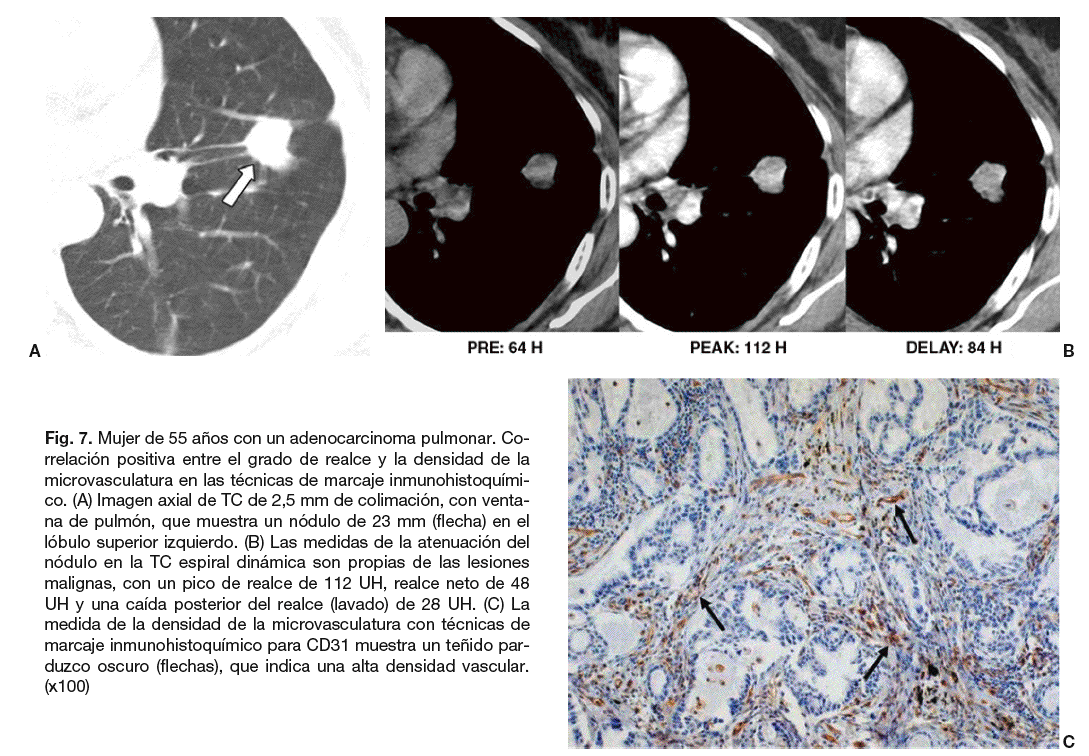
Fig. 7. Mujer de 55 años con un adenocarcinoma pulmonar. Correlación positiva entre el grado de realce y la densidad de la microvasculatura en las técnicas de marcaje inmunohistoquímico. (A) Imagen axial de TC de 2,5 mm de colimación, con ventana de pulmón, que muestra un nódulo de 23 mm (flecha) en el lóbulo superior izquierdo. (B) Las medidas de la atenuación del nódulo en la TC espiral dinámica son propias de las lesiones malignas, con un pico de realce de 112 UH, realce neto de 48 UH y una caída posterior del realce (lavado) de 28 UH. (C) La medida de la densidad de la microvasculatura con técnicas de marcaje inmunohistoquímico para CD31 muestra un teñido parduzco oscuro (flechas), que indica una alta densidad vascular. (x100)
Predicción de las metástasis ganglionares hiliares o mediastínicas en NPS
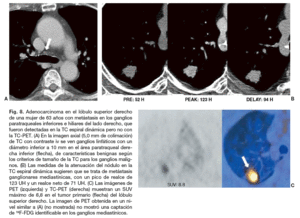
Aunque se ha intentado establecer datos morfológicos de los tumores primarios, como el tamaño o las características de los bordes tumorales en la TC69,70,78,79, que permitan conocer su propensión a metastatizar, los resultados no han sido satisfactorios, especialmente en el caso de los nódulos sólidos malignos. Shim et al80 han sugerido que el grado de realce de un nódulo está relacionado con su tendencia a producir metástasis ganglionares mediastínicas o hiliares; sin embargo, el tamaño del tumor, las características de los bordes, y la presencia de necrosis o engrosamiento broncovascular no mostraron correlación con las metástasis. Para los autores, los cánceres de pulmón en estadio T1 que en la TC dinámica muestran un pico de realce o un realce neto elevados tienen una alta probabilidad de producir metástasis ganglionares mediastínicas. Los porcentajes de sensibilidad, especificidad y precisión fueron del 62, 76 y 74%, respectivamente, cuando se aplicó como punto de corte un valor a partir de 100 UH para el pico de realce, y una sensibilidad del 77%, especificidad del 70% y precisión del 71% con un punto de corte de 60 UH para el realce neto. De acuerdo con Kim et al81 los porcentajes de sensibilidad, especificidad y precisión de la TC-PET para la estadificación de las metástasis ganglionares en el NPS maligno son 47, 100 y 88%, respectivamente. La TC-PET todavía tiene limitaciones para detectar ganglios mediastínicos metastáticos pequeños, como lo demuestra la existencia de falsos negativos43,82. En un estudio de Kim et al81, en 12 de 15 casos falsos negativos en los que no hubo captación significativa de 18F-FDG, los ganglios linfáticos eran visibles en el mediastino, pero eran pequeños, con un diámetro medio en el eje corto de 5,5 mm. La evaluación del grado de realce de un NPS maligno con la TC espiral dinámica tiene más sensibilidad que la TC-PET (aunque no estadísticamente significativa) para predecir metástasis ganglionares mediastínicas, aunque la TC-PET mostró una especificidad y un valor predictivo positivo perfectos80. En consecuencia, en pacientes con nódulos que muestran un realce importante en la TC espiral dinámica, incluso cuando la TC-PET no sugiera la existencia de ganglios mediastínicos metastáticos, la mediastinoscopia es recomendable (fig. 8).
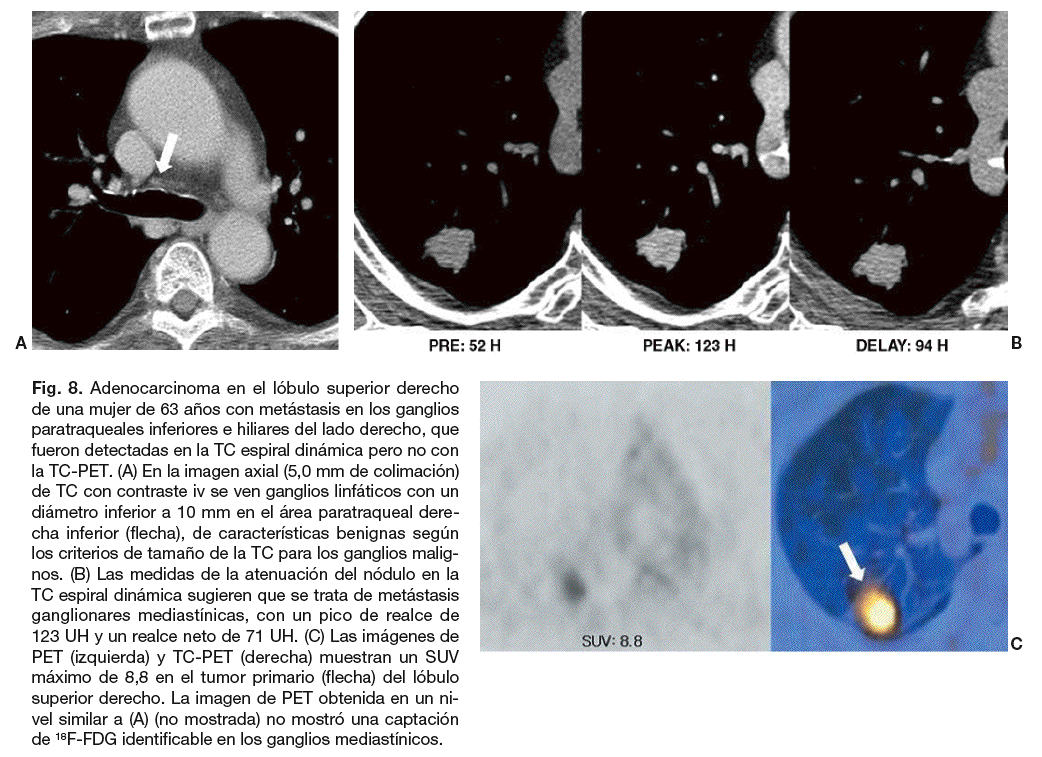
Fig. 8. Adenocarcinoma en el lóbulo superior derecho de una mujer de 63 años con metástasis en los ganglios paratraqueales inferiores e hiliares del lado derecho, que fueron detectadas en la TC espiral dinámica pero no con la TC-PET. (A) En la imagen axial (5,0 mm de colimación) de TC con contraste iv se ven ganglios linfáticos con un diámetro inferior a 10 mm en el área paratraqueal derecha inferior (flecha), de características benignas según los criterios de tamaño de la TC para los ganglios malignos. (B) Las medidas de la atenuación del nódulo en la TC espiral dinámica sugieren que se trata de metástasis ganglionares mediastínicas, con un pico de realce de 123 UH y un realce neto de 71 UH. (C) Las imágenes de PET (izquierda) y TC-PET (derecha) muestran un SUV máximo de 8,8 en el tumor primario (flecha) del lóbulo superior derecho. La imagen de PET obtenida en un nivel similar a (A) (no mostrada) no mostró una captación de 18F-FDG identificable en los ganglios mediastínicos.
Estrategias presentes y futuras
Es obvio que, a pesar del considerable avance técnico de las técnicas de imagen, el diagnóstico y manejo de los pacientes con NPS todavía se basa en los puntos de vista clínicos, pero también que algoritmos diagnósticos basados únicamente en lo clínico no pueden ser aplicados en todos los casos. Para Jeong et al10 cada criterio diagnóstico para malignidad --realce mayor o igual a 25 UH y lavado de 5-31 UH (p = 0,001; cociente de probabilidad, 25,7), borde lobulado (p = 0,011; cociente de probabilidad, 41,7), borde espiculado (p = 0,006; cociente de probabilidad, 35,3), y la ausencia de un nódulo satélite (p = 0,004; cociente de probabilidad, 13,8)-- es útil para el diagnóstico de nódulos malignos según un análisis de variables múltiples, tras controlar el efecto de otros factores diagnósticos. De acuerdo con resultados establecidos previamente10,37, un NPS puede ser evaluado inicialmente usando TC espiral dinámica, que proporciona información morfológica y hemodinámica de los nódulos, y que es una técnica disponible en la mayoría de los centros. La TC-PET puede ser usada como paso siguiente para evaluar pacientes con un diagnóstico posible de cáncer.
Con el fin de establecer estrategias diagnósticas para los NPS es necesario plantearse las siguientes cuestiones: ¿tienen que hacerse ambas exploraciones a pesar del riesgo de radiación y del coste elevado? Si es así, ¿cuál de ellas es técnicamente superior y cuál tiene el mayor coste-efectividad? En la TC espiral dinámica los nódulos con un realce mayor o igual a 25 UH y un lavado de 5-31 UH pueden ser diagnosticados como malignos con una especificidad alta10,37. Además, los nódulos con un realce mayor o igual a 25 UH con realce persistente, sin lavado o con lavado mayor a 31 UH, pueden ser considerados benignos con un valor predictivo negativo 71-95%, aunque aún tienen el potencial de ser malignos. La TC-PET en esos pacientes aumenta la sensibilidad diagnóstica37. Los nódulos con menos de 25 UH de realce tienen sólo una baja probabilidad de ser malignos (rango, 0-5%)10,37.
Sin embargo, cuando los nódulos con un realce menor a 25 UH, y nódulos con realce mayor o igual a 25 UH y realce persistente sin lavado o con lavado mayor a 31 UH, muestran características morfológicas malignas como un borde lobulado y espiculado, pero sin nódulos satélites, debe seguirse con su evaluación con una TC-PET. Si los nódulos tienen características morfológicas malignas del tipo de borde lobulado o espiculado, sin lesiones satélite, la TC-PET es recomendable incluso aunque el estudio hemodinámico sugiera benignidad, especialmente en nódulos que tienen realce mayor o igual a 25 UH.
La precisión de la PAAF y la biopsia transtorácica con aguja requiere preparación. Sus rendimientos diagnósticos para la valoración de NPS55,57 son inferiores en las publicaciones previas a los obtenidos con la TC-PET o con TC espiral dinámica, sola o en combinación con la TC-PET37, lo que sugiere que la PAAF y la biopsia transtorácica con aguja no pueden reemplazar totalmente a la TC-PET o a la TC espiral dinámica en la caracterización del NPS.
Los datos de la TCMD pueden ser útiles para la valoración de la perfusión de un nódulo en 3D y pueden ser más seguros que el análisis en 2D que se utiliza actualmente83. En el futuro el realce de un nódulo en 3D y la imagen dinámica podrán mejorar aún más la valoración de un NPS.
Conclusión
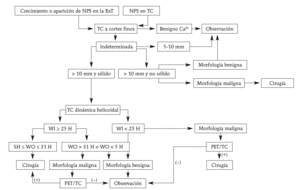
El cribado mediante TC, con o sin la ayuda del sistema CAD, ha incrementado la tasa de detección de lesiones pulmonares nodulares de pequeño tamaño, incluyendo los cánceres de pulmón periféricos precoces. La TC espiral dinámica proporciona información acerca de las características morfológicas y hemodinámicas con una alta especificidad y una precisión razonablemente elevada, por lo que puede ser usada para el estudio inicial de los NPS. La TC-PET es más sensible para la detección de malignidad que la TC espiral dinámica, y todos los nódulos malignos pueden ser potencialmente diagnosticados como malignos con estas dos técnicas. La TC-PET puede hacerse selectivamente para caracterizar un NPS cuando la TC espiral dinámica muestre resultados inconsistentes sobre sus características morfológicas y hemodinámicas (fig. 9). Las medidas seriadas del volumen de un nódulo y con ello, el cálculo del tiempo en que se duplica su tamaño, son actualmente los métodos más fiables para la caracterización tisular de los NIC. Cuando un NPS tiene una probabilidad alta de ser maligno, la resección del nódulo mediante cirugía toracoscópica vídeo-asistida, después de localizar el nódulo usando un sistema de marcaje pulmonar, puede llevarse a cabo para el diagnóstico y el tratamiento.
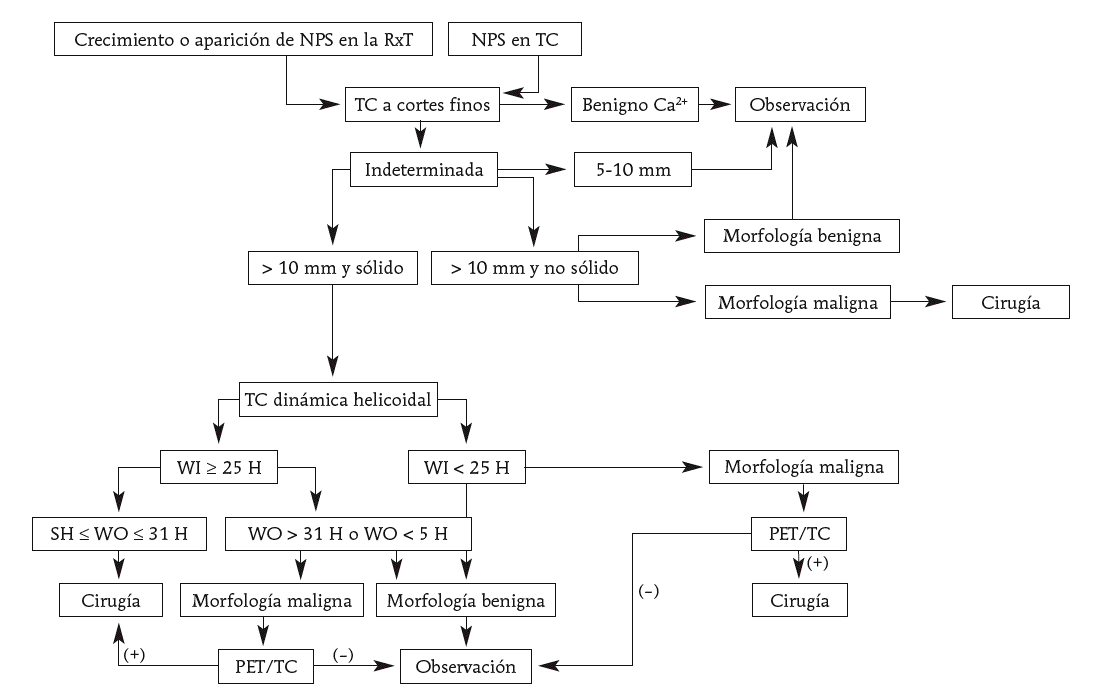
Fig. 9. Propuesta de algoritmo para el manejo de un nódulo pulmonar solitario. Ca2+: calcificación; NPS: nódulo pulmonar solitario; RxT: radiografía de tórax; WI: captación (wash in); WO=lavado (wash out).