El tratamiento estándar para el cáncer de endometrio (CE) es la histerectomía simple con salpingo-ooforectomía bilateral. Las pacientes dentro del grupo de alto riesgo son las que se benefician de la linfadenectomía lumboaórtica. En dicho grupo se encuentran las que presentan grado y subtipo histológico de mal pronóstico y profundidad de invasión miometrial superior al 50% (M2). Este último parámetro puede ser brindado por el estudio intraoperatorio por congelación (EIC) y la resonancia magnética (RM), contribuyendo a decidir quiénes se beneficiarán de la linfadenectomía. El objetivo es establecer el rédito diagnóstico de la RM y EIC para determinar la presencia de M2 en pacientes con CE.
Materiales y métodosEstudio de tipo test diagnóstico, corte transversal. Se incluyeron pacientes de sexo femenino con diagnóstico histopatológico de CE, a las que se realizó RM inicial o basal y fueron intervenidas quirúrgicamente en nuestra institución entre el 1 de enero de 2010 y el 31 de diciembre de 2017. Se estudiaron las RM y los informes de EIC y se compararon con los datos del informe de anatomía patológica. Se efectuó un análisis estadístico de sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN) de ambas pruebas diagnósticas. También se calculó la tasa de precisión diagnóstica de cada método discriminado, el porcentaje de subestimación y sobrestimación. Finalmente, se calculó el valor predictivo de la RM para determinar la presencia de M2 ajustándolo por las variables histológicas de mal pronóstico conocidas.
ResultadosPara la determinación de M2, la RM presentó una sensibilidad del 63%, una especificidad del 87%, un VPP del 73% y un VPN del 81%. La tasa de precisión diagnóstica fue del 78,8%, un 13,12% por subestimación y un 8,13% por sobrestimación de M2. Por su parte, el EIC presentó una sensibilidad del 69%, una especificidad del 86,7%, un VPP del 69% y un VPN del 86%. La tasa de precisión diagnóstica fue del 81,5%, un 9,24% por subestimación y 9,24% por sobrestimación de M2. El grado de concordancia entre ambos métodos es moderada (valor de kappa de 0,54, p < 0,00001).
ConclusionesEn nuestra experiencia, la RM y el EIC presentan un adecuado rédito diagnóstico, pero a favor del EIC, para determinar M2. La contribución de la RM al determinar la presencia y el sitio de invasión miometrial profunda, así como de los factores que puedan resultar confundidores, sumado al aporte de la EIC, se traduce en que ambos métodos ayudan a disminuir el número innecesario de linfadenectomías, con la morbimortalidad y los costos en salud asociados.
The standard treatment for endometrial cancer is simple hysterectomy with bilateral salpingo-oophorectomy. Patients with high risk also benefit from lumbo-aortic lymphadenectomy. High risk patients include those with grades and histologic subtypes associated with poor prognosis and depth of myometrial invasion greater than 50% (M2). To determine which patients would benefit from lumbo-aortic lymphadenectomy, the depth of myometrial invasion can be assessed by intraoperative frozen section or by magnetic resonance imaging (MRI). We aimed to determine the diagnostic yield of intraoperative frozen section and MRI for detecting the presence of M2 in patients with endometrial cancer.
Materials and methodsThis cross-sectional study included women with a histologically confirmed diagnosis of endometrial cancer who underwent baseline MRI and surgical intervention in our institution between 1 January 2010 and 31 December 2017. We reviewed the MRI studies and the intraoperative frozen section reports and compared them with the information in the histopathology report. We compared the sensitivity, specificity, positive predictive value (PPV), and negative predictive value (NPV) of the two tests. We also calculated the diagnostic accuracy of each method and the percentages of underestimation and overestimation. Finally, we calculated the predictive value of MRI for the presence of M2, adjusting it for the histologic variables known to be associated with poor prognosis.
ResultsTo detect M2, MRI had 63% sensitivity, 87% specificity, 73% PPV, and 81% NPV; the diagnostic accuracy was 78.8%, with 13.12% underestimation and 8.13% overestimation of M2. Intraoperative frozen section had 69% sensitivity, 86.7% specificity, 69% PPV, and 86% NPV; the diagnostic accuracy was 81.5%, with 9.24% underestimation and 9.24% overestimation of M2. The degree of concordance between the two methods was moderate (k=0.54, p < 0.00001).
ConclusionsIn our experience, MRI and intraoperative frozen section have adequate diagnostic yields for determining M2, though intraoperative frozen section is slightly better. The contribution of MRI in determining the presence and the site of deep myometrial invasion, as well as the factors that can confound the diagnosis, when added to the contribution of intraoperative frozen section, means that both methods help reduce the number of unnecessary lymph node dissections and the morbidity, mortality, and health costs associated with this practice.
El cáncer de endometrio (CE) es el cuarto cáncer que se presenta con mayor frecuencia en mujeres en Argentina, después del cáncer de mama, colorrectal y de tráquea-bronquios-pulmón1. En Estados Unidos hay 60.000 casos nuevos por año y la mortalidad es de 1,7-2,4/100.000 habitantes2. La mayoría de los casos son esporádicos y menos del 5% se asocian al síndrome de Lynch, donde existe alteración en la reparación de los genes MLH1, MSH2, MSH6 y PMS23.
Existe una clasificación tradicional del CE en dos grupos, basada en la clínica, la epidemiología y el perfil endocrino-metabólico. Los tumores de tipo I son aquellos adenocarcinomas endometrioides, estrógeno-dependientes y asociados a lesiones precursoras, como la neoplasia intraepitelial endometrial, que habitualmente presentan buen pronóstico. Se asocian con alteraciones en los genes PTEN, KRAS, CTNNB1 y/o PIK3CA, entre otros. Entre los de tipos II están los adenocarcinomas endometrioides con grado histológico III y los no endometrioides, como los carcinomas serosos, los carcinosarcomas y el carcinoma de células claras, que son más agresivos y de peor pronóstico y se asocian, en su mayoría, con alteraciones del gen p534.
Histológicamente, el CE puede presentar diferentes formas de invasión miometrial (IM), ya sea como frente amplio expansivo o en forma difusa como masa, cordones, grupos de células y en glándulas individuales. Este proceso se acompaña de una respuesta estromal desmoplásica de tejido fibroso e inflamación crónica5.
La International Federation of Gynecology and Obstetrics (FIGO) utiliza la profundidad de IM y el compromiso de órganos y tejidos adyacentes como criterio de estadificación del CE. Divide el estadio I en IA cuando el tumor invade menos del 50% del miometrio (M1) y IB cuando es mayor del 50% (M2)6, que implica mayor riesgo de invasión del espacio linfovascular con el consiguiente riesgo de diseminación ganglionar y probable recaída. De esta forma, el estadio IA presenta una supervivencia global del 88% al 91% a los 5 años, mientras que la supervivencia decae en un 81% en el estadio IB7–9,. Numerosos estudios han demostrado que el estadio IA de la FIGO presenta un 5% de riesgo de diseminación linfática, aunque no beneficio en la supervivencia con linfadenectomías de rutina10–12 y, por el contrario, aumenta la morbilidad de dicho grupo de pacientes13.
El tratamiento estándar para el CE es la histerectomía con la salpingo-ooforectomía bilateral. Se ha establecido que las pacientes de alto riesgo son las que se benefician de la linfadenectomía lumboaórtica14,15. Dentro de este grupo se incluye a los subtipos histológicos correspondientes a carcinomas endometrioides de grado III, a los carcinomas de células claras, carcinoma seroso, carcinosarcoma y carcinomas desdiferenciado e indiferenciado, entre otros, así como aquellos casos que presentan invasión del cuello uterino o con M2. Esta información la brinda el examen clínico y el análisis de la biopsia inicial16,17. La presencia de M2 se evalúa en el acto quirúrgico mediante el estudio intraoperatorio por congelación (EIC), y además puede ser evaluada mediante resonancia magnética (RM), método recomendado por el American College of Radiology y la European Society of Radiology, para la evaluación y estadificación del CE. Ambos constituyen herramientas que predicen con variada exactitud la IM, y de esta forma contribuyen a disminuir las linfadenectomías innecesarias, con las consecuentes implicaciones para la paciente y el sistema de salud18,19.
Nuestro objetivo principal es calcular el rédito diagnóstico de la RM y el EIC para determinar la presencia de M2 en CE. Como objetivo secundario, planteamos calcular la tasa de precisión diagnóstica de ambos métodos para determinar M2 y discriminar el porcentaje de subestimación y sobrestimación. Y como objetivo terciario, nos planteamos estimar la capacidad predictiva de la RM para determinar la presencia de M2 ajustándola por las variables histológicas de mal pronóstico conocidas.
Material y métodosConforme a la Ley Nacional de Protección de Datos Personales 25.326 (Ley de Habeas Data) y previa autorización del Comité de Ética en los Protocolos de Investigación del Hospital Italiano de Buenos Aires, Argentina, se realizó un estudio de tipo test diagnóstico, de corte transversal.
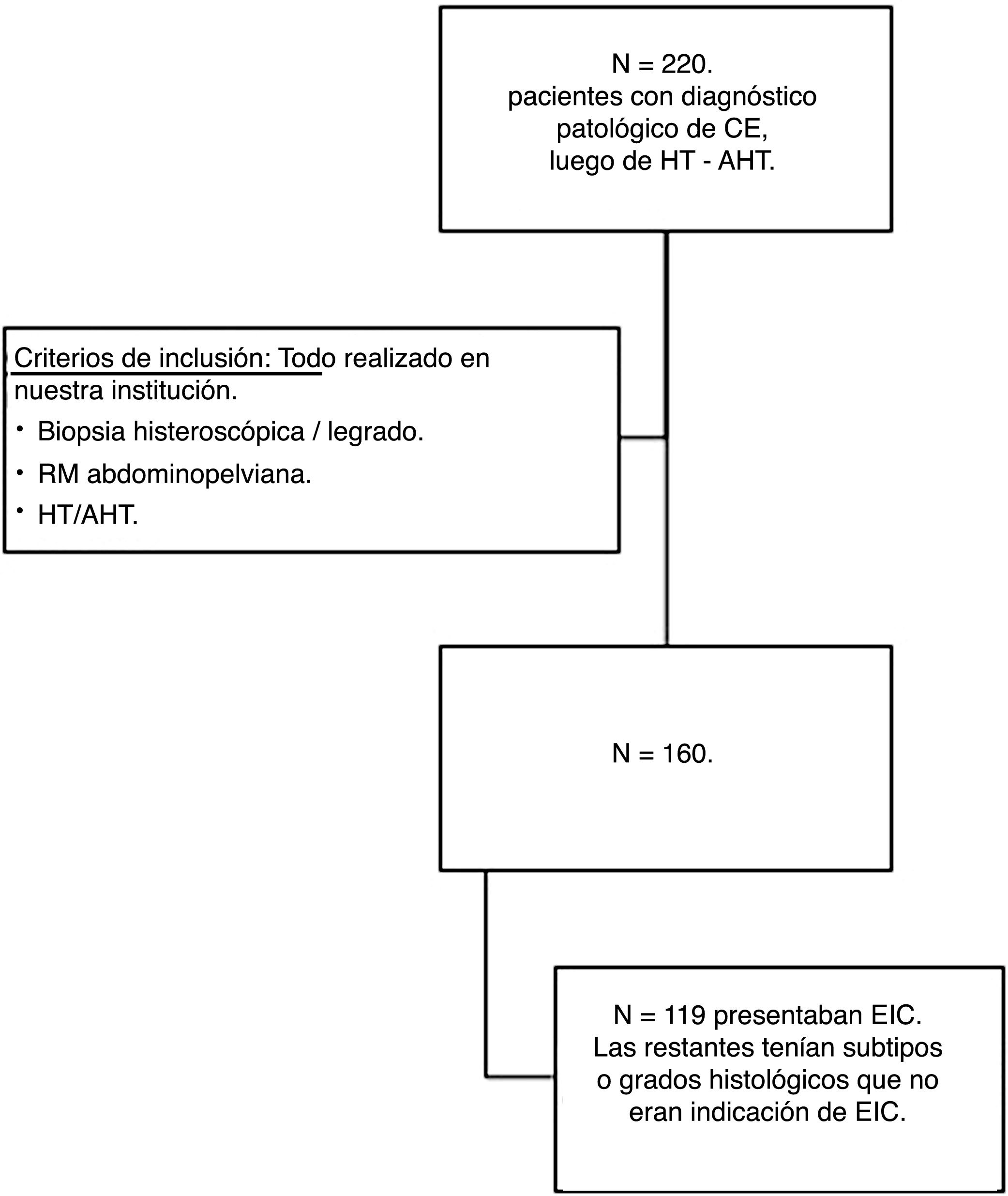
Sobre una base de datos de 227 pacientes con diagnóstico patológico de CE tras la histerectomía, se estudiaron las 160 pacientes que cumplieron con los siguientes criterios de inclusión: diagnóstico patológico inicial después de la biopsia histeroscópica, RM prequirúrgica e histerectomía (con o sin anexectomía) en nuestra institución. El período de estudio fue entre el 1 de enero 2010 y el 31 de diciembre 2017. Los criterios de inclusión se muestran en la figura 1.
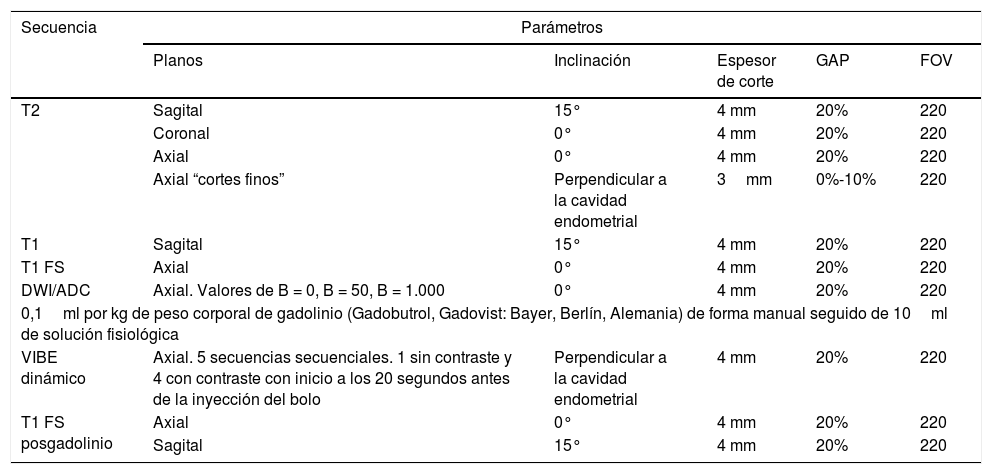
La adquisición de RM de pelvis ginecológica con gadolinio se realizó en equipos 1.5 T (Magnetom Avanto y Essenza Siemens, Erlangen, Alemania) utilizando bobinas de cuerpo de superficie. Se solicitó a las pacientes 3 horas de ayuno y se les administró bromuro de hioscina antes de la adquisición por vía endovenosa para disminuir la peristalsis.
Se obtuvieron secuencias morfológicas de T2 en planos axial, sagital y coronal, T1 con supresión de la grasa en plano axial, y T1 en plano sagital. Luego se obtuvo la secuencia de difusión (DWI. Valor b: 0-50-1000 s/mm2) con su correspondiente coeficiente de difusión aparente (ADC). Se inyectó gadolinio (Gadobutrol, Gadovist: Bayer, Berlín, Alemania) a una dosis de 0,1ml por kg de peso corporal de forma manual seguido de 10ml de solución fisiológica. Las imágenes se adquirieron secuencialmente, 20 segundos antes de la inyección del bolo, durante 180 segundos en total. Se obtuvieron 5 secuencias volumétricas ponderadas en T1 con supresión de la grasa, sin y con contraste endovenoso, y sus correspondientes secuencias en sustracción (tabla 1).
Protocolo de adquisición de resonancia magnética de pelvis ginecológica
| Secuencia | Parámetros | ||||
|---|---|---|---|---|---|
| Planos | Inclinación | Espesor de corte | GAP | FOV | |
| T2 | Sagital | 15° | 4 mm | 20% | 220 |
| Coronal | 0° | 4 mm | 20% | 220 | |
| Axial | 0° | 4 mm | 20% | 220 | |
| Axial “cortes finos” | Perpendicular a la cavidad endometrial | 3mm | 0%-10% | 220 | |
| T1 | Sagital | 15° | 4 mm | 20% | 220 |
| T1 FS | Axial | 0° | 4 mm | 20% | 220 |
| DWI/ADC | Axial. Valores de B = 0, B = 50, B = 1.000 | 0° | 4 mm | 20% | 220 |
| 0,1ml por kg de peso corporal de gadolinio (Gadobutrol, Gadovist: Bayer, Berlín, Alemania) de forma manual seguido de 10ml de solución fisiológica | |||||
| VIBE dinámico | Axial. 5 secuencias secuenciales. 1 sin contraste y 4 con contraste con inicio a los 20 segundos antes de la inyección del bolo | Perpendicular a la cavidad endometrial | 4 mm | 20% | 220 |
| T1 FS posgadolinio | Axial | 0° | 4 mm | 20% | 220 |
| Sagital | 15° | 4 mm | 20% | 220 | |
DWI/ADC: diffussion weighted images/apparent diffussion coefficient; FOV: field of view; GAP: espacios entre cortes/factor de distancia; T1 FS: T1 con saturación de la grasa; VIBE: volumetric interpolated breath-hold examination.
El EIC se realizó mediante el análisis macroscópico de la pieza operatoria. Se localizó el foco de mayor infiltración del miometrio, guiado por lo observado en la RM, y se realizaron cortes por congelación en criostato. Se colorearon con técnicas de hematoxilina-eosina.
Todas la RM fueron analizadas por médicos radiólogos con experiencia en RM ginecológica de 12 y 5 años de experiencia, con criterios de informe unificados. En el momento del análisis, los médicos informantes conocían la edad y los hallazgos de US en el momento del diagnóstico y desconocían el resultado de la biopsia inicial.
Los hallazgos en RM y las fichas de EIC se compararon con los datos de la profundidad de invasión miometrial (M) final del informe de la anatomía patológica. Esto fue realizado por miembros del equipo de investigación que solo conocían la edad de la paciente y desconocían el resultado de la biopsia inicial.
Se efectuó un análisis estadístico de sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN) de ambas pruebas diagnósticas. También se calculó el valor predictivo de la RM para determinar la presencia de M2 ajustándolo por las variables histológicas de mal pronóstico conocidas.
Los resultados fueron considerados significativos cuando el valor de p fue inferior a 0,05. Se analizaron los datos con el software STATA (Data analysis and statistical software for professionals)/IC, junto con el equipo de estadística de nuestra institución.
ResultadosLas características de las pacientes y los hallazgos cualitativos en RM y anatomía patológica fueron resumidos utilizando estadística descriptiva y expresando medidas de resumen de tendencia central y distribución. Las variables continuas se describieron con su media y desviación estándar (DE) o mediana y rango intercuartílico, según distribución, y las variables categóricas fueron expresadas como frecuencias absolutas y relativas.
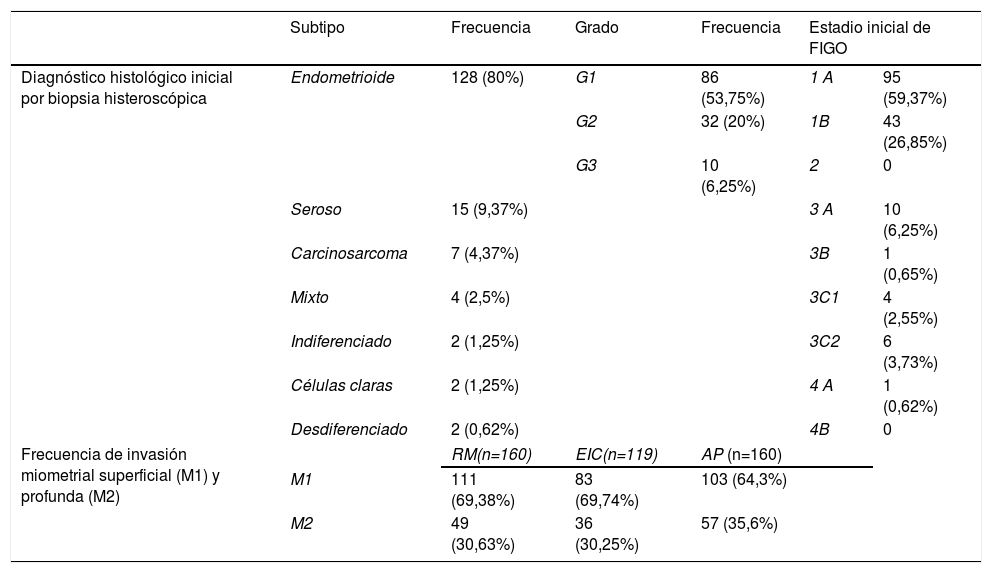
Se analizaron un total de 160 pacientes con diagnóstico de CE, evaluadas con RM preoperatoria, datos que se presentan en la tabla 2. Las pacientes tenían una edad media de 65,78 años (DE: 10,8 años). La frecuencia de presentación de M1 y M2 por RM también se muestra en la tabla 2.
Características demográficas, diagnóstico inicial por biopsia histeroscópica, frecuencia de invasión miometrial superficial y profunda, y estadio inicial según la FIGO
| Subtipo | Frecuencia | Grado | Frecuencia | Estadio inicial de FIGO | ||
|---|---|---|---|---|---|---|
| Diagnóstico histológico inicial por biopsia histeroscópica | Endometrioide | 128 (80%) | G1 | 86 (53,75%) | 1 A | 95 (59,37%) |
| G2 | 32 (20%) | 1B | 43 (26,85%) | |||
| G3 | 10 (6,25%) | 2 | 0 | |||
| Seroso | 15 (9,37%) | 3 A | 10 (6,25%) | |||
| Carcinosarcoma | 7 (4,37%) | 3B | 1 (0,65%) | |||
| Mixto | 4 (2,5%) | 3C1 | 4 (2,55%) | |||
| Indiferenciado | 2 (1,25%) | 3C2 | 6 (3,73%) | |||
| Células claras | 2 (1,25%) | 4 A | 1 (0,62%) | |||
| Desdiferenciado | 2 (0,62%) | 4B | 0 | |||
| Frecuencia de invasión miometrial superficial (M1) y profunda (M2) | RM(n=160) | EIC(n=119) | AP (n=160) | |||
| M1 | 111 (69,38%) | 83 (69,74%) | 103 (64,3%) | |||
| M2 | 49 (30,63%) | 36 (30,25%) | 57 (35,6%) | |||
AP: anatomía patológica; EIC: estudio intraoperatorio por congelación; M1: invasión superficial; M2: invasión profunda; RM: resonancia magnética.
Se realizó EIC en 119 (74,3%) pacientes; en los 41 casos restantes no se realizó EIC por presentar subtipos histológicos de alto riesgo y/o grado histológico III. La frecuencia de presentación de M1 y M2 por EIC se presenta en la tabla 2.
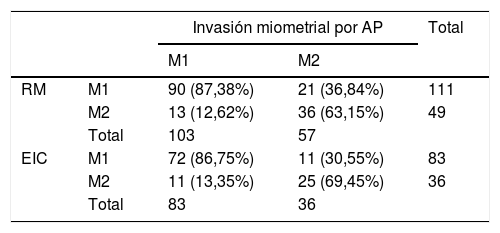
El análisis estadístico de sensibilidad, especificidad, VPP y VPN de ambos métodos para determinar M2 (tabla 3) dio, como resultado estadísticamente significativo (p < 0,05), lo que se describe a continuación. La RM presentó una sensibilidad del 63%, una especificidad del 87%, un VPP del 73% y un VPN del 81%, y el EIC presentó una sensibilidad del 69%, una especificidad del 86,7%, un VPP del 69% y un VPN del 86%. Se estimó el grado de concordancia entre ambos métodos mediante el coeficiente kappa de Cohen, con un resultado de 0,53 (p < 0,00001), con lo que se concluye que la concordancia entre ambos métodos es moderada y estadísticamente significativa.
Resultados de la resonancia magnética y el estudio intraoperatorio para determinar la invasión miometrial distinguiendo la superficial (M1) de la profunda (M2)
| Invasión miometrial por AP | Total | |||
|---|---|---|---|---|
| M1 | M2 | |||
| RM | M1 | 90 (87,38%) | 21 (36,84%) | 111 |
| M2 | 13 (12,62%) | 36 (63,15%) | 49 | |
| Total | 103 | 57 | ||
| EIC | M1 | 72 (86,75%) | 11 (30,55%) | 83 |
| M2 | 11 (13,35%) | 25 (69,45%) | 36 | |
| Total | 83 | 36 | ||
AP: anatomía patológica; EIC: estudio intraoperatorio por congelación; M1: invasión superficial; M2: invasión profunda; RM: resonancia magnética.
La RM presentó una tasa de precisión diagnóstica del 78,75% (n = 126/160), un 13,12% (n = 21/160) de los casos fueron por subestimación y un 8,13% (n = 13/160) por sobreestimación del M2. Por su parte, el EIC presentó un 81,51% de precisión diagnóstica (n = 97/119), un 9,24% (n = 11/119) fueron por subestimación y un 9,24% (n = 11/119) por sobrestimación de M2.
Finalmente, hemos documentado una fuerte asociación entre el resultado de la RM y el análisis de anatomía patológica final para determinar la presencia de M2 (odds ratio: 11,91, intervalo de confianza [IC] al 95%: 5,27-26,94) aun ajustándolo por los subtipos histológicos de alto riesgo y/o grado histológico III.
Después de analizar los dos métodos diagnósticos se observó que ambos presentan una adecuada y similar capacidad diagnóstica, pero a favor del EIC, para determinar la presencia de M2.
DiscusiónEn nuestra experiencia, y similar a lo descrito en la literatura especializada, la RM presenta una adecuada sensibilidad (63%), especificidad (87%), VPP (73%) y VPN (81%), para determinar la presencia de M216,18–22. Si bien en nuestra población de estudio se incluyen pacientes que presentan otros factores de mal pronóstico, independientemente del grado de invasión miometrial, nos interesa destacar que más del 70% de nuestra población corresponde al tipo histológico endometrioide y de bajo grado. Al realizar un análisis estadístico de riesgo, encontramos que la tendencia predictiva de la RM se mantiene aun ajustándolo por los subtipos histológicos de alto riesgo y/o grado histológico III, por lo que consideramos que nuestros resultados se asemejan a los de la literatura especializada, y fundamentalmente, de relevancia clínica (fig. 2).
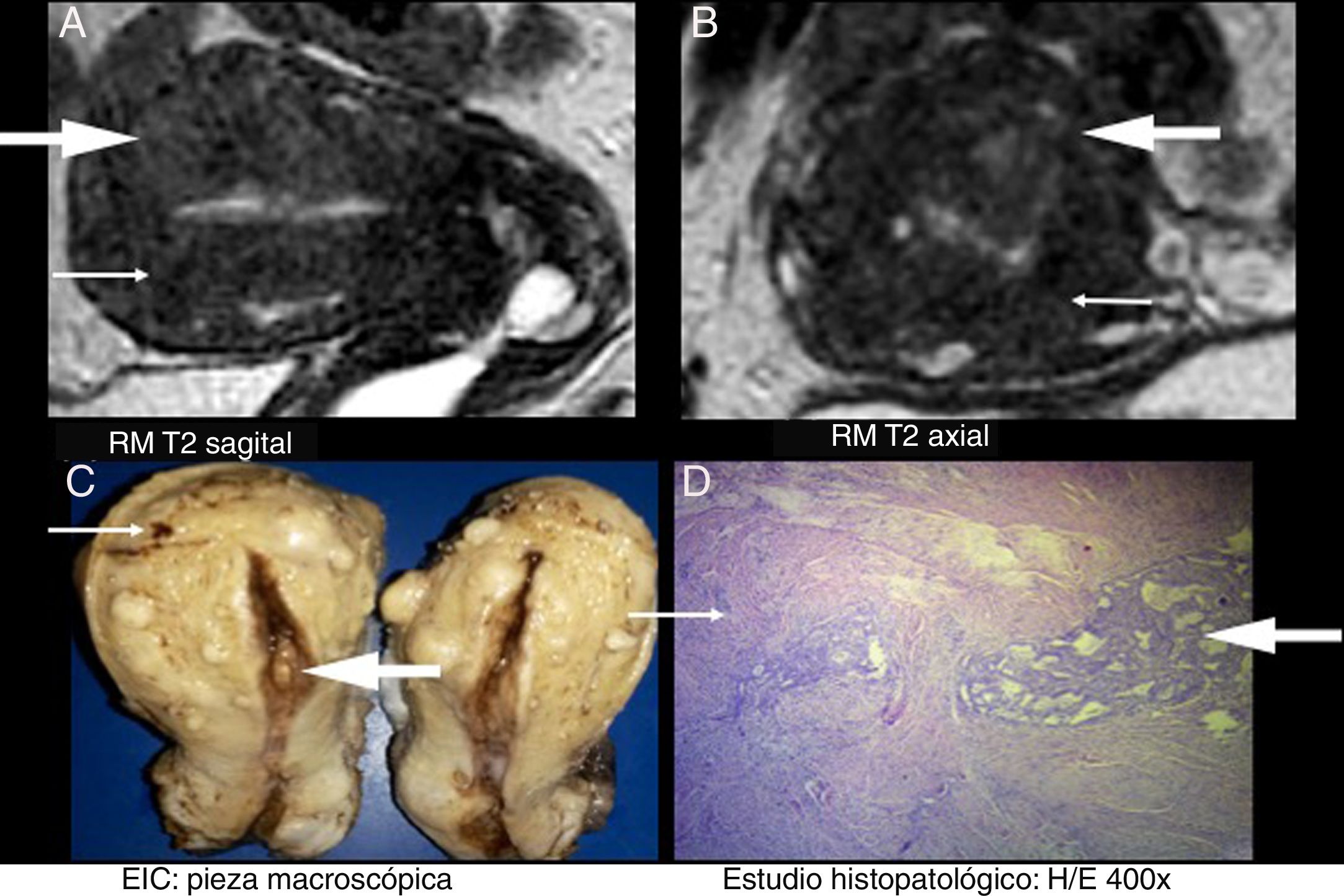
A) Resonancia magnética (RM) T2 sagital. B) RM T2 axial. C) Estudio intraoperatorio por congelación (EIC): pieza macroscópica. D) Anatomía patológica. H/E 400x. Paciente femenina de 54 años, G2P2, en estudio para estadificación inicial de adenocarcinoma de endometrio, subtipo endometrioide y de bajo grado (G1). RM inicial (A y B). Se evidenció una formación tumoral de señal intermedia en T2 (flecha gruesa), restricción en DWI/ADC y realce intenso tras la administración de gadolinio (no se presentan las imágenes de estas dos últimas características). Se visualiza que el miometrio interno presenta adenomiosis difusa (flecha fina) y la formación tumoral la está invadiendo, sin afectar al miometrio profundo. Se clasificó como M1. EIC (C): se discriminó en el acto quirúrgico el proceso tumoral (flecha gruesa) y la adenomiosis difusa con áreas hemorrágicas (flecha fina). Se clasificó como M1. Anatomía patológica (D): reveló un adenocarcinoma endometrioide bien diferenciado G1 con invasión superficial del miometrio (flecha gruesa) y con extensión a través de focos de adenomiosis (flecha fina). Se confirmaron los hallazgos de la EIC.
La gran parte de los casos discordantes se debieron a dificultades técnicas o anatómicas que llevaron a una incorrecta interpretación de la IM profunda. La subestimación se relaciona con la presencia de adenomiosis, miomas corporales, úteros involutivos con miometrio adelgazado o distendido, y/o artefactos técnicos, mientras que la sobrestimación de la invasión miometrial por imágenes se podría explicar por la presencia de desmoplasia y/o edema estromal que dificulta la lectura del tumor mediante RM (fig. 3).
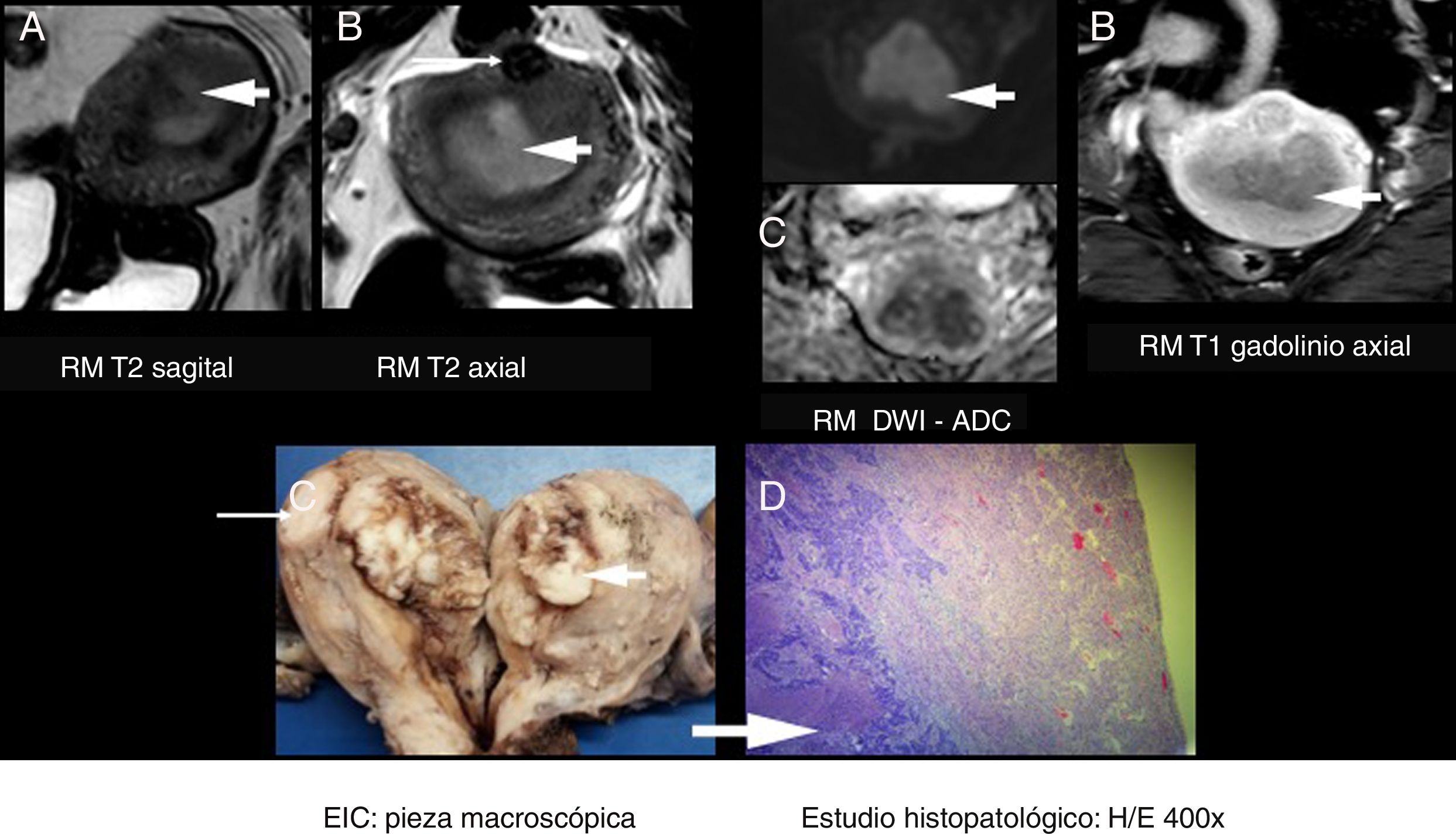
A) Resonancia magnética (RM) T2 sagital. B) RM T2 axial. C) RM DWI/ADC axial. D) RM T1 con gadolinio axial. E) EIC: pieza macroscópica. F) Anatomía patológica. H/E 400x. Paciente femenina de 52 años, G2P2, en estudio para estadificación inicial de adenocarcinoma de endometrio subtipo endometrioide y de moderado grado (G2). RM inicial (A y B). Se evidenció una formación tumoral de señal intermedia en T2 (flecha gruesa), restricción en DWI/ADC (C) y realce intenso tras la administración de gadolinio (D) que ocupaba la pared anterior uterina. Impresiona de infiltrar el miometrio profundo. Se clasificó como M2. Se visualizó un pequeño mioma intramural adyacente (flecha fina). Estudio intraoperatorio (EIC) (C): se discriminó en el acto quirúrgico el proceso tumoral (flecha gruesa) y el leiomioma posterior (flecha fina). Se clasificó como M2. Anatomía patológica (D): demuestra un adenocarcinoma endometrioide, moderadamente diferenciado G2, con invasión profunda del miometrio M2 y proximidad a la serosa uterina (flecha gruesa). Se confirmaron los hallazgos de la EIC y RM.
Existen herramientas técnicas en RM que contribuyen a disminuir la tasa de error. Una de ellas es la adquisición de cortes axiales en T2 perpendiculares al eje mayor de la cavidad endometrial, que permiten evaluar con precisión la extensión axial del tumor.
Por otro lado, las secuencias avanzadas de difusión (DWI-ADC) y la valoración dinámica posterior a la administración de contraste permiten incrementar la diferenciación entre la interfaz miometrio-tumor y mejorar la determinación de la IM. Esto es útil cuando el tumor es isointenso al miometrio en T2, el útero es involutivo, el tumor crece hacia las regiones cornuales o bien existe adenomiosis y/o miomas asociados. Es por lo anteriormente mencionado que se considera que las secuencias T2, DWI-ADC y VIBE (volumetric interpolated breath-hold examination) son la combinación adecuada (“one-stop-shop”) para la correcta estadificación preoperatoria4,18.
La ecografía transvaginal (ETV) es también un método de gran utilidad tanto en el diagnóstico como en la estadificación del cáncer de endometrio. En este, no solo debe evaluarse la cavidad endometrial en la escala de grises como en el Doppler, sino también estudiar la interfase endometrio-miometrio interno y miometrio profundo. Existen casos con compromiso miometrial y escasa expresión endocavitaria, donde la línea endometrial podría interpretarse como “fina” si no se analiza el aspecto del miometrio subyacente. En la revisión sistemática más reciente realizada por el equipo de Alcazar et al. se concluyó que si bien la sensibilidad y la especificidad de la ETV son levemente menores que las de la RM (75% y 82% frente a 83% y 83%, respectivamente), esta diferencia no es estadísticamente significativa23. Sin embargo, tal como se ya ha mencionado, otros artículos como el de Nougaret et al. hablan de las utilidades adicionales de las secuencias de RM para disminuir la tasa de error de interpretación ante factores como la adenomiosis, miomatosis, úteros involutivos, etc., cuya presencia dificulta la interpretación de la ETV4. Por lo mencionado, en nuestro servicio ponderamos la ETV para la evaluación de la paciente con metrorragia de la posmenopausia o sangrado uterino anormal y la RM para la estadificación locorregional y a distancia.
Así mismo, tanto en nuestra experiencia como en la literatura especializada, el EIC presenta una adecuada sensibilidad, especificidad, VPP y VPN para determinar la presencia de M224–26. Los casos discordantes se debieron, en mayor medida, a una sobrestimación del grado de IM debido a la extensión tumoral a través de focos de adenomiosis y a la presencia de leiomiomas que deforman la cavidad uterina. Podrían haberse prevenido mediante la realización de cortes sucesivos por congelación del resto de la cavidad uterina. Si bien el número de pacientes es menor debido a que a no todas las pacientes se les realizó EIC, los resultados estuvieron dentro del IC 95% (fig. 4).
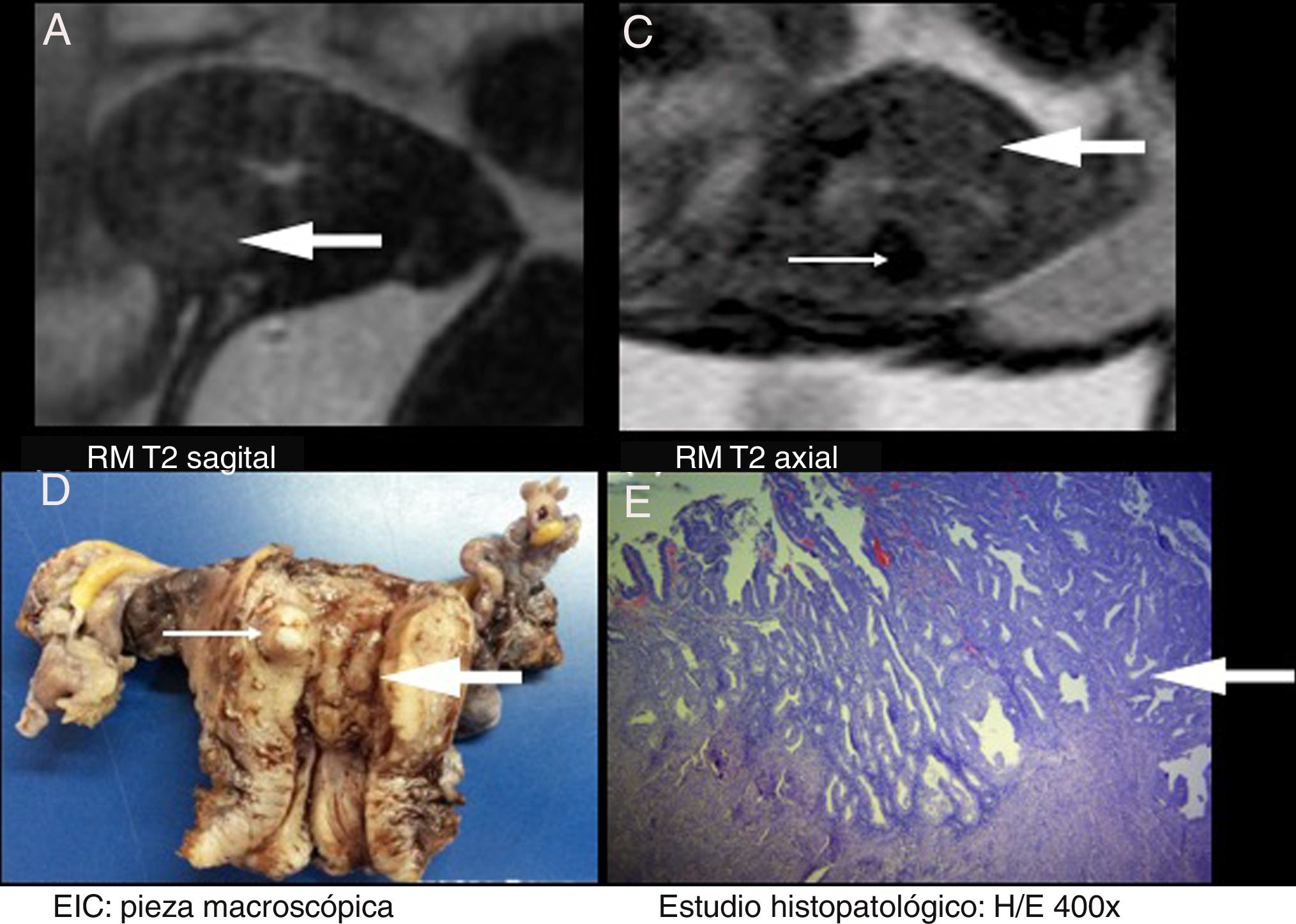
A) Resonancia magnética (RM) T2 sagital. B) RM T2 axial. C) Estudio intraoperatorio (EIC): pieza macroscópica. D) Anatomía patológica. H/E 400x. Paciente femenina de 68 años, G3P3, en estudio para estadificación inicial de adenocarcinoma de endometrio, subtipo endometrioide y de bajo grado (G1). RM inicial (A y B). Se evidenció una formación tumoral de señal intermedia en T2 (flecha gruesa), restricción en DWI/ADC y realce intenso tras la administración de gadolinio (no se presentan las imágenes de estas dos últimas características) que ocupaba la pared anterior uterina. Impresiona comprometer el miometrio profundo. Se concluyó como M2. Se visualizó un pequeño mioma intramural posterior (flecha fina). EIC (C): se discriminó en el acto quirúrgico el proceso tumoral (flecha gruesa) y el leiomioma posterior (flecha fina). Se concluyó como M1. Anatomía patológica (D): revela la presencia de un adenocarcinoma endometrioide bien diferenciado G1, predominantemente intramucoso, con pequeños focos de invasión inicial del miometrio (flecha gruesa). Se confirmaron los hallazgos de la EIC y RM. En dicho caso, la RM brindó un falso positivo. En un análisis retrospectivo se visualizó que el artefacto por movimiento había llevado a la confusión.
Si bien nuestros resultados, y similar a lo notificado en la literatura, muestran que el rédito diagnóstico de la RM es menor que el de EIC16, el aporte de la RM al informar el sitio probable de mayor invasión y los posibles factores confundidores guía al patólogo durante el EIC y de esta forma ambos métodos contribuyen a optimizar la toma de decisiones en el acto quirúrgico.
Algunos grupos han implementado la utilización de la biopsia del ganglio centinela con su estudio histopatológico en diferido. Se realiza en aquellas pacientes con enfermedad aparentemente confinada al endometrio y sin metástasis demostrada para definir la necesidad de linfadenectomía27–29. En los últimos años, numerosos estudios han analizado también el perfil genómico de los tumores de endometrio y se ha propuesto una clasificación molecular que permite obtener información pronóstica independiente de los factores morfológicos ya establecidos. En un futuro, esta herramienta, al ser utilizada en forma rutinaria, permitirá sumar criterios para guiar el tratamiento de las personas con CE18,30. Ambas perspectivas las dejamos en consideración para futuras investigaciones por parte de nuestro equipo.
En nuestra experiencia, la RM y el EIC presentan un adecuado rédito diagnóstico, pero a favor del EIC, para determinar M2. La contribución de la RM al determinar la presencia y el sitio de invasión miometrial profunda, así como de los factores que puedan resultar confundidores sumado al aporte de la EIC, se traduce en que ambos métodos ayudan a disminuir el número innecesario de linfadenectomías, con la morbimortalidad y los costos en salud asociados.
Autoría- 1.
Responsables de la integridad del estudio: SFM y CAPI.
- 2.
Concepción del artículo: SFM y CAPI.
- 3.
Diseño del artículo: SFM y CAPI.
- 4.
Obtención de los datos: LC, SFM y CAPI.
- 5.
Análisis e interpretación de los datos: SFM y CAPI.
- 6.
Tratamiento estadístico: SFM y CAPI.
- 7.
Búsqueda bibliográfica: SFM y CAPI.
- 8.
Redacción del trabajo: SFM y CAPI.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: SPMC y MNN.
- 10.
Aprobación de la versión final: CCRB, PM y WA.
Los autores declaran no tener ningún conflicto de intereses.