Describir nuestra experiencia con la resonancia magnética intraoperatoria (RMio) de 3 teslas en procedimientos neuroquirúrgicos en patología tumoral y evaluar los criterios que condicionaron la ampliación quirúrgica.
Material y métodosEstudio retrospectivo en el que se incluyeron todas las RMio consecutivas realizadas por patología neurooncológica en los primeros 13 meses tras su instalación. Se registraron las posibles complicaciones inmediatas, la presencia de restos tumorales y la modificación de la actitud quirúrgica por los resultados de la RMio. Se midió el tiempo quirúrgico en todos los casos.
ResultadosEl mayor porcentaje de lesiones resecadas correspondió a glioblastomas recidivados, seguido de glioblastomas primarios y metástasis. Se evidenció una resección completa en un 28% y restos tumorales en un 72%. La RMio permitió a los neurocirujanos mejorar la extensión de la resección en un 85%. La media del tiempo quirúrgico fue de 390±122 minutos.
ConclusiónLa RMio con equipos de alto campo (3 teslas) es una técnica novedosa y válida, que permite estudiar la resección tumoral de forma precisa y evaluar si se puede continuar la resección sin dañar zonas elocuentes. Aunque su empleo conlleva una prolongación del tiempo quirúrgico, este mejora con la curva de aprendizaje del personal.
To report our experience in the use of 3 tesla intraoperative magnetic resonance imaging (MRI) in neurosurgical procedures for tumors, and to evaluate the criteria for increasing the extension of resection.
Material and methodsThis retrospective study included all consecutive intraoperative MRI studies done for neuro-oncologic disease in the first 13 months after the implementation of the technique. We registered possible immediate complications, the presence of tumor remnants, and whether the results of the intraoperative MRI study changed the surgical management. We recorded the duration of surgery in all cases.
ResultsThe most common tumor was recurrent glioblastoma, followed by primary glioblastoma and metastases. Complete resection was achieved in 28%, and tumor remnants remained in 72%. Intraoperative MRI enabled neurosurgeons to improve the extent of the resection in 85% of cases. The mean duration of surgery was 390±122minutes.
ConclusionIntraoperative MRI using a strong magnetic field (3 teslas) is a valid new technique that enables precise study of the tumor resection to determine whether the resection can be extended without damaging eloquent zones. Although the use of MRI increases the duration of surgery, the time required decreases as the team becomes more familiar with the technique.
La neurocirugía tiene como primer objetivo extirpar las lesiones intracraneales sin dañar el parénquima normofuncionante, preservando de ese modo las funciones neurológicas esenciales1. La resonancia magnética (RM) ha demostrado ser la prueba idónea para establecer cuál es la situación del tumor y analizar la mejor forma de abordarlo. En los últimos años se han desarrollado sistemas de RM intraoperatoria (RMio) que permiten evaluar la extirpación de las lesiones intracraneales durante el acto quirúrgico. Aunque inicialmente la RMio se utilizaba en los tumores de extirpe glial, en la actualidad también se emplea en otros procedimientos2–14.
El desarrollo de la RM de 3 teslas ha permitido obtener imágenes en menor tiempo, con una mayor resolución y con superiores prestaciones que en los estudios realizados con equipos de menor campo15–19.
En los protocolos habituales se realiza una RM postoperatoria de control para evaluar si la resección de la lesión diana ha sido completa. Esta RM postoperatoria se lleva a cabo en las primeras 24-36 horas. Aunque estos estudios posquirúrgicos son precisos, tienen el inconveniente de que si la resección tumoral no ha sido adecuada debe recurrirse a una segunda intervención para completarla, con los riesgos y el gasto económico que esto comporta.
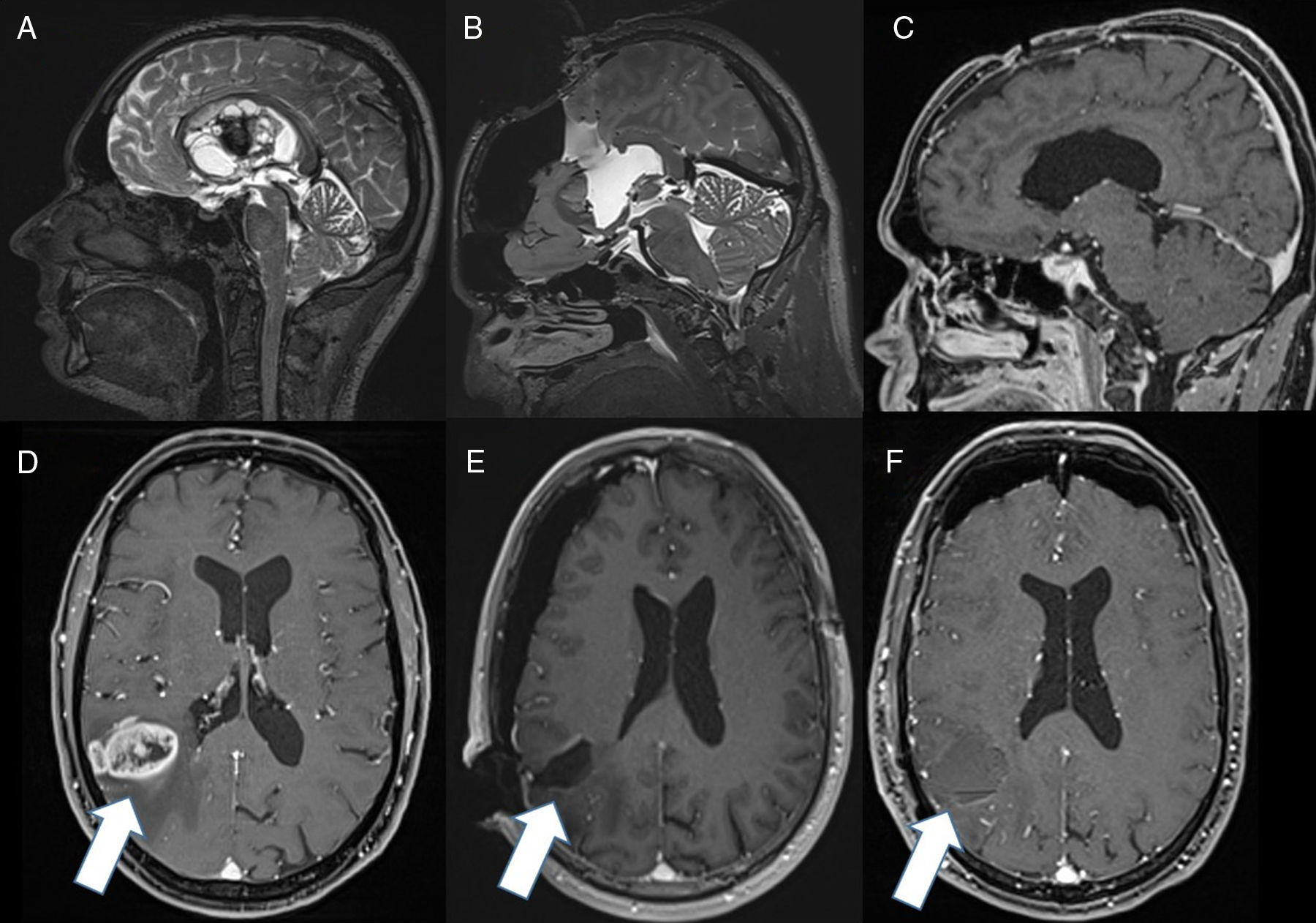
Desde su introducción en la práctica quirúrgica, los sistemas de RMio se han convertido en importantes herramientas para la cirugía de los tumores cerebrales en muchos centros. Varios estudios han demostrado que con la RMio pueden lograrse extirpaciones tumorales más amplias y precisas, lo que se asocia a una mayor supervivencia de los pacientes8,11,16,18. Asimismo, se puede evaluar la existencia de complicaciones inmediatas (hemorragias, infarto…). Todo esto permite analizar si se ha conseguido el objetivo de la cirugía y tomar la decisión de darla por finalizada o continuar con el procedimiento (fig. 1).
Las principales ventajas de la RMio son: el conocimiento del grado de resección «en tiempo real», la preservación de estructuras sanas y la compensación del brain-shift. Se denomina brain-shift a la distorsión de las estructuras intracraneales como consecuencia de la craniectomía; este desplazamiento implica una falta de correlación con los estudios prequirúrgicos, en los que las presiones intracraneales no se han modificado.
En España son varios los centros que disponen del equipamiento de RMio, aunque la mayoría son de bajo campo. El objetivo de este trabajo es describir nuestra experiencia con la implantación de la RMio de 3 T en procedimientos neuroquirúrgicos en patología tumoral y establecer los criterios que condicionaron la ampliación quirúrgica.
Material y métodosEstudio retrospectivo realizado entre enero de 2016 y marzo de 2017 en el que se registraron todas las RMio realizadas y valoradas en nuestro centro por patología neurooncológica.
Se incluyeron 93 pacientes y se recogieron la edad, el sexo y el diagnóstico por la imagen en los estudios prequirúrgicos.
No se consideró necesario consultar con el comité de ética del hospital debido a las características retrospectivas descriptivas del estudio y el uso de datos anonimizados.
En todos los casos, con un neurorradiólogo experimentado presente en la sala, se evaluó el resultado operatorio, que se comunicó personalmente al equipo neuroquirúrgico. Se describieron posibles complicaciones inmediatas, la presencia de restos tumorales o no, y si los resultados de la RMio modificaron la actitud quirúrgica. En los casos con restos tumorales positivos se valoró si este hallazgo conllevó continuar con la resección, o bien si se cesó la intervención en caso de que los restos tumorales fuesen inoperables por encontrarse en zonas elocuentes. Se consideraron como restos tumorales los estudios con focos de alteración de la señal en las secuencias T1, T2 y difusor-tensor, así como su incremento de señal tras administrar contraste paramagnético; específicamente, se distinguieron estas zonas de las áreas de realce inherentes a la actuación quirúrgica y de la presencia de material hemostásico intraoperatorio. El cirujano determinó si el resto tumoral se encontraba en una zona elocuente mediante navegación, tractografía y monitorización neurofisiológica. Se midió el tiempo quirúrgico en todos los casos.
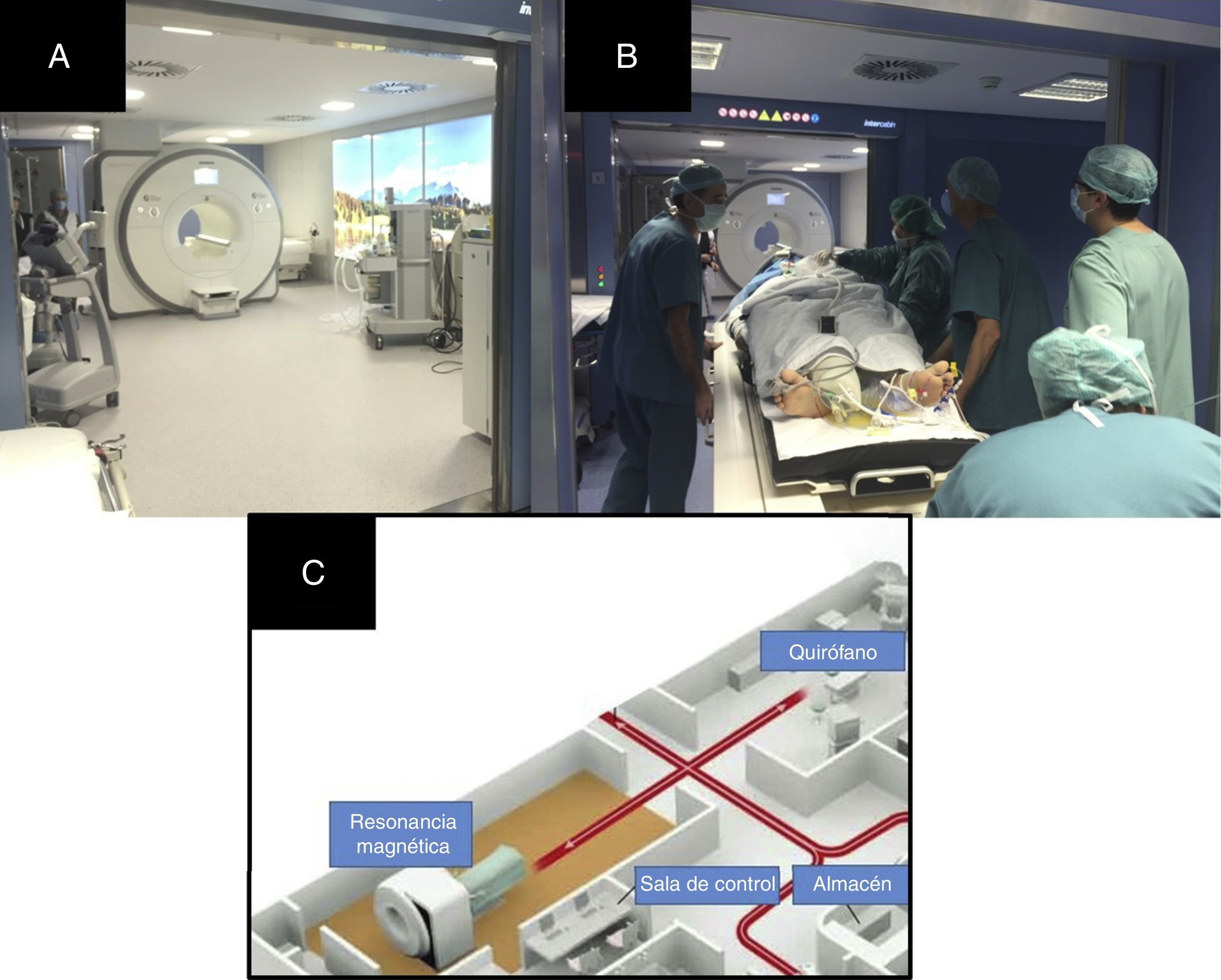
Todos los estudios de RMio se realizaron en un equipo de RM de 3 T (Magnetom Skyra, Siemens Medical Systems, Erlangen, Alemania) (fig. 2 A). En nuestro centro, el equipo se ubica adyacente al quirófano de neurocirugía (fig. 2 B y C). En dicho quirófano, la mesa operatoria ya tiene incluida parte de las bobinas de superficie cerebral (su parte inferior). Cuando se considera, el paciente es transportado del quirófano al equipo en una mesa quirúrgica compatible con la RM. El paciente es controlado en todo momento por el personal de anestesia y neurocirugía, manteniendo las máximas condiciones de asepsia tanto del personal como de la propia sala. Una vez en el imán, se complementa la bobina de superficie con su mitad superior y se procede al estudio. Al ser dos espacios separados se evita la introducción de material ferromagnético en la sala de RM, por lo que no es obligada la adquisición de material quirúrgico compatible. Obviamente, sí se requiere un equipo respirador compatible con un campo de 3 T, y por supuesto la bobina de superficie flexible.
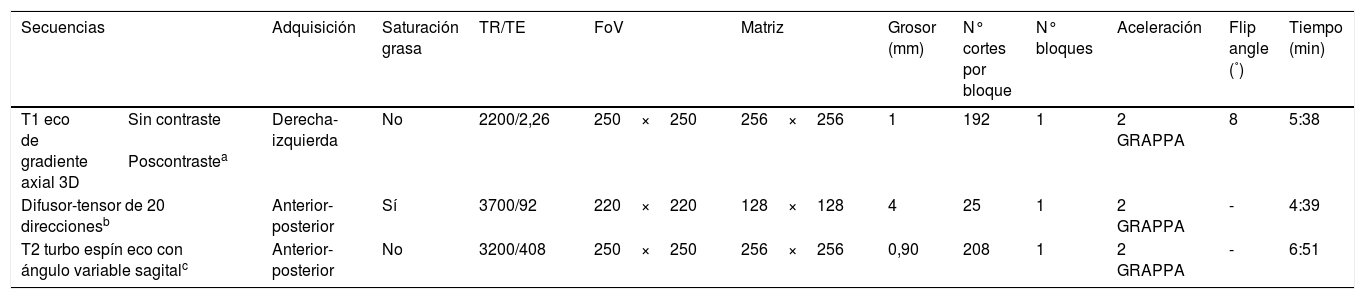
En cada procedimiento se usó un protocolo específico en función de la indicación quirúrgica (tabla 1). Para las secuencias con contraste se utilizó gadobutrol (Gadovist®, Bayer Schering Pharma AG, Berlin-Wedding, Alemania) a una dosis de 0,1ml/kg.
Secuencias empleadas en la RMio
| Secuencias | Adquisición | Saturación grasa | TR/TE | FoV | Matriz | Grosor (mm) | N° cortes por bloque | N° bloques | Aceleración | Flip angle (˚) | Tiempo (min) | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| T1 eco de gradiente axial 3D | Sin contraste Poscontrastea | Derecha-izquierda | No | 2200/2,26 | 250×250 | 256×256 | 1 | 192 | 1 | 2 GRAPPA | 8 | 5:38 |
| Difusor-tensor de 20 direccionesb | Anterior-posterior | Sí | 3700/92 | 220×220 | 128×128 | 4 | 25 | 1 | 2 GRAPPA | - | 4:39 | |
| T2 turbo espín eco con ángulo variable sagitalc | Anterior-posterior | No | 3200/408 | 250×250 | 256×256 | 0,90 | 208 | 1 | 2 GRAPPA | - | 6:51 | |
Los datos obtenidos se recopilaron en una base de datos (Excel; Microsoft, Redmond, WA, USA) y se procedió al análisis estadístico de los resultados (SPSS Statistics Base 20.0; Armonk, NY, Estados Unidos). Las variables continuas y categóricas se han expresado en medias±desviación típica y porcentaje, respectivamente.
ResultadosSe incluyeron 93 pacientes (49 hombres y 44 mujeres), con un rango de edad de 4-82 años (media: 51±17 años).
No se evidenciaron complicaciones posquirúrgicas inmediatas en ninguno de los casos.
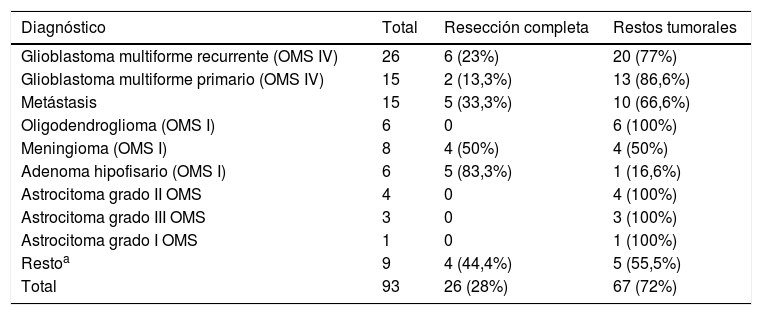
Las indicaciones quirúrgicas, así como la proporción de casos con restos tumorales, se muestran en la tabla 2. Se evidenció una resección completa en 26 pacientes (28%) y restos tumorales en 67 (72%).
Número total de casos y proporción de resecciones completas vs. restos tumorales
| Diagnóstico | Total | Resección completa | Restos tumorales |
|---|---|---|---|
| Glioblastoma multiforme recurrente (OMS IV) | 26 | 6 (23%) | 20 (77%) |
| Glioblastoma multiforme primario (OMS IV) | 15 | 2 (13,3%) | 13 (86,6%) |
| Metástasis | 15 | 5 (33,3%) | 10 (66,6%) |
| Oligodendroglioma (OMS I) | 6 | 0 | 6 (100%) |
| Meningioma (OMS I) | 8 | 4 (50%) | 4 (50%) |
| Adenoma hipofisario (OMS I) | 6 | 5 (83,3%) | 1 (16,6%) |
| Astrocitoma grado II OMS | 4 | 0 | 4 (100%) |
| Astrocitoma grado III OMS | 3 | 0 | 3 (100%) |
| Astrocitoma grado I OMS | 1 | 0 | 1 (100%) |
| Restoa | 9 | 4 (44,4%) | 5 (55,5%) |
| Total | 93 | 26 (28%) | 67 (72%) |
OMS: Organización Mundial de la Salud.
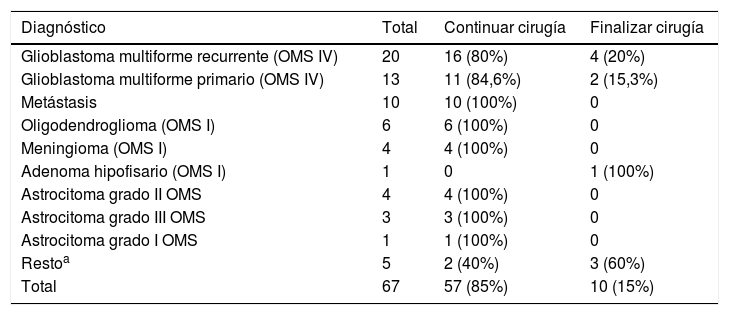
De los pacientes con restos tumorales, se decidió continuar la cirugía debido a este hallazgo en 57 (85%), y finalizarla en 10 (15%) (tabla 3).
Decisión terapéutica en los casos en que se encontraron restos tumorales
| Diagnóstico | Total | Continuar cirugía | Finalizar cirugía |
|---|---|---|---|
| Glioblastoma multiforme recurrente (OMS IV) | 20 | 16 (80%) | 4 (20%) |
| Glioblastoma multiforme primario (OMS IV) | 13 | 11 (84,6%) | 2 (15,3%) |
| Metástasis | 10 | 10 (100%) | 0 |
| Oligodendroglioma (OMS I) | 6 | 6 (100%) | 0 |
| Meningioma (OMS I) | 4 | 4 (100%) | 0 |
| Adenoma hipofisario (OMS I) | 1 | 0 | 1 (100%) |
| Astrocitoma grado II OMS | 4 | 4 (100%) | 0 |
| Astrocitoma grado III OMS | 3 | 3 (100%) | 0 |
| Astrocitoma grado I OMS | 1 | 1 (100%) | 0 |
| Restoa | 5 | 2 (40%) | 3 (60%) |
| Total | 67 | 57 (85%) | 10 (15%) |
OMS: Organización Mundial de la Salud.
La media del tiempo quirúrgico fue de 390±122 minutos, y en ningún caso se produjo ninguna incidencia por los efectos del alto campo magnético por material no compatible.
DiscusiónEn los 13 primeros meses tras la instalación de la RMio hemos realizado 93 estudios en patología tumoral con distintas indicaciones quirúrgicas, siendo las más frecuentes los glioblastomas multiformes primarios, los glioblastomas multiformes recidivados y las metástasis. En un 72% (67/93) de las RMio se hallaron restos tumorales. La RMio permitió a los neurocirujanos mejorar la extensión de la resección en un 85% de los casos (57/67).
En nuestro trabajo hemos hallado un alto porcentaje de restos tumorales en las RMio realizadas (72%); en los glioblastomas multiformes primarios un 86,6%, en los glioblastomas multiformes recidivados un 77%, y en el caso de las metástasis un 66,6%. También hemos observado que hasta en un 85% de las intervenciones se decidió volver a ampliar la resección, con porcentajes diferentes (80% de glioblastomas multiformes primarios y el 100% de las metástasis). En algunos de los casos en que se decidió finalizar la intervención tras los resultados de la RMio fue por haber sido una extirpación total o bien por encontrarse los restos en zonas elocuentes. En el estudio de Pamir et al.19 se hallaron restos tumorales en un 44,6% de las RMio en cirugías de extirpación de lesiones gliomatosas, continuando con la extirpación de la lesión en un 37,5% de los casos. Dichos resultados apoyan la idea de que si durante la realización de una RMio se aprecian restos de la lesión diana es necesario reanudar la cirugía y continuar con el procedimiento. Esto sugiere que, con la RMio, los cirujanos tienen una segunda oportunidad (second look) de continuar el procedimiento y realizar una resección más amplia y precisa, razón por la cual son más cautelosos al extirpar la lesión en un primer momento. Sin embargo, al ser menos agresivos en la resección, aumenta el número de resecciones incompletas.
En nuestra serie no se consiguió ninguna resección completa de los tumores de bajo grado de la Organización Mundial de la Salud en un primer tiempo quirúrgico, aunque esto también puede verse favorecido por el hecho de que en estos tumores los neurocirujanos no emplean ácido 5-aminolevulínico, que diferencia la tonalidad del tumor respecto al parénquima sano, y sí se emplea en los tumores de alto grado.
En el estudio realizado por Senft et al.12 se demostró que la RMio guía a una resección completa en el 96% de los casos, en comparación con el 68% en el grupo que fue intervenido con microcirugía convencional. En nuestra serie, de 15 glioblastomas multiformes primarios, 13 (86%) mostraron restos tumorales en la RMio. Sin embargo, con los hallazgos de la RMio los cirujanos modificaron la actitud de la cirugía en el 84% (11/13) de los casos. Los hallazgos de nuestra experiencia inicial indican que este tipo de estudios permite evaluar la resección tumoral de forma precisa y evaluar si se puede continuar la resección sin dañar zonas elocuentes.
Una de las consecuencias de la RMio descrita en la literatura es el incremento del tiempo de la cirugía, hecho ya señalado en el estudio de Chicoine et al.15, siendo el tiempo medio de las intervenciones de gliomas de 446 minutos. En la base de datos de más de 400 pacientes intervenidos entre los años 2008 y 2011 en nuestro centro (antes de la implantación de la RMio), la media de la duración de la cirugía es de 340 minutos, y en nuestro trabajo hallamos una media de 390±122 minutos, por lo que los estudios con RMio aumentan el tiempo quirúrgico en aproximadamente 50 minutos. La duración de las secuencias de RMio es de 15,45 minutos (en tumores de bajo grado, al no requerirse contraste paramagnético) y de 17,08 minutos (en tumores de alto grado), y la preparación, el traslado, la colocación del paciente y el retorno al quirófano suponen, aproximadamente, 30 minutos. Este es un hecho que debe tenerse en cuenta al implantar la RMio, aunque existe cierta curva de aprendizaje del personal y se espera que en futuros estudios los tiempos sean menores.
Nuestro trabajo presenta varias limitaciones. Se trata de un estudio retrospectivo con un número de exploraciones pequeño. En él solo tratamos de describir nuestra experiencia inicial con la implantación de una RMio de 3 T en procedimientos neuroquirúrgicos. Se necesitan más estudios estadísticos que analicen el impacto de esta técnica en la supervivencia o en el éxito quirúrgico.
También es necesaria una mayor experiencia para concretar si la RMio en tumores indiferenciados evita la RM de control en un plazo menor de 48 horas. Así como en los pacientes pediátricos se acepta con el fin de no repetir una anestesia general, en los adultos es un tema aún en discusión. En nuestro centro se están correlacionando los hallazgos de ambos estudios con el fin de establecer un protocolo definitivo.
En conclusión, la RMio con equipos de alto campo es una técnica novedosa y válida, que permite estudiar la resección tumoral de forma precisa y evaluar si se puede continuar la resección sin dañar zonas elocuentes. Aunque su empleo conlleva una prolongación del tiempo quirúrgico, este mejora con la curva de aprendizaje del personal.
Autoría- 1.
Responsables de la integridad del estudio: JZZ, AGB, ATB, PBL, PD, RGE y ST.
- 2.
Concepción del estudio: JZZ, AGB, ATB, PBL, PD, RGE y ST.
- 3.
Diseño del estudio: JZZ y AGB.
- 4.
Obtención de los datos: JZZ, AGB, ATB y PBL.
- 5.
Análisis e interpretación de los datos: JZZ, AGB y ATB.
- 6.
Tratamiento estadístico: JZZ, AGB y ATB.
- 7.
Búsqueda bibliográfica: JZZ y AGB.
- 8.
Redacción del trabajo: JZZ, AGB y ATB.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: JZZ, AGB, ATB, PBL, PD, RGE y ST.
- 10.
Aprobación de la versión final: JZZ, AGB, ATB, PBL, PD, RGE y ST.
Los autores declaran no tener ningún conflicto de intereses.