Valorar la utilidad en la resonancia magnética (RM) de mama de la difusión y el coeficiente de difusión aparente (CDA) para diferenciar entre lesiones benignas y malignas.
Material y métodosSe estudian prospectivamente 88 pacientes, de 31 a 79 años, con 94 lesiones (80 malignas y 14 benignas), que fueron remitidas para un estudio prequirúrgico de extensión local, y a las que se realizó una RM de mama con estudio dinámico tras administrar contraste intravenoso y secuencia de difusión, valorando su correspondiente CDA. Se correlacionan los resultados obtenidos en difusión con la anatomía patológica.
ResultadosEl valor medio del CDA de las lesiones malignas (1,12±0,25×10−3mm2/s) fue significativamente inferior (p<0,001) al de las benignas (1,61±0,52×10−3mm2/s). No se obtuvieron diferencias significativas entre los diferentes subtipos de carcinomas invasivos y tampoco entre el carcinoma intraductal y el invasivo (p>0,05). Con un valor CDA<0,95×10−3mm2/s como indicador de malignidad, la sensibilidad es del 52% y la especifidad es del 100%.
ConclusiónEn la RM de mama la difusión aporta información adicional en la caracterización de la benignidad y malignidad de las lesiones mejorando la especifidad de la técnica.
To evaluate the usefulness of diffusion-weighted MRI sequences and of the apparent diffusion coefficient (ADC) to differentiate between benign and malignant breast lesions.
Material and methodsWe prospectively studied 88 patients (aged 31 to 79 years) with 94 lesions (80 malignant and 14 benign) who were referred for preoperative local staging. All patients underwent dynamic MRI examination after intravenous contrast administration and a diffusion-weighted sequence with ADC calculation. The results obtained at diffusion-weighted imaging were correlated with those obtained at histological examination.
ResultsThe mean value of the ADC for malignant lesions (1.12±0.25×10−3mm2/s) was significantly lower (p<0.001) than for benign lesions (1.61±0.52×10−3mm2/s). No significant differences in ADC values were found between the different subtypes of invasive carcinomas or between intraductal carcinoma and invasive carcinoma (p>0.05). Using an ADC lower than 0.95×10−3mm2/s as a threshold for malignancy, the sensitivity is 52% and the specificity is 100%.
ConclusionDiffusion-weighted sequences provide additional information in breast MRI that is useful for differentiating between benign and malignant lesions, thus improving the specificity of the technique.
El cáncer de mama es el más frecuente entre las mujeres españolas, y supone la tercera parte de todos los cánceres en la mujer1.
La resonancia magnética (RM) en la valoración del cáncer de mama aporta una información adicional y diferente al resto de las técnicas diagnósticas tradicionales (mamografía y ecografía), a las cuales complementa pero no substituye2–5.
La RM de mama con contraste intravenoso valora básicamente la morfología y la cinética de captación, obteniendo en las lesiones malignas una buena sensibilidad (88–100%), pero con una menor especificidad (60–80%), debido a que lesiones benignas se pueden comportar como malignas, lo que conlleva falsos positivos2–5. Esta dificultad se intenta subsanar mediante la búsqueda de nuevas aplicaciones y secuencias de RM que puedan incrementar la especificidad, como podría ser la secuencia de difusión.
La difusión aporta información acerca del movimiento browniano aleatorio de las moléculas de agua libre en el espacio intersticial y a través de la membrana celular.
Los últimos avances tecnológicos en RM han permitido una expansión en la utilización de la difusión y su correspondiente coeficiente de difusión aparente (CDA) para el examen y diagnóstico de patología en diferentes órganos y sistemas del cuerpo (neurología, digestivo, ginecología)6,7.
Algunos autores han empezado ya a aplicarla en la RM de mama para intentar mejorar la caracterización de las lesiones incrementando la especificidad y fiabilidad de la técnica, demostrándose unos valores de CDA menores en los tumores malignos en comparación con los benignos8–16.
Nuestro objetivo con el presente trabajo es determinar la sensibilidad y especificidad de la difusión por RM de mama al correlacionar los datos obtenidos del CDA con el diagnóstico de la anatomía patológica, y valorar su posible utilidad para diferenciar entre lesiones benignas y malignas
Material y métodosDurante 2 años (de enero 2006 a enero del 2008) se ha realizado un trabajo prospectivo seleccionando 101 pacientes diagnosticadas de cáncer de mama o patología benigna por biopsia o citología previa, que fueron remitidas a nuestro centro para un estudio prequirúrgico de extensión local por RM.
A las 34 mujeres en edad fértil se realizó la RM en la segunda semana del ciclo, mientras que en las 10 menopáusicas que recibían tratamiento hormonal sustitutivo éste se suspendió momentáneamente los 15 días previos a la realización de la RM.
Los criterios de inclusión fueron: a) que las pacientes debían tener realizadas anteriormente las mamografías y/o ecografías y la citología y/o biopsia que confirmaran que se trataba de una neoplasia maligna o de una lesión benigna; b) lesiones de dudosa etiología visualizadas sólo por RM, al realizar el criterio de inclusión a; c) pacientes en que el tratamiento iba a ser tumorectomía o mastectomía para poder correlacionar los resultados de la RM con los de anatomía patológica.
El tiempo máximo transcurrido entre la citología y/o biopsia y la realización de la RM fue de 15 días.
Se excluyeron del estudio las pacientes que no reunieron los criterios de inclusión o bien tenían una contraindicación propia de la técnica de RM (marcapasos, clips vasculares, etc.).
Un total de 13 pacientes también fueron excluidas debido a que la exploración de RM fue de mala calidad por movimientos o artefactos en la difusión.
En las 88 pacientes en que la RM se pudo valorar satisfactoriamente desde el punto de vista de calidad de la imagen, se analizaron un total de 94 lesiones, de las cuales 71 fueron previamente analizadas histológicamente con una biopsia con aguja gruesa (BAG), 20 con punción aspiración con aguja fina (PAAF) y en 3 con colocación de un arpón localizador por RM (con posterior biopsia quirúrgica) ya que sólo eran visibles por esta técnica.
La difusión es un proceso que se puede cuantificar objetivamente mediante el CDA, que se calcula automáticamente determinando la proporción del desplazamiento cuadrado medio a lo largo de una dirección concreta en un tiempo determinado. En nuestro estudio se cuantifica el promedio de la difusión del agua en las 3 direcciones del espacio y su valor promedio se expresa en mm2/s.
Respecto al protocolo, la RM se realizó en una máquina de General Electric (GE) Signa Horizont 1,5T y con bobinas receptoras de superficie específicas de mama. Las secuencias utilizadas fueron:
- •
Secuencia 2D-difusión (valor b=700s/mm2 ) en plano axial.
- •
Secuencia 2D-FSE potenciada en T2 con supresión de la grasa en plano coronal.
- •
Secuencia 2D-SE potenciada en T1 en plano axial.
- •
Secuencia 3D-SPGR con supresión grasa pre y poscontraste intravenoso (gadolinio) con estudio dinámico (7 adquisiciones) en plano sagital.
La secuencia de difusión corresponde a EPI (spin echo-single shot echo planar image), con un valor b=700s/mm2, TR/TE: 5.000/61,8, matriz (128×128), FOV de 320×240mm, grosor corte de 5mm, con un intervalo de 1mm, NEX 5, tiempo de adquisición total de 110s, y no requiere administrar contraste intravenoso.
Posteriormente, las imágenes se trataron y estudiaron en una consola específica (Advantage Workstation 4.0 GE), obteniendo el valor numérico del CDA y su correspondiente mapa CDA (en escala de grises y de colores), así como la morfología y curva de captación de las secuencias dinámicas. El valor del CDA (en 10−3mm2/s) se obtuvo en una región de interés (ROI) de 10mm para el tejido glandular normal, y para la patología benigna o maligna se empleó una ROI de menor tamaño que la lesión (siempre<10mm) en 3 localizaciones diferentes y promediando los resultados. La ROI se colocó sobre el mapa CDA de color y debe evitarse la zona de necrosis o fibrosis, si es que existe, por lo que en este caso hay que situarlo en la zona donde se prevé que hay tejido tumoral sólido con más condensación celular y con captación de contraste más intensa, guiándose por las coordenadas de referencia que localizan la lesión en las imágenes de substracción tras administrar contraste intravenoso de forma dinámica.
Los valores combinados de CDA se compararon para lesiones benignas y malignas utilizando un análisis de la varianza (ANOVA), considerando diferencias estadísticamente significativas una p<0,05. El análisis de sensibilidad, especifidad y punto de corte se estableció mediante el modelo de curvas ROC (receiver operating characteristics).
El estudio estadístico y tratamiento de datos se realizaron mediante el software estadístico SPSS 11.0.
ResultadosSe estudiaron 88 pacientes con 94 lesiones, que tras el estudio histológico correspondieron a 14 benignas y 80 malignas.
La edad de las pacientes estaba comprendida entre 31 y 79 años (media, 57 años).
El tamaño anatomopatológico medio de las lesiones benignas fue de 2,6cm (1,2–8,2cm) y el de las malignas de 1,8cm (8–9cm). Sólo 2 de las lesiones malignas tuvieron un tamaño menor de 1cm (8 y 9mm, respectivamente), y otras 2 por debajo de 1,2cm.
Las benignas consistieron en 6 cambios fibroquísticos, 2 hiperplasias atípicas, 1 papiloma, y 5 fibroadenomas (figs. 1 y 2). Por otra parte, las malignas (figs. 3 y 4) incluyeron 65 carcinomas ductales infiltrantes (CDI), 10 carcinomas intraductales (CDIs), 4 carcinomas lobulillares invasivos y 1 carcinoma medular (tabla 1).
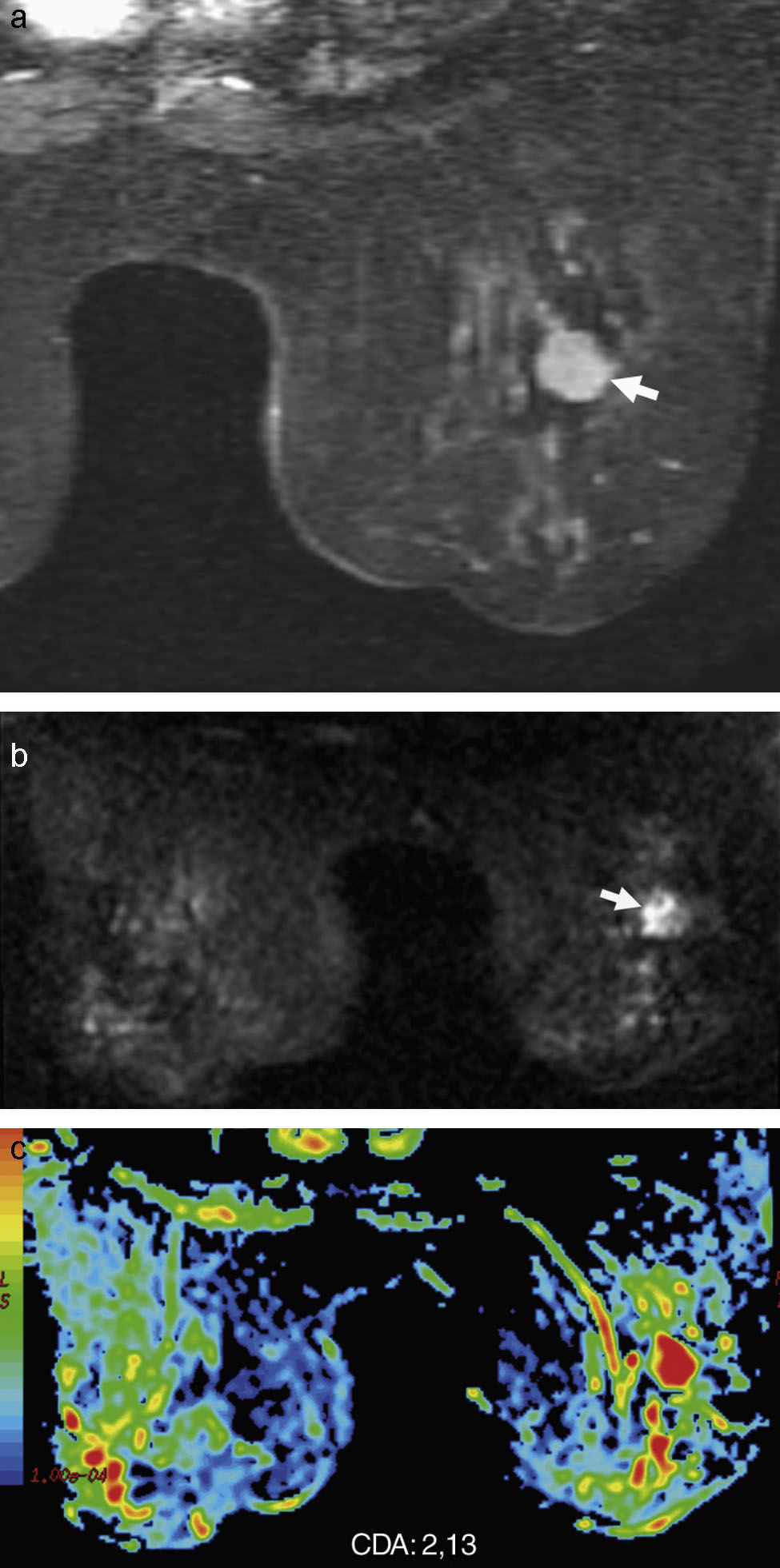
Estudio de resonancia magnética de mama con contraste dinámico en el plano axial (a), donde se visualiza en la mama derecha una tumoración sólida lobulada y bien delimitada (flechas blancas) que correspondió a un fibroadenoma, con curva de captación tipo 1 en forma de parábola. Imagen de difusión axial (b) con mapa en color (c) que demuestra la lesión, que tiene un valor medio del coeficiente de difusión aparente (CDA) de 2,13×10−3mm2/s.
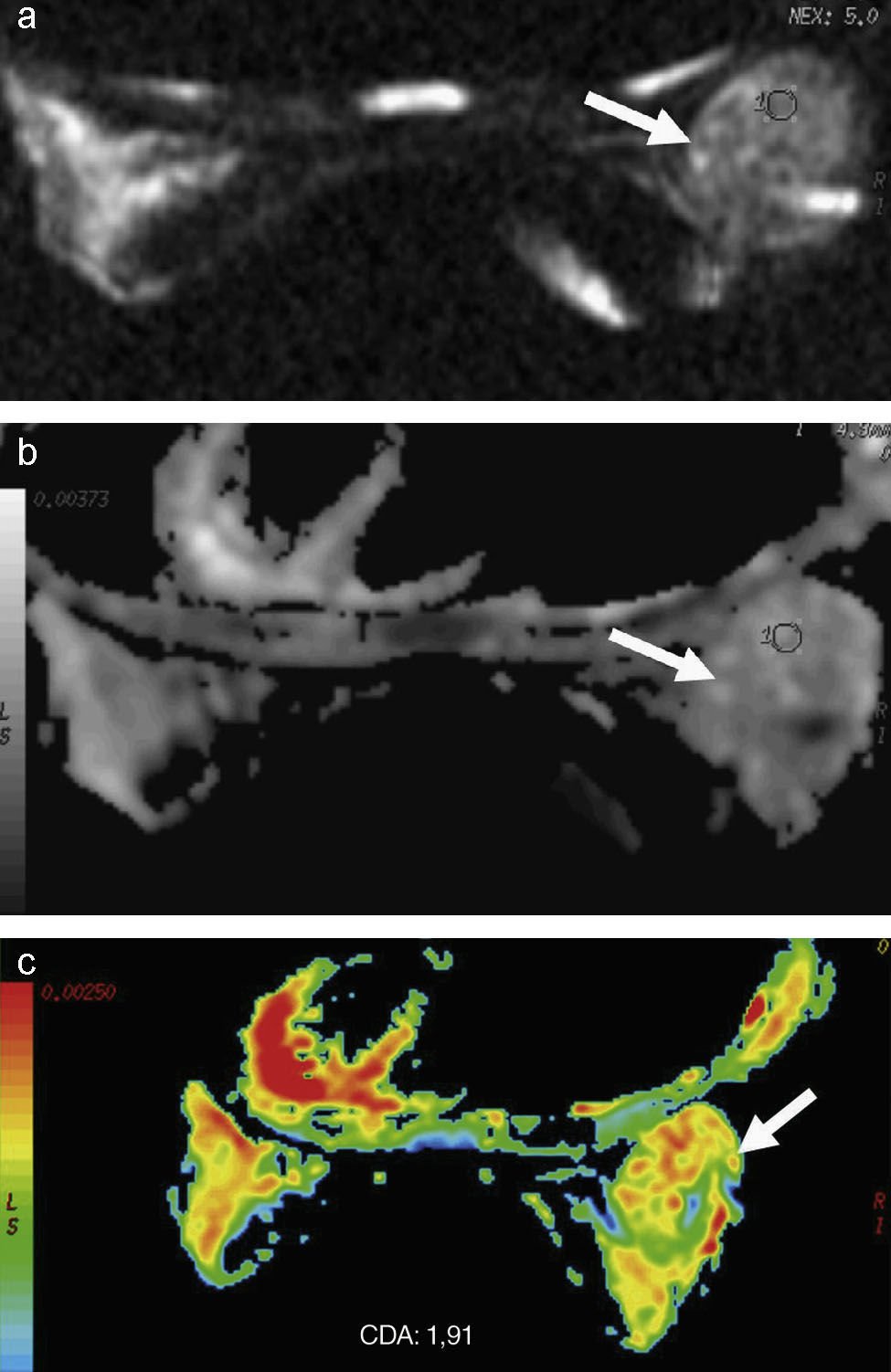
Estudio de resonancia magnética de mama con imagen axial de difusión (a), mapa del coeficiente de difusión aparente en escala de grises (b) y en color (c). Gran fibroadenoma en la mama derecha con un valor medio del coeficiente de difusión aparente (CDA) en la lesión de 1,91×10−3mm2/s.
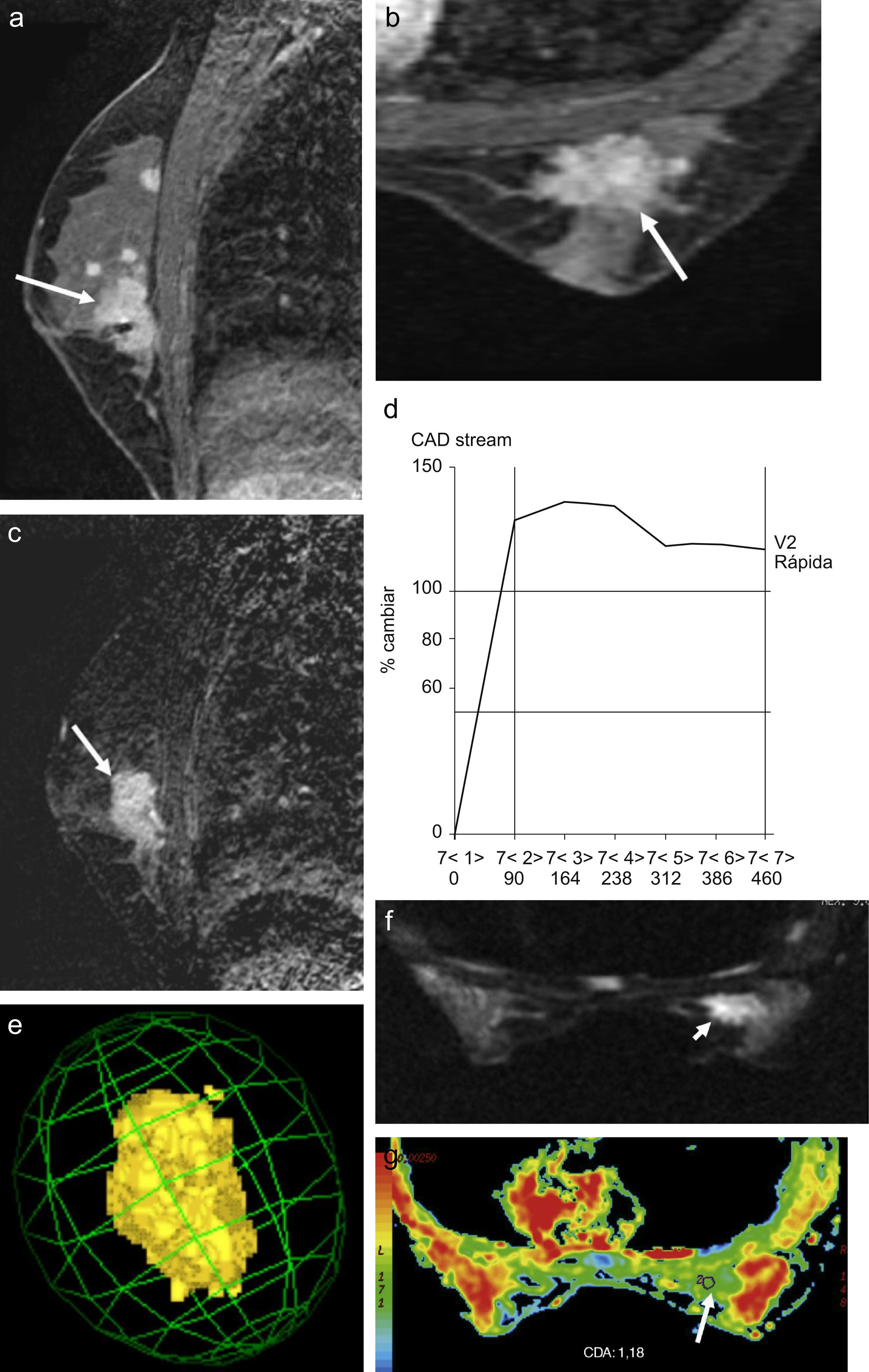
Estudio de resonancia magnética de mama con contraste dinámico en planos sagital (a) y axial (b) con sustracción sagital (c), donde se aprecia una tumoración maligna (carcinoma ductal infiltrante [CDI]) de morfología irregular y bordes irregulares y espiculados (flechas blancas), con múltiples focos multifocales y multicéntricos de CDI y carcinoma intraductal. Curva de captación tipo 3 (d) con imagen 3D (e) de la lesión mayor. Imagen de difusión axial (f) y mapa del coeficiente de difusión aparente (CDA) de color (g) donde las flechas blancas señalan la lesión. El valor medio del CDA de la lesión mayor fue de 1,18×10−3mm2/s.
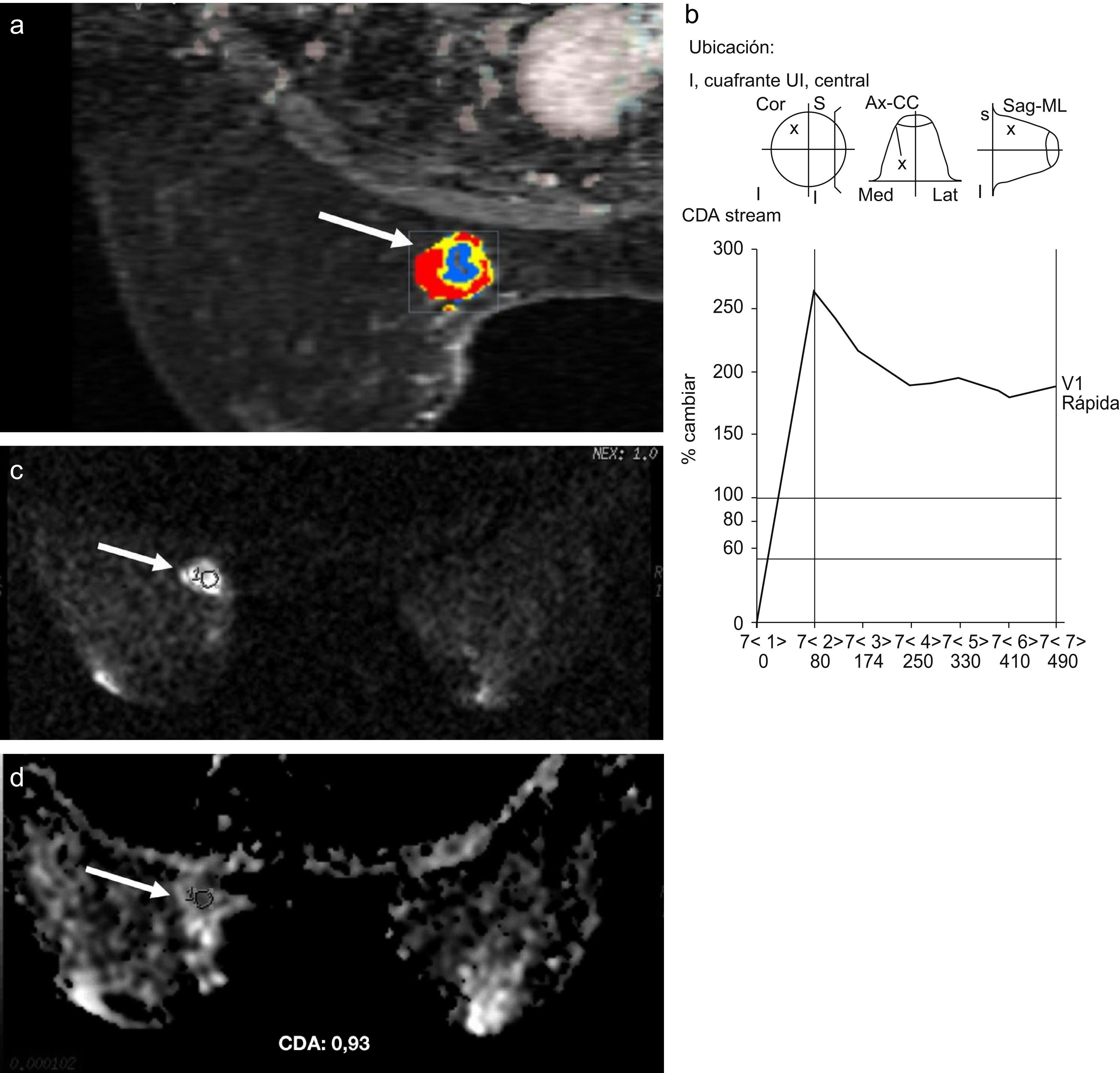
Estudio de resonancia magnética de mama con contraste dinámico en el plano axial en color (a), donde se aprecia en la mama izquierda una tumoración de morfología y bordes irregulares y con curva de captación tipo 3 (b), correspondiente a un carcinoma ductal infiltrante (flechas blancas). Imagen de difusión axial (c) y su correspondiente mapa del coeficiente de difusión aparente (CDA) en escala de grises (d) donde las flechas blancas señalan la lesión. El valor medio del CDA de la lesión fue de 0,93×10−3mm2/s.
Tipos de lesiones (n=94)
| Malignas (n=80) |
| CDI (n=65) |
| CDIs (n=10) |
| Carcinoma lobulillar infiltrante (n=4) |
| Carcinoma medular (n=1) |
| Benignas (n=14) |
| Fibroadenomas (n=5) |
| Mastopatías fibroquísticas (n=6) |
| Hiperplasias atípicas (n=2) |
| Papiloma intraductal (n=1) |
CDI: carcinomas ductales infiltrantes; CDIs: carcinomas intraductales.
El valor medio del CDA de las 80 lesiones malignas fue de 1,12±0,25×10−3mm2/s, mientras que el de las 14 benignas fue de 1,61±0,52×10−3mm2/s. El valor medio del CDA del tejido fibroglandular normal fue de 1,9±0,32×10−3mm2/s (tabla 2).
Valor medio del coeficiente de difusión aparente (CDA) en lesiones mamarias
| Valor medio del CDA (mm2/s) | |
| Lesiones benignas | 1,61±0,52×10−3 |
| Lesiones malignas | 1,12±0,25×10−3 |
| CDI | 1,11±0,23×10−3 |
| CDIs | 1,15±0,22×10−3 |
| Tejido fibroglandular | 1,9±0,32×10−3 |
CDI: carcinomas ductales infiltrantes; CDIs: carcinomas intraductales.
Se observó una diferencia estadísticamente significativa (p<0,001) entre tumores malignos, benignos y tejido fibroglandular normal, debido a que los tumores malignos mostraron un valor medio del CDA menor que las lesiones benignas y el tejido fibroglandular normal.
No hay diferencias significativas (p>0,05) del valor medio del CDA entre los diferentes subtipos de carcinomas invasivos.
Tampoco hay diferencias significativas (p>0,05) entre el valor medio del CDA del CDI (1,11±0,23×10−3mm2/s) y del CDIs (1,15±0,22×10−3mm2/s).
Realizando el corte como umbral indicador de malignidad en un valor medio máximo del CDA de 1,34×10−3mm2/s, se identificaban 72 lesiones malignas de 80, con lo cual la sensibilidad era del 90%. Pero también 5 de las 14 lesiones benignas se diagnosticaban erróneamente como malignas, con lo que la especifidad era del 64,2%. La fiabilidad (seguridad) era del 86%.
Las 5 lesiones benignas que se comportaban como malignas (falsos positivos) eran 4 cambios fibroquísticos y 1 papiloma intraductal.
Los 8 casos que eran la causa de falsos negativos correspondían a 4 CDI y 4 CDIs.
Con un valor medio de CDA<1,09×103mm2/s como indicador de malignidad, se obtenían unos resultados con una menor sensibilidad (73%) y con una mayor especifidad (77%). Sin embargo, si el corte o umbral de malignidad se realizaba en un valor medio del CDA de 0,95×10−3mm2/s, la sensibilidad era del 52% y la especifidad del 100%.
DiscusiónEn nuestro estudio la media del valor del CDA en la difusión de las lesiones malignas fue menor respecto a las lesiones benignas y son datos similares a los de otros autores8–11,13–16. Ello se debe a diversos factores y características anatomopatológicas ya conocidas, que pueden alterar la difusión del agua, como son la densidad celular, la estructura tumoral, los espacios extracelulares y los componentes titulares (edema, necrosis, fibrosis)13,16. Guo et al10 lo atribuyeron básicamente a que la densidad celular es inversamente proporcional al valor del CDA.
En nuestro trabajo no hay diferencias significativas entre los valores CDA del CDI y del CDIs, en contradicción con otros autores que sí las constatan, obteniendo en el CDI un valor menor que en el CDIs13,15,16.
Tampoco hemos encontrado diferencias estadísticamente significativas entre los diferentes subtipos de carcinoma invasivo, al igual que los resultados publicados por Kuroki et al15.
Al realizar el umbral o corte en un valor máximo del CDA de 1,34×10−3mm2/s como indicador de malignidad, el principal motivo del número elevado de falsos positivos y de la baja especifidad fueron los cambios fibroquísticos que debido al edema y la inflamación disminuyen la difusión y el CDA. Por otra parte, de los 8 casos falsos negativos, en 4 casos (2 CDI y 2 CDIs) el motivo parece estar en el pequeño tamaño tumoral (≤1,2cm), con lo cual no fueron detectados en la imagen debido a la limitada resolución espacial de la técnica. En otros 2 casos falsos negativos se trató de CDIs tipo comedocarcinoma en los que la hemorragia y la necrosis tumoral pueden producir un artefacto de susceptibilidad magnética local y un alto grado de oxidación, respectivamente, que posiblemente fueron la causa de una elevación del CDA. Los otros 2 casos falsos negativos fueron 2 CDI biopsiados previamente con BAG y con sangrado local posbiopsia, que sólo se visualizaba microscópicamente, pero en los que la hemorragia producía un artefacto de susceptibilidad magnética que impedía su correcta visualización en la difusión.
Por lo tanto, debe resaltarse que el pequeño tamaño de los tumores (en nuestro caso<1,2cm) y la presencia de hemorragia local intrínseca o extrínseca, aumentan la dificultad de detección e interpretación de las lesiones por difusión. Estos resultados coinciden con los de otros autores13,15.
La baja sensibilidad y alta especifidad obtenidas con un corte o umbral de 0,95×10−3mm2/s son datos interesantes y muy importantes que hay que tener en cuenta, pues la baja sensibilidad es poco relevante, ya que con la secuencia dinámica con contraste ya se obtiene una alta sensibilidad, y la difusión (con su CDA) debe servir para excluir posibles falsos positivos de los estudios dinámicos. Es decir, la difusión es un arma que tenemos para mejorar la especifidad de la RM de mama, y ésta depende del umbral de corte elegido14.
La difusión tiene el inconveniente de que, al emplearse secuencias EPI, hay artefactos de susceptibilidad magnética y de desplazamiento químico, que en parte se pueden subsanar con la utilización de secuencias en paralelo15, ya que son capaces de reducir el número de fases codificadas y, por lo tanto, disminuir el tiempo requerido para rellenar el espacio K.
Estos artefactos, junto con el movimiento, distorsionan la imagen y dificultan la información acerca de las características, localización y extensión de las lesiones.
Otro de los inconvenientes de las imágenes ponderadas en difusión es que tienen una baja resolución espacial, con lo cual lesiones de pequeño tamaño pueden no ser visualizadas. Esta dificultad también se puede solucionar con las secuencias en paralelo15.
La inyección del gadolinio antes de la secuencia de difusión es controvertida. La presencia de gadolinio produce un efecto T2* que teóricamente tendría que modificar el CDA incrementando ligeramente su valor. De todas maneras, el lavado de gadolinio es rápido, sobre todo en lesiones malignas y si se realiza la secuencia de difusión 15min tras su administración, la cantidad de gadolinio en los tejidos disminuye notablemente. Rubesova et al14 no obtuvieron diferencias significativas en el CDA en las lesiones estudiadas con difusión antes y después de inyectar gadolinio. En nuestro trabajo, la secuencia de difusión se ha realizado siempre antes del contraste intravenoso para evitar posibles interferencias.
Variaciones pequeñas (5%) en el CDA durante la fase final del ciclo menstrual han sido constatad as por otros autores17 y se deben al edema estromal, que puede disminuir el CDA. Para evitar al máximo la influencia hormonal, en mujeres fértiles se ha realizado la RM de mama en la segunda semana del ciclo y en las menopáusicas que recibían tratamiento hormonal sustitutivo éste se suspendió momentáneamente. De todas maneras, no se sabe si el CDA varía en los tumores durante el ciclo menstrual.
Una de las limitaciones del estudio que hemos efectuado es la desproporción entre el número de lesiones malignas y benignas, así como entre el CDI y otros tumores infiltrantes (carcinoma lobulillar y medular).
Como conclusión, nuestro estudio demuestra que la secuencia de difusión aporta información adicional acerca de la malignidad o benignidad de las lesiones (caracterización) mejorando su especificidad. En la mayoría de lesiones malignas la difusión es menor que en las benignas, y no hay diferencias significativas entre los diferentes subtipos de carcinoma invasivo y tampoco entre el carcinoma intraductal y el invasivo.
Se podría proponer añadir la secuencia de difusión de forma rutinaria en el protocolo RM de mama, sin que ello suponga un aumento significativo en el tiempo de exploración.
Declaración de conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónBeca SERAM Industria 2006.
AutoríaLos Dres. J. Barceló y J.C. Vilanova han contribuido en la concepción y diseño del estudio, en la obtención de datos, análisis e interpretación. También en la redacción del trabajo, revisión crítica y han hecho aportaciones intelectuales relevantes. Han dado su aprobación final a la versión que se envía para publicar.
Los Dres. J. Albanell, J. Ferrer, F. Castañer, N. Viejo y M. Argelaguet han contribuido en la obtención de datos y en su análisis e interpretación, así como realizando una revisión crítica y aportaciones intelectuales. Todos los autores han dado su aprobación final a la versión que se envía para publicar.










![Estudio de resonancia magnética de mama con contraste dinámico en planos sagital (a) y axial (b) con sustracción sagital (c), donde se aprecia una tumoración maligna (carcinoma ductal infiltrante [CDI]) de morfología irregular y bordes irregulares y espiculados (flechas blancas), con múltiples focos multifocales y multicéntricos de CDI y carcinoma intraductal. Curva de captación tipo 3 (d) con imagen 3D (e) de la lesión mayor. Imagen de difusión axial (f) y mapa del coeficiente de difusión aparente (CDA) de color (g) donde las flechas blancas señalan la lesión. El valor medio del CDA de la lesión mayor fue de 1,18×10−3mm2/s. Estudio de resonancia magnética de mama con contraste dinámico en planos sagital (a) y axial (b) con sustracción sagital (c), donde se aprecia una tumoración maligna (carcinoma ductal infiltrante [CDI]) de morfología irregular y bordes irregulares y espiculados (flechas blancas), con múltiples focos multifocales y multicéntricos de CDI y carcinoma intraductal. Curva de captación tipo 3 (d) con imagen 3D (e) de la lesión mayor. Imagen de difusión axial (f) y mapa del coeficiente de difusión aparente (CDA) de color (g) donde las flechas blancas señalan la lesión. El valor medio del CDA de la lesión mayor fue de 1,18×10−3mm2/s.](https://static.elsevier.es/multimedia/00338338/0000005100000005/v1_201305061339/S0033833809001167/v1_201305061339/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)


