La importancia del ictus y los avances en el tratamiento precoz y específico en los estudios de imagen han contribuido a la revolución diagnóstica y terapéutica del mismo. La TC multimodal (TC basal, TC de perfusión y TC-angiografía) está considerada como una técnica eficaz, rápida y disponible. Resulta clave para el diagnóstico precoz y para la selección de los pacientes que se beneficiarán del tratamiento trombolítico. La TC basal, sin contraste, es adecuada para descartar un origen hemorrágico o una lesión simuladora de ictus y para valorar la existencia de signos precoces. La TC de perfusión nos permitirá conocer la presencia y extensión de tejido isquémico infartado (no recuperable) y de tejido en riesgo o zona de penumbra (potencialmente recuperable), se pudiendo seleccionar así más apropiadamente los pacientes candidatos a tratamiento. Por último, la angio-TC permitirá valorar la circulación intra y extracraneal, conocer la alteración vascular que origina el cuadro y podrá servir de guía para el tratamiento (trombólisis intraarterial o mecánica).
Stroke results in significant morbidity and mortality. Recent years have seen a revolution in the diagnosis and treatment of stroke, with advances in diagnostic imaging and improvements in early and specific treatment. Multimodal CT (unenhanced CT, perfusion CT, and CT angiography) is widely available, fast, and efficacious, all of which give it a key role in the early diagnosis of stroke and in the selection of patients who will benefit from thrombolytic treatment. Unenhanced CT is useful for ruling out hemorrhage or lesions that simulate stroke and for evaluating the presence of early signs. Perfusion CT enables us to know the presence and extension of infarcted ischemic tissue (irrecoverable) and of penumbra (tissue at risk that is potentially recoverable), thus ensuring more appropriate selection of candidates for treatment. Finally, CT angiography makes it possible to evaluate the intra- and extra-cranial circulation, to know the vascular alteration that originated the stroke, and to guide treatment (intra-arterial or mechanical thrombolysis).
Se denomina «ictus» al síndrome clínico que cursa con un déficit neurológico, focal o global, de comienzo súbito y de causa isquémica (85%) o hemorrágica. Supone la tercera causa de muerte, la primera de invalidez permanente y su pronóstico dependerá de la rapidez en la evaluación, diagnóstico y tratamiento1,2.
La «isquemia» es una disminución del flujo sanguíneo cerebral hasta un nivel en el que la función cerebral se afecta de forma temporal o definitiva. Engloba zonas de infarto y de penumbra. El «infarto» es la zona de necrosis coagulativa secundaria a una isquemia severa (flujo menor de 10ml/min/100g) mantenida durante cierto tiempo (2-3 horas). La zona de «penumbra» es el área que rodea al infarto, con flujo cerebral disminuido hasta unos valores (15-20ml/min/100g) que permite su reversión a tejido normal. Si la oclusión vascular se mantiene, las zonas de penumbra se transformarán en infarto. Por ello, el tiempo es vital «time is brain» y el ictus ha pasado a considerarse una urgencia médica3.
Los avances experimentados en el tratamiento precoz (3-4,5 horas) y específico (trombolíticos) han conseguido una importante disminución de la morbimortalidad. Las técnicas de imagen, principalmente la TC, por su rapidez y disponibilidad, son clave para el diagnóstico precoz y para la selección de los pacientes que se beneficiarán del tratamiento. Los objetivos fundamentales en el diagnóstico son1–7:
- 1.
Descartar un origen hemorrágico o una lesión simuladora de ictus (tumor, malformación vascular) y valorar la existencia de signos precoces del ictus (TC basal).
- 2.
Conocer la presencia y extensión de tejido isquémico infartado (no recuperable) y de tejido en riesgo (potencialmente recuperable) o zona de penumbra (TC de perfusión).
- 3.
Identificar la alteración vascular que origina el cuadro (TC-angiografía) (fig. 1).
Debido a su amplia disponibilidad, rapidez de ejecución y eficacia, es el estudio radiológico de primera elección en pacientes con un déficit neurológico agudo. Nos permitirá:
- 1.
Diferenciar con gran precisión un ictus isquémico de otro hemorrágico.
- 2.
Diferenciar entre ictus y otras lesiones (neoplasias, malformaciones, colecciones subdurales) causantes del cuadro ictal.
- 3.
Detectar signos precoces de infarto, aunque su sensibilidad es baja en las 3 primeras horas (en torno a un 25%) y alcanza sólo un 50-60% entre las 3 y las 6 horas.
Los «signos precoces» se deben a hipoperfusión y edema citotóxico, que producen hipoatenuación del parénquima, con pérdida de la diferenciación entre la sustancia blanca y la sustancia gris. Entre ellos, destacan en el territorio de la arteria cerebral media (ACM):
- –
«Hipodensidad de ganglios basales» y/o del «parénquima cerebral».
- –
«Borramiento de los surcos de la convexidad».
- –
«Signo del ribete insular», secundario a la pérdida de diferenciación entre la cápsula externa/extrema y la corteza insular.
- –
«Signo de la arteria cerebral media hiperdensa», por la presencia de un trombo o émbolo intraarterial. Es un signo muy específico pero poco sensible (30%) y con falsos positivos (calcificación vascular, dolicoectasia, hematocrito alto).
La visualización de estos signos se asocia a un peor pronóstico, especialmente la hipodensidad cerebral precoz, altamente específica para isquemia irreversible, que probablemente conlleve una ventana terapéutica sobrepasada, un mayor volumen de tejido infartado, peor evolución clínica y mayor riesgo de transformación hemorrágica. No obstante, existe controversia sobre la relevancia de estos signos para la selección de pacientes, debido a su limitada sensibilidad y a la variabilidad en la interpretación, con un acuerdo interobservador bajo y un 20% de interpretaciones erróneas, y porque tampoco se ha demostrado que los pacientes con afectación extensa (hipodensidad mayor de un tercio del área silviana) tratados con fibrinolíticos tengan peor pronóstico que los no tratados. Por ello, en la actualidad, se considera que la única contraindicación absoluta para la fibrinolisis es la presencia de hemorragia intracraneal. Para reducir la variabilidad interobservador puede utilizarse la escala ASPECTS (Alberta-Stroke-Program-Early-CT-Score), que permite «cuantificar» la hipodensidad en 10 zonas del territorio de la ACM. Para incrementar la detección de signos precoces pueden utilizarse ventanas más estrechas y niveles variables (40/20-20/32), que permiten aumentar la sensibilidad, hasta el 70%, sin pérdida de especificidad3–7.
TC de perfusiónUtilidadLa terapia trombolítica del ictus agudo ha creado la necesidad de una técnica rápida y accesible para ayudar a «identificar la presencia y extensión de tejido cerebral potencialmente recuperable». Los pacientes que muestren exclusivamente tejido infartado (no recuperable), no se beneficiarán de la reperfusión y presentarán mayor riesgo de hemorragia. La presencia del área de «penumbra» ayudará a seleccionar más apropiadamente a los pacientes candidatos al tratamiento.
Se han usado múltiples técnicas de imagen para evaluar la perfusión cerebral (PET, SPECT, Xenon-TC, RM de perfusión), pero están limitadas por su disponibilidad, coste, consumo de tiempo y/o tolerancia por el paciente. Con la progresiva implantación de equipos de TC multidetector (TCMD) es posible realizar con gran rapidez (5 minutos) estudios de perfusión con TC, que permiten confirmar el diagnóstico de sospecha, distinguir entre áreas de infarto y penumbra, y obtener información cualitativa y cuantitativa del estado hemodinámico del parénquima con mapas de «tiempo de tránsito, flujo y volumen».
La TC de perfusión sería aún más imprescindible en pacientes con dudas diagnósticas, pacientes que han sobrepasado la ventana terapéutica y aquellos en los que no se puede establecer el tiempo de inicio del evento.
TécnicaLos estudios de perfusión con TC pueden realizarse mediante dos métodos:
- –
«Infusión lenta o cerebral completa»: consiste en un estudio de TC-angiografía con contraste intravenoso (CIV), que abarca todo el cráneo. Valora los vasos y el parénquima en la misma hélice, pero no aporta información sobre el tiempo de tránsito ni el flujo sanguíneo, parámetros relevantes en el estudio de la isquemia cerebral, por lo que apenas se utiliza.
- –
«Técnica de primer paso»: la más utilizada, que se obtiene a partir de cortes rápidos seriados (cine) sobre una misma zona, adquiridos tras la administración de CIV a flujo alto (4-6 cc/s). Ofrece información temporal del paso del contraste a través de la red capilar y «permite calcular mapas hemodinámicos cuantitativos» en los que participa el factor tiempo, como los derivados del flujo sanguíneo cerebral y el tiempo de tránsito medio. Sus principales inconvenientes son que los mapas están limitados a un grosor de corte (2-8cm, según el equipo disponible) y que no se obtienen de forma simultánea a la TC-angiografía, lo que incrementa «muy discretamente» el tiempo de estudio, la dosis de contraste y la radiación administrada (minimizada al disminuir el miliamperaje y kilovoltaje)1,2,5 (fig. 1).
Entre los parámetros a valorar están3–8:
- –
«Tiempo hasta el pico (TP)», tiempo en el que se consigue la concentración máxima de contraste en la zona de interés.
- –
«Tiempo de tránsito medio (TTM)», que indica la diferencia de tiempo entre la entrada arterial y la salida venosa. Es el más sensible en los estadios precoces.
- –
«Flujo sanguíneo cerebral (FSC)», que es el volumen de flujo sanguíneo por unidad de tiempo (normal = 50-60ml/min/100g).
- –
«Volumen sanguíneo cerebral (VSC)», que indica el volumen de sangre por unidad de masa cerebral (normal = 4-6ml/100g). Flujo y volumen son los parámetros más específicos. La relación entre ellos es: «FSC = VSC/TTM».
La diferencia entre infarto y penumbra se basa en el concepto de autorregulación vascular cerebral. La autorregulación está perdida en el área infartada, por lo que el FSC y el VSC estarán muy disminuidos. En el área de penumbra, por el contrario, la autorregulación estará preservada, el TTM aumentado y el FSC disminuido, pero el VSC puede estar conservado, o incluso aumentado, como consecuencia de la vasodilatación y las aportaciones de los vasos colaterales.
De forma práctica, lo más sencillo es realizar primero la valoración del TTM o del TP, según el equipo disponible. Si está alterado (aumentado), se revisa el mapa de flujo, que estará disminuido en la isquemia. A continuación, se valorará el mapa de volumen, que predice el área de infarto (si está muy disminuido será infarto y si es normal o aumentado corresponderá a penumbra). En la práctica habitual, el simple análisis visual puede, a pesar de sus limitaciones, considerarse suficiente y la valoración del «mapa resumen» o «mapa pronóstico» demostrará la presencia de «mismatch» o «desajuste», positivo cuando el área cerebral alterada en el mapa de TTM o FSC sea al menos un 20% superior a la identificada en los mapas de VSC; será entonces cuando el paciente se beneficie del tratamiento (figs. 2, 3 y 4) (tabla 1). En el accidente isquémico transitorio se prolonga el TTM, pero el FSC estará preservado.
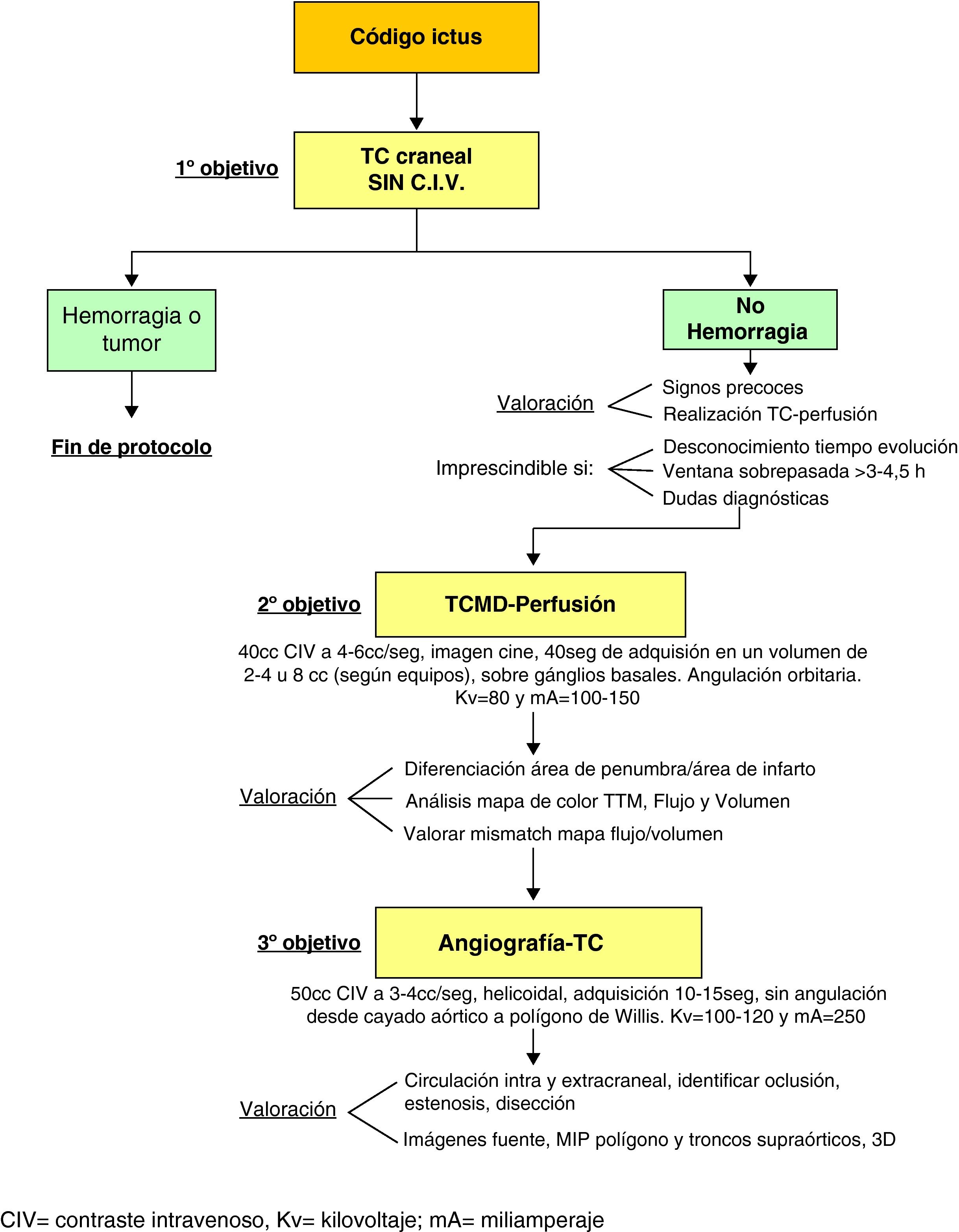
Paciente de 77 años que de forma brusca presenta afasia global y hemiplejia derecha. Imagen de la TC basal axial sin CIV (a) interpretado como normal. La angiografía-TC del polígono de Willis con reconstrucciones MIP axial y coronal (b y c) muestra una oclusión de la ACM izquierda en el segmento M1. En los mapas TC-perfusión de TTM (e), flujo (f) y volumen (g) se identifica una amplia área del territorio de la ACM izquierda afectada que presenta un aumento del TTM (zona azul en e) y una disminución del flujo (zona azul oscuro en f). El mapa de volumen (g) identifica en azul una zona de volumen disminuido de menor tamaño que las anteriores que corresponde al área de infarto, el resto del área afectada en los mapas de TTM y flujo tiene un volumen normal o aumentado (penumbra). El mapa de resumen (h) solapa la zona de alteración del TTM y el volumen, mostrando en rojo el infarto y en verde la penumbra, facilita la identificación de ambas áreas y el porcentaje que representan. En este paciente hay discordancia positiva existiendo una zona de penumbra amplia con respecto al área infartada. Se indicó tratamiento fibrinolítico. La imagen (d) es la TC de control post-fibrinolisis a las 24 horas donde se observa el área de infarto fronto-insular izquierdo.
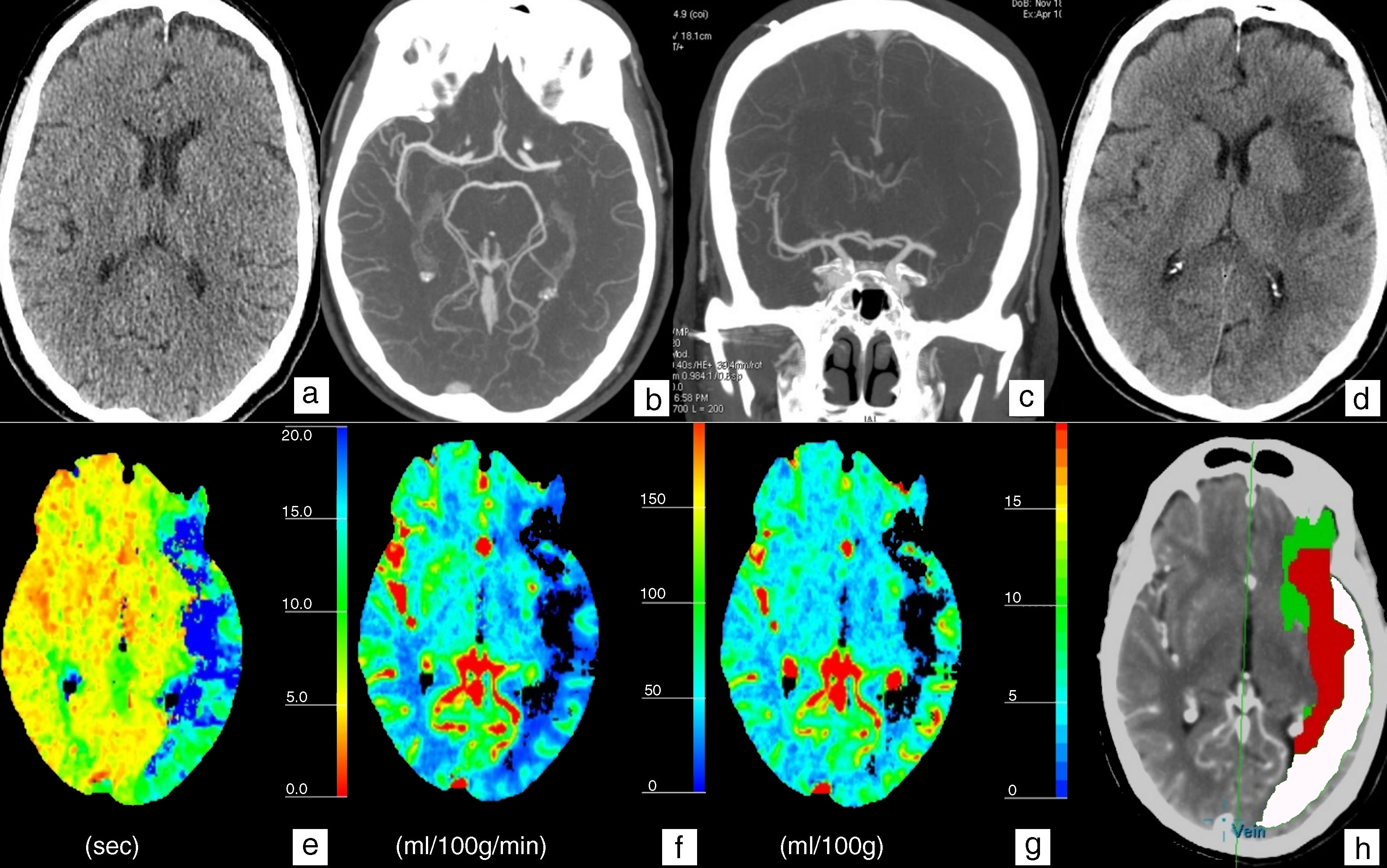
Paciente de 63 años que se despierta con disminución del nivel de conciencia, sin poder precisar tiempo de evolución. Las imágenes (a, b y c) muestran el signo de la ACM izquierda hiperdensa, hipodensidad en el territorio silviano, borramiento de surcos y pérdida de diferenciación entre sustancia blanca y sustancia gris. La imagen axial de angio-TC (d), confirma los hallazgos y además muestra asimetría de vascularización, que parece ausente en ese territorio. El mapa de TTM (e) muestra en azul y negro áreas con tiempo muy elevado; el mapa de flujo (f) presenta en azul zonas de flujo disminuido; el mapa de volumen (g) muestra áreas azules de volumen disminuido, que sugieren infarto. El mapa resumen (h) muestra en rojo el área infartada y en verde la de penumbra, que en este caso es inferior al 20% del área isquémica, que contraindica el tratamiento fribrinolítico.
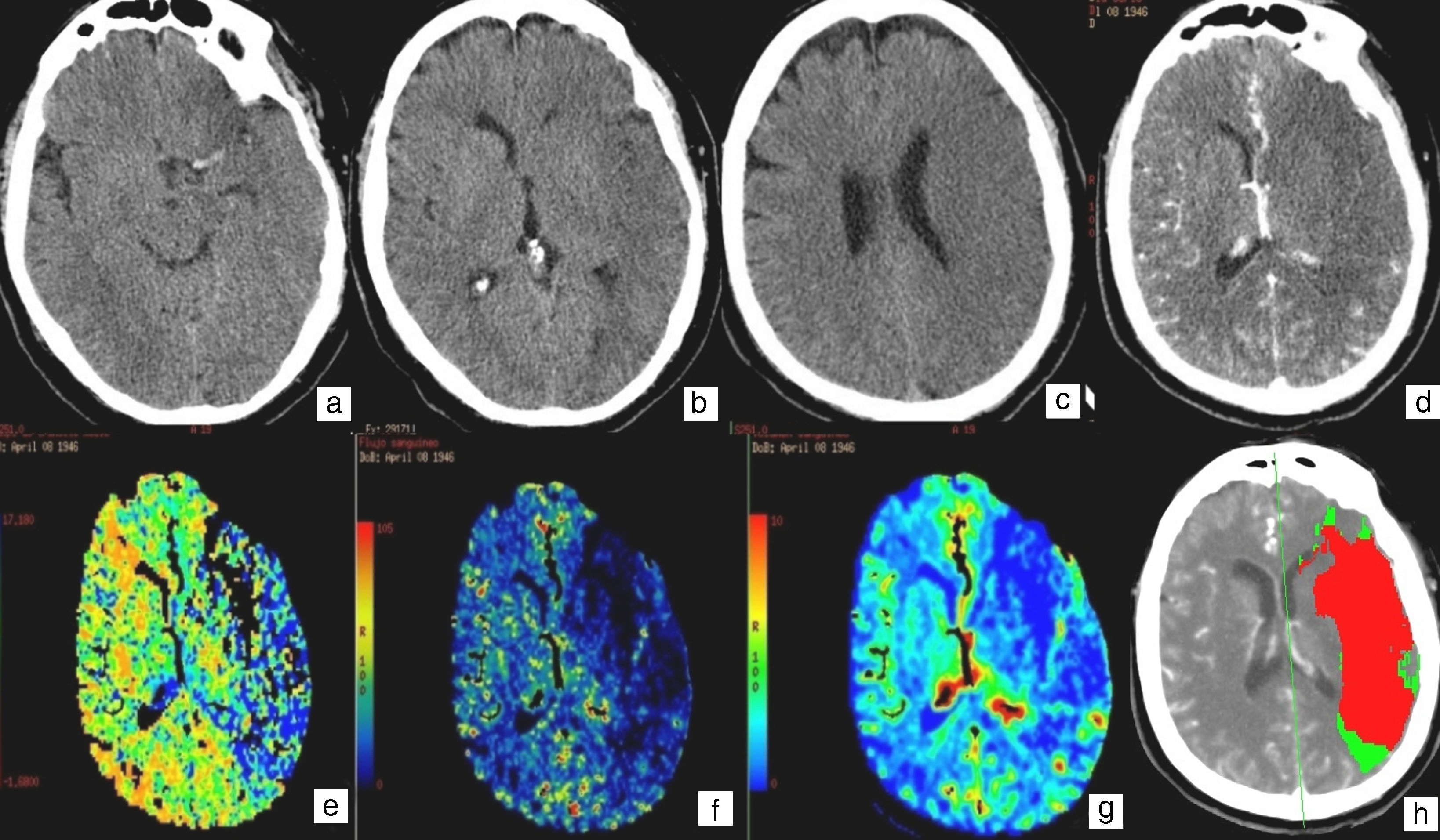
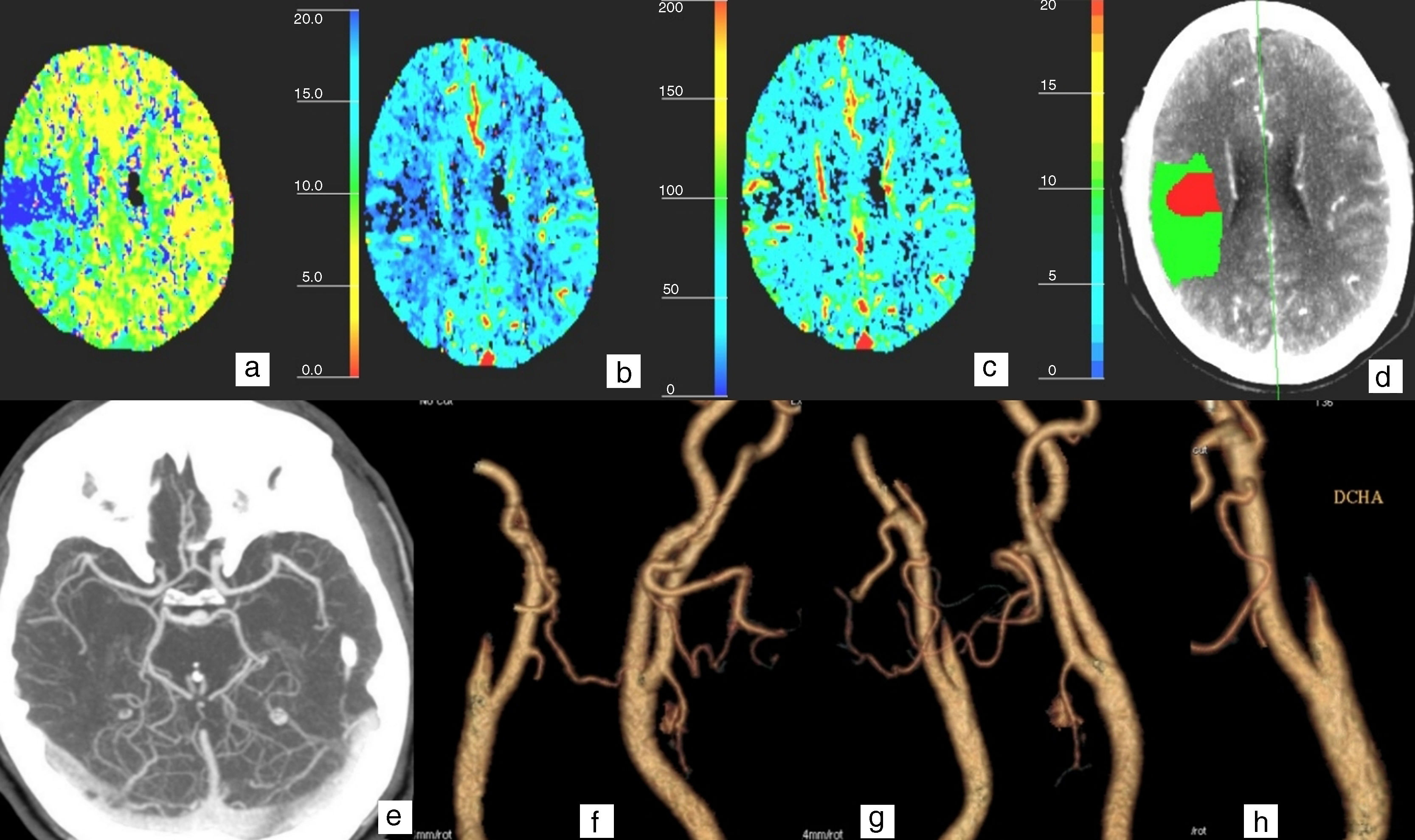
Paciente de 62 años que comienza de forma brusca con debilidad y adormecimiento de extremidad superior izquierda y afasia. En los mapas hemodinámicos de la TC-perfusión se identifica una lesión isquémica córtico-subcortical que afecta a los giros pre y posrolándicos derechos, con un aumento del TTM (a), una disminución del flujo (b) y un volumen conservado (c) en 2/3 del mismo, como se demuestra en el mapa resumen (d), donde se observa en rojo el área de infarto y en verde la de penumbra que representa 2/3 del área de isquemia. En la angiografía-TC se aprecia en las reconstrucciones 3D (f, g y h) una oclusión de la arteria carótida interna derecha y en la imagen axial con reconstrucción MIP del polígono de Willis(e) una permeabilidad de la ACM derecha debido a la circulación colateral establecida desde el territorio vascular izquierdo, pero con discreta disminución de su calibre con respecto a la contralateral. No se realizó tratamiento fribrinolítico por falta de consentimiento.
Análisis de TC-perfusión en ictus isquémico agudo
| Entidad | Mapa de TTM | Mapa de flujo-FSC | Mapa de volumen-VSC |
|---|---|---|---|
| Penumbra | Elevado | Disminuido | Normal o ligeramente aumentado |
| Infarto | Elevado | Marcadamente disminuido | Marcadamente disminuido (< 2 ml/100 g) |
FSC: flujo sanguíneo cerebral; TTM: tiempo de tránsito medio; VSC: volumen sanguíneo cerebral.
Las principales limitaciones se plantean en relación a:
- –
La reproducibilidad de la técnica que resultaba inicialmente dudosa para algunos investigadores. Actualmente, se considera que los hallazgos postproceso son claramente reproducibles entre radiólogos.
- –
La seguridad diagnóstica, ya que los resultados de la TC de perfusión aún no están totalmente estandarizados. Así, la trombólisis se puede realizar aunque el estudio de perfusión sea normal o con penumbra pequeña (inferior al 20%) o ausente, pues puede que esos focos isquémicos sean significativos clínicamente, aunque resulten demasiado pequeños para la capacidad de resolución de la TC de perfusión.
- –
La limitación de la cobertura anatómica a 2-8cm (que será completa con equipos de 256 detectores) desacredita su validez para infartos de la circulación posterior.
Sin embargo y a pesar de todas estas controversias, estudios recientes demuestran que la TC de perfusión es muy sensible en la detección precoz de la isquemia cerebral y es capaz de ofrecer una aproximación a la extensión del «tejido en penumbra» de forma similar a la RM, aunque esta pueda resultar superior en isquemias lacunares, infartos de la fosa posterior y en pacientes jóvenes9–11.
Angio-TCLa angiografía mediante TC cumple con el tercer objetivo en el diagnóstico del ictus3–7,12–14:
- –
«Valoración de la circulación intra y extracraneal», es decir, determinación del lugar de oclusión vascular, existencia de trombo o disección, grado de colateralidad y presencia y graduación de la enfermedad ateroesclerótica. Es altamente específica (98%), sensible (98,4%) y exacta (99%) para la detección de estenosis o trombos intracraneales proximales en pacientes con ictus, aunque resulta más limitada en oclusiones distales. En la enfermedad carotídea presenta una sensibilidad y especificidad del 85 y 93% respectivamente, que ascienden al 97 y 99% para oclusiones vasculares completas.
- –
«Guía para un tratamiento adecuado»: la trombolisis intraarterial o mecánica puede ser más eficaz que la terapia intravenosa en pacientes con ictus agudo y un trombo en la carótida o en ramas proximales de la ACM. La visualización del mapa vascular puede ser de interés para la actuación del neurorradiólogo intervencionista. La correlación entre la angio-TC y los parámetros clínicos es buena para localizar las oclusiones vasculares.
Los autores declaran no tener ningún conflicto de intereses.
Queremos demostrar nuestro más sincero agradecimiento a la Dra. Olivia Rodríguez por la iconografía mostrada.