La transposición congénitamente corregida de grandes arterias (TGAcc) implica una doble discordancia: atrio-ventricular y ventriculo-arterial. Presentamos las imágenes de resonancia magnética cardíaca de una paciente de 9 años con TGAcc, comunicación interventricular y coartación de aorta, a quien se le realizó cerclaje pulmonar, corrección de la coartación y posterior “doble switch”. Se realiza una revisión de la patología y de las complicaciones a evaluar tras la intervención quirúrgica.
Congenitally corrected transposition of the great vessels implies double discordance: atrioventricular and ventriculoarterial. We present cardiac magnetic resonance images from a 9-year-old girl with congenitally corrected transposition of the great vessels, interventricular communication, and coarctation of the aorta who was treated with pulmonary artery banding, correction of coarctation, and posterior double switch. We also review the disease and the complications that should be evaluated after the surgical intervention.
La transposición congénitamente corregida de grandes arterias (TGAcc), inversión ventricular o L-transposición (L-loop) implica una doble discordancia: auriculoventricular (aurícula derecha conectando con el ventrículo izquierdo a través de la válvula mitral y la aurícula izquierda con el ventrículo derecho a través de la válvula tricúspide) y ventriculoarterial (salida de la aorta anterior e izquierda desde el ventrículo derecho y la arteria pulmonar emergiendo posterior y derecha desde el ventrículo izquierdo)1.
Presentamos las imágenes de resonancia magnética (RM) cardíaca de una paciente de 9 años con TGAcc, comunicación interventricular (CIV) y coartación de aorta, a quien se le realizó cerclaje pulmonar, corrección de la coartación y posterior “doble switch” (figs. 1 y 2). El estudio fue realizado en un equipo Panorama 1.0T (Philips Medical Systems) y se adquirieron secuencias habituales de cine (sangre blanca SSFP) para valoración funcional, sangre negra para la evaluación anatómica, secuencias de cuantificación de flujo en contraste de fase (PC) 2D, angio-RM con gadolinio [Dotarem® 0,5 mmol/ml (ácido gadotérico), 0,2ml/kg] y secuencias de doble inversión-recuperación en la valoración de realce tardío de gadolinio. El posprocesado se realizó con software en consola auxiliar Diagreso®, Philips Intellispace. En este trabajo realizamos una revisión de la patología y de las complicaciones que se han de evaluar tras su corrección.
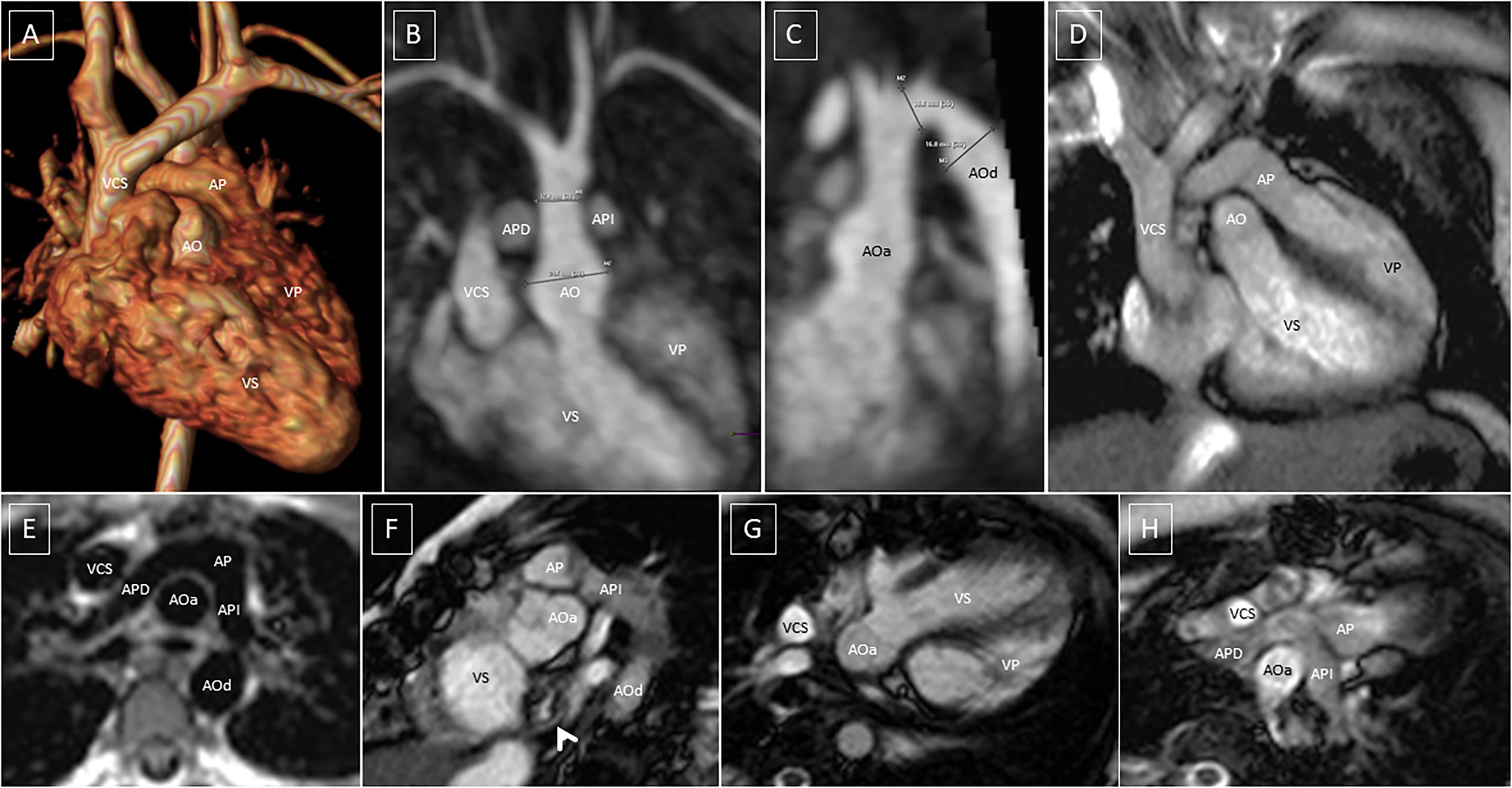
Cambios posquirúrgicos en grandes vasos después del “switch” arterial+Lecompte. Aorta ascendente posterior. Las arterias pulmonares abrazan la aorta ascendente suprasinusal. A) Angio-RM torácica, reconstrucción 3D, visión anterior. B) Proyección de máxima intensidad (MIP) coronal oblicuo. Dilatación sinusal de aorta ascendente. Arterias pulmonares a los lados. C) MIP sagital oblicuo. Dilatación sinusal. Aneurisma fusiforme poscirugía de coartación. D) EG eje largo 3C. Relación de grandes vasos con tractos de salida. E) SE axial sangre negra. Imagen típica de arterias pulmonares y aorta ascendente. F) EG eje corto. Relación entre aorta ascendente-tracto de salida sistémico y arteria pulmonar. Estenosis en parche auricular sistémico (flecha). G y H) EG 4C, tracto de salida del ventrículo izquierdo (sistémico) y tracto de salida del ventrículo derecho (pulmonar).
AO: aorta; AOa: aorta ascendente; AOd: aorta descendente; AP: arteria pulmonar; APD: arteria pulmonar derecha; API: arteria pulmonar izquierda; VCS: vena cava superior; VP: ventrículo pulmonar; VS: ventrículo sistémico.
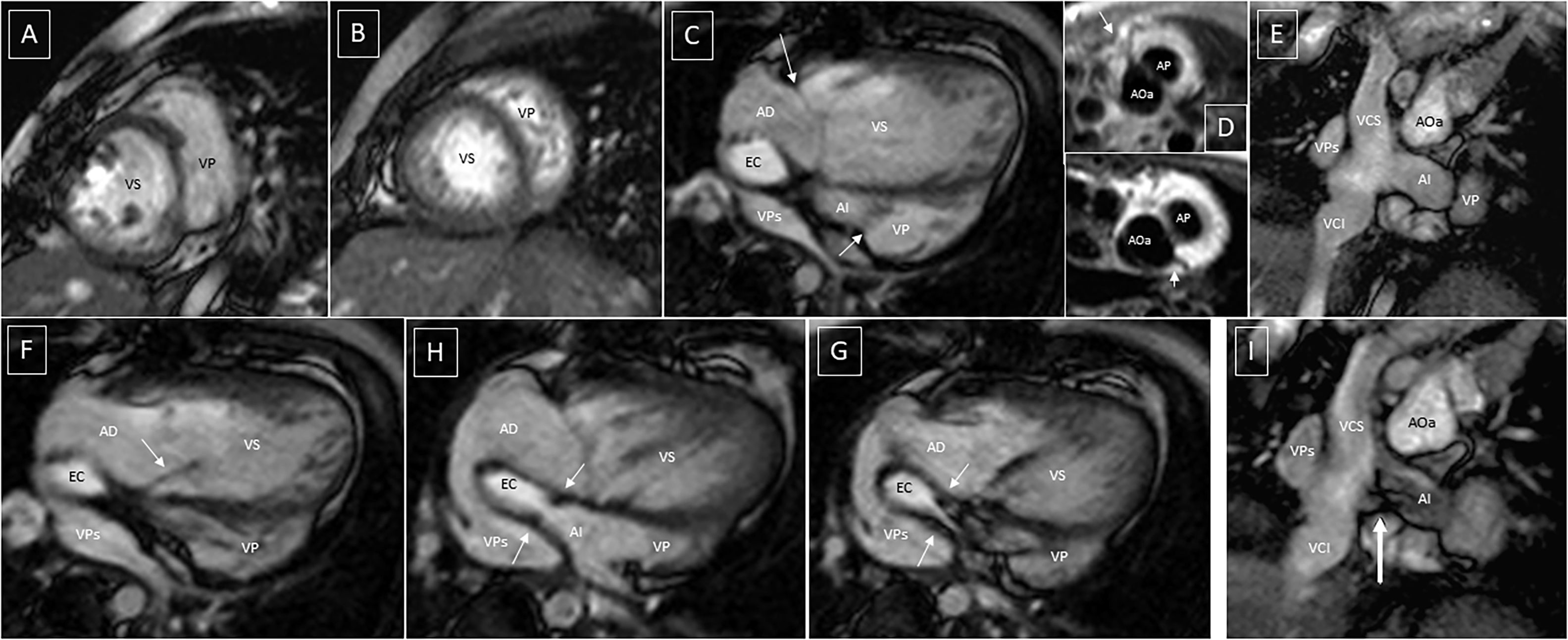
Cambios posquirúrgicos en aurículas y venas cava después del “switch” auricular. A y B) EG eje corto, anomalía de compactación de ventrículo izquierdo, segmento medio y apical. C, F, G y H) EG 4C. E e I) EG coronal oblicuo. Disposición típica del “baffle” auricular. Desplazamiento apical de VT en C (flechas). Insuficiencia valvular AV sistémica en F (flecha). Rodete estenótico del “baffle” con aceleración del flujo en G y H (flechas). Morfología del “baffle” unión de venas cava en E e I. Aceleración de flujo en anastomosis del “baffle” en I (flecha). D) SE sangre negra axial. Arteria coronaria derecha y ADA (arriba); circunfleja (abajo). AD: aurícula derecha; AI: aurícula izquierda; EC: eje de cavas; VCI: vena cava inferior; VPs: venas pulmonares.
La TGAcc tiene una prevalencia estimada de 0,04/1.000 adultos1. Se debe a un giro hacia la izquierda (L-loop) del tubo cardíaco durante la embriogénesis, con el resultado del ventrículo morfológicamente izquierdo posicionado a la derecha2. Puede ocurrir de forma aislada o combinada con otras anomalías cardíacas: CIV (perimembranosa 80%)2, estenosis pulmonar y enfermedad tricuspídea1. La aorta se soporta por un infundíbulo muscular y no existe continuidad con la válvula auriculoventricular a dicho nivel. Por el contrario, existe continuidad mitropulmonar y un cono subaórtico que separa la tricúspide de la aorta. Los tractos de salida muestran una disposición paralela con el anillo pulmonar sobre el septo interventricular, lo que puede condicionar una obstrucción del tracto de salida del ventrículo morfológicamente izquierdo (40%)2. Es frecuente la presencia de válvula tricúspide displásica, con o sin desplazamiento apical de velo septal, que causa incompetencia valvular (30%)1,2.
Entre otras anomalías más complejas que pueden acompañarla se incluyen: atresia mitral/tricuspídea, drenaje venoso pulmonar y/o sistémico anómalos, alteración de situs auricular/abdominal y la existencia de ventrículo único1,2.
Aunque la ecocardiografía representa la primera prueba diagnóstica, la RM cardíaca es de elección cuando la ventana ecográfica es subóptima y en la valoración posquirúrgica. Las técnicas de reparación de la TGAcc se encuentran representadas por:
1. Corrección anatómica o “doble switch” (caso presentado por nuestro grupo). De mayor complejidad y, por tanto, poco utilizada en la práctica clínica diaria. En esta técnica se pretende restablecer el ventrículo morfológicamente izquierdo como sistémico. Para ello se redirecciona el flujo intraauricular mediante técnica de Mustard-Senning y además se realiza un “switch” arterial con intercambio de grandes arterias, translocación de arterias coronarias, anteposición de arterias pulmonares por delante de la aorta (operación de Jatene)2 y cierre de CIV con parche. Para poder realizar la corrección anatómica, el ventrículo morfológicamente izquierdo tiene que soportar la presión sistémica. Si esto no fuese posible, se deberá acondicionar previamente el ventrículo izquierdo manteniendo presiones elevadas tras “banding” pulmonar1,2.
2. Reparación fisiológica, en donde el ventrículo derecho soportará la presión sistémica y únicamente se corrige la patología asociada tipo CIV1.
3. Operación de Rastelli, cuando coexisten estenosis pulmonar compleja y CIV tunelizable a la aorta, que consiste en el cierre de la CIV con parche “en teja” para redireccionar el flujo del ventrículo izquierdo a la aorta, e implante de conducto protésico entre el ventrículo derecho y la arteria pulmonar2.
Es importante conocer las técnicas quirúrgicas realizadas para saber qué tipo de complicaciones debemos tener en cuenta durante el seguimiento. La RM cardíaca nos permite estudiar los cambios posquirúrgicos en un único estudio y procedimiento anestésico del paciente. Además, es capaz de definir las complicaciones tanto cardíacas como extracardíacas, que en la mayoría de los casos escapan a la capacidad diagnóstica de la ecografía transtorácica, y se convierte en una técnica imprescindible para un seguimiento adecuado. Por tanto, en el estudio mediante RM cardíaca, en la corrección anatómica tipo “doble switch” deberemos:
- •
A nivel del Mustard-Senning: descartar estenosis de canal de la vena cava superior (la más frecuente) e inferior, principalmente mediante secuencias de cine SSFP, con cortes coronales a nivel de plano bicava y plano 4 cámaras, así como angio-RM en fase venosa tardía para obtener un buen relleno de la vena cava inferior. Valorar posibles estenosis de canal venoso pulmonar y/o dehiscencia de “baffle” auricular, con secuencias axiales/4 cámaras cine SSFP y angio-RM. Y finalmente, evaluar la presencia de dilatación de la vena ácigos, lo que representa un signo indirecto de probable estenosis u obstrucción del “baffle” auricular. Todas las aceleraciones de flujo observadas en las secuencias cine SSFP deben hacernos sospechar posibles estenosis o shunts I-D, y deberemos confirmarlo posteriormente con planos específicos y cortes más finos en la dirección del jet visualizado inicialmente. Igualmente se podrán analizar con secuencias de cuantificación de flujo tipo contraste de fase (PC) 2D o 4D-Flow4, que nos permitirán una mayor precisión en su evaluación cuantitativa y cualitativa.
- •
A nivel ventriculoarterial (“switch” arterial) debemos descartar obstrucción en el tracto de salida de ventrículo derecho, generalmente secundario a estenosis de la valva neopulmonar y/o supravalvular pulmonar en el lugar de sutura quirúrgica (la más frecuente), así como estenosis de las ramas pulmonares asociada a distorsión anatómica tras maniobra de Lecompte. Debemos cuantificar el flujo proporcional en la arteria pulmonar derecha e izquierda mediante secuencias PC 2D o 4D Flow. En el tracto de salida del ventrículo izquierdo, evaluar dilatación de la neoaorta (principalmente anillo valvular y región sinusal, coincidiendo con el sitio de translocación de las arterias coronarias)2,3, insuficiencia de la valva neoaórtica y estenosis supravalvular aórtica (en el lugar de sutura quirúrgica). En cuanto a los ventrículos, se deberá evaluar la función, volumen y masa de ventrículo izquierdo1 y descartar infarto silente, mediante la evaluación de alteraciones segmentarias en secuencias cine SSFP y/o la evidencia de realce tardío3. Evaluar la función, volumen y masa del ventrículo derecho (incrementada si existe obstrucción en el tracto de salida). Y, finalmente, excluir patología de arterias coronarias, como la estenosis/oclusión ostial (posquirúrgicas), el “kinking” proximal y el recorrido interarterial.
Los avances logrados en las técnicas de imagen cardíaca avanzada (RM cardíaca) de la última década han permitido obtener una mejor evaluación y seguimiento pre- y postoperatorios de los pacientes con cardiopatías congénitas complejas como la TGAcc. Si a esto le sumamos el progreso en las técnicas quirúrgicas durante el mismo período, obtenemos como resultado final un mejor control evolutivo y un aumento de las tasas de supervivencia de los pacientes con TGAcc.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.