INTRODUCCIÓN
En las últimas dos décadas el gran avance teórico en el terreno de las arritmias se ha acompañado de un importante desarrollo tanto en el campo de la terapéutica como en el del diagnóstico.
Las arritmias pueden presentarse a consecuencia de anormalidades electrofisiológicas primarias, o ser la expresión de una enfermedad cardíaca estructural subyacente. Algunas enfermedades metabólicas como el hipertiroidismo y el feocromocitoma, así como también alimentos y bebidas ricos en cafeína, el tabaco, el alcohol, determinadas drogas y algunos fármacos pueden producir arritmias en corazones previamente sanos.
El amplio espectro clínico de las arritmias cardíacas engloba desde la forma asintomática (hallazgo casual en un reconocimiento médico rutinario), palpitaciones, sensación de mareo, hasta el síncope, insuficiencia cardíaca y la muerte súbita.
En primer lugar, ante la sospecha de una arritmia es necesario su confirmación eléctrica mediante un electrocardiograma (ECG) y/o Holter y después un estudio electrofisiológico. A continuación se debería descartar una enfermedad cardíaca asociada o una cardiopatía estructural, y aquí es donde intervienen las pruebas de imagen como la ecocardiografía, la resonancia magnética (RM) y la tomografía computarizada (TC).
La RM es una técnica de imagen atractiva que permite definir con precisión la anatomía y la función cardíaca. En el campo de la arritmología clínica la RM tiene su campo de acción en dos ámbitos muy bien definidos. Uno es en la evaluación diagnóstica de la displasia arritmogénica del ventrículo derecho, en que la RM contribuye de forma importante a la identificación de criterios para su diagnóstico. El otro, es en el estudio anatómico de las venas pulmonares y funcional de la aurícula izquierda antes y después del procedimiento de ablación con radiofrecuencia en pacientes con fibrilación auricular (FA).
En el presente artículo de actualización se abordarán las facetas más novedosas de estas dos entidades.
FIBRILACIÓN AURICULAR
La FA es la arritmia más común. Afecta al 6% de la población de más de 65 años y casi al 10% de la población de más de 80 años1. Es la causa más frecuente de hospitalización por arritmia y se asocia a una mortalidad 1,5-1,9 veces más elevada que la población general cuando se ajusta por otros factores de riesgo cardiovascular2. Es una causa mayor de accidente vascular cerebral con una incidencia anual del 5% en pacientes mayores de 65 años. Los síntomas incluyen ansiedad, palpitaciones, disnea, intolerancia al ejercicio, fatiga, etc. El mecanismo electrofisiológico más aceptado es la existencia de múltiples circuitos de reentrada que provocan una contracción fibrilatoria de la aurícula. El inicio de esta actividad desorganizada requiere de unos factores desencadenantes, como son una estimulación simpática o parasimpática exagerada o una actividad ectópica auricular rápida. Con respecto a esta última, se ha demostrado que la gran mayoría de latidos ectópicos auriculares que inician las crisis de FA tienen su origen en las venas pulmonares y principalmente en las venas superiores3. La perpetuación de la FA requiere también de unos factores que están relacionados con el remodelado eléctrico y anatómico a nivel de la aurícula izquierda y que consisten en una disminución del período refractario (remodelado eléctrico) y en la aparición de fibrosis (remodelado anatómico) que facilitan nuevos circuitos de reentrada que perpetúan la arritmia y conlleva una pérdida de la contractilidad auricular4,5. El tratamiento clásico de la FA (cardioversión eléctrica y fármacos antiarrítmicos) tiene limitaciones, con una tasa de recidivas de hasta el 50% de casos y un importante número de efectos secundarios1.
Tras el descubrimiento de que más del 90% de latidos ectópicos que conducen a FA se originan en las venas pulmonares, se ha desarrollado recientemente el tratamiento mediante las técnicas de ablación con radiofrecuencia. Dicho procedimiento se ha demostrado como una terapia válida para restablecer el ritmo sinusal en la FA refractaria al tratamiento farmacológico. Existen dos técnicas con finalidad curativa que se han desarrollado durante los últimos años con el objetivo de aislar eléctricamente las venas pulmonares y/o modificar el sustrato arritmogénico auricular: una consiste en la ablación focal mediante aplicación ostial de radiofrecuencia6 y la otra en el aislamiento eléctrico mediante ablación circunferencial de la aurícula izquierda en torno a las venas pulmonares7. La técnica de ablación es invasiva y no exenta de complicaciones; la más frecuente es la estenosis de las venas pulmonares con una prevalencia publicada que varía entre el 1,5-42%8. La mayoría de las veces es asintomática. En general, parece que la técnica de ablación circunferencial se asocia a una menor incidencia de estenosis9-11. Otras complicaciones descritas aunque poco frecuentes son el taponamiento cardíaco, accidente vascular cerebral, hemotórax, hipertensión pulmonar, infarto venoso pulmonar y fístula atrioesofágica (< 0,05%)12-14.
Indicación de las técnicas de imagen
Las técnicas de imagen (TC y RM) desempeñan un papel importante en el estudio anatómico de la aurícula izquierda y las venas pulmonares antes y después del tratamiento con ablación. No obstante, la RM presenta unas ventajas ya conocidas sobre la TC, que la convierten en la técnica de imagen de preferencia: ausencia de irradiación, no utilización de contraste yodado y permite con más precisión el estudio volumétrico de la aurícula izquierda.
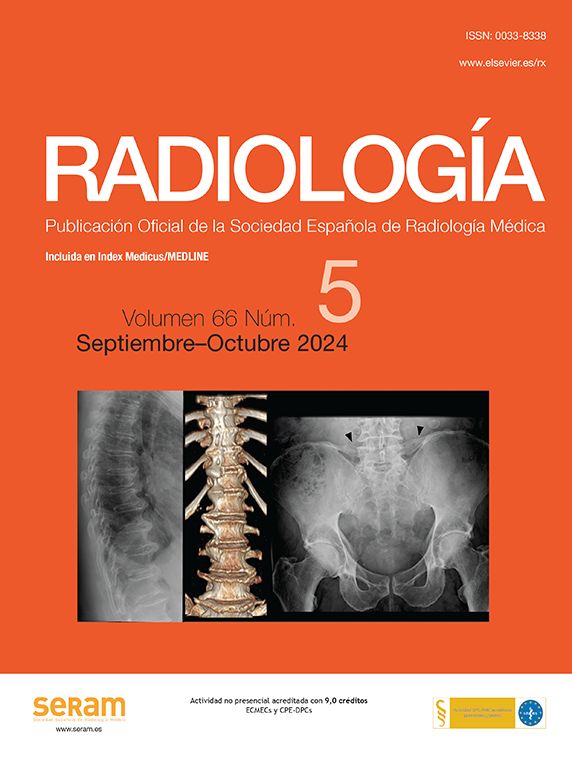
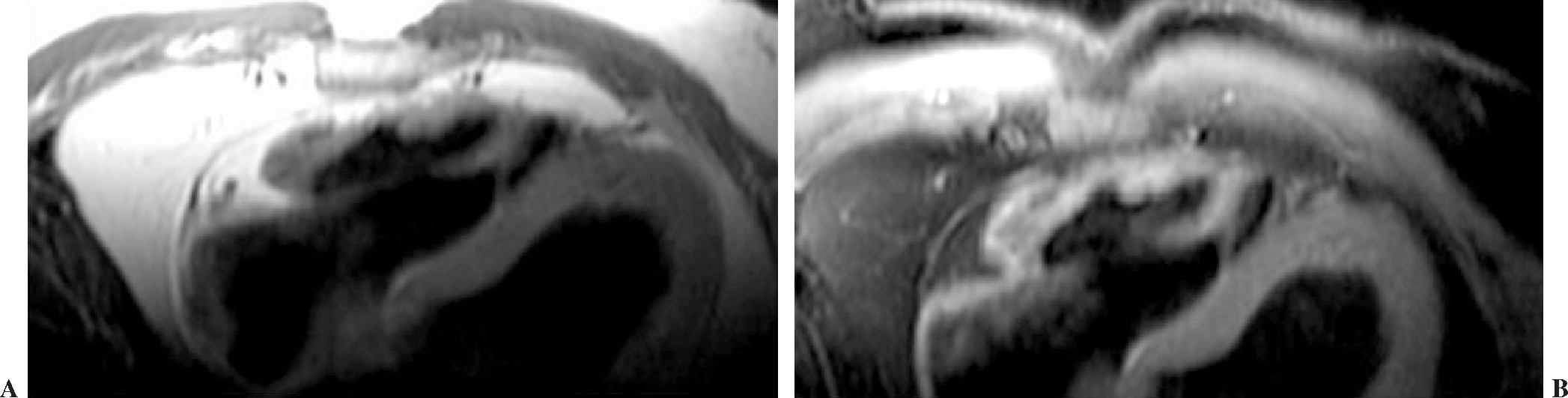
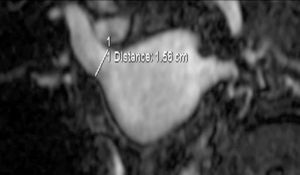
El conocimiento de la anatomía de las venas pulmonares es necesario para una correcta planificación de la terapia ablativa. Asimismo, es importante la medición basal del calibre de las venas pulmonares, la cual se utiliza como medida de referencia para poder detectar en el seguimiento de los pacientes complicaciones del tipo estenosis relacionadas con la ablación (fig. 1).
Fig. 1.--(A) Estudio angio-resonancia magnética (RM) pre-ablación. Se muestra la vena pulmonar inferior izquierda con un diámetro normal. (B) Estudio angio-RM a los 4 meses post-ablación. Se muestra una disminución del calibre en un 50%.
Es importante el conocimiento de los cambios volumétricos que se producen en la aurícula izquierda tras la ablación, ya que puede representar un indicador de respuesta al tratamiento. Existe escasa información sobre si el proceso de remodelado auricular se detiene o incluso se revierte después de la ablación, lo que se denominaría remodelado inverso. Existen varios estudios donde se observa la evolución del tamaño de la aurícula izquierda y de las venas pulmonares después de una ablación por FA paroxística o persistente15-19. En dichas series se observa una disminución significativa del volumen de la aurícula izquierda y del área ostial de las venas pulmonares que sólo ocurre en los pacientes que recuperan el ritmo sinusal. Por el contrario, en los que presentan recurrencia de la FA, las dimensiones de la aurícula izquierda aumentan. Esto demostraría que la ablación, cuando resulta eficaz e impide la recurrencia de FA, inicia un mecanismo de remodelado estructural inverso.
Anatomía y variaciones anatómicas
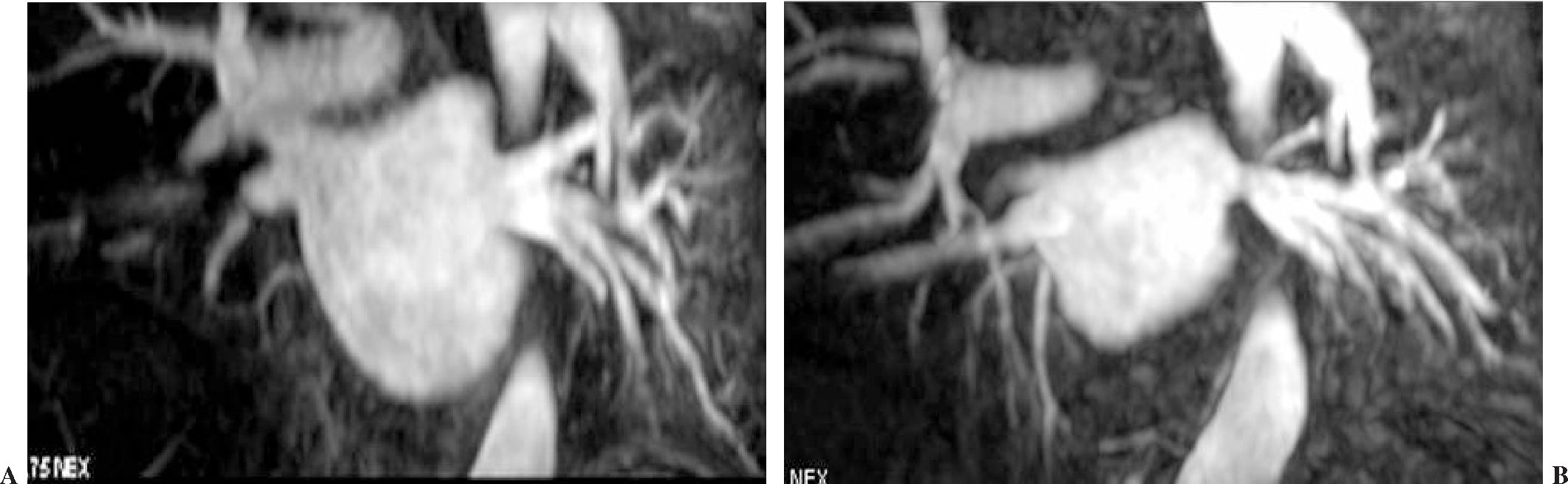
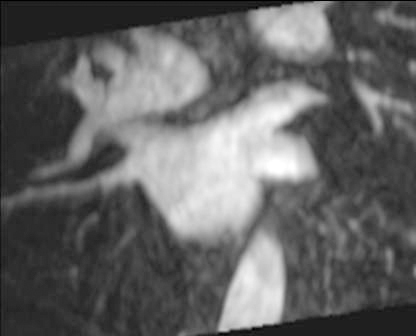
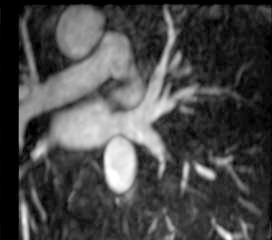
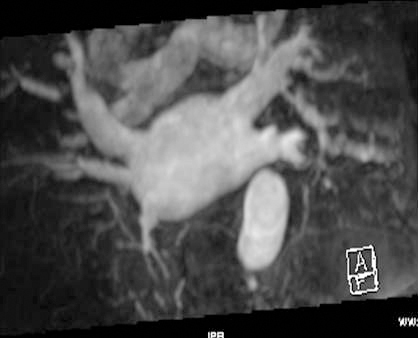
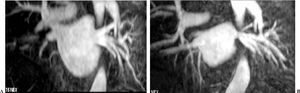
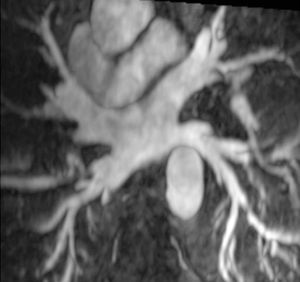
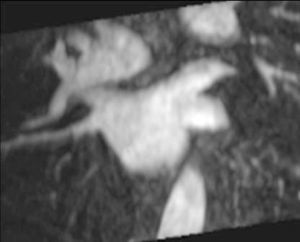
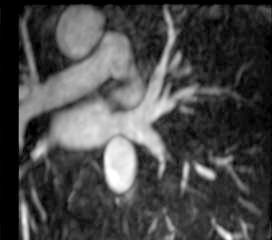
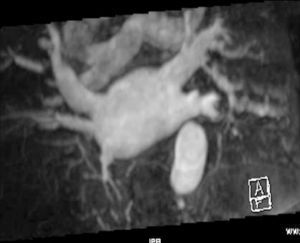
La anatomía normal de las venas pulmonares consiste en 4 venas que drenan a la aurícula izquierda a través de 4 ostia independientes (fig. 2). Dicha distribución anatómica aparece en el 70% de la población general. Las venas pulmonares superiores se proyectan hacia delante y arriba. Las venas pulmonares inferiores se proyectan hacia atrás y abajo. La vena pulmonar superior derecha se localiza justo por detrás de la vena cava superior. Las venas pulmonares izquierdas se sitúan entre la orejuela y la aorta descendente y presentan una morfología ovoidea o elíptica, con el diámetro menor en sentido antero-posterior, a diferencia de las venas pulmonares derechas, que presentan una morfología más circular. La vena pulmonar del lóbulo medio generalmente drena a la vena pulmonar superior derecha (53-69% de la población general) y menos frecuentemente a la vena pulmonar inferior derecha (3-8%). La variante anatómica más frecuente (12-25%) es el tronco común izquierdo corto, en que la unión de la pared inferior de la vena pulmonar superior y la pared superior de la vena pulmonar inferior se sitúan por fuera del reborde de la aurícula izquierda (fig. 3). Cuando el tronco común presenta una longitud de ≥ 1 cm se denomina tronco común izquierdo largo (fig. 4). Los troncos comunes tienen un diámetro superior al del resto de venas pulmonares. La presencia de venas pulmonares accesorias que drenan de forma independiente a la aurícula izquierda ocurre más frecuentemente en el lado derecho, siendo la más común una vena pulmonar accesoria media que generalmente drena el lóbulo medio (17-23% de la población general) (fig. 5), aunque a veces drena el segmento apical del lóbulo inferior. Estas venas accesorias generalmente tienen un calibre menor al resto de las venas pulmonares.
Fig. 2.--Anatomía normal de las 4 venas pulmonares drenando a la aurícula izquierda.
Fig. 3.--Tronco común izquierdo corto. La unión de la pared inferior de la vena pulmonar superior y la pared superior de la vena pulmonar inferior se sitúa por fuera del reborde de la aurícula izquierda.
Fig. 4.--Tronco común izquierdo largo. El tronco común presenta una longitud de ≥ 1 cm.
Fig. 5.--Vena pulmonar media derecha.
Algunos autores han relacionado la presencia de variantes anatómicas con una mayor prevalencia de FA20-22, aunque no se ha podido demostrar hasta el momento una relación clara entre ambos hechos23.
Protocolo de exploración
Se utiliza una antena específica para estudios cardíacos y se realizan localizadores en plano sagital y coronal. A continuación se adquieren secciones axiales mediante una secuencia eco de gradiente desde el botón aórtico hasta el diafragma, con sincronización con el ECG. Se obtiene un conjunto de imágenes en distintas fases del ciclo cardíaco que podremos ver en modo de cine-RM. La adquisición de las imágenes se realiza en apnea y al final de la espiración. A continuación se realiza una secuencia de angio-RM 3D en plano axial centrado en las venas pulmonares durante la administración de 0,2 mmol/ kg de gadolinio a un flujo de 2 ml/seg. La adquisición coincide con la llegada del contraste a la aorta descendente y es mediante la detección automática del bolus. El tiempo de adquisición es de entre 19-25 segundos. Las imágenes son transferidas a una estación de trabajo y se realizan las reconstrucciones multiplanares de las venas pulmonares y el estudio volumétrico de la aurícula izquierda.
Análisis y post-procesado de la imagen
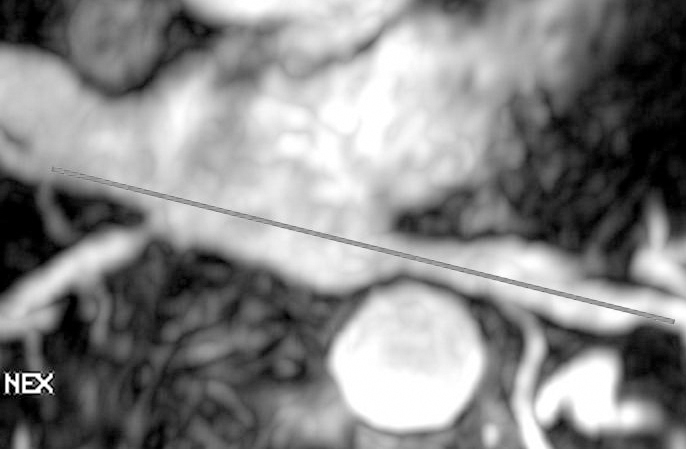
Se evalúa el número y el diámetro de las venas pulmonares. Para realizar las mediciones del ostium de cada una de las venas pulmonares, se realizan reconstrucciones multiplanares a partir del estudio de angio-RM 3D. Sobre la imagen inicial en plano axial se obtiene una reconstrucción en oblicuo-coronal a partir de una sección paralela a lo largo del eje mayor de la vena pulmonar (fig. 6). El diámetro se mide en el ostium, el cual se define como el punto de inflexión entre la pared de la vena pulmonar y la pared de la aurícula izquierda (fig. 7).
Fig. 6.--En la imagen en plano axial se obtiene una reconstrucción en oblicuo-coronal a partir de una sección paralela a lo largo del eje mayor de la vena pulmonar.
Fig. 7.--Vena pulmonar superior derecha. El diámetro se mide en el ostium, el cual se define como el punto de inflexión entre la pared de la vena pulmonar y la pared de la aurícula izquierda.
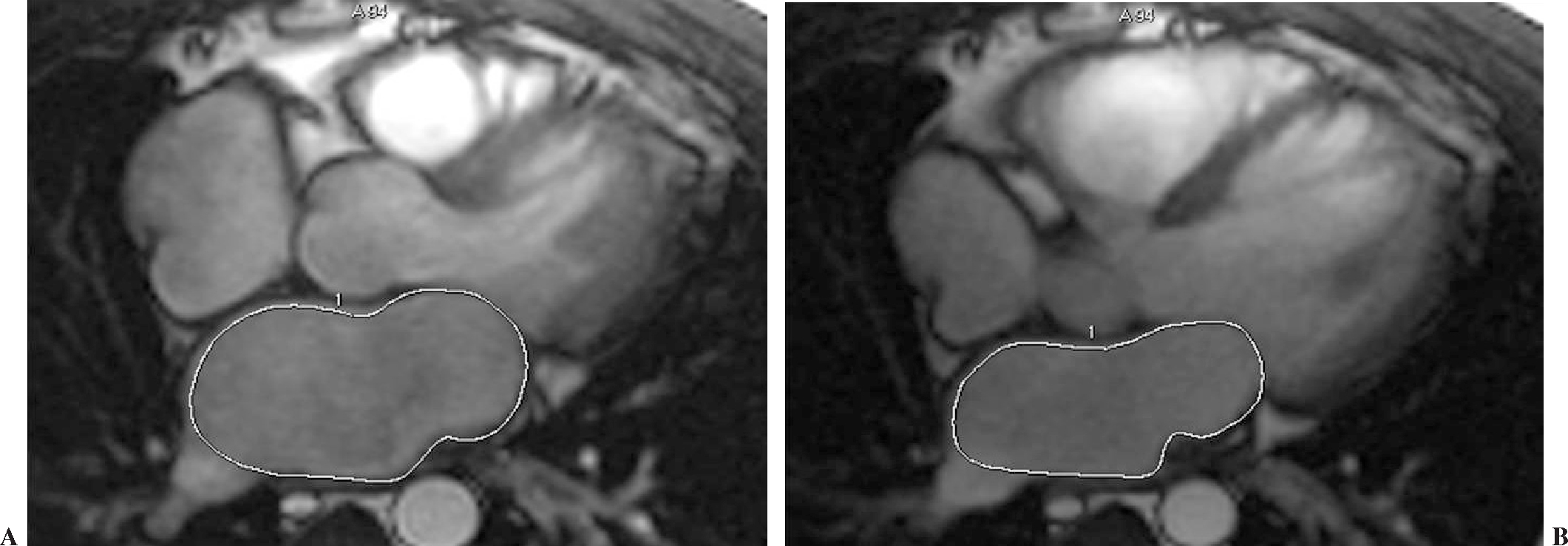
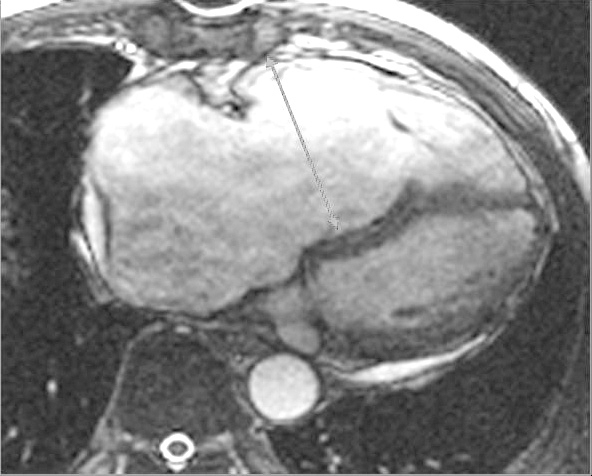
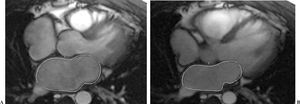
En la secuencia de cine-RM eco de gradiente se cuantifica la volumetría de la aurícula izquierda mediante el método volumétrico de Simpson (suma de todas las áreas multiplicado por el grosor de corte y corregido por el espaciado entre los cortes). Para ello se selecciona la imagen en máxima dilatación, que corresponde a la imagen justo antes de la apertura de la válvula mitral y la imagen en máxima contracción, que es justo al cierre de la válvula mitral; dibujamos manualmente el borde interno de la aurícula izquierda en máxima dilatación y en máxima contracción (fig. 8), obteniendo así el área diastólica y sistólica del ciclo cardíaco en cada corte.
Fig. 8.--(A) Se contornea manualmente el borde interno de la aurícula izquierda en máxima dilatación. (B) Aurícula izquierda en máxima contracción. Se obtiene así el área diastólica y sistólica del ciclo cardíaco en cada corte.
Se examinan también los espacios pleurales, el espacio pericárdico y la anatomía vascular; se evalúan alteraciones valvulares (insuficiencia, estenosis) y la morfología cardíaca en general.
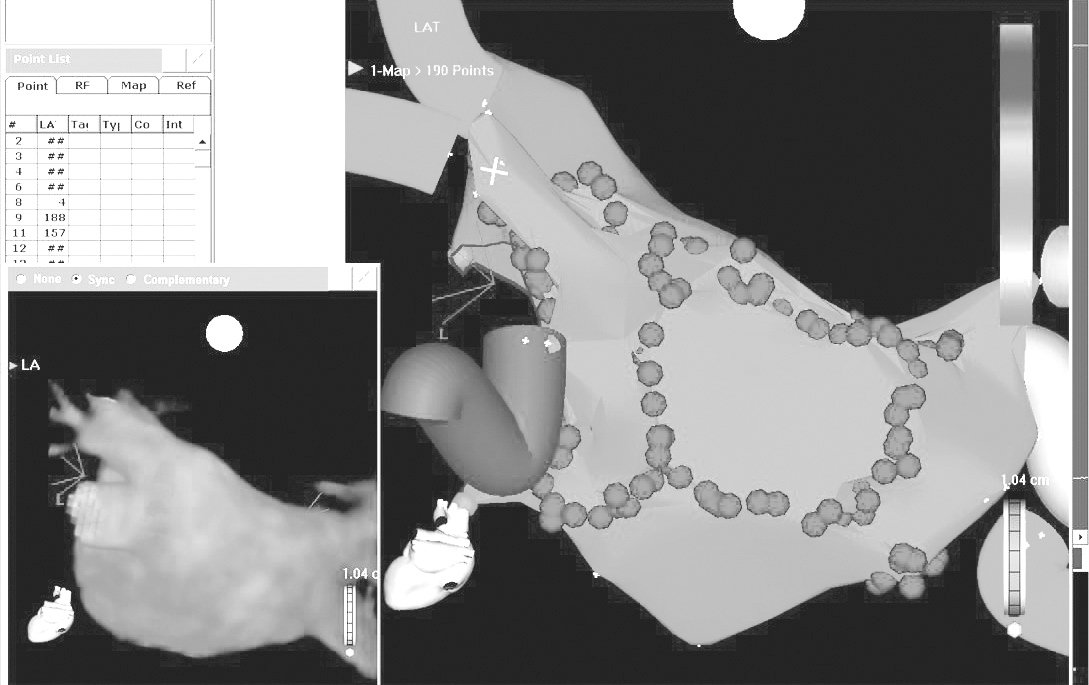
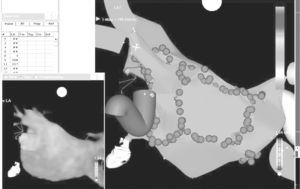
La FA se asocia a un remodelado auricular y a una disfunción ventricular izquierda. Hoy en día todavía se desconoce si estos cambios son causa o efecto de la arritmia. La ablación mediante radiofrecuencia de las venas pulmonares es una modalidad de tratamiento reciente para los pacientes con FA que no responden al tratamiento farmacológico. La RM es una técnica de imagen no invasiva que permite realizar una correcta evaluación anatómica de las venas pulmonares y del volumen auricular izquierdo antes y después de la terapia ablativa. Esta información es importante a la hora de seleccionar el tamaño del catéter de mapeo circular y de determinar que todos los orificios son evaluados durante el procedimiento. Los sistemas de navegación no fluoroscópica siguen desarrollándose y ya incorporan programas de integración que permiten fusionar las imágenes anatómicas, obtenidas mediante TC o RM, con el mapa electroanatómico obtenido en el laboratorio de electrofisiología (fig. 9), lo cual ayuda a una mejor orientación durante el procedimiento de la ablación.
Fig. 9.--Fusión de las imágenes anatómicas, obtenidas mediante tomografía computarizada o resonancia magnética, con el mapa electroanatómico obtenido en el laboratorio de electrofisiología.
La RM permite descartar estenosis de las venas pulmonares y otras complicaciones postablación. El diámetro de las mismas deberá siempre compararse con las imágenes de referencia pre-ablación. La cuantificación de la volumetría de la aurícula izquierda y el cálculo de la fracción de eyección antes y después del tratamiento permite comprobar las modificaciones en el volumen auricular. Esto último es un tema de actualidad, motivo de múltiples estudios que analizan cómo la técnica actúa sobre el remodelado estructural auricular y su correlación con la evolución clínica del paciente.
DISPLASIA ARRITMOGÉNICA DEL VENTRÍCULO DERECHO
La displasia arritmogénica del ventrículo derecho (DAVD) es una miocardiopatía familiar y una de las causas más frecuentes de muerte súbita y arritmias ventriculares en gente joven24. La prevalencia de la enfermedad varía ampliamente según las series descritas, pero se estima que ocurre en 1:5.000 personas y existe controversia acerca de su distribución geográfica25,26.
El hallazgo patológico más llamativo es una atrofia difusa o segmentaria del miocardio en la pared libre del ventrículo derecho (VD) y su remplazamiento por tejido fibrograso. Con frecuencia la afectación es transmural y ocasiona dilataciones aneurismáticas. Predominantemente se localiza en la región denominada el «triángulo de la displasia», que está formado por la cara anterior del infundíbulo, la inferobasal (área subtricuspídea) y la región apical del ventrículo derecho, pero puede estar involucrado todo el VD de forma difusa. También se ha descrito afectación única del ventrículo izquierdo y biventricular27.
La etiología es todavía desconocida y se postulan 4 teorías: disontogénica, degenerativa, inflamatoria y la teoría apoptótica. Los estudios descriptivos señalan que la sustitución progresiva del miocardio por células del tejido adiposo y del fibroso sucede tras un exagerado proceso de apoptosis28-30.
La historia clínica natural es progresiva y viene determinada por la inestabilidad eléctrica y la paulatina disfunción ventricular derecha. Las fases iniciales de la enfermedad suelen ser asintomáticas o silentes, progresando hacia una fase más inestable de arritmias con morfología de bloqueo completo de rama izquierda, para pasar después a un fallo cardíaco derecho y llegar a una fase final con insuficiencia cardíaca biventricular, a menudo indistinguible de la miocardiopatía dilatada31. La muerte súbita no está en relación con la progresión de la enfermedad y puede presentarse como la primera y única manifestación en cualquiera de las fases. Dichos pacientes son particularmente vulnerables a las arritmias coincidiendo con el esfuerzo físico, el cual actuaría como desencadenante, debido a que la estimulación adrenérgica activaría al sustrato arritmogénico contenido en el tejido fibrograso.
La infiltración únicamente por grasa del VD es probablemente un proceso diferente y no debe considerarse sinónimo de DAVD. Además varios trabajos han demostrado la presencia de grasa en la pared del VD en sujetos sanos, y sobre todo en mujeres de edad avanzada. El diagnóstico debería realizarse sólo cuando se demuestre la presencia de fibrosis31-33, y viene dado por la confirmación mediante biopsia de la sustitución miocárdica por tejido fibrograso. No obstante, la realización de la biopsia no es en el momento actual una recomendación rutinaria34. La sensibilidad de la biopsia es baja debido a que, por razones de seguridad, se realiza en el septo interventricular, localización poco afectada por la enfermedad. Algunos autores han evaluado la presencia de fibrosis en pacientes con sospecha de DAVD mediante la administración de contraste endovenoso y la secuencia de realce tardío con muy buenos resultados, que han sido correlacionados con el estudio histológico35.
No existe una única prueba diagnóstica de referencia. En 1994, McKenna et al establecieron unos criterios diagnósticos conjuntamente con el grupo de trabajo internacional de la miocardiopatía arritmogénica24. El diagnóstico viene dado por una serie de criterios mayores y menores que engloban distintos parámetros: alteraciones en el ECG, alteraciones morfo-funcionales, arritmias de origen en el VD, alteraciones histológicas e historia familiar (tabla 1). Se requieren para el diagnóstico el cumplimiento de dos criterios mayores, o uno mayor y dos menores, o 4 menores. Las técnicas de imagen, como la ecocardiografía y la RM, son las que proporcionan la evaluación de las alteraciones morfo-funcionales del VD.
Protocolo de exploración
Se utiliza una antena específica para estudios cardíacos. Los estudios se realizan con sincronización electrocardiográfica. Se realizan unas secuencias de localización en tres planos. A continuación, para caracterizar la morfología de las paredes ventriculares se utiliza una secuencia espín-eco de sangre negra potenciada en T1 en plano axial sin y con saturación grasa. Para estudiar la función ventricular y detectar alteraciones en la motilidad, ya sea global o segmentaria, se realizan secuencias eco de gradiente o cine-RM en plano eje corto y oblicuo sagital orientado sobre el tracto de salida del VD. A continuación se administra contraste endovenoso y se realizan varias adquisiciones multiplanares tardías mediante una secuencia de supresión miocárdica, para valorar la presencia de fibrosis en la pared ventricular derecha.
Análisis de la imagen por resonancia magnética
Por RM se han de buscar 5 hallazgos:
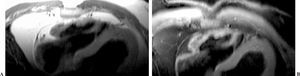
1. Presencia de áreas hiperintensas en el miocardio, que indicarían la presencia de grasa (fig. 10).
Fig. 10.--(A) Secuencia de sangre negra sin saturación grasa que muestra una hiperintensidad a nivel del miocardio de la cara anterior del ápex del ventrículo derecho. (B) Secuencia de sangre negra con saturación grasa que confirma la presencia de grasa que infiltra el miocardio.
2. Dilatación del tracto de salida del ventrículo derecho.
3. Dilatación ventricular derecha.
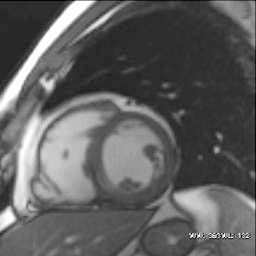
4. Áreas discinéticas (fig. 11).
Fig. 11.--Saculación discinética en la pared libre del ventrículo derecho.
5. Dilatación auricular derecha.
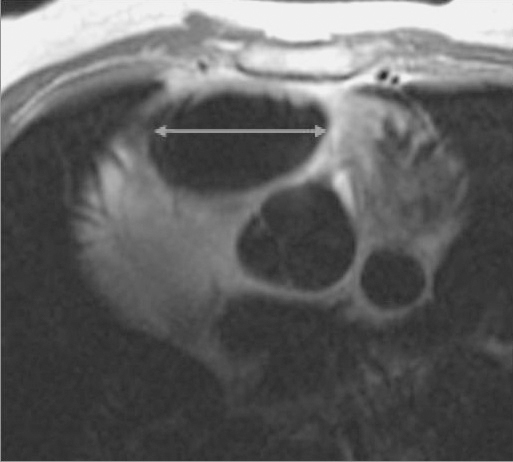
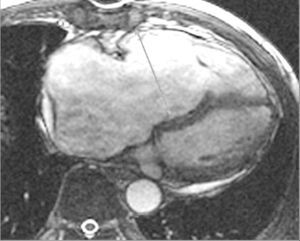
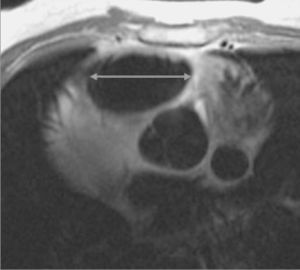
La dilatación del VD (fig. 12) es una de las primeras condiciones, ya que como hemos mencionado previamente, la presencia de grasa en la pared no es concluyente. Se considera el tracto de salida del VD dilatado cuando es superior a 30 mm (fig. 13). Los hallazgos radiológicos podríamos ordenarlos de mayor a menor importancia: alteraciones de la motilidad, alteraciones morfológicas y por último alteraciones en la intensidad de la señal a nivel de la pared del VD.
Fig. 12.--Secuencia eco de gradiente en plano axial donde se muestra dilatación severa del ventrículo derecho.
Fig. 13.--Secuencia de sangre negra en plano axial donde se muestra dilatación del infundíbulo del ventrículo derecho.
Dificultades, limitaciones y consejos
La evaluación del VD presenta una serie de problemas que están relacionados con la propia anatomía ventricular derecha:
1. La pared del VD es muy delgada, generalmente no supera los 3 mm de grosor.
2. La motilidad ventricular derecha se ha demostrado mediante estudio angiográfico, que no es uniforme36.
3. La presencia normal de grasa a nivel del surco aurículo-ventricular derecho, rodeando la arteria coronaria derecha, y también acumulaciones de grasa a nivel apical y en menor cantidad en el espacio subepicárdico, justo por debajo del pericardio. Si a estas particularidades además le añadimos la posible presencia de artefactos de volumen parcial con la grasa normal subepicárdica, condicionan que la valoración de un adelgazamiento de la pared, citado por algunos autores32,37 como un signo radiológico importante, y la valoración de alteraciones leves o moderadas de la motilidad sea sumamente difícil. Se aconseja valorar únicamente adelgazamientos si éstos van acompañados de alteraciones de la contractilidad. Además podemos encontrar infiltración grasa en corazones normales, particularmente en sujetos de edad avanzada38,39. Es importante realizar la secuencia de sangre negra potenciada en T1 con saturación grasa, la cual ayuda a delimitar mejor el miocardio del VD. La utilización de la secuencia de realce tardío tras la administración de contraste endovenoso es de gran ayuda para la demostración de fibrosis en la pared ventricular.
La interpretación de los hallazgos por RM en la práctica asistencial diaria es cualitativa, y por tanto subjetiva, y éstos serán más fiables cuanto más severas sean las alteraciones. Se requiere una buena técnica, una curva de aprendizaje y tener experiencia en las características y variaciones normales del ventrículo derecho40. Sería importante usar criterios cuantitativos para definir el tamaño y la motilidad del VD, ya que el grado de afectación (discreto, moderado y severo) es determinante para considerar un criterio como mayor o menor. Consecuentemente hay una alta incidencia de falsos diagnósticos de DAVD en relación con una mala valoración de los trastornos de la motilidad, lo que junto a la variabilidad inter-observador hace que la especificidad sea sólo del 60%41,42.
El diagnóstico no debe efectuarse únicamente por criterios de imagen-RM. El diagnóstico debe obtenerse basándose en el conjunto de los criterios diagnósticos propuesto por la Sociedad Europea de Cardiología, y entre ellos la RM es importante en la práctica clínica para la demostración de las alteraciones estructurales y en la disfunción global y segmentaria.
Declaración de conflicto de intereses.
Declaramos no tener ningún conflicto de intereses.
Correspondencia:
TERESA M.ª DE CARALT. Servicio de Radiodiagnóstico. Hospital Clínic. Villarroel, 170. 08036 Barcelona. España. TMCARALT@clinic.ub.es
Recibido: 28-VI-06
Aceptado: 27-IX-06