El objetivo del presente trabajo es compartir con el lector nuestra experiencia en el tratamiento percutáneo con radiofrecuencia guiada por tomografía computarizada de los tumores óseos benignos tras haber realizado más de 100 intervenciones en los últimos 8 años. En la actualidad, puede afirmarse que esta técnica debe ser el tratamiento de elección de la inmensa mayoría de los osteomas osteoides y que también tiene aplicaciones, como tratamiento definitivo, en muchos casos de osteoblastomas o de condroblastomas así como en otros tumores óseos benignos más infrecuentes. El procedimiento ha demostrado ser altamente eficaz y ha presentado escasas complicaciones, permitiendo a los pacientes unos tiempos de recuperación muy rápidos.
We report our experience in the computed tomography (CT)-guided percutaneous radiofrequency ablation of more than 100 benign bone tumors in the last eight years. We affirm that this should be the technique of choice in the vast majority of osteoid osteomas; it can also be applied as a definitive treatment in many cases of osteoblastomas or chondroblastomas as well as in less common benign bone tumors. CT-guided percutaneous radiofrequency ablation has proven highly efficacious and has resulted in very few complications; thus, patients tend to recover very quickly.
Como ocurre con muchos otros términos en medicina, “ablación por radiofrecuencia” (ARF) proviene de la traducción literal de la expresión inglesa1 y hace referencia a la destrucción mediante el calor de un determinado tejido. El empleo del calor como herramienta terapéutica (la cauterización) ya era conocida en los remotos inicios de la medicina, por lo que la ARF no es más que una forma moderna y sofisticada de emplear el calor como método de tratamiento.
Hoy en día, hay diversas técnicas que permiten destruir una lesión mediante calor: las microondas, el láser, los ultrasonidos de alta frecuencia, la crioterapia y la radiofrecuencia. Esta última es la que, sin duda, ha alcanzado más desarrollo, y la que tiene un uso mundialmente conocido y aceptado para el tratamiento (paliativo o curativo) de tumores malignos primarios o metastáticos en hígado, pulmón, riñones, glándulas suprarrenales, partes blandas, etc. Tampoco podemos olvidar su utilidad para el tratamiento de ciertas arritmias cardíacas o para aliviar el dolor radicular.
En el campo osteomuscular se lleva empleando con éxito muchos años, principalmente en el tratamiento del osteoma osteoide (OO). Fue el grupo de trabajo del Dr. Rosenthal, el que publicó el primer artículo en el que se describía el uso de la ARF para tratar el OO2. En esta última década, la biblografía recoge la experiencia de numerosos autores que emplean esta técnica de forma eficaz para tratar y curar este tipo de tumor óseo3–19.
Principios físicos de la ablación por radiofrecuenciaCuando colocamos un electrodo en el interior de una lesión y, tras conectarlo a un generador, hacemos circular por él una corriente alterna de alta frecuencia (en el rango de las ondas de radio, 460–480kHz, de ahí el nombre), el efecto que provoca sobre las moléculas de los tejidos se conoce como “agitación iónica”. Estos rapidísimos cambios de movimiento provocan fricción entre las moléculas y la generación de calor que conduce, cuando la temperatura alcanza los 60°C, a una necrosis coagulativa20.
El volumen de necrosis obtenido es de morfología más o menos esférica y su tamaño depende de varios parámetros, y los factores principales son la potencia del equipo, el tiempo de tratamiento, el tamaño del electrodo y las características del tejido donde estemos aplicando la radiofrecuencia (RF)21,22. Concretamente, en el hueso, un electrodo de 1cm de punta activa genera una esfera de destrucción de 16–18mm23–28. De ahí la importancia que tiene la colocación del electrodo justo en el centro de la lesión.
Con objeto de incrementar el tamaño de la lesión, se han desarrollado diversos métodos: equipos de mayor potencia, electrodos tipo “paraguas”, electrodos múltiples y electrodos con refrigeración interna. Si bien no son necesarios en el tratamiento del OO, por el pequeño tamaño del nidus, sí nos resultarán útiles para tratar otras lesiones de mayor tamaño.
Una de las grandes ventajas de la ARF es que el tamaño de la lesión es reproducible, por lo que la aparición de efectos adversos, especialmente daños no deseados en tejidos sanos, tiene una frecuencia bastante baja.
Equipos de radiofrecuenciaEn el mercado hay 6 tipos diferentes de generadores de RF con capacidad para tratar tumores. Nosotros, al igual que la mayoría de autores que han publicado su experiencia en el tratamiento mediante ARF del OO, utilizamos el equipo Cool-Tip RF de Valleylab (Boulder, Colorado, EEUU), comercializado en España por Covidien. Se trata de un generador de hasta 200W de potencia, que trabaja con una frecuencia de 480Khz y es de fácil manejo. Existe la posibilidad de emplear electrodos de 7 o 10 mm de punta activa.
Osteoma osteoideGeneralidadesNo pretendemos hacer un repaso exhaustivo de las características del OO, ya que es una información ampliamente recogida en la bibliografía29–31, pero queremos hacer hincapié en una serie de aspectos que consideramos importantes.
La frecuencia del OO no está bien definida; alguien mencionó alguna vez que representaban el 10% de los tumores benignos, y esa cifra se reproduce sistemáticamente en toda referencia bibliográfica. Según nuestros propios datos, es esperable ver un caso de OO por cada 50.000 o 70.000 habitantes y año.
Respecto a su presentación clínica, es evidente que lo vemos más en varones (relación 2:1) pero, según nuestra casuística, la edad de presentación tiene un abanico amplio (1–45 años), con una edad media de 23 años (mayor que la encontrada en la bibliografía). La típica clínica de dolor en reposo que cede con aspirina suele observarse en lesiones que se localizan en la diáfisis de huesos largos, mientras que la presentación atípica sería aquella en la que el dolor viene referido a una articulación distinta de donde radica la lesión (más de un caso de OO de cadera se inicia con dolor en la rodilla), o a cuadros de dolor muy intenso (sobre todo en lesiones intraarticulares) donde, además, el nidus es muy pequeño y no tiene reacción perióstica. Ello conlleva que hasta en el 10% de los casos de OO se demore el diagnóstico exacto varios años. La gran mayoría de los OO son corticales o periósticos, pero hasta un 20% son medulares. La presencia de reacción perióstica, edema óseo y de partes blandas o de sinovitis puede ser variable en función de la localización de la lesión.
En todo caso, el diagnóstico de OO se puede establecer cuando nos encontramos un paciente con un cuadro clínico compatible, con una tomografía computarizada (TC) en la que se observa un nidus y con una gammagrafía ósea con la típica captación “en moneda”. Esta tríada ofrece una exactitud diagnóstica de casi el 100% de los casos. Hay ocasiones en las que el OO puede ser muy pequeño (2–3mm), por lo que es importante que le indiquemos al médico nuclear lo que estamos buscando para que el estudio gammagráfico incluya cortes tomográficos finos. Hoy en día, la realización de una SPECT-TC sería ideal en pacientes intervenidos, en los que ha fracasado el tratamiento quirúrgico y presentan distorsión de la estructura ósea, que impide indentificar el nidus a tratar. También conviene recordar que las lesiones intraarticulares suelen carecer de la clásica reacción perióstica. A la exploración, suele observarse atrofia muscular del miembro afectado.
Aunque está bien establecida la semiología del OO mediante resonancia magnética (RM)32, una fuente de errores importante proviene precisamente de la realización de RM a estos pacientes: si no se sospecha la existencia de un OO, la presencia de edema óseo o sinovitis oscurece la visualización del nidus y provoca diagnósticos erróneos y demoras, como ya se ha mencionado, en la correcta orientación clinicoterapéutica del paciente.
La localización más frecuente del OO es el fémur proximal y, en general, en el miembro inferior se localizan el 75% de los casos. Hasta un 15% de los OO se ubica en la columna vertebral (sobre todo en elementos posteriores), y el resto podemos encontrarlos en casi cualquier hueso, incluidas las falanges de las manos.
Opciones terapéuticasHoy en día, siguen habiendo 3 opciones terapéuticas para este tipo de lesión:
- 1.
Tratamiento médico. Es de sobra conocido que el dolor que produce esta lesión suele ser controlable mediante aspirina o antiinflamatorios no esteroideos. También está recogido en la bibliografía que el OO es un tumor que acaba desapareciendo solo33, aunque no está bien establecido cuántos años han de transcurrir para que acontezca este hecho.
Es evidente que no en todos los casos se logra controlar adecuadamente el dolor y los pacientes jóvenes no toleran bien tratamientos prolongados, no exentos de complicaciones, por lo que, disponiendo de una opción poco agresiva como es la ARF, el tratamiento conservador no es un tratamiento recomendable34. Nosotros sólo lo hemos aconsejado en una única ocasión.
- 2.
Tratamiento quirúrgico. Ha sido el tratamiento de elección durante muchas décadas y, por desgracia, se sigue practicando en demasiados centros hospitalarios. Tiene una serie de inconvenientes que deberían bastar para su erradicación como tratamiento de elección:
- •
Para alcanzar el nidus hay que plantear, en ocasiones, abordajes agresivos.
- •
Para extirpar el tumor hay que eliminar hueso sano, siendo necesario en determinadas circunstancias recurrir a material de osteosíntesis para prevenir la aparición de fracturas.
- •
La tasa de recurrencia es superior al 10%.
- •
Como toda cirugía, conlleva mayor morbilidad y una estancia hospitalaria más prolongada que un tratamiento percutáneo.
- •
La recuperación total del paciente puede demorarse meses.
- •
- 3.
Tratamientos percutáneos. Normalmente realizados con la guía de la TC. Hay autores que extirpan la lesión empleando un trocar grueso35–37. Otros prefieren el uso del alcohol38,39 o la fotocoagulación con láser (procedimiento muy parecido a la ARF)40,41, aunque sin duda es la ARF la técnica percutánea que ha alcanzado más difusión mundial, desde que fue descrita por Rosenthal et al2.
Para que decidamos realizar una ARF, el paciente debe tener lo que nosotros denominamos la tríada diagnóstica, ya mencionada anteriormente. Es conveniente que radiólogo y traumatólogo participen de este consenso diagnóstico.
Posteriormente, tenemos que hablar con el paciente o sus responsables legales para explicarles la técnica, contarle las complicaciones y resolver sus dudas. La firma del consentimiento es obligatoria y un trámite que nunca debemos olvidar.
Indudablemente, también deberá ser valorado por el servicio de anestesiología y contar con unas pruebas de coagulación normales.
En pacientes adultos, cuando la tríada diagnóstica no es tan clara pero sí que se ve en la TC una lesión que parece un nidus; les planteamos la realización de la ARF, pero les explicamos que quizás dicha lesión no sea la causa del dolor, por lo que puede que no se obtenga mejoría o, al menos, ésta no sea absoluta.
No solemos emplear la RM como herramienta diagnóstica del OO salvo que la lesión esté ubicada en la columna vertebral (en estos casos ayuda a la planificación de la ARF).
Ablación por radiofrecuencia: el procedimientoNosotros siempre lo hacemos en la sala de TC y siempre estamos 2 radiólogos osteoarticulares. También participan el anestesiólogo (el procedimiento, por la misma naturaleza del OO, es muy doloroso), 2 enfermeras (una de anestesia y otra de radiología) y un TER. El anestesiólogo, lógicamente, es el que decide el tipo de anestesia pero, en general, podemos resumir diciendo que cuando el paciente es un niño o la lesión está en la columna vertebral, se emplea la anestesia general. En el resto de supuestos, se utilizará anestesia locorregional (raquídea, bloqueo poplíteo, etc.).
Nuestra forma de actuar es muy similar a la descrita por Pinto et al42.
¿Cómo abordamos la lesión? Hay que tener mucho cuidado y esmerarse en evitar estructuras vasculonerviosas que puedan dañarse (fig. 1). También hay que recordar que cuanta menos masa muscular atravesemos, mejor. Por último, otro consejo: evitar, si es factible, cruzar la reacción perióstica ya que suele ser bastante trabajoso.
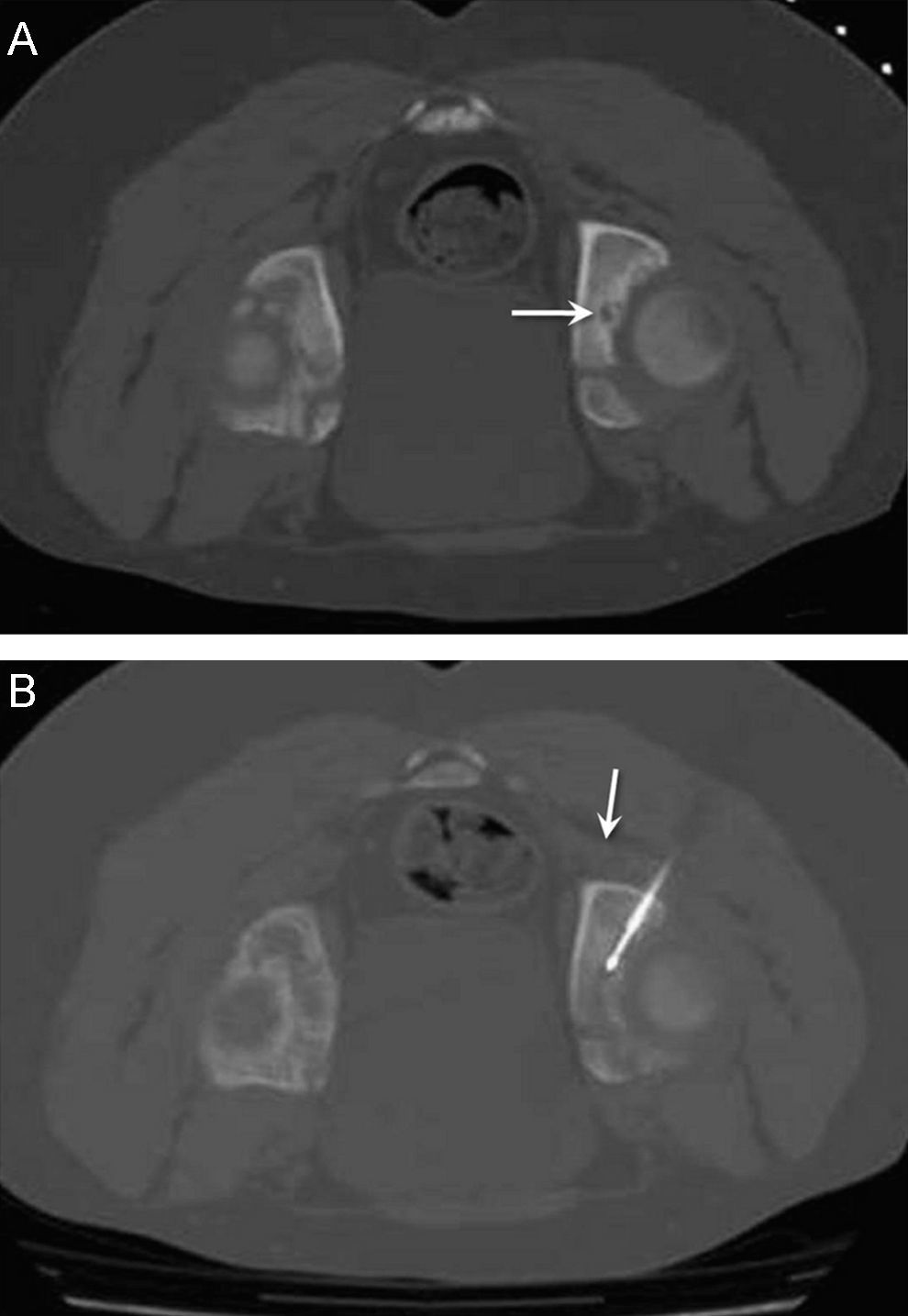
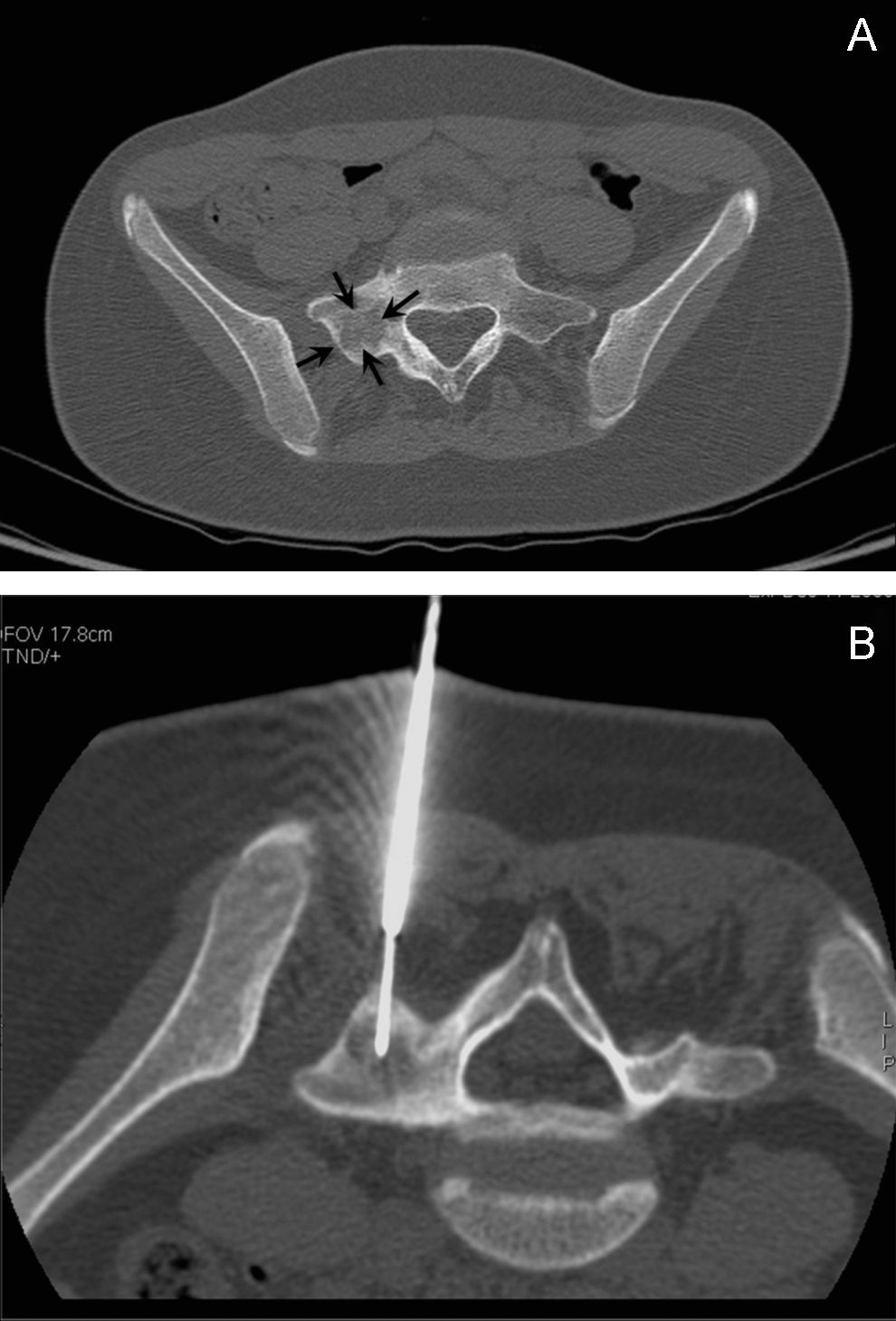
A) Osteoma osteoide ubicado en el acetábulo (flecha). El acceso quirúrgico en esta localización es complicado y requiere una cirugía agresiva. B) Buscando una ruta segura, podemos posicionar el electrodo en el nidus con absoluta precisión. En este caso se optó por un abordaje posterior, evitando el nervio ciático (flecha) y otras estructuras vasculonerviosas.
Una vez que tenemos al paciente anestesiado y hemos seleccionado la ruta de acceso, tenemos que decidir cómo alcanzamos la lesión. En el mercado hay varios tipos de agujas de biopsia ósea. Nosotros las que más utilizamos son la Ostycut y la de BiopsyBell, ambas de 11G y 13cm de longitud. En muchas ocasiones, con estas agujas podemos lograrlo de forma puramente manual, especialmente en niños donde el hueso no es muy duro. Otras veces, nos tenemos que ayudar con un martillo o debemos recurrir al taladro eléctrico. Esto suele suceder en adultos o cuando hay mucha reacción perióstica. Recientemente, se han comercializado agujas de biopsia ósea diseñadas para atravesar hueso y parecen ofrecer muy buenas prestaciones, como la de la casa Wacrees.
Sea cual sea la aguja de biopsia que empleemos, no solemos tomar muestra de la lesión para su análisis histopatológico, salvo que las características radiológicas o clínicas nos hagan dudar del diagnóstico de OO.
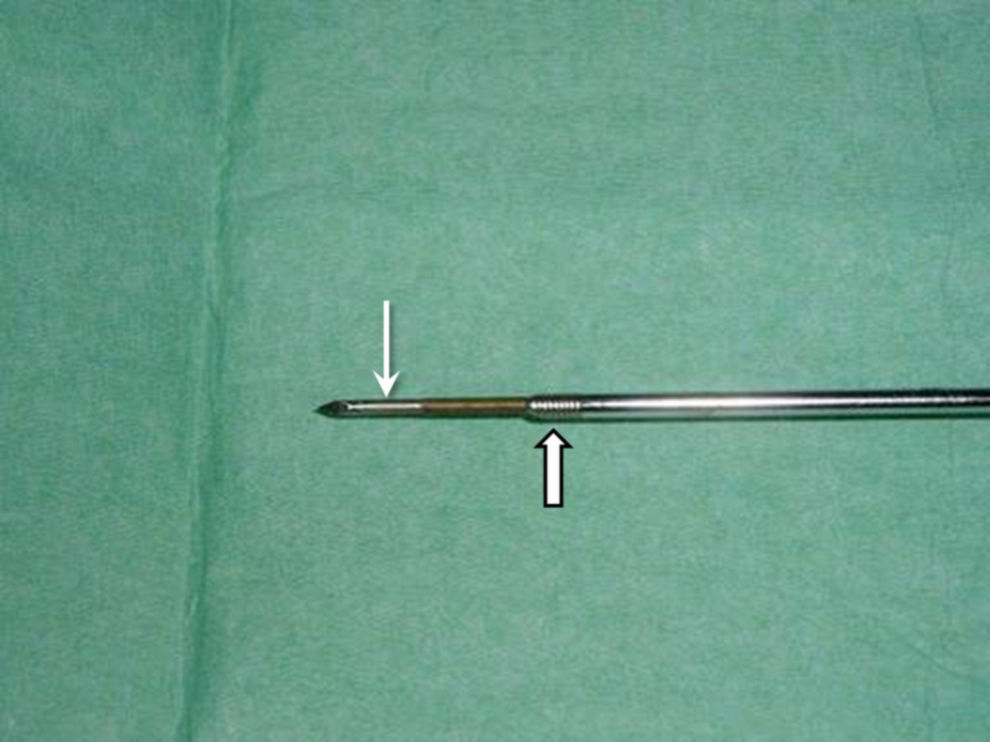
Cuando ya estamos en el centro del nidus, retiramos la guía interna e introducimos la aguja de RF. Empleamos agujas de 15cm de longitud con una punta expuesta de 7 o 10mm y un grosor de 17G. Estas agujas tienen capacidad de refrigeración interna, aunque en la actualidad no solemos emplear esta prestación. Un paso importantísimo en el procedimiento es comprobar que la punta activa del electrodo no contacta con la aguja de biopsia (fig. 2) Para ello retiraremos la aguja de biopsia todo lo posible y hacemos un control para comprobarlo.
Podemos llevarnos la sorpresa, en función de la aguja de biopsia utilizada (más larga de 13cm), de que sí contacten. Tenemos 2 soluciones: retirar la aguja de biopsia y buscar el orificio de entrada con el electrodo o bien cambiar la aguja por otra más corta. Si descuidamos este aspecto, dicho contacto provocaría que toda la aguja de biopsia se transforme en “electrodo activo”, con la consiguiente quemadura en partes blandas y en la piel.
Una vez que tenemos el electrodo en el centro del nidus estamos listos para conectar el generador de RF. Utilizamos el modo manual para alcanzar 90°C durante 4min. Sólo realizamos refrigeración interna cuando el OO es grande (más de 10mm) o cuando no hemos logrado posicionar el electrodo en el centro de la lesión, con el objeto de incrementar el diámetro de la circunferencia de necrosis. Si hemos optado por ello, pasados los 4min de RF, y sin retirar el electrodo, comprobamos que se alcanza una temperatura de 45°C. En lesiones de mayor tamaño podemos realizar un segundo pase tras recolocar el electrodo, pues está demostrado que disminuye de forma notable la tasa de recidivas43.
El paciente es vigilado en el hospital de día. En la mayoría de los casos, puede irse de alta esa misma tarde. En algunas situaciones, el manejo del dolor requiere medicación intravenosa y prolongar el ingreso 24h. Nunca hemos tenido que mantener a un paciente ingresado más de ese tiempo.
Desde un primer momento, el paciente puede hacer vida normal, incluyendo caminar, sea cual sea la localización del OO. Sólo aconsejamos restringir la actividad física deportiva durante 6–8 semanas, cuando la lesión se localiza en un hueso de carga o en la columna vertebral.
Seguimiento y evoluciónUna vez dado de alta, mantenemos contacto telefónico con el paciente a los 7–10 días y volvemos a verlos a los 2 y a los 12 meses. Si está asintomático, no solemos realizar ninguna prueba de imagen hasta el año, cuando repetimos una radiografía y una TC. Hay autores que también suelen realizar una RM a los pocos días de la realización de la ARF44, pero es un proceder que no solemos emplear: los hallazgos radiológicos suelen ser tan floridos que podrían llegar a asustarnos cuando, insistimos, lo que nos debe guiar en nuestra actitud es el control del dolor.
En un 80% de casos la imagen del nidus ha desaparecido en la TC del año. En el resto, pese a que el paciente está completamente asintomático, persiste dicha imagen15. Todos estos pacientes son adultos y podríamos explicar este hallazgo por la menor capacidad de regeneración ósea.
La mayoría de los pacientes están libres de dolor en las primeras 24–48h. A los 7 días, más del 95% está asintomático. Nosotros damos un plazo de 1 mes para decidir si el tratamiento ha sido un éxito o no.
En nuestra casuística, sólo un 3% de pacientes presentó clínica más allá de las 4 semanas. En esta circunstancia, repetimos la gammagrafía ósea que, si es positiva, va seguida de una nueva TC. Si se confirma que el OO persiste, lo indicado es repetir la ARF. El porcentaje de curación en nuestra serie de pacientes con OO es del 100%. No hemos tenido ningún paciente que, tras estar libre de enfermedad, haya vuelto a presentar la misma clínica. Es decir, nuestro porcentaje e recurrencias es cero.
ComplicacionesLa complicación más temida de la ARF es la de provocar una lesión por necrosis en estructuras vasculonerviosas. Debemos procurar que queden a más de 1cm de la punta del electrodo pero, según nuestra experiencia, podemos reducir este margen si hay cortical ósea sana interpuesta.
Otra situación indeseable es la aparición de necrosis cutánea por el contacto de la aguja de biopsia, tal como se ha explicado anteriormente.
Cuando el OO se localiza en una articulación, puede aparecer una sinovitis reactiva que acompaña de dolor importante y requiere tratamiento médico.
ContraindicacionesAunque es una situación infrecuente, si no podemos asegurar la realización de la ARF sin provocar efectos secundarios importantes, debemos abstenernos de hacerla.
Si el paciente es portador de un marcapasos o cualquier otro dispositivo similar, tenemos que determinar si su funcionamiento puede verse afectado por la corriente eléctrica. Afortunadamente, el rango de edad en el que aparecen estos tumores difiere del de los pacientes portadores de estos dispositivos.
Osteoma osteoide localizado en la columna vertebralEsta localización no es infrecuente (en nuestra serie alcanza el 15% de los casos) y reúne una serie de connotaciones especiales: el tumor puede estar próximo a estructuras nerviosas, ya sea una raíz o el propio cordón medular, por lo que hay que tomar precauciones especiales.
Algunos autores abogan por no realizar ARF en esta localización34, pero en la bibliografía sí que hay casos de pacientes con OO en la columna vertebral que han sido tratados con éxito y sin complicaciones45–48.
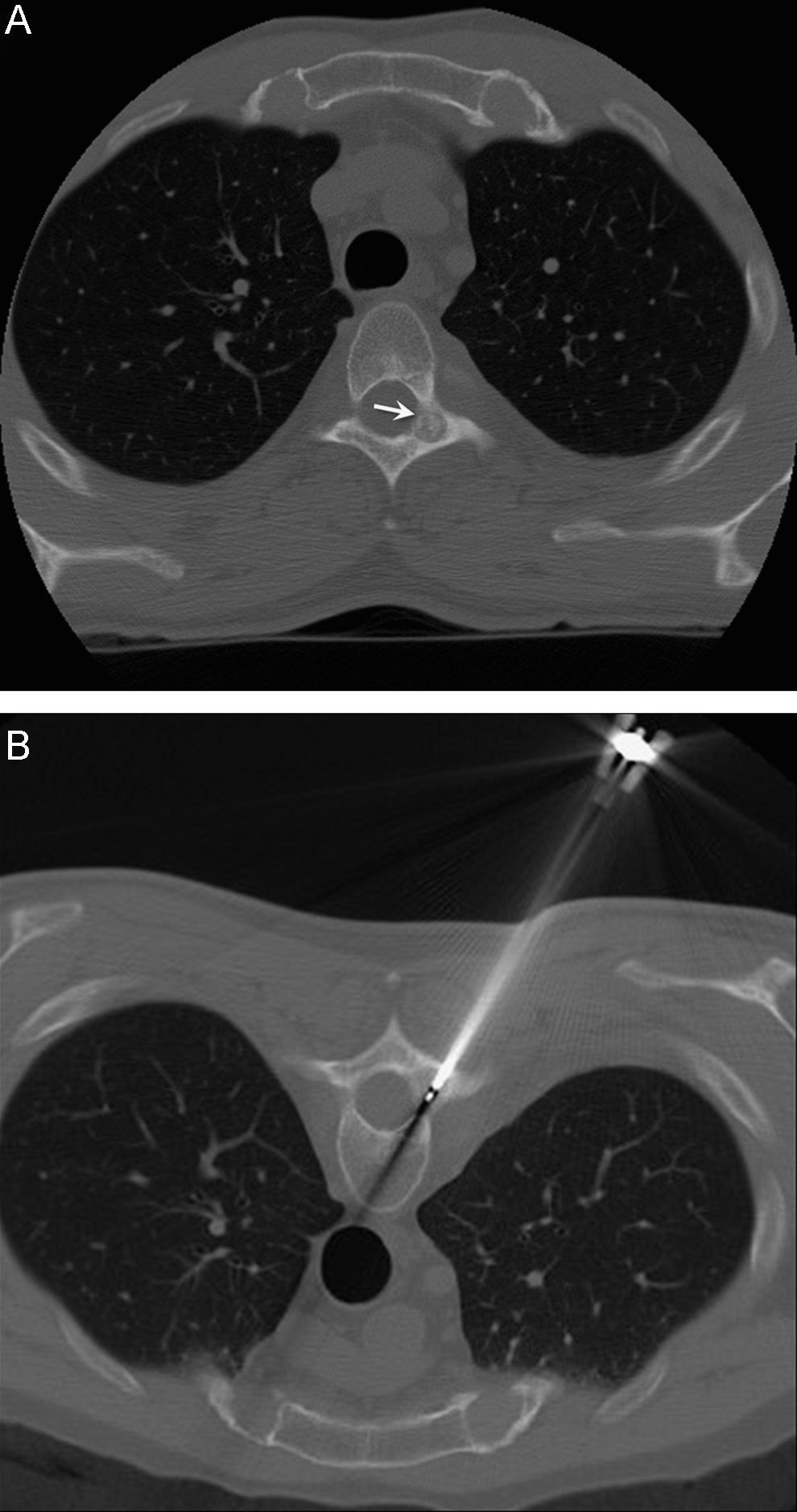
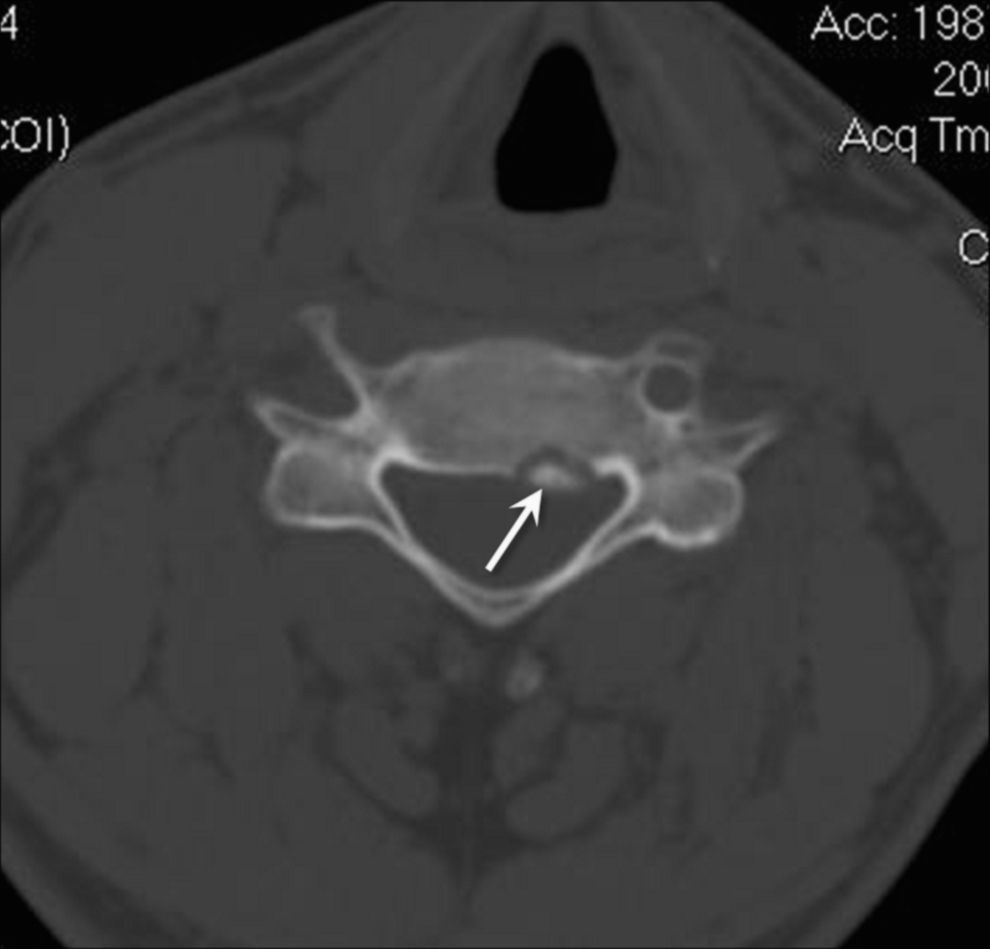
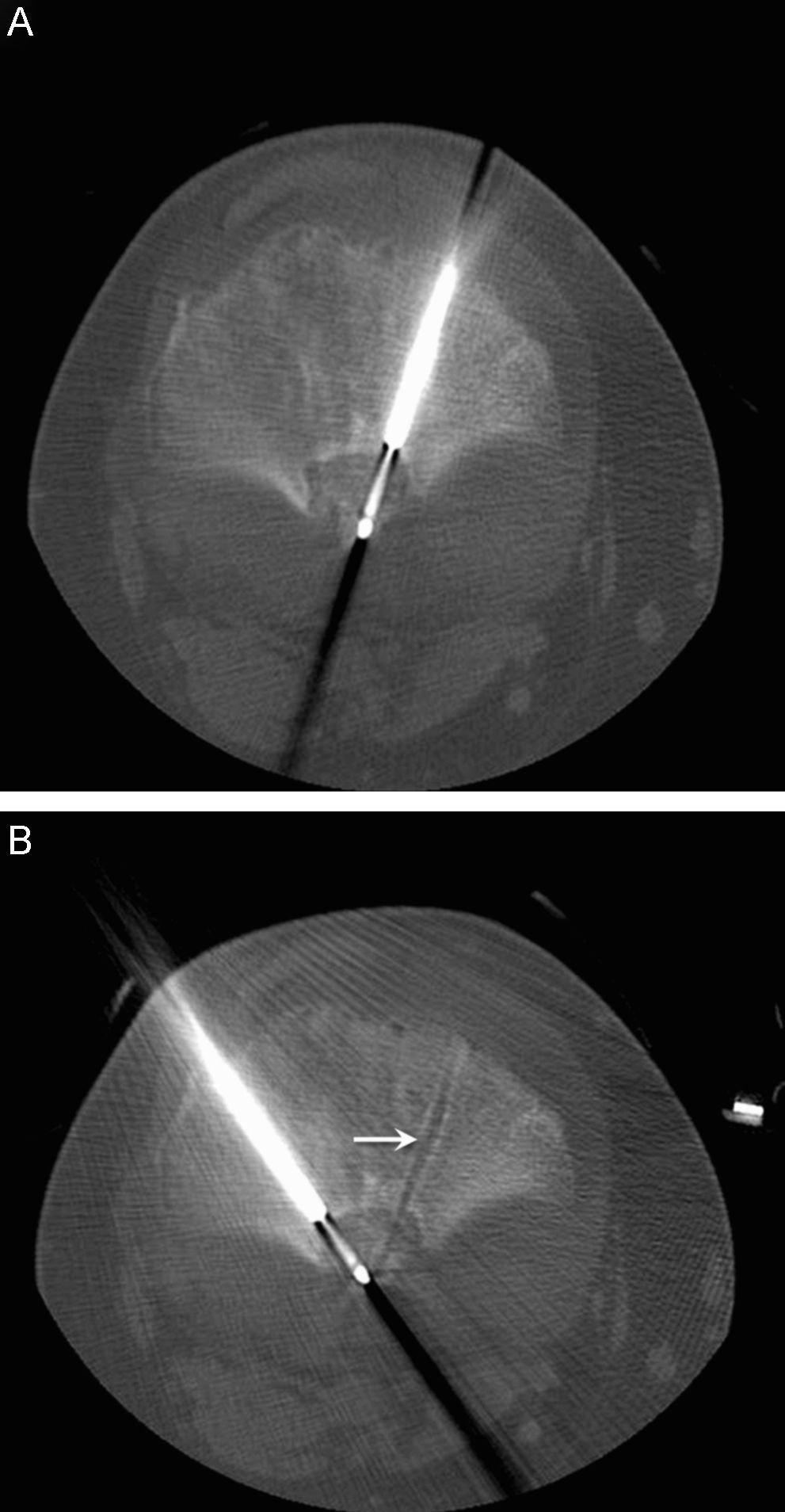
Hay algunos estudios experimentales en los que se ha investigado la distribución del calor dentro del hueso y cómo es posible que se afecten tejidos blandos o estructuras vasculonerviosas adyacentes25–27,49–53. Los resultados son dispares. De nuestro propio estudio sobre el efecto in vivo de la RF en huesos de perros, dedujimos que si existe una cortical intacta entre el OO y otras estructuras, la cortical actúa como barrera e impide lesionar más allá de ésta, por lo que, a nuestro juicio, siempre que exista esta condición (para lo cual debemos realizar cuidadosas reconstrucciones con la TC en los 3 planos) es factible aplicar RF a un OO ubicado en la columna vertebral54 (fig. 3). Hemos tratado 15 casos y sólo nos hemos encontrado ausencia de cortial de seguridad en 1 caso, ubicado en el aspecto posterior de la quinta vértebra cervical (fig. 4).
Este tumor es bastante más infrecuente que el OO, del cual, en muchas ocasiones, es difícil de diferenciar incluso histológicamente. Por ello se suele establecer el límite de 15mm de tamaño, por encima del cual hablamos de osteoblastoma. La distribución por sexo y edad es idéntica.
Se suelen localizar en la columna vertebral (casi la mitad de los casos), el fémur proximal y el astrágalo. Las características radiológicas también son similares a las del OO, pero con la peculiaridad de que pueden ser localmente agresivos, llegando incluso a destruir la cortical, y con importante afectación de partes blandas y marcado edema óseo.
Antes de plantearnos utilizar la ARF para tratar un osteoblastoma, debemos tener su confirmación histopatológica y realizar una correcta planificación del procedimiento, porque suele ser necesario realizar al menos 2-3 pases de RF para asegurar la completa destrucción del tumor. También conviene recordar que si hay destrucción cortical, hay que ser muy cuidadosos para evitar daños en estructuras vecinas o, llegado el caso, derivar al paciente para que sea tratado quirúrgicamente.
En el seguimiento de estos pacientes debemos de estar más pendientes que en los casos de OO, ya que la posibilidad de que haya que realizar un segundo procedimiento es, teóricamente, más elevada y debemos vigilar que no aparezcan recidivas. Su duración debería prolongarse por lo menos hasta los 5 años (que es el que se lleva a cabo cuando el tumor se trata quirúrgicamente).
Nuestro grupo ha tratado 2 casos de osteoblastoma, uno localizado en la columna lumbar (con 2 pases de RF) y otro en el sacro (se completaron 4 pases de RF para asegurar la destrucción de la lesión) (fig. 5). No hemos encontrado referencias bibliográficas que recojan la experiencia de otros autores.
A) Lesión lítica en hemisacro derecho (flechas), se comprueba mediante biopsia percutánea que se trata de un osteoblastoma. B) Dado el tamaño de la lesión, se realizaron hasta 4 pases para asegurarnos de su total destrucción (Procedimiento realizado junto al Dr. Ricard Pérez en el Hospital Universitario Germans Trías i Pujol.)
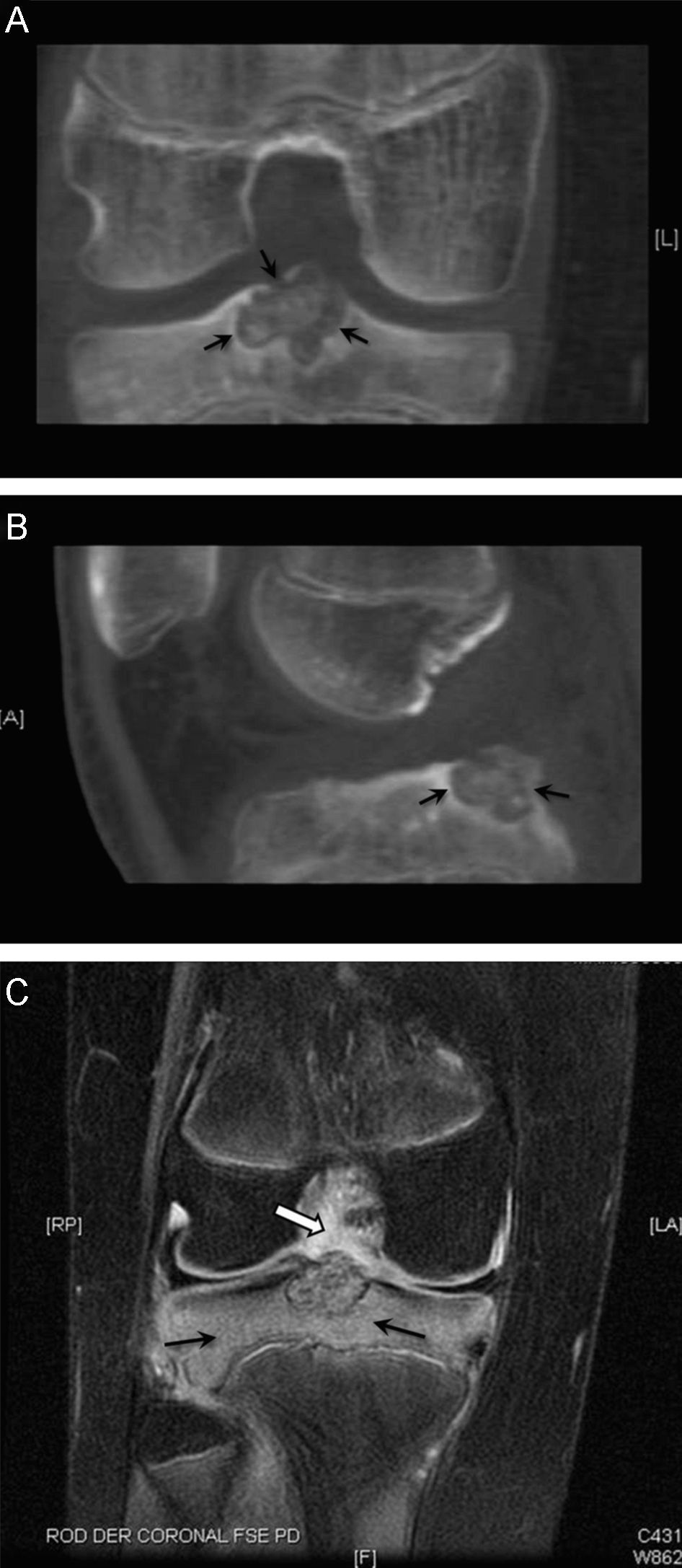
El condroblastoma es un tumor benigno raro55, de estirpe condral y que casi siempre se localiza en la epífisis de los huesos largos. En la radiografía simple se manifiesta como una lesión lítica bien definida y de borde escleroso, de hasta 4cm de tamaño. La presencia de calcificaciones puede ponerse de manifiesto hasta en un 75% de casos si se estudian con TC. Puede extenderse a la metáfisis y complicarse con una fractura. Es más frecuente en varones en la segunda década de la vida. Con RM, la lesión suele ser hipointensa, en las secuencias potenciadas en T1 y también hipointensa, pero heterogénea, en las secuencias potenciadas en T2. El edema óseo y de partes blandas suele ser muy llamativo y ayuda a establecer el diagnóstico diferencial con otras lesiones que se localizan en la epífisis (fig. 6). El dato clínico más constante es el dolor.
A) Tomografía computarizada (TC), imagen coronal: lesión lítica bien definida en la epífisis tibial (flechas), presenta calcificaciones en su interior. B) TC, imagen sagital: la lesión es muy posterior (flechas) en relación con la inserción del ligamento cruzado posterior. C) Resonancia magnética, corte coronal T1 con supresión grasa y tras administrar gadolínio. La lesión realza de forma notable y se acompaña de un edema óseo importante (flechas) y extensa sinovitis (flecha gruesa).
Al ser un tumor benigno, con un abordaje quirúrgico complejo y con una tasa de recidiva posquirúrgica de hasta el 20%, podemos considerar este tumor como potencialmente tratable con ARF. Indudablemente, el primer paso que hay que seguir es confirmar histológicamente que se trata de un condroblastoma. La biopsia permite establecer el diagnóstico diferencial con el tumor de células gigantes y el condrosarcoma de células claras, aunque este último aparece en pacientes de mayor edad. Se puede hacer coincidir la toma de muestra y la realización de la ARF en un único procedimiento.
La decisión de aplicar la ARF a un condroblastoma debe llevarse a cabo de forma individualizada, conociendo muy bien la técnica y planteando la posibilidad, que en nuestros 3 casos siempre ha existido, de tener que realizar varios pases con el electrodo para asegurar la completa destrucción del tumor. Algunos autores han publicado sus resultados con el uso de electrodos expandibles tipo “paraguas”56, pero hay escasa bibliografía al respecto57–59.
En los 3 casos que hemos tratado mediante ARF, siempre hemos utilizado electrodos de 1cm de punta expuesta y hemos empleado la refrigeración interna para alcanzar esferas de necrosis de mayor tamaño (fig. 7).
A) Tras confirmar histológicamente que se trata de un condroblastoma, realizamos 3 pases con un electrodo de 1cm de punta activa. B) En esta imagen de tomografía computarizada se identifica el electrodo en el interior de la lesión y el trayecto del electrodo colocado previamente (flecha).
La respuesta clínica, desaparición del dolor, se produce en las primeras 24–48h. Realizamos un estrecho seguimiento, con controles de imagen (radiografía y RM) cada 3 meses el primer año y anuales hasta el cierre del cartílago de crecimiento.
Otros tumores óseosAlgunos autores suelen hacer biopsia sistemáticamente antes de realizar la ARF, pero no esperan al resultado de la anatomía patológica para realizar dicha técnica, por lo que luego, al conocer el informe histopatológico, pueden encontrarse con la sorpresa de que, creyendo tratar un OO, han tratado de forma efectiva otro tipo de lesión. De hecho, el primer condroblastoma que se trató con RF lo fue de esta manera accidental57.
En la bibliografía hemos encontrado un artículo con 2 casos de granuloma eosinófilo tratados con ARF60, también de cordomas61 y de algunos tumores de partes blandas. Nosotros hemos tratado una recidiva de un tumor de células gigantes en una cuña del pie.
Aunque no lo hemos incluido dentro de los temas de esta actualización, no podemos dejar de mencionar que la ARF también se puede utilizar para el tratamiento de metástasis óseas62,63. Dentro de las diversas estrategias terapéuticas para el manejo del dolor que provocan las metástasis óseas, se ha demostrado que la ARF provoca una disminución sustancial del dolor óseo secundario a una metástasis lítica. Incluso en ciertos pacientes podemos proponer la realización de la ARF con intenciones curativas. Algunos grupos abogan por combinar RF e inyección de cemento cuando la metástasis es grande y hay riesgo de fractura tras la aplicación de la RF.
ResumenLa ablación percutánea empleando RF y guiada por TC ha demostrado en estos últimos años ser una técnica altamente eficaz y segura para el tratamiento del OO en más del 95% de los casos. Que todavía haya centros que intervengan quirúrgicamente los OO demuestra las dificultades que tienen las nuevas técnicas, en general, para ser implantadas y el desconocimiento que hay todavía hoy en día de la ARF.
En casos seleccionados, también es útil para tratar otros tumores óseos benignos como el osteoblastoma, el condroblastoma, el granuloma eosinófilo, etc. Es una herramienta más en el manejo del dolor secundario a metástasis.
Las futuras aplicaciones de esta técnica dependerán, sobre todo, del desarrollo de generadores más potentes que permitan destruir de forma eficaz lesiones de mayor tamaño.
No podemos olvidar que el éxito de estos procedimientos está relacionado con el desarrollo de equipos multidisciplinarios.
Declaración de conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.