Introducción
Las fugas representan la principal complicación en el tratamiento endovascular de los aneurismas de aorta abdominal (AAA): las fugas de los tipos I (fuga directa) y III (dislocación) se producen en los sitios de anclaje de la prótesis y se deben prevenir (elección adecuada del aneurisma y de la prótesis) o tratarse de forma inmediata mediante la colocación de extensiones. En ocasiones, la dislocación se debe a cambios en la morfología del aneurisma tratado. Las fugas del tipo II y la denominada "endotensión", se deben al relleno y presurización del saco aneurismático a través de sus arterias colaterales permeables; las más importantes son la arteria mesentérica inferior y las arterias lumbares. Este tipo de fugas se deben prevenir mediante la embolización o ligadura de las arterias responsables antes de la colocación de la prótesis, o tratarse, siempre que hayan signos de presurización del saco, como es su crecimiento, mediante embolización selectiva, ligadura quirúrgica o llenado del saco con sustancias esclerosantes1-3.
Además de las fugas, hay otros 2 factores que pueden modificar la evolución del aneurisma: la fatiga de los materiales sometidos a un movimiento continuo (metal/tela) y los cambios morfológicos que se producen en los aneurismas sellados que disminuyen de tamaño, tanto en diámetro como en longitud, dando lugar a angulaciones y acortamientos de las prótesis. Esto último ha sido más evidente en los casos tratados con endoprótesis de primera generación4.
En el presente estudio hemos planteado la manera de estabilizar el saco aneurismático en el momento de colocar la endoprótesis, cerrando además el origen de las arterias colaterales existentes. Para ello se ha diseñado un modelo animal experimental de AAA que mantiene permeables las arterias lumbares, tiene un volumen suficiente (alrededor de 9 ml) y cuello proximal y distal adecuados (cerca de 2 cm) como para permitir su sellado mediante endoprótesis. La estabilización del aneurisma se consigue, justo después de colocar la prótesis aórtica, rellenando su cavidad con sustancias introducidas a través de un catéter vascular. Estas sustancias ocupan el saco aneurismático y penetran en las arterias colaterales ocluyéndolas proximalmente, estabilizando así su evolución natural.
Material y métodos
El trabajo se ha desarrollado en su totalidad en el Departamento de Patología Animal de la Facultad de Veterinaria de la Universidad de León, siguiendo todos los requisitos establecidos para estudios de experimentación animal5.
El AAA se ha creado cosiendo a la cara anterior de la aorta infrarrenal un parche de dacron, de tal manera que, además de obtener un aneurisma de tamaño considerable, han quedado permeables las arterias lumbares. Posteriormente, se excluyó el aneurisma de la circulación mediante la colocación de una prótesis endovascular recubierta tipo passager (Boston Scientific Corporation) mientras se dejaba en el interior del saco, entre elstent y la pared aórtica, un catéter 4F por el que posteriormente se han perfundido, hasta rellenar dicho saco, los materiales de embolización: ethibloc (Johnson & Johnson) y onix (EV3, MTI).
Se realizaron controles inmediatos con angiografía digital y tomografía computarizada (TC) a todos los animales y, de manera aleatoria, estudios de resonancia magnética y ecografía Doppler. En todos los casos, después de la extracción de la pieza se han efectuado estudios anatomopatológicos macroscópicos y microscópicos.
Primera fase
En la primera fase se han empleado 10 cerdos híbridos industriales denominados Large White, hembras, de entre 50 y 60 días y con un peso que oscilaba entre los 18 y los de 20 kg.
Desde el día anterior al procedimiento han sido tratados con amoxicilina a dosis de 300 mg intramusculares cada día, que se ha mantenido hasta 7 días después de la intervención. Se utilizó profilaxis con antiagregantes plaquetarios (Trifusal®) a dosis de 300 mg vía oral cada 24 h. Previo a la cirugía fueron premedicados con una dosis única de 80 mg de Stremil® (azaperona) por vía intramuscular 30 min antes de la inducción anestésica y posteriormente trasladados a la mesa de quirófano y colocados en decúbito dorsal. Para realizar la anestesia se han introducido 100 mg de Nokemyl® (metomidato) y 0,3 mg de atropina a través de una vena del dorso de la oreja. Tras la colocación de un tubo endotraqueal de 6 mm se ha mantenido anestesia con halotano a dosis de entre el 0,8 y el 1,5 %.
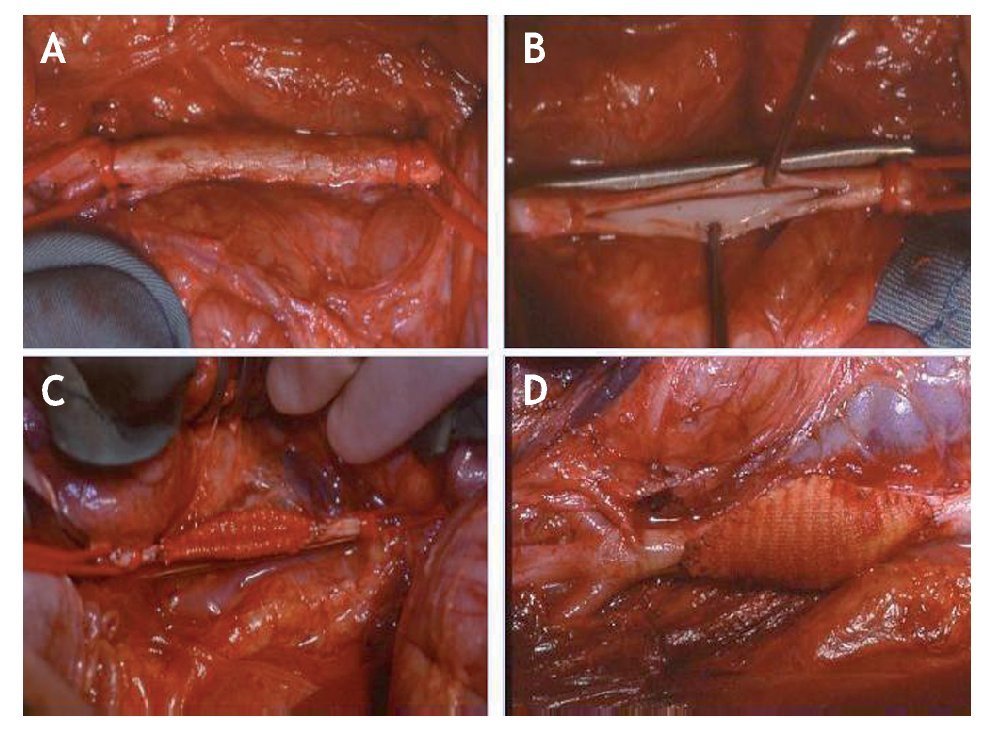
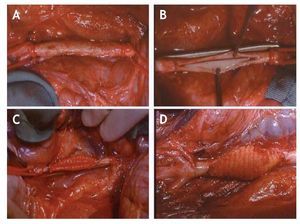
La técnica quirúrgica ha consistido en una laparotomía media amplia, evisceración del paquete intestinal y apertura del retroperitoneo para exponer la aorta desde las arterias renales hasta sus ramas terminales, que en el cerdo son 5. Después de pasar lazos a la aorta a niveles proximal y distal se ha procedido a realizar una heparinización sistémica con una dosis única intravenosa de 20 mg de heparina sódica. Posteriormente, se ha colocado una pinza lateral en el tercio anterior de la aorta dejando libres los dos tercios posteriores con las arterias lumbares permeables. Se ha realizado una apertura longitudinal de 4 cm de longitud en la cara anterior de la aorta, dejando unos 3 cm de aorta respetada desde las arterias renales y hasta el cono terminal. Mediante sutura continua con monofilamento de 6 ceros se ha colocado un parche de dacron de forma romboidal con diámetro > 4 cm y < 2,5 cm. Una vez terminada la sutura se ha liberado la pinza, realizado hemostasia y comprobado la permeabilidad del injerto. El tamaño aproximado del aneurisma producido fue de unos 40 ´ 2,5 ´ 30 mm (fig. 1).
Figura 1 Secuencia de la creación del modelo de aneurisma de aorta abdominal. A) Disección quirúrgica de la aorta abdominal. B) Pinzamiento del tercio superior de la aorta y realización de arteriotomía longitudinal. C) Sutura de parche romboidal de dacron. D) Resultado final del aneurisma creado.
Sin cerrar el abdomen se efectuó disección de las 2 arterias femorales. Con ellas expuestas se colocaron introductores vasculares mediante técnica de Seldinger. Por la arteria femoral derecha se introdujo un catéter multipropósito 4F o un catéter coaxial de menor calibre hasta dejar su extremo distal en el interior del saco aneurismático, mientras que por la arteria femoral izquierda se avanzó el introductor vascular de una prótesis recubierta tipo passager hasta su posición de liberación. Después de hacer una arteriografía para localizar las arterias renales y el comienzo del aneurisma, con el extremo del catéter multipropósito en el interior del saco aneurismático, se liberó una prótesis passager de 100 mm de longitud ´ 10 mm de diámetro, de tal manera que el aneurisma quedó excluido de la circulación. Sin embargo, inyecciones de contraste efectuadas por el catéter de diagnóstico en el interior del saco aneurismático rellenaban dicho saco así como arterias lumbares colaterales, sin observarse fuga de contraste. Entonces se procedió a la introducción, a través del mismo catéter, de la sustancia embolizante en la cantidad suficiente para rellenar el saco en su totalidad, así como las arterias lumbares.
A pesar de sus diferentes características estructurales, los materiales empleados se introdujeron sin problemas a través del catéter vascular o de un catéter coaxial y fue posible controlar el volumen de sustancia embolizante gracias a su radiopacidad, de tal manera que la inyección se interrumpió cuando el aneurisma y el origen de las ramas lumbares se veían rellenos.
Posteriormente se realizó una angiografía digital de control para objetivar la permeabilidad de la aorta y la ausencia de fugas.
Sin dejar drenajes, se procedió al cierre por planos con sutura reabsorbible en el peritoneo, el plano muscular y el subcutáneo. La piel se cerró con seda.
Una vez terminado el procedimiento y suspendido el halotano se dejó despertar espontáneamente al animal sin la utilización de fármacos. Transcurridos 15 min aproximadamente y recuperada la respiración espontánea, se retiraron la intubación endotraqueal y la vía venosa.
Se realizaron curas diarias de la herida quirúrgica con antiséptico local y los puntos de piel se retiraron pasadas 2 semanas. Todos los animales tole raron alimentos sólidos a las 24 h del procedimiento.
Debido al rápido crecimiento de este tipo de animales, se sacrificaron para su análisis al mes de la intervención. Previamente se realizaron estudios de TC, resonancia magnética (RM) y ecografía Doppler. Posteriormente se efectuó el análisis morfológico de la pieza anatómica e histopatológico de los tejidos implicados.
Después de esta primera fase se dejó, in vitro, durante 1 año una prótesis vascular recubierta tipo passager en contacto permanente con ethibloc y con onix, para valorar su posible alteración estructural.
Segunda fase
Se realizó el mismo trabajo, en el mismo centro de experimentación, pero con 2 diferencias importantes: la primera es que el animal objeto de nuestro estudio fue la oveja en edad adulta, por tanto más estable, lo que ha permitido hacer un análisis a más largo plazo; la segunda es que el material de embolización que se empleó fue únicamente onix.
El onix es etilen-vinil copolímero disuelto en dimetil sulfóxido. Se trata de un compuesto líquido que lleva polvo de tántalo micronizado, lo que le proporciona radiopacidad. Este líquido, que se puede introducir a través de un catéter, se solidifica en contacto con una solución acuosa como la sangre, dando lugar a su cambio de estado.
Para este segundo estudio se utilizaron 10 ovejas adultas de raza gallega, con un tamaño de entre 30 y 45 kg. Se aislaron y dejaron en ayunas 2 días antes del tratamiento. La premedicación y la inducción anestésica fueron semejantes a las que se realizaron con los cerdos, aunque la oveja demostró ser más lábil y de más complicado manejo farmacológico.
La técnica quirúrgica también fue similar, con la diferencia de que el aparato digestivo de la oveja, mucho más voluminoso y complejo, dificultó el acceso al campo quirúrgico aórtico. El diámetro de la aorta de la oveja es de unos 9 mm y la distancia desde las arterias renales hasta el cono distal de unos 14 mm. Por lo demás, el proceso de la realización quirúrgica del aneurisma fue similar al del cerdo.
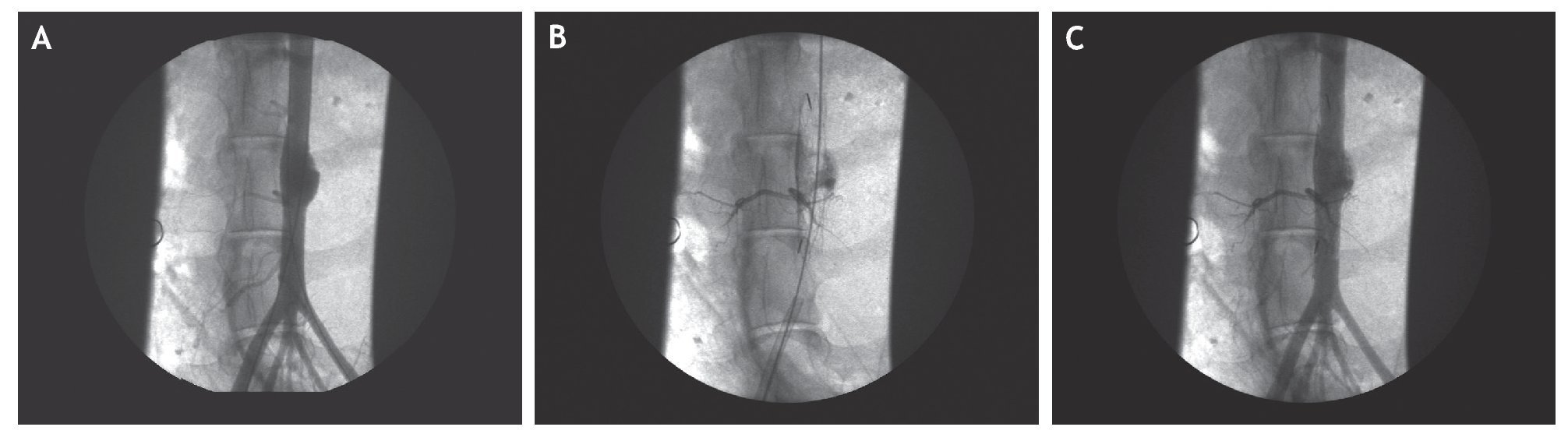
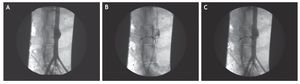
El procedimiento endovascular se realizó por punción percutánea de las 2 arterias femorales: en la derecha, a través de una guía rígida, se colocó en posición el introductor de la prótesis recubierta passager de 100 ´ 10 mm; mientras que en la izquierda, a través de un introductor vascular 5F, se introdujo un microcatéter cuyo extremo distal quedó colocado en el centro del saco del aneurisma. Con el microcatéter en dicha posición se desplegó la prótesis cubriendo y sellando el aneurisma, lo que se demostró en todos los casos por inyección de contraste en aorta infrarrenal (fig. 2).
Figura 2 Secuencia de exclusión del aneurisma de aorta abdominal (AAA). A) Arteriografía del AAA. Se observa una guía a través de cada arteria ilíaca. B) Una vez excluido el aneurisma se inyecta onix a través del microcatéter rellenándose el saco y 2 arterias lumbares. C) Por último, se comprueba la permeabilidad de la aorta y sus ramas.
La preparación del onix requiere un agitador para mantener el copolímero líquido antes de inyectarlo. Previo a su introducción se sella el microcatéter con dimetil sulfóxido y a continuación se inyecta lentamente el onix. Los polvos de tántalo que lleva en suspensión permiten su visualización directa con radioscopia6.
El cierre de la herida quirúrgica y el proceso post-operatorio fue similar al del grupo de cerdos.
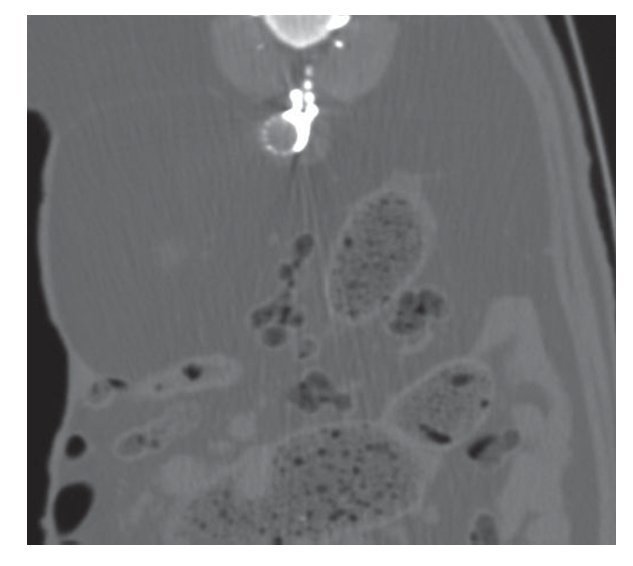
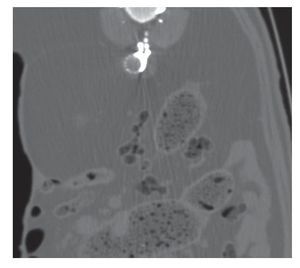
A todos los animales se les realizó estudio angiográfico, con y sin sustracción digital, antes y después de haber sido tratado el aneurisma. También se realizaron, de manera aleatoria, estudios de ecografía Doppler color, TC y RM (fig. 3).
Figura 3 Imagen de tomografía computarizada abdominal en la que se muestra un corte axial a la altura de las arterias lumbares. Se visualiza onix depositado en el saco aneurismático y también en el interior de las arterias lumbares.
Con intervalos que oscilaron entre el mes y el año se procedió a la eutanasia de los animales, con anestesia general, mediante sobredosis de fenobarbital. El aneurisma se explantó en bloque desde las arterias renales hasta la bifurcación ilíaca. En todos los casos se realizó estudio macroscópico e histopatológico de la pieza quirúrgica con especial atención al estado de las arterias lumbares.
En 3 cerdos de la primera fase y en 3 ovejas de la segunda, se realizó el procedimiento en 2 tiempos: primero se hizo el aneurisma y, posteriormente, en una segunda intervención, se efectuó el procedimiento endovascular. Todos los demás se realizaron en el mismo acto quirúrgico, con una sola anestesia.
Mientras que el seguimiento en los cerdos fue limitado por razones de crecimiento del animal, en las ovejas se tuvo la ocasión de valorar los resultados en diferentes períodos, habiendo sido sacrificados 2 animales 1 año después de la intervención.
Resultados
Técnicamente es posible la realización de AAA en animales de experimentación mediante la colocación anterior de un parche de dacron. Este tipo de intervención tiene la ventaja de crear un aneurisma de suficiente tamaño dejando permeables las arterias lumbares. También es técnicamente posible la colocación de una prótesis recubierta, por vía endovascular, para excluir de la circulación en el aneurisma creado.
La supervivencia, tanto a la intervención quirúrgica como al tratamiento endovascular, ha sido del 100 % en los 2 grupos; si bien todos los cerdos han permanecido vivos hasta el momento de su análisis final, mientras que las ovejas han tenido una mortalidad postoperatoria del 50 % debida a una mayor labilidad para la anestesia.
Se han producido paraplejias tanto en el grupo de los cerdos (2 casos) como en el de las ovejas (1 caso). Todas ellas parecen estar relacionadas con el procedimiento quirúrgico, ya que se han presentado en los animales a los que se les había realizado el aneurisma pero no se les había colocado todavía la endoprótesis ni tratado el saco. Se desconoce la causa, aunque en un estudio con RM de uno de los casos se han detectado alteraciones de señal medular compatibles con un proceso isquémico.
Resultados de la primera fase
La primera fase ha servido fundamentalmente para valorar la posibilidad de producir aneurismas que tuvieran un tamaño suficiente y que presentaran arterias colaterales permeables. Debido a que el cerdo es mucho más fácil de manejar, tanto desde el punto de vista anestésico como quirúrgico, nos ha servido de experiencia para afrontar con garantías de éxito la segunda fase del proyecto. De hecho, se consiguió realizar el aneurisma en todos los animales y la supervivencia fue del 100 %. En todos los casos, para crear el saco aneurismático, se colocó un parche de dacron de 4 ´ 2,5 cm en la cara anterior de la aorta infrarrenal, con lo que se produjo un aneurisma de un tamaño aproximado de 4 ´ 2,5 ´ 3 cm, equivalente a un aneurisma de unos 9 ml de volumen.
Se realizó un pinzamiento parcial de la aorta en su pared anterior. De esta forma, de la mayoría de los aneurismas salían al menos 2 arterias lumbares permeables en situación posterolateral, lo que permitió valorar la penetración en ellas de las sustancias embolizantes.
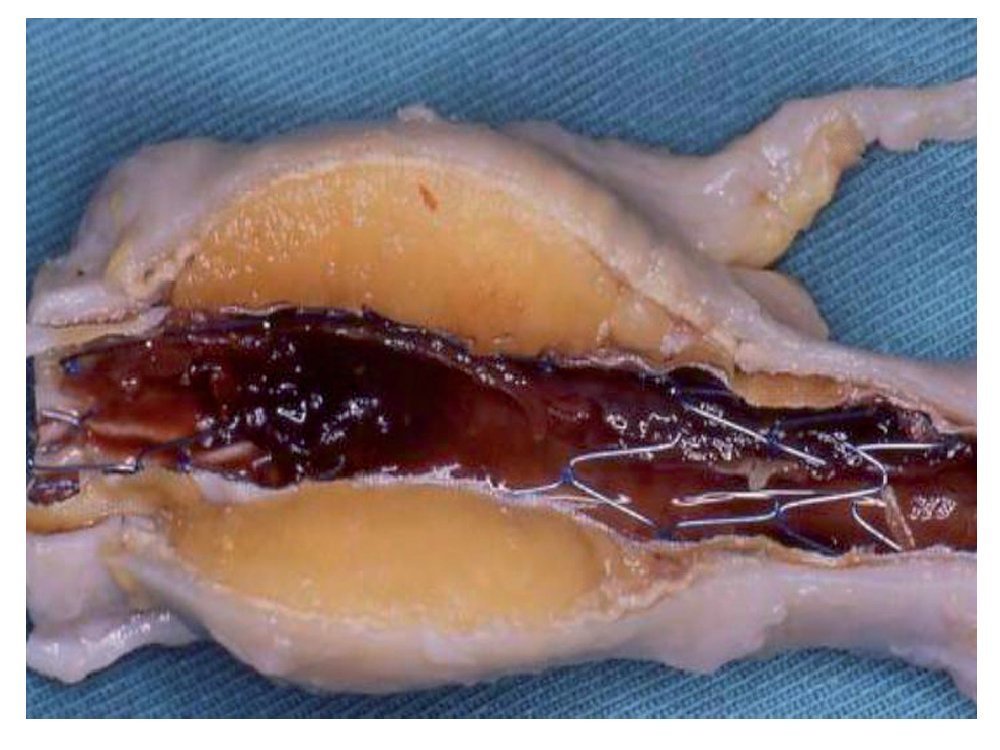
Esta primera fase ha servido también para determinar cuál de los productos de embolización ha sido el más adecuado. De los materiales empleados, el ethibloc se pudo introducir a través de un catéter vascular 4F sin que se observaran fugas periprotésicas, pero la resistencia a la inyección fue mayor y la penetración en las pequeñas arterias lumbares menor. El ethibloc rellenó el saco de forma homogénea (fig. 4). El onix, que se introdujo a través de un catéter coaxial 3F, rellenó el saco aneurismático de forma homogénea y el grado de penetración en las arterias colaterales se pudo controlar parando la inyección durante breves intervalos.
Figura 4 Aneurisma de cerdo, de 3 meses de evolución tratado con ethibloc. Se observa cómo el producto rellena de manera homogénea el saco del aneurisma, entrando en la arteria lumbar.
No se produjeron fugas de material fuera del saco aneurismático en ninguno de los casos y se mantuvo la permeabilidad de la aorta y de sus ramas terminales.
En los estudios de la pieza anatómica, los 2 materiales rellenaron el saco del aneurisma (fig. 4), pero la penetración del onix en las arterias lumbares fue mayor que la del ethibloc.
En el estudio histopatológico, en todos los casos se observó la formación de una neoíntima que cubría toda la superficie interna delstent. La adherencia del material de sellado sobre ésta es mayor con el ethibloc y menor con el onix.
Resultados de la segunda fase
Como consecuencia de los resultados de la primera fase se eligió el onix como material de embolización para el estudio a más largo plazo. Se consiguió realizar el aneurisma en todos los animales y la supervivencia en el postoperatorio inmediato fue del 100 %, si bien en las ovejas hubo una mortalidad postoperatoria tardía del 50 % por su mayor labilidad para la anestesia debida a su configuración anatómica. Las 5 ovejas que fallecieron en el postoperatorio se estudiaron de manera inmediata mientras que las 5 restantes se sacrificaron para su estudio al mes (1 oveja), a los 3 meses (1 oveja), a los 6 meses (1 oveja) y al año del implante (2 ovejas).
El onix se introdujo con control radioscópico a través de un catéter coaxial 3F, rellenando el saco aneurismático de forma homogénea. Su grado de penetración en las arterias lumbares se pudo controlar parando la inyección durante breves intervalos. Por término medio necesitaron 3 ml de onix y 0,4 ml de dimetilsulfóxido (DMSO). No se observaron fugas de material fuera del saco aneurismático en ninguno de los casos y en los controles angiográficos se mantuvo la permeabilidad de la aorta y de sus ramas terminales.
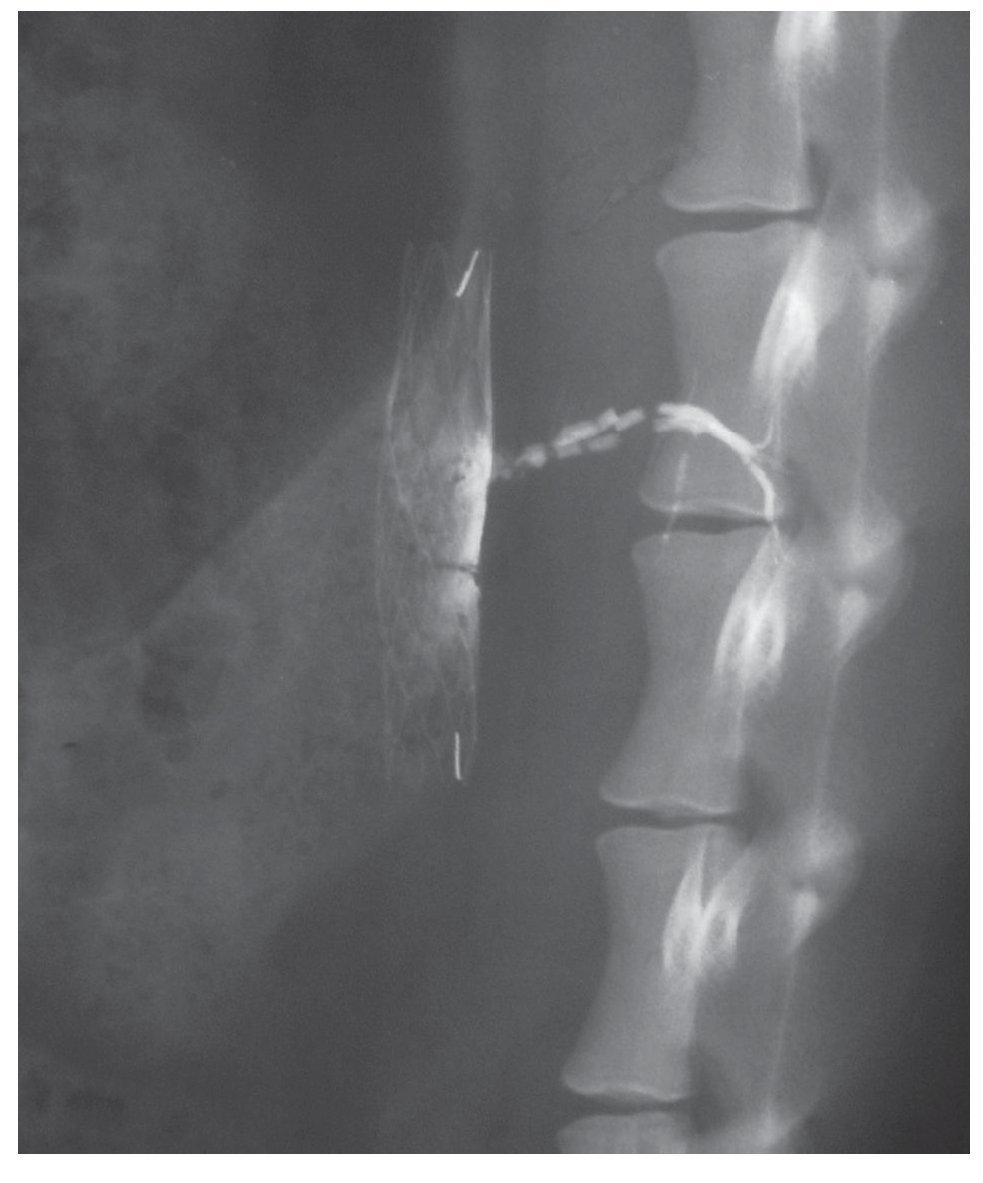
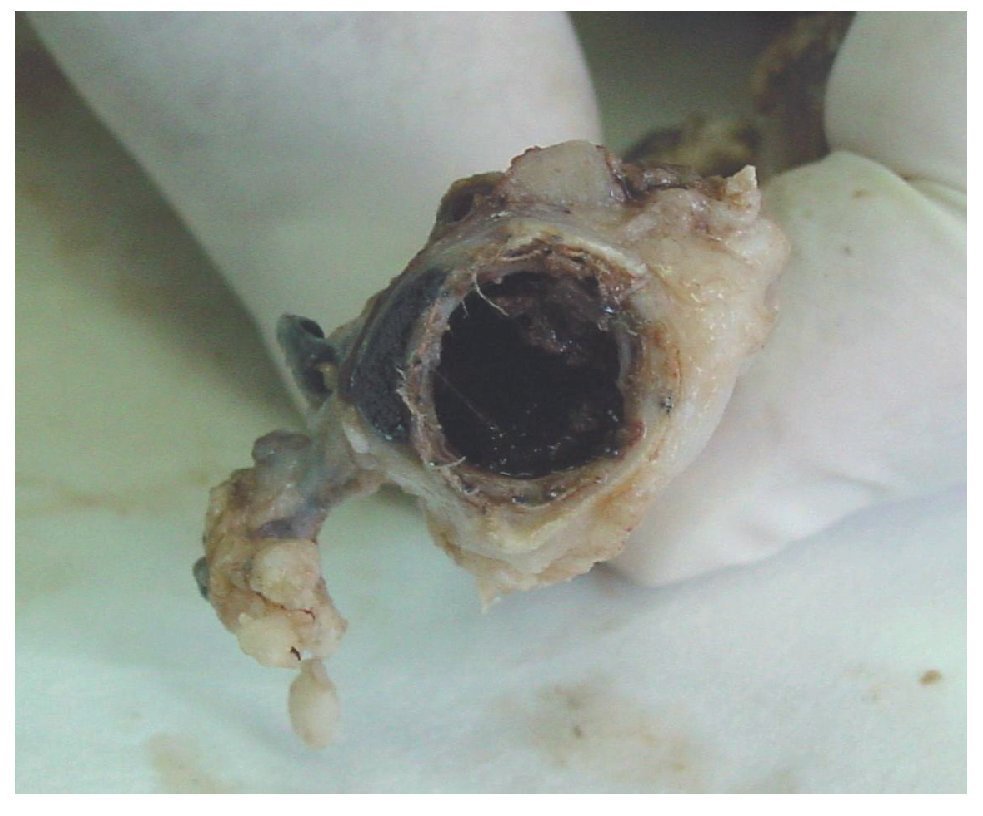
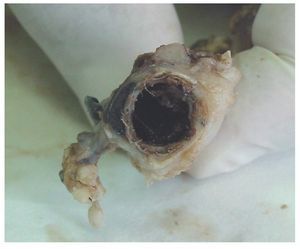
En los estudios de la pieza anatómica explantada el onix rellenó el saco aneurismático de forma homogénea y se mantuvo así en los controles realizados hasta 1 año después (fig. 5). El onix entró en las arterias lumbares y permaneció estable durante todo el tiempo del estudio (fig. 6). Hay una ligera adherencia del material de sellado sobre la pared vascular.
Figura 5 Radiografía simple en proyección lateral del aneurisma de una oveja 1 año después de ser tratado con onix. El onix todavía permanece estable en el interior del saco aneurismático y de las arterias lumbares.
Figura 6 Pieza anatómica del aneurisma de aorta abdominal de una oveja 1 año después de ser tratado con onix. En el corte transversal se aprecia el saco del aneurisma lleno de onix y cómo este ocupa el interior de la arteria lumbar.
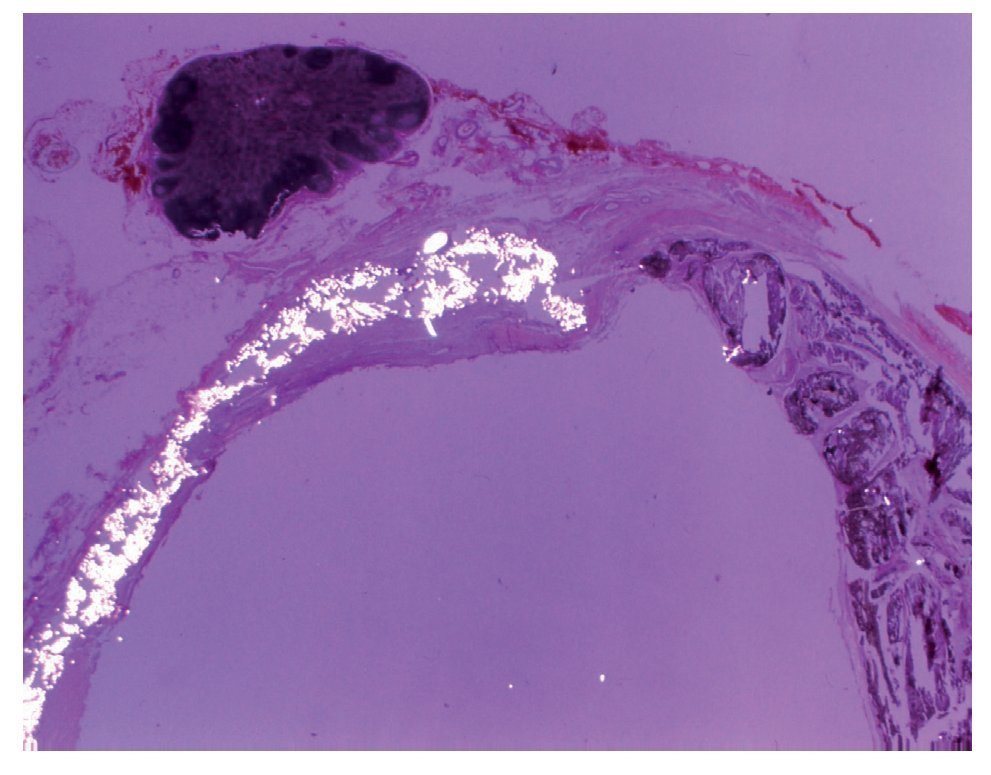
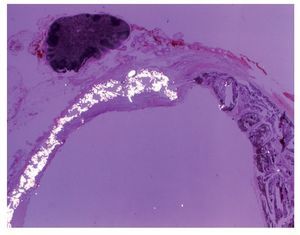
En el examen histopatológico se observó que el onix se comportaba como un material inerte, que apenas produce reacción a cuerpo extraño y tampoco reacción endotelial (fig. 7).
Figura 7 Examen histopatológico: sección transversal de aorta abdominal. El material de la prótesis destaca por su refringencia al ser examinado con luz polarizada. El resto de la pared contiene abundante onix. Por fuera de la adventicia hay un ganglio linfático. El onix llena el espacio situado entre la prótesis y la íntima del vaso.
Por otra parte, en el análisis realizado de las 2 prótesis que se han mantenido durante un año, in vitro, en contacto con ethibloc y onix no se observó ninguna alteración estructural.
Discusión
Desde el punto de vista experimental, se han publicado diferentes modelos de AAA en animales, realizados tanto por vía quirúrgica con tejidos autólogos o sintéticos7-9 como por vía endovascular mediante dilatación con balón de angioplastia soportado por una prótesis vascular10. En los modelos quirúrgicos, tanto por aposición como por interposición, las arterias colaterales se ligan mientras que en los modelos diseñados por Michael10 y por Schoder et al11 las arterias lumbares permanecen permeables consiguiendo un aneurisma 2 veces mayor que la aorta original. También se ha descrito un modelo experimental en perros realizado con parche de vena yugular a nivel abdominal, como en nuestro estudio, o a nivel ilíaco. En esta última localización sería la arteria hipogástrica la que originaría la fuga tipo II12.
En los 2 grupos de animales de nuestro estudio, la longitud de la aorta desde la arteria renal más baja hasta la bifurcación aórtica es mayor de 10 cm. El diámetro de los aneurismas producidos ha sido 4 veces mayor que el diámetro de la aorta, con 4 cm de longitud. Por eso, al colocar una prótesis recubierta de 100 ´ 10 mm hay suficiente superficie para permitir el sellado proximal y distal de un saco aneurismático que conserva unos 24 mm de diámetro máximo. El pinzamiento anterior de la aorta al crear el aneurisma permite el flujo de sangre a su través durante toda la intervención, con permeabilidad de las arterias lumbares, que se visualizan al realizar arteriografía de control en la mayoría de los casos. El aneurisma permanece estable hasta 1 año después de tratado.
Los productos empleados para la estabilización del saco aneurismático son de uso corriente para el tratamiento de lesiones vasculares: aneurismas o malformaciones arteriovenosas.
El ethibloc es una emulsión alcohólica que se emplea por vía endovascular para embolización renal o para el tratamiento de malformaciones vasculares. Se aplica con jeringa, en la que viene precargado, y pasa sin dificultad a través de un catéter vascular. En nuestros casos el ethibloc rellenó el aneurisma con escasa adherencia sobre la prótesis y penetró en el interior de las arterias lumbares. En el estudio a los 6 meses el producto se mantuvo estable en el interior del saco.
El onix está, en principio, diseñado para la embolización de malformaciones arteriovenosas cerebrales, aunque también se ha utilizado para el tratamiento de seudoaneurismas arteriales13. En su estado líquido se puede introducir con facilidad a través de un catéter, pero en contacto con una solución acuosa, como la sangre, se transforma, y cambia de estado, en un material esponjoso que no se adhiere a la pared vascular10. Antes de introducir el onix, el catéter portador debe lavarse con una pequeña cantidad de DMSO para evitar que el compuesto se solidifique en el interior del catéter. En nuestra experiencia, el onix, una vez preparado, se puede inyectar de manera lenta y controlada y se visualiza en radioscopia durante su inyección. Se difunde fácilmente en el interior del saco aneurismático y rellena pronto las arterias lumbares. Si se detiene su inyección durante unos segundos, al volver a inyectarlo tiende a distribuirse hacia otros territorios.
Se ha realizado seguimiento de 2 ovejas que se han mantenido en un rebaño 1 año después de ser tratadas con onix y, en la radiografía simple del abdomen, se ha observado el saco del aneurisma completamente lleno de onix y su penetración en las arterias lumbares (fig. 5). En la TC y en la arteriografía previas a su eutanasia, la aorta se vio permeable y el aneurisma excluido y sellado.
Un inconveniente para la realización de este procedimiento en humanos es el coste económico del onix, debido a la cantidad que haría falta introducir para conseguir el sellado de aneurismas mayores de 5 cm de diámetro. Otros materiales de embolización son, sin embargo, más económicos.
Las fugas representan el principal problema en el tratamiento endovascular de los AAA14,15. Los tipos I y III constituyen un riesgo evidente de rotura por presurización del aneurisma. Se deben prevenir mediante una correcta valoración clínica y anatómica, y tratar, si aparecen, mediante la colocación de extensiones protésicas. Las fugas del tipo II o la expansión del saco en ausencia de fuga demostrable (endotensión) representan un riesgo potencial de rotura del aneurisma15,16. Baum et al16 han demostrado que las fugas tipo II aportan sangre al saco aneurismático con una presión similar a la de la presión arterial, por lo que, para evitar el riesgo de rotura, recomiendan prevenir su aparición antes que tener que tratarlas posteriormente.
Hasta ahora, las alternativas al tratamiento han consistido en la embolización de las arterias lumbares o mesentérica inferior antes o después de la exclusión del aneurisma17. Antes de excluirlo se pueden emplear coils de embolización para ocluir ramas arteriales prominentes que salen del aneurisma y después de su exclusión, también se han descrito cateterismos supraselectivos a través de la arteria mesentérica superior o de arterias ilíacas internas, así como la punción directa del saco con aguja fina para introducir el material de embolización por vía traslumbar18,19. La TC sería la técnica adecuada para medir y comparar el tamaño de los aneurismas antes y después de la embolización, a pesar del artefacto que suelen ocasionar los coils20. El estudio de Baum et al16 compara la eficacia de las técnicas transarterial y translumbar. La embolización transarterial de la arteria mesentérica inferior tiene un 80 % de fallos en comparación con el 8 % en los pacientes tratados con embolización traslumbar. La conclusión de su estudio es que sólo se debe considerar la embolización translumbar directa para el tratamiento de las fugas tipo II. De acuerdo con Baum et al, se propone una técnica capaz de embolizar el saco aneurismático, pero a diferencia de estos autores, nuestra aportación consiste en que la embolización se realiza en el mismo procedimiento de exclusión del AAA.
Dolmatch et al21 han descrito un modelo experimental de aneurisma creado con balón de angioplastia que conserva arterias lumbares permeables.
El aneurisma se trata con una endoprótesis recubierta a la que realizan un pequeño orificio a través del cual introducen onix en el saco sellando las arterias colaterales. A diferencia del nuestro, este modelo no sería repetible en humanos.
La conclusión de nuestro trabajo es que técnicamente hay la posibilidad de estabilizar el saco de un AAA en el momento de ser excluido con una endoprótesis. La ocupación de las arterias colaterales al aneurisma evitará la aparición de fugas tipo II. La técnica, relativamente sencilla, consiste en rellenar el saco del aneurisma con una sustancia que se pueda introducir a través de un catéter vascular. La técnica es independiente del material empleado. De los productos que se usan actualmente para tratamiento endovascular, el onix parece ser el más útil.
Declaración de conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
*Autor para correspondencia.
Correo electrónico:ggarmoll@gmail.com (G. Garzón Moll).
Recibido el 21 de junio de 2007;
aceptado el 14 de enero de 2008