Las urgencias no traumáticas de cabeza y cuello son un reto en el campo neurorradiológico por los motivos referidos en la primera parte: su área de afectación, en la encrucijada del tórax y la cavidad craneal, y su baja incidencia en la urgencia, lo que supone que sean poco conocidas.
Manteniendo el mismo enfoque que en la actualización previa, a partir de las formas clínicas de presentación en el ámbito de la urgencia, en lugar de la división por regiones anatómicas estudiaremos las entidades que se presentan con patrones que combinan tumefacción cervical, disfagia y disnea, y los déficits agudos de los sentidos. Dentro de este último grupo, el síntoma al que haremos referencia específica será el déficit visual, puesto que es el que de forma más frecuente requiere estudio radiológico urgente.
Nontraumatic emergencies of the head and neck represent a challenge in the field of neuroradiology for two reasons. As explained in the first part of this update, these entities affect an area where the thorax joins the cranial cavity and can thus compromise both structures; second, they are uncommon, so they are not well known.
Maintaining the same approach as in the first part, focusing on the clinical presentations in the emergency department rather than on the anatomic regions affected, we will study the entities that present with two patterns: those that present with a combination of cervical numbness, dysphagia, and dyspnea and those that present with acute sensory deficits. In the latter group, we will specifically focus on visual deficits, because this is the most common symptom that calls for urgent imaging studies.
Las urgencias no traumáticas de cabeza y cuello representan un grupo pequeño en el quehacer radiológico; sin embargo, son muy importantes. Como refieren Brucker et al.1, esta región anatómica contiene pocas estructuras que puedan ser prescindibles. El papel del radiólogo, después del análisis de la imagen y tras considerar los datos clínicos, es definir la localización y extensión de los procesos, identificar los signos radiológicos que indiquen un compromiso vital del paciente o condicionen su tratamiento, y establecer un diagnóstico diferencial.
Como se dijo en la primera parte, en la mayoría de los artículos, las urgencias aparecen clasificadas según la región afectada por el proceso patológico, pero el paciente acude a urgencias con unos síntomas o signos clínicos, por lo que resulta interesante un abordaje desde ese punto de vista. En esta revisión haremos referencia a la forma de manejo radiológico y a las características clínicas de aquellas entidades que se presentan con cuadros combinados de tumefacción cervical, disfagia y disnea y de aquellos pacientes que acuden con déficits sensoriales agudos.
La extensión del artículo no hace posible referenciar todas las entidades urgentes que tienen estas formas de presentación clínica. Por tanto, hemos elegido las más frecuentes, hemos tratado de establecer diagnósticos diferenciales, aclarar algunos conceptos y, como hicimos en la primera parte, destacar cuadros clínicos menos habituales, pero con una imagen radiológica característica que puede permitir un diagnóstico correcto a pesar de su infrecuencia.
División nosológica y técnicas de imagenExisten cuatro situaciones clínicas en la emergencia no traumática de cabeza y cuello: tumefacción cervical, disfagia, disnea y déficit sensorial. Las causas responsables de estos cuadros pueden ser de origen inflamatorio-infeccioso, tumoral o vascular2. En esta segunda parte se discutirán los cuadros que combinan la clínica de tumefacción facial, disfagia y disnea, así como, los déficits sensoriales.
La combinación de tumefacción cervical, disfagia y disnea no es infrecuente. Se observa en las infecciones de la cavidad oral-suelo de la boca, en la angina de Ludwig, en la fascitis necrotizante, en las colecciones-abscesos retrofaríngeos y en el enfisema espontáneo. Estas situaciones requieren la realización de una tomografía computarizada (TC) cervical que se extienda hasta la carina o incluso incluya toda la cavidad torácica. La continuidad anatómica de los espacios retrofaríngeos (el espacio retrofaríngeo y el espacio peligroso) hasta el mediastino inferior hace posible la extensión de los procesos cervicales al tórax. El uso de la radiografía simple solo podría tener aplicación en el caso del individuo joven, que comience de forma brusca con esta combinación clínica y además asocie crepitación cervical, para descartar el infrecuente cuadro de enfisema espontáneo.
En el déficit sensorial incluimos solo el déficit visual. Los déficits del gusto y del olfato no los estudiaremos puesto que no son síntomas tan discapacitantes y no alarman tanto al paciente como para acudir a urgencias. La hipoacusia súbita es la pérdida de audición que se desarrolla generalmente en 12 horas3 y que implica una pérdida de 30dB o más objetivada en al menos tres test de frecuencia, realizados en las primeras 72 horas. Tiene un impacto fuerte en la vida del paciente, sobre todo cuando se asocia a tinnitus y a vértigo, lo que ocurre en el 90% y 20-60% de los casos, respectivamente4,5. Su estudio en el momento agudo requiere la realización de una otoscopia y una audiometría para excluir causas subyacentes y confirmar su diagnóstico, por lo que quedan a cargo del servicio de otorrinolaringología. La resonancia magnética (RM), aunque está incluida en la batería de pruebas diagnósticas de esta entidad, no se realiza de forma urgente.
Tumefacción cervical y disfagia-disneaAbscesos de la cavidad oral y suelo de la bocaLa mayoría de las infecciones en el área de cabeza y cuello tienen un origen odontogénico6. La enfermedad inflamatoria dental puede tener un origen endodontal o periodontal. En la infección endodontal, el origen está en una caries dental que progresa destruyendo la dentina, posteriormente la pulpa dental y en el último paso llega al canal del nervio dentario. Por esta vía, la infección alcanza el ápex dental y puede formar un granuloma o absceso apical. En la enfermedad periodontal, la infección comienza como una gingivitis que progresa por el ligamento periodontal y forma un absceso periodontal. Los abscesos apicales o periodontales se observan radiológicamente como cavidades radiolucentes que rodean al diente. El absceso puede romper la cortical maxilar o mandibular y, según la pieza dental afectada, puede progresar siguiendo una localización y extensión variable.
Las infecciones que se originan en el maxilar7 pueden extenderse al espacio bucal, al espacio masticador o al espacio parafaríngeo, según las piezas patológicas sean las de la región premaxilar, o el segundo molar o el tercer molar, respectivamente. En las infecciones de origen mandibular, los procesos inflamatorios de las piezas anteriores se localizarán en el espacio sublingual, y cuando se trate de los molares segundo y tercero, en el espacio submandibular, porque las raíces de estos últimos se sitúan por debajo de la línea milohioidea.
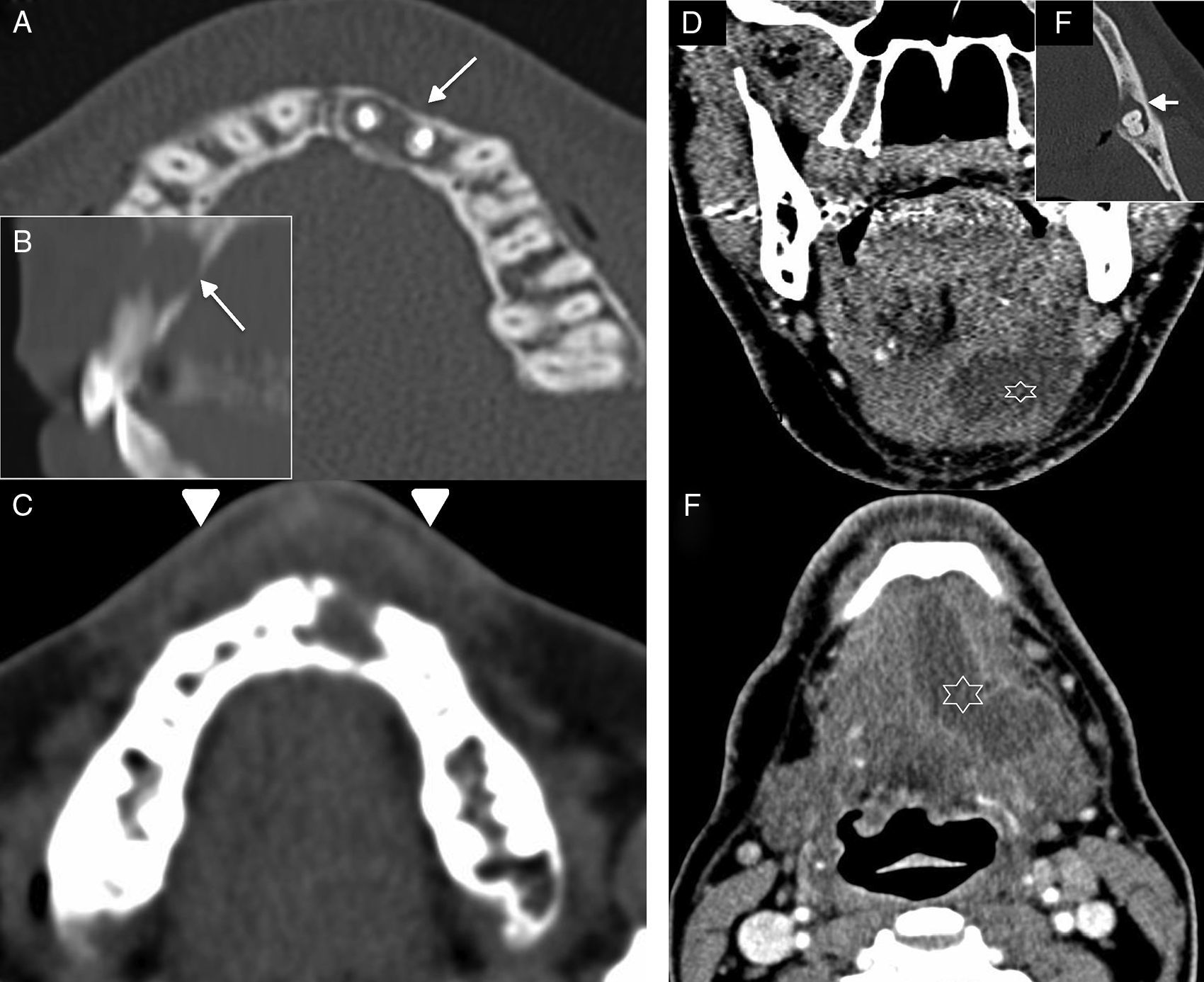
La TC, además de identificar el absceso dental, pondrá de manifiesto la presencia de una colección líquida con realce periférico. La localización y extensión de esta colección debe quedar reflejada en el informe radiológico porque es esencial para guiar el drenaje quirúrgico. Además, se debe identificar la pieza dental implicada (fig. 1). La nomenclatura utilizada para definir el diente afectado puede hacer referencia al nombre (incisivos, canino, premolares y molares) y su ubicación según el cuadrante (superiores: derecho o izquierdo, inferiores: derecho o izquierdo). Siguiendo un patrón numérico, el método más usado en España es el de la Federación Dental Internacional (FDI), que numera 11-18, 21-28, 31-38 y 41-48, las piezas correspondientes a las arcadas dentales maxilar derecha e izquierda y mandibular izquierda y derecha, respectivamente, comenzando por el primer incisivo hasta el último molar en cada uno de los cuadrantes. La nomenclatura de la Asociación Dental Americana (ADA) numera las piezas del 1 al 32, comenzando por el tercer molar de la arcada superior derecha y continuando de forma sucesiva con el resto de cuadrantes, de la misma forma que en el sistema FDI8,9.
Abscesos de la cavidad oral. Absceso en espacio bucal-vestibular. A) Tomografía computarizada (TC), corte axial reconstruido en ventana de hueso. B) TC, reconstrucción sagital en ventana de hueso. C) TC corte axial reconstruido en ventana de partes blandas. Mujer que acude con neuralgia y tumefacción facial anterior. La TC pone de manifiesto una afectación periodontal en región premaxilar (flechas en A y B), piezas 21 y 22–que presentan material metálico por endodoncia previa–en forma de absceso periapical con afectación flemonosa del espacio bucal y del vestíbulo (flechas cortas en C). Absceso submandibular. D) TC, corte coronal con contraste intravenoso. E) TC, reconstrucción axial oblicua en ventana de hueso. F) TC, corte axial con contraste intravenoso. Varón de 62 años que comienza con dolor submandibular izquierdo. En la TC existía una colección con realce periférico (absceso) en el suelo de la boca izquierdo (asterisco en D y F). El foco infeccioso se localizaba en la pieza 38 (flecha en E), que presentaba un absceso periapical con dehiscencia de la cortical lingual.
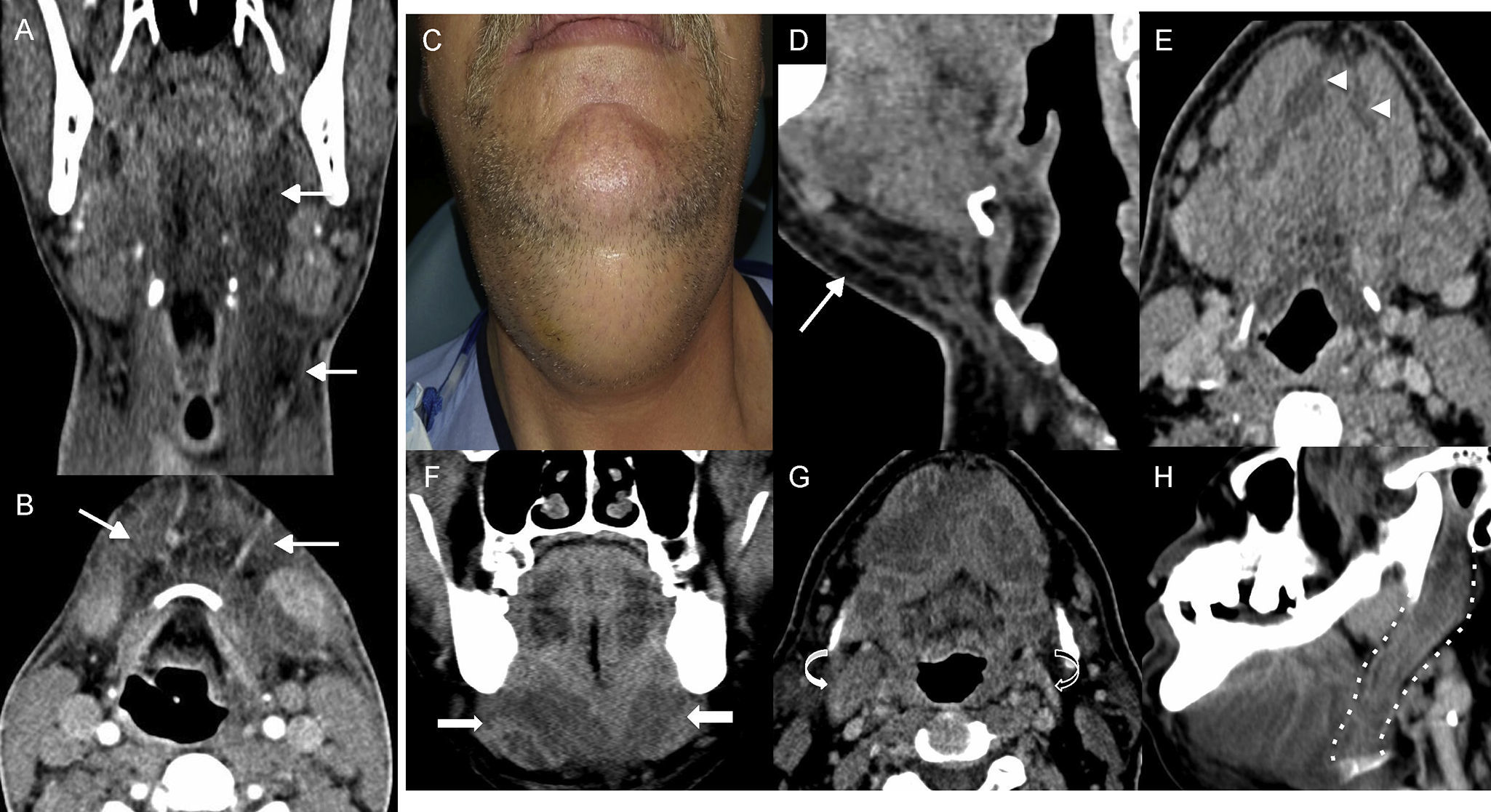
La angina de Ludwig10 es un tipo específico y grave de celulitis del suelo de la boca que se extiende de forma bilateral a las partes blandas de la cavidad oral y de los espacios profundos del cuello, e implica a los músculos localizados entre el suelo de la boca y la laringe (fig. 2). Clínicamente, aparece como dolor y tumefacción del suelo de la boca y puede asociar dolor torácico. Antes de la época antibiótica, la extensión del proceso al mediastino era más común y fue la responsable de la denominación dada a esta entidad. Puede comprometer la vía aérea y requerir traqueostomía de forma más frecuente que otros abscesos cervicales11. La TC se utiliza para valorar la extensión del proceso inflamatorio, la presencia de colecciones serosanguinolentas o la formación de abscesos, que ocurren en algunos casos12,13.
Angina de Ludwig. A) Tomografía computarizada (TC), corte coronal con contraste intravenoso. B) TC, corte axial con contraste intravenoso. Paciente de 18 años que acudió porque desde hacía 3 días tenía odinofagia y sensación distérmica. A la exploración presentaba dificultad para la apertura bucal y sobreelevación de la lengua. La imagen demostró un aumento de densidad de la grasa de los espacios submandibular y parafaríngeo (flechas en A y B). D-H) TC con contraste intravenoso de otro paciente diferente (C), que acudió por tumefacción cervical. D) corte sagital. E y G) Cortes axiales. F) corte coronal. H) Reconstrucción oblicua sagital. Al inicio (C-E), la TC demostró aumento de densidad y trabeculación de la grasa en espacio submandibular (flecha) asociada a pequeñas colecciones en el suelo de la boca (puntas de flecha). Se le ingresa con el diagnóstico de angina de Ludwig y tratamiento antibiótico i.v. El paciente empeora, y se repite la TC (F-H) en la que se observan colecciones líquidas (flechas largas) en el suelo de la boca con claro aumento de su tamaño con respecto al estudio inicial. La afectación se extendía por el vientre posterior de músculo digástrico (flecha curva en G y línea de puntos en H), que estaba aumentado de tamaño (obsérvese de forma comparativa con el del lado izquierdo, flecha curva negra). El drenaje demostró contenido seropurulento.
La fascitis necrotizante es una infección polimicrobiana y agresiva de las partes blandas superficiales y profundas del cuello, que sucede de manera más frecuente en pacientes con situaciones comórbidas como la diabetes o la inmunosupresión. La infección, que puede tener origen en la piel, la mucosa o los dientes, progresa rápidamente y puede alcanzar el mediastino y comprometer la vida del paciente14. Clínicamente, los pacientes presentan síntomas de tumefacción cervical y disfagia-disnea asociados a fiebre alta. Existen unos indicadores de laboratorio de riesgo para fascitis necrotizante basados en los test de laboratorio de rutina15. Con ellos se trata de diferenciar esta entidad de otras infecciones de partes blandas menos agresivas, para poder realizar de forma precoz su tratamiento de elección: el desbridamiento quirúrgico urgente16.
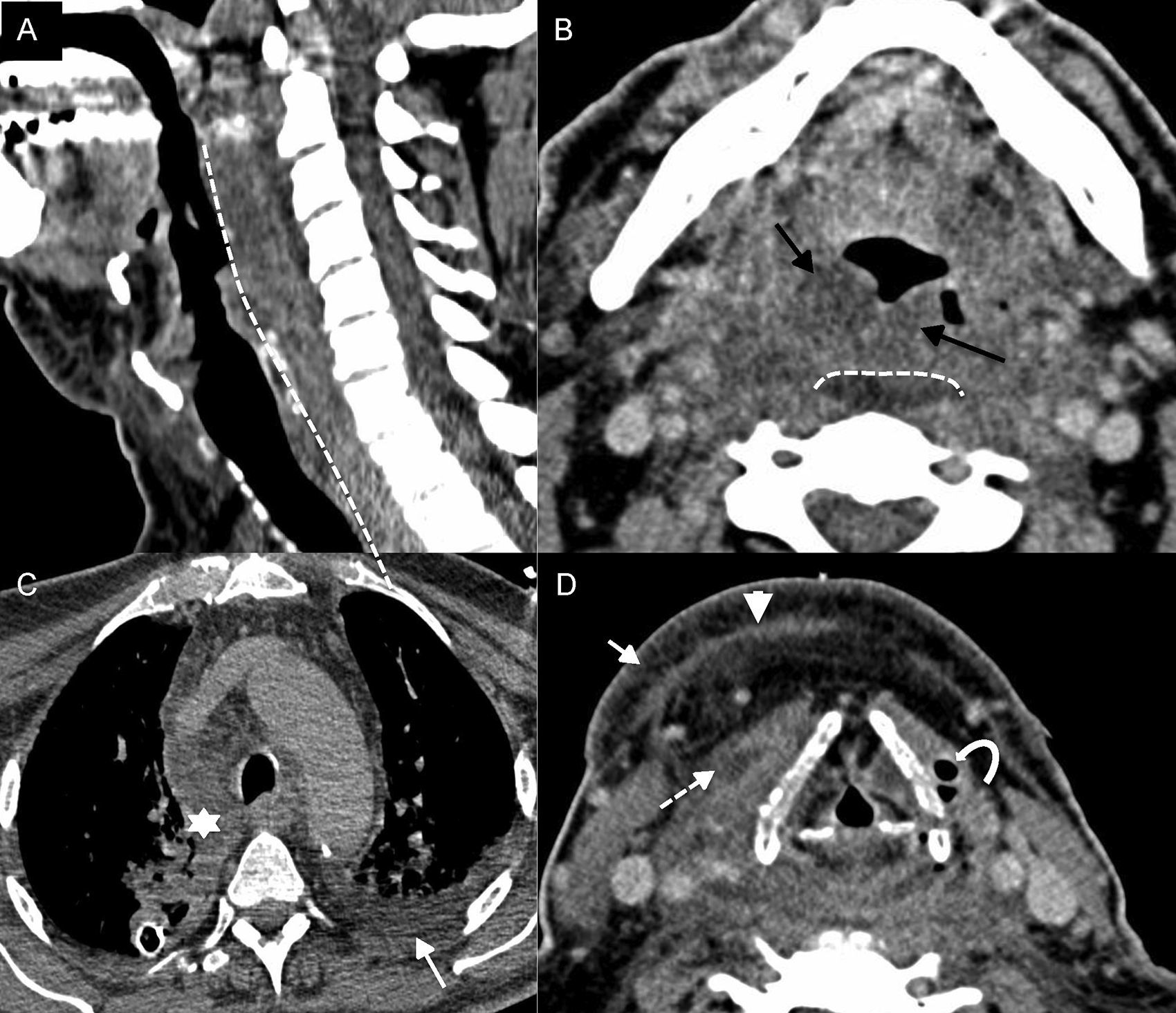
En la TC, los signos radiológicos que ayudan a establecer su diagnóstico son la evidencia de celulitis, fascitis, miositis, colecciones múltiples, adenopatías reactivas y, a veces, trombosis séptica (fig. 3). La presencia de gas (en ausencia de cirugía reciente o radioterapia) es un hallazgo muy sugestivo de esta entidad, pero no sucede en todos los casos17.
Fascitis necrotizante. A) Tomografía computarizada (TC) sagital con contraste intravenoso. B-D) TC axial con contraste intravenoso a diferentes niveles cervicales. Paciente de 74 años que acude a urgencias por disnea, odinofagia y fiebre. Se avisa al otorrinolaringólogo, que observa saturación del 87% y tiraje. En la imagen existe engrosamiento de la piel y del tejido celular subcutáneo–celulitis–(flecha en D), engrosamiento y realce de las fascias superficiales y profundas–fascitis–(punta de flecha en D), engrosamiento y realce con colecciones líquidas de los músculos prelaríngeos–miositis–(flecha discontinua en D), edema del espacio mucoso faríngeo (flechas negras en B) y edema de todo el espacio retrofaríngeo (línea discontinua en A y B) que se extendía al mediastino (asterisco en C). Además, existía gas (flecha curva en D) y derrame pleural derecho (flecha en C).
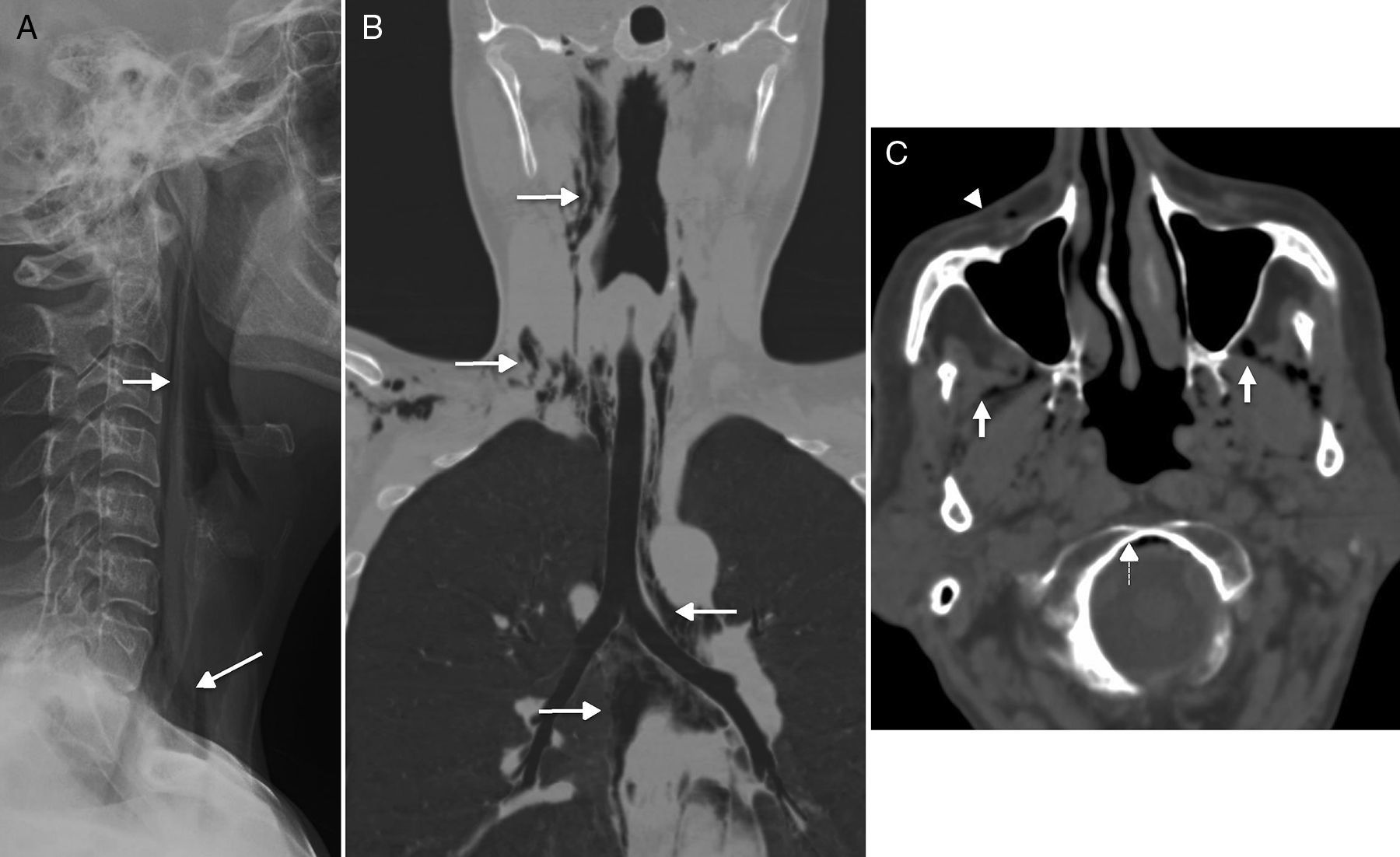
El enfisema cervical espontáneo se define como la presencia de gas en espacios cervicales y mediastínicos que se produce de manera espontánea en adultos jóvenes y es de carácter autolimitado y benigno18. Clínicamente, aparece como dolor retroesternal intenso y repentino asociado a disnea de instauración brusca. No existe relación con iatrogenia, trauma o infección. El mecanismo fisiopatológico que subyace es un aumento de la presión en los alvéolos (producida por múltiples etiologías: tos, Valsalva…) que produce su rotura. El aire progresa de forma centrípeta hacia el mediastino porque allí existe menor presión. Desde el punto de vista radiológico, aparecen burbujas aéreas de distribución aleatoria en los diferentes espacios cervicales y en el mediastino (fig. 4A y B). Se debe diferenciar del síndrome de Boerhave o rotura esofágica secundaria al vómito, un cuadro clínico asociado a mayor morbimortalidad y que requiere tratamiento quirúrgico.
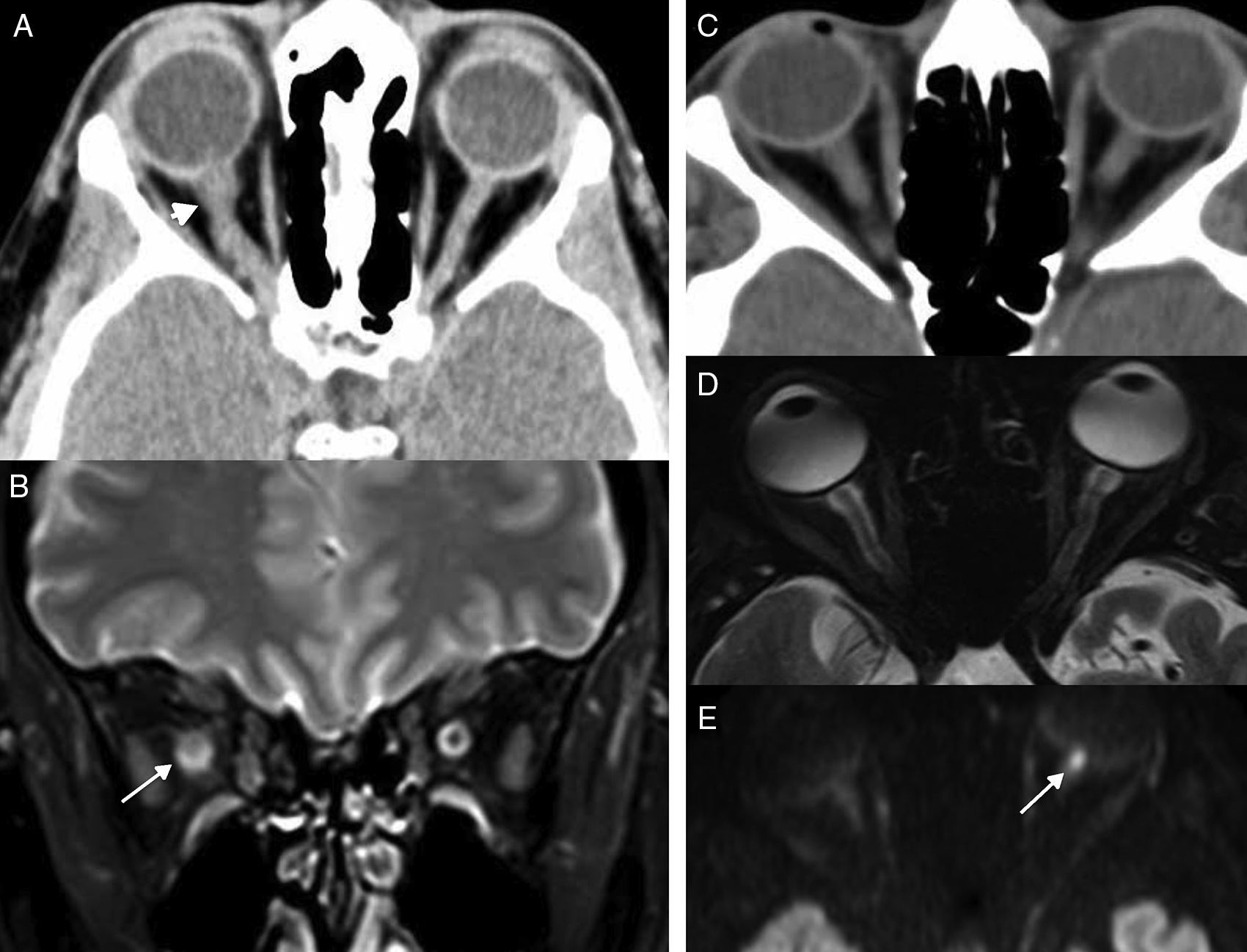
Enfisema cervical espontáneo. A) Radiografía simple lateral. B) Tomografía computarizada (TC), reconstrucción coronal. C) TC axial. A y B) Neumomediastino espontáneo en una paciente joven que acude a urgencias con dolor retroesternal, sensación de disnea y odinofagia tras atragantamiento. Existe marcado enfisema cervical (flechas) que se extiende al mediastino, hallazgo fácilmente reconocible en la radiografía simple. La TC se realizó para tratar de diferenciarlo del síndrome de Boerhave. C) TC de cráneo de un paciente con sospecha de ictus y portador de una vía periférica. En la imagen existía aire en espacio masticador (flechas blancas), vena facial anterior (punta flecha) y en espacio epidural, en región anterior de foramen magno (flecha discontinua).
El enfisema espontáneo no debe confundirse con la presencia de pequeñas cantidades de aire en los espacios cervicales que se observan de forma incidental en los estudios de TC (fig. 4C). Se ha identificado en el 0,034% de las TC de cráneo realizadas en la urgencia a pacientes con una vía periférica, considerada esta la puerta de acceso del aire19. La localización de las burbujas aéreas es aleatoria; es más común en las venas orbitarias, el espacio masticador o los senos cavernosos. Los pacientes con este hallazgo no presentan antecedentes traumáticos ni otros datos clínicos relevantes.
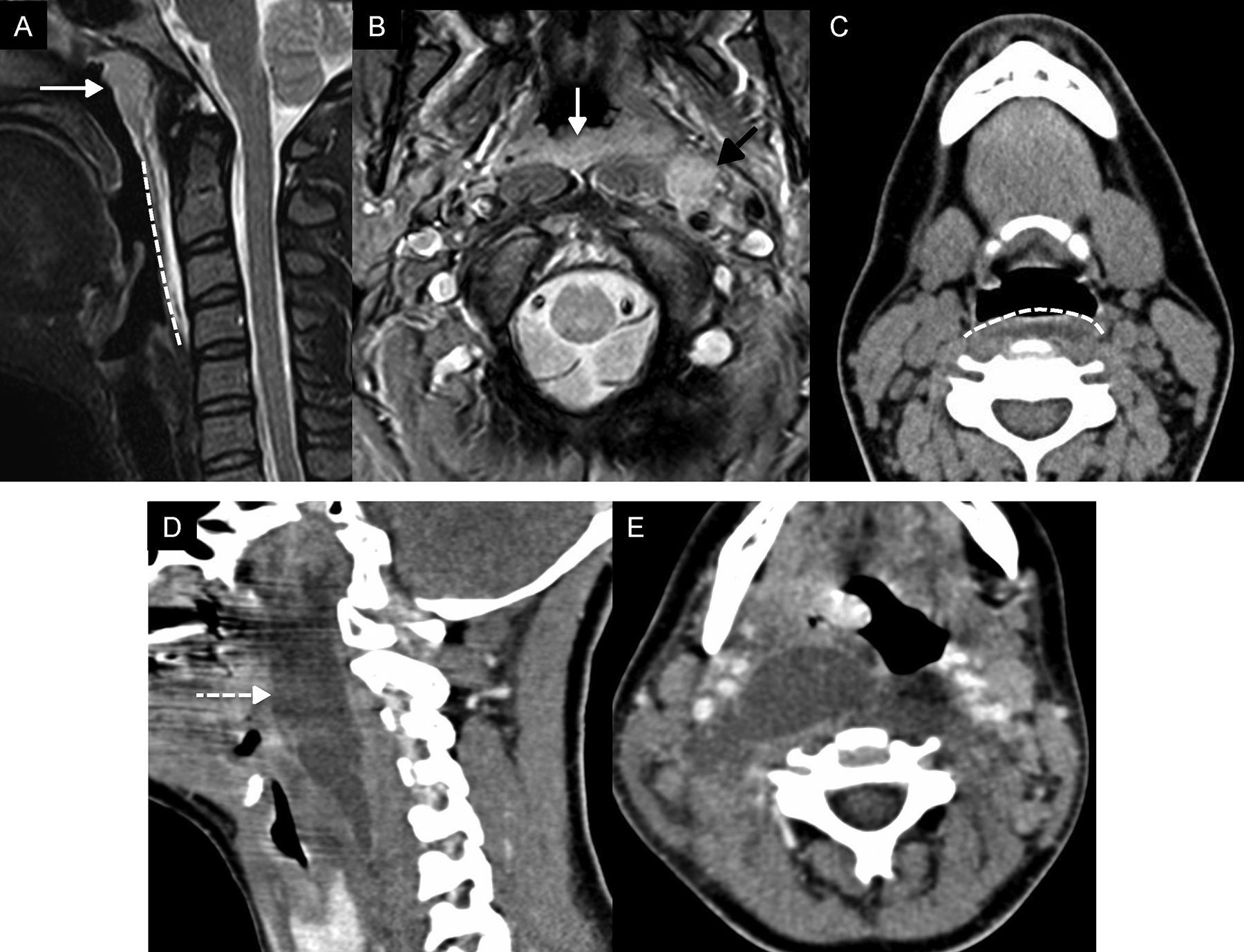
Infección retrofaríngea y prevertebralLa retrofaringe o espacio posterior a la faringe es un espacio virtual que se extiende desde la base del cráneo hasta el mediastino superior. Existe otro espacio virtual, posterior al retrofaríngeo, denominado espacio peligroso, que puede alcanzar el mediastino posterior y descender hasta la región inferior de la cavidad torácica. La diferenciación de estos espacios a nivel cervical no es posible y es su extensión caudal la que define si el proceso inflamatorio se sitúa en uno u otro (una extensión más allá de T3 indicaría afectación del espacio peligroso). La implicación de cualquiera de estos espacios generalmente es secundaria a una infección originada en la vía aerodigestiva superior, cuyo patrón de drenaje linfático está en los ganglios del espacio retrofaríngeo. El proceso infeccioso ocasiona una adenitis y cambios inflamatorios en el tejido adyacente. La adenitis se manifiesta como un aumento del tamaño del ganglio linfático. La afectación inflamatoria de partes blandas adyacente o celulitis aparece radiológicamente como un aumento simétrico del espacio retrofaríngeo, que se ocupa por una lámina de líquido que típicamente no excede unos pocos milímetros (fig. 5A-C). La adenitis insuficientemente tratada puede supurar, romperse y originar un absceso. En esta situación aparece una colección líquida mayor, asimétrica y con un realce parietal variable (fig. 5D-E)17. La adenitis supurada representa una forma relativamente frecuente de complicación y formación secundaria de abscesos retrofaríngeos en niños.
Infección del espacio retrofaríngeo. A) Resonancia magnética (RM), corte sagital T2 con saturación grasa. B) RM, corte axial T2. C) Tomografía computarizada (TC), corte axial. D) TC, reconstrucción sagital tras administrar contraste intravenoso. E) TC, corte axial tras administrar contraste intravenoso. A-C) Mujer con dolor cervical, fiebre y odinofagia. En la RM se observó hipertrofia del espacio mucoso de amígdalas faríngeas–amigdalitis–(flechas blancas en A y B), una adenitis retrofaríngea izquierda (flecha negra en B) y edema (celulitis) retrofaríngeo (línea discontinua en A y C). Obsérvese cómo el edema se extiende en el espacio retrofaríngeo de forma bilateral y apenas distiende unos milímetros dicho espacio. D y E) Mujer de15 años diagnosticada de mononucleosis, que acude por fiebre alta, odinofagia importante y trismo. La TC mostró una colección líquida asimétrica y con realce periférico en espacio retrofaríngeo, sugestiva de absceso (flecha discontinua), que se confirmó tras aspiración y drenaje.
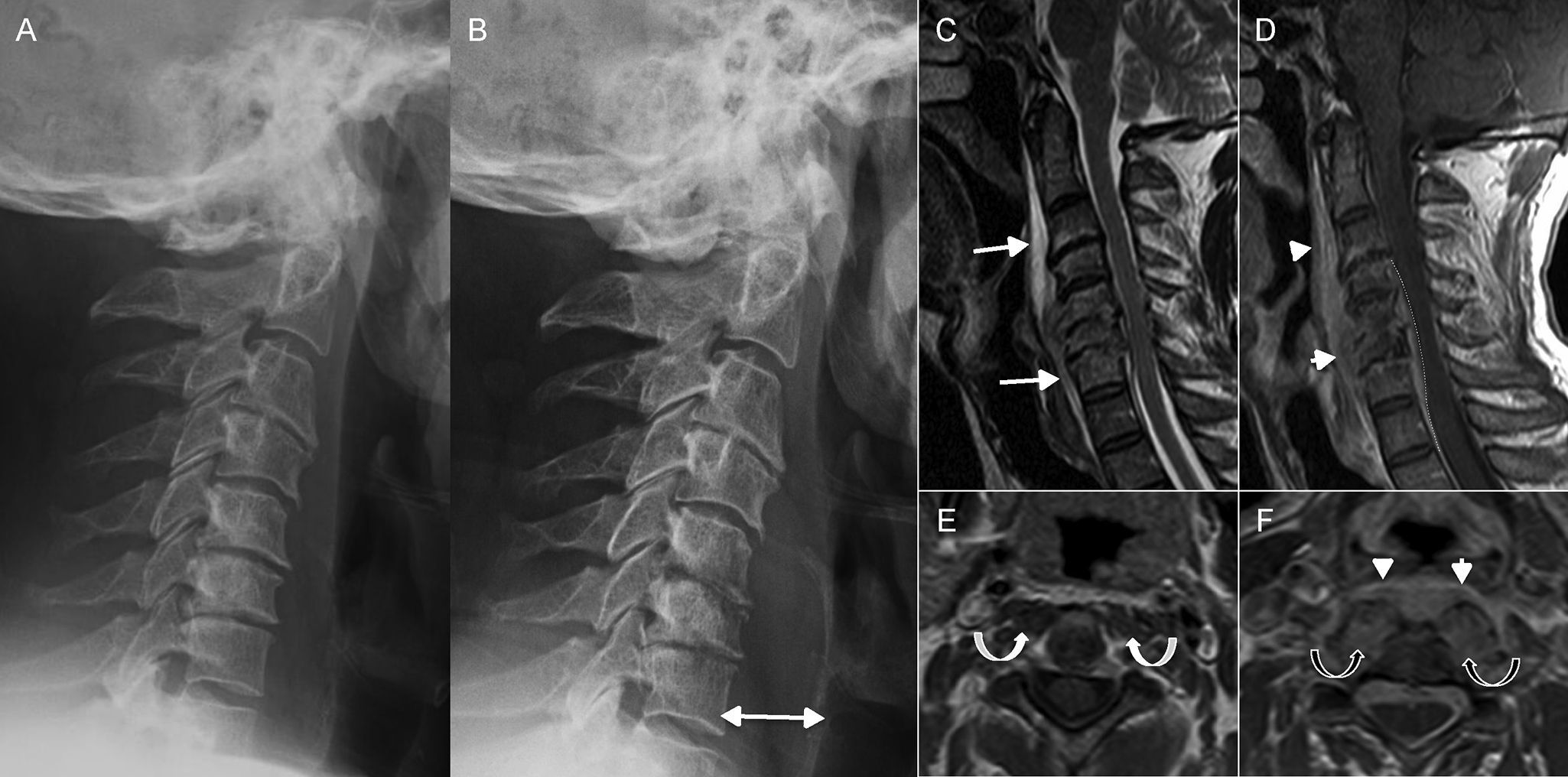
El espacio prevertebral es el espacio que queda definido por la fascia cervical profunda y en el que se localiza la musculatura prevertebral. Los procesos infecciosos de la columna vertebral, la espondilodiscitis, pueden alcanzar este espacio y son generalmente los responsables de su afectación13,20. La espondilodiscitis se produce por una inoculación directa (traumática o quirúrgica), por extensión de una infección adyacente o por diseminación hematógena de gérmenes patógenos. El agente causal más frecuente es Staphylococcus aureus y su localización más frecuente es la región torácica o lumbar. La RM es la técnica más sensible para su estudio porque define bien la afectación discovertebral, así como las posibles colecciones prevertebrales o epidurales (fig. 6).
Espondilodiscitis. A y B) Radiografía lateral de columna cervical. C) Resonancia magnética (RM), corte sagital potenciado en T2. D) RM, corte sagital potenciado en T1 con gadolinio. E y F) RM, cortes axiales potenciados en T1 con gadolinio a nivel de C2 (E) y a nivel de C6 (F). Paciente que acude por dolor cervical y se le realiza una radiografía lateral (A). En ella se observa una disminución de los espacios intervertebrales y una leve erosión de los platillos C5-C6 y C6-C7, que se interpretan como cambios degenerativos. Acude 12 días más tarde con dolor más intenso. Se repite de nuevo la radiografía (B) y se observa clara progresión con pérdida de altura de los cuerpos vertebrales C5 y C6 y un mayor aumento del espacio prevertebral (doble flecha en B). Con la sospecha de espondilodiscitis, se realiza RM, que confirma el cuadro, y en la que se evidencia una colección prevertebral (flechas largas en C) con realce intenso tras administrar gadolinio (puntas de flecha en D y F). También existía una colección en espacio epidural (línea discontinua en D). En el lugar de mayor afectación, segmento C5-C6, se observaba aumento del tamaño y de la captación de la musculatura prevertebral (flechas curvas negras en F) que no existía en niveles superiores como en C2 (flechas curvas blancas en E).
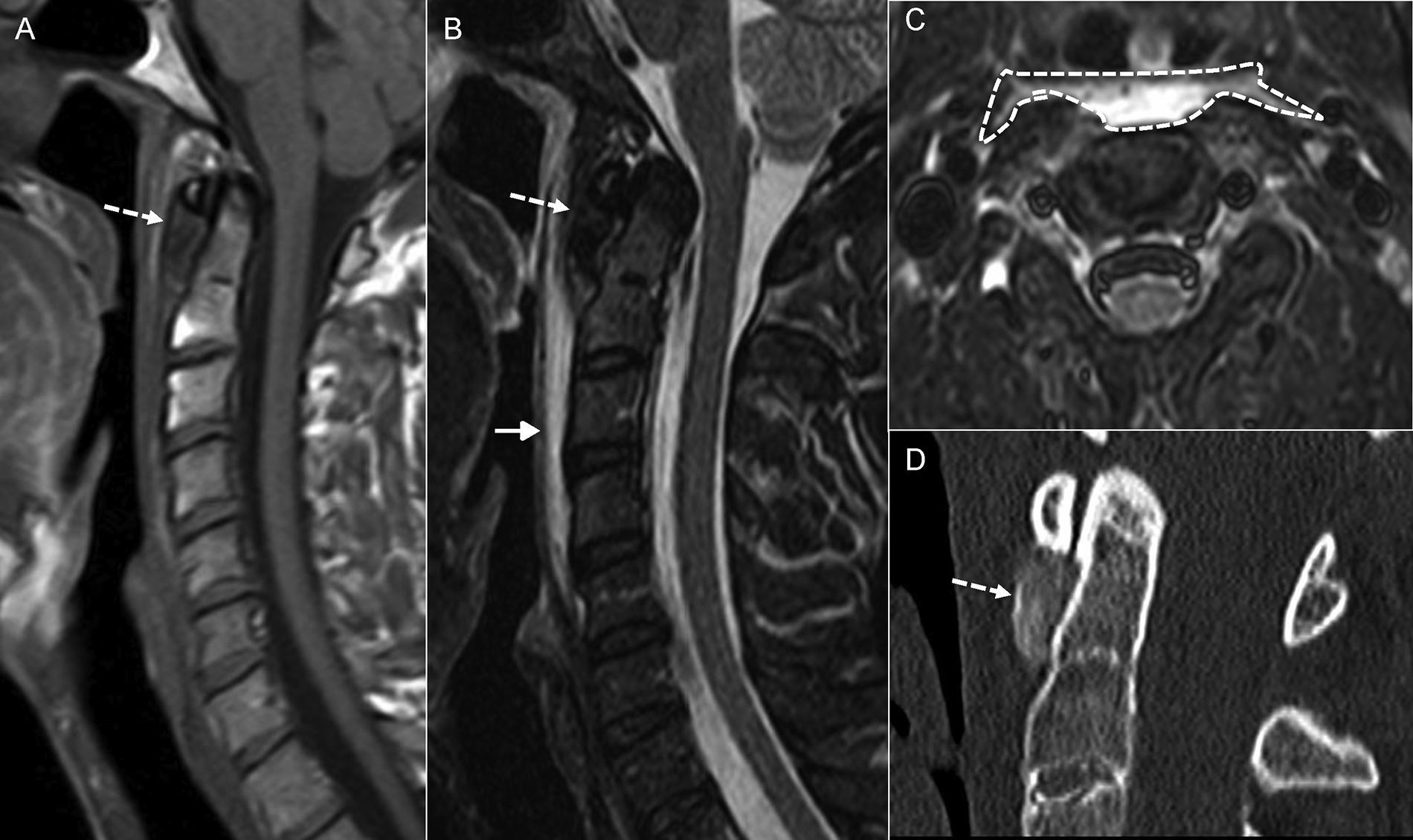
Existe una entidad infrecuente, probablemente porque está infradiagnosticada, denominada tendinitis calcificada del músculo largo del cuello (fig. 7), que también puede implicar al espacio prevertebral. Se produce por el depósito de hidroxiapatita cálcica en el tendón del músculo largo del cuello. Este depósito anómalo origina una respuesta inflamatoria a cuerpo extraño. El diagnóstico del cuadro se hace tras reconocer en la radiografía simple los signos patognomónicos y en la TC observar la presencia de imágenes densas calcificadas (no óseas) en el espacio prevertebral-retrofaríngeo a nivel C1-C2, asociadas a edema de partes blandas, que se extiende desde el nivel cervical C1 a C421,22.
Tendinitis calcificada del músculo largo del cuello. A) Resonancia magnética (RM), corte sagital potenciado en T1. B) RM, corte sagital potenciado en T2. C) RM, corte axial potenciado en T2 con saturación grasa. D) Tomografía computarizada (TC), reconstrucción sagital en ventana de hueso. Paciente que acudió con dolor cervical. Se le realizó RM en la que se evidenció edema del espacio prevertebral (flecha en B y silueta discontinua en C). Además, existía marcada hiposeñal anterior a la apófisis odontoides (flecha discontinua en A y B) que la TC confirmó como depósito cálcico (flecha discontinua en D).
La pérdida de visión aguda se estudia atendiendo a dos factores: la duración de la pérdida y el segmento del sistema visual responsable.
La duración puede tener un carácter transitorio o persistente. Las formas transitorias se definen como aquellas que duran menos de 24 horas, y se producen generalmente por una oclusión vascular que afecta al globo ocular o a la corteza visual, o son secundarias a una crisis comicial o a migraña. Las formas persistentes son aquellas que duran más de 24 horas y típicamente no se deben a una isquemia transitoria. Cualquiera que sea la duración de la pérdida de visión será valorada por el oftalmólogo, que orientará el diagnóstico requiriendo o no la realización de pruebas de imagen. Las formas transitorias o amaurosis fugaz unilaterales hacen sospechar un origen carotídeo como responsable de la oclusión arterial. En este caso es necesario realizar ecografía-Doppler, angio-TC o angio-RM. La pérdida de visión bilateral, sobre todo en pacientes mayores y asociada a síntomas vertebrobasilares, hace necesaria la realización de TC y/o RM para valorar el parénquima encefálico y las estructuras vasculares de la circulación posterior.
Si atendemos al segmento visual responsable de la pérdida de visión, debemos recordar que el estímulo luminoso debe atravesar los distintos componentes del globo ocular, continuar por el nervio óptico, las vías visuales intracraneales y alcanzar la corteza occipital. Por tanto, la patología puede quedar dividida en tres segmentos: el globo ocular (excepto la retina), la retina y los patrones visuales neurales.
Las alteraciones en el globo ocular y en la retina son estudiadas por los oftalmólogos y no suelen necesitar imagen complementaria. Son los problemas en los patrones neurales los que pueden requerir estudios radiológicos adicionales23.
Evitando las formas de amaurosis fugaz (excepto la imagen de la neuritis óptica isquémica para diferenciarla de la neuritis óptica inflamatoria) hemos querido referirnos en esta revisión a aquellos cuadros de afectación de los patrones visuales neurales más frecuentes en nuestro quehacer radiológico y a los que, siendo infrecuentes, podemos ser los radiólogos los que establezcamos su diagnóstico (tabla 1).
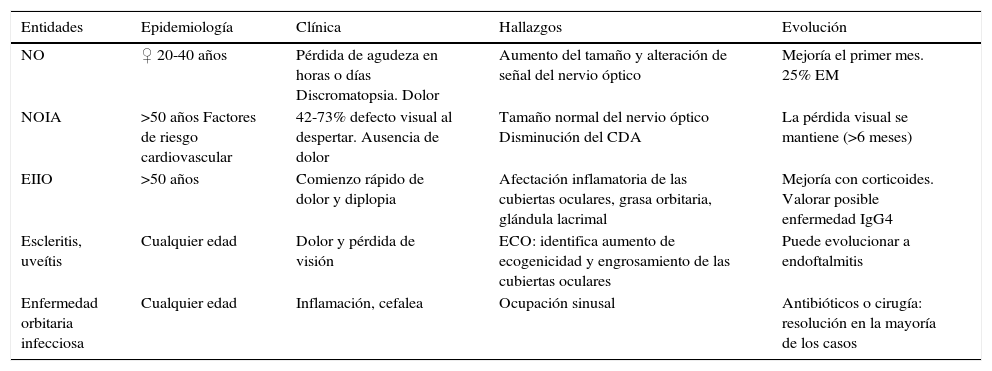
Diagnóstico diferencial de las entidades responsables de un déficit visual
| Entidades | Epidemiología | Clínica | Hallazgos | Evolución |
|---|---|---|---|---|
| NO | ♀ 20-40 años | Pérdida de agudeza en horas o días Discromatopsia. Dolor | Aumento del tamaño y alteración de señal del nervio óptico | Mejoría el primer mes. 25% EM |
| NOIA | >50 años Factores de riesgo cardiovascular | 42-73% defecto visual al despertar. Ausencia de dolor | Tamaño normal del nervio óptico Disminución del CDA | La pérdida visual se mantiene (>6 meses) |
| EIIO | >50 años | Comienzo rápido de dolor y diplopia | Afectación inflamatoria de las cubiertas oculares, grasa orbitaria, glándula lacrimal | Mejoría con corticoides. Valorar posible enfermedad IgG4 |
| Escleritis, uveítis | Cualquier edad | Dolor y pérdida de visión | ECO: identifica aumento de ecogenicidad y engrosamiento de las cubiertas oculares | Puede evolucionar a endoftalmitis |
| Enfermedad orbitaria infecciosa | Cualquier edad | Inflamación, cefalea | Ocupación sinusal | Antibióticos o cirugía: resolución en la mayoría de los casos |
CDA: coeficiente de difusión aparente; ECO: ecografía; EIIO: enfermedad inflamatoria idiopática orbitaria; EM: esclerosis múltiple; NO: neuritis óptica inflamatoria; NOIA: neuritis óptica isquémica aguda.
Las manifestaciones clínicas de la neuritis óptica inflamatoria (NO) y de la neuropatía óptica isquémica aguda (NOIA) están bien establecidas. La NO es la causa más común de enfermedad del nervio óptico en adultos jóvenes, mientras que la NOIA es la etiología más frecuente en individuos mayores.
La NO se caracteriza por una pérdida de agudeza visual progresiva, con una instauración de horas a días, y son manifestaciones muy características, la discromatopsia, la disminución de la sensibilidad al contraste y el dolor con los movimientos oculares en los primeros 5 días. La agudeza visual mejora en la mayoría de los casos durante el primer mes. Los pacientes suelen ser mujeres jóvenes, de 20 a 40 años de edad, en muchas ocasiones relacionadas con la esclerosis múltiple24–26.
La NOIA se caracteriza por un comienzo brusco de pérdida de agudeza visual o un defecto campimétrico, generalmente sin dolor con los movimientos oculares. El 42% de los pacientes notan el defecto visual al despertarse27. La pérdida de agudeza visual se mantiene en el tiempo, aunque puede haber una mejoría después de los seis primeros meses. Estos pacientes suelen ser mayores de 50 años y asocian factores de riesgo cardiovascular. Las NOIA se dividen en anteriores o aquellas que afectan a la papila del nervio óptico, y posteriores o retrobulbares. El origen puede ser arterítico o no arterítico.
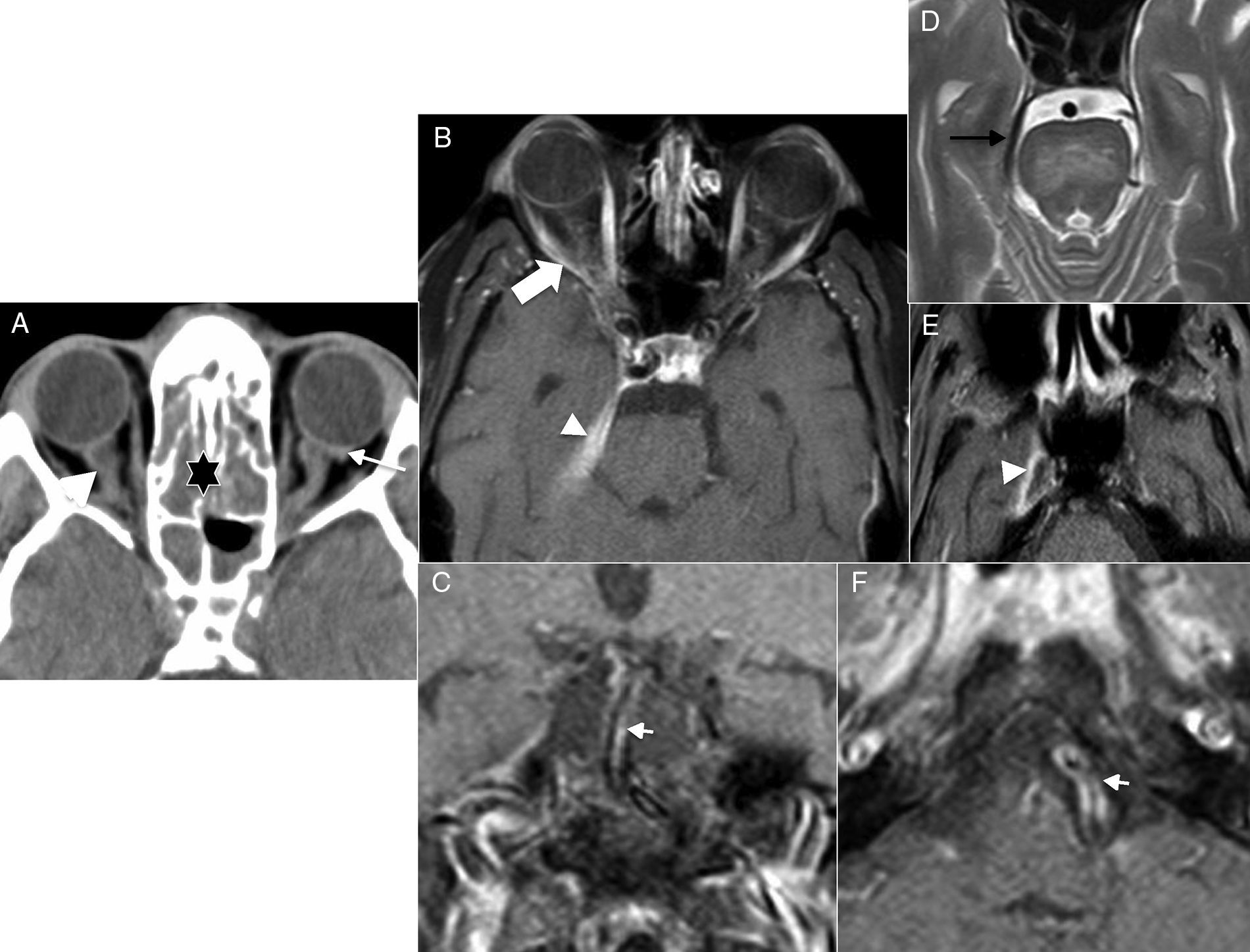
Sin embargo, a pesar de que existen diferencias clínicas entre ambas entidades, en ocasiones las características se solapan y puede ser necesario realizar técnicas de imagen complementarias que nos ayuden en el diagnóstico28. En la NO puede verse un aumento del tamaño del nervio óptico en la TC craneal de urgencias29 pero, sin duda, la RM es más sensible para diferenciar estas dos entidades. Esta técnica, además del posible aumento del tamaño, puede evidenciar captación de contraste en la imagen T1 con gadolinio30,e hiperseñal y mala definición en T2 del nervio óptico en la NO (fig. 8A-B). En la NOIA, el nervio óptico tiene un grosor normal, pero puede presentar hiperseñal en difusión a nivel de la papila (en las formas anteriores) con mayor frecuencia que en los casos de NO31 (fig. 8C-E).
Neuritis óptica. A) Tomografía computarizada (TC) craneal, corte axial. B) Resonancia magnética (RM), corte coronal potenciado en T2 con saturación grasa. Mujer de 23 años que acude por pérdida de visión y dolor en ojo derecho. La TC pone de manifiesto un aumento del calibre del nervio óptico (flecha en A). La RM define mejor el aumento del nervio óptico que muestra hiperseñal y mala definición de las cubiertas bulbares (flecha en B). Neuritis óptica isquémica aguda. C) TC craneal, corte axial. D) RM, corte axial potenciado en T2 con saturación grasa. E) RM, corte axial potenciado en difusión. Paciente de 62 años que acude a urgencias por pérdida de visión en ojo izquierdo. La TC craneal no mostraba alteraciones relevantes ni a nivel del parénquima encefálico ni a nivel orbitario. En la RM, el nervio óptico tenía un grosor y una definición normales. La imagen en difusión, sin embargo, demostró una hiperseñal en la papila del nervio óptico izquierdo (flecha en E).
En las formas arteríticas de la NOIA debemos destacar la arteritis de células gigantes (ACG). Esta enfermedad es la vasculitis sistémica más común. Puede ocasionar afectación anterior o posterior del nervio óptico. La pérdida de visión generalmente es monocular y transitoria, pero en el 15-20% de los casos se puede hacer permanente o puede ser bilateral; estos últimos cuadros son más frecuentes si no se establece su diagnóstico y tratamiento precoz con corticoides. La entidad se sospecha en pacientes con edad avanzada, con pérdida de visión monocular y que asocian de forma característica claudicación de la mandíbula, polimialgia reumática y valores elevados de la proteína C y de la velocidad de sedimentación. Desde el punto de vista patogénico, la enfermedad afecta a la aorta, a los vasos supraaórticos y a las arterias superficiales epicraneales, como la arteria temporal superficial y la arteria occipital. La biopsia con examen histopatológico, confirmando la presencia de una afectación inflamatoria granulomatosa y linfocítica de la pared arterial, es el mejor test diagnóstico. Sin embargo, hay estudios que demuestran que la RM de alta resolución con contraste puede ser una técnica diagnóstica no invasiva y prometedora32. Con ella se puede observar un engrosamiento y realce tras la administración de contraste a nivel parietal-periadventicial en las arterias temporal superficial y occipital33. Se ha descrito también afectación de arterias intracraneales, como la arteria carótida interna y las arterias vertebrales, pero en comparación con la alta sensibilidad y especificidad de los vasos extracraneales, la sensibilidad de la afectación intracraneal es baja34.
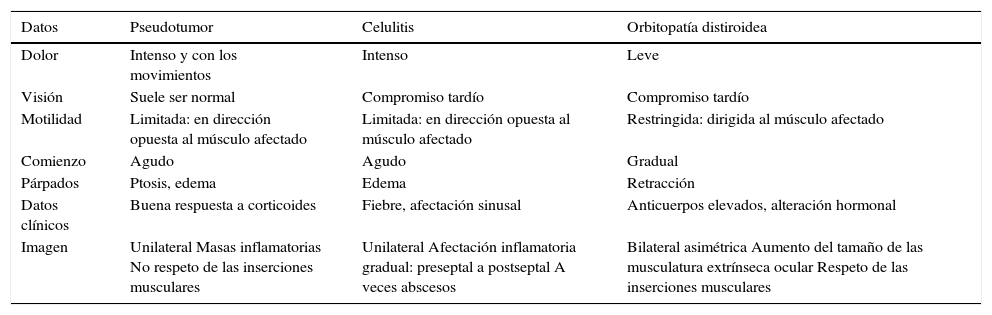
Enfermedad inflamatoria idiopática orbitariaComo ya referimos en la primera parte, bajo este epígrafe encontramos aquellas condiciones que causan inflamación orbitaria aguda, asociada generalmente a dolor y en las que no existe una etiología infecciosa. Por lo tanto, en este grupo nosológico quedan englobadas entidades como la granulomatosis de Wegener, la ACG, el pseudotumor inflamatorio y la enfermedad asociada a IgG4. Radiológicamente, aparecen masas de partes blandas inflamatorias o aumento del tamaño y mala definición de las estructuras oculares, pudiendo plantear diagnóstico diferencial con otras patologías como la celulitis orbitaria o la orbitopatía distiroidea (tabla 2).
Diagnóstico diferencial clínico-radiológico de las entidades inflamatorias orbitarias más frecuentes
| Datos | Pseudotumor | Celulitis | Orbitopatía distiroidea |
|---|---|---|---|
| Dolor | Intenso y con los movimientos | Intenso | Leve |
| Visión | Suele ser normal | Compromiso tardío | Compromiso tardío |
| Motilidad | Limitada: en dirección opuesta al músculo afectado | Limitada: en dirección opuesta al músculo afectado | Restringida: dirigida al músculo afectado |
| Comienzo | Agudo | Agudo | Gradual |
| Párpados | Ptosis, edema | Edema | Retracción |
| Datos clínicos | Buena respuesta a corticoides | Fiebre, afectación sinusal | Anticuerpos elevados, alteración hormonal |
| Imagen | Unilateral Masas inflamatorias No respeto de las inserciones musculares | Unilateral Afectación inflamatoria gradual: preseptal a postseptal A veces abscesos | Bilateral asimétrica Aumento del tamaño de las musculatura extrínseca ocular Respeto de las inserciones musculares |
La enfermedad relacionada con la IgG4 es una entidad de descripción relativamente reciente. Se caracteriza por unas concentraciones elevadas de IgG4 en suero y tumefacción o infiltración de los tejidos por células plasmáticas IgG4 positivas. En el estudio histológico se observan abundantes células plasmáticas IgG4 positivas, fibrosis y flebitis obliterativa. Es una enfermedad de etiología autoinmune que típicamente progresa durante largos períodos afectando a uno o a varios órganos y que responde de forma habitual a los corticoides. En 2010, Umehara et al.35 establecieron los criterios diagnósticos de esta entidad: una concentración de IgG4 en suero > 135mg/dL y más del 40% de células plasmáticas IgG4 positivas, y la presencia de más de 10 células por campo de gran aumento en la muestra de biopsia. En el campo de la neurorradiología puede presentarse a nivel orbitario como un aumento de tamaño de la glándula lacrimal o pseudotumor inflamatorio, o desarrollar una paquimeningitis hipertrófica. Como pseudotumor inflamatorio puede dar origen a masas conales o extraconales, pero se debe recordar que la mayoría de los pseudotumores inflamatorios no forman parte del espectro de IgG4. El aumento del calibre de las ramas del nervio trigémino, en especial del nervio infraorbitario, es un dato a favor de esta entidad36,37. Hay estudios que han descrito el pseudotumor inflamatorio relacionado con la IgG4 del nervio trigémino como masas de partes blandas que realzan homogéneamente y que afectan a la base del cráneo a lo largo de las divisiones V2 y V3 trigeminales.
Los criterios diagnósticos de las diferentes entidades responsables de la enfermedad inflamatoria idiopática orbitaria se establecen según datos clínicos, analíticos y de anatomía patológica. En la imagen aparecen como lesiones inflamatorias con localizaciones más o menos características según las entidades, pero no existen signos claros que permitan establecer el diagnóstico etiológico exacto. Es decir, los radiólogos no podemos definir la entidad solo con la imagen, sino que necesitamos conocer los parámetros clínicos. Además, a veces los criterios clínicos diagnósticos para estas entidades no se cumplen de forma completa. En estos casos, a la vista de los hallazgos radiológicos, podría plantearse para su manejo un término más amplio como el de enfermedad inflamatoria idiopática orbitaria (fig. 9).
Enfermedad inflamatoria idiopática orbitaria por arteritis de células gigantes. A) Tomografía computarizada (TC) craneal, corte axial. B, E y F) Resonancia magnética (RM), corte axial potenciado en T1 con saturación grasa tras administrar gadolinio. C) RM, corte coronal potenciado en T1 con saturación grasa tras administrar gadolinio. D) RM, corte axial potenciado en T2. Paciente de 68 años (A) que acudió por pérdida de visión en ojo izquierdo y fue diagnosticado de neuritis óptica isquémica aguda. En la TC existía un engrosamiento de ambos nervios ópticos (flecha corta en A) y de las cubiertas bulbares (flecha larga en A). A pesar de que ni los datos clínicos ni las biopsias fueron concluyentes, se diagnosticó de arteritis de células gigantes y con esta sospecha se trató con corticoides. Reingresa 4 meses más tarde (B-F) por nueva clínica en ojo derecho. Se le realiza una tomografía por emisión de positrones (no mostrada) que describió una captación en cavum de Meckel y vértice orbitario derechos. La RM confirma la afectación del vértice orbitario (flecha gruesa en B) y evidencia un engrosamiento e hipercaptación de la duramadre del cavum de Meckel (punta de flecha en E) y del ligamento petroclinoideo derechos (punta de flecha en B), este último hipointenso en T2 (flecha negra en D). Además, se observó engrosamiento e hipercaptación de la pared de las arterias basilar y vertebral (flechas en C y F).
La enfermedad orbitaria infecciosa tiene su forma de manifestación más frecuente como celulitis septal y retroseptal, cuyo origen suele ser una afectación sinusal piógena o, más raramente, fúngica. Puede asociarse a pérdida de la agudeza visual cuando la infección se extienda y lesione el nervio óptico o cuando el componente inflamatorio comprometa el vértice orbitario.
La sinusitis fúngica es una afección infecciosa sinusal relativamente infrecuente. Se clasifica en dos formas: invasiva y no invasiva38,39. La forma invasiva se define por la presencia de hongos fuera de la cavidad aérea sinusal, ocurre en individuos inmunodeprimidos y clínicamente puede presentarse de forma aguda o crónica. En los casos agudos, el individuo acude con fiebre, rinorrea y ulceración mucosa. En las formas crónicas, el comienzo es insidioso y se caracteriza por la invasión progresiva de las estructuras parasinusales, como el vértice orbitario, lo que se puede traducir clínicamente con una disminución de la visión o de la motilidad ocular.
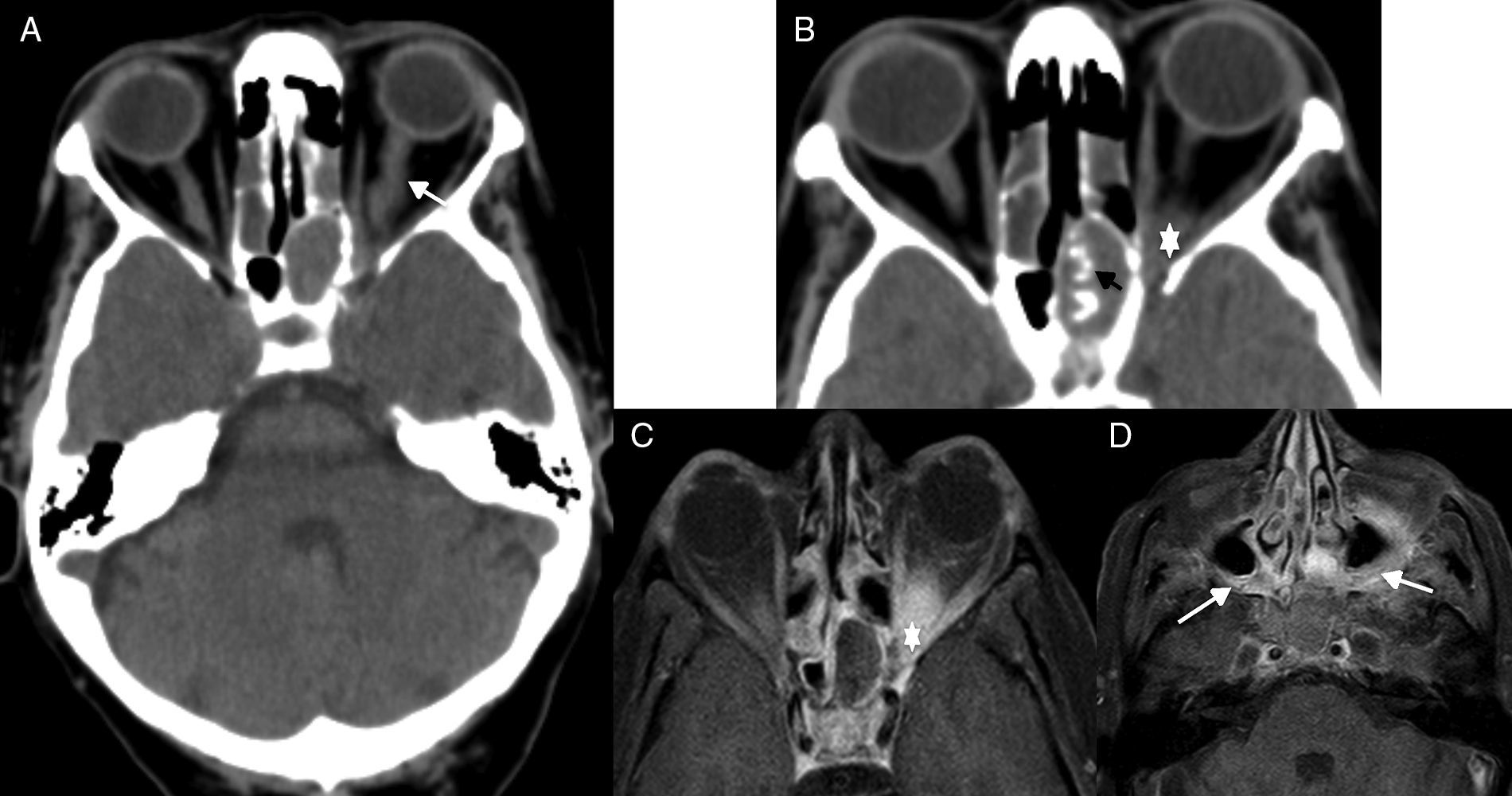
En la TC se observa una ocupación sinusal con presencia de calcificaciones densas y abigarradas40, y una mala definición de las estructuras del vértice orbitario secundaria a la presencia de tejido inflamatorio-fúngico. La RM define mejor la afectación orbitaria y la extensión del proceso (fig. 10).
Síndrome del ápex orbitario por sinusitis fúngica. A) Tomografía computarizada (TC) craneal, corte axial. B) TC de senos paranasales, corte axial. C y D) Resonancia magnética (RM), corte axial potenciado en T1 con saturación grasa tras administrar gadolinio. Paciente que acude a urgencias por pérdida de visión en ojo izquierdo. Se le realiza una TC de cráneo (A) en la que se observa un aumento del calibre del nervio óptico (flecha en A), una opacificación completa del seno esfenoidal, que presentaba las paredes engrosadas y calcificaciones groseras intrasinusales (flecha negra en B), y un aumento de partes blandas en el ápex (asterisco en B). Con la sospecha de sinusitis fúngica invasiva, se realiza RM (C y D), en la que se evidencia el aumento de partes blandas del ápex orbitario (asterisco en C) y la extensión de la inflamación a los tejidos blandos adyacentes (flechas blancas en D) en ambas fosas pterigopalatinas.
Cualquier paciente que tenga datos radiológicos de rinosinusitis crónica y obliteración de los planos grasos perisinusales debería hacer sospechar este diagnóstico.
ConclusiónLas urgencias no traumáticas de cabeza y cuello que clínicamente aparecen como combinación de tumefacción cervical, disfagia, disnea y déficit sensorial agudo son un porcentaje pequeño de las urgencias en la imagen de cabeza y cuello. El papel del radiólogo es determinar la localización y extensión del proceso, identificar hallazgos que permitan valorar la gravedad del cuadro, como la presencia de gas en la fascitis y diferenciar inflamación (no drenable) de absceso (drenable). Pero no debemos olvidar que somos radiólogos clínicos y que el éxito de un buen diagnóstico está en interpretar de forma correcta y estructurada las imágenes, considerándolas dentro del contexto clínico del paciente, y no de forma aislada e independiente. Así seremos capaces de establecer un diagnóstico correcto de los diferentes procesos, incluso en aquellos casos infrecuentes o con formas de presentación radiológica y clínica poco habituales.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría- 1.
Responsable de la integridad del estudio: BBA.
- 2.
Concepción del estudio: BBA.
- 3.
Diseño del estudio: BBA, MTG, LEG, YCI.
- 4.
Obtención de los datos: BBA, MTG, LEG, YCI.
- 5.
Análisis e interpretación de los datos: BBA, MTG, LEG, YCI.
- 6.
Tratamiento estadístico: BBA.
- 7.
Búsqueda bibliográfica: BBA, MTG, LEG, YCI.
- 8.
Redacción del trabajo: BBA, MTG, LEG, YCI.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: BBA, MTG, LEG, YCI.
- 10.
Aprobación de la versión final: BBA, MTG, LEG, YCI.
Los autores declaran no tener ningún conflicto de intereses.