Conocer los valores predictivos y la variabilidad interobservador de los descriptores y de las categorías diagnósticas del sistema BI-RADS- ecografía y su utilidad para predecir la malignidad de los nódulos sólidos mamarios.
Material y métodosSe seleccionaron consecutivamente 601 nódulos sólidos de 554 pacientes evaluados mediante ecografía. Todas las ecografías fueron realizadas por alguno de los 3 radiólogos participantes en el estudio y las imágenes estáticas revisadas independientemente por los 3, sin conocimiento de la historia clínica, de la mamografía ni de la anatomía patológica.
ResultadosLos descriptores que mejor predijeron la benignidad fueron el margen circunscrito y la formal oval (valor predictivo negativo [VPN] > 96%), la orientación paralela (VPN, 84–91%) y la interfase abrupta (VPN, 81–90%). Los que mejor predijeron la malignidad fueron el margen espiculado (valor predictivo positivo [VPP], 77–85%), el halo ecogénico (VPP, 61–71%) y la orientación antiparalela (VPP, 53–54%).
La concordancia interobservador fue buena para la morfología (κ=0,61), el margen circunscrito (κ=0,65) y las calcificaciones (κ=0,63).
Los descriptores que presentaron los valores pronósticos más altos para la malignidad fueron el margen espiculado (odds ratio [OR] =14,68–10,45) y la orientación antiparalela (OR=3,95–6,17).
La categoría 3 mostró un excelente VPN para los 3 radiólogos (99–100%). La concordancia interobservador fue buena para las categorías 5 (κ=0,77) y 3 (κ=0,68) y moderada para la 4 (κ=0,59).
ConclusionesEl sistema BI-RADS-ecografía ayuda a diferenciar las lesiones mamarias benignas de las malignas con una concordancia interobservador buena o moderada. La categoría 3 mostró un excelente VPN, lo que permitiría evitar las biopsias de las lesiones incluidas en ésta.
To determine the predictive values and the interobserver variability of the descriptors and diagnostic categories of the BI-RADS- Ultrasound system and its usefulness for predicting malignancy in solid breast nodules.
Material and methodsWe evaluated 601 consecutive solid nodules in 554 patients studied with ultrasound. All ultrasound examinations were performed by one of the three radiologists that participated in the study and the static images were reviewed by all three radiologists independently; radiologists were blind to the clinical history and to the findings at mammography and at histological study.
ResultsThe descriptors that best predicted benignity were circumscribed margins and oval shape (NPV, > 96%), parallel orientation (NPV, 84%–91%), and abrupt interface (NPV, 81%–90%). The descriptors that best predicted malignancy were spiculated margins (PPV, 77%–85%), echogenic halo (PPV, 61%–71%), and nonparallel orientation (PPV, 53%–54%).
Interobserver concordance was good for lesion shape (κ=0.61), circumscribed margins (κ=0.65), and calcifications (κ=0.63).
The descriptors that presented the highest prognostic values for malignancy were spiculated margins (OR=14.68–10.45) and nonparallel orientation (OR=3.95–6.17).
Final assessment category 3 yielded an excellent NPV for all three radiologists (99%–100%). The interobserver concordance was good for category 5 (κ=0.77) and for category 3 (κ=0.68); it was moderate for category 4 (κ=0.59).
ConclusionsThe BI-RADS- Ultrasound system helps differentiate benign breast lesions from malignant ones and has a good or moderate interobserver concordance. Final assessment category 3 yielded an excellent negative predictive value, making it possible to avoid biopsies in lesions in this category.
El sistema de informes y registro de datos de imagen de mama (BI-RADS) para la mamografía fue desarrollado por el American College of Radiology (ACR) para estandarizar y mejorar la calidad de los informes mamográficos y reducir la confusión en la interpretación del diagnóstico por la imagen de la mama, al suministrar información acerca del riesgo de malignidad de las lesiones detectadas y facilitar el control posterior de las pacientes1–3.
El ACR publicó conjuntamente con la cuarta edición del BI-RADS-mamografía la primera edición del BI-RADS-ecografía4 y del BI-RADS-resonancia magnética4.
El léxico describe aspectos morfológicos del nódulo (forma, orientación, márgenes, patrón ecográfico, calcificaciones, etc.) y hallazgos asociados de los tejidos circundantes (edema, distorsión de la arquitectura, etc.) y define 6 categorías finales según el nivel de sospecha de la lesión mamaria3–5.
Si bien la mamografía es la única técnica aceptada para el cribado de la patología mamaria, la ecografía se usa frecuentemente como técnica complementaria para estudiar una imagen o un área dudosa en una mamografía realizada previamente6.
Aunque múltiples estudios han evaluado el valor predictivo de distintos signos ecográficos para diferenciar las lesiones benignas de las malignas7–9, pocos lo han hecho utilizando sólo los descriptores del sistema BI-RADS-ecografía10–12.
La mayoría de los trabajos publicados que valoran la variabilidad interobservador coinciden en que tanto la mamografía13–17 como la ecografía18,19 tienen una considerable variabilidad intra e interobservador. Dada la relativamente reciente implantación del sistema BI-RADS-ecografía hay pocos trabajos que hayan estudiado la variabilidad interobservador de éste11,20.
El propósito del presente estudio es evaluar en nuestro medio los valores predictivos positivo y negativo, y la variabilidad interobservador de los descriptores y de las categorías finales del sistema BI-RADS-ecografía, así como valorar la utilidad de los descriptores para predecir la malignidad.
Material y métodosEl estudio se realizó de abril de 2002 a abril de 2005 en el Servicio de Radiodiagnóstico de nuestro hospital, centro de referencia para aproximadamente 350.000 habitantes. Para su realización se obtuvo la aprobación del Comité de Ética e Investigación Clínica.
La primera exploración que se realiza a las mujeres menores de 35 años en nuestra unidad es la ecografía, salvo que por la clínica se sospeche la presencia de un carcinoma, y la mamografía a las pacientes que tienen una edad igual o superior a 35 años.
Nuestra práctica clínica incluye una mezcla de estudios diagnósticos y de cribado, realizando aproximadamente 9.500 mamografías y 900 ecografías de mama anuales. Además, también se realizan procedimientos diagnósticos complementarios a las pacientes derivadas del programa de cribado de nuestra comunidad, de los que más del 95% son ecografías.
Desde abril de 2002 hasta abril de 2005 se realizaron en nuestra unidad 2.958 ecografías de mama. Se ha incluido en el estudio consecutivamente a las mujeres que durante este tiempo presentaron un nódulo sólido, palpable o no, de nueva aparición o bien que hubiese aumentado de tamaño con respecto a estudios previos.
Se estudió ecográficamente toda la mama. Las ecografías fueron realizadas por alguno de los 3 radiólogos participantes en el estudio (J.S., R.F. o P.A.), todos con experiencia en el diagnóstico de la mama y familiarizados con el uso del sistema BI-RADS, si bien no se hizo un entrenamiento específico previo a la valoración de las lesiones que fueron incluidas en este estudio.
Las estudios se realizaron con un ecógrafo Philips ATL HDI® 5.000 System (Philips Medical Systems, Bothell, WA) con un transductor lineal multifrecuencia de 5–12MHz. Se adquirieron imágenes en escala de grises y se grabaron en formato electrónico para su posterior valoración.
Se valoraron, al menos, 6 imágenes estáticas de cada nódulo 1 año más tarde de la realización del estudio, para evitar que cualquiera de los radiólogos pudiera sesgar los resultados al reconocer alguno de los casos en los que estuvo implicado. La valoración se realizó por los 3 radiólogos de forma independiente y sin conocimiento de la historia clínica, de la mamografía ni de la anatomía patológica.
Por ecografía se recogió el tamaño del nódulo, medido en su eje mayor y expresado en milímetros, los criterios del sistema BI-RADS-ecografía y la clasificación del nódulo en categoría 3, 4 o 5. Los nódulos se clasificaron sólo utilizando criterios ecográficos, por lo que pudo haber lesiones palpables que se clasificaran como categoría 3. Al valorar sólo nódulos sólidos no se utilizaron las categorías 0, 1 ni 2.
En todos los casos se obtuvo un diagnóstico anatomopatológico por punción aspiración con aguja fina (PAAF), biopsia con aguja gruesa (BAG) o por cirugía.
En nuestro hospital la PAAF es un método diagnóstico comúnmente utilizado para los nódulos categoría 3 en pacientes menores de 40 años sin factores de riesgo asociados. En los 123 nódulos en los que el diagnóstico se obtuvo sólo por citología se realizó seguimiento ecográfico durante al menos dos años para asegurar la estabilidad de la lesión.
Se realizó PAAF y BAG de los 478 nódulos restantes, utilizando para las biopsias pistolas automáticas tipo Acecut calibre 18G×75mm o 14G×75mm, obteniendo entre 2 y 4 cilindros por lesión. Siempre se realizó PAAF previamente a la biopsia con la finalidad de obtener varias muestras de la zona o zonas más sospechosas de la lesión. No se hizo un seguimiento específico de las pacientes en las que se obtuvo un resultado por biopsia de benignidad.
Se diagnosticaron quirúrgicamente 5 nódulos, 3 en los que el resultado de la biopsia fue no concluyente y 2 en los que hubo discordancia entre la imagen radiológica y el resultado anatomopatológico.
El análisis estadístico se realizó con la ayuda de los programas Statistical Package for Social Sciences (SPSS) versión 14.0 para Windows© y Tabulated Data Epidemiological Analysis (EPIDAT) versión 3.0 para Windows©.
Para cada uno de los descriptores del sistema BI-RADS-ecografía se calcularon los valores predictivos positivo (VPP) y negativo (VPN). Se calculó el VPP de un descriptor dividiendo el número de carcinomas por el número total de nódulos que presentó dicho descriptor, y el VPN dividiendo el número de lesiones benignas por el número total de nódulos que presentó dicho descriptor.
Para valorar la concordancia interobservador se halló el índice kappa de Cohen (κ) para los 3 observadores y por parejas para comprobar si alguno desplazaba el índice kappa global de forma significativa. De acuerdo con lo descrito por Fleiss et al21, el grado de acuerdo se consideró excelente o muy bueno entre 1 y 0,81; bueno entre 0,80 y 0,61; moderado entre 0,60 y 0,41; bajo entre 0,40 y 0,21, e insignificante si era ⩽0,20.
Posteriormente, se realizó un análisis multivariante para identificar las variables que se relacionaban de un modo independiente con el diagnóstico anatomopatológico. Para ello se diseñó un modelo de regresión logística que incluía como variable dependiente el diagnóstico anatomopatológico y como variables independientes la edad de las pacientes, el tamaño del nódulo y todos los descriptores del sistema BI-RADS-ecografía.
Se consideró un nivel de significación α de 0,05.
ResultadosLa muestra la integraron 601 nódulos sólidos mamarios de 554 pacientes. Las edades estuvieron comprendidas entre 17 y 88 años, con una media de 47 años. La media de edad de las pacientes con nódulos benignos fue de 44 años y la de las pacientes con nódulos malignos de 56 años.
El tamaño medio de los nódulos fue de 15,3mm (14,7mm de los benignos y 16,8mm de los malignos).
Fueron benignos 417 nódulos (69,4%), de los que 319 (76,5%) eran fibroadenomas, 41 (9,9%) cambios fibroquísticos, 25 (6%) adenosis esclerosante, 22 (5%) fibrosis estromal, 5 (1,2%) necrosis grasa, 2 (0,5%) cicatrices radiales, 2 (0,5%) tumores phyllodes benignos y 1 (0,3%) granuloma a cuerpo extraño.
Fueron malignos 184 nódulos (30,6%), de los que 159 (86,4%) eran carcinomas ductales infiltrantes, 14 (7,6%) carcinomas lobulillares infiltrantes, 7 (3,8%) carcinomas ductales in situ, 2 (1,1%) carcinomas medulares, 1 (0,5%) carcinoma mucinoso y 1 (0,5%) carcinoma metastásico.
Descriptores del sistema BI-RADS-ecografíaEn la tabla 1 se presentan los VPP y VPN de cada uno de los descriptores del sistema BI-RADS-ecografía para los 3 observadores.
Valores predictivos positivos (VPP) y negativos (VPN) de los descriptores y de categorías finales del sistema BI-RADS-ecografía para los 3 observadores*
| VPP 1 | VPP 2 | VPP 3 | VPN 1 | VPN 2 | VPN 3 | |
| Forma oval | 0,10 (1/103) | 2,70 (4/148) | 3,30 (6/179) | 99,10 (102/103) | 97,30 (144/148) | 96,60 (173/179) |
| Forma redondeada | 6,66 (1/15) | 20,00 (5/20) | 10,00 (1/10) | 93,33 (14/15) | 75,00 (15/20) | 90,00 (9/10) |
| Forma irregular | 37,68 (182/483) | 40,42 (175/433) | 42,96 (177/412) | 62,32 (301/483) | 59,58 (258/433) | 57,04 (235/412) |
| Orientación paralela | 16,35 (61/373) | 12,01 (40/333) | 9,48 (29/306) | 83,65 (312/373) | 87,99 (293/333) | 90,52 (277/306) |
| Orientación antiparalela | 53,95 (123/228) | 53,73 (144/268) | 52,54 (155/295) | 46,05 (105/228) | 46,27 (124/268) | 47,46 (140/295) |
| Margen circunscrito | 0 (0/114) | 2,19 (3/137) | 2,72 (4/147) | 100 (114/114) | 97,81 (134/137) | 97,28 (143/147) |
| Margen mal delimitado | 61,43 (43/70) | 59,82 (67/112) | 67,07 (112/167) | 38,57 (27/70) | 40,18 (45/112) | 32,93 (55/167) |
| Margen angulado | 50,47 (107/212) | 56,37 (115/204) | 44,22 (111/251) | 49,53 (105/212) | 43,63 (89/204) | 55,78 (140/251) |
| Margen microlobulado | 31,31 (124/396) | 37,71 (155/411 ) | 37,24 (124/333) | 68,69 (272/396) | 62,29 (256/411) | 62,76 (209/333) |
| Margen espiculado | 79,17 (114/144) | 85,33 (64/75) | 76,51 (114/149) | 20,83 (30/144) | 14,67 (11/75) | 23,49 (35/149) |
| Interfase abrupta | 14,42 (62/430) | 19,41 (85/438) | 10,50 (42/400) | 85,58 (368/430) | 80,59 (353/438) | 89,50 (358/400) |
| Halo ecogénico | 71,35 (122/171) | 60,74 (99/163) | 70,65 (142/201) | 28,65 (49/171) | 39,26 (64/163) | 29,35 (59/201) |
| Patrón hiperecogénico | 20,00 (1/5) | 36,84 (7/19) | 20,00 (3/15) | 80,00 (4/5) | 63,16 (12/19) | 80,00 (12/15) |
| Patrón complejo | 36,26 (33/91) | 31,82 (14/44) | 34,92 (22/63) | 63,74 (58/91) | 68,18 (30/44) | 65,08 (41/63) |
| Patrón hipoecoico | 32,78 (139/424) | 31,06 (155/499) | 32,18 (130/404) | 67,22 (285/424) | 68,94 (344/499) | 67,82 (274/404) |
| Patrón isoecoico | 14,81 (12/81) | 20,51 (8/39) | 24,37 (29/119) | 85,19 (69/81) | 79,49 (31/39) | 75,63 (90/119) |
| Sin cambios acústicos posteriores | 21,18 (36/170) | 15,69 (24/153) | 19,47 (59/303) | 78,82 (134/170) | 84,31 (129/153) | 80,53 (244/303) |
| Realce posterior | 17,94 (40/223) | 14,49 (30/207) | 19,47 (22/113) | 82,06 (183/223) | 85,51 (177/207) | 80,53 (91/113) |
| Sombra posterior | 52,43 (97/185) | 53,43 (109/204) | 55,56 (95/171) | 47,57 (88/185) | 46,57 (95/204) | 44,44 (76/171) |
| Patrón posterior combinado | 47,83 (11/23) | 56,76 (21/37) | 57,14 (8/14) | 52,17 (12/23) | 43,24 (16/37) | 42,86 (6/14) |
| Macrocalcificaciones | – (0/1) | – (0/2) | – (0/1) | – (1/1) | – (2/2) | – (1/1) |
| Microcalcificaciones fuera de la masa | 100 (3/3) | 50,00 (1/2) | 60,00 (3/5) | – (0/3) | 50,00 (1/2) | 40,00 (2/5) |
| Microcalcificaciones dentro de la masa | 51,85 (70/135) | 50,00 (85/170) | 55,28 (68/123) | 48,15 (65/135) | 50,00 (85/170) | 44,72 (55/123) |
| Ductos: calibre o arborización anormal | 60,00 (36/60) | 62,00 (93/150) | 50,00 (5/10) | 40,00 (24/60) | 38,00 (57/150) | 50,00 (5/10) |
| Cambios en los ligamentos de Cooper | 86,49 (32/37) | 72,73 (48/66) | 82,86 (29/35) | 13,51 (5/37) | 27,27 (18/66) | 17,14 (6/35) |
| Edema | 82,01 (114/139) | 68,64 (116/169) | 80,49 (33/41) | 17,99 (25/139) | 31,36 (53/169) | 19,51 (8/41) |
| Distorsión arquitectural | 81,13 (43/53) | 77,50 (93/120) | 84,62 (22/26) | 18,87 (10/53) | 22,50 (27/120) | 15,38 (4/26) |
| Engrosamiento cutáneo | 66,67 (8/12) | 57,14 (8/14) | 73,33 (11/15) | 33,33 (4/12) | 42,86 (6/14) | 26,67 (4/15) |
| Irregularidad o retracción cutánea | 54,55 (6/11) | 40,00 (4/10) | 57,14 (4/7) | 45,45 (5/11) | 60,00 (6/10) | 42,86 (3/7) |
| Categoría 3 | – (0/105) | 0,71 (1/141) | – (0/101) | 100 (105/105) | 99,29 (140/141) | 100 (101/101) |
| Categoría 4 | 8,94 (27/302) | 11,52 (25/217) | 9,57 (27/282) | 91,06 (275/302) | 88,48 (192/217) | 90,43 (255/282) |
| Categoría 5 | 80,93 (157/194) | 65,02 (158/243) | 72,02 (157/218) | 19,07 (37/194) | 34,98 (85/243) | 27,98 (61/218) |
1: observador 1; 2: observador 2; 3: observador 3.
Los descriptores que presentaron los mayores VPN fueron el margen circunscrito (97–100%), la forma ovalada (97–99%), la orientación paralela (84–91%) y la interfase abrupta (81–90%).
Los mayores VPP los presentaron el margen espiculado (77–85%), el halo ecogénico (61–71%) y la orientación antiparalela (VPP 53–54%).
De los descriptores que definen el patrón ecogénico ninguno obtuvo un VPP o VPN > 80%, excepto el patrón isoecoico para el primer observador (VPN 85%), si bien los patrones hiperecoico e isoecoico presentaron los VPN más altos en general.
De los hallazgos acústicos posteriores, los descriptores realce posterior y sin cambios posteriores obtuvieron los VPN más altos para los 3 observadores (81–86% y 79–84%, respectivamente). La sombra posterior presentó el VPP más alto (52–56%).
Presentaron calcificaciones 139 nódulos. No se presentan los valores predictivos de las macrocalcificaciones dentro del nódulo ni de las microcalcificaciones fuera del nódulo, ya que se identificaron ocasionalmente. Cuando se identificaron dentro del nódulo sus VPP y VPN fueron aproximadamente del 50%.
Hubieron amplias diferencias entre los 3 observadores al identificar los descriptores que hacen referencia a los tejidos circundantes a la lesión, salvo para el engrosamiento y la retracción cutánea. Las mayores diferencias fueron observadas para el calibre o la arborización anormal de los ductos. Para los 3 observadores los VPP más altos los obtuvieron los cambios en los ligamentos de Cooper (engrosamiento o retracción), el edema y la distorsión arquitectural.
No se valoró la presencia de vascularización con Doppler, ya que este descriptor no es útil para diferenciar las lesiones benignas de las malignas y no hay ningún patrón de vascularización específico.
En la tabla 2 se muestra la concordancia interobservador para todos los descriptores, detallándose el acuerdo final entre los 3 observadores, aunque también se realizó por parejas de observadores para comprobar que ninguno desplazaba el índice kappa global de forma significativa.
Variabilidad interobservador de los descriptores y de las categorías finales del sistema BI-RADS-ecografía en nuestra serie, en la de Lazarus et al y en la de Lee et al
| Nuestra serie k1-2-3 (IC del 95%) | Lazarus et al20 | Lee et al11 | |
| Forma | 0,61 (0,55–0,66) | 0,66 | 0,49 |
| Forma oval | 0,61 (0,55–0,69) | 0,71 | 0,47 |
| Forma redondeada | 0,37 (0,20–0,53) | 0,29 | 0,32 |
| Forma irregular | 0,63 (0,57–0,68) | 0,70 | 0,58 |
| Orientación | 0,59 (0,54–0,64) | 0,61 | 0,56 |
| Margen circunscrito | 0,65 (0,59–0,70) | 0,71 | 0,42 |
| Margen no circunscrito | 0,45 (0,38–0,52) | 0,24 | 0,33 |
| Margen mal delimitado | 0,35 (0,28–0,41) | 0,22 | 0,20 |
| Margen angulado | 0,37 (0,31–0,42) | 0,22 | 0,21 |
| Margen microlobulado | 0,43 (0,37–0,48) | 0,25 | 0,25 |
| Margen espiculado | 0,55 (0,49–0,61) | 0,26 | 0,66 |
| Límites de la lesión | 0,56 (0,51–0,62) | 0,69 | 0,59 |
| Ecogenicidad | 0,40 (0,39–0,50) | 0,29 | 0,40 |
| Patrón hiperecogénico | 0,37 (0,17–0,57) | 0,16 | 0,00 |
| Patrón complejo | 0,46 (0,38–0,55) | 0,40 | 0,13 |
| Patrón hipoecoico | 0,46 (0,41–0,52) | 0,29 | 0,41 |
| Patrón isoecoico | 0,40 (0,33–0,48) | 0,05 | 0,38 |
| Cambios acústicos posteriores | 0,56 (0,53–0,61) | 0,40 | 0,49 |
| Sin cambios acústicos posteriores | 0,44 (0,39–0,50) | 0,39 | 0,47 |
| Realce posterior | 0,58 (0,52–0,63) | 0,39 | 0,50 |
| Sombra posterior | 0,72 (0,67–0,77) | 0,66 | 0,59 |
| Patrón posterior combinado | 0,37 (0,22–0,52) | 0,09 | 0,14 |
| Calcificaciones | 0,63 (0,58–0,69) | – | 0,61 |
| Sin calcificaciones | 0,63 (0,58–0,69) | – | 0,64 |
| Microcalcificaciones fuera de la masa | 0,35 (0,40–0,65) | – | 0,00 |
| Microcalcificaciones en la masa | 0,64 (0,58–0,70) | – | 0,60 |
| Ductos: calibre o arborización anormal | 0,19 (0,13–0,25) | – | – |
| Cambios en los ligamentos de Cooper | 0,30 (0,21–0,39) | – | – |
| Edema | 0,36 (0,30–0,42) | – | – |
| Distorsión arquitectural | 0,31 (0,24–0,38) | – | – |
| Engrosamiento cutáneo | 0,38 (0,19–0,56) | – | – |
| Categoría (3, 4, 5) | 0,68 (0,64–0,72) | 0,28* | 0,53 |
| Categoría 3 | 0,68 (0,62–0,74) | 0,32* | 0,58 |
| Categoría 4 | 0,59 (0,54–0,64) | 0.19* | 0.35 |
| Categoría 5 | 0,77 (0,73–0,81) | 0,56* | 0,71 |
IC: intervalo de confianza; k1-2-3: Índice kappa para los 3 observadores.
Entre los tres observadores la concordancia fue buena para la morfología (κ=0,61), el margen circunscrito (κ=0,65) y las calcificaciones (κ=0,63). Fue moderada para la orientación, los hallazgos acústicos posteriores, el margen microlobulado, el margen espiculado, los límites de la lesión, el patrón ecográfico y la retracción cutánea, y baja para el resto de los descriptores.
Categorías finales del sistema BI-RADS-ecografíaEn la tabla 1 se presentan los VPP y VPN de las categorías 3, 4 y 5 del sistema BI-RADS-ecografía para los 3 observadores.
La categoría 3 presentó un VPN para los 3 observadores entre el 99 y el 100%, la categoría 4 un VPP entre el 9 y el 12% y la categoría 5 un VPP entre el 65 y el 81%.
En la tabla 2 se muestra la concordancia interobservador de las categorías. Fue buena (κ=0,68) para la categoría asignada al nódulo. La categoría que presentó mayor concordancia fue la 5 (κ=0,77) seguida de la 3 (κ=0,68) y la 4 (κ=0,59).
La categoría 5 también fue la que presentó la mejor concordancia por parejas de observadores seguida de la categoría 3 y de la 4.
Descriptores del sistema BI-RADS-ecografía predictores de malignidadEn la tabla 3 se presentan las odds ratio (OR) de los descriptores que se relacionaron de forma independiente con la malignidad para los 3 observadores (R1, R2 y R3).
Odds ratio (OR) de los descriptores del sistema BI-RADS-ecografía que se asociaron independientemente con la malignidad en el análisis multivariante para los 3 observadores
| OR (IC del 95%) 1 | OR (IC del 95%) 2 | OR (IC del 95%) 3 | |
| Edad | 1,076 (1,053–1,059) | 1,085 (1,062–1,108) | 1,074 (1,051–1,098) |
| Diámetro máximo | 1,073 (1,042–1,106) | 1,085 (1,052–1,119) | 1,078 (1,045–1,113) |
| Orientación antiparalela | 3,949 (2,389–6,530) | 5,690 (3,315–9,768) | 6,168 (3,480–10,931) |
| Margen microlobulado | 1,906 (1,081–3,359) | 2,979 (1,631–5,439) | 2,275 (1,344–3,885) |
| Margen espiculado | 14,677 (8,099–26,600) | 10,135 (4,577–22,444) | 10,447 (5,918–18,442) |
| Microcalcificaciones | 1,583 (0,901–2,779) | 1,856 (1,122–3,070) | 2,261 (1,269–4,030) |
IC: intervalo de confianza; 1: observador 1; 2: observador 2; 3: observador 3.
Para el primer observador el diagnóstico anatomopatológico estuvo relacionado de forma independiente con la orientación antiparalela, los márgenes microlobulados y los márgenes espiculados, además de con la edad de las pacientes y el tamaño del nódulo. El modelo de regresión logística clasificó correctamente el 87,9% de los nódulos para este observador.
Para el segundo y el tercer observador se relacionaron de forma independiente los mismos descriptores, aunque la presencia de calcificaciones también se relacionó de forma significativa para ambos. El modelo de regresión logística clasificó correctamente el 86,7% de los nódulos para el segundo observador y el 86,4% para el tercero.
Los márgenes espiculados (OR=14,68–10,14) y la orientación antiparalela (OR=6,20–3,95) son los que presentaron la mayor fuerza de asociación para los 3 observadores.
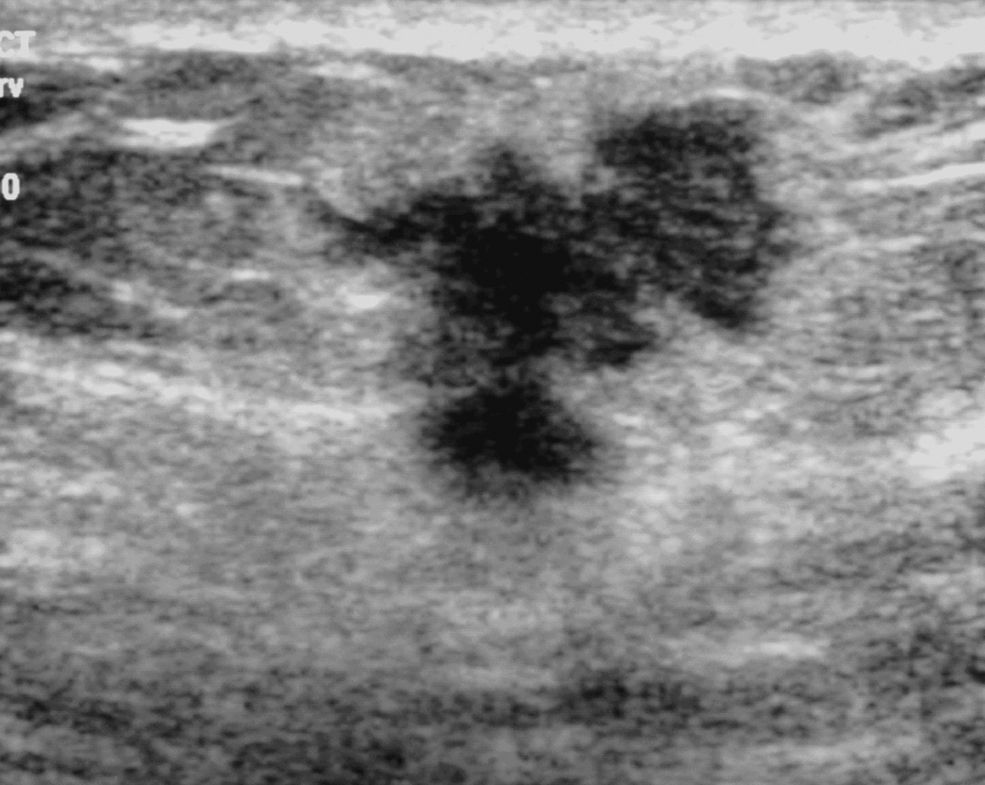
DiscusiónDescriptores del sistema BI-RADS-ecografíaLos descriptores que mejor predijeron la benignidad de los nódulos en nuestra serie fueron el margen circunscrito, la forma ovalada, la orientación paralela y la interfase abrupta de la lesión. En la serie de Hong et al22, compuesta por 403 nódulos, fueron los mismos descriptores con un VPN del 90, 84 y 78%, respectivamente, al igual que en la de Costantini et al10, que incluía 178 nódulos, con un VPN del 88, 80 y 71%, respectivamente. Por lo tanto, en las 3 series los descriptores con VPN más alto son los que tienen que estar presentes en una lesión para que se pueda incluir en la categoría 3: forma oval, margen circunscrito y orientación paralela (fig. 1).
Los descriptores que mejor predijeron la malignidad fueron el margen espiculado, el halo ecogénico y la orientación antiparalela, igual que en la serie de Hong et al22 en la que obtuvieron un VPP del 86, 70 y 69%, respectivamente. Sin embargo, en la de Costantini et al10 destaca el alto VPP que mostró el margen angulado (91%), ya que en nuestro estudio fue sólo del 44–56% y en el de Hong et al22 del 60%.
Con respecto al resto de los descriptores, de los que definen la ecogenicidad de la lesión, la isoecogenicidad obtuvo un VPN similar al obtenido por Hong et al22 (VPN 85%).
De los hallazgos acústicos posteriores, el descriptor realce posterior fue el que mejor predijo la benignidad, tanto en nuestra serie como en las de los otros autores10,22. Ninguno de ellos fue útil para predecir la malignidad, ni en nuestra serie ni en la de Hongs et al22, aunque en la de Costantini et al10 la sombra posterior sí lo fue al obtener un VPP del 79%.
Por último, las microcalcificaciones se identificaron fuera del nódulo en muy pocas ocasiones y las visibles dentro del nódulo no sirvieron para diferenciar las lesiones benignas de las malignas. Este descriptor no se valoró por Hong et al22 ni por Costantini et al10)
En general, los valores predictivos de los descriptores fueron similares en nuestra serie y en la de Hong et al22, difiriendo de los de Costantini et al10. Esto pudiera deberse a que en nuestra serie y en la de Hong et al22 la prevalencia de cáncer es muy similar (31 y 35%, respectivamente), siendo muy superior (59%) en la de de Costantini et al10 y, como es conocido, los valores predictivos de un test varían dependiendo de la prevalencia de la enfermedad objeto de estudio.
Según los trabajos publicados hasta el momento, los descriptores que representan alteraciones de los tejidos circundantes aparecen infrecuentemente y, si están presentes, sugieren que la lesión es maligna. En la serie de Hong et al22 sólo el 14% de los nódulos tenía alteraciones de los tejidos circundantes, de los que el 75% eran malignos, y en la de Constantini et al10 el 16%, de los que el 59% eran malignos. En nuestra serie estos descriptores se identificaron con mayor frecuencia, si bien hubo una amplia variabilidad entre los 3 observadores. Si se analizan individualmente, todos son más frecuentes en los nódulos malignos que en los benignos con porcentajes que varían entre el 54 y el 86%. El edema es el identificado con mayor frecuencia por los 3 observadores seguido de los cambios ductales y la distorsión arquitectural. Los menos frecuentes son el engrosamiento y la retracción de la piel, dato esperable puesto que su presencia generalmente indica una lesión maligna en un estadio muy avanzado.
Sólo se han encontrado 2 trabajos en los que se valorase la variabilidad interobservador de los criterios del sistema BI-RADS-ecografía, el publicado por Lazarus et al20, que incluyó 94 lesiones valoradas tanto por mamografía como por ecografía con una prevalencia de cáncer del 34%, y el recientemente publicado por Lee et al11, que evaluó la variabilidad intra e interobservador de 150 lesiones con una prevalencia de cáncer del 51%.
Como se muestra en la tabla 2 los descriptores que presentaron la mejor concordancia interobservador son los mismos en nuestra serie y en la de Lazarus et al20, margen circunscrito, morfología y sombra posterior. Dentro del descriptor morfología, la mayor concordancia en nuestra serie la presentó la forma irregular seguida de la forma oval (0,63 y 0,61, respectivamente), mientras que en la de Lazarus et al20 fue a la inversa (0,71 y 0,70, respectivamente).
Los resultados expuestos en la tabla parecen reflejar que, a excepción de la sombra posterior, la forma irregular y las calcificaciones en la masa, la concordancia es mayor para los descriptores observados en las lesiones benignas que para los visibles en las malignas.
Es destacable que en los 3 trabajos el descriptor margen circunscrito presentó una concordancia buena o moderada (tabla 2), lo que puede ser de mucha utilidad para diferenciar las lesiones benignas de las malignas. Por el contrario, la concordancia de los descriptores incluidos dentro del margen no circunscrito fue muy baja en las 3 series excepto para el margen espiculado (κ=0,66) en la serie de Lee et al11. Algunos autores sugieren que esta baja concordancia se debe a que varios de estos descriptores pueden coincidir en la misma lesión, lo que dificultaría el elegir uno de ellos, aunque esto no debe suponer un problema para el manejo clínico de las pacientes, puesto que todos ellos deben ser considerados como hallazgos sospechosos11 (figs. 2 y 3).
En la serie de Lee et al11 el descriptor calcificaciones obtuvo buena concordancia interobservador (κ=0,61). En nuestra serie también la obtuvo (κ=0,63), aunque en la de Lazarus et al20 sólo se identificó ocasionalmente. La concordancia para las microcalcificaciones dentro del nódulo fue buena tanto en nuestra serie como en la de Lee et al11 y baja para las que están fuera (tabla 2). Estos resultados confirman que las microcalcificaciones son difícilmente visibles en el tejido mamario normal, pero que son claramente visibles cuando están dentro de una lesión hipoecoica7.
Los descriptores orientación, límites de la lesión, espiculaciones y los márgenes microlobulados presentaron concordancia moderada.
Los márgenes mal definidos o angulados, los hallazgos acústicos posteriores, salvo la sombra posterior, y el patrón ecográfico mostraron baja concordancia en las 3 series. Lazarus et al20 sugieren que la baja concordancia del patrón ecográfico se debe a que los radiólogos tienen dificultad para elegir un único descriptor, sobre todo si la lesión es de gran tamaño. Algunos autores defienden que se añada el descriptor “combinado” para definir las masas heterogéneas11, aunque el patrón ecográfico no sea un criterio útil para diferenciar las lesiones benignas de las malignas7,20.
Con respecto a las alteraciones de los tejidos circundantes, su concordancia fue baja o insignificante en nuestra serie, presentando las mayores variaciones por parejas de observadores. En los otros trabajos no fueron valoradas11,20.
Es destacable que entre los descriptores que presentaron los mejores valores predictivos negativos, el margen circunscrito y la forma oval presentaron buena concordancia interobservador, mientras que para la orientación paralela y la interfase abrupta sólo fue moderada. Parece obvio, como ya demostraron Berg et al23 con respecto a los descriptores mamográficos, que un entrenamiento específico puede disminuir la variabilidad interobservador de los descriptores más útiles, incluso en el caso de radiólogos expertos.
Categorías finales del sistema BI-RADS-ecografíaAunque se han publicado numerosos trabajos acerca del valor predictivo de las categorías finales del sistema BI-RADS, la gran mayoría se ha realizado utilizando mamografía y ecografía24–27, limitándose a 3 los que utilizan sólo criterios ecográficos10–12.
En nuestra serie es de destacar el alto VPN de la categoría 3 para los 3 observadores (99,3–100%). El primer observador clasificó 103 nódulos como categoría 3, el segundo 141 y el tercero 101. Sólo uno de los nódulos del segundo observador fue maligno en el estudio anatomopatológico.
En las series que utilizaron la mamografía y ecografía el VPN de la categoría 3 varió entre el 9728 y el 99,8%25, y en las que usaron sólo criterios ecográficos entre el 9210 y el 100%28. El bajo VPN observado en la serie de Costantini et al10 puede deberse a que estos autores no siguieron estrictamente los criterios establecidos por el sistema BI-RADS-ecografía, puesto que incluían los nódulos con margen mal definido o sombra posterior como único signo de sospecha. En sus conclusiones finales admiten que si no los hubiesen incluido, el VPN de la categoría 3 habría alcanzado el 96%. En la serie de Lee et al11 el VPN de la categoría 3 fue del 95% y en la de Raza et al12 del 99,5%.
Graft et al23 analizaron si el seguimiento era una alternativa aceptable a la biopsia para los nódulos no palpables clasificados como categoría 3. En una serie de 445 nódulos obtuvieron un VPN del 99,8% tras un seguimiento entre 2 y 5 años. Hasta ahora se ha defendido la biopsia para cualquier lesión palpable, incluso si las características radiológicas de la lesión sugerían benignidad, a pesar de que hasta un 97–100% de las biopsias realizadas a anomalías palpables no visibles radiológicamente son benignas25,28,29 y casi el 100% si las lesiones presentan características mamográficas y ecográficas de benignidad27,30. Creemos, como otros autores12, que, dado el alto VPN que presenta la categoría 3 en la mayoría de las series, el coste sanitario y las molestias que presentan las pacientes, se podría evitar la biopsia de los nódulos incluidos en ella, siempre que se sigan estrictamente los criterios establecidos por el ACR para su inclusión en esta categoría.
En nuestra serie, la categoría 4 presentó un VPP entre el 9 y el 12%, similar al observado por Raza et al12 (16.2%), pero inferior al observado por otros autores, 4722 y 51%11.
El VPP de la categoría 5 fue del 65–81%, inferior al obtenido por Costantini et al10 (87%), Raza et al12 (93%) y Lee et al11 (96%). El sistema BI-RADS-ecografía establece que las lesiones incluidas en ésta deben tener un 95% o más de probabilidad de ser malignas, por lo que el bajo VPP obtenido en nuestra serie sugiere que se han clasificado como categoría 5 lesiones que deberían haber sido incluidas en la categoría 4. Esto hubiese mejorado el VPP de ambas categorías aunque, como demuestra la amplia variabilidad observada en todas las series, el VPP de la categoría 4 depende de la prevalencia de lesiones benignas y malignas incluidas en el estudio.
Con respecto a la concordancia interobservador, el valor obtenido para la categoría final fue buena (κ=0,68), la categoría 5 fue la que presentó una mayor concordancia (κ=0,77), seguida de la 3 (κ=0,68) y de la 4 (κ=0,59).
En la serie de Lazarus et al20 la concordancia de la categoría final fue baja (κ=0,28). Sólo la categoría 5 obtuvo una concordancia moderada (κ=0,56), siendo baja la de las categorías 3 (κ=0,32) y 4 (κ=0,16). Estas diferencias podrían explicarse porque las lesiones fueron valoradas por 5 radiólogos y la categoría 4 fue subdividida en subcategorías (a, b y c), si bien la categoría se determinó usando la mamografía y la ecografía conjuntamente, lo que, al menos en teoría, hubiese permitido una mejor caracterización de la lesión.
En la serie de Lee et al11 la concordancia de la categoría final fue moderada (κ=0,53), la que presentó la mayor concordancia fue la categoría 5 (κ=0,71) seguida de la 3 (κ=0,58). Como nosotros, estos autores sólo utilizaron criterios ecográficos, y como Lazarus et al20 subdividieron la categoría 4. Si no la hubiesen subdividido, la concordancia de la categoría global asignada al nódulo hubiese sido buena (κ=0,62).
Algunos autores sugieren que el uso de subcategorías es útil para comunicar a los clínicos y a las pacientes el nivel de sospecha de la lesión20, aunque otros refieren que la categoría 4b es ambigua11 y defienden dividir la categoría 4 sólo en 2 subcategorías11,31.
Descriptores del sistema BI-RADS-ecografía predictores de malignidadDe los descriptores que se asociaron de forma independiente con la malignidad los que presentaron un valor pronóstico más alto para los 3 observadores fueron el margen espiculado (OR= 14,68–10,45) y la orientación antiparalela (OR= 3,95–6,17) lo que indica que un nódulo que tenga los márgenes espiculados tiene al menos 10 veces más probabilidades de ser maligno que uno que no los tenga y que si el nódulo no es paralelo a la piel tiene 4 veces más probabilidades de ser maligno que uno que sea paralelo.
Sólo se ha encontrado un trabajo, el publicado por Zonderland et al32, en el que se realizó un análisis multivariante para identificar los descriptores del sistema BI-RADS-ecografía que se relacionaban de forma independiente con la malignidad. En su serie de 1.103 pacientes con una prevalencia de cáncer del 27% sólo se relacionaron la forma irregular, los márgenes mal definidos o no circunscritos y la sombra posterior (OR=8,38, 3,05 y 5.84, respectivamente). No obstante, destacan en sus conclusiones que el poder discriminatorio de estos descriptores no fue absoluto, ya que en 38 cánceres no fue identificado ninguno de ellos y en 11 de las lesiones benignas estaban todos presentes.
En nuestra serie los descriptores que se asociaron de forma independiente con la malignidad sí permitieron diferenciar los nódulos benignos de los malignos, ya que no hubo ninguna lesión maligna en la que no se identificara alguno de los descriptores que se asociaron independientemente con la malignidad y no hubo ningún nódulo benigno que presentase el margen espiculado y la orientación antiparalela, los 2 descriptores que más se asociaron con la malignidad.
En este estudio sólo se han incluido nódulos sólidos y tiene 2 limitaciones. La primera, que los 3 radiólogos participantes en el estudio sabían que a todos los nódulos incluidos en él se les realizaría una biopsia diagnóstica. Esto pudo influir al establecer la categoría final de éstos, ya que un falso negativo no tendría repercusión clínica. La segunda, que las ecografías se realizaron por alguno de los radiólogos participantes en el estudio y, posteriormente, sólo se valoraron imágenes estáticas.
Con respecto a la concordancia interobservador, en nuestro trabajo no se realizó un entrenamiento previo, por lo que los resultados pueden ser más representativos de la práctica clínica. Aunque no ha habido diferencias significativas entre los 3 observadores, sería útil valorar si los resultados variarían en función de la experiencia de los radiólogos incluidos en un estudio.
En conclusión, podemos decir que tanto los descriptores como las categorías finales del sistema BI-RADS-ecografía ayudan a diferenciar las lesiones mamarias benignas de las malignas, presentando una concordancia interobservador buena o moderada, que podría mejorarse con un adecuado entrenamiento.
Además, la categoría 3 presentó un alto valor predictivo negativo que permitiría evitar la biopsia de las lesiones incluidas en ella, lo que redundaría en una mejor asistencia al disminuir la ansiedad de las pacientes, la morbilidad del proceso y los costes de éste.
Declaración de conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AutoríaJosé M. Santana Montesdeoca realizó las pruebas, la recogida de datos, el análisis de éstos y la redacción del trabajo.
Alfredo Gómez Arnáiz colaboró en la redacción del trabajo y su revisión crítica.
Rafael Fuentes Pavón realizó las pruebas, la recogida de datos y el análisis de éstos.
Patricia Alemán Flores realizó las pruebas, la recogida de datos y el análisis de éstos.
José M. Limiñana Cañal realizó el estudio estadístico y el análisis de los datos obtenidos.
Ascensión Jorrín Moreno colaboró en la redacción del trabajo y su revisión crítica.
Todos los autores han leído y aprueban la versión final del artículo.