Debido al uso generalizado de la imagen médica para estudiar las enfermedades del cuello, la prevalencia de los nódulos tiroideos ha alcanzado el 67%. Esto es un problema sociosanitario relevante porque, después de evaluar las características del nódulo, hay que decidir cuándo hacer una aspiración con aguja fina ecoguiada para determinar cuáles son malignos. En este trabajo, revisamos la técnica ecográfica y la de la punción, las diferentes guías de actuación para caracterizar los nódulos tiroideos y los criterios que ayudan a determinar qué pacientes necesitan la punción diagnóstica y evitar procedimientos invasivos innecesarios. Colaborar estrechamente con los diferentes especialistas implicados en el manejo del nódulo tiroideo permite optimizar los recursos y obtener más rendimiento diagnóstico.
The widespread use of medical imaging to study diseases of the neck reveals the prevalence of thyroid nodules can be as high as 67%. This is an important problem for the healthcare system because after analyzing the characteristics of the nodules a decision must be made regarding whether to perform fine-needle aspiration cytology to determine whether the lesion is malignant. In this article, we review the techniques for ultrasonographic study and fine-needle aspiration. We discuss the different guidelines for characterizing thyroid nodules and the criteria that help determine which patients need fine-needle aspiration for diagnosis and when an invasive procedure is unnecessary and can be avoided. Close collaboration with the different specialists involved in the management of thyroid nodules helps optimize resources and diagnostic performance.
El uso generalizado de la imagen médica para estudiar las enfermedades del cuello ha contribuido a detectar, muchas veces incidentalmente, nódulos tiroideos, lo que ha aumentado su prevalencia hasta el 67% en la población general. Sin embargo, solo un 10% son malignos1. El reto es determinar cuáles son malignos y decidir cuáles deben intervenirse quirúrgicamente2.
La ecografía es la técnica de elección para el cribado de los nódulos tiroideos. Sin embargo, pese a que se ha intentado establecer qué características diferencian los malignos de los benignos, no existe consenso sobre qué lesiones deben ser biopsiadas. Ante este problema, es necesario unificar criterios sobre qué características ecográficas indican que el nódulo es maligno o benigno con un valor predictivo aceptable3. Entre estas características están, principalmente, la forma, los márgenes, la ecogenicidad y las calcificaciones. Estudios recientes han indicado que, aisladamente, un signo ecográfico no sirve para predecir malignidad, pero combinar varios de ellos y la muestra citológica aumenta claramente la especificidad2,4. El propósito de este trabajo es revisar las últimas guías de actuación para caracterizar los nódulos tiroideos y adoptar criterios que ayuden a seleccionar a los pacientes que requerirán una punción diagnóstica.
Técnica y anatomía ecográfica del tiroidesLa glándula tiroides está situada en la región anteroinferior del cuello, en el espacio infrahioideo. Está formada por 2 lóbulos, derecho e izquierdo, unidos por el istmo. En el adulto normal, cada lóbulo tiene un diámetro longitudinal de 40 a 60mm y uno anteroposterior de 13 a 18mm. El espesor del istmo es de 4 a 6mm5.
En condiciones normales, la ecogenicidad de la glándula es homogénea, mayor que la de los músculos. Sus bordes están bien definidos y se separa con nitidez del resto de las estructuras circundantes. Con ecografía Doppler color, se pueden identificar en ambos polos las arterias y venas tiroideas6.
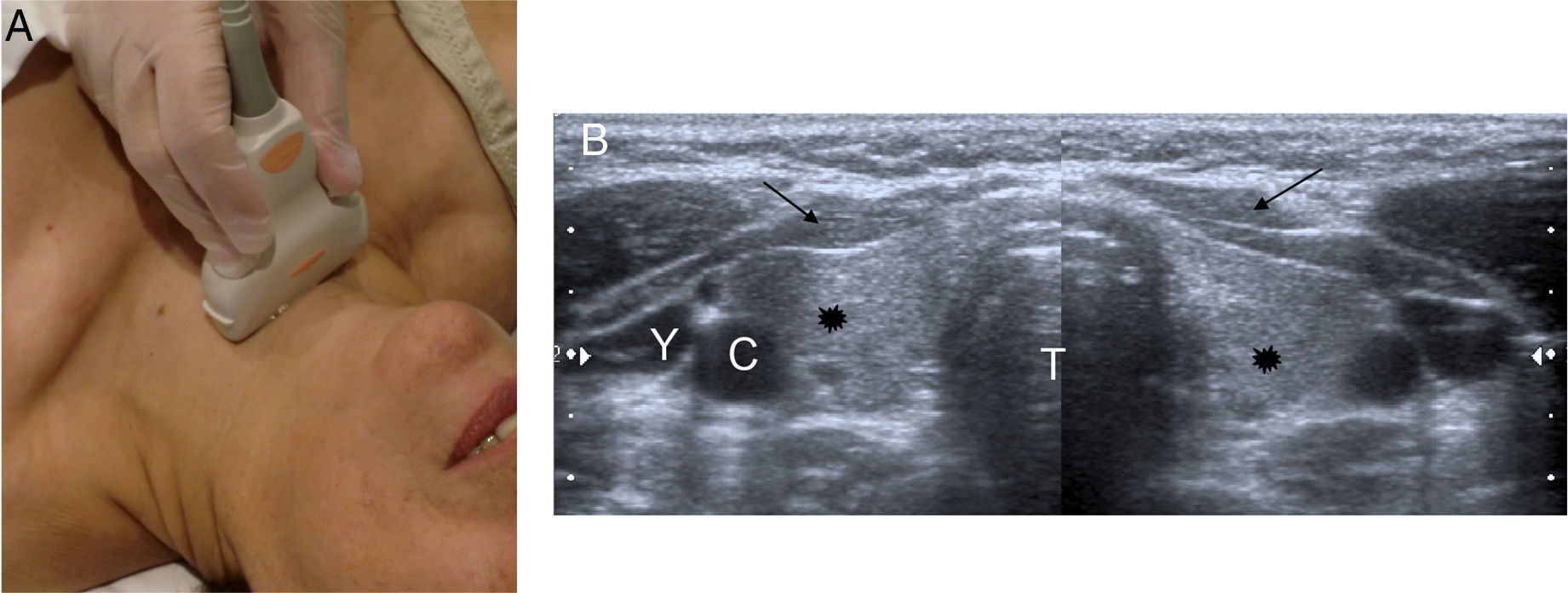
Debido a la localización superficial de la glándula, tanto la ecografía de alta resolución en tiempo real como el Doppler color son muy útiles para estudiar la anatomía y las lesiones tiroideas. Debe realizarse siempre que se sospeche un nódulo tiroideo4, con transductores lineales de frecuencias entre 7,5MHz y 12MHz. Se coloca al paciente en decúbito supino, con el cuello extendido (puede colocarse una almohada debajo de los hombros para facilitar la hiperextensión del cuello). Debe examinarse la glándula completa, incluido el istmo, en planos transversales y longitudinales, extendiéndose hasta la región yugular, submandibular y supraclavicular, donde puede haber adenopatías5,6 (fig. 1). La ecografía es la técnica de elección para valorar la glándula tiroidea, ya que permite estimar el volumen tiroideo, detectar nódulos no palpables (de hasta 3mm), diferenciar nódulos quísticos de sólidos, caracterizar, localizar y medir los nódulos, servir de guía para la punción o biopsia, monitorizar la respuesta terapéutica y detectar adenopatías u otras masas cervicales7.
Enfermedad nodular de la glándula tiroidesEcográficamente, se puede diferenciar entre nódulos (único o múltiples) y una afectación difusa, sin o con nódulos5,6. La afectación tiroidea difusa no es objeto de este artículo.
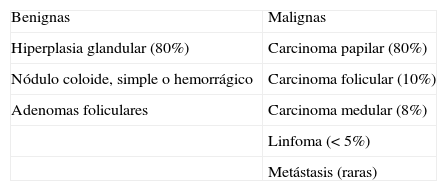
El nódulo tiroideo se define como la lesión tiroidea focal, palpable o no, que ecográficamente es diferente del parénquima tiroideo que lo rodea8. Los nódulos tiroideos pueden ser benignos y malignos9 (tabla 1). Los no palpables tienen el mismo riesgo de malignidad que los palpables1.
La hiperplasia glandular representa el 80% de la enfermedad nodular benigna. Los nódulos hiperplásicos son habitualmente isoecogénicos, con un halo hipoecogénico que suele corresponder a vasos periféricos. Frecuentemente, se necrosan o sangran y se comportan como lesiones quísticas, donde se acumula sangre, líquido seroso o sustancia coloide5,6. Los cambios degenerativos se correlacionan con su apariencia ecográfica en forma de áreas puramente anecogénicas que corresponden a fluido seroso o coloide, liquido ecogénico o con niveles líquido-líquido móviles que corresponden a hemorragia y focos ecogénicos brillantes con artefactos de reverberación en «cola de cometa», por material coloide denso. Cuando los espacios quísticos suponen más del 50% del volumen del nódulo, se denomina patrón «espongiforme» y los septos delgados intraquísticos que con el Doppler son avasculares, probablemente corresponden a restos de tejido tiroideo5,10.
El adenoma folicular benigno aparece sobre todo en mujeres; la mayoría no son funcionantes. Ecográficamente, suele mostrarse como un nódulo único, más ecogénico que la glándula, algunas veces con una cápsula que lo delimita. Con el Doppler, los vasos se dirigen desde la periferia hacia el centro («en rueda de carro»)5.
Los nódulos malignos representan el 1% de las neoplasias con mayor prevalencia en el sexo femenino. Los carcinomas papilar y folicular son los más frecuentes, con un pronóstico excelente y una supervivencia a los 20 años del 90-95%.
El carcinoma papilar tiene más incidencia en la edad media de la vida y durante la infancia. Suele presentarse como un nódulo sólido hipoecogénico en el 85% de los casos. Es característica la presencia de «cuerpos de psamoma», que ecográficamente se traducen como microcalcificaciones. Metastatiza en los ganglios cervicales, los cuales pueden presentar las mismas microcalcificaciones que el tumor primario. En la exploración con Doppler es característico el aumento de vascularización central4,5.
El carcinoma folicular puede asociarse a un bocio multinodular en el 75% de los casos. Lo más frecuente es que sea un nódulo isoecogénico o hipoecogénico, no metastatiza en los ganglios cervicales, no suele presentar microcalcificaciones y disemina por vía hematógena al hueso, pulmón, cerebro e hígado. La dificultad radica en diferenciarlo del adenoma folicular, ya que ecográfica y citológicamente no se pueden distinguir. El diagnóstico definitivo es anatomopatológico4–6,10.
El carcinoma medular es más agresivo, con una supervivencia a los 10 años entre el 42 y el 90%. Puede presentarse de forma esporádica o ser familiar y representa alrededor del 8% de todos los carcinomas de tiroides. La característica más importante es la producción de calcitonina y medirla es útil tanto para diagnosticarlo, como para el cribado familiar y el seguimiento. En la ecografía, es un nódulo único hipoecogénico con macrocalcificaciones en el 90% de los casos y halo periférico grueso e irregular. Puede formar parte del síndrome de neoplasia múltiple, donde con mayor frecuencia es multifocal y bilateral4–6,10.
El carcinoma anaplásico es el de peor pronóstico, con una supervivencia a los 5 años del 5%. Supone el 5% de las neoplasias tiroideas. Son tumores hipoecogénicos y, a menudo, rodean e invaden las estructuras vasculares y los músculos cervicales5.
El linfoma tiroideo representa alrededor del 2% de todas las neoplasias tiroideas. En la mayoría de los pacientes, se trata de un linfoma no Hodgkin de grado bajo o intermedio. Suele ser un nódulo alargado, de muy baja ecogenicidad, tamaño variable, bordes lobulados y áreas de necrosis4,6.
Las metástasis, típicamente de pulmón, mama y riñón, tienen características ecográficas inespecíficas y se suelen ver como nódulos sólidos asociados a una neoplasia conocida4,5.
Diagnóstico clínico del nódulo tiroideoLa anamnesis debe orientarse a los antecedentes familiares del paciente y a los factores de riesgo para el cáncer de tiroides, porque si junto con los signos ecográficos hay datos de sospecha, se va a modificar el manejo del nódulo tiroideo7,8,11 (tabla 2).
Factores de riesgo para desarrollar cáncer de tiroides
| Signos de alta sospechaHistoria familiar de carcinoma de tiroides o neoplasia endocrina múltipleRápido crecimiento tumoralNódulo duro, firme o fijo a estructuras adyacentesParálisis de cuerdas vocalesAdenopatías regionales: cervicales, supraclaviculares, submentonianas y metástasis a distancia |
| Signos de moderada sospechaEdad inferior a 20 años y superior a 70 añosSexo masculinoHistoria de irradiación de cabeza y cuello en la infancia y adolescenciaNódulo mayor de 4cmPresencia de síntomas de compresión de la vía aérea incluyendo disnea, disfonía, disfagia o ronquera |
El nódulo tiroideo es generalmente asintomático, pero si aumenta de tamaño puede causar síntomas por compresión, como dificultad respiratoria, para deglutir, disfonía, paresia del nervio recurrente, dolor en el cuello y, si se altera la función tiroidea, síntomas de hiper o hipotiroidismo. Estos son importantes ya que pueden modificar el algoritmo diagnóstico y condicionar el tratamiento7,11.
En cuanto a los datos de laboratorio, son importantes11:
- –
Tirotropina (TSH): cuando se detecte un nódulo tiroideo, debe medirse el nivel sérico de la TSH, porque la posibilidad de malignidad es mayor en pacientes con valores altos y los nódulos con valores bajos raramente son malignos.
- –
Tiroglobulina: excelente marcador tumoral para seguir los pacientes con carcinoma papilar.
- –
Calcitonina: solo se determina de forma sistemática en pacientes con historia familiar o antecedentes personales de carcinoma medular de tiroides.
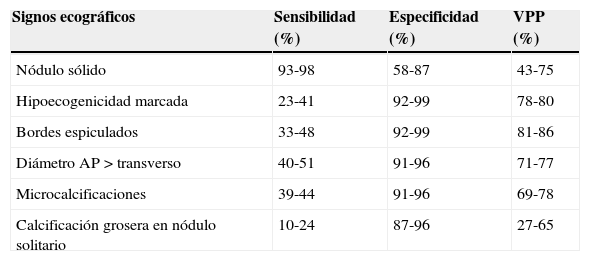
La ecografía tiene un papel imprescindible en la evaluación inicial del nódulo tiroideo7. Aunque algunos signos ecográficos son altamente específicos, ninguno de ellos por sí solo permite determinar la malignidad del nódulo tiroideo2,11,12 (tabla 3).
Valores diagnósticos de los signos ecográficos más significativos para malignidad en el nódulo tiroideo
| Signos ecográficos | Sensibilidad (%) | Especificidad (%) | VPP (%) |
|---|---|---|---|
| Nódulo sólido | 93-98 | 58-87 | 43-75 |
| Hipoecogenicidad marcada | 23-41 | 92-99 | 78-80 |
| Bordes espiculados | 33-48 | 92-99 | 81-86 |
| Diámetro AP > transverso | 40-51 | 91-96 | 71-77 |
| Microcalcificaciones | 39-44 | 91-96 | 69-78 |
| Calcificación grosera en nódulo solitario | 10-24 | 87-96 | 27-65 |
Tomado de Zabala Landa et al.11.
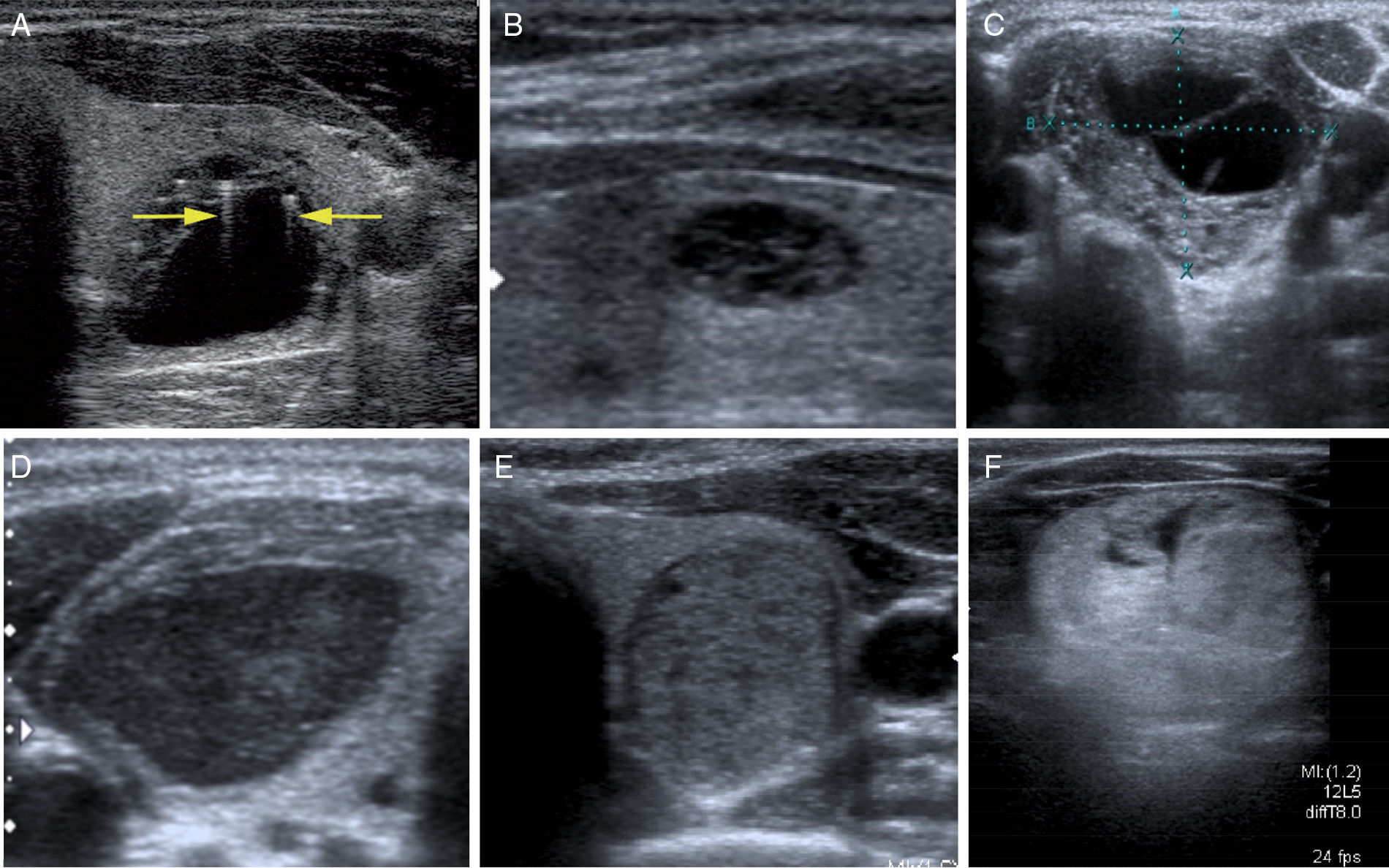
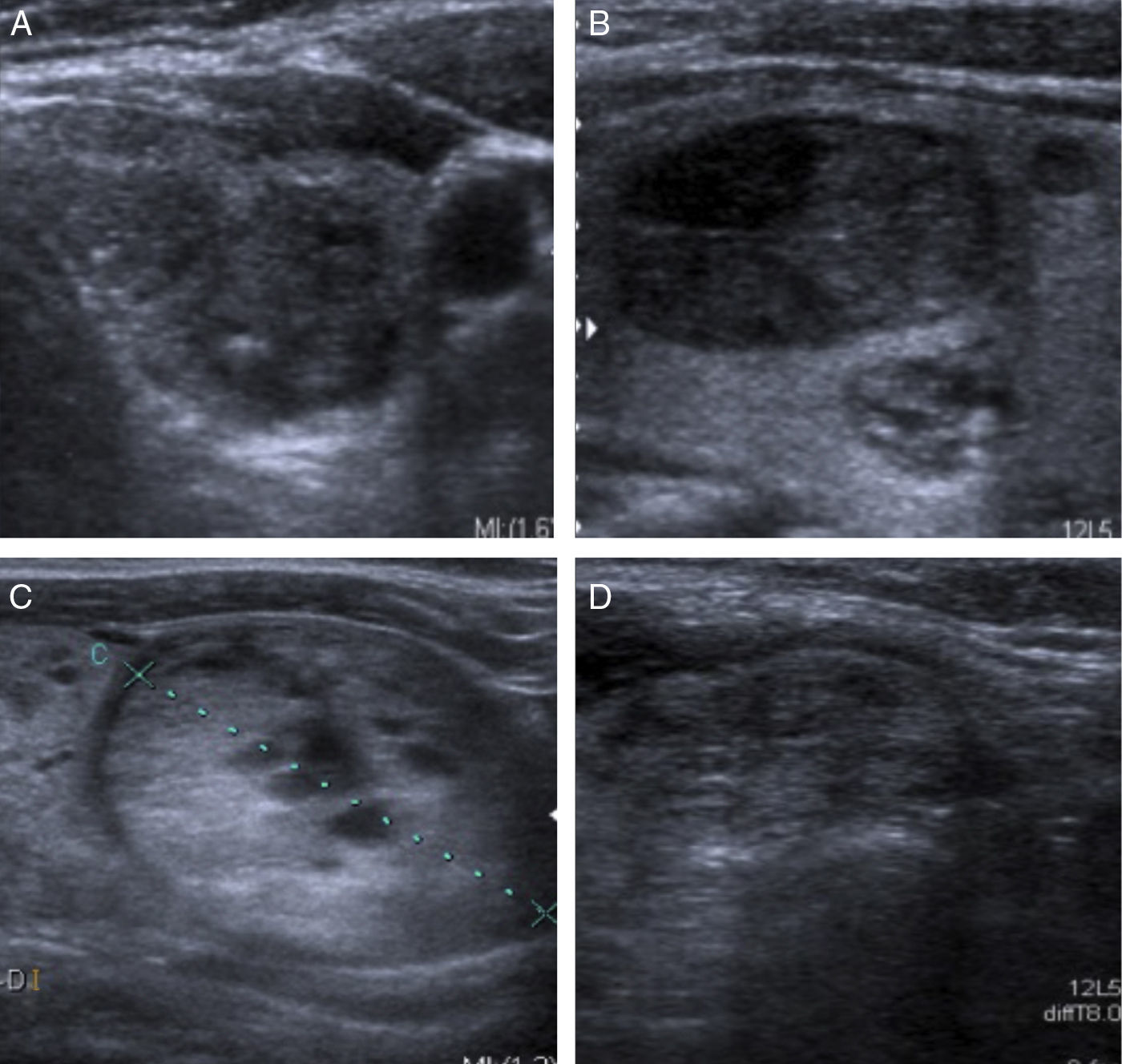
1. Consistencia. Los nódulos pueden ser sólidos, quísticos y mixtos (sólido-quísticos). Con frecuencia, los nódulos malignos son sólidos e hipoecogénicos. La característica más sensible es la consistencia sólida1,2,4. Quistes por encima de 1,5-2cm son raros, pero, si existen, se puede asegurar que son benignos1,10. Quistes menores de 1cm pueden contener un foco ecogénico brillante, que corresponde a contenido coloide con artefacto de reverberación en «cola de cometa» y suelen verse en nódulos hiperplásicos benignos. Algunos nódulos isoecogénicos contienen microquistes múltiples que ocupan más de la mitad del volumen del nódulo y se denominan «espongiformes» o «en panal de abeja» (fig. 2). Las lesiones quísticas y los nódulos espongiformes se consideran patrones ecográficos de benignidad, con un elevado valor predictivo positivo (99%)2,11.
Consistencia y ecogenicidad. A) Quiste coloide con artefacto de reverberación «en cola de cometa» (flechas). B) Patrón espongiforme. Nódulos con microquistes que ocupan más del 50% de su volumen. C) Patrón sólido-quístico. Nódulo sólido con degeneración quística. El resultado citológico fue de benignidad. D) Nódulo sólido marcadamente hipoecogénico. Carcinoma papilar de tiroides. E) Nódulo sólido hiperplásico isoecogénico con halo hipoecogénico. F) Nódulo hiperecogénico, bien definido sin signos ecográficos de sospecha.
2. Ecogenicidad. Los nódulos pueden ser hipoecogénicos comparando la ecogenicidad con el parénquima tiroideo adyacente o los músculos infrahiodeos, isoecogénicos cuando tiene la misma ecogenicidad que el parénquima tiroideo o hiperecogénicos cuando la ecogenicidad es mayor. La hipoecogenicidad marcada es muy específica (92-99%) de malignidad2,11.
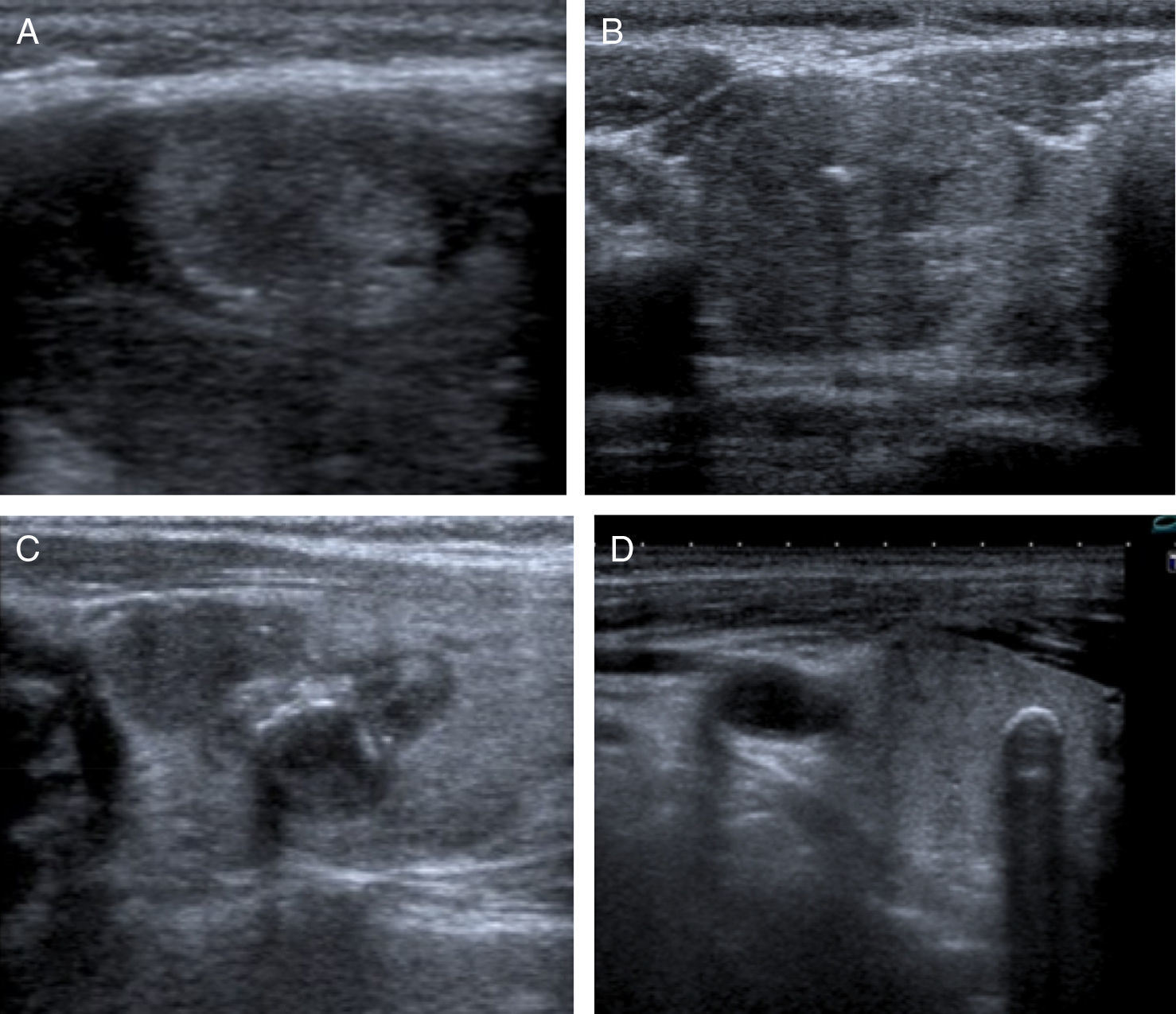
3. Calcificaciones. Se clasifican como microcalcificaciones, calcificaciones groseras o calcificaciones en cáscara de huevo (periféricas). Las microcalcificaciones son una de las características más específicas de malignidad, con alto valor predictivo positivo. Corresponden generalmente a «cuerpos de psamoma» típicos del carcinoma papilar. Ecográficamente, aparecen como focos hiperecogénicos sin sombra acústica posterior. Las calcificaciones groseras y las calcificaciones en cáscara de huevo son inespecíficas, aunque las calcificaciones groseras también se pueden encontrar en nódulos solitarios o en el cáncer medular2,10,13 (fig. 3).
Calcificaciones. A) Pequeños focos ecogénicos sin sombra posterior que corresponden a microcalcificaciones. B) Calcificaciones groseras en el centro de un nódulo isoecogénico. El estudio citológico confirmó que se trataba de un nódulo benigno. C) Calcificaciones groseras agrupadas en el interior de un nódulo sólido e hipoecogénico, altamente indicativo de malignidad. El diagnóstico citológico fue de carcinoma papilar. D) Calcificación en cáscara de huevo.
4. Márgenes. Los márgenes del nódulo tiroideo pueden estar bien, regular o mal definidos, o ser irregulares, algunos microlobulados. Los márgenes irregulares y espiculados son muy específicos (91,8%) de malignidad2,11. Sin embargo, la mayoría de los nódulos benignos tienen los márgenes regulares10 (fig. 4).
Márgenes y halo. A) Márgenes lobulados mal definidos, rodeando un nódulo hipoecogénico que anatomopatológicamente correspondió a un carcinoma papilar. B) Márgenes bien definidos. C) Halo completo regular en un nódulo sólido isoecogénico. El resultado del estudio citológico fue de benignidad. D) Nódulo sólido con halo incompleto. El estudio citológico y la intervención quirúrgica confirmaron que se trataba de un carcinoma papilar.
5. Halo. Es un anillo hipoecogénico debido a la seudocápsula fibrosa, a un infiltrado inflamatorio o a parénquima comprimido. Un halo uniforme y completo es muy indicativo de benignidad con un valor predictivo negativo del 95%11. Sin embargo, no ver el halo es de baja especificidad para el cáncer de tiroides, porque está presente en más de la mitad de los nódulos benignos y en hasta un 10-24% de los carcinomas papilares4 (fig. 4).
6. Forma. Las lesiones ovaladas con un diámetro anteroposterior mayor que el transversal se asocian a malignidad, con una especificidad del 93%1,11.
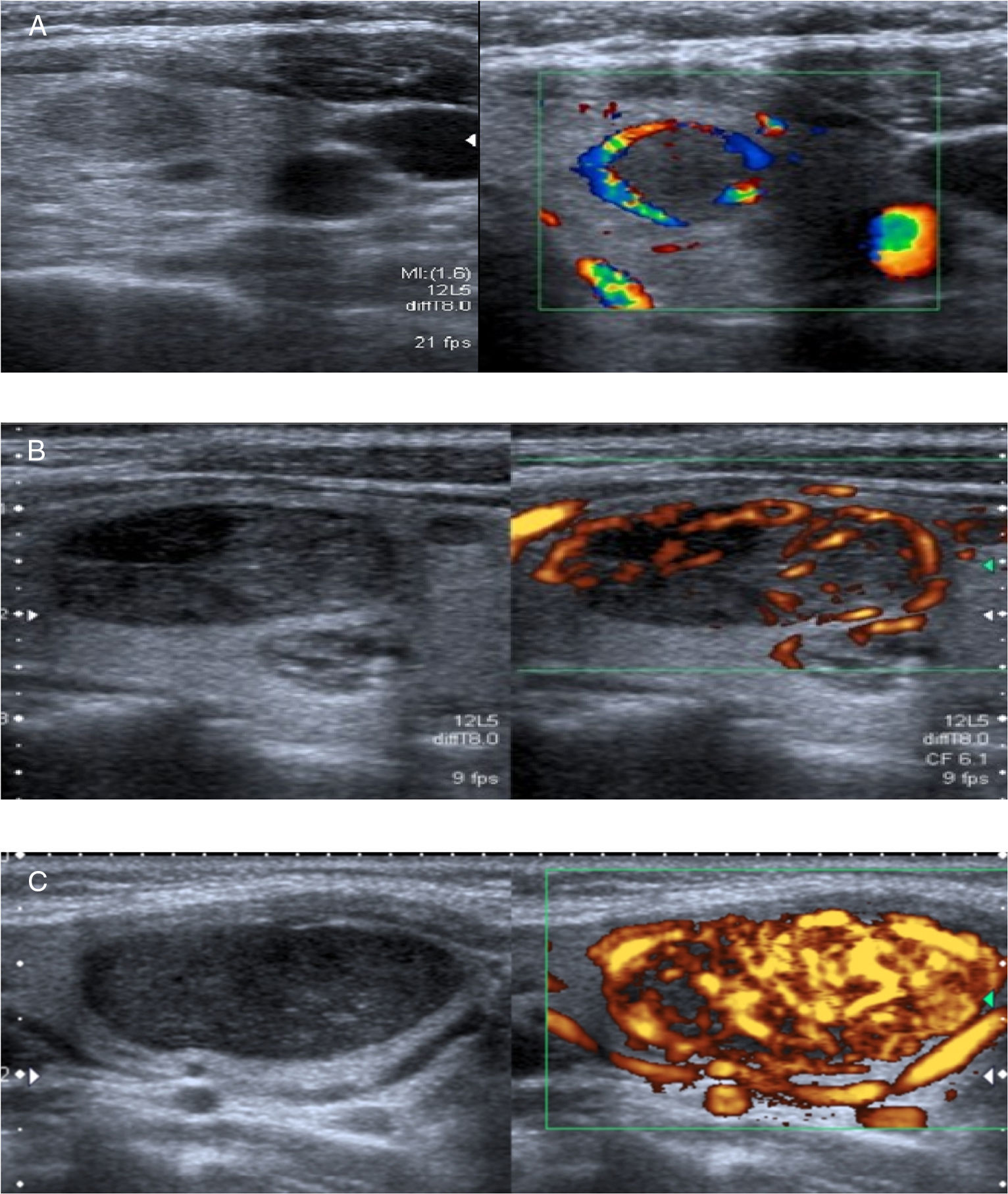
7. Patrón de vascularización. Se clasifica en flujo ausente, vasos periféricos y vasos centrales. Aunque el patrón central está presente en el 74% de los nódulos malignos, es un signo poco específico de malignidad11,14. El patrón más característico de los nódulos benignos es la vascularización periférica. Un nódulo completamente avascular es muy improbable que sea maligno, aunque siempre hay que tener en cuenta la sensibilidad de los diferentes equipos y la variabilidad en la interpretación1,8,12 (fig. 5).
8. Invasión local o metástasis en los ganglios linfáticos. Son signos muy específicos de malignidad. Las características ecográficas de las adenopatías metastásicas son la alteración de la ecoestructura normal, microcalcificaciones o áreas quísticas11. La invasión de estructuras vecinas se relaciona con tumores agresivos, como el carcinoma anaplásico, linfoma y sarcoma. Las metástasis en los ganglios linfáticos son más comunes en el carcinoma papilar y raras en el folicular6,8.
Otras características menos específicas son:
- –
Tamaño del nódulo. No influye en el diagnóstico de benignidad o malignidad1,15.
- –
Número de nódulos. El riesgo de malignidad de cada nódulo en una glándula con múltiples nódulos es comparable al de un nódulo solitario. El carcinoma folicular se encuentra con frecuencia en glándulas multinodulares y el carcinoma papilar es multifocal en el 20% de los casos1,2.
- –
Crecimiento del nódulo: El nódulo crece significativamente cuando aumenta su diámetro en más del 20% o existe un incremento de al menos 2mm en 2 o más dimensiones, en un intervalo de seguimiento de 6-18 meses1,8. En general, un crecimiento progresivo del nódulo es un indicador deficiente de malignidad2,7,10,16.
Es una técnica poco cruenta, segura y barata, que diagnostica entre el 80 y el 95% de los casos. En centros con experiencia el uso de la punción aspiración con aguja fina ecoguiada (EcoPAAF) ha disminuido las tiroidectomías en un 50%. No tiene apenas complicaciones; las más frecuentes, los hematomas cutáneos o intraquísticos. La toma de antiagregantes plaquetarios o la anticoagulación no la contraindican por el escaso riesgo de complicaciones hemorrágicas7.
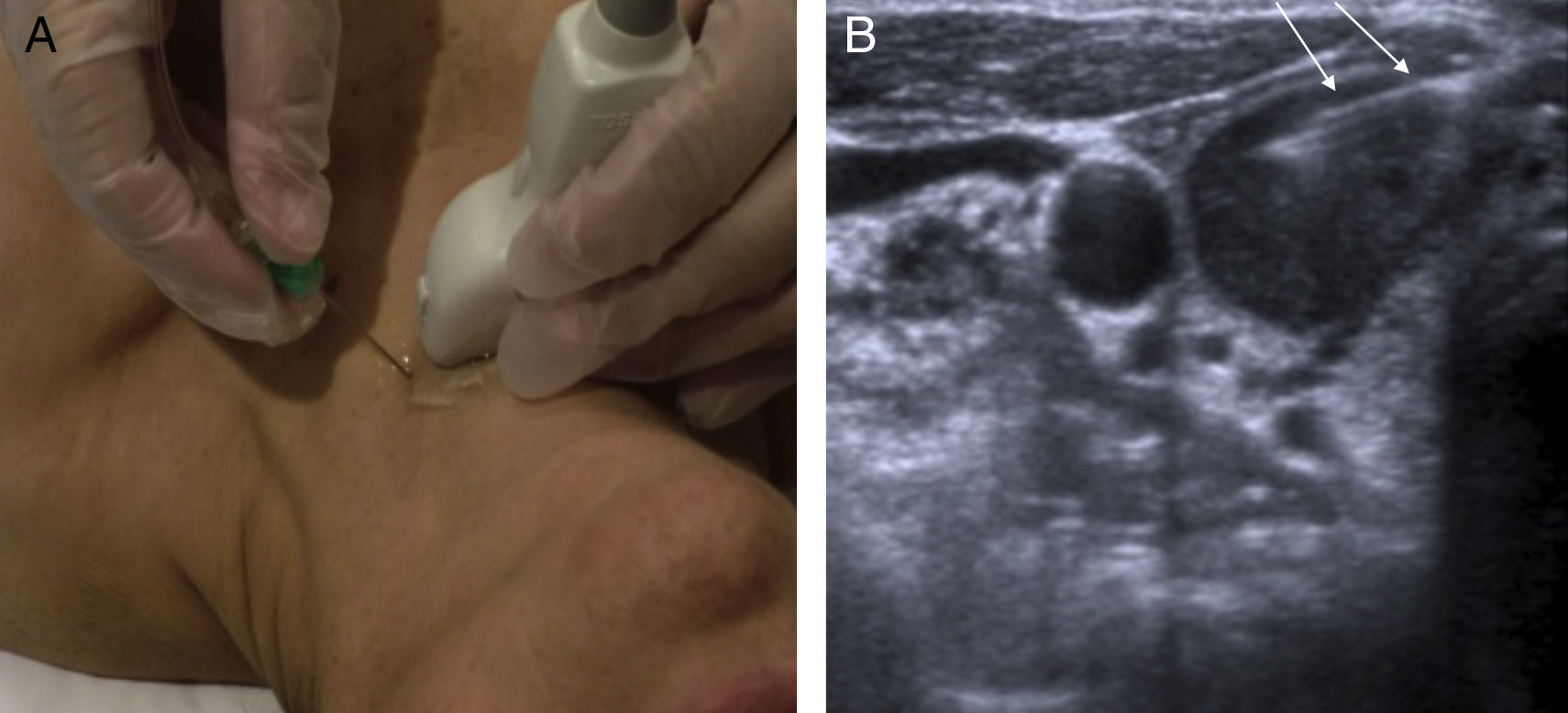
Antes de hacerla, se explica al paciente el procedimiento y se obtiene el consentimiento por escrito. Se coloca al paciente en decúbito supino con el cuello en hiperextensión. Se localizan el nódulo y el mejor trayecto para abordarlo. Se utiliza una aguja de calibre 21-22 G conectada a una jeringa de 20 cc y a un sistema de aspiración. Existen 2 técnicas: por aspiración y por capilaridad. Tras asegurar que la aguja está en el interior del nódulo, en la primera se realizan varios pases a la vez que se ejerce aspiración con la jeringa para obtener una muestra adecuada; en la segunda, se realizan varios pases moviendo la aguja de forma enérgica sin ejercer aspiración hasta obtener muestra suficiente. Una vez obtenida la muestra, se extiende en una porta, en fresco o con fijación citológica, para enviar al anatomopatólogo7,17 (fig. 6).
La EcoPAAF es más eficaz que la dirigida por palpación para realizar un diagnóstico anatomopatológico correcto, porque disminuye los resultados no diagnósticos y los falsos negativos al localizar mejor el nódulo9,16.
El informe citológico según la clasificación de Bethesda establece las siguientes posibilidades18,19:
- –
No diagnóstico o insuficiente (riesgo de malignidad del 1-4%).
- –
Benigno (riesgo de malignidad del 0-3%).
- –
Indeterminado (riesgo de malignidad alrededor del 15%). Se divide en 2 subtipos: atipia con significado indeterminado o lesión folicular de significado indeterminado.
- –
Neoplasia folicular o sospechosa de neoplasia folicular (riesgo de malignidad del 15-30%).
- –
Sospechosa de malignidad (riesgo del 60-75%).
- –
Maligna (riesgo del 97-99%).
En los casos de no diagnóstico, diagnóstico insuficiente o indeterminado está indicado repetir la EcoPAAF8,9,17,20,21. Una alternativa en caso de EcoPAAF repetidas, indeterminadas o insuficientes, es la biopsia con aguja gruesa11,14.
Las diferentes guías de manejo del nódulo tiroideo indican que los nódulos con resultado de benignidad pueden ser monitorizados con seguimiento clínico y ecográfico en 6-18 meses, y repetir la EcoPAAF si hay crecimiento significativo o aparecen signos ecográficos sospechosos. Si no es así, el tiempo hasta la próxima revisión puede aumentarse1,8,11.
Otras pruebas de imagen1. Gammagrafía tiroidea. En la actualidad, está limitada a identificar tejido tiroideo con funcionamiento autónomo. Es de elección en los nódulos con TSH baja para determinar si el nódulo es caliente y en algunos pacientes anticoagulados por el riesgo de sangrado de la PAAF. Los nódulos calientes no requieren punción por el riesgo bajo de malignidad (inferior al 5%)7,8,11.
2. Tomografía computarizada y resonancia magnética. Sirven para delimitar la extensión del bocio intratorácico y su relación con estructuras mediastínicas, pero no permiten descartar malignidad. No son pruebas de uso habitual en el manejo del nódulo tiroideo8.
3. Elastografía. Un nódulo tiroideo con consistencia firme o dura tiene un riesgo elevado de malignidad. La elastografía tiene una alta sensibilidad (82-97%) y especificidad (96-100%) en pacientes seleccionados22. El valor predictivo parece ser independiente del tamaño del nódulo y se mantiene para lesiones que son indeterminadas en la PAAF. Es una técnica de aparición reciente, aún poco utilizada, por lo que hacen falta estudios prospectivos que establezcan su eficacia8.
Nuevas guías de actuación en el manejo del nódulo tiroideoDebido a la alta prevalencia del nódulo tiroideo, es necesario unificar criterios y encontrar características ecográficas de uso común para diferenciar entre malignidad o benignidad y seleccionar los nódulos sospechosos en los que estaría indicado realizar una EcoPAAF. En la actualidad, la controversia se centra en qué pacientes seleccionar para no realizar punciones innecesarias que aumentan el gasto sanitario sin aumento del beneficio7,8,11,21. Para solucionar este problema, en los últimos años se han propuesto diversas estrategias.
En 2002, Kim et al.13 propusieron biopsiar cualquier nódulo, con independencia de su tamaño, que presentase al menos una característica ecográfica entre las siguientes: hipoecogenicidad marcada, márgenes irregulares o lobulados, microcalcificaciones o diámetro anteroposterior mayor que el transverso. Con estos criterios consiguieron una alta sensibilidad (93%) y un elevado valor predictivo negativo (95%)11,13,23.
La Asociación Americana del Tiroides planteó en 2009 seleccionar a los pacientes teniendo en cuenta criterios clínicos y ecográficos8. Propuso pinchar todos los nódulos mayores de 1cm con características ecográficas de sospecha, los menores de 1cm en caso de historia familiar o factores de alto riesgo asociados y los mayores de 2cm, independientemente de las características ecográficas, pero no los nódulos puramente quísticos. En los pacientes con bocio multinodular, cada nódulo tiene el mismo riesgo de malignidad que si fuera único. Si ninguno de los nódulos tiene datos ecográficos sospechosos, se recomienda acceder al dominante y realizar seguimiento ecográfico del tiroides por si hubiera cambios en la imagen ecográfica de alguno de los nódulos. En los nódulos mixtos (sólido-quísticos), si fuese necesario biopsiarlos, se recomienda pinchar el componente sólido. En las lesiones totalmente quísticas solo está indicada la punción para aliviar los síntomas, aunque recidivan en el 80%. También recomienda que se use la ecografía para seguir rutinariamente los nódulos benignos o bocios multinodulares y repetir la punción si se detecta un crecimiento de más del 50% del volumen. Tras un diagnóstico de cáncer de tiroides, recomendó realizar una ecografía cervical preoperatoria y EcoPAAF de cualquier ganglio sospechoso. No incluyó la ecografía cervical en el protocolo de seguimiento de los pacientes con cáncer de tiroides después del tratamiento8,11.
La Guía de la Sociedad de Radiólogos Ecografistas recomendó en 2005 la EcoPAAF considerando criterios de tamaño y características ecográficas1. La punción estaba indicada en nódulos mayores de 1cm con microcalcificaciones, nódulos mayores de 1,5cm si son sólidos o presentan calcificaciones groseras, nódulos mayores de 2cm con componente sólido-quístico o fundamentalmente quísticos con componente sólido mural, y nódulos con crecimiento significativo desde el primer examen. También en los ganglios sospechosos con nódulo ipsilateral, independientemente del tamaño. En nódulos quísticos no sería necesaria la EcoPAAF1,11. Esta guía ha sido una de las más utilizadas, pero recientemente se ha demostrado que la especificidad es baja (54%) porque no incluye nódulos menores de 1cm, asumiendo que la extirpación del microcarcinoma no mejora la expectativa de vida por el curso poco agresivo de este tumor, y no considerando la agresividad de algunos microcarcinomas con crecimiento extracapsular y metástasis ganglionares23.
La Guía de la Asociación Americana de Endocrinología Clínica (AACE) propugna la biopsia de todo nódulo hipoecogénico mayor de 1cm, incluso menor de 1cm si es hipoecogénico, y asocia algún signo ecográfico de malignidad o hay factores de riesgo en los antecedentes clínicos9,11,18. La especificidad de esta guía es alta (91%), lo que aumenta su eficacia23.
Horvath et al.3 propusieron en 2009 criterios ecográficos para caracterizar todo tipo de nódulos tiroideos: benignos y no benignos, tipos anatomopatológicos foliculares y no foliculares, para poder seleccionar aquellos que necesitan punción. La idea surgió de la clasificación Breast Imaging Reporting and Data System, para crear un Thyroid Imaging Reporting and Data System (TIRADS). Consiste en crear una puntuación para la afectación tiroidea en general (TIRADS 1 a 6) y para los nódulos (TIRADS 2 a 6), con probabilidad creciente de cáncer: categoría 1, tiroides normal; categoría 2, hallazgos benignos (quiste o nódulo espongiforme); categoría 3, lesión probablemente benigna (< 5% malignidad); categorías 4 y 5, lesiones probablemente malignas (5-95% malignidad) y candidatas a biopsia. Esta clasificación tiene sus limitaciones, ya que no tiene en cuenta el tamaño ni los factores de riesgo, y la categoría 3, donde no está recomendada la biopsia, puede incluir carcinomas no diagnosticados en un porcentaje considerable. La categoría 6 se reserva para nódulos malignos ya confirmados por punción antes de la intervención quirúrgica3,11,12.
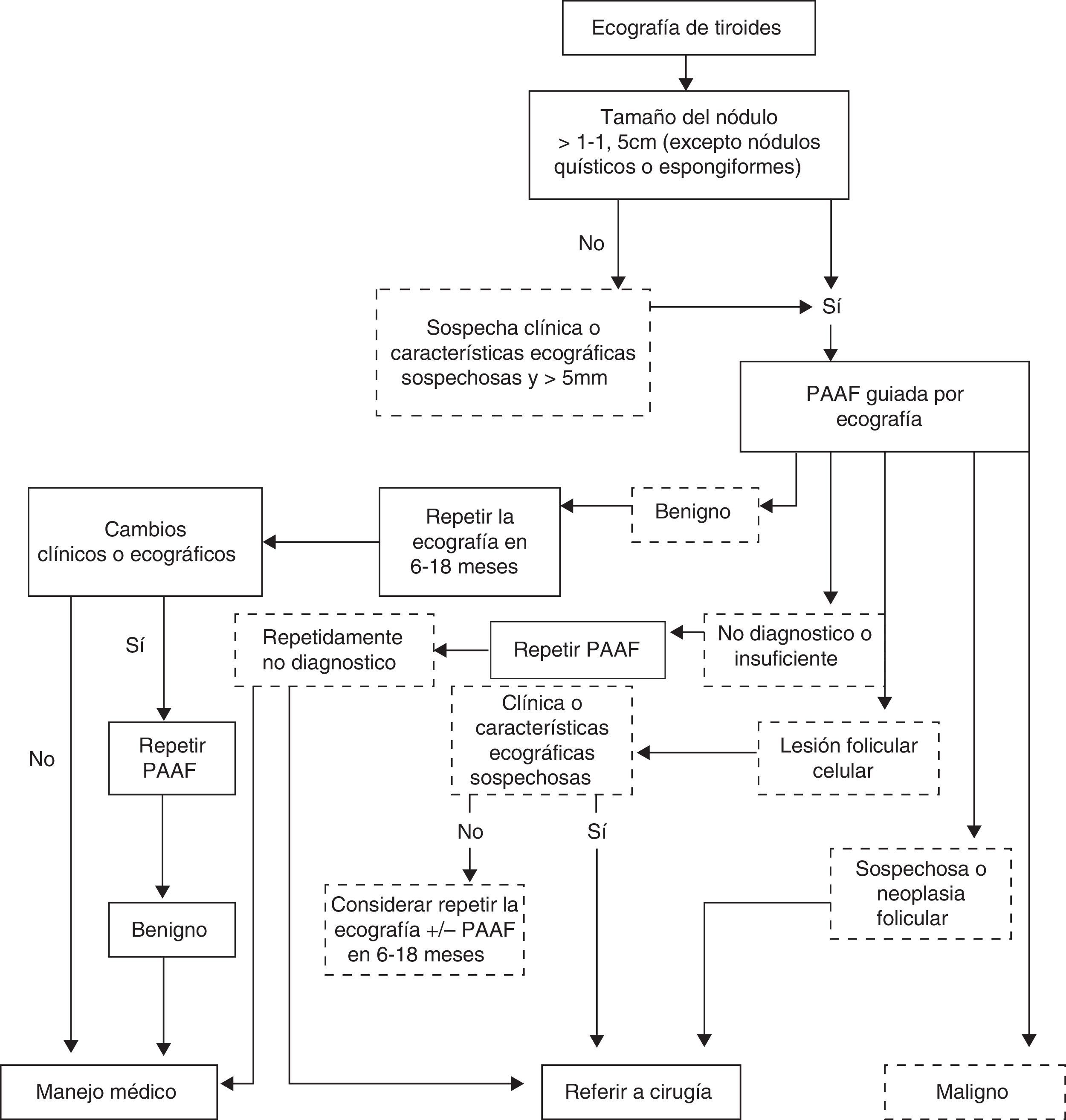
Hasta ahora, las diferentes sociedades han publicado guías de práctica clínica sobre el manejo del nódulo tiroideo sin que exista un consenso generalizado, probablemente porque no existe concordancia en todos los aspectos valorados (datos clínicos, datos de laboratorio, características ecográficas). En lo que sí coinciden es en que la estratificación del riesgo por las características ecográficas y la correlación con los datos citológicos es eficaz para mejorar la detección del cáncer de tiroides y disminuir las intervenciones quirúrgicas de lesiones benignas23. Pero en todas las guías existen incertidumbres que se tienen que resolver basándose en el juicio clínico, la experiencia y las características individuales del paciente, por lo que hasta el momento solo son útiles parcialmente24. Si se busca una sensibilidad alta, seguiremos los criterios de Kim, que dejan sin diagnosticar solo un 7% de los carcinomas. Si, por otro lado, considerando que no se ha encontrado asociación significativa de ninguna característica aislada con el riesgo de malignidad, que la incidencia del carcinoma de tiroides en el conjunto de los nódulos tiroideos es baja (9-13%) y que la gran mayoría son carcinomas papilares con buen pronóstico y alta supervivencia a largo plazo, la estrategia sería la de las guías con especificidad alta, como la de la AACE, a la vez seguras y coste-efectivas. No indican la punción en nódulos menores de 1cm, excepto los que tienen varias características ecográficas de malignidad y signos clínicos o factores de riesgo, asumiendo que no se diagnosticará un 21% de los carcinomas, pero disminuyendo las EcoPAAF negativas, lo que aumenta su eficacia11,23 (fig. 7). Al igual que en el resto de las guías, pensamos que la EcoPAAF se debería evitar en aquellos nódulos con características ecográficas de benignidad claras (nódulos quísticos y con patrón espongiforme). Además, algún estudio demuestra que estos nódulos continúan siendo benignos a largo plazo1,8,11,13. Desde nuestro punto de vista, ante la falta de consenso clínico, el futuro debería ir encaminado hacia la creación de una consulta de alta resolución en la que estarían implicados diferentes profesionales (endocrinólogos, radiólogos, médicos nucleares y anatomopatólogos) en un intento de aumentar el rendimiento diagnóstico con la mínima iatrogenia, especializar más el manejo y mejorar el seguimiento de los pacientes con una mejor relación coste-efectividad25.
Algoritmo de actuación ante el nódulo tiroideo modificado8,15.
La ecografía es la técnica de elección para diagnosticar, caracterizar y seguir los nódulos tiroideos. La EcoPAAF es una herramienta esencial porque es simple, segura, eficaz y coste-efectiva, evita los falsos negativos, disminuye el número de intervenciones quirúrgicas innecesarias y aumenta la especificidad. Dado la alta prevalencia de los nódulos tiroideos y la utilidad diagnóstica de la ecografía, se han propuesto varias guías de práctica clínica que intentan unificar y encontrar criterios ecográficos de uso común para diferenciar los nódulos benignos de los malignos. Pero no hay consenso entre ellas y sigue pendiente lograr un protocolo que las unifique. Aun así, todas ellas permiten seleccionar mejor el nódulo que debe biopsiarse y evitan procedimientos cruentos innecesarios en muchos pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría- 1.
Responsable de la integridad del estudio: SMG y MJVM.
- 2.
Concepción del estudio: SMG y MJVM.
- 3.
Diseño del estudio: SMG y MJVM
- 4.
Obtención de los datos: SMG y MJVM.
- 5.
Análisis e interpretación de los datos: SMG y MJVM.
- 6.
Tratamiento estadístico: N/A
- 7.
Búsqueda bibliográfica: SMG.
- 8.
Redacción del trabajo: SMG y MJVM.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: SMG y MJVM.
- 10.
Aprobación de la versión final: SMG y MJVM.
Los autores declaran no tener ningún conflicto de intereses.