Comparar el impacto pronóstico de la extensión de la enfermedad pulmonar en tomografía computarizada (TC) valorada de forma visual por un radiólogo experto y de manera automática por un sistema de inteligencia artificial (IA) en pacientes con neumonía COVID-19.
Material y métodosEstudio retrospectivo que incluyó pacientes con sospecha clínica de neumonía COVID-19 y valoración visual, y por IA de la extensión de la afectación pulmonar. Se dividió a los pacientes en grupos de mal (fallecimiento/UCI) y buen pronóstico (alta). Se realizaron análisis uni y multivariante (regresión logística) de las variables que demostraron diferencias significativas entre ambos grupos.
ResultadosLos pacientes de mal pronóstico presentaron más frecuentemente una mayor extensión de la afectación pulmonar de manera visual (estadios 3-4; 37,5 vs. 14,3%; p=0,001) y estimada por la IA (estadios 3-4; 35 vs. 6,2%; p<0,001). El coeficiente de correlación de concordancia radiólogo-IA fue excelente (0,905; p<0,001). La hipertensión arterial (OR: 4,26; p<0,001), las alteraciones analíticas de creatinina (OR: 5,63; p<0,001), lactato-deshidrogenasa (OR: 11,69; p<0,001) y dímero D (OR: 5,68; p<0,001) y la extensión del parénquima pulmonar afectado valorados visualmente (estadio 1 vs. 4 OR: 10,36; p=0,001) y por la IA (estadio 1 vs. 4 OR: 25; p=0,001) fueron las variables con mayor impacto pronóstico en el análisis univariante. Los modelos de análisis multivariante considerando la extensión valorada visualmente y por la IA no demostraron diferencias significativas entre ellos (AUC: 0,876 vs. 0,870; p=0,278).
ConclusiónLa valoración de la extensión del parénquima pulmonar afectado en las imágenes de la TC, aislada y en conjunto con factores clínicos y analíticos, demuestra valor pronóstico en los pacientes con neumonía COVID-19. No se observaron diferencias significativas entre la estimación visual del radiólogo y el sistema de detección automática basado en IA empleado en este estudio.
To compare the prognostic impact of the extent of lung disease detected on computed tomography (CT) when assessed visually by an expert radiologist compared to automatically by an artificial intelligence (AI) system in patients with COVID-19 pneumonia.
Material and methodsA retrospective study of patients with clinical suspicion of COVID-19 pneumonia which assessed the extent of lung involvement visually and by AI. Patients were divided into poor (death/ICU) and good (discharge) prognosis groups. Univariate and multivariate analyses (logistic regression) were performed on the variables that demonstrated significant differences between both groups.
ResultsPatients with a poor prognosis more frequently had greater lung involvement visually (stages 3-4; 37.5% vs 14.3%; P=.001) and by AI (stages 3-4; 35% vs 6.2%; P<.001). The radiologist-AI agreement correlation coefficient was excellent (0.905; P<.001). High blood pressure (OR 4.26; P0.001), alterations in levels of creatinine (OR 5.63; P<.001), lactate dehydrogenase (OR 11.69; P<.001) and D-dimer (OR 5.68; P<.001), and the extent of affected lung parenchyma assessed visually (stage 1 vs 4 OR 10.36; P=.001) and by AI (stage 1 vs 4 OR 25; P=.001) were the variables wit the greatest prognostic impact in the univariate analysis. The multivariate analysis models considering the extent assessed visually and by AI did not demonstrate any significant differences (AUC 0.876 vs 0.870; P=.278).
ConclusionThe extent of affected lung parenchyma on CT images demonstrates prognostic value both on their own and in conjunction with clinical factors and blood levels in patients with COVID-19 pneumonia. No significant differences were observed between the radiologist's visual estimate and the AI-based automatic detection system used in this study.
En diciembre de 2019, un nuevo virus apareció en China1. Con el nombre severe acute respiratory syndrome coronavirus-2 (SARS-CoV-2), se dispersó por el mundo, ocasionando una pandemia de coronavirus infection disease (COVID-19). Cientos de millones de infectados y millones de muertos han sido registrados en estos más de 3 años de pandemia2.
Desde que se tuvo conocimiento de esta enfermedad, se demostró la utilidad de la tomografía computarizada (TC) de tórax como método para el diagnóstico de neumonía COVID-19, debido a su alta sensibilidad para detectar infiltrados pulmonares3 y a su capacidad para valorar las distintas formas de presentación de la enfermedad pulmonar a lo largo de la evolución clínica4. Principalmente, la TC torácica se ha indicado como una herramienta diagnóstica inicial para los pacientes con condiciones respiratorias moderadas o graves3 y fue incluida en las recomendaciones de diferentes sociedades científicas para el manejo de los pacientes con dicha enfermedad5–7. Estudios posteriores demostraron que la TC también podía proporcionar información pronóstica durante el seguimiento de la enfermedad8,9, siempre en combinación con los datos clínicos y las pruebas de laboratorio.
En el mismo contexto, dado el valor clínico que tenían los hallazgos de la TC y la necesidad de disponer de datos objetivos sobre la presencia y extensión de la enfermedad pulmonar, se aplicaron métodos de inteligencia artificial (IA) para obtener parámetros cuantitativos y precisos10–14. Su utilidad se evaluó, sobre todo, desde el punto de vista radiológico15,16.
La valoración de la extensión de la enfermedad pulmonar por neumonía COVID-19 mediante un programa de IA podría aportar una mayor precisión en el volumen pulmonar afectado, una mayor capacidad de estratificar el riesgo real asociado y predecir el desenlace de la enfermedad junto con los datos demográficos, clínicos y de laboratorio. En este sentido, el objetivo primordial de nuestro estudio fue comparar la contribución al pronóstico de pacientes con neumonía COVID-19 de la extensión de la enfermedad pulmonar establecida por un radiólogo experto frente a un programa de IA unido a otros datos demográficos, clínicos y de laboratorio.
Material y métodosDiseñoSe realizó un estudio retrospectivo en 2 sedes de un hospital terciario español que incluyó a 511 pacientes consecutivos con sospecha clínica de neumonía COVID-19 a quienes se les efectuó una TC torácica. Todos los pacientes firmaron el consentimiento informado para la realización de la prueba de imagen. El comité de ética de nuestra institución aprobó el protocolo del estudio (2020.061), dispensando la necesidad de obtener consentimiento debido a la naturaleza retrospectiva del estudio.
Criterios de inclusiónPacientes con sospecha clínica de neumonía COVID-19 que acudieron al servicio de urgencias entre el 10 de marzo y el 31 de agosto de 2020, con una prueba polymerase chain reaction (PCR) positiva para SARS-CoV-2 al ingreso y con una TC torácica realizada en las primeras 24h de su entrada al hospital.
Criterios de exclusiónPacientes con PCR negativa para SARS-CoV-2, neumonía causada por un patógeno diferente de SARS-CoV-2 o coinfección, edad menor de 18 años y hallazgos pulmonares incidentales como masas o nódulos pulmonares sospechosos de malignidad.
Variable principalLa variable principal del estudio fue la extensión y el número de campos pulmonares afectados en la TC con hallazgos indicativos de neumonía COVID-19.
Los estudios de TC se llevaron a cabo con equipos multidetector (SOMATOM Sensation 64 y SOMATOM Emotion 16; Siemens Healthineers, Forchheim, Alemania) específicamente dedicados a los pacientes con sospecha de neumonía COVID-19. Los estudios se obtuvieron en decúbito supino y en inspiración, sin emplear contraste intravenoso. Se utilizaron los siguientes parámetros: voltaje del tubo 120kV, corriente de referencia del tubo de 190mAs con modulación antropomórfica de la corriente CareDose 4D (Siemens Healthineers), 32×0,6mm de colimación del detector y pitch de 1. Las imágenes fueron reconstruidas con grosor de corte de 1mm e incremento de reconstrucción de 1mm utilizando algoritmos de reconstrucción de partes blandas (B31f) y de alta resolución (B60f) para la evaluación del mediastino y del parénquima pulmonar, respectivamente. Las imágenes se archivaron en picture archiving and communication systems (PACS) para su análisis.
Un radiólogo torácico con 16 años de experiencia, sin conocer los datos clínicos de los pacientes, evaluó la extensión de la afectación pulmonar de neumonía COVID-19 en las TC torácicas mediante la estimación visual semicuantitativa de la carga inflamatoria de neumonía COVID-19 en cada lóbulo pulmonar de acuerdo con la siguiente escala de puntuación: 0 puntos para la ausencia de afectación; 1 punto para una extensión <25%; 2 puntos para una afectación del 26-50%; 3 puntos si la extensión era del 51-75% y 4 puntos cuando la afectación superaba el 75%17. La puntuación visual total se calculó mediante la suma de las puntuaciones individuales de cada lóbulo (0-20 puntos).
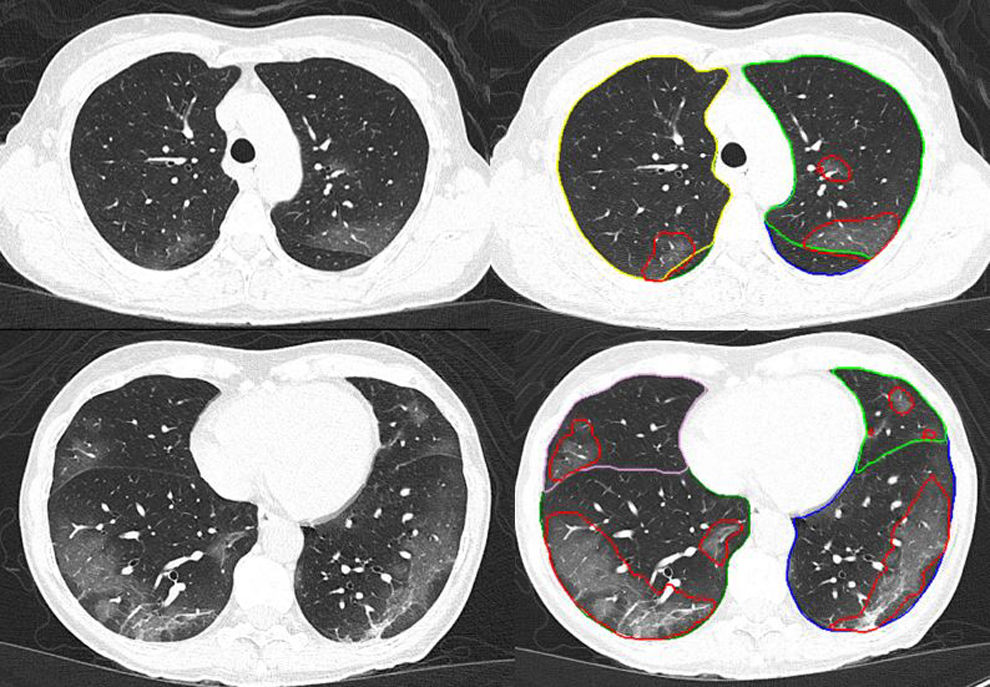
En un análisis posterior, las imágenes de la TC fueron procesadas con un prototipo de IA capaz de detectar y cuantificar de forma automática el volumen y el porcentaje de las áreas de mayor densidad del parénquima pulmonar correspondientes a neumonía, tanto como afectación en vidrio deslustrado como en forma de consolidación (AI-Rad Companion Research CT Pneumonia Analysis v2.0; Siemens Healthineers). El prototipo proporcionó un informe de datos que incluía el porcentaje de afectación pulmonar para cada lóbulo y para el total del parénquima pulmonar de cada paciente (fig. 1), que fue estratificada siguiendo la misma escala de puntuación utilizada por el radiólogo (fig. 2).
Para el análisis de los datos, las puntuaciones totales obtenidas por el radiólogo y por la IA se agruparon en 4 estadios para reflejar la extensión de la afectación parenquimatosa pulmonar total: 1 (0-4 puntos), 2 (5-9 puntos), 3 (10-14 puntos) y 4 (15-20 puntos)18.
Variables secundariasSe consideraron síntomas de neumonía COVID-19 la fiebre, astenia, disnea, mal estado general, tos, diarrea, odinofagia y cefalea. Además del número de días transcurridos desde el inicio de los síntomas, se recogieron los datos clínicos y antecedentes personales en todos los pacientes, incluyendo edad, género, índice de masa corporal, historia de enfermedad cardiovascular, patología oncológica previa y/o actual, diabetes, hipertensión arterial (HTA), inmunosupresión por enfermedad autoinmune o farmacológica, enfermedad renal crónica, asma, enfermedad pulmonar obstructiva crónica (EPOC) y condición de fumador.
Adicionalmente se obtuvieron los siguientes datos de laboratorio en el momento de la atención en urgencias: hemoglobina, leucocitos, neutrófilos, linfocitos, plaquetas, proteína C reactiva (PCR), procalcitonina, creatinina, lactato deshidrogenasa (LDH), bilirrubina, niveles de troponina y dímero D. Los datos microbiológicos para SARS-CoV-2 se evaluaron a partir de hisopos nasofaríngeos.
Finalmente, se recogieron los diferentes tratamientos que precisaron los pacientes durante su ingreso, que consistió en combinaciones de hidroxicloroquina, agentes antivirales, terapia antibiótica, corticoides, heparina de bajo peso molecular y/o soporte ventilatorio, de acuerdo con su situación y evolución clínicas.
Los pacientes fueron clasificados en 2 grupos de acuerdo con su evolución durante la infección. Los pacientes que fallecieron o precisaron ingreso en la unidad de cuidados intensivos (UCI) se clasificaron como grupo de mal pronóstico; mientras que los que no precisaron ingreso hospitalario o se recuperaron de la infección sin precisar tratamiento médico intensivo fueron clasificados como grupo de buen pronóstico.
Análisis estadísticoLas variables categóricas se muestran como proporciones y porcentajes, mientras que las variables continuas se expresan como media±desviación estándar o como mediana (rango intercuartílico [RIC]). La distribución normal de las variables se evaluó con la prueba de Kolmogorov-Smirnov. Se utilizó la prueba de Chi-cuadrado de Pearson para la comparación de proporciones y la prueba de la t de Student o la prueba de U de Mann-Whitney para la comparación de medias de los datos paramétricos y no paramétricos, respectivamente. La evaluación de la correlación entre las puntuaciones totales de la extensión del parénquima pulmonar aportados por el radiólogo y por la IA se realizó mediante un coeficiente de correlación de concordancia.
Las variables clínicas, analíticas y de imagen radiológica que mostraron diferencias significativas entre grupos se utilizaron para el análisis uni y multivariante (regresión logística). El análisis multivariante se llevó a cabo mediante un estudio de regresión logística por pasos, que excluye aquellas variables que al incluirlas en el modelo pierden su significación estadística respecto al análisis univariante. Se establecieron 3 modelos de estudio multivariante: uno que solo analizaba los datos clínicos y analíticos (sin la parte de imagen radiológica), otro que incluía los estadios de extensión valorados por el radiólogo y uno último que añadía los estadios de extensión de la IA. Los resultados de estos análisis se expresaron como odds ratio (OR) con su intervalo de confianza (IC) al 95%.
Se realizó un análisis del área bajo la curva (area under the curve [AUC]) de la curva operador-receptor (receiver operating characteristic [ROC]) y se compararon las diferencias entre áreas para estudiar la capacidad discriminativa de la interpretación realizada por el radiólogo y la IA de manera aislada, así como de los diferentes modelos del sistema multivariante descritos. El análisis estadístico se realizó con el programa informático SPSS® (versión 29.0; IBM Corporation). Se consideró un valor de p a 2 colas <0,05 para indicar una diferencia estadísticamente significativa.
ResultadosPacientes: datos demográficos, clínicos, analíticos y terapéuticosDe los 511 pacientes valorados inicialmente, se excluyeron 204 por presentar una prueba PCR negativa para SARS-CoV-2, 6 pacientes con datos de sobreinfección bacteriana en la TC, uno por presentar una masa pulmonar como hallazgo incidental y un paciente por ser menor de edad (fig. 3). En el análisis estadístico final se incluyeron, por tanto, 299 sujetos (164 varones, 135 mujeres, edad media de 60,79±16,3 años, tiempo medio desde la aparición de los síntomas de 8,31±6,2 días). Sus características demográficas, datos clínicos y analíticos y los tratamientos empleados se resumen en la tabla 1.
Características demográficas, clínicas, analíticas y terapéuticas de los pacientes totales
| Valores | |
|---|---|
| Factores clínicos | |
| Edad (años) | 60,79±16,3 |
| Género (n.° y % mujeres) | 135 (45,2%) |
| IMC | 26,59±5,2 |
| Enfermedad cardiovascular | 70 (23,4%) |
| Enfermedad oncológica | 51 (17,1%) |
| Diabetes mellitus | 44 (14,7%) |
| Hipertensión arterial | 128 (42,8%) |
| Inmunosupresión | 23 (7,7%) |
| Insuficiencia renal | 29 (9,7%) |
| Asma | 13 (4,3%) |
| EPOC | 15 (5%) |
| Tabaco (fumadores y exfumadores) | 79 (26,4%) |
| Síntomas | 287 (96%) |
| Días de síntomas | 8,31±6,2 |
| Fiebre | 235 (78,6%) |
| Astenia | 63 (21,1%) |
| Disnea | 108 (36,1%) |
| Mal estado general | 100 (33,4%) |
| Tos | 203 (67,9%) |
| Diarrea | 65 (21,7%) |
| Odinofagia | 27 (9%) |
| Cefalea | 33 (11%) |
| Analítica | |
| Hemoglobina (g/dl) | 13,66±1,9 |
| Leucocitos (×109/l) | 10,37±45,3 |
| Neutrófilos (×109/l) | 5,99±22,9 |
| Linfocitos (×109/l) | 1,75±6,9 |
| Plaquetas (×109/l) | 198,35±76,9 |
| PCR (mg/dl) | 7,35±8,3 |
| Procalcitonina (mg/dl) | 0,2±0,6 |
| Creatinina (mg/dl) | 0,97±0,6 |
| LDH (UI/l) | 306,49±125,5 |
| Bilirrubina (mg/dl) | 0,53±0,3 |
| Troponina T (ng/l) | 11,33±28,4 |
| Dímero D (ng/ml) | 1.220,37±2.069,7 |
| Tratamientos | |
| Ventilación mecánica | 23 (7,7%) |
| Azitromicina | 243 (81,3%) |
| Hidroxicloroquina | 265 (88,6%) |
| Lopinavir/ritonavir | 118 (39,4%) |
| Interferón beta | 20 (6,7%) |
| Tocilizumab | 38 (12,7%) |
| Corticoides | 100 (33,4%) |
| Heparina | 236 (78,9%) |
| Pravastatina | 90 (30,1%) |
| Cefalosporinas | 216 (72,2%) |
| Levofloxacino | 45 (15,1%) |
EPOC: enfermedad pulmonar obstructiva crónica; IMC: índice de masa corporal; LDH: lactato deshidrogenasa; PCR: reacción en cadena de la polimerasa.
En el grupo de mal pronóstico se incluyeron 40 pacientes, mientras que el resto (259 pacientes) fueron dados de alta o no precisaron de ingreso hospitalario, clasificándose en el grupo de buen pronóstico. La tabla 2 refleja las características demográficas principales, los síntomas recogidos al ingreso, los datos analíticos extraídos y los diferentes tratamientos utilizados; de acuerdo con la clasificación de grupos de pronóstico. Los pacientes incluidos en el grupo de mal pronóstico presentaron una mayor edad media (71,28±14,5 años vs. 59,17±15,9 años; p<0,001), así como una mayor frecuencia de enfermedad cardiovascular (45 vs. 20,1%; p=0,001) y oncológica (30 vs. 15,1%; p=0,019), diabetes mellitus (25 vs. 13,1%; p=0,049), HTA (72,5 vs. 38,2%; p<0,001), inmunodepresión (17,5 vs. 6,2%; p=0,012), insuficiencia renal (27,5 vs. 6,9%; p<0,001) y EPOC (12,5 vs. 3,9%; p=0,020). También presentaron más alteraciones analíticas, entre las que destacaban cifras más altas de PCR (13,48±10,1 vs. 6,42±7,6mg/dl; p<0,001), dímero D (2.359,72±2.873,6 vs. 1.046,12±1.864,4ng/ml; p<0,001) y LDH (394,26±126,2 vs. 293,36±120,2UI/l; p<0,001). Los pacientes del grupo de mal pronóstico, además, precisaron con mayor frecuencia tratamientos médicos intensivos que los pacientes incluidos en el grupo de buen pronóstico.
Características demográficas, clínicas, analíticas y terapéuticas de los pacientes según los grupos de pronóstico
| Buen pronóstico | Mal pronóstico | Valor de p | |
|---|---|---|---|
| Factores clínicos | |||
| Edad (años) | 59,17±15,9 | 71,28±14,5 | <0,001 |
| Género (n.° y % mujeres) | 119 (45,9%) | 16 (40%) | 0,482 |
| IMC | 26,65±5,46 | 26,28±3,8 | 0,821 |
| Enfermedad cardiovascular | 52 (20,1%) | 18 (45%) | 0,001 |
| Enfermedad oncológica | 39 (15,1%) | 12 (30%) | 0,019 |
| Diabetes mellitus | 34 (13,1%) | 10 (25%) | 0,049 |
| Hipertensión arterial | 99 (38,2%) | 29 (72,5%) | <0,001 |
| Inmunosupresión | 16 (6,2%) | 7 (17,5%) | 0,012 |
| Insuficiencia renal | 18 (6,9%) | 11 (27,5%) | <0,001 |
| Asma | 13 (5%) | 0 (0%) | 0,147 |
| EPOC | 10 (3,9%) | 5 (12,5%) | 0,020 |
| Tabaco (fumadores y exfumadores) | 66 (26,5%) | 13 (32,5%) | 0,349 |
| Síntomas | 248 (95,8%) | 39 (97,5%) | 0,600 |
| Días de síntomas | 8,44±6 | 7,48±7,3 | 0,363 |
| Fiebre | 203 (78,4%) | 32 (80%) | 0,816 |
| Astenia | 56 (21,6%) | 7 (17,5%) | 0,552 |
| Disnea | 92 (35,5%) | 16 (40%) | 0,583 |
| Mal estado general | 87 (33,6%) | 13 (32,5%) | 0,892 |
| Tos | 179 (69,1%) | 24 (60%) | 0,251 |
| Diarrea | 61 (23,6%) | 4 (10%) | 0,053 |
| Odinofagia | 25 (9,7%) | 2 (5%) | 0,339 |
| Cefalea | 32 (12,4%) | 1 (2,5%) | 0,064 |
| Analítica | |||
| Hemoglobina (g/dl) | 13,73±1,8 | 13,16±2,5 | 0,082 |
| Leucocitos (×109/l) | 10,77±48,7 | 7,82±6,1 | 0,354 |
| Neutrófilos (×109/l) | 6,02±24,6 | 5,80±4,3 | 0,895 |
| Linfocitos (×109/l) | 1,75±7,3 | 1,79±4,7 | 0,960 |
| Plaquetas (×109/l) | 202,43±79,1 | 172,08±55,3 | 0,004 |
| PCR (mg/dl) | 6,42±7,6 | 13,48±10,1 | <0,001 |
| Procalcitonina (mg/dl) | 0,18±0,7 | 0,32±0,5 | 0,139 |
| Creatinina (mg/dl) | 0,93±0,6 | 1,2±0,5 | 0,003 |
| LDH (UI/l) | 293,36±120,2 | 394,26±126,2 | <0,001 |
| Bilirrubina (mg/dl) | 0,51±0,3 | 0,64±0,3 | 0,036 |
| Troponina T (ng/l) | 8,47±24,2 | 30,89±43,9 | <0,001 |
| Dímero D (ng/ml) | 1.046,12±1.864,4 | 2.359,72±2.873,6 | <0,001 |
| Tratamientos | |||
| Ventilación mecánica | 1 (0,4%) | 22 (55%) | <0,001 |
| Azitromicina | 212 (81,9%) | 31 (77,5%) | 0,723 |
| Hidroxicloroquina | 231 (89,2%) | 34 (85%) | 0,958 |
| Lopinavir/ritonavir | 89 (34,3%) | 29 (72,5%) | <0,001 |
| Interferón beta | 13 (5%) | 7 (17,5%) | 0,002 |
| Tocilizumab | 21 (8,1%) | 17 (42,5%) | <0,001 |
| Corticoides | 71 (27,4%) | 29 (72,5%) | <0,001 |
| Heparina | 202 (78%) | 34 (85%) | 0,188 |
| Pravastatina | 78 (30,1%) | 12 (30%) | 0,934 |
| Cefalosporinas | 186 (71,8%) | 30 (75%) | 0,505 |
| Levofloxacino | 31 (12%) | 14 (35%) | <0,001 |
EPOC: enfermedad pulmonar obstructiva crónica; IMC: índice de masa corporal; LDH: lactato deshidrogenasa; PCR: reacción en cadena de la polimerasa.
En cuanto a la extensión de la afectación pulmonar valorada de forma visual, el radiólogo experto clasificó al total de pacientes en los siguientes estadios: 1 (100 pacientes; 33,4%), 2 (147 pacientes; 49,2%), 3 (35 pacientes; 11,7%) y 4 (17 pacientes; 5,7%). Por su parte, la IA dividió a los pacientes por estadios de la siguiente manera: 1 (159 pacientes; 53,2%), 2 (110 pacientes; 36,8%), 3 (25 pacientes; 8,4%) y 4 (5 pacientes; 1,6%).
El coeficiente de correlación de concordancia fue excelente para la comparación entre la puntuación total (0-20 puntos) aportadas por el radiólogo y por la IA (0,905; IC 95%: 0,881-0,925; p<0,001).
Valor pronóstico de la tomografía computarizadaEn la figura 4 se muestra la valoración visual de la extensión por el radiólogo y por el sistema automático de IA y se comparan los estadios de los pacientes según los grupos de pronóstico establecidos. Se halló un mayor porcentaje de pacientes con una afectación parenquimatosa pulmonar extensa (estadios 3 y 4) en el grupo de mal pronóstico respecto al grupo de buen pronóstico, con diferencias estadísticamente significativas, tanto en el análisis llevado a cabo por el radiólogo (estadios 3 y 4; 37,5 vs. 14,3%; p=0,001), como por el algoritmo de IA (estadios 3 y 4; 35 vs. 6,2%; p<0,001).
En la regresión logística univariante (tabla 3), los pacientes con mayor extensión de la afectación pulmonar en el momento del diagnóstico (estadio 4) presentaron mayor probabilidad de desenlace fatal al compararlos con los de menor afectación (estadio 1), tanto estimado de forma visual por el radiólogo (OR: 10,36; IC: 2,71-39,98; p=0,001) como por parte del algoritmo de IA (OR: 25; IC: 3,69-169,07; p=0,001).
Impacto en el riesgo de ingreso en la UCI o fallecimiento de las variables con diferencias significativas entre grupos de pronóstico. Análisis univariante de regresión logística
| OR | IC 95% | Valor de p | |
|---|---|---|---|
| Edad (ref.≤65 años)>65 años | 4,87 | 2,32-10,19 | <0,001 |
| Enfermedad cardiovascular | 3,26 | 1,63-6,51 | 0,001 |
| Enfermedad oncológica | 2,42 | 1,13-5,16 | 0,022 |
| Diabetes mellitus | 2,21 | 0,99-4,97 | 0,053 |
| Hipertensión arterial | 4,26 | 2,04-8,91 | <0,001 |
| Inmunosupresión | 3,22 | 1,23-8,41 | 0,017 |
| Enfermedad renal crónica | 5,08 | 2,19-11,80 | <0,001 |
| EPOC | 3,56 | 1,15-11,02 | 0,028 |
| Plaquetas (ref.≥150×109/l)<150×109/l | 2,21 | 1,11-4,39 | 0,024 |
| PCR (ref.≤5mg/l)>5mg/l | 4,59 | 2,09-10,08 | <0,001 |
| Creatinina (ref.≤1mg/dl)>1mg/dl | 5,63 | 2,74-11,56 | <0,001 |
| LDH (ref.≤250UI/l)>250UI/l | 11,69 | 2,75-49,63 | 0,001 |
| Dímero D (ref.≤600ng/ml)>600ng/ml | 5,68 | 2,15-14,98 | <0,001 |
| Estadios de extensión IA (ref. estadio 1 [0-4 puntos]) | |||
| Estadio 2 [5-9 puntos] | 3,05 | 1,03-7,16 | 0,01 |
| Estadio 3 [10-14 puntos] | 13,09 | 4,64-36,95 | <0,001 |
| Estadio 4 [15-20 puntos] | 25 | 3,69-169,07 | 0,001 |
| Estadios de extensión radiólogo (ref. estadio 1 [0-4 puntos]) | |||
| Estadio 2 [5-9 puntos] | 2,99 | 1,08-8,26 | 0,034 |
| Estadio 3 [10-14 puntos] | 6,56 | 2,03-21,32 | 0,002 |
| Estadio 4 [15-20 puntos] | 10,36 | 2,71-39,68 | 0,001 |
IA: inteligencia artificial; IC 95%: intervalo de confianza del 95%; LDH: lactato deshidrogenasa; PCR: reacción en cadena de la polimerasa; UCI: unidad de cuidados intensivos.
El análisis univariante mediante regresión logística demostró diferencias estadísticamente significativas entre los grupos de buen y mal pronóstico en todas las variables clínicas y analíticas, excepto la diabetes mellitus (tabla 3). En este sentido, la edad superior a 65 años (OR: 4,87; IC: 2,32-10,19; p<0,001), la enfermedad renal crónica (OR: 5,08; IC: 2,19-11,80; p<0,001) y la hipertensión arterial (OR: 4,26; IC: 2,04-8,91; p<0,001) fueron los factores con mayor impacto en el pronóstico del paciente; mientras que desde el punto de vista analítico, observamos que los valores de LDH (OR: 11,69; IC: 2,75-49,63; p=0,001), creatinina (OR: 5,63; IC: 2,74-11,56; p<0,001) y el dímero D (OR: 5,68; IC: 2,15-14,98; p<0,001) fueron los que tuvieron mayor implicación pronóstica.
Análisis multivarianteLos resultados del análisis multivariante se muestran en la tabla 4. Quedaron excluidos la edad, enfermedad cardiovascular y oncológica, inmunosupresión, insuficiencia renal y EPOC. En el modelo clínico, tener hipertensión arterial y presentar valores alterados de creatinina, LDH y dímero D fueron los factores que más influyeron en el mal pronóstico de los pacientes. Al incluir los parámetros de imagen, destacó el alto valor de OR de la extensión de la afectación parenquimatosa pulmonar al comparar los estadios menor y mayor, establecida tanto por el radiólogo (estadio 1 vs. estadio 4) (OR: 12,64; IC 95%: 1,76-90,65; p=0,012) como por el sistema de detección automática con IA (estadio 1 vs. estadio 4) (OR: 27,77; IC 95%: 2,72-283,31; p=0,005), cada uno en sus respectivos modelos.
Comparación de modelos de pronóstico mediante análisis multivariante de regresión logística
| Modelo clínico+radiólogoa | Modelo clínico+IAb | Modelo clínico (sin TC)c | ||||
|---|---|---|---|---|---|---|
| OR (IC 95%) | Valor de p | OR (IC 95%) | Valor de p | OR (IC 95%) | Valor de p | |
| Hipertensión arterial | 3,54 (1,43-8,72) | 0,006 | 3,52 (1,39-8,92) | 0,008 | 3,28 (1,37-7,86) | 0,008 |
| PCR (ref.≤5mg/l) | No incluido | 3,12 (1,09-8,85) | 0,033 | 2,65 (0,99-7,11) | 0,054 | |
| Creatinina (ref.≤1mg/dl) | 5,49 (2,36-12,76) | <0,001 | 4,86 (2,04-11,59) | <0,001 | 5,01 (2,2-11,38) | <0,001 |
| LDH (ref.≤250UI/l) | 4,44 (0,92-21,37) | 0,063 | No incluido | 5,23 (1,09-24,99) | 0,038 | |
| Dímero D (ref.≤600ng/ml) | 3,08 (0,94-10,08) | 0,063 | 3,02 (0,87-10,55) | 0,083 | 3,60 (1,11-11,69) | 0,033 |
| Estadios de extensión IA (ref. estadio 1 [0-4 puntos]) | No incluido | 0,003 | No incluido | |||
| Estadio 2 [5-9 puntos] | 1,89 (0,60-5,92) | 0,275 | ||||
| Estadio 3 [10-14 puntos] | 7,04 (1,86-26,62) | 0,004 | ||||
| Estadio 4 [15-20 puntos] | 27,77 (2,72-283,31) | 0,005 | ||||
| Estadios de extensión radiólogo (ref. estadio 1 [0-4 puntos]) | 0,063 | No incluido | No incluido | |||
| Estadio 2 [5-9 puntos] | 3,89 (0,79-19,22) | 0,096 | ||||
| Estadio 3 [10-14 puntos] | 7,09 (1,19-42,42) | 0,032 | ||||
| Estadio 4 [15-20 puntos] | 12,64 (1,76-90,65) | 0,012 | ||||
IA: inteligencia artificial; IC 95%: intervalo de confianza del 95%; LDH: lactato deshidrogenasa; OR: odds ratio; PCR: reacción en cadena de la polimerasa; TC: tomografía computarizada.
Variables excluidas por el análisis estadístico: edad, enfermedad cardiovascular y oncológica, inmunosupresión, insuficiencia renal, EPOC, niveles de plaquetas y niveles de PCR.
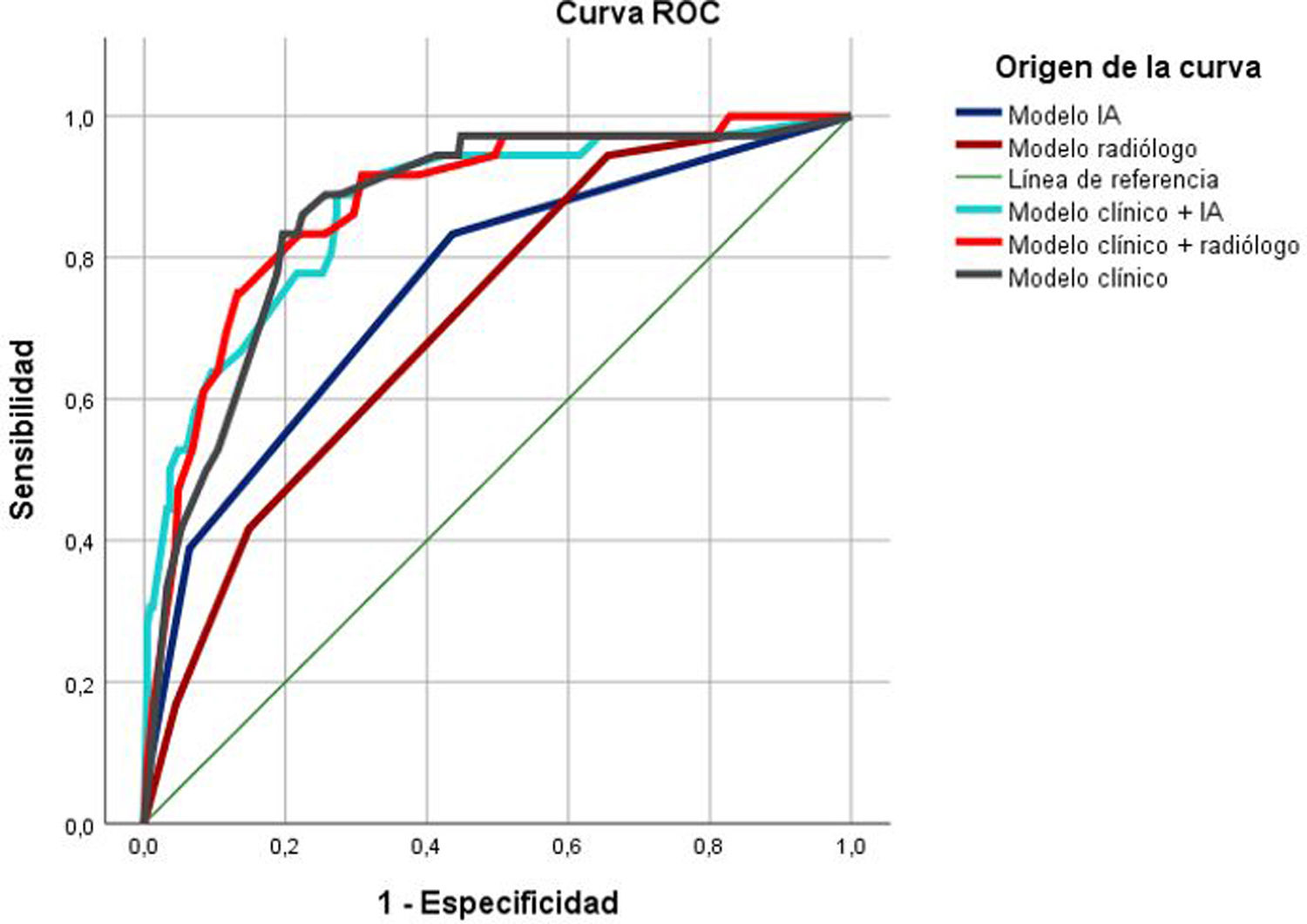
La comparación entre los diferentes modelos de análisis multivariante se realizó mediante el área bajo la curva (fig. 5). Se compararon los modelos que combinaron las variables clínicas con la valoración de la imagen del radiólogo (clínico+radiólogo) y de la IA (clínico+IA), las variables clínicas de manera aislada (clínico) y los datos de la imagen aislados (radiólogo e IA). El modelo que combinó los datos clínicos y del radiólogo (AUC: 0,876; IC 95%: 0,816-0,936) tomado como referencia, demostró poseer diferencias estadísticamente significativas con las valoraciones de imagen aisladas, tanto por parte del radiólogo (diferencia de AUC: −0,162; p<0,001) como por la IA (diferencia de AUC: −0,118; p=0,002), mientras que el rendimiento diagnóstico de dicho modelo fue similar al de los modelos que combinaron los datos clínicos y de IA (AUC: 0,870; IC 95%: 0,804-0,937) y el modelo clínico aislado (AUC: 0,865; IC 95%: 0,803-0,927). Se encontraron hallazgos similares al comparar el modelo combinado de datos clínicos y de IA con el resto de los modelos. El rendimiento de los modelos de imagen aislados del radiólogo (AUC: 0,714; IC 95%: 0,638-0,790) y de la IA (AUC: 0,758; IC 95%: 0,676-0,840) no mostró diferencias estadísticamente significativas (p=0,317).
DiscusiónLa TC ha demostrado resultar una herramienta de mucha utilidad no solo para el diagnóstico de la neumonía COVID-19, sino también para la estratificación del riesgo vital de la enfermedad, para el pronóstico del paciente y para la cuantificación del parénquima pulmonar afectado7,9,19. En este trabajo se estudió la influencia que diferentes factores clínicos, analíticos y radiológicos pudieran tener en el pronóstico de los pacientes con neumonía COVID-19 que acudieron a los servicios de Urgencias de nuestro centro hospitalario. Se observó que la extensión de la afectación del parénquima pulmonar analizada mediante TC demostró ser un factor relevante capaz de predecir la evolución clínica de los pacientes. Otros factores clínicos como la edad, enfermedad cardiovascular u oncológica, HTA, inmunosupresión, enfermedad renal crónica y EPOC; así como datos analíticos como el nivel de plaquetas, PCR, creatinina, LDH y dímero D también demostraron tener implicación en el pronóstico de los pacientes a corto plazo. En los pacientes que precisaron ingreso en UCI o que finalmente fallecieron (grupo de mal pronóstico) se utilizaron tratamientos más intensivos, porque su evolución clínica así lo requería.
Las características de los hallazgos en las pruebas de imagen de radiología simple20,21 y de la TC torácica8,9,22 han demostrado su importancia a la hora de establecer la gravedad de la enfermedad y el pronóstico precoz de los pacientes con neumonía COVID-19, tanto de manera aislada como asociados con datos clínicos y analíticos18–20,22–24. Nuestro trabajo se encuentra en la línea de estos estudios al demostrar la influencia que tienen factores como la edad, los antecedentes personales (enfermedad renal crónica, HTA), las alteraciones analíticas (LDH, creatinina, dímero D) y la extensión de la afectación del parénquima pulmonar en la evolución clínica de este grupo de pacientes. La fiebre y la tos fueron los síntomas más frecuentes en ambos grupos, pero sin ninguna implicación pronóstica.
En este estudio observamos que cuanto mayor fuera la extensión de la afectación pulmonar en la neumonía COVID-19, valorada de forma visual por un radiólogo o medida por un algoritmo de IA, mayor era la probabilidad de un desenlace fatal o de necesidad de tratamientos intensivos durante el ingreso hospitalario. Asimismo, en diferentes modelos, se evidenció una significativa implicación pronóstica al evaluar la extensión en TC, junto a datos clínicos y analíticos. La excelente correlación que encontramos en este trabajo entre la valoración semicuantitativa del radiólogo y los datos de extensión de la afectación pulmonar por la IA también se ha descrito en otros estudios16,25–27. Por tanto, consideramos que la interpretación semicuantitativa realizada por el radiólogo es una manera rápida, fácil de usar y precisa para cuantificar la extensión de afectación pulmonar en pacientes con neumonía COVID-19.
Entre las limitaciones de nuestro estudio se encuentra su naturaleza retrospectiva. Durante la primera ola de la pandemia el manejo clínico de los pacientes se encontró dificultado por la situación de extrema urgencia, las importantes necesidades y los limitados recursos que se encontraron los hospitales y sistemas sanitarios, lo que podría haber influido en el desenlace fatal de los pacientes. Asimismo, los conocimientos acerca del SARS-CoV-2 y de la neumonía COVID-19, a pesar de avanzar a gran velocidad, fueron limitados al inicio de la pandemia, especialmente en el campo de las opciones terapéuticas. Las imágenes de TC fueron interpretadas por un único radiólogo, por lo que no se pudo comparar la concordancia entre distintos observadores. No obstante, diversos estudios confirman que, entre radiólogos, la variabilidad al interpretar la extensión de la neumonía COVID-19 es pequeña4,16. Por último, en este trabajo se utilizó un programa de IA concreto para estudiar la extensión de la enfermedad pulmonar. Es posible que con otros programas informáticos se obtuvieran unos resultados distintos.
En conclusión, la estimación de la extensión del parénquima pulmonar afectado en las imágenes de TC posee valor pronóstico en pacientes con neumonía COVID-19, tanto al ser evaluado de manera aislada como al combinarlo con factores clínicos y analíticos. En este trabajo, la valoración visual del radiólogo demostró poseer una precisión similar al sistema de detección automática basada en IA para predecir una mayor probabilidad de desenlace fatal. Es necesario ampliar el número de pacientes y comprobar si otros sistemas de IA proporcionan datos similares antes de instaurar su uso en la práctica clínica.
Contribución de los autores- •
Responsable de la integridad del estudio: ISA.
- •
Concepción del estudio: ISA y GBA.
- •
Diseño del estudio: ISA, AEC y GBA.
- •
Obtención de los datos: ISA, APN y MV.
- •
Análisis e interpretación de los datos: ISA, AEC y GBA.
- •
Tratamiento estadístico: ISA y APN.
- •
Búsqueda bibliográfica: ISA y AEC.
- •
Redacción del trabajo: ISA.
- •
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: ISA, AEC, APN, MV y GBA.
- •
Aprobación de la versión final: GBA.
La presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesMarta Vidorreta es empleada de Siemens Healthineers. El resto de los autores no declaran ningún conflicto de intereses.
Agradecemos a Siemens Healthineers y su equipo de desarrollo D&A su colaboración en este estudio con la cesión del prototipo CT Pneumonia Analysis.