El cáncer de esófago es un tumor de comportamiento agresivo, que suele diagnosticarse en etapas avanzadas. La ausencia de serosa permite su rápida propagación a estructuras vecinas del mediastino, y una extensa red de drenaje linfático facilita la diseminación tumoral incluso en estadios precoces. La actual clasificación TNM, armonizada con la del cáncer gástrico, proporciona nuevas definiciones en la clasificación anatómica, añade características no anatómicas del tumor e incluye los tumores de la unión esofagogástrica. La mayor precisión en la determinación del estadio clínico inicial se obtiene con la combinación de ecoendoscopia, TC, PET-TC y RM, que desempeñan un papel esencial en la elección, la planificación y la evaluación del tratamiento. En este artículo repasamos algunas particularidades que explican el comportamiento de este tumor, revisamos la estadificación TNM actual y presentamos las distintas pruebas de imagen de que disponemos en la actualidad para su evaluación, incluyendo un algoritmo de diagnóstico.
Cancer of the esophagus is a tumor with aggressive behavior that is usually diagnosed in advanced stages. The absence of serosa allows it to spread quickly to neighboring mediastinal structures, and an extensive lymphatic drainage network facilitates tumor spread even in early stages. The current TNM classification, harmonized with the classification for gastric cancer, provides new definitions for the anatomic classification, adds non-anatomic characteristics of the tumor, and includes tumors of the gastroesophageal junction. Combining endoscopic ultrasound, computed tomography, positron emission tomography, and magnetic resonance imaging provides greater accuracy in determining the initial clinical stage, and these imaging techniques play an essential role in the selection, planning, and evaluation of treatment. In this article, we review some particularities that explain the behavior of this tumor and we describe the current TNM staging system; furthermore, we discuss the different imaging tests available for its evaluation and include a diagnostic algorithm.
El cáncer de esófago es el octavo más frecuente en todo el mundo y ocupa el tercer lugar entre los de origen gastrointestinal. Según datos recientes de la Sociedad Española de Oncología Médica, a partir de la revisión de 2012 del proyecto GLOBOCAN, la incidencia en España es de 2.090 casos, con una prevalencia estimada a 5 años de 2.238, y aunque representa el 1% de todos los cánceres supone el 1,7% de las muertes por esta causa. A diferencia de lo que ocurre con otros tumores, se espera que la incidencia del cáncer de esófago siga aumentando en los próximos años1–3.
El 90% de los casos son carcinomas epidermoides o adenocarcinomas. El cáncer de células escamosas, relacionado con el consumo de alcohol y tabaco, globalmente es el más frecuente en todo el mundo, en especial en los países orientales, y su incidencia está disminuyendo en los países occidentales. El adenocarcinoma es en la actualidad el más común en los países occidentales, por un aumento significativo de su incidencia en los últimos años en relación con la enfermedad por reflujo gastroesofágico y la obesidad. Mientras que el primero de ellos se distribuye de forma similar en los distintos segmentos del esófago, el segundo asienta en el esófago distal en tres cuartas partes de los casos4,5. Otras estirpes tumorales, como el linfoma, el carcinoma de células fusiformes, los tumores neuroendocrinos y los tumores del estroma gastrointestinal (GIST), son muy poco frecuentes6.
El cáncer de esófago es un tumor de comportamiento agresivo que suele diagnosticarse en estadios avanzados, lo que en buena parte se explica por algunas particularidades anatómicas y de drenaje linfático de este órgano. A pesar de los recientes avances en su diagnóstico y tratamiento, el pronóstico sigue siendo pobre y representa la sexta causa de muerte por cáncer en todo el mundo, con una supervivencia a 5 años inferior al 20%.
Los avances en el abordaje terapéutico, multidisciplinario, en los últimos años han permito mejorar la mediana de supervivencia de estos pacientes. Al margen de la cirugía, hoy se dispone de opciones de tratamiento como la resección endoscópica o el empleo de quimiorradioterapia neoadyuvante seguida de cirugía o quimiorradioterapia definitiva. Además, se están desarrollando tratamientos quimioterápicos frente a nuevos receptores, como el HER-2 (human epidermal growth factor receptor 2) que aparece sobreexpresado en el adenocarcinoma de esófago, e inhibidores de factores de crecimiento como VEGF (vascular endothelial growth factor) y EGFR (epidermal growth factor receptor), que en un futuro podrían prolongar la supervivencia de los pacientes con enfermedad diseminada.
Las pruebas de imagen tienen un papel esencial en la valoración integral de estos pacientes, tanto en la evaluación inicial, determinando la resecabilidad y el tratamiento más adecuado, como en la valoración de la respuesta y en el seguimiento7.
En este artículo repasamos algunas particularidades anatómicas y del drenaje linfático del esófago que explican el comportamiento agresivo de este tumor, revisamos la clasificación actual y sus aportaciones para la estadificación del cáncer de esófago, y presentamos la utilidad y las limitaciones de cada una de las pruebas de imagen empleadas en la valoración inicial y durante el proceso terapéutico de estos pacientes.
Particularidades anatómicas en el cáncer de esófagoEl esófago es un tubo muscular que conecta la faringe con el estómago, cuya pared está formada por cuatro capas: mucosa, submucosa, muscular y adventicia. El esófago no tiene serosa, característica que facilita una rápida diseminación del cáncer a estructuras vecinas del cuello y el mediastino8,9.
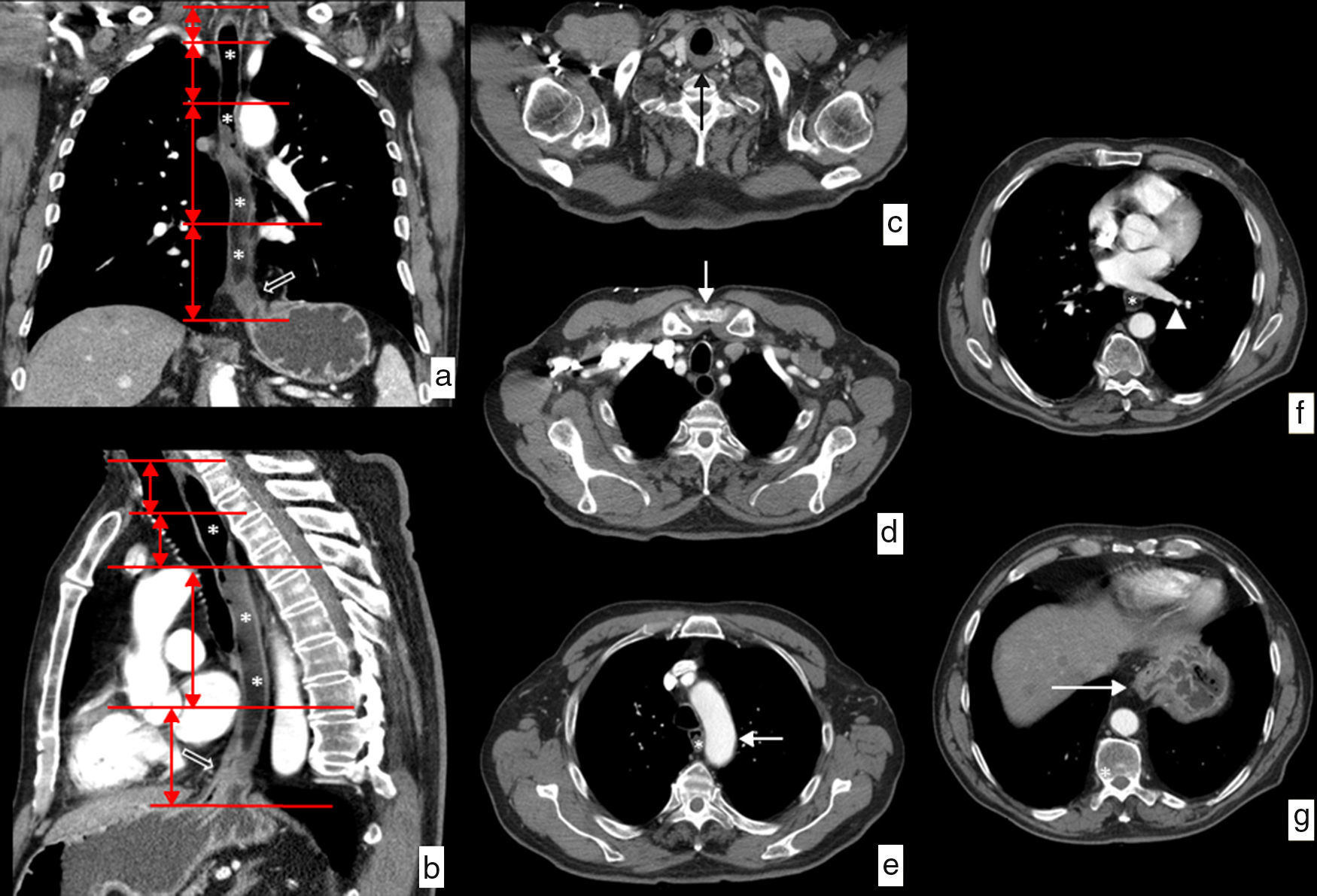
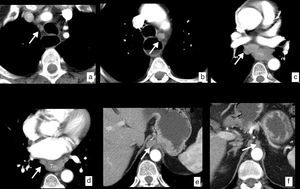
Aunque existe una división endoscópica según la distancia desde el borde superior del tumor a los incisivos, habitualmente empleamos una división clínica que divide el esófago en cervical, torácico superior, medio e inferior, con unas relaciones y unos límites anatómicos bien definidos10–12 (fig. 1):
- •
Esófago cervical. Límites: desde el músculo cricofaríngeo hasta la escotadura esternal. Relaciones anatómicas: arterias carótidas, glándula tiroides, tráquea y cuerpos vertebrales.
- •
Esófago torácico superior. Límites: desde la escotadura esternal hasta el arco aórtico. Relaciones anatómicas: las mismas.
- •
Esófago torácico medio. Límites: desde el arco aórtico hasta la vena pulmonar inferior. Relaciones anatómicas: tráquea y bronquios principales, aorta, arteria pulmonar, vena cava superior, vena ázigos, aurícula izquierda y cuerpos vertebrales.
- •
Esófago torácico inferior. Límites: desde la vena pulmonar inferior hasta la unión esofagogástrica. Relaciones anatómicas: aorta, vena cava inferior, vena ázigos, aurícula izquierda, cuerpos vertebrales y diafragma.
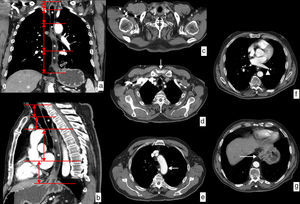
Límites y relaciones anatómicas del esófago en TC. Se ha administrado agua como contraste oral negativo, que rellena la luz esofágica (*) discretamente dilatada por una neoplasia esofágica en el tercio distal visualizada en las imágenes (flechas huecas). a) Vista coronal de reconstrucción curva siguiendo el eje del esófago. Las líneas rojas horizontales representan los límites de cada uno de los segmentos en que se divide el esófago. b) Vista sagital de reconstrucción curva siguiendo el eje del esófago que muestra la misma información. c) Imagen axial a la altura del límite superior del esófago cervical determinado por el músculo cricofaríngeo (flecha negra). d) Imagen axial a la altura del límite entre el esófago cervical y el tercio superior del esófago torácico determinado por la escotadura esternal (flecha blanca). e) Imagen axial a la altura del límite entre los tercios superior y medio del esófago torácico determinado por el arco aórtico (flecha blanca). f) Imagen axial a la altura del límite entre los tercios medio e inferior del esófago torácico determinado por la vena pulmonar inferior (punta de flecha). g) Imagen axial a la altura del límite inferior del tercio inferior del esófago torácico determinado por la unión esofagogástrica (flecha blanca).
El límite superior de la lesión es el que determina la localización de la neoplasia en cada uno de los niveles del esófago.
Drenaje linfáticoLa diseminación linfática es el factor pronóstico individual más importante en el cáncer de esófago y un buen predictor de supervivencia libre de enfermedad13.
Las rutas de drenaje linfático del esófago son complejas y presentan algunas particularidades que es preciso conocer para realizar una correcta valoración diagnóstica y planificar adecuadamente el tratamiento en los pacientes con cáncer de esófago.
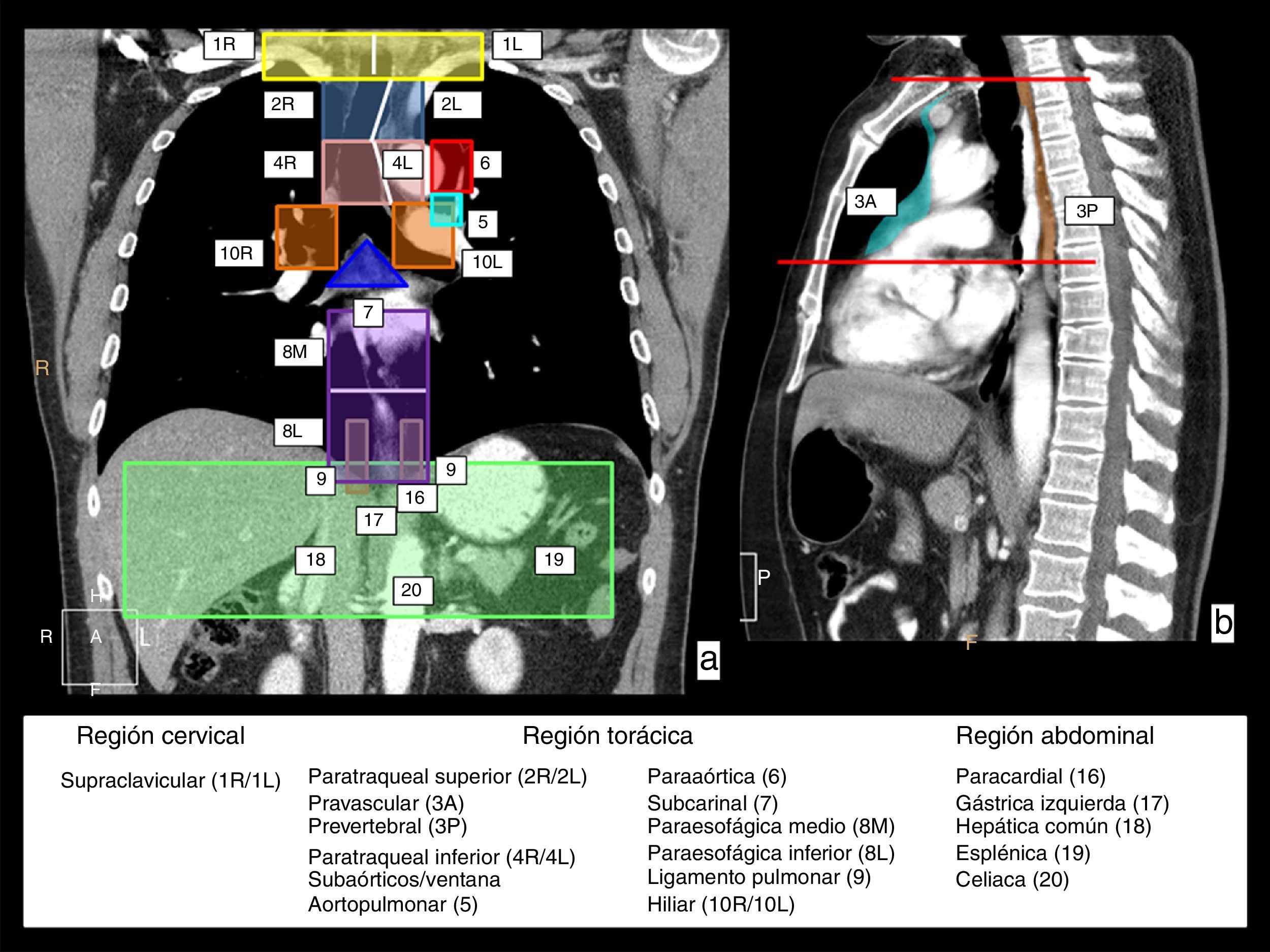
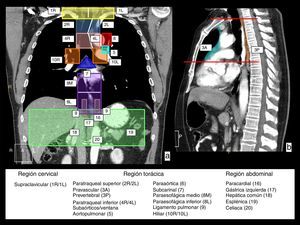
En primer lugar, el drenaje linfático del esófago implica cadenas linfáticas en tres regiones anatómicas: el cuello, en las cadenas supraclaviculares; el tórax, en diversas cadenas mediastínicas; y el abdomen, en las cadenas del abdomen superior. En la figura 2 se muestra una representación esquemática de estas estaciones de drenaje linfático sobre imágenes de reconstrucción coronal y sagital de TC.
Cadenas de drenaje linfático del esófago. En una vista coronal (a) y sagital (b) de TC se representan con colores y números las cadenas que se encargan del drenaje linfático del esófago y que implican tres regiones anatómicas. En la región cervical, las cadenas supraclaviculares derecha (1R) e izquierda (1L), con el límite entre ambas representado por la línea blanca vertical. En la región torácica, las cadenas del mediastino superior que incluyen las cadenas paratraqueales superiores derecha (2R) e izquierda (2L), y paratraqueales inferiores derecha (4R) e izquierda (4L), delimitadas por la línea paratraqueal izquierda representada con una línea blanca, y las cadenas prevascular (3A) y prevertebral (3P), que se representan en la vista sagital; las cadenas aórticas, que incluyen la cadena subaórtica o de la ventana aortopulmonar (5) y paraaórtica (6); y las cadenas del mediastino inferior, que incluyen la cadena subcarinal (7), paraesofágica media (8M), paraesofágica inferior (8L), del ligamento pulmonar (9) e hiliares derecha (10R) e izquierda (10L). En la región abdominal superior, las cadenas paracardial (16), gástrica izquierda (17), hepática común (18), esplénica (19) y celiaca (20).
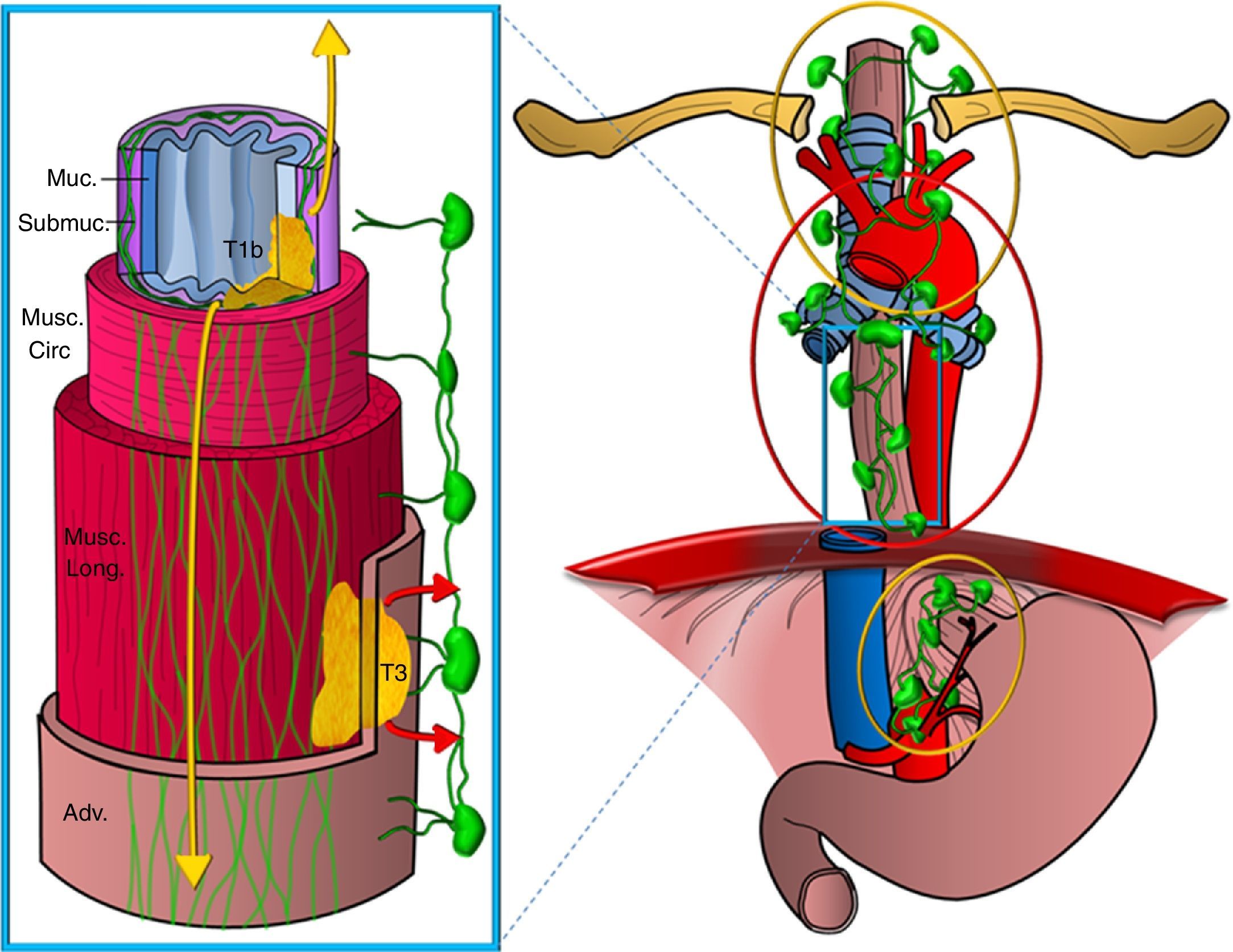
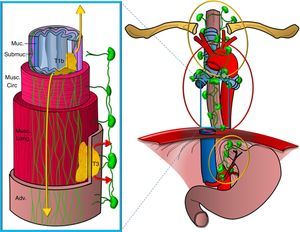
En segundo lugar, el esófago tiene en su pared dos rutas de drenaje linfático: una en la capa submucosa, con una extensa red intramural de canales linfáticos, que se extiende longitudinalmente de forma ininterrumpida desde la hipofaringe hasta el estómago, y que drena en ganglios del mediastino superior y desde ahí a ganglios supraclaviculares y también en ganglios del área perigástrica, y otra ruta en la capa muscular con una red de vasos linfáticos menos desarrollada, que drenan de forma segmentaria en ganglios periesofágicos (fig. 3). Existe una comunicación restringida entre ambas redes y, en términos generales, los dos tercios superiores del esófago drenan en sentido craneal y el tercio inferior lo hace en sentido caudal14,15.
Esquema de las vías de drenaje linfático del esófago. Representación de un segmento del esófago mostrando las distintas capas de la pared (Muc: mucosa; Submuc: submucosa; Musc. circ: muscular circular; Musc. long: muscular longitudinal; Adv: adventicia). Se representan dos tumores que la infiltran, uno de forma superficial hasta la submucosa (T1b) y otro más avanzado (T3), y las redes de drenaje linfático, una en la capa submucosa, más extensa y en sentido longitudinal, que drena en las cadenas del mediastino superior y perigástricas (extensión representada en colores amarillos), y otra en la capa muscular, menos desarrollada, que drena de forma segmentaria en las cadenas periesofágicas (extensión representada en colores rojos).
Esta es la razón por la que los tumores que se extienden solo a la capa submucosa pueden presentar una extensión en cadenas ganglionares alejadas de su localización en la pared esofágica sin que las cadenas periesofágicas más próximas se encuentren afectadas, lo que se denomina skip metastasis. Por tanto, la presencia de ganglios patológicos a distancia del tumor primario no es indicativa de enfermedad localmente avanzada ni implica peor pronóstico que las adenopatías tumorales más cercanas al tumor (fig. 4). En cambio, los tumores que infiltran al menos la capa muscular, además de las cadenas antes mencionadas, con frecuencia afectan a ganglios periesofágicos o al resto de las cadenas mediastínicas16,17.
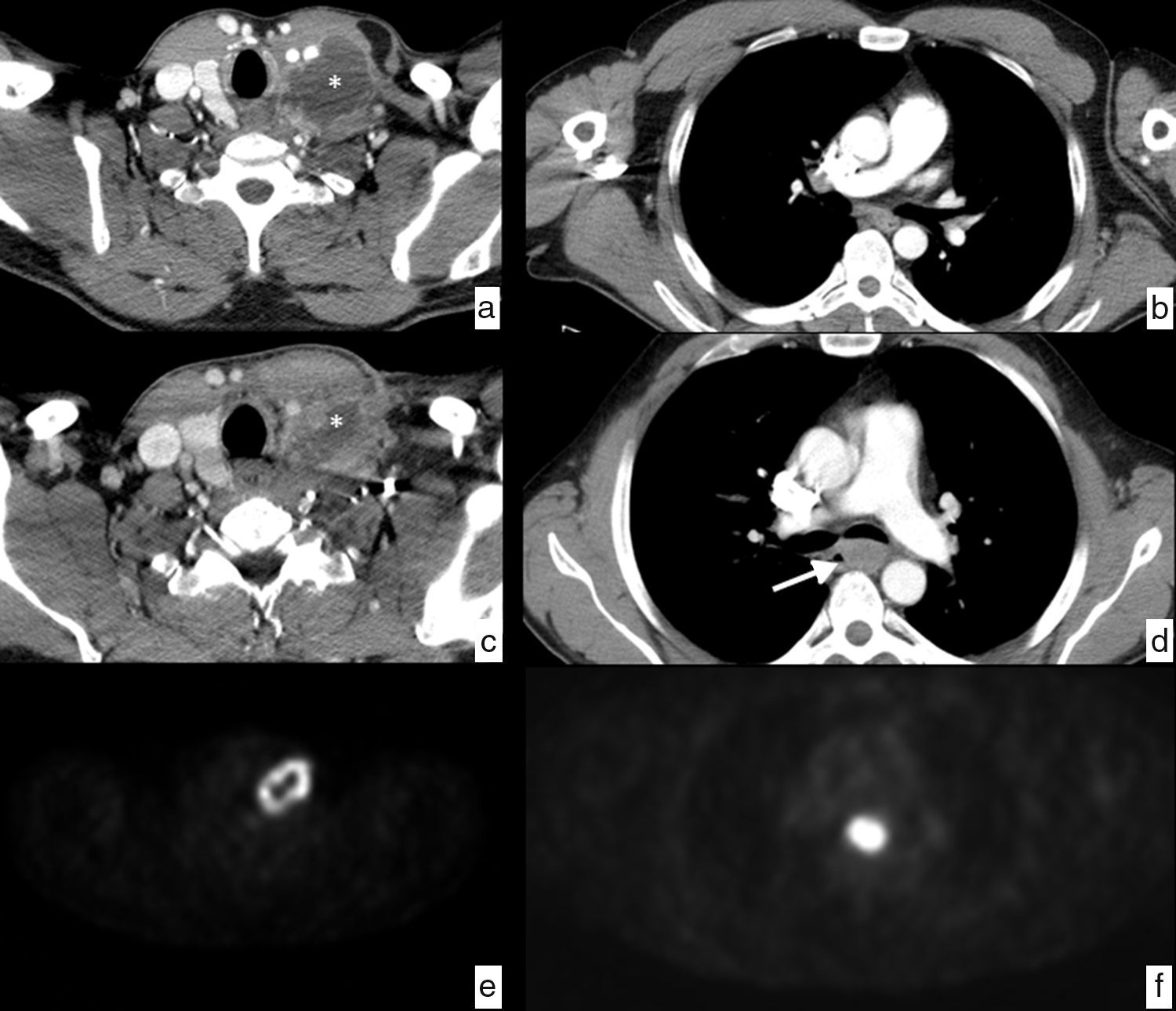
Paciente con adenopatía laterocervical. Estudio inicial, corte axial de TC en la región cervical (a), que muestra una adenopatía laterocervical izquierda (*) de densidad heterogénea con realce periférico y área hipodensa central que sugiere necrosis. Estudio de control tras tratamiento antibiótico, corte de TC en la región cervical a la misma altura (c), que muestra una disminución de tamaño del ganglio patológico (*), a pesar de lo cual persiste la sospecha de origen neoplásico y se decide biopsia, con el resultado de lesión sugestiva de carcinoma epidermoide. Para determinar el origen primario se completa el estudio con PET, que muestra una captación anular patológica de origen tumoral en la región laterocervical izquierda (e) y una captación patológica en el tercio medio del esófago a la altura de la carina, con SUV de 20.5, sospechosa de neoplasia primaria (f), además de adenopatías mediastínicas y retropancreática, y lesiones óseas dudosas en D1 y D4, no mostradas en las imágenes. El estudio endoscópico confirma la existencia de una neoplasia de esófago con biopsia de carcinoma epidermoide que se detecta retrospectivamente (flecha) en el estudio de TC tras el tratamiento (d) y que pasa inadvertida en el estudio inicial (b). Se trata de un cáncer de esófago que probablemente era de pequeño tamaño al inicio, pero mostraba un ganglio patológico a distancia en la cadena laterocervical izquierda (skip metastasis). El diagnóstico clínico final fue de carcinoma epidermoide de tercio medio de esófago en estadio IV, por adenopatía no regional (retropancreática) y dudosas metástasis óseas. Se decide tratamiento con quimiorradioterapia definitiva.
Este drenaje linfático tan complejo ha llevado a que las guías clínicas recomienden linfadenectomías extensas durante el acto quirúrgico, con la intención de realizar un procedimiento curativo y reducir o evitar la posibilidad de recidiva local. No obstante, siempre ha resultado una práctica controvertida y algunos artículos recientes ponen en duda la necesidad de este abordaje18–23.
EstadificaciónLa clasificación actual del cáncer de esófago corresponde a la 7a edición TNM del American Joint Committee on Cancer24, que se actualizó en el año 2010 e introdujo importantes cambios en relación a la clasificación anterior25. Es el resultado de un proyecto de colaboración de varios centros de cinco países de tres continentes, en el que se valoraron las características del tumor y su relación con las tasas de supervivencia en miles de pacientes con cáncer de esófago y de la unión esofagogástrica sometidos a esofagectomía. Además, busca una armonización con la clasificación del cáncer gástrico26,27. Incluye nuevas definiciones en la clasificación anatómica del tumor in situ y del estadio T4, que se divide en dos: tumores que infiltran la pleura, el pericardio o el diafragma y se consideran resecables (T4a), y tumores que infiltran la aorta, los cuerpos vertebrales o la tráquea, que se consideran no resecables (T4b). Aborda una revisión de la clasificación de la extensión ganglionar (N), incluye como ganglios regionales todos los descritos anteriormente, desde las cadenas supraclaviculares hasta el tronco celiaco, y contempla además el número de ganglios afectos como factor pronóstico. Y finalmente reduce la categoría de extensión metastásica (M) a dos grupos: ausente (M0) o presente (M1), incluyendo las metástasis en ganglios no regionales. También introduce características no anatómicas, como la estirpe, el grado tumoral y la localización, que no se contemplaban en la clasificación anterior (tabla 1).
Comparación entre la 6ª y la 7ª ediciones de la clasificación TNM. En negrita, en la columna de la derecha, los cambios introducidos en la clasificación actual
| 6aedición AJCC/UICC (2002) | 7aedición AJCC/UICC (2010) |
|---|---|
| Características anatómicas | Características anatómicas |
| Tx: el tumor no puede ser valorado | Tx: el tumor no puede ser valorado |
| T0: sin evidencia de tumor | T0: sin evidencia de tumor |
| Tis: lesiones malignas en el epitelio sin invasión de la membrana basal | Tis: displasia de alto grado |
| T1: el tumor invade la mucosa, pudiendo alcanzar la submucosa, pero sin sobrepasarla | T1: el tumor invade la mucosa, pudiendo alcanzar la submucosa, pero sin sobrepasarla (T1a solo la mucosa, T1b alcanza la submucosa) |
| T2: el tumor invade la capa muscular propia sin sobrepasarla | T2: el tumor invade la muscular propia sin sobrepasarla |
| T3: el tumor sobrepasa la adventicia, invadiendo tejido paraesofágico, pero no estructuras adyacentes | T3: el tumor sobrepasa la adventicia, invadiendo tejido paraesofágico, pero no estructuras adyacentes |
| T4: el tumor invade estructuras adyacentes | T4: el tumor invade estructuras adyacentes |
| T4a (resecable): pleura, pericardio, diafragma | |
| T4b (irresecable): aorta, cuerpo vertebral, tráquea | |
| N0: sin metástasis en ganglios regionales | N0: sin metástasis en ganglios regionales |
| N1: metástasis en ganglios regionales | N1: metástasis en 1-2 ganglios regionales |
| N2: metástasis en 3-6 ganglios regionales | |
| N3: metástasis en 7 o más ganglios regionales | |
| M0: sin metástasis a distancia | M0: sin metástasis a distancia |
| M1a: metástasis en ganglios cervicales en t. esófago distal y en ganglios celiacos en t. esófago proximal | M1: metástasis a distancia |
| M1b: metástasis a distancia | |
| Características no anatómicas | Características no anatómicas |
| No se consideran | Tipo histológico: Adenocarcinoma Carcinoma de células escamosas |
| Grado histológico: G1: bien diferenciado G2: moderadamente diferenciado G3: pobremente diferenciado G4: indiferenciado | |
| Localización del tumor: Torácico superior: 20-25cm desde los incisivos Torácico medio: 25-30cm desde los incisivos Torácico inferior: 30-40cm desde los incisivos |
La edición actual incluye los tumores de la unión esofagogástrica en el mismo grupo que los tumores del esófago. Estos pueden dividirse en tres tipos según la clasificación modificada de Siewert: tipo 1, con su epicentro en el esófago distal entre 5 y 1cm por encima de la unión esofagogástrica; tipo 2, con su epicentro entre 1cm por encima y 2cm por debajo de la unión esofagogástrica; y tipo 3, con su epicentro en el cardias entre 2 y 5cm por debajo de la unión esofagogástrica, en tumores que se extienden a la propia unión esofagogástrica28.
De la aplicación de esta clasificación se obtienen grupos de estadificación mucho más complejos que en la edición previa, pero que permiten una mejor estratificación del pronóstico de supervivencia global29.
Está anunciada una nueva revisión de la clasificación TNM (8ª edición) para el año 2016, que será efectiva a partir del 1 de enero de 2017. La actual clasificación tiene como principal limitación que los datos en que se basa proceden exclusivamente de pacientes sometidos a esofagectomía. De la nueva clasificación cabe esperar una mayor homogeneidad entre los distintos estadios; una clasificación clínica inicial y tras el tratamiento de inducción; otras características no anatómicas del tumor que puedan afectar a la supervivencia; datos de supervivencia de pacientes no sometidos a esofagectomía, y una posible armonización del cáncer de esófago cervical con los tumores de cabeza y cuello30,31.
Diagnóstico, estadificación clínica, evaluación de la respuesta y seguimiento por la imagenDeterminación de las características no anatómicasEsofagoscopia y biopsiaSon las herramientas esenciales en la valoración de las características no anatómicas del tumor. Además de definir la localización del tumor según la distancia desde los incisivos hasta su límite superior, mediante el análisis de la muestra obtenida se conocen su estirpe y grado histológico32.
EsofagogramaAunque en el pasado se empleaba como método de diagnóstico inicial ante la sospecha de cáncer de esófago previamente al estudio endoscópico, en la actualidad se ha abandonado su uso sistemático. En casos concretos puede aportar información acerca de la localización y la extensión del tumor, en especial en neoplasias estenosantes que impiden el paso del endoscopio o para demostrar la presencia de una fístula traqueoesofágica33.
Determinación de las características anatómicasEcoendoscopiaSe considera la prueba de imagen más precisa en la valoración de la profundidad de la infiltración tumoral en la pared (cT), con valores de sensibilidad y especificidad del 81,6% y el 99,4%, respectivamente, para los tumores T1, y del 92,4% y el 97,4% para los tumores T434.
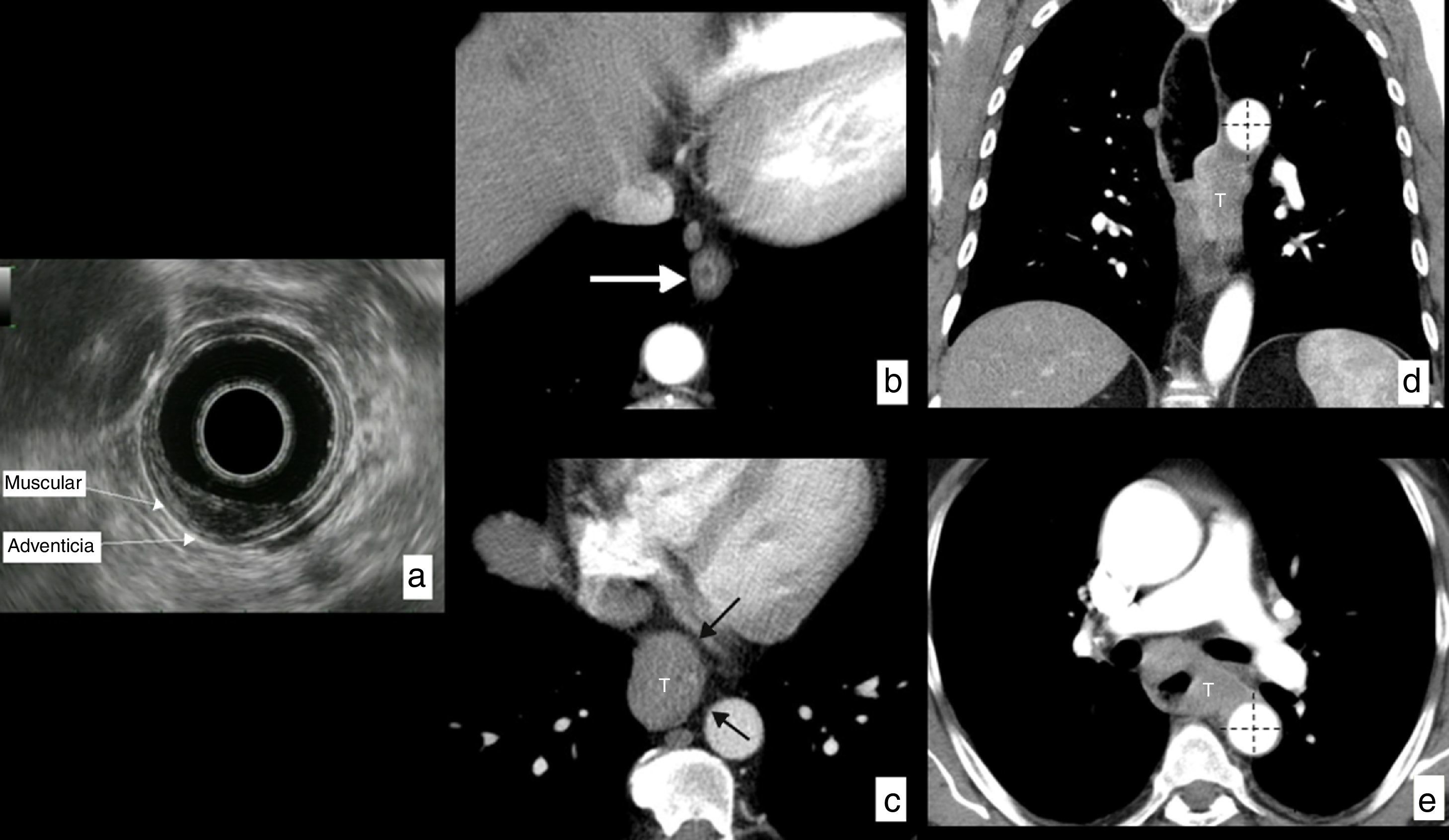
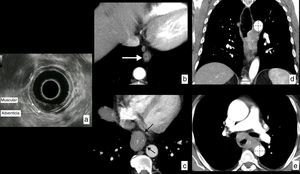
Es especialmente útil en la valoración precisa de tumores en estadios iniciales (T1-T2) de cara a la planificación de un tratamiento endoscópico conservador (resección endoscópica) o inicialmente quirúrgico con esofagectomía (fig. 5), e identifica a los pacientes en estadios más avanzados (T3-T4) que recibirán tratamiento neoadyuvante o definitivo mediante quimioterapia o quimiorradioterapia.
Cáncer de esófago, valoración de la infiltración de la pared (cT) en distintos pacientes. a) Ecoendoscopia en paciente con carcinoma epidermoide en el tercio medio del esófago que invade la mucosa y la submucosa, sin sobrepasarla, respetando la capa muscular: T1b según la clasificación TNM actual. b) TC en corte axial de otro paciente que muestra una pequeña lesión polipoidea de crecimiento endoluminal dependiente de la pared esofágica (flecha). Tras la resección quirúrgica, el estudio histológico confirmó que el tumor respetaba la capa muscular: T1 según la clasificación TNM actual. c) Corte axial de TC que muestra un tumor (T) del tercio inferior del esófago que infiltra los tejidos periesofágicos, pero que muestra en todo momento un plano graso con las estructuras vecinas (flechas negras), descartando infiltración de estas: T3 según la clasificación TNM actual. d) TC en reconstrucción coronal y corte axial (e) de otro paciente con tumor (T) de tercio medio e inferior del esófago que se extiende más allá de la pared y muestra amplio contacto con la aorta descendente, en más de 90° (líneas discontinuas), que sugiere radiológicamente infiltración de esta: T4b (irresecable) según la clasificación TNM actual.
Las limitaciones más importantes de la técnica son que es dependiente del operador y que en un alto número de casos el tumor es estenosante y no puede ser evaluado.
Permite valorar los ganglios mediastínicos (cN), identificando como patológicos aquellos con un diámetro menor de más de 10mm, morfología redondeada, hipoecoicos o con contornos mal definidos, con unos valores de sensibilidad y especificidad en función de estas características del 76-84% y el 70-85%, respectivamente. Además, en los casos en que su determinación condiciona un cambio en la estrategia terapéutica ofrece la posibilidad de realizar un análisis citológico mediante punción-aspiración con aguja fina de forma dirigida, lo que aumenta significativamente la sensibilidad del 84,7% al 96,7% y la especificidad del 84,6% al 95,5%, y su resultado ha demostrado ser un predictor pronóstico independiente de supervivencia35. De esta manera se convierte en una herramienta muy precisa para la valoración de la extensión ganglionar locorregional (cN), aunque de forma parcial, al no poder evaluar las cadenas ganglionares cervicales y mediastínicas alejadas de la pared del esófago12,30,34,36,37.
Aunque el papel de la ecoendoscopia está bien establecido en la valoración inicial, no es una herramienta útil en la evaluación tras la neoadyuvancia por la alta tasa de sobreestadificación como consecuencia de los cambios inflamatorios y de fibrosis secundarios al tratamiento38–40.
Tomografía computarizadaSu papel fundamental en la estadificación local del tumor (cT) es descartar la invasión de órganos adyacentes (T4). Sugiere infiltración tumoral si el área de contacto entre el tumor y la aorta supera los 90° o si hay obliteración del triángulo graso entre el esófago, la aorta y el cuerpo vertebral adyacente; si hay desplazamiento o deformación del contorno de la pared posterior de la tráquea o el bronquio principal, fístula esofagotraqueal o esofagobronquial, o extensión directa del tumor a la luz de la vía aérea, en cuyo caso está indicada la realización de broncoscopia; y si se aprecia una irregularidad del contorno del borde cardiaco con pérdida de los planos grasos adyacentes. La presencia de cualquiera de estos hallazgos obliga a considerar la posibilidad de un tumor irresecable (T4b). Los valores de sensibilidad y especificidad de la técnica para detectar infiltración aórtica o traqueobronquial son de casi el 100% y el 52-97%, respectivamente12. Para el resto de las estructuras mediastínicas, el criterio de imagen empleado para descartar su infiltración es la preservación de los planos grasos de las mismas con la lesión (fig. 5).
La presencia de tejido tumoral en el espesor de la grasa mediastínica indica T3 (extensión extramural sin infiltración de estructuras vecinas). La TC tiene una precisión diagnóstica limitada en la enfermedad en estadio precoz (T1-T2), en cuyo caso la lesión debe aparecer confinada a la pared esofágica10,12,32 (fig. 5).
En la valoración de la extensión ganglionar locorregional (cN) es una técnica menos precisa que la ecoendoscopia, pues el criterio de tamaño, que es el que se utiliza habitualmente como hallazgo sospechoso, es un mal predictor de infiltración tumoral (hay ganglios reactivos aumentados de tamaño y ganglios tumorales de tamaño normal). Los valores establecidos de sensibilidad y especificidad de la técnica son del 59% y el 81%, respectivamente37.
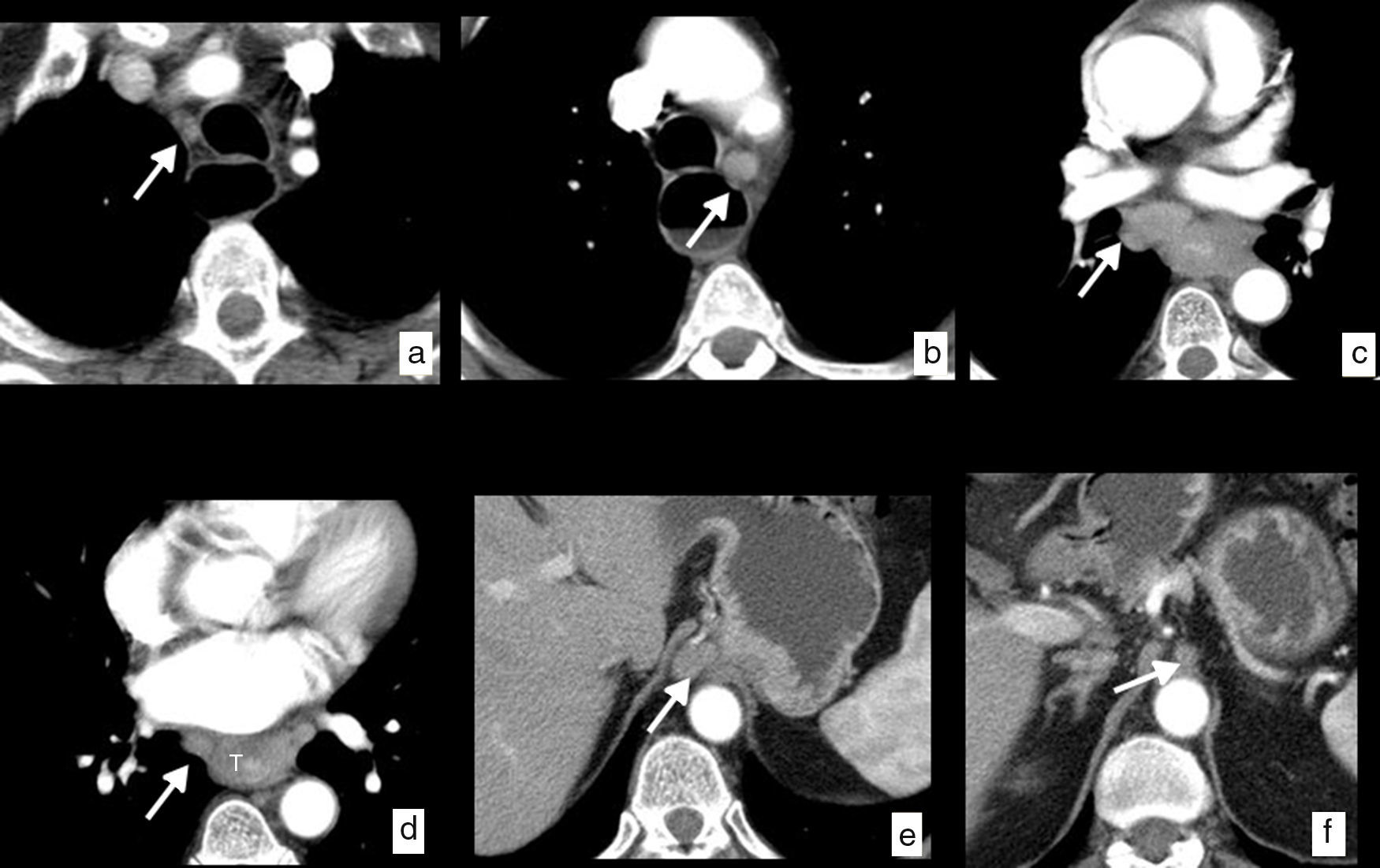
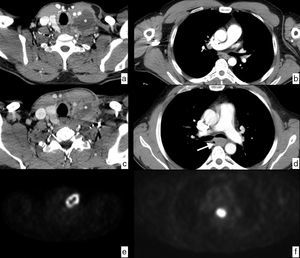
Un ganglio se considera sospechoso por TC cuando su diámetro menor es de más de 10mm si se localiza en las cadenas torácicas y abdominales, y de 5mm en las cadenas supraclaviculares. Deben tenerse en cuenta otras características de imagen, como la pérdida de la morfología normal, la hipercaptación, la densidad heterogénea o la irregularidad de los contornos, para mejorar la precisión diagnóstica (fig. 6).
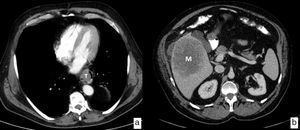
Cáncer de esófago, con diseminación ganglionar en estudios de TC (cN). Imágenes axiales en las que se identifican ganglios patológicos (flechas) secundarios a la extensión ganglionar en diferentes cadenas locorregionales mediastínicas y abdominales superiores. a) Cadena paratraqueal superior derecha (2R). b) Cadena paratraqueal inferior izquierda (4L). c) Cadena subcarinal (7). d) Cadena paraesofágica media (8M). e) Cadena paracardial (16). f) Cadena celiaca (20). Engrosamiento de la pared en el tercio medio del esófago (T) en relación con el tumor primario (d).
Como valor añadido, y a diferencia de la ecoendoscopia, permite valorar todas las cadenas de drenaje linfático del esófago.
Nuestro protocolo de estudio en el cáncer de esófago incluye una primera hélice que se adquiere a los 30 segundos del inicio de la administración de contraste yodado intravenoso, y que abarca desde la región cervical inferior (por la extensión del drenaje linfático del esófago) hasta los senos costofrénicos, para incluir con seguridad los tumores de segmentos inferiores, y una segunda hélice con 70 segundos de retraso desde las cúpulas diafragmáticas hasta las tuberosidades isquiáticas. Inmediatamente antes de realizar el estudio, el paciente ingiere cuatro vasos de agua como contraste oral negativo.
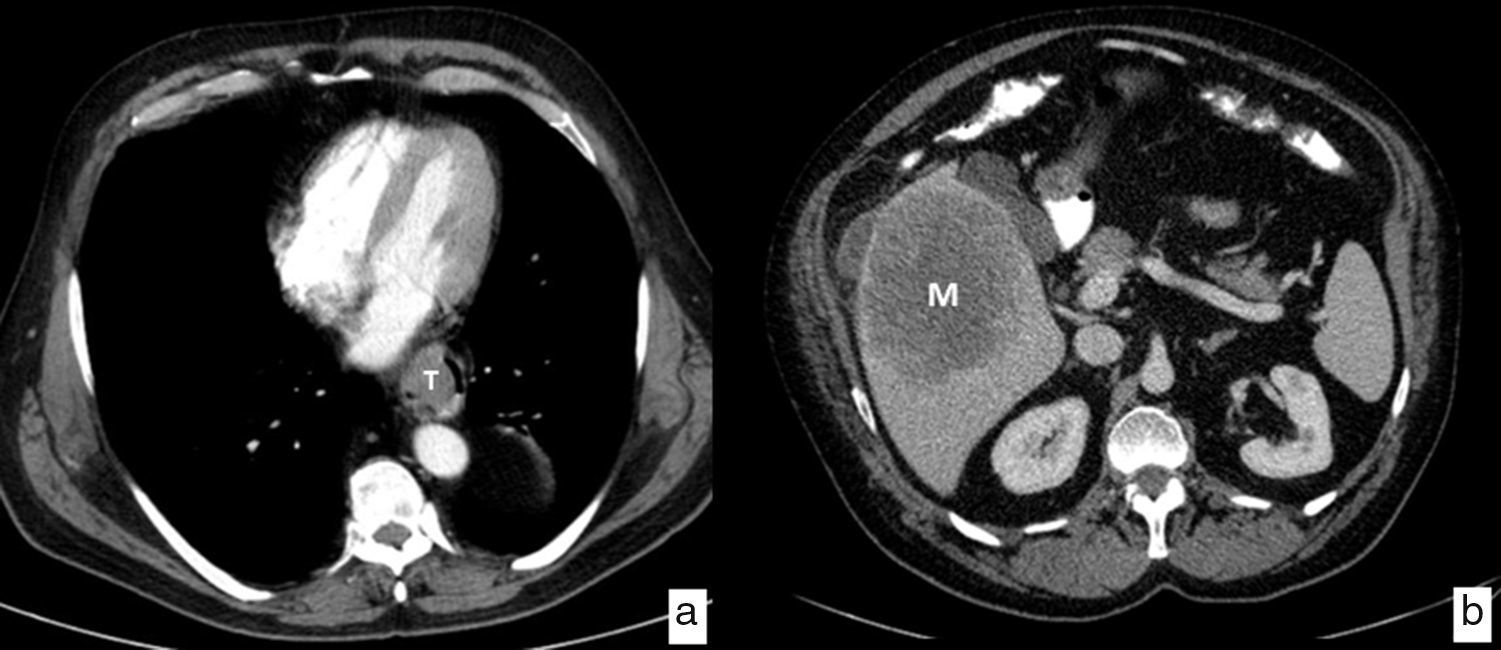
La TC es la prueba de imagen más ampliamente utilizada en la valoración inicial de los pacientes diagnosticados de cáncer de esófago para descartar metástasis a distancia (cM); los órganos más frecuentemente afectados son el hígado, los pulmones, los huesos y las glándulas suprarrenales. Tiene una sensibilidad del 90% para la detección de metástasis hepáticas mayores de 1cm (fig. 7). Un 30% de los pacientes tienen metástasis en el momento del diagnóstico, lo que los excluye de la posibilidad de un tratamiento quirúrgico con pretensiones curativas.
Suele ser la herramienta empleada para valorar la respuesta al tratamiento neoadyuvante, aunque con importantes limitaciones por el aumento de densidad de los planos grasos periesofágicos consecuencia del mismo.
Como seguimiento por la imagen de los pacientes tratados por cáncer de esófago con intención curativa se recomienda la realización de una TC torácica, abdominal y pélvica cada 6 meses durante los primeros 2 años, y posteriormente cada año los siguientes 3-4 años. Puede completarse con otras exploraciones en caso de dudas diagnósticas y según el lugar de sospecha de la recidiva tumoral, que con mayor frecuencia aparece como enfermedad a distancia. También es la prueba indicada en el seguimiento de los pacientes en tratamiento paliativo, según las necesidades clínicas41.
PET-TCLa exploración suele hacerse desde la base del cráneo hasta los muslos, con los brazos sobre la cabeza para evitar artefactos en el tórax. La dosis empleada para un adulto de 70kg es de 370 MBq de 18F-FDG por vía intravenosa en infusión lenta, y las imágenes se adquieren 60 minutos después42.
El uso combinado de ambas técnicas se ha demostrado superior a la utilización de cada una de ellas por separado. La principal utilidad de la PET-TC con 18F-FDG radica en la identificación de metástasis (cM) no detectadas con otras técnicas, que se estima hasta en un 15% de los pacientes, o de tumores sincrónicos, no infrecuentes, en la cabeza y el cuello, el pulmón o el estómago, en relación con el abuso de alcohol y tabaco. Para la extensión locorregional, las limitaciones en la resolución espacial de la imagen funcional condicionan la valoración del grado de infiltración del tumor en la pared (cT), y aunque puede detectar ganglios tumorales con mayor precisión que la TC y en territorios alejados de la ecoendoscopia, la intensa captación del trazador por el tumor primario dificulta diferenciarlo de ganglios peritumorales (cN)12,35,43.
Actualmente las guías clínicas no recomiendan su uso sistemático en la valoración inicial de estos pacientes, salvo como alternativa a la TC44, pero es previsible que en los próximos años se incluya, dada la disponibilidad de estos equipos. Permite señalar el grado metabólico antes del tratamiento, como factor pronóstico, y facilita el seguimiento posterior tras la neoadyuvancia o en caso de recurrencia45.
Tiene un papel bien establecido en la planificación de la radioterapia y puede ser de utilidad en la evaluación de la respuesta local al tratamiento neoadyuvante, aunque se han comunicado resultados contradictorios debido a la persistencia de la captación del trazador por esofagitis y ulceración inducidas por la quimiorradioterapia (falsos positivos), y es preciso disponer de un mayor número de estudios que avalen su utilidad.
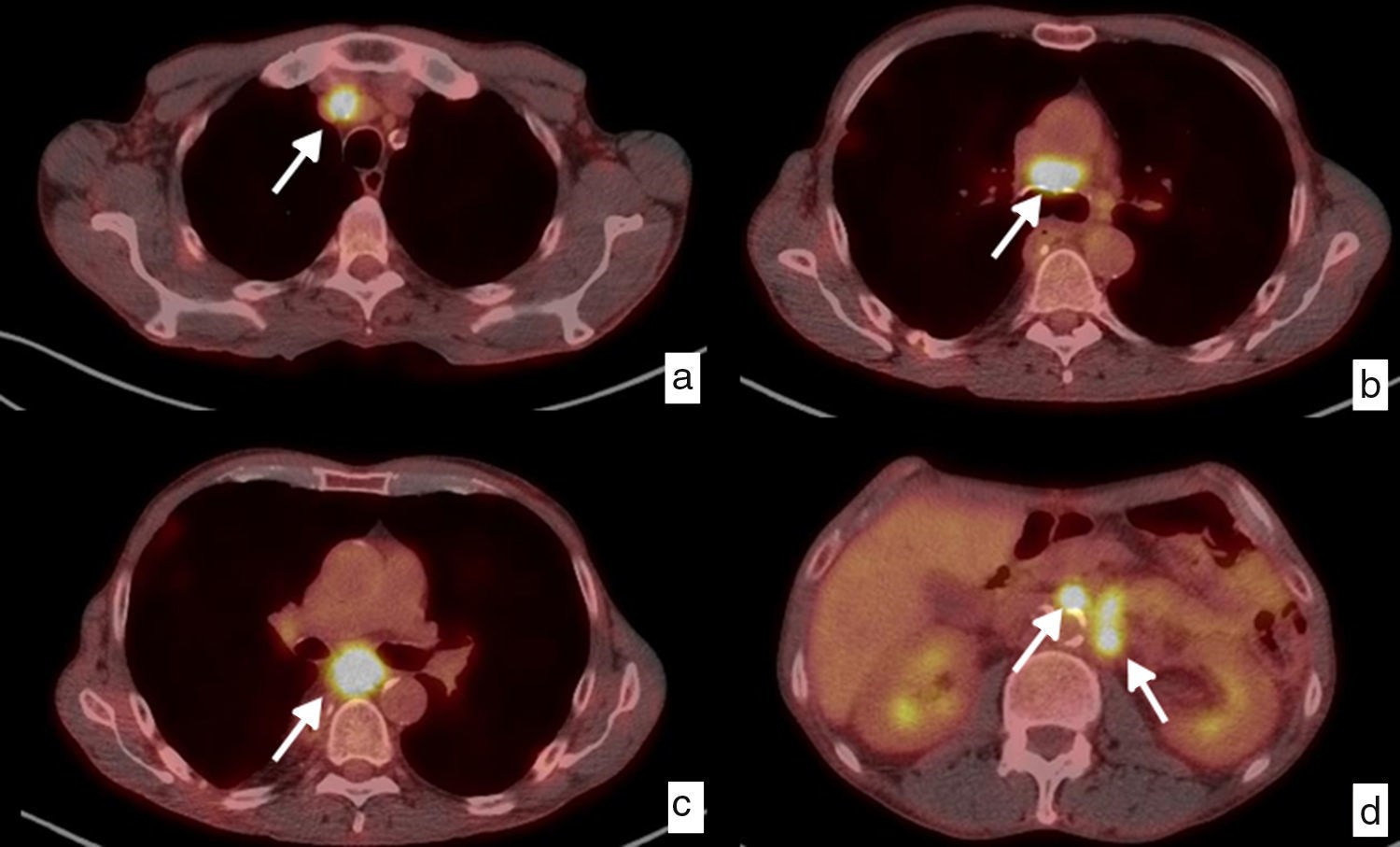
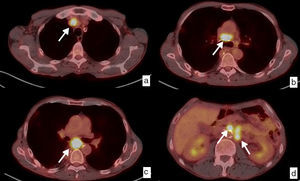
Contribuye a la identificación de metástasis de intervalo (que aparecen en el transcurso del tratamiento previo a la cirugía), las cuales ocurren hasta en un 8% de los casos46, y a la detección de recidiva tumoral durante el seguimiento, en especial cuando hay dudas diagnósticas con otras técnicas43,47–49 (fig. 8).
Recidiva ganglionar local y a distancia. Diagnóstico mediante PET-TC. Paciente con diagnóstico inicial de carcinoma epidermoide de tercio inferior de esófago torácico que fue intervenido quirúrgicamente con estadificación patológica pT3pN2. Imágenes axiales en el estudio de seguimiento, 6 meses después de la cirugía. Ganglios patológicos (flechas blancas) aumentados de tamaño y con incremento de la captación del trazador, con un SUV máximo entre 11.61 y 9.64, en las cadenas mediastínicas, que indican recidiva ganglionar local (a, b, c), y retroperitoneales superiores, pre y paraaórtica izquierda, en relación con recidiva a distancia (M1) (d).
La resonancia magnética (RM) no se emplea sistemáticamente en la valoración de estos pacientes. Sin embargo, la mejora reciente en los protocolos de RM, con secuencias más rápidas, y el empleo de sincronización cardiaca y respiratoria, que ha permitido mejorar la calidad de las imágenes, y la valiosa información funcional que aporta la secuencia de difusión, ampliamente utilizada en la valoración de otros órganos, hacen que la RM pueda desempeñar un papel complementario resolviendo las limitaciones del resto de las técnicas49,50.
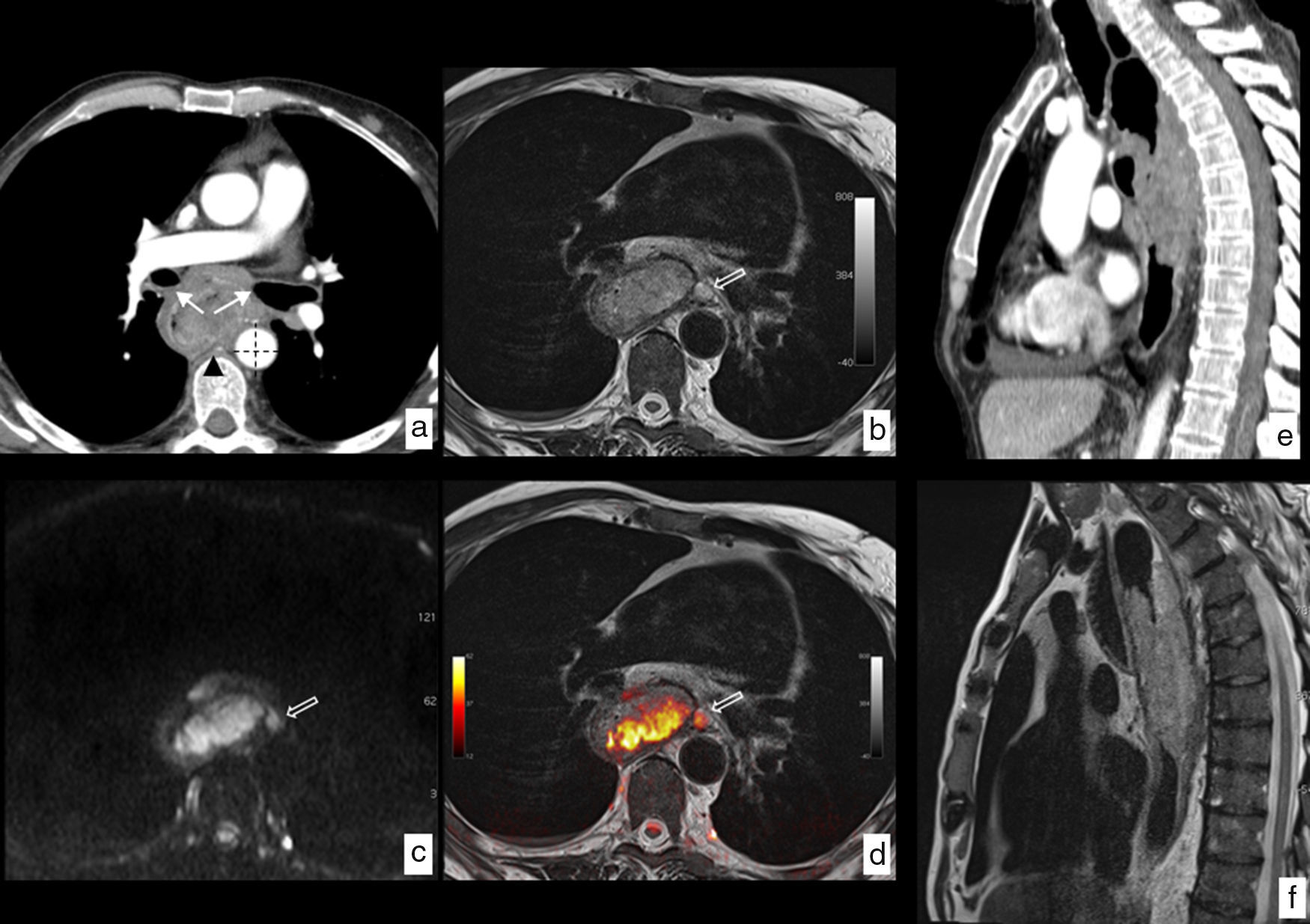
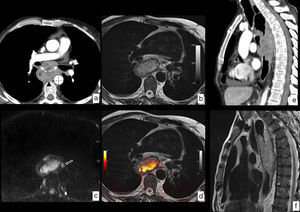
La RM tiene una resolución de contraste tisular superior a la TC y la PET-TC, lo que en algunos casos puede aclarar las dudas sobre una posible infiltración tumoral de estructuras vecinas (T4) cuando los hallazgos no son concluyentes con otras técnicas (fig. 9). La precisión de la prueba alcanza el 81% en comparación con los hallazgos histológicos en la valoración de la infiltración tumoral de la pared (cT)51.
RM en cáncer de esófago con infiltración local. Neoplasia en tercio superior y medio del esófago con biopsia de carcinoma epidermoide. a) TC en corte axial en la que se identifica la lesión esofágica que contacta con la pared posterior de ambos bronquios principales (flechas), con la aorta descendente en más de 90° (líneas discontinuas) y con los cuerpos vertebrales (punta de flecha), sin identificar plano graso con dichas estructuras, lo que radiológicamente plantea infiltración local, en este caso irresecable. b) RM en corte axial a la misma altura potenciada en T2, que muestra la mayor resolución tisular de la técnica, lo que permite demostrar la ausencia de infiltración de las estructuras descritas y además muestra un ganglio patológico (flecha hueca) no identificado en el estudio con TC. c) RM potenciada en difusión a la misma altura que aporta información funcional, demostrando una alta señal con valor de b de 1.000 s/mm2, que indica restricción de la difusión del agua en la lesión tumoral y la presencia del ganglio paraesofágico antes referido. d) Imagen de fusión T2-difusión que incluye información anatómica y funcional conjuntamente. Comparación de la mayor resolución de contraste tisular de la RM (f) frente a la TC (e), en plano sagital, descartando infiltración de cuerpos vertebrales. Estadificación clínica final T3 N2-3 M0, que se desestimó para tratamiento quirúrgico y el paciente fue tratado con quimiorradioterapia definitiva.
Además, las secuencias STIR y de difusión mejoran la detección de ganglios locorregionales (cN) y permiten distinguirlos de la infiltración tumoral de la pared y de tejidos periesofágicos. Se han comunicado valores de hasta un 81% de sensibilidad, un 95% de especificidad y un 95% de precisión con el empleo de la secuencia STIR52.
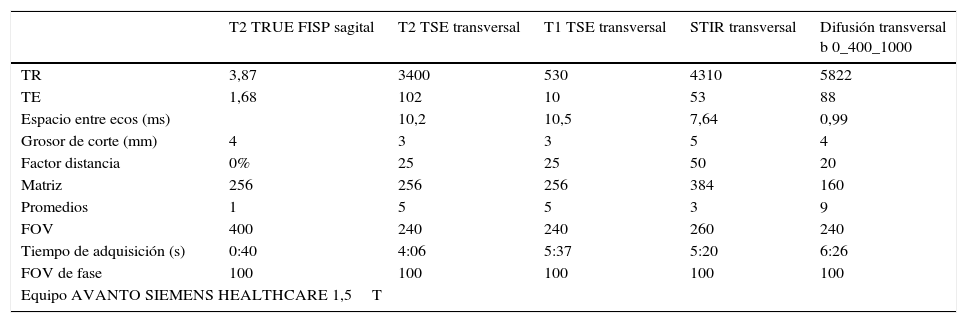
Aunque el protocolo de estudio de RM deberá adaptarse al motivo concreto por el que se realiza la exploración, en general incluye una secuencia rápida potenciada en T2 en el plano sagital, que sirve como localizador; secuencias potenciadas en T1 y T2 en incidencia axial, recogiendo la totalidad de la lesión; y secuencias STIR y de difusión, obteniendo el correspondiente mapa de coeficiente de difusión aparente (CDA), también en incidencia axial y cubriendo la totalidad del tórax53 (tabla 2).
Protocolo de adquisición de estudio de RM empleado en nuestro centro para el cáncer de esófago
| T2 TRUE FISP sagital | T2 TSE transversal | T1 TSE transversal | STIR transversal | Difusión transversal b 0_400_1000 | |
|---|---|---|---|---|---|
| TR | 3,87 | 3400 | 530 | 4310 | 5822 |
| TE | 1,68 | 102 | 10 | 53 | 88 |
| Espacio entre ecos (ms) | 10,2 | 10,5 | 7,64 | 0,99 | |
| Grosor de corte (mm) | 4 | 3 | 3 | 5 | 4 |
| Factor distancia | 0% | 25 | 25 | 50 | 20 |
| Matriz | 256 | 256 | 256 | 384 | 160 |
| Promedios | 1 | 5 | 5 | 3 | 9 |
| FOV | 400 | 240 | 240 | 260 | 240 |
| Tiempo de adquisición (s) | 0:40 | 4:06 | 5:37 | 5:20 | 6:26 |
| FOV de fase | 100 | 100 | 100 | 100 | 100 |
| Equipo AVANTO SIEMENS HEALTHCARE 1,5T | |||||
TR tiempo de repetición. TE tiempo de eco. FOV field of view (campo de visión)
El papel de la RM en la planificación del tratamiento con radioterapia está bien establecido en otros tumores, como los de cabeza y cuello, próstata, recto y cérvix, y basándose en la mejor resolución de contraste tisular antes mencionada esta técnica puede tener una importante utilidad en el futuro, permitiendo optimizar las dosis y minimizar el volumen de irradiación de estructuras vecinas54.
Recientes estudios señalan que la RM puede tener un papel en la evaluación de la respuesta al tratamiento neoadyuvante, en especial cuando los resultados de la TC y de la PET-TC son contradictorios. Incluso podría predecir la respuesta tumoral antes del tratamiento empleando la imagen funcional con RM (secuencia de difusión)55–57.
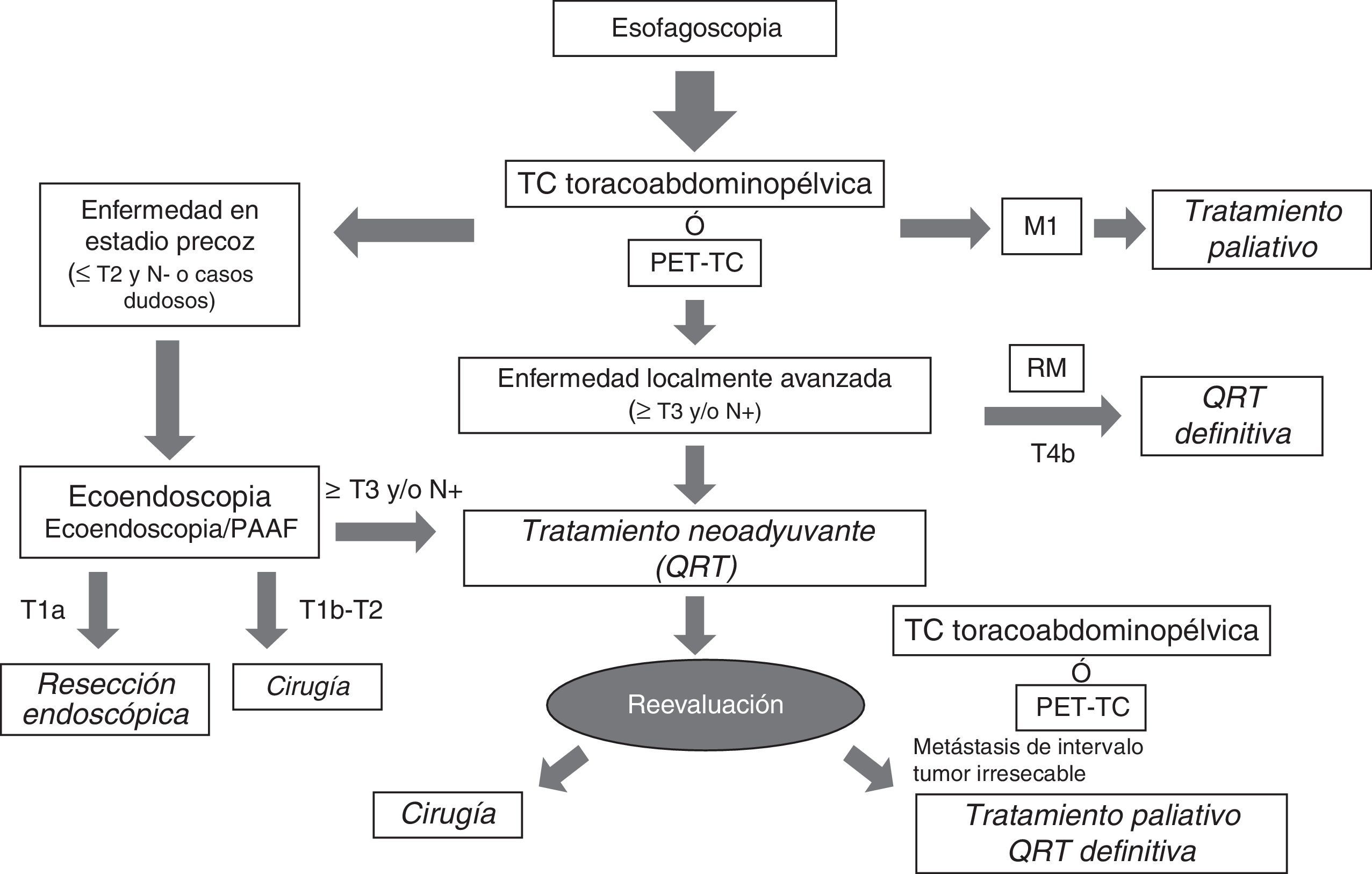
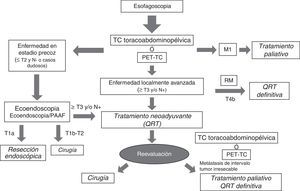
Selección de pruebas diagnósticasLa tabla 3 recoge a modo de resumen las fortalezas y debilidades de cada una de las técnicas de imagen empleadas en la estadificación clínica del cáncer de esófago. La mayor precisión diagnóstica se obtiene con una adecuada combinación de ellas, que queda recogida en un algoritmo de diagnóstico que nos permite clasificar adecuadamente a los pacientes para recibir el tratamiento más apropiado, según las características del tumor, en cada una de las etapas del proceso terapéutico (fig. 10).
De esta manera, tras la endoscopia y la confirmación histológica del cáncer de esófago, la prueba de imagen inicial en la mayoría de los centros es una TC toracoabdominopélvica, incluyendo la región supraclavicular. Según la disponibilidad podría sustituirse por una PET/TC. En aquellos casos en que se sospeche enfermedad en estadio precoz, que lamentablemente son pocos, estaría indicado realizar una ecoendoscopia para seleccionar aquellos pacientes en estadio T1a (sólo infiltración de la mucosa, respetando la submucosa), en quienes podría realizarse una resección endoscópica del tumor. Si se confirma el estadio clínico T1a en la histología, se consideraría el tratamiento definitivo, mientras que si se demuestra resección incompleta o infiltración de la capa submucosa (T1b) el tratamiento sería insuficiente y debería completarse con esofagectomía y linfadenectomía radical, dado el riesgo de diseminación ganglionar por la extensa red linfática en esta capa de la pared del esófago. En los casos en que se demuestra infiltración de la capa muscular (T2), el abordaje inicial es la cirugía. Para realizar un tratamiento inicialmente quirúrgico, además del grado de infiltración en la pared debe descartarse una posible extensión ganglionar locorregional (N0) con las distintas pruebas de imagen y, eventualmente, mediante punción-aspiración con aguja fina guiada por ecoendoscopia en caso de ganglios sospechosos. Si en la TC o la PET-TC inicial se diagnostica enfermedad metastásica (M1) o tumor no resecable (T4b), se descarta el tratamiento quirúrgico y el paciente será derivado para tratamiento paliativo con quimioterapia o quimiorradioterapia, por lo que en ocasiones es recomendable confirmar el estadio con histología o con RM. Los tumores localmente avanzados y resecables (T3, T4a y N+) recibirán tratamiento neoadyuvante con quimiorradioterapia y reevaluación posterior con nueva TC o PET/TC, seguida de cirugía y quimioterapia adyuvante, salvo que aparezcan metástasis de intervalo o el tumor se haya convertido en irresecable por progresión local. En algunos centros se está planteando la utilización de quimiorradioterapia radical en este grupo de pacientes, en especial en los que por sus condiciones particulares se prevé una mayor morbimortalidad quirúrgica. El manejo del cáncer de esófago debe ser abordado en comités multidisciplinarios, y se adaptará a las circunstancias de cada caso5,7,12,21,28,44,58,59.
En conclusión, los radiólogos debemos estar familiarizados con las características anatómicas especiales y la clasificación actual del cáncer de esófago, y conocer la utilidad de cada una de las herramientas de diagnóstico por la imagen disponibles para proporcionar información relevante en el manejo clínico de estos pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría- 1.
Responsable de la integridad del estudio: JEI.
- 2.
Concepción del estudio: JEI.
- 3.
Diseño del estudio: JEI, MACC.
- 4.
Obtención de los datos: JEI, RRP, AAD.
- 5.
Análisis e interpretación de los datos. JEI, MACC, GCFP.
- 6.
Tratamiento estadístico: No procede.
- 7.
Búsqueda bibliográfica: JEI, MACC.
- 8.
Redacción del trabajo: JEI, MACC, GCFP, RRP.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: JEI, MACC, GCFP, RRP, AAD.
- 10.
Aprobación de la versión final: JEI, MACC, GCFP, RRP, AAD.
Los autores declaran no tener ningún conflicto de intereses