INTRODUCCIÓN
Hasta ahora se consideraban la proliferación de osteoclastos y osteoblastos, así como la actividad de los mismos, los procesos fundamentales para el mantenimiento de la estructura ósea. Sin embargo, se ha descrito que la prevalencia de apoptosis o muerte celular programada es esencial para la homeostasis esquelética, y los cambios que puedan producirse en el número de osteoblastos y osteoclastos por este mecanismo son también responsables del desequilibrio entre formación y resorción que conduce a la mayoría de las patologías óseas, incluyendo la osteoporosis posmenopáusica.
El crecimiento y la actividad de las células óseas están regulados por factores locales y sistémicos que afectan, en última instancia, al metabolismo óseo. Se ha descrito que durante la menopausia el descenso en los niveles de estrógenos produce un aumento de la expresión y secreción por parte de los osteoblastos de diversas citoquinas proinflamatorias, entre ellas el factor de necrosis tumoral alfa (TNF-α). Aunque varios estudios han establecido la importancia de la activación osteoclástica por TNF-α, aún no se conoce el papel de esta citoquina sobre los osteoblastos en el desarrollo de la pérdida ósea que se produce en la posmenopausia. Por otro lado, estudios in vitro con osteoblastos de origen murino han demostrado un aumento de la apoptosis celular en respuesta a TNF-α.
Aunque aún no se conocen los mecanismos moleculares implicados en la apoptosis de los osteoblastos humanos, una posible vía podría ser la de Fas/FasL. Se ha descrito que en osteoblastos la señalización a través de Fas induce la apoptosis de estas células y que la sensibilidad mediada por Fas a la apoptosis en varios tipos celulares está modulada por citoquinas.
El objetivo del presente trabajo ha sido estudiar el efecto del TNF-α en la apoptosis mediada por Fas en dos tipos de células osteoblásticas: la línea celular osteoblástica humana MG-63 y en osteoblastos humanos procedentes de cultivo primario.
MATERIAL Y MÉTODOS
CULTIVO CELULAR
La línea celular osteoblástica MG-63 y los osteoblastos humanos procedentes de muestras de hueso normal de mujeres posmenopáusicas que no padecían ninguna enfermedad o tratamiento que pudiera afectar al metabolismo del hueso y cuya edad no sobrepasaba los 70 años, fueron utilizados como estirpes celulares en el presente estudio. La técnica utilizada en el cultivo primario de osteoblastos es la descrita por Nacher M et al (REEMO 1993;2:3-8). En breve el hueso trabecular se corta en pequeños fragmentos de 1-2 mm que se colocan sobre una malla de nylon de 80 μm de tamaño de poro, la cual se apoya sobre dos anillas de vidrio. La malla con los explantes se coloca en una placa Petri con medio de cultivo Dulbecco's Modified Eagle Medium (DMEM) (Gibco, Grand Island, NY) suplementado con el 20% de suero bovino fetal (FBS) (Biological Industries, Kibbutz, Beth Haemek, Israel). Aproximadamente una semana después, los osteoblastos empiezan a crecer sobre la malla a partir de los explantes. Las mallas se cubren de células en aproximadamente 3-4 semanas y pasado este tiempo las células se tripsinizan y se subcultivan usando tripsina a una concentración del 0,25% (Biological Industries). Los osteoblastos se caracterizan mediante la determinación de la actividad fosfatasa alcalina y de la síntesis de osteocalcina en respuesta a la estimulación con 1,25 (OH)2D3 (Roche, Basel, Suiza). Todos los experimentos se llevaron a cabo con células subcultivadas entre el segundo y el quinto pase.
INDUCCION DE APOPTOSIS MEDIADA POR Fas EN OSTEOBLASTOS HUMANOS
Se estudió la apoptosis inducida por anti-Fas (CH-11) en osteoblastos humanos procedentes de cultivo primario y en MG-63. Las células se cultivaron en placas de 12 pocillos a una densidad celular de 40.000 células/pocillo en ausencia de suero y con/sin TNF-α (200 U/ml) durante 48 h. Transcurrido ese tiempo, algunos pocillos se estimularon con CH-11 a una concentración de 1.000 ng/ml durante 24 h más. La muerte celular por apoptosis así provocada se cuantificó mediante citometría de flujo de células permeabilizadas y teñidas con yoduro de propidio.
CUANTIFICACION DE LA APOPTOSIS EN OSTEOBLASTOS HUMANOS POR CITOMETRIA DE FLUJO
Se recogieron todas las células contenidas en el sobrenadante y las células adherentes se despegaron con tripsina-EDTA (200 mg/l de EDTA, 500 mg/l de tripsina 1:250) (Bio-Whittaker). Para la citometría de flujo se tiñeron con 100 μg/ml de yoduro de propidio, 10 μg/ml de Rnasa A (Sigma-Aldrich, San Luis, Misuri, EE.UU.), un 0,05% de NP-40 en PBS a 4 °C durante 1 hora. A continuación las muestras fueron pasadas por el citómetro de flujo (Coulter, EE.UU.). Mediante el empleo del programa LYSIS II se calculó el porcentaje de células con menor contenido de ADN (fracción A0), que se corresponde con las células apoptóticas con el núcleo fragmentado. Los restos celulares fueron excluidos ajustando los parámetros de tamaño y complejidad.
ESTUDIO ESTADISTICO
El estudio se realizó en el cultivo primario de 6 líneas de osteoblastos procedentes de 6 mujeres posmenopáusicas diferentes. Cada punto individual del estudio se realizó por sextuplicado. Se utilizó el test no paramétrico de Mann-Whitney para la comparación de las variables entre los diferentes grupos (MedCalc Software, Bélgica).
RESULTADOS
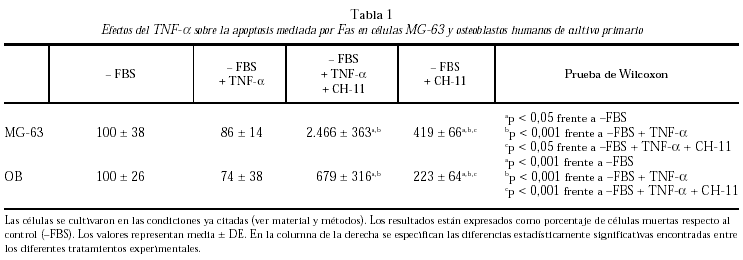
Los resultados obtenidos en este estudio se muestran en la tabla 1.
En primer lugar, al deprivar las células de suero fetal (el suero contiene factores de superviviencia para diversos tipos celulares) no se observó un aumento significativo de la apoptosis en ninguno de los tipos celulares utilizados en este estudio. Además, nuestros resultados demuestran que la incubación de los osteoblastos y las células MG-63 con TNF-α en ausencia de CH-11 no indujo apoptosis celular en los cultivos.
A continuación, estudiamos la apoptosis mediada por Fas en células MG-63 y osteoblastos procedentes de cultivo primario inducida por CH-11. El tratamiento de ambos tipos de células con CH-11, que produce una activación del receptor de Fas a partir del cual se desencadena toda la cascada apoptótica, aumentó significativamente el número de células apoptóticas; este aumento fue mayor en las MG-63 (419 ± 66%) que en los osteoblastos de cultivo primario (223 ± 64%).
Cuando las células fueron pretratadas con TNF-α antes de añadir CH-11 se observó un aumento significativo de la muerte celular por apoptosis. Este aumento fue mucho mayor que el observado tras el tratamiento de las células sólo con CH-11. El orden de magnitud de este aumento fue mayor en las células MG-63 que en los osteoblastos humanos en cultivo primario.
COMENTARIOS FINALES
En el presente trabajo hemos estudiado los efectos del TNF-α sobre la apoptosis en osteoblastos humanos. Aunque algunos autores han descrito que el TNF-α induce apoptosis en osteoblastos, nosotros no hemos observado este hecho en nuestros modelos celulares (MG-63 y osteoblastos humanos procedentes de cultivo primario). Esta discrepancia en los resultados podría explicarse por diferencias entre especies.
En cuanto a los efectos del TNF-α sobre la apoptosis mediada por Fas en osteoblastos, aunque el TNF-α no induce directamente apoptosis de estas células, el tratamiento de éstas con TNF-α aumentó significativamente la sensibilidad de las células a la apoptosis al añadir CH-11 a los cultivos.