Se trata de un paciente de 73 años que consulta por dolor costal bilateral y centrotorácico de características mecánicas, desde hace 4 meses.
Entre sus antecedentes personales destacan: hipertensión arterial de larga evolución en tratamiento médico, carcinoma urotelial con resección transuretral en abril de 1998, fibrilación auricular embolígena con infartos esplénicos y cerebrales en 1998 con leve ataxia y dismetría residual y en tratamiento con anticoagulantes orales.
Hace 4 meses, el paciente tuvo un cuadro respiratorio diagnosticado de bronquitis y desde entonces presenta dolor centrotorácico y en ambos costados, que aumenta con los movimientos y no ha cedido con antiinflamatorios. Refiere además astenia progresiva desde hace 2 meses, acompañada de anorexia y epigastralgia. Se le realizó una gammagrafía ósea que mostraba imágenes de depósito sólo en parrilla costal lateral y región dorsal baja, compatible con patología ostearticular.
En la exploración el paciente se encontraba consciente y orientado con una tensión arterial (TA) de 140/70, pulso a 60 lpm, afebril, con palidez de piel y mucosa, eupneico y sin adenopatías. Auscultación cardíaca arrítmica sin soplos. La auscultación pulmonar mostraba murmullo vesicular conservado. No presentaba dolor a la presión en parrilla costal. En el abdomen presentaba hepatomegalia blanda, no dolorosa de 2 cm en el lóbulo hepático izquierdo. Sin edemas ni signos de flebitis. Tacto rectal: heces de características normales.
La analítica nos dio los siguientes resultados: hemoglobina (Hb) de 9,4 g/dl, volumen corpuscular medio (VCM) de 84,7 FL, leucocitos y plaquetas normales, velocidad de sedimentación globular (VSG) de 54/86. Bioquímica: creatinina de 5,1 mg/dl, aclaramiento de creatinina 12 ml/min, calcio de 9,8 mg/dl, fosfatasa alcalina de 90 U/I. Frotis sanguíneo: moderada aniso-poiquilocitosis dominantemente normocítica y normocrónica. Reticulocitos 0,7%. Estudio de hierro: sideremia de 36 μg/dl, ferritina 717 ng/ml, datos compatibles con anemia de trastornos crónicos. Sangre oculta en heces negativa. Radiografía de tórax: ligero aumento de índice cardiotorácico, imágenes costopleurales bilaterales compatibles con callo de fractura. El electrocardiograma reflejaba bradicardia sinusal. Endoscopia digestiva alta: mínima herenia de hiato sin repercusión y ligera gastropatía antral. Ecografía abdominal: posible imagen en lóbulo hepático izquierdo compatible con hidatidosis hepática. Proteinuria de 311 mg/dl. Espectro electroforético: albúmina de 3,1 g/dl, gammaglobulina de 0,8 U con una débil banda en zona gamma. Inmunoelectroforesis en orina: Bence-Jones tipo Lambda (8,08 g/24 horas), cadenas ligeras libres. Beta 2 microglobulina de 17,68 μg/ml.
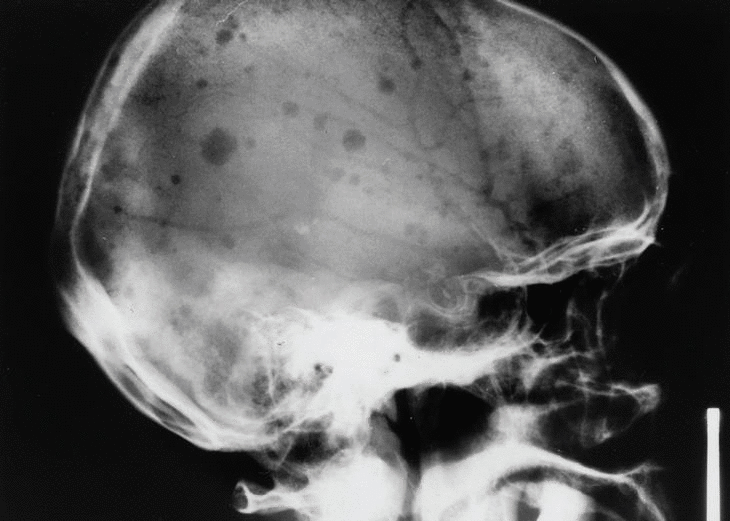
Punción esternal: plasmocitosis difusa con buena celularidad global. Inmunofenotipo de médula ósea: claro predominio de células plasmáticas de población CD 56 positivos, todo ello compatible con mieloma múltiple. Serie ósea: dudosa afectación de D12, imágenes osteolíticas en cráneo (fig. 1).
Fig. 1
De acuerdo con el Servicio de Hematología se comenzó con tratamiento quimioterápico con buena tolerancia, siendo su analítica en el momento del alta: creatinina 3,8 mg/dl, hemoglobina de 9,8 g/dl.
COMENTARIOS
El mieloma múltiple representa una proliferación maligna de células plasmáticas, justifica el 1% de los tumores malignos en la raza blanca y el 2% en la raza negra, y el 13% y 33% respectivamente de todos los cánceres hematológicos1. Su incidencia aumenta con la edad, estableciéndose el diagnóstico a una edad media de 65 años; es raro en personas menores de 40 años aunque hay casos descritos en jóvenes3. La incidencia anual se aproxima a 4 casos por cada 100.000 personas y es algo más frecuente en varones. El dolor óseo es el síntoma más frecuente y aparece en casi el 70% de los casos. Nuestro paciente presenta la tríada clásica del mieloma: plasmocitosis medular (> 10%), lesiones osteolíticas y un componente M en suero y orina. Son características también la insuficiencia renal, presente en un 25% de los pacientes, y una anemia normocítica y normocrónica que aparece en alrededor del 80% de los casos, con aumento de la velocidad de sedimentación globular.
Las radiografías óseas y de tórax pueden revelar lesiones osteolíticas, afectando predominantemente al esqueleto axial, siendo el cráneo el lugar anatómico más frecuentemente afectado (54%), seguido de pelvis (46%) y fémur (42%). Recientes estudios revelan que la radiografía simple es superior a la resonancia magnética (RM) en la detección de afectación ósea por el mieloma (87,5% frente a 79% de los pacientes), aunque la RM es superior detectando lesiones en columna y pelvis (76% frente a 42%)4, esta última podría ser útil en pacientes con dolor óseo sin alteraciones en la radiografía convencional, o bien poseer valor pronóstico, determinando que sea más probable que progresen en pacientes con baja masa celular tumoral5. Las lesiones típicas son puramente osteolíticas y, en general, la destrucción ósea aparece en forma de focos bien circunscritos, constituyendo las denominadas geodas o lesiones en «sacabocados», con escasa o nula reacción esclerosa circundante. El diagnóstico diferencial (tabla 1)6 debe establecerse con las metástasis óseas de neoplasias sólidas, enfermedades inflamatorias, etc.
Además de lesiones líticas, la mayoría de los pacientes con mieloma múltiple tienen pérdida de masa ósea difusa y algunos presentan fracturas vertebrales; además, hasta el 30% presentan fracturas no vertebrales7 y el 20%-30% se presentan con hipercalcemia.
La gammagrafía ósea es una prueba importante para el diagnóstico de metástasis esqueléticas por varias neoplasias malignas, incluidos el cáncer de próstata, mama o tiroides. El papel de ésta en la detección de lesiones óseas secundarias a mieloma ha sido evaluado en varios estudios, concluyendo en el ya conocido pobre valor diagnóstico8,9, debido a que los agentes utilizados no se concentran bien en las lesiones frecuentemente osteolíticas del mieloma, que generalmente muestra resorción ósea activa con relativamente poca formación ósea. Para mejorar esta técnica, recientes estudios sugieren la combinación de 201TI y gammagrafía10, debido a que el 201TI se concentra en los tumores osteolíticos, mediado probablemente por el incremento de flujo sanguíneo y del metabolismo tumoral.
La resorción ósea está aumentada debido al incremento en el número y actividad de los osteoclastos. La estimulación de la actividad osteoclástica por células del mieloma adyacentes se cree debida a la producción de citocinas. Varios estudios han implicado interleucina 1β (IL-1β), lifotoxina, factor de necrosis tumoral (TNF), interleucina 6 (IL-6), factor estimulante de colonias macrofágico (MCSF), factor de crecimiento hepatocitario (HGF)11-13. El HGF es producido por las células del mieloma en cultivo, induce la secreción de interleucina 11 por los osteoblastos y puede entonces estimular la osteoclastogénesis; este efecto puede estar potenciado por TNF, IL-1 y TGF. Algunos pacientes también poseen niveles elevados del receptor soluble de IL-6. En la mayoría de los tumores con lesiones osteolíticas, el aumento de resorción ósea intenta ser compensado por un aumento en la formación ósea, observándose un aumento de marcadores de metabolismo óseo, tanto de formación como de resorción. Sin embargo, en el mieloma múltiple, debido a los mecanismos comentados, puede existir un aumento exclusivo de resorción ósea sin incremento de la formación, por lo que los niveles de fosfatasa alcalina sérica total, como ocurre en este caso, pueden ser normales14-17.
La presencia de dolor óseo y fracturas se correlaciona positivamente con concentraciones aumentadas de región telopeptídica carboxiterminal (ICTP) del colágeno tipo I y fosfatosa alcalina ósea (BAP). Estos marcadores bioquímicos podrían ser útiles en monitorizar la enfermedad ósea del mieloma, y por ello también la dosis de tratamiento con bifosfanatos, ya que el inhibir éstos la resorción ósea disminuirían la progresión de la enfermedad.
Varios datos influyen en el pronóstico de esta enfermedad, tales como la hemoglobina, el calcio, el componente M, la cuantificación de β2 microglobulina sérica, los niveles de IL-6, el isótopo de cadenas ligeras (siendo la supervivencia más breve en los pacientes que secretan cadenas lambda) y el grado de afectación esquelético18,19.
FE DE ERRATAS
En el trabajo titulado "Hiperparatiroidismo subclínico: ¿arte o parte de un dilema clínico, social y económico?", publicado en el número 3 de esta Revista, correspondiente al mes de mayo (REEMO 2001; 10(3): 79-80) aparece un error que a continuación resolvemos.
El mencionado trabajo está firmado por F. Escobar-Jiménez y M. Muñoz Torres, cuando en realidad sólo tenía que haber un firmante, que es F. Escobar-Jiménez.