Se presenta el caso de unpaciente varón de 76 años de edad con los siguientesantecedentes personales: ex-fumador de dos paquetes de cigarrillosal día durante 20 años, carcinoma epidermoide delaringe tratado con laringuectomía parcialsupraglótica y radioterapia hace 30 años, enfermedadpulmonar obstructiva crónica (EPOC) desde hace 7años, adenocarcinoma de próstata, estadio D1 tratadocon hormonoterapia (acetato de ciproterona), sin evidencia demetástasis óseas ni viscerales.
Hace 3 años consulta pordolor lumbar de características mecánicas, sinirradiación y que no cedía con antiinflamatorios noesteroideos. A la exploración el paciente presentaba dolor ala palpación en columna lumbar y disminuciónantiálgica de la movilidad. Las pruebas complementariasmostraban una fosfatasa alcalina de 144UI, fosfatasa ácidatotal de 65,8UI y fosfatasa ácida prostática de0,74UI. Se realizaron radiografías de columna dorsal ylumbar, pelvis y sacro que mostraron múltiplesimágenes osteocondensantes a nivel del sacro, pelvis ycolumna lumbar. En la gammagrafía ósea se encontraronmúltiples áreas de captación sugestivas demetástasis en columna dorsolumbar y costalesderechas.
Se estableció eldiagnóstico de metástasis osteoblásticas decarcinoma de próstata, pasando el paciente al estadio D2 dela clasificación de Whitmore-Jewett. El paciente fue tratadocon terapia isotópica con inyección por víaintravenosa de estroncio 89. Tres años después elpaciente está asintomático y con un grado funcionalaceptable.
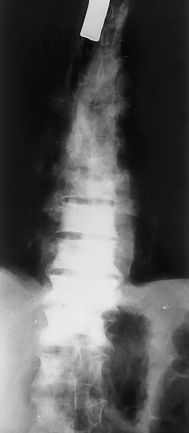
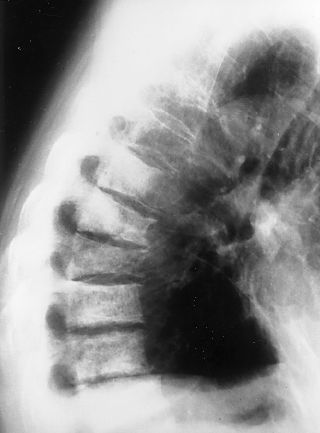
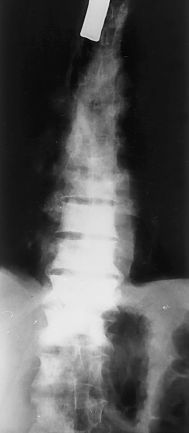
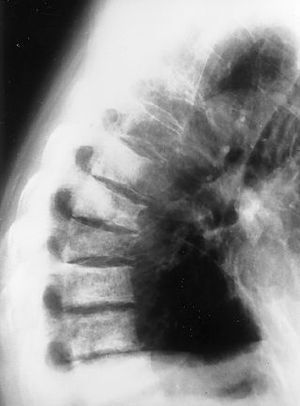
Las imágenes quepresentamos son de esa revisión a los 3 años. Setrata de radiografías anteroposterior (AP) y lateral decolumna dorsolumbar donde vemos imágenes de aumento dedensidad en varios cuerpos vertebrales dorsolumbares (lesionesosteoblásticas), con aplastamientos vertebrales y signosdegenerativos. En la placa AP se observa tambiéncánula de traqueotomía (figs. 1 y 2).
Figura1.
Figura2.
Ante estas imágenesosteoblásticas nos planteamos el siguientediagnóstico diferencial: lo más frecuente son lasmetástasis de carcinoma de próstata, le siguen enfrecuencia metástasis de otras neoplasias malignas. Las quetienen mayor tendencia a producir imágenes osteocondensantesson: tumor carcinoide bronquial, tumor de vejiga conafectación prostática, carcinoma nasofaríngeo,carcinoma de estómago, carcinoma de mama radiado,neuroblastoma y meduloblastoma. También pueden darimágenes osteoblásticas el linfoma, el cordoma y elmieloma de células plasmáticas. Entre laspatologías no tumorales encontramos la osteomielitis,mastocitosis, esclerosis tuberosa, mielofibrosis, enfermedad dePaget, osteodistrofia renal, fracturas por compresión ysarcoidosis1.
COMENTARIO
El adenocarcinoma depróstata es el tumor maligno más frecuente del tractogenitourinario masculino y el segundo en frecuencia generaldespués del pulmonar. La relación de factoresgenéticos, ambientales e infecciosos que intervienen en suetiopatogenia no ha quedado suficientemente establecida.
La hormonodependencia delcáncer de próstata parece indicar el papel de losandrógenos en su etiología o patogenia.
El adenocarcinomaprostático puede diseminarse por tres vías: laextensión directa, la vía linfática y eltorrente sanguíneo. Las metástasis hematógenassuelen ser con más frecuencia óseas (pelvis,vértebras lumbares, vértebras torácicas,costillas por orden de frecuencia) que viscerales. Lasmetástasis suelen tener componentes osteoblásticos yosteolíticos. La serie ósea con radiologíasimple tiene baja sensibilidad en su detección, siendo lagammagrafía mucho más sensible aunque suespecificidad no es muy alta, ya que podemos encontrar falsospositivos en fracturas en consolidación, osteoartritis,enfermedad de Paget y otros2.
La frecuencia demetástasis óseas en el cáncer depróstata es altísima. Harada encuentra en 137 casosde necropsias con adenocarcinoma de próstatahistológicamente comprobado, que la frecuencia demetástasis óseas es del 81%, casi tan alta como la deadenopatías tumorales, que en este estudio fue del82%3. Además la correlación entre lapresencia de metástasis óseas y adenopatíasfue estadísticamente significativa, lo que sugiere que lasadenopatías podrían estar implicadas en la llegadadel tumor al hueso.
Son varios los autores que hanintentado explicar por qué el cáncer depróstata metastatiza con tanta frecuencia al hueso, y hanutilizado para ello un modelo experimental: el tumor depróstata R3327 MatLyLu, aplicado en ratas macho deCopenhague4. Estos ensayos sugieren fuertemente que elplexo venoso vertebral o plexo de Batson podría ser lavía de extensión del cáncer de próstataa la columna lumbar5. De ellos se derivan datos quealgún día pueden ser aplicables a pacientes, como lafase de hipercalcemia transitoria que detectaGeldof4.
Otro estudio que compara ladistribución de metástasis óseas en 55pacientes con cáncer de próstata y 55 pacientes concáncer de mama llegaba a la misma conclusión: lafrecuencia de metástasis óseas en el cáncer depróstata se explica por la extensión a travésdel plexo venoso de Batson6.
Rana en 1993 estudia lasupervivencia en 169 pacientes con cáncer de próstatay metástasis óseas y la relaciona con la cargametastásica, cuya unidad define como la mitad delárea equivalente a un cuerpo vertebral. Encuentra mayormortalidad cuanto mayor es la cargametastásica7.
En cuanto al tratamiento, seestá empezando a emplear la terapia intravenosa conestroncio 89 (SR 89). Se están realizando múltiplesestudios que demuestran su tolerancia y eficacia a largoplazo8.
Las conclusiones que podemosextraer son que el plexo venoso de Batson está implicadodirectamente en la extensión del tumor al hueso, que lacarga metastásica tiene importancia en el pronósticoy que la terapia con SR 89 por vía intravenosa podríaconvertirse en el tratamiento de elección en estospacientes.