INTRODUCCIÓN
El hueso es un tejido dinámico sometido a un continuo proceso de formación, llevado a cabo por las células osteoblásticas, y a un proceso de resorción llevado a cabo por los osteoclastos. En la vida adulta existe un equilibrio entre estas dos actividades, que es lo que se denomina acoplamiento1. Hasta fechas recientes se pensaba que la proliferación de osteoblastos y osteoclastos y la actividad formadora y resortiva eran los factores fundamentales implicados en el mantenimiento de la masa ósea. Sin embargo, recientemente se ha introducido en el esquema regulador un cuarto elemento: la longitud de la vida de las células óseas, su mayor o menor grado de supervivencia2. Se ha llegado así al concepto de que la apoptosis o muerte celular programada tiene también un papel fundamental en el mantenimiento de la masa ósea.
Está universalmente aceptado el hecho de que el descenso de los niveles de estrógenos tras la menopausia conduce a una disminución de la masa del hueso3 debido a un desequilibrio en el remodelado óseo: aumento de resorción sobre la formación. Sin embargo, es posible que la falta de estradiol (E) pueda tener también algún efecto sobre la apoptosis de los osteoblastos. El tratamiento hormonal sustitutivo ha tratado de paliar o corregir la aparición de la osteoporosis postmenopáusica, y han surgido también un gran número de fármacos alternativos con propiedades antirresortivas, como son los moduladores selectivos de los receptores estrogénicos o SERM, entre los que se encuentra el raloxifeno, producto que ejerciendo las mismas acciones positivas que el E sobre la masa ósea, no presenta los efectos secundarios negativos de este compuesto sobre la mama o el útero4. A pesar de que un gran número de ensayos clínicos bien diseñados muestran sin lugar a dudas el efecto positivo del tratamiento hormonal sustitutivo5 y el raloxifeno6 sobre la pérdida de masa ósea en la osteoporosis postmenopaúsica, los mecanismos de acción de estradiol y de raloxifeno sobre las células óseas no se conocen en su totalidad.
Uno de los principales mecanismos de inducción de apoptosis tiene lugar a través de la activación de los receptores de muerte de la membrana celular como Fas7. Resultados previos obtenidos en nuestro laboratorio demuestran que la activación del receptor de Fas induce apoptosis en osteoblastos procedentes del cultivo primario y en MG-63. Por lo tanto, es posible que el sistema Fas-Fas Ligando (Fas-FasL) pueda desempeñar algún papel en el mantenimiento de la masa ósea a través de la regulación de la apoptosis de los osteoblastos y que el estradiol o el raloxifeno desempeñe también algún papel fisiológico en dicho mantenimiento.
El microambiente celular modula la muerte celular programada. En este punto es importante reseñar que existe un gran número de evidencias que sugieren que el descenso en la función ovárica con la menopausia está asociado con un incremento espontáneo de las citoquinas proinflamatorias8. Sin embargo, el mecanismo exacto por el que los estrógenos interfieren con la actividad de las citoquinas no se conoce actualmente, pero podría incluir potenciales interacciones con la apoptosis de las células óseas.
El propósito de este trabajo ha sido estudiar los posibles efectos del 17beta-estradiol y del raloxifeno sobre los niveles de expresión de ARNm y de proteína de membrana Fas tras estimulación con factor de necrosis tumoral (TNF)-α, en células MG-63 y en osteoblastos procedentes de un cultivo primario de hueso trabecular de mujeres postmenopáusicas sanas.
MATERIALES Y MÉTODOS
CULTIVO CELULAR
La línea celular osteoblástica MG-63 y los osteoblastos humanos procedentes de muestras de hueso normal de mujeres postmenopáusicas que no padecían ninguna enfermedad o tratamiento que pudiera afectar al metabolismo del hueso, y cuya edad no sobrepasaba los 70 años, fueron utilizadas como estirpes celulares en el presente estudio. La técnica utilizada en el cultivo primario de osteoblastos es la descrita por Marie et al9 con algunas modificaciones10. Los osteoblastos se caracterizaron mediante la determinación de la actividad fosfatasa alcalina y de la síntesis de osteocalcina en respuesta a la estimulación con 1,25 (OH)2D3 (Roche, Basel, Suiza). Todos los experimentos se llevaron a cabo con células subcultivadas entre el segundo y el quinto pase.
ANALISIS MEDIANTE CITOMETRIA DE FLUJO DE LA EXPRESION DE FAS
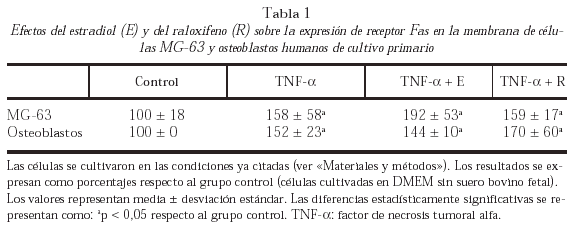
Para estudiar la expresión de Fas en la membrana celular de células MG-63 y osteoblastos procedentes de cultivo primario, las células se despegaron de la placa con EDTA 2mM tras el cultivo en presencia de TNF-α (200 U/ml) o TNF-α (200U/ml) más estradiol E (108 M) o raloxifeno R (108 M) durante 48 horas. Las células se incubaron durante 30 minutos a 4 oC con 20 μg/ml de anticuerpo anti-Fas CH-11 (Upstate Biotecnology, Lake Placid, NY, EE.UU.) o con 20 μg/ml de IgM control seguido por una incubación durante 30 minutos a 4 oC con un anticuerpo secundario conjugado con FITC (1:100) (Pharmigen, San Diego, CA). Las medias de fluorescencia celular se calcularon usando un software específico (LYSIS). Un experimento paralelo en las mismas condiciones se realizó con células deprivadas, sin añadir TNF-α ni E ni R, para ser utilizado como control.
RT-PCR DE FAS
El ARN total se aisló de las células MG-63 y de los osteoblastos humanos procedentes de cultivo primario mediante el reactivo Trizol Reagent (Life Technologies, Grand Island, NY, EE.UU.). El ARNm de Fas se detectó mediante RT-PCR semicuantitativa. El ARN se aisló y se cuantificó tras horas de incubación con TNF-α (200 U/ml) o TNF-α (200 U/ml) más E o R (108 M). Fueron usados 100 ng de ARN en la RT-PCR. Los primers (Life Technologies, Grand Island, NY, EE.UU.) utilizados fueron: Fas (sense): CAATGGGGATGAACCAGACTGC, Fas (antisense): GGCAAAAGAAGAAGACAAAGCC. El tamaño del producto de la PCR es de 324 pares de bases y la temperatura de annealing 62 oC. Un experimento paralelo en las mismas condiciones se realizó con células deprivadas, sin añadir TNF-α ni E ni R, para ser utilizado como control.
ESTUDIO ESTADISTICO
Se utilizó la prueba no parámetrica de Wilcoxon para la comparación de las variables entre los diferentes grupos (MedCalc Software, Bélgica).
RESULTADOS
EXPRESION DE RECEPTOR FAS EN LA MEMBRANA CELULAR
La expresión de receptor de Fas en la membrana celular de MG-63 y de osteoblastos humanos procedentes de cultivo primario se analizó mediante citometría de flujo. La expresión de receptor de Fas en membrana aumentó significativamente en las células pretratadas con TNF-α con respecto a las células no tratadas, tanto en células MG-63 como en osteoblastos humanos. La adición al cultivo de E o rRno modificó significativamente el aumento de la expresión de Fas inducida por TNF-α (tabla 1).
EXPRESION DE ARNm DE FAS
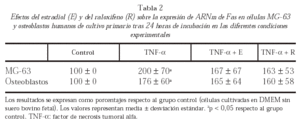
Los niveles de ARNm de Fas en MG-63 y osteoblastos humanos procedentes de cultivo primario se determinaron mediante RT-PCR (tabla 2).
La expresión de ARNm de Fas en MG-63 aumentó significativamente en células pretratadas con TNF-α tras 24 h de incubación respecto a células no tratadas. Ni E ni R modificaron el efecto producido por el TNF-α.
En osteoblastos humanos procedentes de cultivo primario se observó el mismo efecto.
COMENTARIOS FINALES
En este trabajo hemos estudiado la expresión de ARNm y de la proteína Fas en presencia o ausencia de TNF-α en cultivos primarios de osteoblastos humanos de mujeres postmenopáusicas y en la línea celular osteoblástica MG-63.
Los osteoblastos humanos procedentes de mujeres postmenopáusicas y las células MG-63 expresan receptores de Fas. El TNF-α aumentó la expresión de Fas, tanto a nivel de proteína como a nivel de ARNm. Ni E ni el R, a las concentraciones terapéuticas utilizadas en este estudio, tuvieron ningún efecto sobre el incremento de la expresión de Fas inducida por TNF-α.