INTRODUCCIÓN
El tejido óseo tiene diversas funciones metabólicas y mecánicas. El remodelado óseo es un proceso vital que ocurre durante toda la etapa del crecimiento y de la vida adulta. La homeostasis del tejido óseo depende del balance equilibrado entre formación y resorción ósea. El desequilibrio origina un amplio espectro de patologías óseas, desde una disminución de la masa ósea (por ejemplo, osteoporosis), a diferentes alteraciones genéticas que favorecen un incremento exagerado en la masa ósea (por ejemplo, esclerostosis).
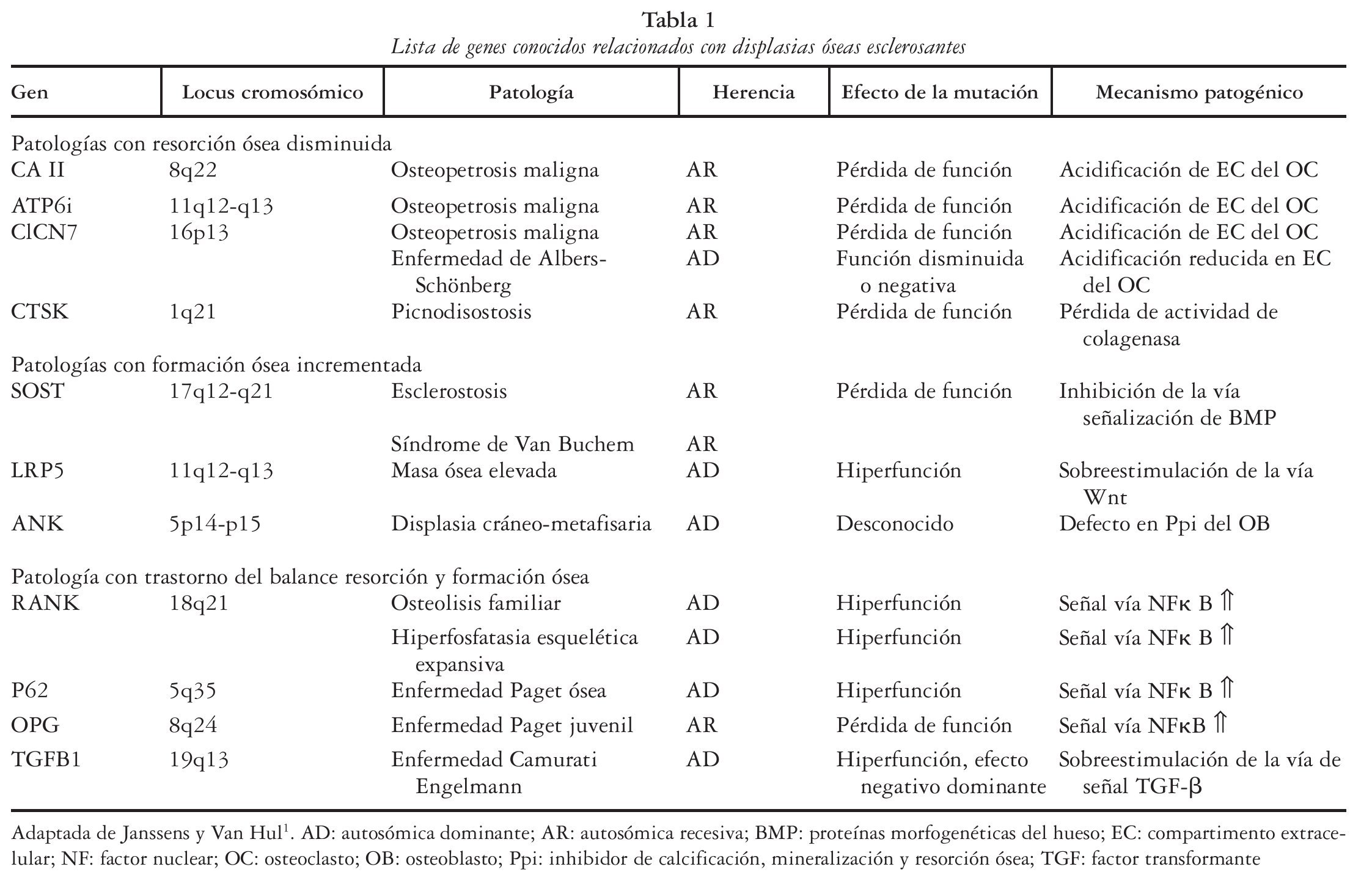
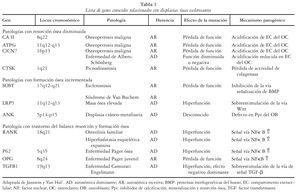
Se han descrito tres mecanismos patogénicos diferentes que dan lugar a patologías con alteración de la densidad ósea1 (tabla 1): el incremento de la formación ósea (esclerostosis, síndrome de Van Buchem, etc.), la resorción ósea reducida (osteopetrosis, picnodisostosis, etc.) y la alteración del balance entre resorción y formación (Paget juvenil, enfermedad de Camurati-Engelman, etc.). Los factores genéticos desempeñan un papel clave en la determinación de la densidad mineral ósea (DMO), tanto en el pico de masa ósea como en la pérdida de masa ósea relacionada con la edad, y probablemente la relacionada con diversos fármacos o situaciones osteopenizantes. Recientes estudios sugieren incluso el control genético sobre aspectos cualitativos óseos2, estableciendo una firme conexión entre masa ósea y mutaciones del co-receptor de la vía de señalización Wnt (proteína relacionada con LDL, LRP5) o mutaciones del antagonista de Wnt (SOST o esclerostina); a su vez, los avances en genética molecular en ratones han permitido confirmar la importancia crítica de la vía de señalización Wnt en el metabolismo óseo y en la enfermedad ósea3.
REGULACIÓN DE LA MASA ÓSEA Y LA VÍA DE SEÑALIZACIÓN Wnt
SISTEMA Wnt
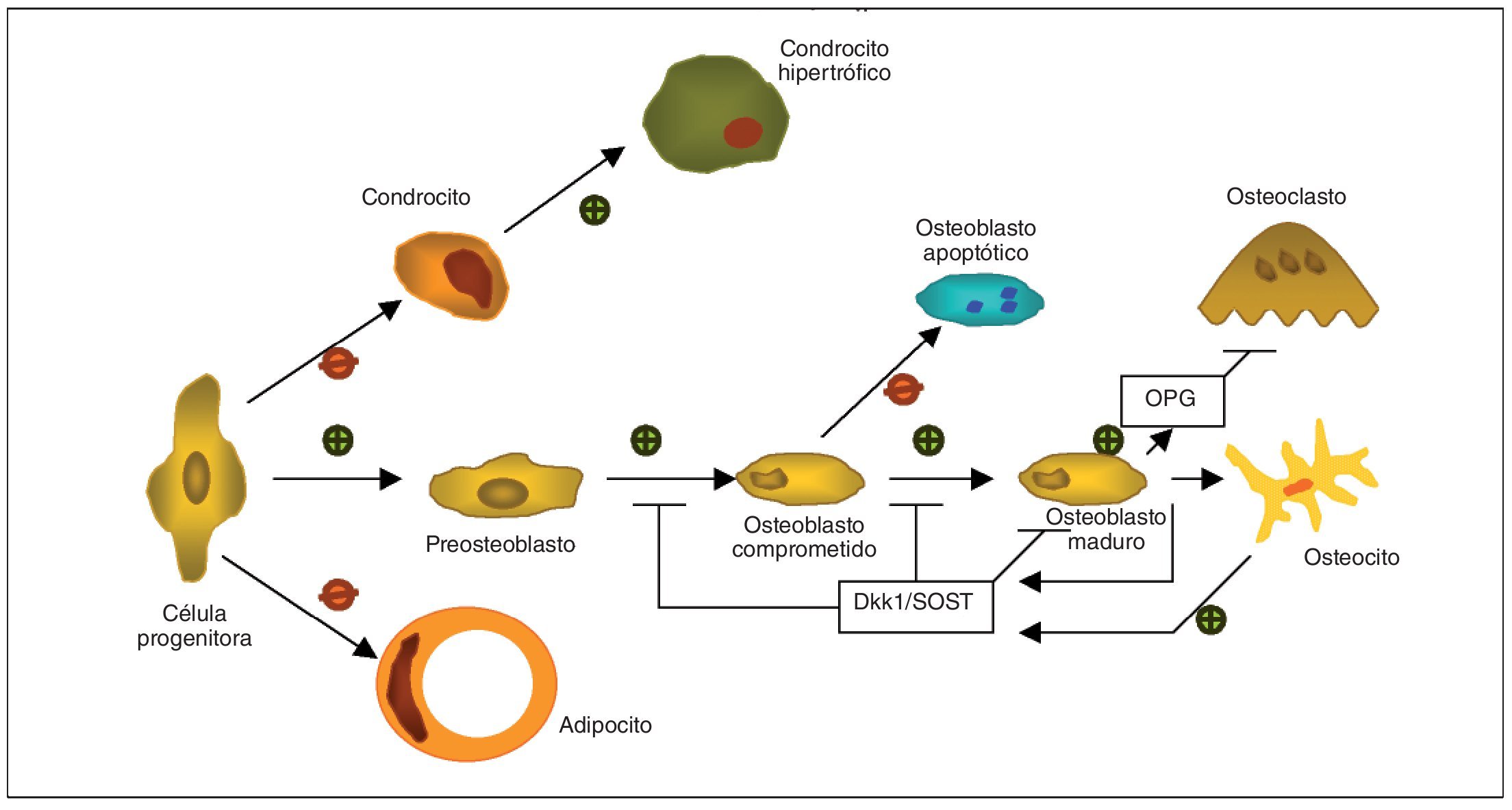
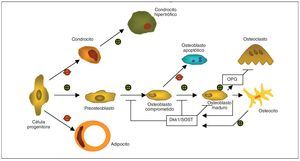
El remodelado óseo es un proceso controlado que implica a una compleja red de factores conectados entre sí3,4 (tabla 2). La vía de señalización Wnt consiste en toda una serie de proteínas secretadas que regulan diferentes procesos celulares que incluyen aspectos relevantes del metabolismo óseo5 (fig. 1). Esta familia de proteínas forma una red de señales intracelulares que funciona en combinación con otros factores como son las proteínas morfogenéticas del hueso (BMP), que afectan a la formación ósea. Las BMP precisan de un correcto funcionamiento del resto de componentes de la vía Wnt y viceversa, por lo que de este modo la estimulación del osteoblasto formador de hueso ocurre a modo de un proceso que interrelaciona ambos componentes.
Fig. 1.Adaptada de Baron y Rawadi3. Papel de la vía canónica de señalización Wnt como regulador de la formación y resorción ósea, que favorece la línea celular del osteoblasto mediante el control de la proliferación, diferenciación y maduración del osteocito, mientras que inhibe la diferenciación del adipocito o del condrocito desde la célula progenitora. Los osteocitos son capaces de producir Dkk1 y SOST, que ejercen un feedback negativo sobre la diferenciación y función del osteoblasto. La vía de señalización Wnt también induce en osteoblastos la producción de osteoprotegerina (OPG), incrementando la ratio OPG/RANKL para reducir la diferenciación del osteoclasto y la resorción ósea.
Las proteínas secretadas por la vía Wnt activan tres vías intracelulares: beta-catenina (vía canónica), calcio (Ca2+) y la vía de polaridad celular planar. La primera es la dominante en la regulación de la diferenciación del osteoblasto, mediante la interacción de beta-catenina con los factores de transcripción del núcleo como el factor derivado de células-T (TCF) y el factor de unión al potenciador linfoide (lymphoid enhancer-binding factor o LEF).
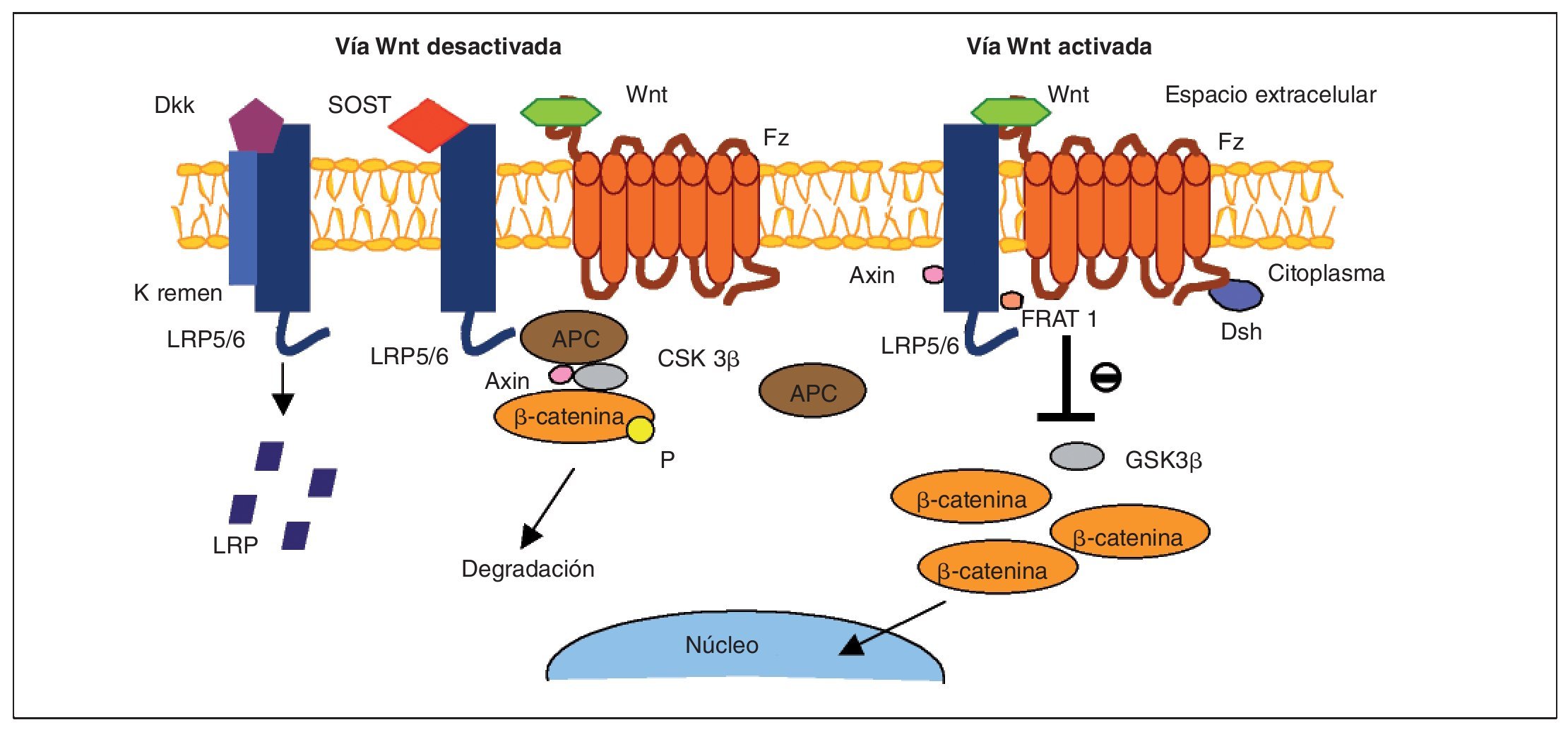
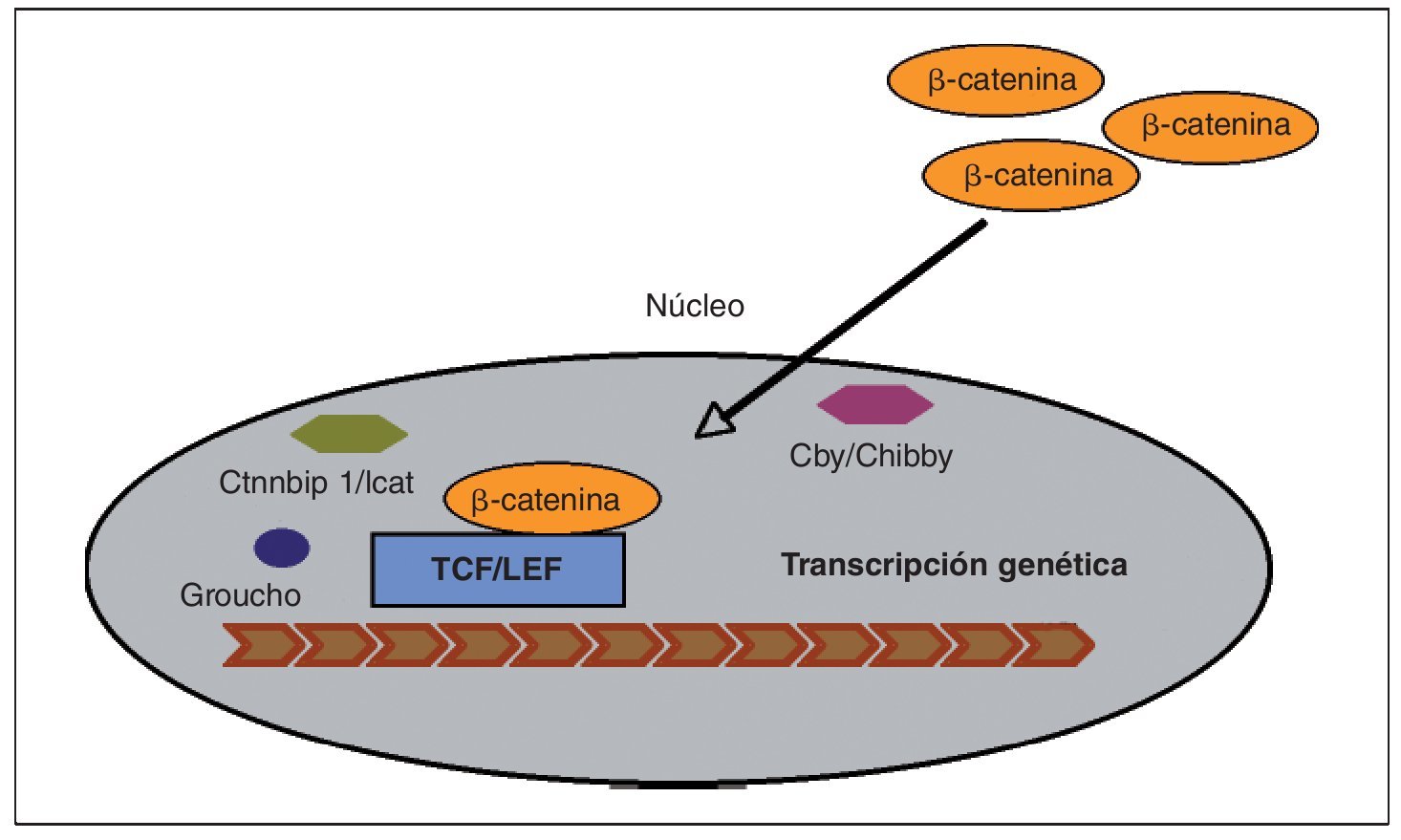
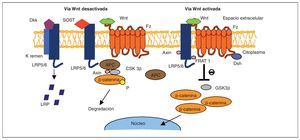
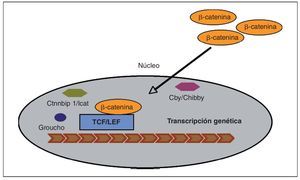
En las células que expresan de forma apropiada los receptores y los componentes intracelulares correctos, la cascada de señales Wnt es puesta en marcha por el acoplamiento de toda una familia de proteínas Wnt al complejo co-receptor de la membrana celular, consistente en un receptor frizzled (Fz) y en una proteína relacionada con el receptor LDL (LRP5/6)3 (fig. 2). La señal se transmite a través del reclutamiento de diversas proteínas intracelulares al terminal-C intracelular de Fz o a la porción intracelular del complejo co-receptor. En este punto, otra proteína Wnt denominada Dishevelled (Dsh) es reclutada y modificada tras su unión al receptor Fz, al igual que ocurre con otros factores intracelulares: Axin y Frat-1, que se unen al receptor LRP5/6. Dependiendo del tipo de unión de Wnt al receptor Fz unido a LRP5/6, se pueden activar tres vías independientes: beta-catenina (vía canónica), calcio (Ca2+) y la vía de polaridad celular planar (vía no canónica). A continuación vamos a desarrollar el funcionamiento de la vía canónica Wnt por ser la mejor conocida y la que regula principalmente la formación ósea. La vía canónica de señalización Wnt depende principalmente de la estabilidad de la beta-catenina en el citoplasma del osteoblasto, y su posterior traslocación al núcleo, donde ejerce su actividad transcripcional para promover la diferenciación del osteoblasto3,6 (fig. 3). En la ausencia de proteínas de la familia Wnt, la beta-catenina es fosforilada por diferentes quinasas (principalmente la glucógeno-sintetaso-kinasa o GSK3β, pero también la CK1) y degradada en el proteosoma. La unión de Wnt al complejo co-receptor Fz-LRP5/6 da lugar a la inhibición de la actividad de GSK3β, impidiendo así la fosforilación y degradación de la beta-catenina, lo que conlleva una acumulación de la misma en el citoplasma del osteoblasto. Una vez alcanzada cierta cantidad de beta-catenina, esta es transportada al núcleo, donde se asocia con los factores de transcripción TCF/LEF para regular la expresión de los genes de la vía canónica Wnt, entre los cuales se han identificado varios relacionados con la diferenciación del osteoblasto. Se han descubierto dentro del núcleo varios factores que son capaces de influir en la transcripción: Ctmbip1/Icat, que inhibe la unión de beta-catenina a TCF, Cby/Chibby, que puede traslocar beta-catenina de nuevo al citosol, y Groucho, que se une a TCF e inhibe su acción.
Fig. 2. Vía de señalización Wnt en el osteoblasto. Cuando la vía está activada, Wnt forma un complejo con el receptor frizzled (Fz) y LRP5/6; beta-catenina se disocia de una serie de cofactores (APC, Axin y GSK3β), impidiendo así su fosforilación. Los cofactores Axin, Frat1 y Dsh provocan una inhibición en la enzima glucógeno-sintetaso-quinasa (GSK3β), lo que permite alcanzar un nivel estable de beta-catenina en el citosol, que es traslocada al núcleo, donde activa genes que promueven la diferenciación del osteoblasto. En la forma opuesta a la anterior, la proteína Fz no está unida al ligando Wnt y no se produce señal de activación. Los factores inhibidores Dkk y SOST pueden acoplarse a LRP5/6 y bloquear la señal Wnt; en esta situación, no se produce la inhibición de GSK3β y la beta-catenina es fosforilada (P) y transportada al proteosoma para su degradación. APC: factor supresor tumoral (adenomatous polyposiscoli tumor).
Fig. 3. Previa activación de la vía canónica de señalización Wnt, la beta-catenina es traslocada al núcleo donde forma un complejo con el factor derivado de células T (TCF), el cual está sujeto a un estricto control para activar o no la transcripción genética. Dentro del núcleo existen factores capaces de captar beta-catenina3,11: Ctnnbip1/Icat, que inhibe su unión a TCF, y Cby/Chibby, que puede traslocarla de nuevo al citosol. Se ha identificado otro factor, llamado Groucho, capaz de conectarse a un dominio específico de TCF neutralizando su actividad e impidiendo a beta-catenina activar la transcripción.
RECEPTORES LRP5/6
Los receptores LRP5 y LRP6 son proteínas de la superficie celular que pertenecen a la familia de receptores relacionados con LDL (LDLR) y son capaces de unirse e internalizar ligandos mediante un mecanismo de endocitosis. A diferencia de otros miembros de la familia de LDLR, el receptor LRP5/6 no contiene la secuencia de señal requerida para realizar la endocitosis, pero ha mostrado una capacidad clara para unirse a proteínas Wnt y mediar en la vía de señalización canónica Wnt. LRP5 y LRP6 codifican 1.615 y 1.613 aminoácidos transmembrana, respectivamente, con un 71% de semejanzas entre ellas. El dominio extracelular de ambos receptores está compuesto principalmente por 6 terminales-N YWTD repetidos y un factor parecido al factor de crecimiento epidérmico (EGF-like sequence); esta estructura se repite 4 veces y va seguida de un dominio parecido a un ligando LDLR (LDLR-like ligand-binding). Los análisis moleculares han revelado que YWTD forma un módulo de 6 caras (six-bladed β-propeller), de los cuales uno de ellos es capaz de unir Wnt y proteína SOST, y otro es capaz de unir y modular la actividad inhibitoria de Dkk.
Aunque LRP5 y LRP6 son indistinguibles cuando se compara su capacidad de traslucir la señal Wnt, los avances en investigaciones genéticas han demostrado la existencia de al menos dos diferencias entre estos dos receptores. El receptor LRP6, y no LRP5, es preciso para el correcto desarrollo embrionario; el hecho de que ratones con déficit del receptor LRP6 mueran al nacer, mientras que ratones con déficit de LRP5 puedan ser viables, sugiere que la falta de función entre uno de los dos receptores no pueda ser compensada por el otro.
EFECTOS ÓSEOS DE LA VÍA CANÓNICA Wnt
La importancia de la vía canónica de señalización Wnt en el control de la masa ósea fue establecida mediante la identificación de mutaciones en el gen del co-receptor LRP5 que induce síndrome de osteoporosis-pseudoglioma (OPPG) o la entidad hereditaria conocida como masa ósea elevada (HBM)3. El síndrome OPPG es una patología poco frecuente, de herencia autosómica recesiva, que afecta al tejido óseo y al sistema ocular, y que está motivada por una mutación o pérdida de función en el gen del receptor LRP5. Los pacientes con OPPG tienen una masa ósea muy disminuida, y son propensos a presentar fracturas y deformidades del esqueleto óseo. En cambio, mutaciones que generan hiperfunción de LRP5 han sido asociadas a la entidad HBM. En ratones, al anular o inducir un incremento de actividad de LRP5 se han obtenido fenotipos similares a OPPG y HBM, respectivamente. Además, inactivando o reduciendo la expresión de antagonistas Wnt como Sfrp1, APC, Dkk1 o SOST, se incrementó de forma marcada la masa ósea trabecular en el ratón adulto. De otro modo, el incremento en la expresión de antagonistas Wnt como Ctgf, Wif1, Dkk1 o SOST, redujo significativamente la DMO. Los osteoblastos son las dianas celulares principales de la vía Wnt: la beta-catenina es esencial para determinar si los progenitores mesenquimales se convierten en osteoblastos o condrocitos, indicando que la vía de señalización Wnt puede afectar al papel final ejercido por el osteoblasto. Un mecanismo adicional por el cual Wnt puede controlar la función del osteoblasto es mediante el bloqueo de la adipogénesis, ya que puede inhibir factores de transcripción adipogénica como C/ EBPα y PPARγ, tal y como se ha demostrado in vivo, con ratones transgénicos tipo Wnt/0b, o in vitro, aunque no se ha objetivado firmemente una conexión directa e inversa entre los mecanismos que interfieren en estas dos líneas mesenquimales.
Tomados en conjunto, estos resultados sugieren que la vía de señalización Wnt puede determinar el destino celular de los precursores mesenquimales, a la vez que la actividad formadora de hueso del osteoblasto. Por tanto, la vía canónica Wnt controla los osteoblastos a diferentes niveles: diferenciación, proliferación o apoptosis, y función final.
Hay que señalar que las mutaciones que afectan a LRP5, tanto en humanos como en ratones (hiperfunción o hipofunción), alteran la formación ósea sin afectar a los parámetros de resorción. Basado en los datos disponibles en la actualidad sobre mutaciones en LRP5, se podría concluir que la vía canónica de señalización Wnt no regula al osteoclasto, pero existe alguna evidencia en experimentos in vitro e in vivo que indica que Wnt incrementa la expresión de OPG en el osteoblasto y células del estroma, lo que da lugar a la inhibición en la diferenciación del osteoclasto por la interacción con RANKL.
ESCLEROSTINA, ANTAGONISTA DE LA VÍA Wnt Y POSIBLE DIANA TERAPÉUTICA
La esclerostina (o proteína del gen SOST, localizado en el cromosoma 17q12-q21) es un antagonista de la señal de la vía canónica Wnt capaz de unirse a las BMP, inhibir su acción y, como consecuencia, anular la diferenciación o función de los osteblastos inducida por BMP. Además se ha objetivado la presencia de la esclerostina únicamente en los osteocitos, específicamente en condrocitos hipertróficos7. En el trabajo publicado por Kusu et al en el año 2003, realizado en tejido óseo embrionario de ratón, se logró determinar la actividad biológica de la proteína recombinante esclerostina (sclerostin mRNA) y se observó que la esclerostina desempeña un papel importante en la osteogénesis pero no en la condrogénesis del desarrollo de huesos largos, ya que se expresaba en condrocitos hipertróficos del pericondrio, periostio y hueso trabecular de la diáfisis ósea. Esto indicaba que la esclerostina se expresaba en zonas de formación ósea en huesos largos desarrollados.
La esclerostina es una proteína antagonista de Wnt, que comparte semejanzas con otro antagonista de Wnt denominado Wise3. Ambas forman parte de una familia de proteínas (incluyendo a CCN, Dan y Wif), las cuales son capaces de unirse a las BMP y anular su señal. Sin embargo, varios estudios han demostrado claramente que la esclerostina interactúa con LRP5 y LRP6 para inhibir la vía canónica de señalización Wnt. Debe señalarse como importante que la variante patológica LRP5-HBM y un cambio similar en LRP6, impide la unión de esclerostina con LRP5/6, lo que sugiere que la elevada DMO observada en pacientes con HBM puede ser resultado de la reducción en el grado de inhibición ejercida por la esclerostina endógena, Dkk1 o ambas. Por ello, los agentes terapéuticos que puedan alterar la capacidad de la esclerostina de unirse a LRP5 podrían imitar el fenotipo de la entidad HBM en pacientes con osteoporosis.
Los avances en los análisis genéticos han demostrado que entidades patológicas como la esclerostosis son el resultado de la pérdida de función del producto derivado del gen SOST o esclerostina, mientras que el síndrome Van Buchem está asociado con una expresión disminuida del gen SOST o una alteración funcional de la región cromosómica que regula dicho gen3,7. Como se ha descrito previamente, la esclerostina se expresa exclusivamente en osteocitos, y se piensa que estas células, enclavadas en la matriz ósea, son las principales mecanosensoras del hueso, participando en la regulación de la formación de hueso y determinación de la masa ósea. En el trabajo publicado por Keller et al en el año 20058, se demuestra que la expresión local de esclerostina disminuye en la presencia de cargas mecánicas y bajo tratamiento farmacológico con parathormona (PTH), posiblemente por reducir la inhibición en la acción antagónica sobre la vía de señalización Wnt y activando la formación de hueso. Se han desarrollado anticuerpos monoclonales neutralizantes de esclerostina (scl-Ab), que muestran actividad anabólica ósea en ratas y ratones. En primates, este anticuerpo mostró un perfil farmacocinético favorable, a la vez que una actividad ósea significativa, y se convirtió así en un serio candidato para formar parte de ensayos clínicos en el futuro. La inhibición de la esclerostina es un acercamiento prometedor, desarrollándose en el momento actual estudios mediante la administración de anticuerpos neutralizantes de esclerostina (scl-mAb). Recientemente, en un trabajo de Li et al9, se ha demostrado que la administración subcutánea de scl-mAb en ratas anexectomizadas con osteopenia puede estimular directamente la formación ósea en una relación dósis dependiente, objetivando además un incremento aceptable del remodelado cualitativo en hueso trabecular, sin incrementar la resorción ósea.
Padhi et al10 han comprobado que la administración de una dosis única de este anticuerpo en 48 mujeres sanas posmenopáusicas produce incrementos significativos en los marcadores de formación ósea (osteocalcina, procolágeno tipo 1 o P1NP, y fosfatasa alcalina ósea o BSAP) en relación con la administración de placebo, y una tendencia a la disminución del telopéptido carboxiterminal del colágeno (TCx) sérico; en este mismo trabajo se observó, además, una buena tolerancia tras la administración subcutánea de una dosis única de scl-mAb. Esto puede suponer una estrategia potencial terapéutica para entidades patológicas que se beneficiarían del incremento de masa ósea.
DKK1 COMO ANTAGONISTA DE Wnt Y POSIBLE DIANA TERAPÉUTICA
La proteína Dkk1 también se inserta en la región C-terminal 3 y 4 del receptor de LRP5/63 (fig. 2). La región Cys-2 de la familia de proteínas Dkk es suficiente para mediar en la unión con LRP6, y si se produce una mutación en la región restante o residual Cys220, se obtiene como resultado la supresión de dicha interacción. Al igual que con LRP5/6, la proteína Dkk es capaz de unirse a otra familia de receptores transmembrana (de un solo paso, single-pass transmembrane receptor) conocida con el nombre de proteínas Kremen: Krm1 y Krm2. Estas se unen a Dkk1 y Dkk2 con elevada afinidad por la mediación de la región Cys-2. Aunque Dkk1, Dkk2 y Dkk4 son capaces de unirse a LRP5/6 en ausencia de proteínas Kremen, tanto Krm1 como Krm2 pueden potenciar la capacidad de Dkk de inhibir la señal de Wnt. Como resultado de lo anterior, se forma un complejo proteico Dkk/LRP/Krm en la membrana celular, que es rápidamente desplazado al citosol, lo que da lugar a la pérdida de receptores LRP5/6 de la membrana. De este modo, la unión Dkk a LRP5/6 inhibe la vía canónica de señalización Wnt mediante la reducción del número de receptores de membrana LRP. Diversas líneas de investigación en ratones transgénicos han demostrado el compromiso de Dkk1 en la regulación de formación ósea. Mientras que la expresión disminuida del gen Dkk1 da lugar a un fenotipo con elevada DMO, la expresión incrementada del mismo da lugar a osteopenia. El oligonucleótido Dkk1 antisense en ratas ha mostrado prevenir los efectos de la ooforectomía en la DMO, en el contenido mineral del hueso y en el pico de masa ósea en fémur, mediante el papel que ejerce incrementando el número de osteoblastos y reduciendo la expresión de RANKL, que como consecuencia final lleva a reducir la osteoclastogénesis11.
CONCLUSIONES
Los tratamientos actuales para la osteoporosis están casi exclusivamente basados en un efecto anti-reabsortivo, pero existe una necesidad real para terapias alternativas basadas en la estimulación de vías anabólicas en el hueso, siendo en el momento actual la PTH inyectable el único ejemplo. El reto para el desarrollo de nuevas moléculas que modulen la vía de señal Wnt es reducir su efecto exclusivamente al tejido óseo, aspecto objetivado positivamente en agentes como la esclerostina.
Correspondencia:
E. Jódar Gimeno.
Servicio de Endocrinología y Nutrición. Hospital Universitario 12 de Octubre. Avda. Andalucía, km. 5,4. 28041 Madrid. España.
Correo electrónico: ejodar.hdoc@salud.madrid.org