BIOMECANICA ÓSEA PARA CLINICOS
J. R. CAEIRO REY
CIRUGIA ORTOPÉDICA Y TRAUMATOLOGIA. COMPLEJO HOSPITALARIO DE OURENSE. ORENSE
A diferencia de otros profesionales de la medicina que también tienen al hueso y a la patología ósea dentro del contenido de su especialidad, los cirujanos ortopédicos destinamos gran parte de nuestra formación y vida profesional al diagnóstico y tratamiento de las fracturas, es decir, al estudio de las causas y consecuencias del fracaso biomecánico del mismo.
Bajo este prisma profesional, entendemos que sólo cuando se es capaz de ver al hueso sano como un órgano-tejido vivo dotado de una composición química, una estructura jerarquizada y un sistema de modulación estructural responsables de sus propiedades biomecánicas y de su resistencia, se puede comprender la fisiopatología de dichos fracasos.
Así, desde esta perspectiva debemos considerar que la resistencia ósea, entendiendo como tal la fuerza necesaria para desencadenar bajo unas condiciones específicas de carga, el fracaso biomecánico del hueso, es el resultado de la integración de dos variables, la cantidad y la calidad óseas. Mientras que la cantidad de hueso depende directamente de su densidad mineral ósea (DMO), la calidad del mismo, entendiendo como tal al conjunto de factores independientes de la DMO relacionados con la capacidad de un hueso para resistir fuerzas de fractura, depende de variables tales como la composición química de los materiales orgánicos e inorgánicos que componen su matriz y de cómo se produce la estructuración espacial de los mismos. Ambos determinantes primarios de la resistencia ósea son a su vez dependientes de un proceso de transformación de la estructura ósea denominado remodelado óseo, mecanismo por el cual el hueso adulto se renueva para mantener intactas sus propiedades materiales, estructurales y biomecánicas.
Los componentes orgánico y mineral de la matriz ósea, y en cierta medida su organización ultraestructual, determinan las propiedades materiales del hueso, mientras que colectivamente sus niveles de organización jerárquica (ultra, micro y macroarquitectural) determinan las propiedades estructurales del mismo.
El nivel macroestructural define las características del hueso en su conjunto (forma, tamaño, geometría y proporción de subtipos titulares cortical y trabecular), mientras que el nivel microestructural describe al tejido óseo como la resultante de la distribución espacial de los materiales que lo componen. Así, el hueso cortical se presenta como una estructura compacta de distribución lamelar, que aporta a la unidad ósea un excelente armazón, mientras que el hueso trabecular, con una estructura mineralizada tipo panal, formada por tubos y placas interconectadas entre sí y con la superficie endostal cortical se comporta de manera semejante a un conjunto de muelles capaces de deformarse almacenando energía. El nivel ultraestructural describe la composición y arquitectura de la red molecular ósea, red compuesta por un 80% de colágeno tipo I dispuesto en fibras (matriz celular) y un 20% de componentes inorgánicos (matriz mineral) ordenados en forma de cristales de hidroxiapatita (HA) y de fosfato cálcico amorfo (FCA).
El colágeno, cristales de HA y de FCA confieren al tejido óseo parte de sus propiedades materiales características, sobre todo las de resistencia a la compresión y a la tracción, si bien no se conoce todavía con exactitud cuáles son las propiedades específicas, ni las interacciones necesarias entre cada uno de ellos necesarias para explicar el comportamiento biomecánico del hueso desde el punto de vista material. En este sentido, la red de fibras de colágeno, más dúctil que la cristalina, otorgaría al tejido óseo fundamentalmente rigidez y resistencia a la tracción en sentido longitudinal, además de proporcionarle parte de sus propiedades plásticas. En cambio, los cristales de HA y los de FCA proporcionarían al tejido óseo, fundamentalmente, resistencia y rigidez a la compresión.
En conjunto, propiedades materiales y estructurales determinan el comportamiento biomecánico elástico-plástico normal de la unidad ósea, proceso analizable desde el punto de vista físico mediante las curvas de tensióndeformación del hueso. A partir de estas curvas se pueden estudiar propiedades materiales específicas del tejido óseo (rigidez, flexibilidad, fortaleza, debilidad, resistencia, fragilidad, dureza, ductibilidad y fatiga), al mismo tiempo que se pueden analizar las diferencias entre las propiedades biomecánicas de un hueso sano y uno patológico.
Creemos, por tanto, que un enfoque biomecánico de la patología ósea puede resultar útil al clínico para entender las alteraciones fisiopatológicas que se producen en enfermedades óseas fragilizantes del tipo de la osteoporosis y, por tanto, para comprender cuáles son los objetivos terapéuticos de ciertos fármacos y cómo se justifica su eficacia antifractura.
DÉFICIT DE VITAMINA B12, HOMOCISTEÍNA Y METABOLISMO ÓSEO
JOSÉ A. RIANCHO
SERVICIO DE MEDICINA INTERNA. HOSPITAL UNIVERSITARIO .MARQUÉS DE VALDECILLA. UNIVERSIDAD DE CANTABRIA. SANTANDER
La arteriosclerosis y la osteoporosis son dos procesos asociados al envejecimiento que constituyen importantes problemas de salud en las sociedades occidentales. Evidentemente, sus manifestaciones clínicas y sustratos histopatológicos son muy distintos. Sin embargo, en los últimos años se han ido acumulando una serie de datos que sugieren la existencia de ciertas relaciones entre ellos. De hecho, algunos estudios epidemiológicos señalan que ambas enfermedades tienden a asociarse en la población, de manera que los pacientes con problemas cardiovasculares tienen una masa ósea menor que los controles sanos. El nexo de unión no está plenamente esclarecido y posiblemente sea múltiple, incluyendo diversos factores patogénicos comunes a la osteoporosis y la arteriosclerosis, como la biodisponibilidad de estrógenos, la actividad física, el tabaquismo, etc.
Otro posible factor de asociación entre esos procesos lo constituye la homocisteína. Los pacientes con homocistinuria, un raro trastorno congénito del metabolismo en el que los niveles de homocisteína aumentan marcadamente, presentan frecuentemente osteoporosis y arteriosclerosis aceleradas. Por otro lado, numerosos estudios epidemiológicos han demostrado una asociación entre las elevaciones moderadas de homocisteína y el riesgo de cardiopatía isquémica e ictus en la población general. En los últimos años se han publicado también algunos estudios de cohortes europeas y norteamericanas que revelan igualmente una asociación entre los niveles de homocisteína y la incidencia de fracturas osteoporóticas1,2.
Los estudios mencionados, amplios y bien diseñados, parecen establecer claramente la existencia de una asociación entre niveles séricos de homocisteína y riesgo de osteoporosis. Sin embargo, no queda claro si se trata de una relación causal o no. Las concentraciones elevadas de homocisteína pueden interferir con la formación de los puentes de colágeno. Pero entre los factores que influyen en la concentración de homocisteína se encuentra la disponibilidad de estrógenos, ácido fólico y vitamina B12. Los primeros tienen una influencia sobre el esqueleto, independiente de la homocisteína, bien conocida. En cuanto a las vitaminas, implicadas no sólo en el metabolismo de la homocisteína, sino en otros procesos celulares, también pueden tener efectos directos sobre la homeostasis esquelética. Así, en varios estudios se ha encontrado una asociación positiva entre los niveles de ácido fólico o vitamina B12 y la densidad mineral ósea, independiente de la homocisteína3,4. Por otro lado, se ha observado una relación entre la masa ósea y algunos polimorfismos de la metilentetrahidrofolato reductasa, enzima implicada en el metabolismo del ácido fólico y cuya actividad influye en los niveles de homocisteína. Pero parece haber una interacción compleja entre tales polimorfismos y algunos factores nutricionales, incluyendo la ingesta de diferentes vitaminas5,6.
Por tanto, los niveles de homocisteína y de diversas vitaminas, incluyendo el ácido fólico y la vitamina B12, están asociados con el riesgo de osteoporosis. Sin embargo, por el momento resulta difícil establecer la influencia real e independiente de cada uno de ellos. Y, lo que es más importante, si el tratamiento con suplementos de esas vitaminas no sólo reduce los niveles de homocisteína, sino también el riesgo de fracturas, como sugiere un estudio reciente7.
BIBLIOGRAFÍA
1. Van Meurs JBJ, Dhonukshe-Rutten RAM, Pluijm SMF, Van der Klift M, de Jonge R, Lindemans J ,et al. Homocysteine levels and the risk of osteoporotic fracture. N Engl J Med. 2004; 350:2033-41
2. McLean RR, Jacques PF, Selhub J, Tucker KL, Samelson EJ, Broe KE, et al. Homocysteine as a predictive factor for hip fractures in older persons. N Engl J Med. 2004; 350:2042-49.
3.Cagnaci A, Baldassari F, Rivolta G, Arangino S, Volpe A. Relation of homocysteine, folate, and vitamin B12 to bone mineral density of postmenopausal women. Bone. 2003; 33:956-9.
4.Golbahar J, Hamidi A, Aminzadeh MA, Omrani GR. Association of plasma folate, plasma total homocysteine, but not methylenetetrahydrofolate reductase C677T polymorphism, with bone mineral density in postmenopausal Iranian women: a cross-sectional study. Bone. 2004; 33:760-5.
5.McLean RR, Karasik D, Selhub J, Tucker KL, Ordovas J, Russo GT, et al. Association of a common polymorphism in the methylenetetrahydrofolate reductase (MTHFR) gene with bone phenotypes depends on plasma folate status. J Bone Miner Res. 2004; 19:410-8.
6.Abrahamsen B, Madsen JS, Tofteng CL, Stilgren L, Bladbjerg EM, Kristensen SR, et al. Are effects of MTHFR (C677T) genotype on BMD confined to women with low folate and riboflavin intake? Analysis of food records from the Danish osteoporosis prevention study. Bone. 2005; 36:577-83.
7.Sato Y, Honda Y, Iwamoto J, Satoh K. Effect of folate and mecobalamine on hip fractures in patients with stroke: a randomized controlled trial. JAMA. 2005; 293:1082-8.
CALCIMIMÉTICOS EN EL HIPERPARATIROIDISMO SECUNDARIO
J. L. FERNANDEZ MARTIN
SERVICIO DE METABOLISMO ÓSEO Y MINERAL. INSTITUTO REINA SOFIA DE INVESTIGACION. HOSPITAL CENTRAL DE ASTURIAS.OVIEDO. ABS VIA ROMA. BARCELONA.
Los pacientes con insuficiencia renal crónica presentan alteraciones de la homeostasis del calcio y del fósforo asociada a cambios en el metabolismo de la vitamina D. Como consecuencia de ello, la mayoría de estos pacientes desarrollan hiperparatiroidismo secundario caracterizado por un incremento en la secreción y síntesis de PTH, así como un aumento de la proliferación celular que conduce hacia una hiperplasia de las paratiroides 1
La regulación de la PTH es un proceso complejo en el que intervienen como reguladores más importantes el calcio, el fósforo y el calcitriol, siendo el calcio iónico en el fluido extracelular el factor principal involucrado en dicha regulación2. Pequeños descensos en la concentración de calcio extracelular producen grandes incrementos de la secreción de PTH en un intervalo de tiempo muy corto (segundos-minutos); si la hipocalcemia es más prolongada (horas-días), el efecto observado no es únicamente sobre la secreción de PTH sino también sobre la síntesis3. Finalmente, cuando esta hipocalcemia se mantiene durante semanas, se estimula la proliferación de las células paratiroides produciéndose la hiperplasia de la glándula4.
Las glándulas paratiroides son capaces de detectar los cambios de calcio extracelular a través del receptor sensor de calcio (CaR). El CaR es un receptor transmembrana acoplado a proteínas G que se expresa en multitud de tejidos y sistemas, entre ellos las paratiroides. Cuando se produce un descenso en la concentración de calcio extracelular, el CaR se activa y desencadena una serie de segundos mensajeros cuyo resultado final es la inhibición de la secreción de PTH5.
La progresión del hiperparatiroidismo secundario conlleva una reducción en la expresión del CaR 6 sobre todo cuando la glándula presenta un crecimiento nodular. Como consecuencia de esta reducción en la densidad de CaR, las glándulas paratiroides presentan una mayor dificultad para responder al calcio y se necesitan concentraciones más elevadas del mismo para inhibir la PTH.
En los pacientes con insuficiencia renal en hemodiálisis, la PTH y producto Ca x P elevados se asocia con una elevada mortalidad, morbilidad y dolores óseos7,8. El incremento del producto Ca x P se puede ver agravado por el empleo de vitamina D y ligantes de P que contienen calcio. Dada la relevancia de la progresión del hiperparatiroidismo secundario entre los pacientes en diálisis, la National Kidney Foundation ha elaborado unas guías (NKF/KDOQI) de manejo de pacientes en las que recomienda, entre otros, mantener unos niveles de PTH entre 150-300 pg/ml y un producto Ca x P por debajo de 55 mg2/dl29. Las herramientas terapéuticas existentes para el control del hiperparatiroidismo secundario resultan insuficientes, de tal manera que casi un 50% de los pacientes en diálisis presentan niveles de producto Ca x P > 55 mg2/dL2 y casi un 80% niveles de PTH > 300 pg/ml10.
Tras el descubrimiento del CaR, se invirtieron grandes esfuerzos en el desarrollo de compuestos con capacidad para modular la función del mismo. De esta forma se desarrollaron los calcimiméticos, compuestos que inicialmente eran capaces de mimetizar al calcio (tipo I). Posteriormente se desarrollaron los calcimiméticos tipo II, unas moléculas orgánicas pequeñas que en realidad no mimetizan al calcio, sino que producen cambios en la conformación estructural del CaR haciéndolo más sensible a la acción del calcio11, por lo que en realidad deberían denominarse "moduladores alostéricos positivos". Entre los calcimiméticos que se encuentran en desarrollo clínico destaca el cinacalcet sobre el que ya se han realizado ensayos clínicos de eficacia y tolerabilidad y ya ha sido aprobado para uso clínico en determinados países.
El cinacalcet de forma aguda ha mostrado su eficacia reduciendo la PTH de una forma dosis dependiente12. La máxima concentración del cinacalcet tras su administración se alcanza a las 2-3 horas y tras ese tiempo se alcanza también la máxima supresión de la PTH. Cuando se administra de forma continua, puesto que potencia el efecto del calcio, al igual que éste, es capaz también de inhibir la síntesis de mRNA de la PTH. En ratas con insuficiencia renal crónica también ha mostrado su capacidad para inhibir la proliferación celular y el tamaño de las glándulas paratiroides13
Existen tres grandes ensayos clínicos en fase III con cinacalcet realizados en EE.UU./Australia, Europa/Australia y EE.UU./Canadá/Australia respectivamente14,15. En dichos ensayos se incluyeron pacientes en hemodiálisis con PTH intacta basal por encima de 300 pg/ml y un calcio basal mayor o igual a 8,4 mg/dl. Los pacientes fueron divididos aleatoriamente en dos grupos y tratados con placebo y cinacalcet respectivamente. La dosis inicial de cinacalcet fue de 30 mg diaria (variando entre 30 y 180 durante un periodo de 12 semanas de ajuste de dosis). Los descensos en PTH en el grupo tratado con cinacalcet se evidenciaron ya desde la primera semana y oscilaron entre un 38% y un 48% en los tres ensayos. También se evidenciaron descensos significativos del calcio, fósforo y producto Ca x P 15 Estos efectos beneficiosos del cinacalcet se observaron independientemente del sexo, edad, tiempo en diálisis, grado de severidad del hiperparatiroidismo, del tratamiento con metabolitos/análogos de la vitamina D y de los niveles basales de fósforo y producto Ca x P. Tras el tratamiento con cinacalcet, entre el 39% y el 44% de los pacientes presentaban valores de PTH y producto Ca x P dentro de los rangos recomendados en las guías NKF/KDOQI mientras que los que recibieron placebo, solo lo cumplían entre un 5% y un 7%14. El tratamiento con cinacalcet es en general bien tolerado por los pacientes. Las náuseas y los vómitos fueron más frecuentes en el grupo de pacientes que recibió cinacalcet frente a los del grupo placebo, si bien fueron de intensidad leve o moderada y de forma puntual. Los pocos casos de hipocalcemia asociados al tratamiento fueron fácilmente corregibles mediante el ajuste de las dosis de ligantes de fósforo o del calcitriol o ambas.
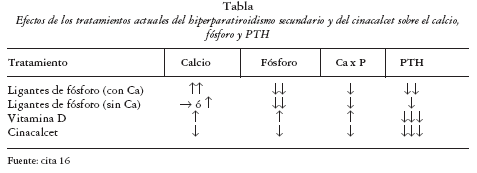
El cinacalcet constituye una herramienta terapéutica novedosa muy eficaz para el tratamiento del hiperparatiroidismo secundario que actúa directamente sobre los mecanismos moleculares que regulan la secreción y la síntesis de PTH. En la actualidad, además del ajuste de la concentración de calcio en el líquido de diálisis, el manejo de la progresión del hiperparatiroidismo secundario se realiza mediante la dieta, el uso de metabolitos/análogos de la vitamina D y la administración de ligantes del P en el tubo digestivo. En la tabla se muestra una comparación de estos últimos con el cinacalcet en cuanto a sus efectos sobre el calcio, fósforo y PTH 16 El empleo conjunto de todas estas estrategias terapéuticas promete una mayor eficacia en el control de esta enfermedad.
AGRADECIMIENTOS
El Fondo de Investigaciones Sanitarias (FIS 04/1576) ha subvencionado parcialmente este trabajo.