Apoptosis is a mechanism intrinsic to the biological machinery of the healthy cells in which it plays a physiological role in different processes. However, during the development of cancer, this mechanism can be altered, favoring tumor progression and resistance to the common antitumor therapies. New proapoptotic drugs, some being small molecules administered orally and others monoclonal antibodies of intravenous administration, are being developed for the treatment of cancer, in preclinical and clinical phases, associated or not to other agents, and their future seems to be promising.
Apoptosis is a mechanism intrinsic to the biological machinery of the healthy cells in which it plays a physiological role in different processes. However, during the development of cancer, this mechanism can be altered, favoring tumor progression and resistance to the common antitumor therapies. New proapoptotic drugs, some being small molecules administered orally and others monoclonal antibodies of intravenous administration, are being developed for the treatment of cancer, in preclinical and clinical phases, associated or not to other agents, and their future seems to be promising.
La apoptosis es un mecanismo intrínseco a la maquinaria biológica de las células sanas, donde desempeña un papel fisiológico en diversos procesos. Sin embargo, durante el desarrollo del cáncer, este mecanismo se puede ver alterado, favoreciendo la progresión tumoral y la resistencia a las terapias antitumorales habituales. Nuevos fármacos proaptóticos, unos son pequeñas moléculas que se administran por vía oral y otros son anticuerpos monoclonales de administración intravenosa, se están desarrollando para el tratamiento del cáncer, tanto en fases preclínicas como clínicas, asociados o no a otros agentes, y su futuro parece prometedor.
La apoptosis es un mecanismo intrínseco a la maquinaria biológica de las células sanas, donde desempeña un papel fisiológico en diversos procesos. Sin embargo, durante el desarrollo del cáncer, este mecanismo se puede ver alterado, favoreciendo la progresión tumoral y la resistencia a las terapias antitumorales habituales. Nuevos fármacos proaptóticos, unos son pequeñas moléculas que se administran por vía oral y otros son anticuerpos monoclonales de administración intravenosa, se están desarrollando para el tratamiento del cáncer, tanto en fases preclínicas como clínicas, asociados o no a otros agentes, y su futuro parece prometedor.
Toutes choses ont leur saison, les bonnes et tout (Todas las cosas tienen su hora, incluso las buenas). Les Essais, Livre II, Chapitre XXVIII, Michel de Montaigne.
Concepto de apoptosis e implicaciones clínicas
La muerte celular en mamíferos se produce por necrosis, auto-fagia o apoptosis (muerte celular programada, genéticamente controlada)1.. La apoptosis es un proceso fisiológico de eliminación celular estrechamente regulado y caracterizado por una secuencia de cambios morfológicos estereotipados: contracción celular, condensación de la cromatina y fragmentación nuclear y celular, con formación de cuerpos apoptóticos que son engullidos por las células fagocíticas próximas antes de que se pierda la integridad de la membrana2. Las alteraciones en la regulación de la apoptosis son críticas en el desarrollo del cáncer y en la resistencia al tratamiento. Las aberraciones genéticas de las células tumorales inducen con frecuencia su muerte por apoptosis, pero en el proceso de malignización pueden adquirir cambios en genes y proteínas implicados en las vías apoptóticas, permitiendo a dichas células tumorales evadir la apoptosis3. En las células cancerosas la apoptosis puede ser un fenómeno reversible, si no se sobrepasa un determinado punto de no retorno, lo que podría contribuir a la repoblación de células tumorales entre los ciclos de tratamiento antitumoral, facilitando la progresión o la recaída4. Por otra parte, las células tumorales apoptóticas podrían tener efectos inmunomoduladores, induciendo anergia o fenómenos inmunosupresores5,6.
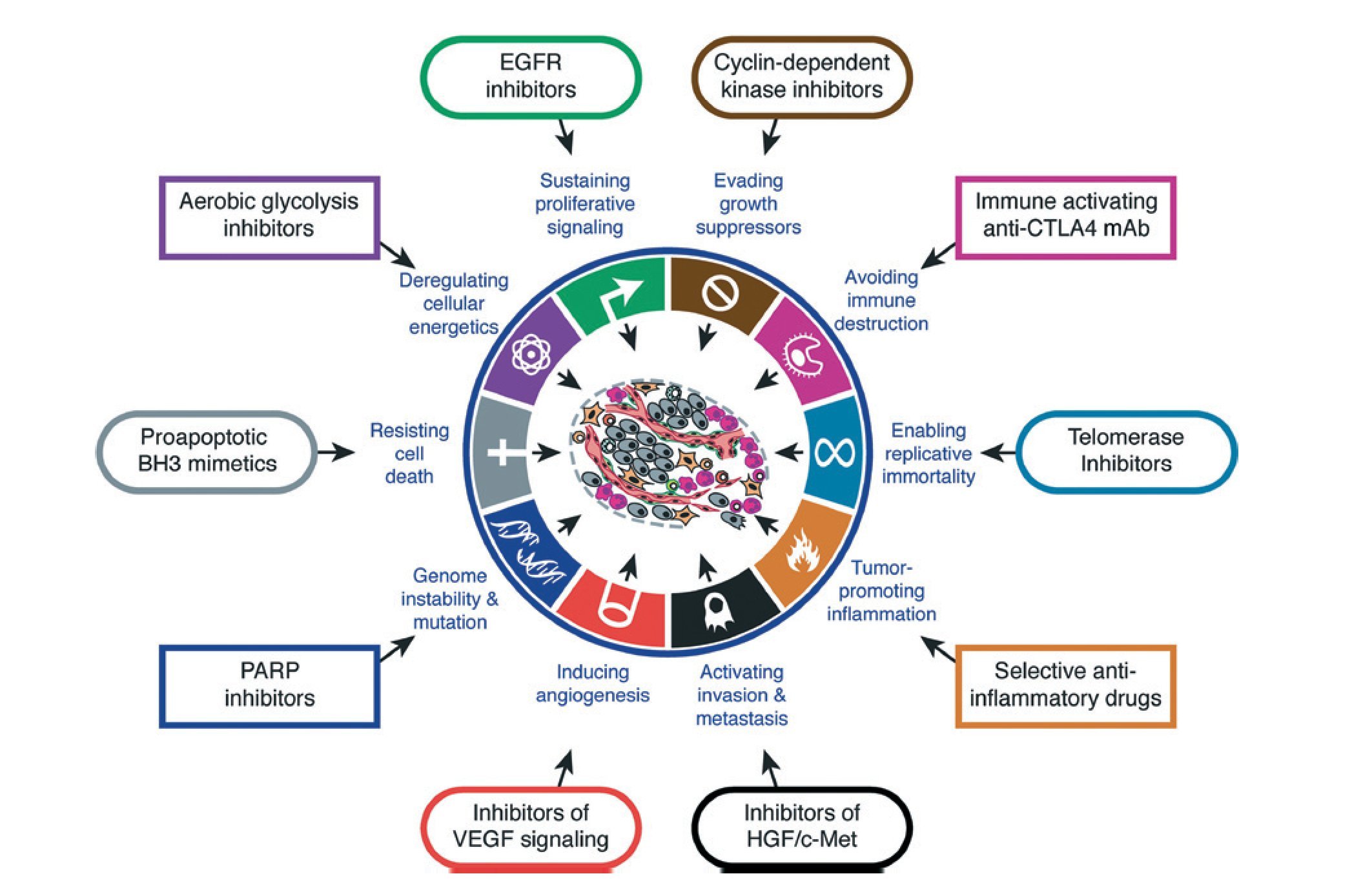
El desarrollo de resistencia a la muerte celular ha sido reconocido como uno de los mecanismos básicos durante el desarrollo del cáncer y, sus vías, se presentan como dianas terapéuticas prometedoras7 (fig. 1).
Fig 1 ¿ La vía apoptótica como una de las dianas terapéuticas de futuro en el tratamiento del cáncer. Tomada de Hanahan D, et al D7, reproducido con permiso.
Vías de la apoptosis y aplicaciones clínicas
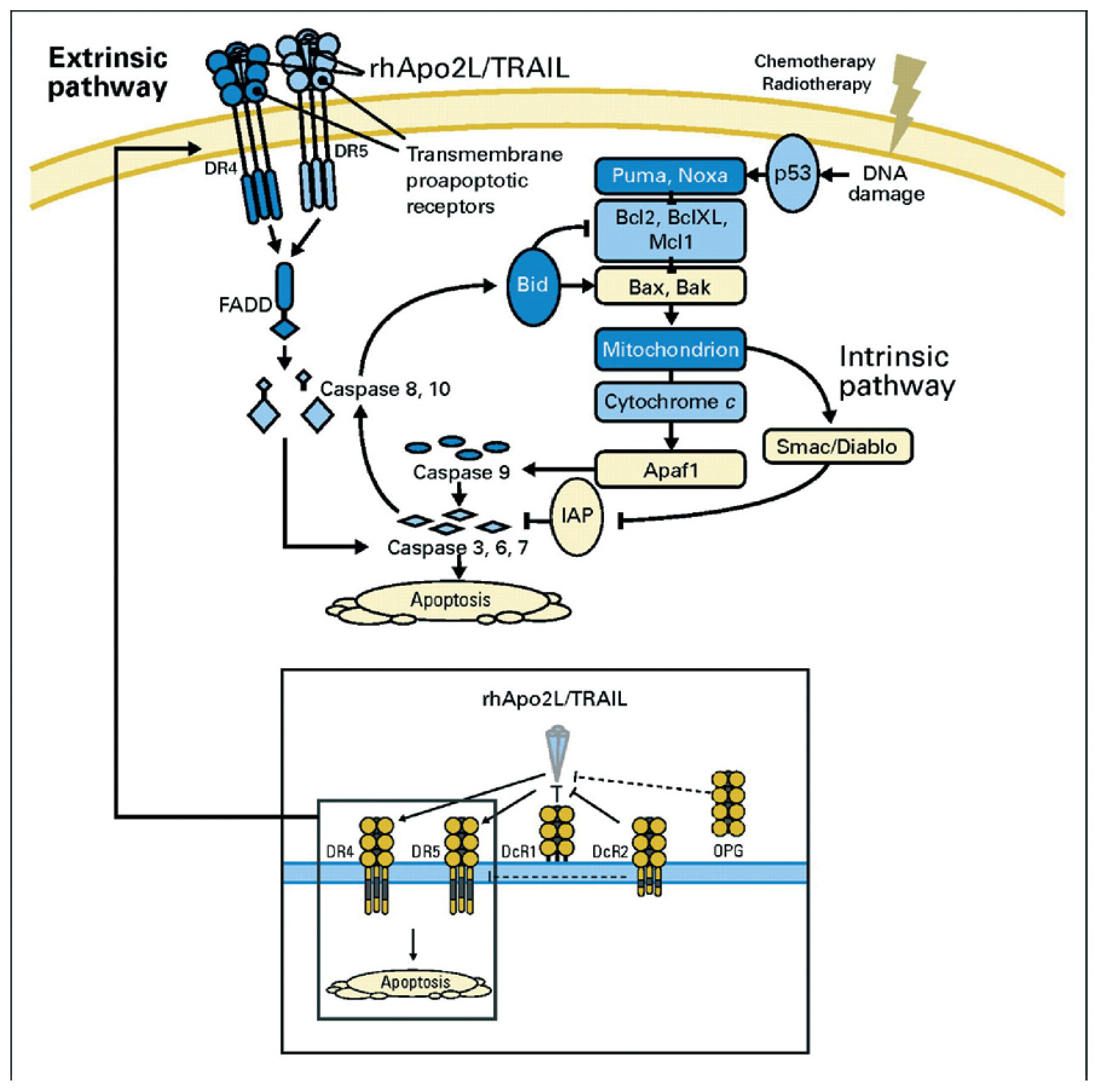
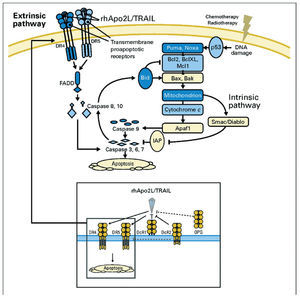
La apoptosis es inducida por dos vías de señalización: la vía intrínseca, activada por la liberación de factores pro-apoptóticos mitocondriales (como el citocromo c y la proteína Smac/diablo) y la vía extrínseca, activada a través de receptores de muerte que se expresan en la superficie celular8 (fig. 2). Ambas vías convergen, llevando a efecto su orden letal a través de la activación de las caspasas, proteasas intracelulares9.
Fig. 2¿ Vías intrínseca y extrínseca de la apoptosis rhApo2L/TRAIL, ligando 2 humano recombinante de la apoptosis/ ligando inductor de la apoptosis relacionado con el factor de necrosis tumoral. Apaf1: factor 1 activador de la proteasa apoptótica; FADD: dominio mortal asociado; IAP: inhibidor de apoptosis; OPG: osteoprotegerina. Tomada de Ashkenazi A et al8, reproducido con permiso.
Vía intrínseca de la apoptosis
La vía intrínseca de la apoptosis se activa desde el interior de la célula por daños en el ADN o en los microtúbulos, como los inducidos por quimioterapia y radioterapia, precisando en algunos casos de la intermediación de la proteína supresora de tumores p5310,11. implica además la interacción de proteínas anti-apoptóticas de la familia Bcl-2 y proteínas pro-apoptóticas como BAX y BAK12. Las células tumorales pueden evadir la apoptosis mediante mutaciones inactivadoras de p53 o amplificación del regulador negativo de p53 HDM2, que confieren resistencia a las terapias convencionales13. La sobreexpresión de Bcl-2 o la reducción en la expresión de BAX se han asociado a peor respuesta al tratamiento y peor pronóstico en algunos tumores como el cáncer de mama y el cáncer de ovario14-18; una baja expresión de la proteína Smac/ diablo se ha asociado a un peor pronóstico en pacientes con carcinoma renal de células claras y, por el contrario, la transfección a estas células de cáncer renal de Smac/Diablo las sensibiliza al tratamiento con cisplatino19. Esta correlación no es aplicable a todos los tipos tumorales ya que la expresión de otras proteínas de la vía intrínseca llamadas BH3-only puede modificar la sensibilidad a ciertos fármacos20, 21.
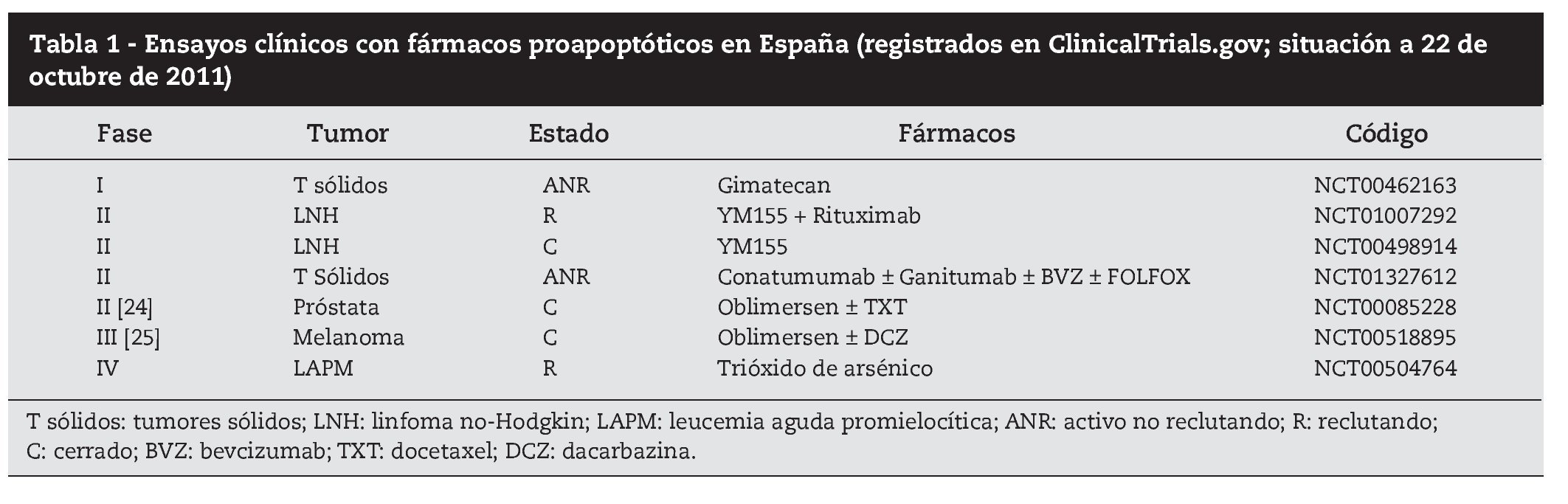
En pacientes con tumores sólidos y hematológicos se están realizando ensayos clínicos fase II-III con medicamentos que suprimen Bcl-2 y restauran la sensibilidad a la quimioterapia, como el oligonucleótido antisentido oblimersen y las moléculas ABT-737 y ABT-26322 (tabla 1). Estos fármacos tienen un perfil de toxicidad particular y así por ejemplo, ABT-263 (navitoclax) ha demostrado tener como principal efecto tóxico una trombopenia dosis-dependiente23. Centros españoles han participado en sendos ensayos clínicos fase ii con oblimersen: en el primer ensayo oblimersen añadido a taxotere fracasó en demostrar beneficio clínico en pacientes con cáncer de próstata avanzado hormonorrefractario; en el segundo ensayo, oblimersen combinado con dacarbazina demostró mejoría de la supervivencia en pacientes con melanoma metastásico y niveles basales bajos de LDH en sangre24,25. Datos recientes sugieren que otro mecanismo antitumoral de las pequeñas moléculas inhibidoras de Bcl-2 podría ser mediante la inhibición de la neoangiogénesis tumoral26.
La simple determinación de los niveles de expresión de Bcl-2 en el tumor es insuficiente para predecir el beneficio de la terapia anti-Bcl-2: el análisis cuantitativo de la expresión génica, "arrays" de anticuerpos o el análisis por Western blot de proteínas podrían aportar información complementaria a los estudios inmunohistoquímicos de las biopsias tumorales26.
Vía extrínseca de la apoptosis
La vía extrínseca de la apoptosis es independiente de p53 y se activa desde el exterior de la célula por ligandos agonistas de los receptores proapoptóticos (PARAs), tales como Apo2L/TRAIL o fasL que se unen respectivamente a los receptores de muerte celular DR4 y DR5 o fas, pertenecientes a la superfamilia del Tnf27,28. En algunas ocasiones Apo2/TRAIL puede activar además la vía intrínseca mediante Bid, una proteína de la familia Bcl-2. Apo2L/TRAIL induce selectivamente la apoptosis en las células cancerosas, pero no en las células normales, quizá debido a la sensibilización de las células tumorales a los Paras inducida por oncogenes como Myc y Ras29.
Hay dos tipos moleculares de PARAs en ensayos clínicos en pacientes con tumores sólidos y linfomas: uno es la forma humana recombinante de Apo2L/TRAIL (rhApo2L/TRAIL) como puede ser la duladermina; otro son los anticuerpos monoclonales dirigidos contra los receptores DR4 o DR5, tales como mapatumumab o apomab30.
En ensayos clínicos fase i la administración por vía intravenosa de rhApo2L/TRAIL a pacientes con tumores sólidos produjo principalmente astenia (38%), toxicidad digestiva (náuseas 28%, vómitos 23%, estreñimiento 18%), fiebre (23%) y anemia (18%), destacando como mejor respuesta dos casos de condrosarcoma con una respuesta parcial prolongada31. Sin embargo en otro ensayo fase i, duladermina, en combinación con paclitaxel, carboplatino y bevacizumab, no se alcanzó toxicidad limitante de dosis y ha demostrado actividad antitumoral en pacientes con adenocarcinoma de pulmón, encontrándose actualmente en ensayo fase ii32. Por otro lado, en modelos preclínicos de cáncer de mama con metástasis óseas, la combinación de duladermina con inhibidores de RANKL, frente a la administración aislada de cada uno de los fármacos anteriores, ha demostrado reducir la afectación tumoral ósea33. Nuevas formas de rhApo2L/TRAIL ligadas a liposomas, actualmente en estudio preclínicos, podrían mejorar la eficacia antitumoral de estos fármacos en el futuro34. Finalmente, mapatumomab ha demostrado en ensayos fase i no presentar toxicidades graves, además de tener una excelente tolerancia en combinación con quimioterapia (paclitaxel-carboplatino)35,36.
La respuesta tumoral a los PARAs puede verse afectada por mutaciones en Bax o en la caspasa 8, así como por alteraciones en la expresión de las proteínas anti-apoptóticas como Bcl-2 o cFLIP, o de proteínas pro-apoptóticas, como la proteína inhibidora de la Raf-1 quinasa y Myc30. Líneas celulares de cáncer de mama que no expresan receptores de estrógeno ni receptores de progesterona ni HEr2 parecen especialmente sensibles a rhapo2L/TRAIL37. En líneas celulares tumorales que sobreexpresan HER2 podría haber un efecto sinergista entre trastuzumab (que bloquea HER2) y la vía de TRAIL: por un lado, la activación de la vía de HER2 parece aumentar la expresión de receptores de TRAIL DR1 y DR2 y, por otro lado, el tratamiento con trastuzumab potenciaría la apoptosis mediada por la vía de TRAIL38,39.
Aunque es necesario cierto grado de expresión tumoral de DR4 o DR5 para conseguir respuesta al tratamiento con rhApo2L/TRAIL, los niveles de estos receptores no predicen la sensibilidad al fármaco40. Por el contrario, la expresión de enzimas específicas de O-glicosilación (reguladoras de las señales de apoptosis a través de DR4 y DR5) se han identificado como el predictor más potente de sensibilidad a rhApo2L/TRAIL: el análisis de 119 líneas celulares de cáncer reveló que el nivel de expresión de mRNA de la enzima iniciadora de O-glicosilación ppGalNAcT-14 se correlacionaba con la sensibilidad a rhApo2L/ TRAIL en líneas celulares de cáncer de páncreas, cáncer de pulmón no microcítico y melanoma (p < 0,0009; n = 87). La expresión de ppGalNAcT-3(p < 0,026; n = 36) y fucosiltransferasas se correlacionaba con la sensibilidad de líneas celulares de cáncer de colon40. La identificación de potenciales biomarcadores séricos de la actividad farmacodinámica de rhApo2L/ TRAIL, podrían ser particularmente útiles desde el punto de vista de la práctica clínica al requerir solamente la extracción de una muestra de sangre del paciente en tratamiento. Se han desarrollado, además, pruebas de inmunohistoquímica que permiten cuantificar en muestras parafinadas de tejido tumoral humano la expresión de enzimas de O-glicosilación como GalNAcT14 y FUT3/6, que podrían utilizarse en futuros ensayos clínicos como biomarcadores predictores de respuesta a agonistas rhApo2L/TRAIL (como duladermina) y a anticuerpos agonistas de DR5 (como drozitumab)41.
Por otro lado la imagen molecular con el potencial uso clínico de la tomografía de emisión de positrones (PET), utilizando como trazadores radioisótopos como el Tecnecio-99m-HYNIC anexina V o el nuevo ácido α-metil 18f-alquil-dicarboxílico (18f-ML-10), podría permitir la cuantificación el índice de apoptosis en los tumores de pacientes sometidos a tratamiento42,43.
Las proteínas inhibidoras de la apoptosis (IAPs), como XIAP y la Survivina, son inhibidores naturales de las caspasas proapoptóticas. AEG35156, un XIAP antisentido de segunda generación, ha demostrado buena tolerancia y actividad clínica en un ensayo fase i en pacientes con linfoma, melanoma y cáncer de mama refractarios a otros tratamientos44. Otra clase de fármacos en ensayo clínico son los antagonistas de las IAPs, como el inhibidor de survivina YM155 que ha demostrado un 12% de respuestas en un ensayo fase I45.
Conclusiones
La inhibición de la apoptosis es esencial en la carcinogénesis y el conocimiento de las vías moleculares subyacentes a este proceso ha permitido desarrollar nuevos fármacos antitumorales. La mayoría de estos fármacos se encuentran en fases precoces de su desarrollo clínico (ensayos fase I y II), siendo los menos los que han alcanzado el desarrollo en ensayos fase III. Fármacos que activan la vía intrínseca de la apoptosis (como oblimersen) podrían ayudar a restaurar la sensibilidad del tumor a los tratamientos de quimioterapia y radioterapia. Los fármacos que activan la vía extrínseca (como el agonista rhApo2L/TRAIL) ofrecen la ventaja potencial de actuar selectivamente sobre las células tumorales sin afectar a las células sanas. La identificación de biomarcadores predictivos séricos y en tejido tumoral, así como nuevas técnicas de imagen (PET con radiotrazadores de apoptosis), contribuirán a optimizar el diseño y los resultados de los ensayos clínicos de esta nueva clase farmacológica en el tratamiento del cáncer.
Conflicto de intereses
Los autores declaran que no tienen ningún conflicto de intereses.
Información del artículo
Historia del artículo:
Recibido el 25 de octubre de 2011
Aceptado el 16 de febrero de 2012
Autor para correspondencia.
Correo electrónico: rapazocid@seom.org (R. A. Pazo Cid).