El tumor de células granulares del esófago (TCG) es una neoplasia rara y su diagnóstico preciso se basa en el examen histopatológico. Con el incremento de la endoscopia como medida de tamizaje se ha visto un leve aumento en la incidencia, por lo que debe tenerse en cuenta como diagnóstico diferencial en el momento de abordar una lesión subepitelial.
MetodologíaPresentación de un caso clínico con TCG cuya endoscopia de vías digestivas altas (EVDA) muestra una lesión subepitelial en el tercio distal del esófago, y que debido a las características histopatológicas, clínicas y ecosonográficas se decide seguimiento y manejo expectante.
ConclusionesEs importante el conocimiento de las características, comportamientos y estrategias de manejo del TCG, pues muchos son asintomáticos y estables en el seguimiento, por lo que no necesitan tratamientos agresivos. Por el riesgo de malignidad, es importante su control riguroso.
Esophageal granular cell tumors (GCTs) are rare. Their precise diagnosis is based on histopathological examination of the specimen. However, owing to the use of endoscopy as a screening tool the incidence of these lesions has presently mildly increased and must be considered as a differential diagnosis of subepithelial lesions.
MethodologyA case is presented of a GCT as a subepithelial lesion in the distal part of the esophagus found by esophagogastroduodenoscopy (EGD). Conservative management and follow-up was decided due to the histopathological, clinical and ultrasound features of the lesion.
ConclusionsKnowledge regarding GCTs¿ characteristics, behavior and management is important for many are asymptomatic and remain clinically stable during follow-up, requiring no aggressive treatment. A rigorous follow-up is recommended due to its malignant potential.
El tumor de células granulares (TCG) es una neoplasia de tejidos blandos poco frecuente, en su mayoría benigna, cuyo hallazgo suele ser incidental1. Descrito por primera vez en 1926 por Abrikossoff, llamado mioblastoma, se conoce ahora que se origina de las células de Schwann. Puede ocurrir en cualquier parte del cuerpo, pero los sitios más comunes son la piel, la lengua, el tejido subcutáneo y el músculo esquelético. En la literatura cerca del 5 al 11% se encuentran en el tracto gastrointestinal, la mayoría en el esófago. El primer caso se reportó en 19312,3.
Los pacientes, por lo general, no presentan síntomas si el tamaño del tumor es menor de 10mm y cuando surgen corresponden a disfagia, distensión abdominal, pirosis y pérdida de apetito. El diagnóstico se realiza por medio del estudio histopatológico e inmunohistoquímico con S-1001. Aunque la mayoría de las veces el TCG es de características benignas, se ha descrito que entre el 1 y el 2% pueden llegar a presentar malignidad, con metástasis locales y remotas4. El conocimiento de estos tumores poco frecuentes y las actuales recomendaciones de tratamiento se basan en informes de casos individuales o estudios de series pequeñas, debido a la rareza de su presentación2.
En Colombia son pocas las descripciones de los casos de TCG y a nivel de esófago son mucho menos, solo se encontró un caso con 2 lesiones de 4 y 11mm de diámetro, a quien se le dio manejo con remoción por vía endoscópica5. A continuación, se presentan a un paciente que ingresa al Hospital de San José Bogotá con diagnóstico de TCG y el seguimiento realizado, así como una revisión de la literatura respecto a la epidemiología, la fisiopatología, las características histopatológicas y los tratamientos.
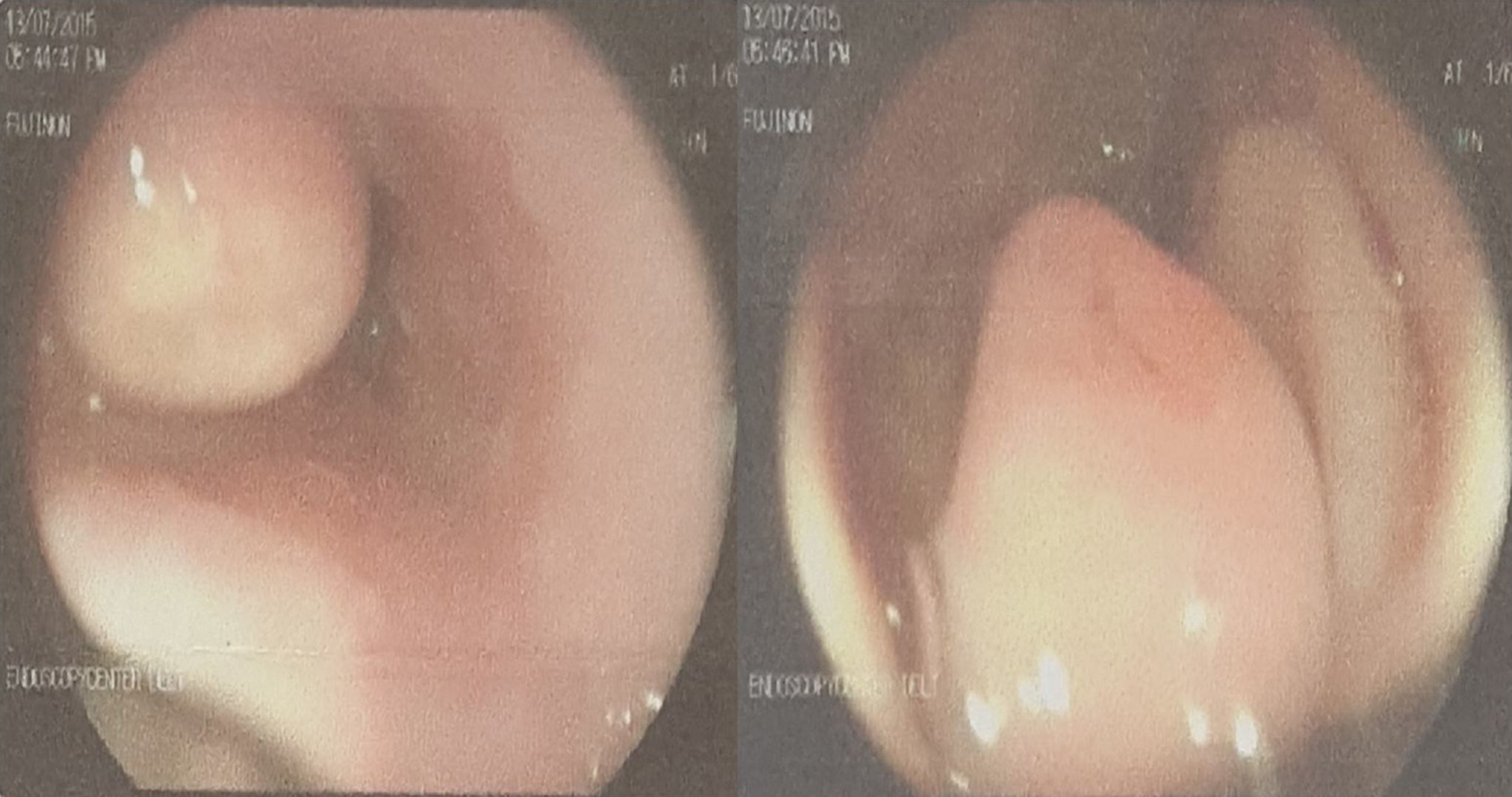
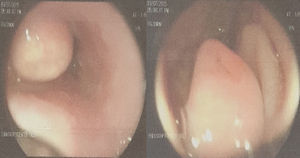
Presentación del casoMujer de 27 años de edad, proveniente de la isla de San Andrés, de ocupación instructora de inglés, con antecedente de hipertensión arterial crónica. Manifiesta que presentó un cuadro clínico hace una semana consistente en episodio de sangrado digestivo alto, atendido en el Hospital de San Andrés, donde le practican endoscopia de vías digestivas altas (EVDA) con hallazgo de masa en el tercio inferior de esófago, gastropatía antral y úlcera duodenal Forrest III (fig. 1). El resultado de la biopsia informa TCG.
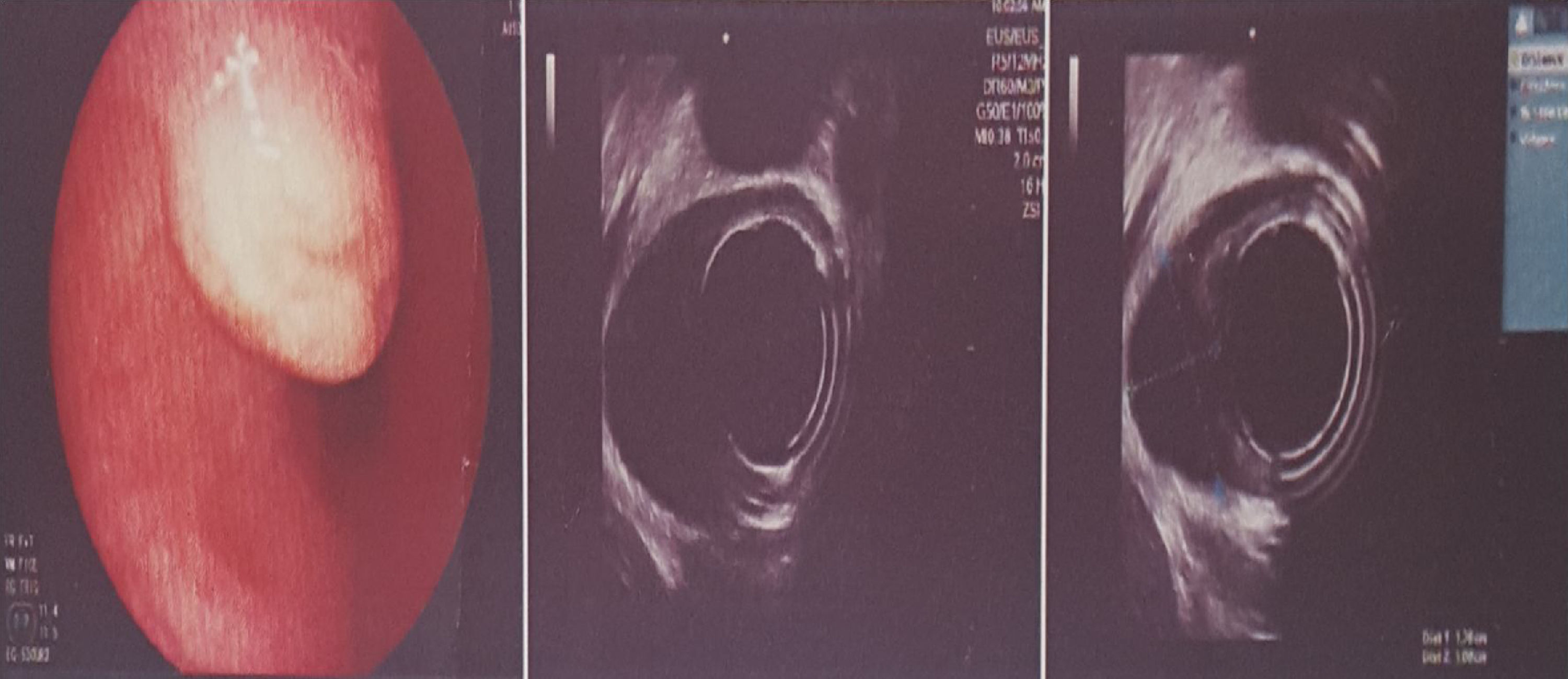
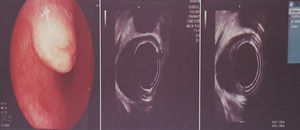
Es valorada en el servicio de gastroenterología del Hospital de San José de Bogotá; la paciente refiere que no ha vuelto a presentar episodios de sangrado digestivo y niega disfagia. La ecosonografía endoscópica (ECE) reporta en esófago inferior: lesión hipoecoica de bordes bien definidos situada en la muscular propia, homogénea, de 1,8×1,1cm. Por el estado asintomático y el resultado de la ECE, se considera seguimiento durante un año con nueva ECE (fig. 2).
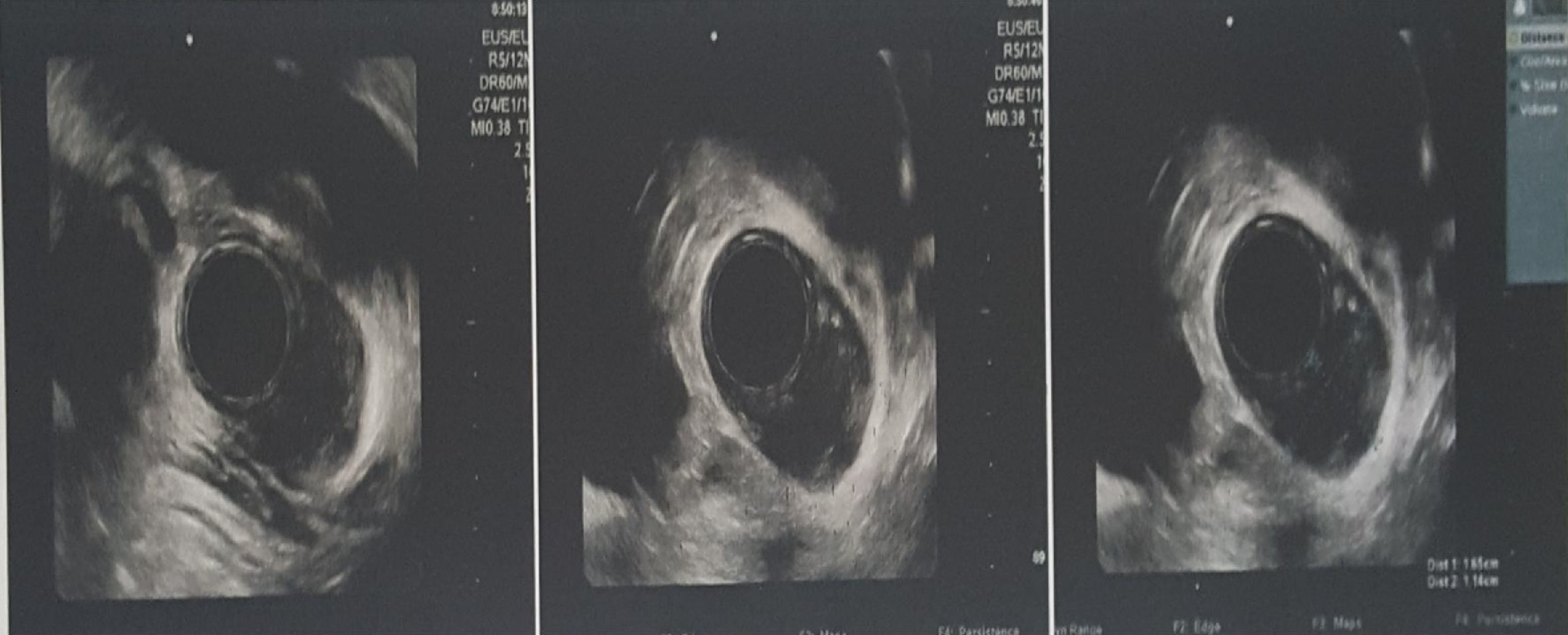
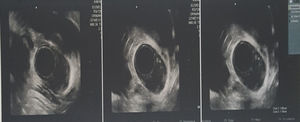
En el nuevo control realizado al año, la paciente niega disfagia, regurgitación o sensación de saciedad temprana y la ECE informa imagen hipoecogénica con centro ecogénico regular, bien definida, que mide 16×11mm y se origina en la muscular propia, con diagnóstico endoscópico de TCG (fig. 3). Dado que la paciente se encuentra asintomática y además sin crecimiento del tumor en comparación con la ECE previa de hace un año, se continúa con seguimiento por 12 meses y tratamiento expectante.
Revisión de la literaturaSe ha llegado a estimar que el TCG se encuentra entre el 0,0019 y el 0.03% de todas las neoplasias a nivel mundial y el 0,4% de las lesiones en esófago6. Las ubicaciones más frecuentes son lengua (40%), piel (30%), mama (15%) y el tracto gastrointestinal (del 2,7% al 8,1%)7. El esófago es el sitio más común en el tracto gastrointestinal, como lo evidencia el estudio de An et al., donde se evaluó a 69 casos de TCG en el esófago, con la localización más frecuente en el esófago distal (52/69 casos, 75%), seguido por el esófago medio (10/69, 15%) y la porción proximal (7/69, 10%)8. Por lo regular, es un nódulo submucoso, aunque se han descrito lesiones multifocales en el 4-30,4% de los pacientes9,10, generalmente benigno, con tasas de malignidad del 1 al 2%, y una supervivencia a 5 años mayor del 35%11.
Es más frecuente en el sexo femenino 2,2:18 y no se ha visto relación con la raza; sin embargo, se ha descrito en gran medida en la población oriental, tal vez por la mayor frecuencia de realización de EVDA12. Su origen histológico no es claro; muchos tipos de células se han postulado incluyendo mioblastos, histiocitos, fibroblastos perineurales, células de Schwann y mesenquimales indiferenciadas; también se han considerado teorías con respecto a la naturaleza no neoplásica de la lesión y su asociación con procesos inflamatorios y degenerativos. En la actualidad, las hipótesis apuntan a que lo hacen a partir de las células de Schwann debido a las características de tinción y por marcaje inmunohistoquímico de la proteína S-10013.
La presentación de síntomas depende del tamaño de la lesión, pero por lo general el hallazgo es incidental ante EVDA por cuadros de sintomatología digestiva alta. Cuando el diámetro del tumor es menor de 1cm, los pacientes pueden experimentar disfagia, distensión abdominal, pirosis y pérdida de apetito14. Con menos frecuencia desarrollan reflujo gastroesofágico, dolor torácico, tos, náuseas y ronquera15.
Durante la evaluación endoscópica se observa como una lesión única pequeña aislada, de consistencia firme y cubierta por mucosa blanquecina o amarillenta intacta. En la mayoría de los casos mide pocos milímetros de diámetro (menos de 1cm), con una presentación menor de 2cm en el 75% de los pacientes, aunque han sido descritos tumores hasta de 10cm de diámetro.
El diagnóstico definitivo se logra por medio de estudios de histopatología con inmunohistoquímica. En el examen macroscópico el color de la superficie suele ser blanco grisáceo, rosa o amarillo, con una elevación polipoide o nodular, sin pedículo, se localiza en la mucosa y submucosa y es poco frecuente la invasión de la capa muscular. Las células tumorales son grandes y de apariencia poligonal, el citoplasma eosinofílico amplio y granular, y los núcleos pequeños, centrales, uniformes con cromatina fina. Las células se organizan formando nidos o acinos7.
La inmunohistoquímica es positiva para S-100, CD68, enolasa específica neuronal y vimentina. El ácido peryódico de Schiff y la tinción de antígeno epitelial de membrana son débilmente positivos. Es negativa para citoqueratina, desmina, actina y CD34 (aunque las células mesenquimatosas que rodean pueden ser positivas para CD34)2,16.
El TCG maligno es muy raro. Sonobe et al. lo clasifican en 2 tipos, uno de los cuales es maligno en la histología y en la clínica, y el otro es clínicamente maligno a pesar de una apariencia histológica benigna17. Fanburg-Smith et al. proponen como criterios de malignidad la presencia de necrosis, núcleos vesiculares con nucléolos grandes, relación núcleo-citoplasma alta, aumento de la actividad mitótica (más de 2 mitosis por 10 campos de gran aumento [200 Å∼ magnificación microscópica]) y pleomorfismo. Aquellos tumores que cumplan con al menos 3 de estos criterios se clasifican como malignos, si tienen uno o 2 son atípicos y cuando solo hay pleomorfismo focal y ninguno de los otros criterios se cumplen, entonces se considera benigno18.
Otros hallazgos indicativos de malignidad son el crecimiento rápido del tumor dado por un tamaño mayor de 5cm de diámetro y más de 2 mitosis en 10 campos de alta potencia, células tumorales en forma de huso con núcleos y nucléolo vesiculares, alta relación de núcleo-citoplasma con pleomorfismo celular y necrosis del tejido tumoral14.
La ECE es muy útil en el diagnóstico y la evaluación del tamaño, la ubicación y las capas infiltradas, así como para la toma de biopsias, proporcionando precisión de diagnóstico entre el 97 y el 100%19. Los tumores se observan como lesiones hipoecoicas, homogéneas y lisas, por lo regular recubiertos por mucosa normal. Los valores promedio de escala de grises de los TCG son mayores que los del leiomioma, lo que puede ayudar al diagnóstico diferencial20,21. Cuando el tumor invade las capas externas del esófago, la ECE puede contribuir a la planificación de la resección quirúrgica22.
Los diagnósticos diferenciales incluyen los tumores del estroma gastrointestinal, leiomioma, schwannoma, neurofibroma y xantoma. Las características diferenciales se presentan en la tabla 123,24.
Características de tumores diferenciales de TCG
| Tipo de tumor | Localización anatómica | Características celulares | Inmunohistoquímica |
|---|---|---|---|
| GIST | Raro en esófago | Células redondas y dispuestas en fascículo | Positiva para CD117 y CD34 |
| Leiomioma | Predominan en el esófago | Células fusiformes moderados con citoplasma eosinófilo, dispuesto en carretera y/o en patrón de tejido. Los núcleos son en forma de barra o de cigarro | Positiva para SMA y desmina, y negativas para CD34 y CD117 |
| Schwannoma | Más común en estómago | Tiene una cápsula completa. Las células tumorales son en forma de huso o estrelladas | Positiva para S-100 |
| Neurofibroma | Compuesto de células fusiformes delgadas y largas, con forma ondulada y citoplasma pálido | Negativa para CD68 | |
| Xantoma | Más común en estómago | Células redondas o poligonales con citoplasma pálido. Los núcleos son redondos, pequeños y se encuentra en el centro de las células | Positiva para CD68 y negativas con PAS |
GIST: tumores del estroma gastrointestinal; PAS: peryódico de Schiff.
En la actualidad, no existe un consenso sobre el tratamiento. Dada la baja incidencia, son pocos los estudios que discuten el manejo de estas lesiones y la información disponible proviene de casos aislados o de pequeñas series de pacientes, sin contar con estudios aleatorios para comparar las diferentes opciones terapéuticas25. Se ha indicado resecar los tumores sintomáticos, mayores de 10mm, que crecen rápido y con características histológicas indicativas de malignidad. Mientras que los tumores pequeños y asintomáticos (menores de 10mm) pueden ser objeto de seguimiento con ECE de manera anual26,27.
El tratamiento endoscópico se está utilizando cada vez más como una alternativa a la resección quirúrgica tradicional, ya que es menos invasiva y las tasas de complicación pueden ser menores que la cirugía. Dentro de las posibilidades endoscópicas se encuentran la resección mediante fulguración con láser o argón plasma; sin embargo, tienen la desventaja de ser unas técnicas costosas y en desuso, además de que la fulguración con argón impide realizar un análisis histológico completo de la lesión tumoral, siendo la mucosectomía endoscópica el procedimiento actual de elección28.
Los criterios considerados para la práctica de mucosectomía son los siguientes: tamaño del tumor menor de 2cm; que no comprometa la capa musculara propia de la pared esofágica (valorado por ECE) y la ausencia de criterios anatomopatológicos de malignidad. Las complicaciones pueden incluir perforación (0,7-2,5%), hemorragia digestiva alta (0-24%) mediastinitis, abscesos y estenosis29. Es importante realizar seguimiento endoscópico al menos 3 semanas después de la ME para valorar la curación completa, la posible existencia de lesiones residuales o la recurrencia (observada en el 5 al 10% de los casos).
El tratamiento quirúrgico se asocia a una mortalidad más elevada, dado que se lleva a cabo a través de toracotomía. Hasta hace unos pocos años era la única alternativa posible en vez del tratamiento conservador, pero hoy día se recomienda solo si se han tomado en consideración los criterios de malignidad junto con la invasión de la capa profunda, múltiples tumores sintomáticos o cuando el tratamiento endoscópico ha sido contraindicado30.
ConclusionesEs importante el conocimiento de las características, los comportamientos y las estrategias de manejo del TCG. Como se ha descrito, muchos de estos son asintomáticos y estables durante el seguimiento, por lo que no necesitan tratamientos agresivos. En cambio, los sintomáticos y de mayor tamaño o en crecimiento requieren una caracterización y un estudio más cuidadoso, con lo que la ECE es una herramienta útil que guía la toma de decisiones terapéuticas.
Con la creciente realización de EVDA en nuestro país secundaria a la alta incidencia de cáncer gástrico, es posible encontrar un mayor número de casos de este tumor, por lo que se debe contar con protocolos de manejo, evitando la realización de procedimientos invasivos innecesarios. Se requieren estudios aleatorizados para definir adecuadamente el manejo óptimo de esta patología, así como la respuesta terapéutica y la supervivencia en nuestra población.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.