Está bem descrito na literatura o padrão de cultivo de células da granulosa (CG) humanas que perpetua a luteinização, simulando a fase lútea do ciclo. Nesse sistema, há redução na secreção de estradiol (E2) e aumento na síntese de progesterona (P4) e relaxina (RLN). Objetivamos padronizar um sistema de cultura livre de soro, com o intuito de reverter o processo de luteinização de CG obtidas em ciclos de fertilização in vitro (FIV), pré‐luteinizadas pela gonadotrofina coriônica humana (hCG), para aplicação na maturação in vitro de folículos ovarianos pré‐antrais. Foi feito estudo experimental com GC obtidas de 10 mulheres em tratamento de reprodução assistida. As CG foram cultivadas em α‐MEM contendo IGF‐I, ITS, androstenediona, PVP‐40 (meio quimicamente definido) ou TCM‐199 contendo FSH/soro. Após 48, 96 e 144 horas, foram avaliados: morfologia das culturas, produção de E2, P4 (Quimioluminescência/Immulite), RLN (Elisa) e ultraestrutura (Microscopia Eletrônica). Os dados foram analisados por Anova e regressão linear com efeitos mistos (SAS versão 9.0). Células cultivadas em α‐MEM apresentam alta capacidade estrogênica e padrão de produção hormonal característico da fase folicular, mantendo características morfológicas/ultraestruturais semelhantes a células in vivo. No sistema de cultura padronizado, as CG não completam in vitro o processo de luteinização deflagrado pela hCG, assumindo fenótipo de fase folicular.
It is well described in the literature the granulosa cells (GC) culture pattern that perpetuates human luteinizing simulating the luteal phase of the cycle. In this system, there is a reduction in the secretion of estradiol (E2) and increased synthesis of progesterone (P4) and relaxin (RLN). We aim to standardize a serum‐free culture system, in order to reverse the luteinization process of GC obtained in IVF cycles, pre‐luteinized by hCG, for use in in vitro maturation of preantral ovarian follicles. An experimental study was conducted with GC obtained from 10 women undergoing treatment for assisted reproduction. The GC were cultured in α‐MEM containing IGF‐I, STI, androstenedione, PVP‐40 (chemically defined medium) or TCM‐199 containing FSH/serum. After 48, 96 and 144h were analyzed: culture morphology, concentrations of E2, P4 (Chemioluminescence/Immulite), and RLN (Elisa), and ultrastructure (Electron Microscopy). Data were analyzed by Anova and linear mixed‐effects regression (SAS version 9.0). Cells cultured in α‐MEM present estrogenic capacity and pattern of hormone production characteristic of the follicular phase, maintaining morphological/ultrastructural features similar that in vivo cell. In standard culture system, the CG not completes in vitro luteinization process triggered by hCG, assuming follicular phase phenotype.
As células da granulosa (CG) sofrem profundas alterações morfológicas e funcionais ao longo do desenvolvimento folicular devido à complexa dinâmica do folículo e apresentam distintos graus de diferenciação de acordo com sua localização folicular, estádio de crescimento do folículo ovariano e também de acordo com a fase do ciclo menstrual. Os primeiros eventos de diferenciação das CG durante o desenvolvimento folicular incluem mobilização de colesterol (COL), reorganização do complexo de Golgi, lisossomos, gotas lipídicas e retículo endoplasmático liso e rugoso,1,2 os quais promovem o transporte e o armazenamento intracelular do COL para sua conversão a hormônios esteroides.1
Essas mudanças ultraestruturais são acompanhadas pela expressão das enzimas P450 aromatase e P450 scc.3 Os últimos eventos associam‐se diretamente ao estabelecimento do processo de esteroidogênese e consistem em mudanças estáveis na estrutura e na forma das CG (forma poliédrica, com baixa razão citoplasma/núcleo), formação abundante de junções do tipo Gap e formação de cristas trabeculares dispostas nas mitocôndrias.2,4
Após a ovulação, as CG do folículo pré‐ovulatório transformam‐se em CG luteínicas, originando o corpo lúteo. Essas células tornam‐se hipertrofiadas, sofrem modificações ultraestruturais e secretam grandes quantidades de progesterona, típicas da fase lútea do ciclo. As CG luteínicas apresentam ultraestrutura típica de células esteroidogênicas, com retículo endoplasmático liso abundante, mitocôndrias com cristas tubulares, ribossomos, acúmulo de numerosas gotas lipídicas contendo ésteres de colesterol no citoplasma, superfície celular com numerosas expansões e protuberâncias.5 Além de haver um rearranjo do citoesqueleto, há uma diminuição das junções Gap.6,7
Culturas de células da granulosa têm sido rotineiramente usadas para estudo da diferenciação in vitro de células ovarianas e para aplicações na tecnologia de reprodução assistida (TRA) como suporte para a maturação in vitro (MIV) de oócitos e cultivo embrionário.8 Contudo, os sistemas de cultura de CG desenvolvidos nas últimas duas décadas têm sido caracterizados por um consistente declínio na produção de estradiol com o tempo de cultura,9,10 enquanto a síntese de progesterona aumenta, sugerindo início de luteinização. Além disso, as CG só respondem a concentrações farmacológicas de FSH.
Quanto à suplementação proteica nesses sistemas de cultura, a prática usual tem sido a adição de soro ao meio. Como o soro promove a adesão das CG à superfície da placa de cultura, vários estudos usam o soro recobrindo a placa de cultura antes de semear as células, adicionando‐o ao meio nas primeiras horas de cultivo ou durante todo o período em baixas concentrações.11–14 Células da granulosa humanas obtidas nos ciclos de fertilização in vitro (FIV) e cultivadas em meio suplementado com soro têm mostrado luteinização em cultura14 e, consequentemente, têm sido usadas como modelo para simular células granulosas luteínicas, do corpo lúteo.15 Vale ressaltar que a obtenção dessas células é feita após o uso do hCG para simulação do pico de LH e indução da maturação oocitária. A produção endócrina dessas culturas, portanto, é característica da segunda fase do ciclo e não pode ser comparada à função endócrina da fase folicular.
Sistemas de cultura de CG livres de soro foram descritos pela primeira vez por Campbell e Webb em 1996 com CG ovinas16 e, posteriormente, CG bovinas.13 Nesses sistemas de cultura a produção de estradiol pode ser induzida e mantida em resposta a concentrações fisiológicas de FSH, IGF‐I e/ou insulina com aumento das respostas proliferativa e estrogênica até 144 horas de cultura. Além da capacidade estrogênica das CG e do padrão normal de produção hormonal característico da fase folicular do ciclo, as CG mantêm in vitro características ultraestruturais semelhantes a células in vivo, agregando‐se em cachos (clusters) sustentados por CG alongadas com aspecto semelhante a fibroblastos.2
O mecanismo de ação pelo qual as células de cocultura atuam na maturação e na capacitação do oócito in vitro e no desenvolvimento dos embriões é ainda discutível, mas nos sistemas de cultivo embrionário inclui a possibilidade de desintoxicação do meio pela remoção de íons de metais pesados, hipoxantina ou radicais livres e pela secreção de substâncias embriotróficas, como fatores de crescimento.17,18
O tema central deste estudo é a aquisição de conhecimentos sobre a diferenciação in vitro de CG humanas, a caracterização do perfil esteroidogênico das CG cultivadas em meio livre de soro e proteína e o estabelecimento de um modelo de cultura de CG suporte para a MIV de oócitos humanos em estágio de vesícula germinativa nos procedimentos de reprodução assistida (RA) e de folículos ovarianos pré‐antrais para aplicação em programas de preservação de fertilidade.
Para tal, os resultados pretendidos devem ser gerados a partir da comparação de estudos in vivo e in vitro, mimetizando a fisiologia endócrina reprodutiva. In vivo, em resposta ao pico ovulatório de LH, as células do folículo pré‐ovulatório são submetidas à sua etapa final de diferenciação e luteinizam. O comportamento de segunda fase não é adequado para a MIV, uma vez que até alcançar a maturidade o oócito secreta fatores inibidores de luteinização, a fim de evitar a luteinização precoce do folículo.19,20
A recuperação de oócitos imaturos para subsequente maturação in vitro e fertilização é no momento uma opção viável para as técnicas de RA. Com o uso de menores doses de gonadotrofinas para a estimulação ovariana, a MIV evita os efeitos colaterais e minimiza custos para os pacientes. Recentemente, foi proposta a combinação entre ciclo natural de FIV e MIV de oócitos imaturos como um enfoque em potencial para o tratamento da infertilidade. Mais recentemente, com as modalidades propostas para preservação de fertilidade em pacientes com risco de falência ovariana precoce ou portadoras de doenças neoplásicas e que serão submetidas à quimioterapia, desenvolveu‐se a técnica de congelamento de tecido ovariano.8 Nesses casos, quando da remissão da doença, há a possibilidade de se reimplantar o tecido congelado (autoenxerto) ou proceder‐se à extração de folículos desse tecido, os quais certamente são imaturos, e maturá‐los in vitro para posterior procedimento de RA.
As técnicas atualmente disponíveis de MIV são ainda bastante limitadas. Acreditamos que o desenvolvimento de um sistema de cocultivo de células da granulosa e oócitos possa mimetizar o estado fisiológico do microambiente ovariano e melhorar os resultados de MIV. Os padrões de cultivo de células da granulosa humanas atualmente descritos trabalham com células granuloso‐luteínicas, ou seja, que já sofreram ação do LH e têm perfil de produção hormonal desfavorável para o crescimento de folículos nos estágios mais precoces do seu desenvolvimento. Assim, este estudo propôs padronizar um método de cultivar células da granulosa humanas em meio sem soro e albumina, ou seja, meio quimicamente definido, que acreditamos ter a capacidade de promover a reversão dessa luteinização, ao menos parcialmente.
O propósito do presente estudo foi investigar a função esteroidogênica pós‐hCG das CG antrais, obtidas de aspirados de fluido folicular de pacientes submetidas à RA, em meio de cultura livre de soro e proteína (quimicamente definido), e padronizar um modelo de cultura de CG humanas cuja produção endócrina seja representativa da fase folicular ou estrogênica do ciclo menstrual, com produção mantida de E2 e P4 e alta relação E2/T ou E2/P4.
Portanto, para comprovar essa reversão, total ou parcial, analisamos comparativamente o comportamento das células da granulosa obtidas de mesmo pool folicular semeando‐as em dois meios de cultivo: o meio padrão (TCM‐199 suplementado com soro) e o novo meio proposto (quimicamente definido, α‐MEM), determinando a morfologia celular após o cultivo, as características ultraestruturais das CG por microscopia eletrônica de transmissão, o perfil de produção hormonal (proporções de estradiol e progesterona) e a secreção de RLN, um polipeptídeo produzido pelo corpo lúteo, como marcador de luteinização.
MétodoPacientesO estudo foi aprovado pelo Comitê de Ética do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (Processo n° 7474/2008). Foi feito um estudo experimental com CG humanas obtidas de aspirados de fluido folicular destinados ao descarte, resultantes da captação de oócitos em ciclos de reprodução assistida de pacientes tratadas no Serviço de Reprodução Humana do hospital.
As pacientes foram incluídas neste estudo de acordo com seguintes critérios: idade entre 18 a 40 anos; ciclos ovulatórios; FSH menor do que 12 UI; indução de ovulação com FSH em associação com LH ou hCG; indicação de reprodução assistida por fator de infertilidade masculino ou tubário e assinatura do TCLE (Termo de Concordância Livre e Esclarecido). Os critérios de exclusão foram: presença de endocrinopatias, como hiperplasia adrenal congênita, hiperprolactinemia e doenças tireoideanas, ainda que compensadas, e pacientes com endometriose ou com falhas de fertilização em ciclos anteriores.
Dentre outros critérios de exclusão considerou‐se o uso de medicamentos que sabidamente afetam a função reprodutiva ou metabólica, como tratamento com glicocorticoides ou antiandrogênios por um período mínimo de 60 dias antecedentes ao início da indução.
Hipestimulação ovariana controlada (HOC)As pacientes receberam anticoncepcional oral de baixa dosagem (Etinilestradiol 20+Gestodeno 75), iniciado entre o primeiro e o quinto dia do ciclo precedente ao ciclo de indução e até cinco dias antes da data programada para iniciar a indução com gonadotrofina no ciclo anterior para programação da menstruação.
O bloqueio hipofisário foi feito com análogo do Hormônio Liberador das Gonadotrofinas (GnRHa) (Acetato de Nafarelina – Synarel® – Pfizer) por via nasal, com uma borrifada a cada 12 horas iniciada na fase lútea do ciclo anterior (10 dias antes do início da indução) e mantida até o dia da administração da gonadotrofina coriônica humana (hCG).
No dia programado para o início da indução da ovulação, a paciente foi submetida a exame de ultrassonografia, com a finalidade de avaliar os ovários e a anatomia uterina. Para a indução foi administrado FSH recombinante (Gonal® – Laboratório Serono – ou Puregon® – Laboratório Organon) em doses variáveis, de acordo com a resposta da paciente, por via subcutânea (SC) sempre às 18 horas. O ajuste de dose foi feito com base no recrutamento e no crescimento folicular acompanhados pela ultrassonografia transvaginal seriada. Na presença de pelo menos dois folículos com diâmetro superior a 17mm, foi administrado hCG recombinante (Ovidrel®) na dose de 250μg às 22 horas. Após um intervalo de 34 a 36 horas, os oócitos foram captados.
Coleta do fluido folicularTodos os folículos com diâmetro superior a 14mm foram puncionados e aspirados. A aspiração dos folículos foi obtida por uma pressão constante de 100mm de mercúrio (mm Hg) com controle eletrônico (Labotect GmbH, modelo 3014). O fluido aspirado foi coletado em tubos estéreis de polipropileno (Falcon‐Costar) previamente aquecidos e mantidos a temperatura de 37°C e, em seguida, identificados e enviados para a sala em anexo (Laboratório de Fertilização in vitro), aos cuidados de uma embriologista, para identificação e retirada dos oócitos. O aspirado folicular contendo as CG foi enviado imediatamente para os procedimentos preparatórios para o cultivo celular.
Recuperação das células da granulosa do aspirado folicularO aspirado folicular total de cada paciente foi transferido para tubo Falcon de 15mL contendo 2mL de PBS acrescido de antibiótico/antimicótico e mantido em gelo. Em seguida, o conteúdo folicular foi vertido para placa de Petri estéril de 60mm e após sedimentação das células sanguíneas recuperaram‐se rapidamente os grumos de CG com auxílio de micropipeta e microscópio estereoscópio. Finalmente, foram transferidas para tubo Falcon de 15mL e centrifugadas a 1.500rpm por 10min a 4°C. Após centrifugação, o pellet foi ressuspendido em 1mL de meio α‐MEM, as CG foram suavemente depositadas sobre a coluna de Histopaque e centrifugadas a 2.000rpm por 20 minutos a 4°C. A camada de CG visível na interface foi isolada lentamente por pipetagem e as CG foram lavadas em 2ml de PBS e centrifugadas a 2.000rpm por 10min a 4°C. Em seguida, o pellet foi ressuspendido em 100μL de meio α‐MEM ou TCM previamente equilibrado em incubadora de CO2. Foi retirada amostra da suspensão celular para determinação da concentração e do número de células viáveis.
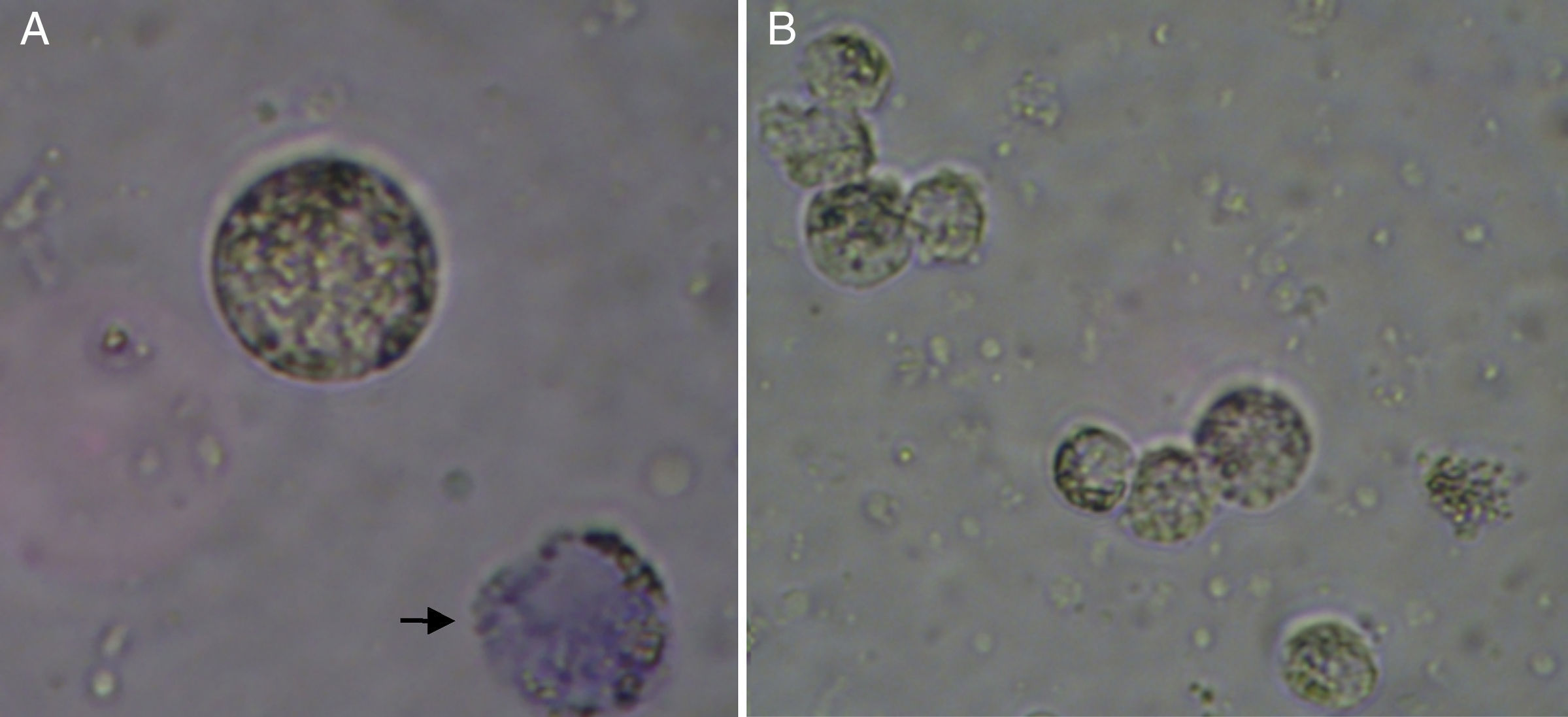
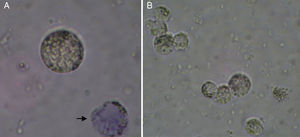
Determinação da concentração e da viabilidade das células da granulosaA concentração celular e o índice de viabilidade foram determinados pelo método de exclusão do Azul de Trypan. Resumidamente, uma amostra da suspensão celular foi diluída (1:10) em solução a 0,2% de Azul de Trypan (Trypanblau, Merck, Alemanha) e analisada em câmara de Newbauer. A viabilidade foi estimada dividindo‐se o número de células viáveis pelo número total de células. De acordo com os princípios da técnica, as células mortas mostram‐se coradas pelo Azul de Trypan, enquanto as células vivas permanecem não coradas, com aspecto refringente à visualização em microscópio óptico (fig. 1).
Cultivo das células da granulosaMeios de culturaForam usados dois sistemas de cultura:
- 1)
TCM 199 (sistema convencional – controle): meio TCM‐199 (Invitrogen‐Gibco BRL), suplementado com 10% de soro fetal bovino inativado a 56° C durante 30 minutos, 0,5μg/mL de FSH (Folltropin‐Bioniche Canadá, London, ON, Canadá) e 2mM de glutamina (Sigma Chemical Co., St. Louis, MO, USA).
- 2)
α‐MEM (sistema quimicamente definido): meio α‐MEM (Invitrogen‐Gibco BRL) acrescido de suplementação específica para estimular a capacidade estrogênica das CG (Pedido de patente enviado à Agência USP de Inovação). As células foram cultivadas a 37°C em atmosfera úmida com 5% de CO2 durante 144 horas. A cada 48 horas, os meios de cultura foram renovados e coletados para as dosagens de E2, P4 e RLN.
As células foram plaqueadas nas concentrações de 20.000 ou 40.000 células viáveis em cada poço da placa de cultura contendo 200μL de meio previamente equilibrado, em duplicata para cada concentração celular e tratamento (meio de cultura). As células foram cultivadas em placas de cultura de 96 poços em meio TCM‐199 ou α‐MEM a 37°C em atmosfera úmida com 5% de CO2 durante 144 horas. A cada 48 horas, os meios de cultura foram renovados.2
Avaliação morfológica e ultraestruturalPara a fixação das células para a microscopia eletrônica de transmissão, os meios de cultura foram substituídos por meio recém‐preparado com 120 horas de cultivo e as células fixadas após 24 horas. Foram feitas primeiramente as etapas de lavagem com PBS e tampão cacodilato 0,1M (pH 7,4) e logo em seguida as células foram fixadas com 2% de glutaraldeído, 2% de formaldeído e 0,05% de CaCl2 em PBS com Ca2+/Mg2+.
Em seguida as amostras foram pós‐fixadas com tetróxido de ósmio 1% feito em tampão cacodilato 0,1M (pH 7,4), contrastadas com acetato de uranila 0,5%, desidratadas em séries crescentes de etanol P.A (Merck), incluídas em resina. Foram montados os blocos e confeccionadas lâminas com cortes de meio micra e coradas com Azul de Toluidina. Após exame das células em microscopia de luz, as amostras emblocadas e bem preservadas foram processadas. Foram feitos cortes ultrafinos (60nm) para montagem das grades de cobre e contrastadas com acetato de uranila 0,5% e citrato de chumbo para posterior análise da ultraestrutura.
Dosagens hormonaisApós 48, 96 e 144 horas de cultivo, os meios de cultura foram coletados e mantidos a ‐20°C até a análise. A concentração de estradiol e progesterona nas amostras dos meios de cultura foi determinada pelo método de quimioluminescência, usando kit comercial (DPC, Immulite System, Los Angeles, CA, USA), de acordo com instruções do fabricante. As análises foram feitas em duplicata, sem extração, e cada esteroide foi analisado em um único ensaio para evitar variação entre‐ensaios.
Os coeficientes de variação intraensaio foram menores do que 15% para o E2 e 10% para P4. As sensibilidades analíticas dos kits de estradiol e de progesterona foram de 15 pg/mL e 0,1 ng/mL, respectivamente. A relaxina foi dosada por Elisa, usando kit comercial (Enzime‐linked Immunosorbent Assay Kit for Human Relaxin, USCN Life Science, USA). Os ensaios foram feitos no Laboratório de Ginecologia e Obstetrícia do hospital.
Análise estatísticaOs dados da concentração de esteroides e relaxina nos meios de cultura foram analisados por Anova e teste de regressão linear de efeitos mistos usando o procedimento GLM (PROC GLM) do software SAS® 9.0. Os dados são apresentados como média e desvio‐padrão e o nível de significância adotado foi de 5% (α=0,05).
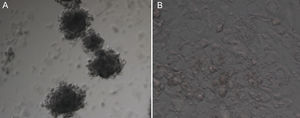
ResultadosCaracterização morfológica da culturaα‐MEMNesse sistema de cultura, as células crescem em suspensão, formando clusters de células justapostas com fenótipo semelhante às CG in vivo (fig. 2A). As CG desses agregados mantêm a forma poliédrica e apresentam‐se fortemente compactadas (fig. 2A).
Padrão de crescimento de células da granulosa humanas cultivadas em sistema de cultura convencional ou quimicamente definido. A, crescimento característico em suspensão (clusters) das células da granulosa cultivadas no meio α‐MEM; B, monocamada de células da granulosa em cultivo no meio TCM‐199. Microscópio Invertido acoplado a Micromanipulador Nikon Diaphot 300. 200X.
As características celulares nesse sistema de cultivo são bem descritas na literatura. Por causa da adição de soro, as CG crescem formando monocamadas aderentes ao fundo da placa de cultura (fig. 2B) e apresentam aspecto de fibroblastos.
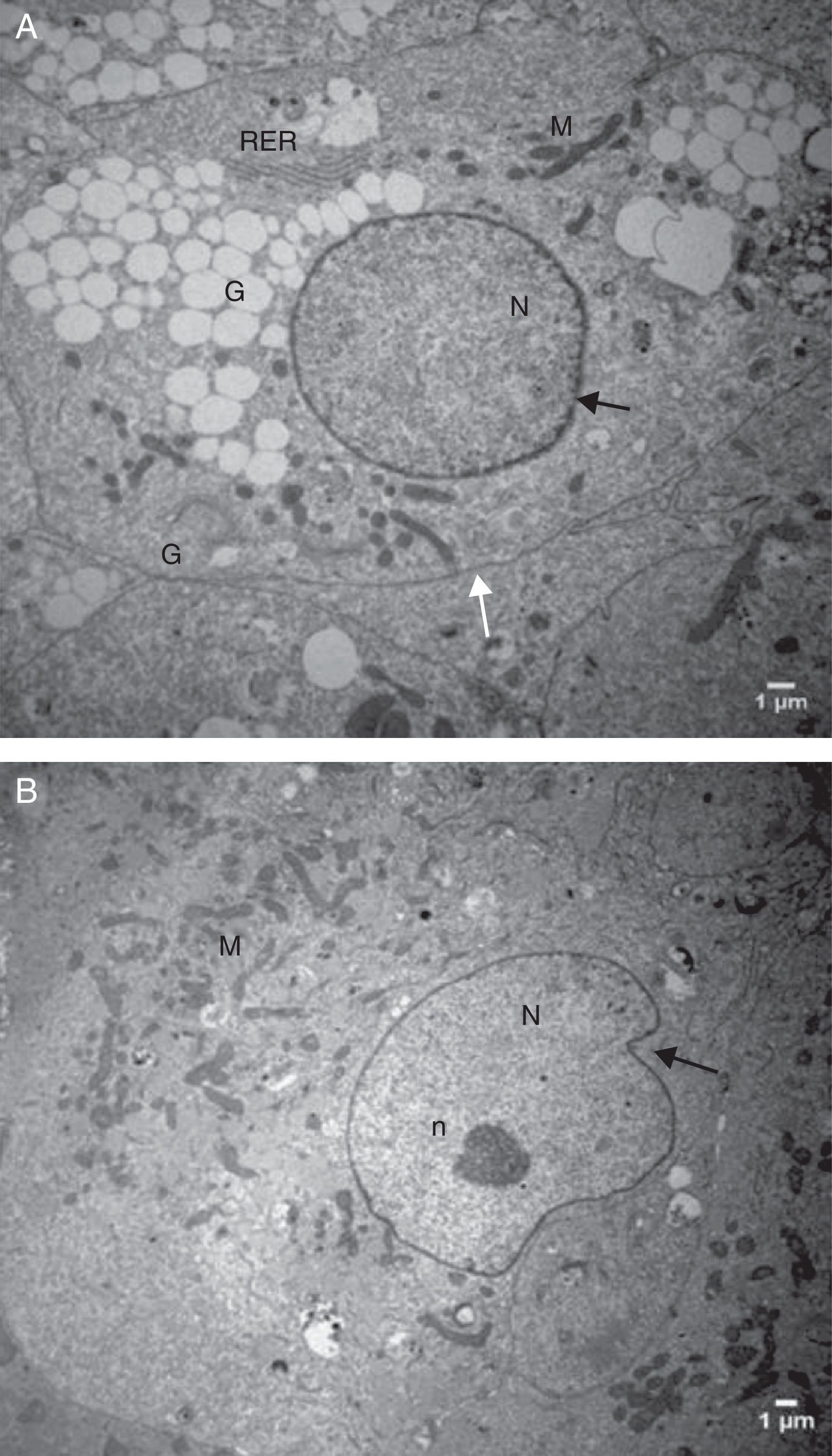
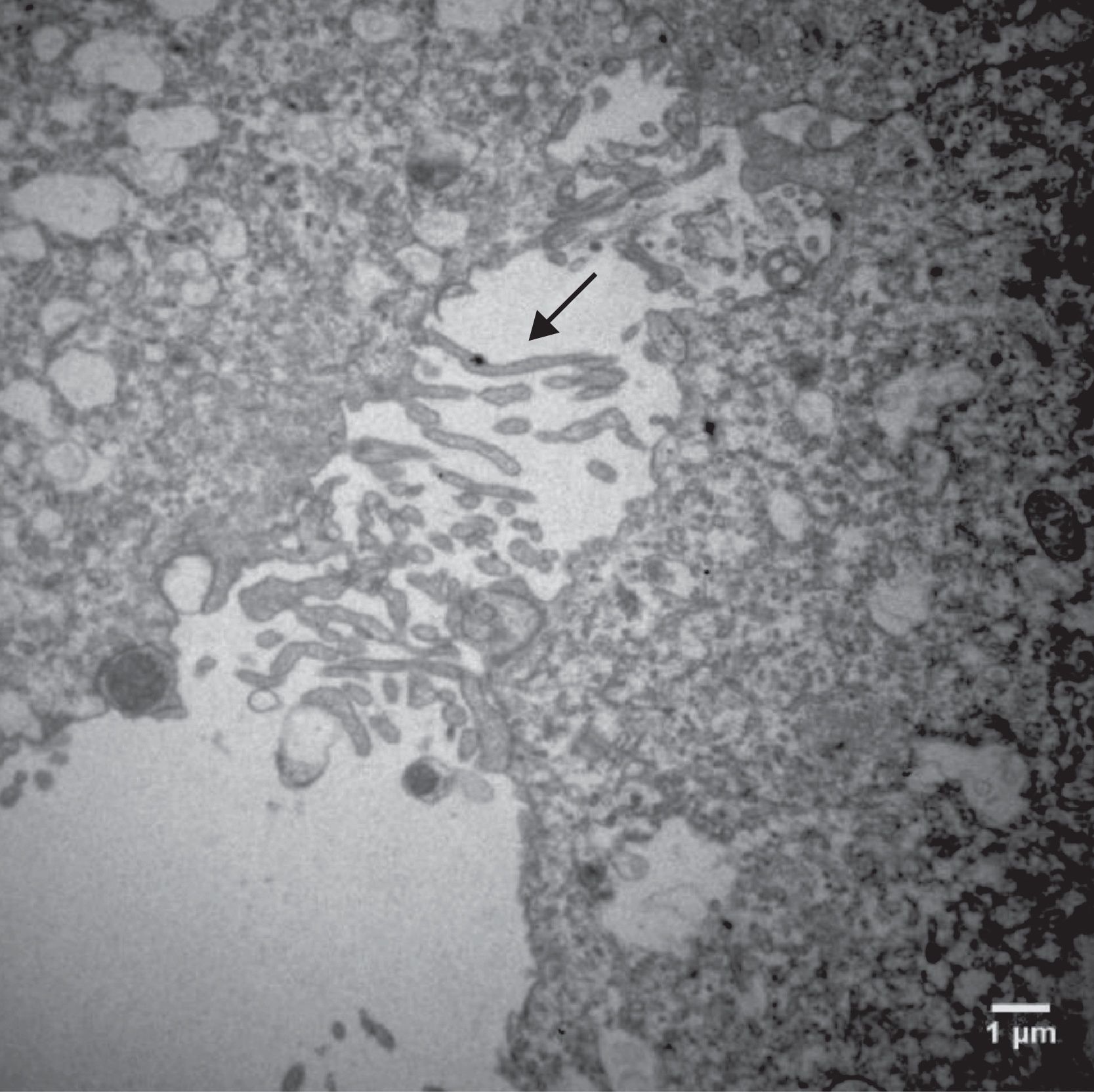
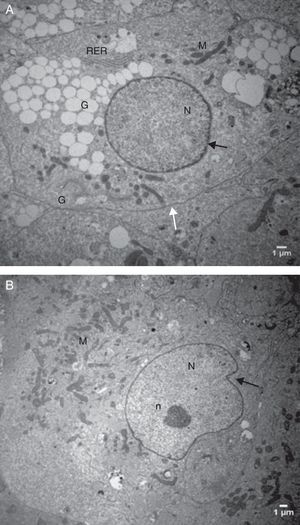
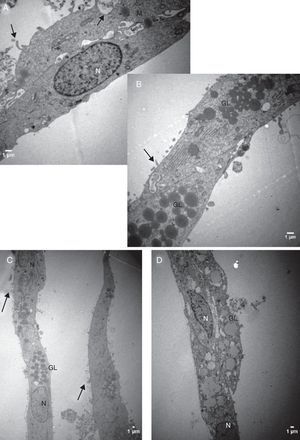
Análise descritiva da ultraestrutura das células da granulosaFormato celularCélulas da granulosa cultivadas em α‐MEM apresentaram formato predominantemente poliédrico (fig. 3). Em contraste, as células cultivadas em TCM‐199 apresentaram formato alongado, semelhante a fibroblasto (fig. 4), característica morfológica sugestiva de início de luteinização.
Eletromicrografias de CG cultivadas em meio α‐MEM (144 h). A, notar forma poliédrica da célula, organelas e membrana nuclear bem evidente. B, observar a presença de núcleo bem desenvolvido e nucléolo (seta). N, núcleo; n, nucléolo; M, mitocôndria; GL, gota lipídica; RER, retículo endoplasmático rugoso; G, complexo de Golgi. ME: A, 6.700X; B, 5.000X.
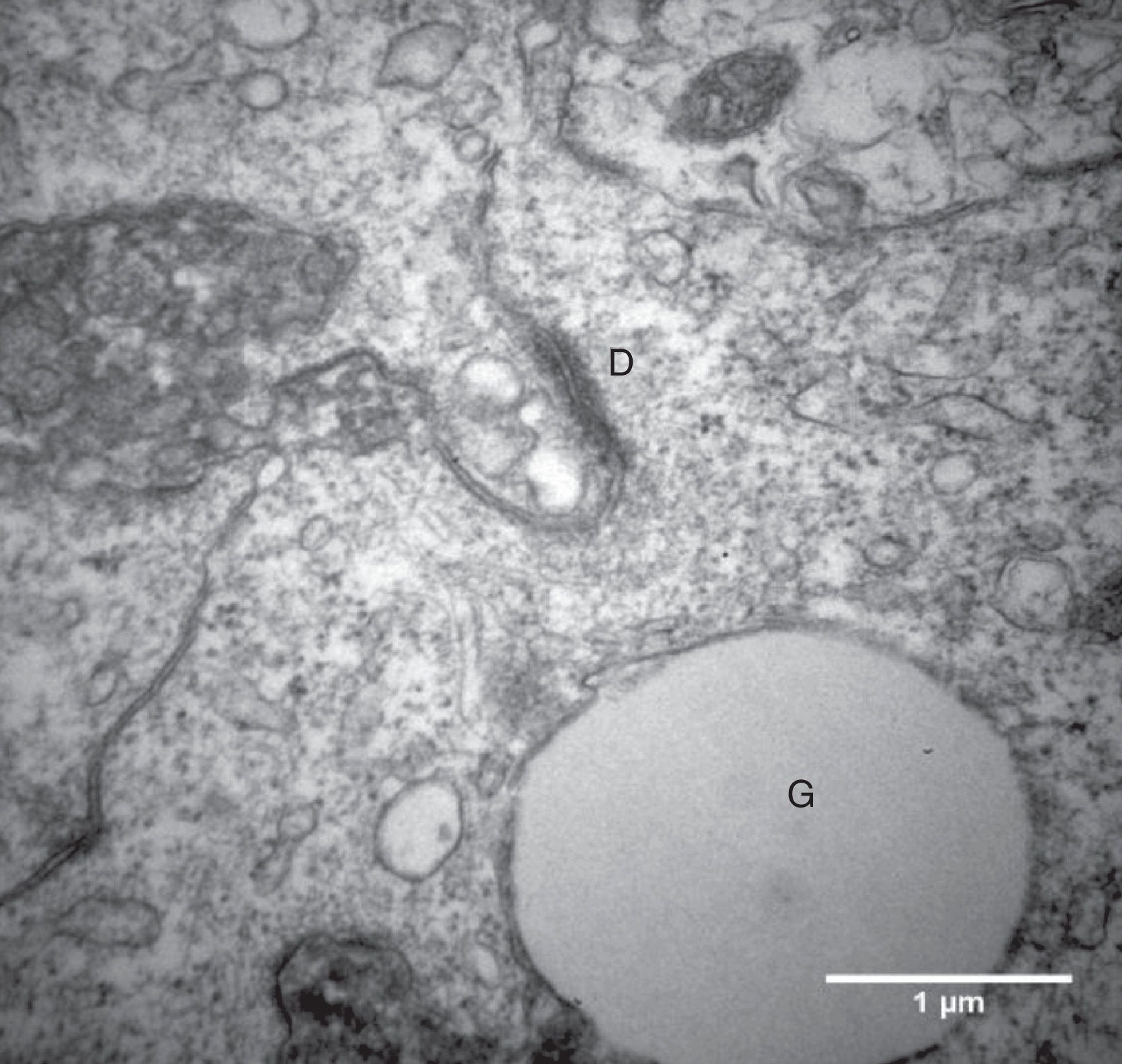
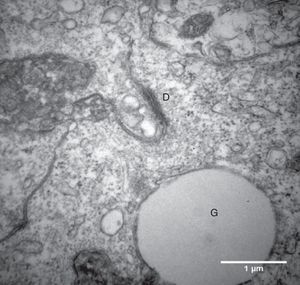
Por causa da característica de formarem clusters de células fortemente compactadas e aderidas entre si, observamos, na maioria das eletromicrografias, a presença de muitas interdigitações de membrana, áreas de comunicação celular e estruturas de junção celular responsáveis pela forte adesão entre as células, como, por exemplo, os desmossomos (fig. 4).
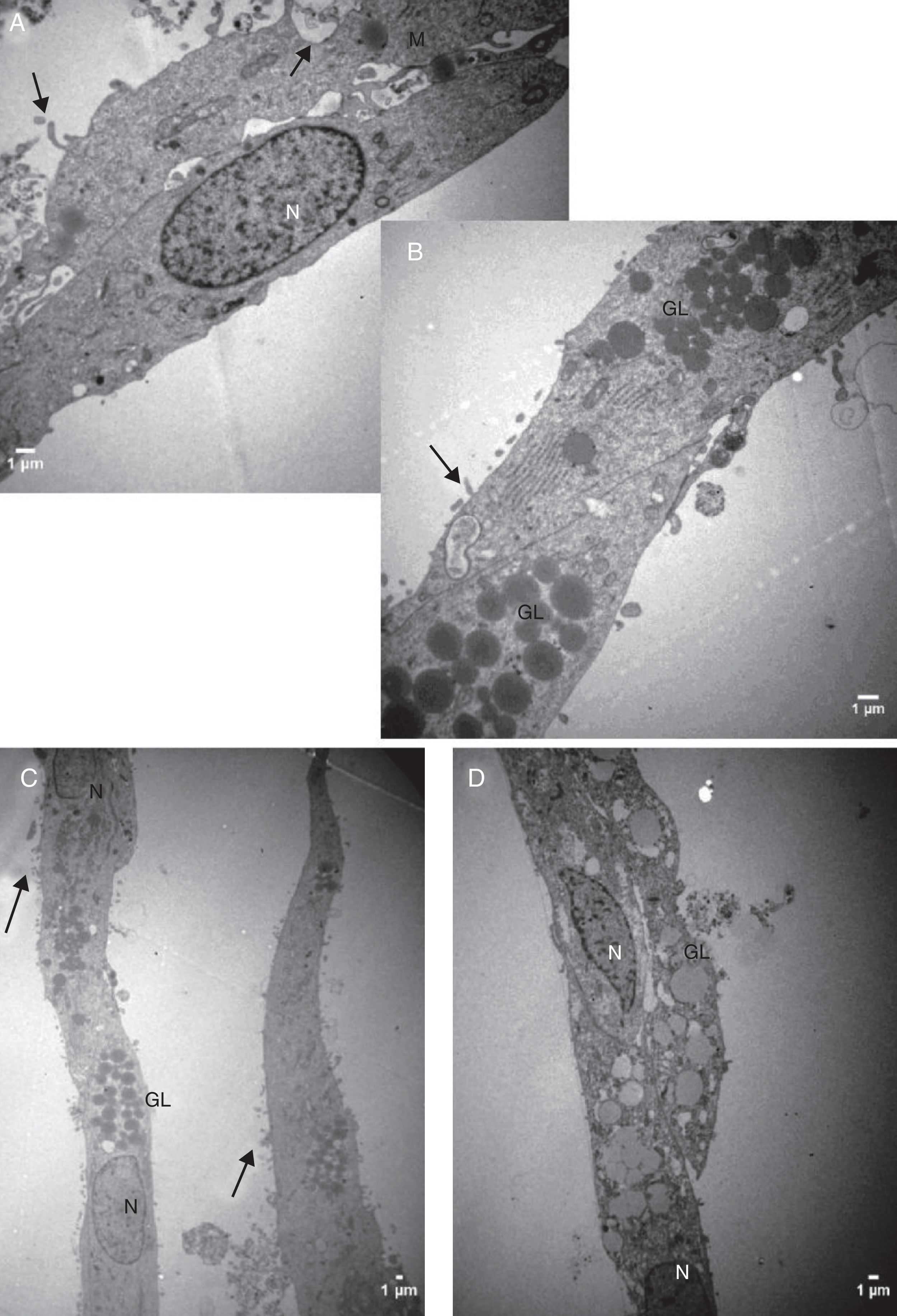
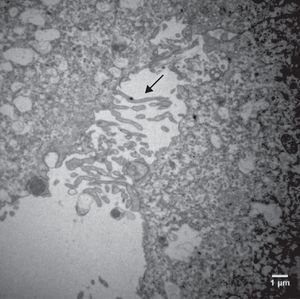
Características ultraestruturais das células cultivadas em meio TCM‐199Diferentemente das CG cultivadas no meio α‐MEM, as CG cultivadas no meio TCM‐199 apresentaram membrana citoplasmática irregular por causa de inúmeras microvilosidades, evaginações e protrusões pleomórficas sugestivas de luteinização (figs. 5 e 6).
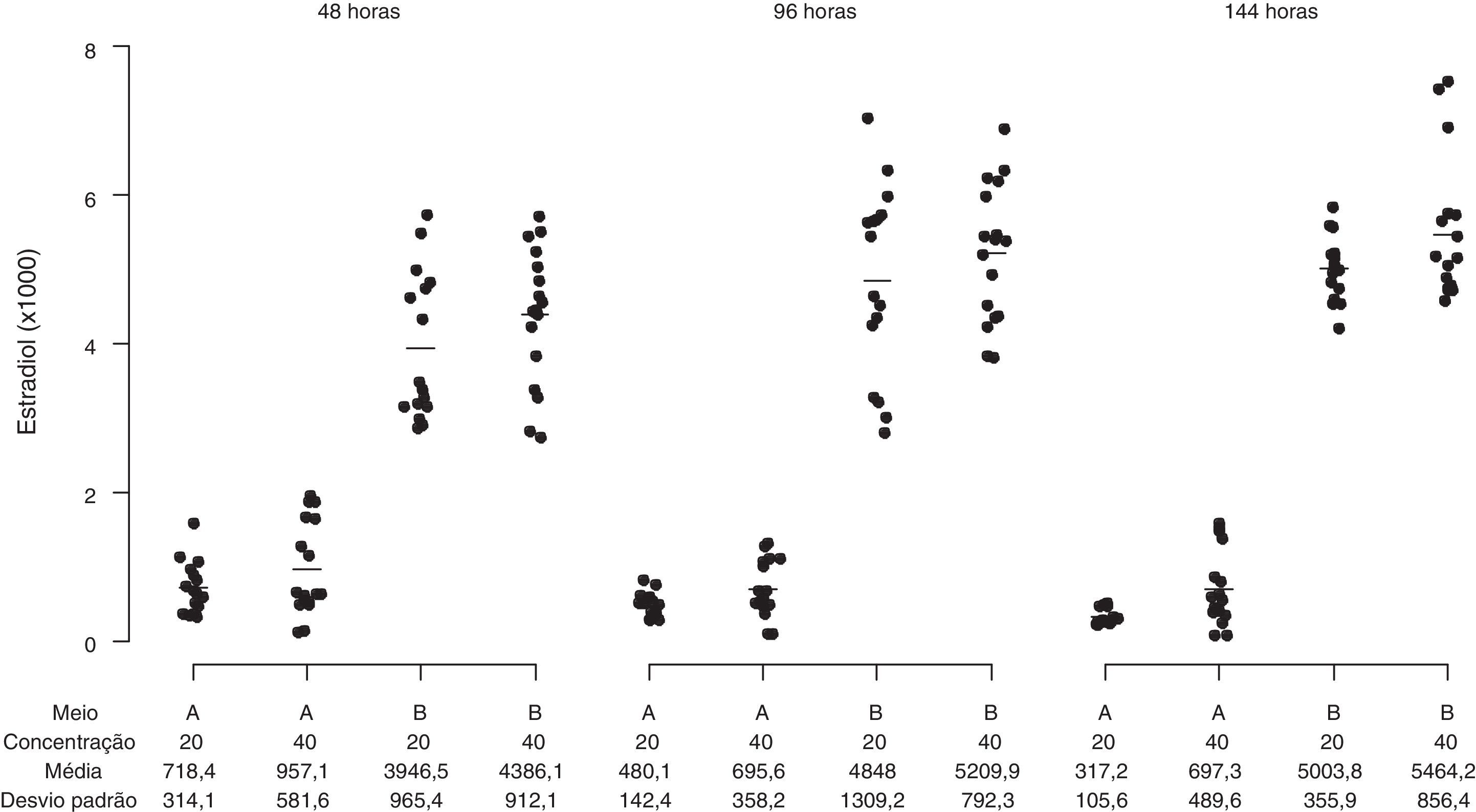
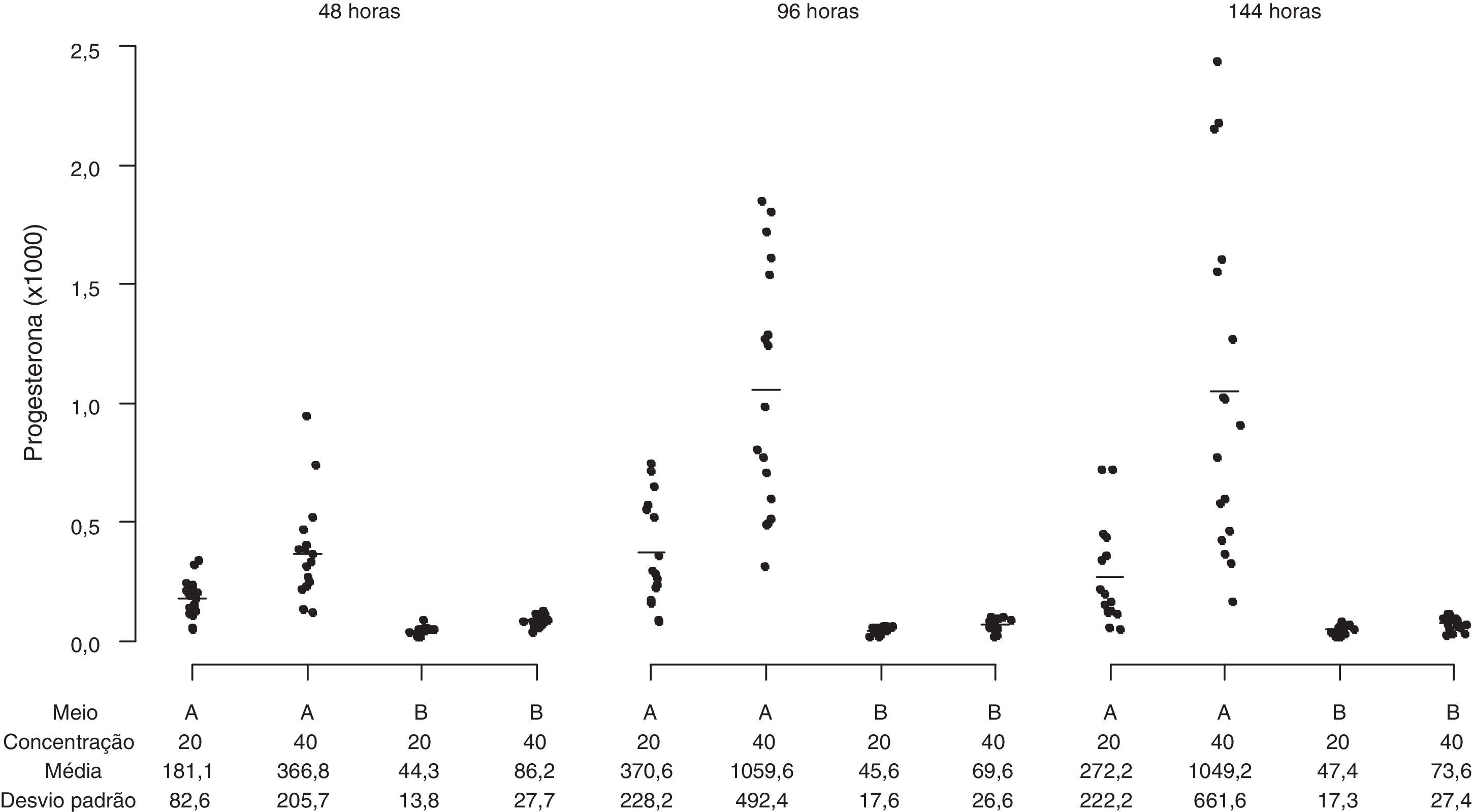
O perfil da secreção de esteroides foi determinado em amostras de meios obtidos de culturas das CG que apresentaram alta viabilidade celular pré‐cultivo (> 85%) e características morfológicas compatíveis com os dois sistemas de cultura usados, representados pelos meios α‐MEM e TCM‐199. As células da granulosa cultivadas em α‐MEM (sistema de cultura quimicamente definido) secretaram progressivamente concentrações mais elevadas de estradiol durante o período de cultura, enquanto as células cultivadas em TCM‐199 (controle) apresentaram uma produção consistentemente menor de estradiol em todos os tempos de cultivo avaliados (fig. 7; p<0,001). A secreção de P4 foi reduzida com o tempo de cultivo no meio α‐MEM e aumentou significativamente no TCM‐199 (fig. 8; p<0,001). As concentrações celulares testadas influenciaram diferencialmente apenas a secreção de P4 no meio TCM‐199, com incremento na produção de P4 com a concentração de 2×105 células/mL (40.000/200μL) nos tempos 96 e 144 horas (fig. 8; p<0,001).
Secreção de estradiol (pg/mL) por células da granulosa humanas (105/mL e 2×105/mL) cultivadas em sistema quimicamente definido ou controle. Meio A=TCM‐199 (controle); Meio B=α‐MEM. Concentração 20 ou 40=20.000 ou 40.000 células/200μL de meio de cultura. Os desvios‐padrão referem‐se à variabilidade inter‐indivíduos estimada por modelos de efeitos mistos (n=10).
Secreção de progesterona (ng/mL) por células da granulosa humanas (105/mL e 2×105/mL) cultivadas em sistema quimicamente definido ou controle. Meio A=TCM‐199 (controle); Meio B=α‐MEM. Concentração 20 ou 40=20.000 ou 40.000 células/200μL de meio de cultura. Os desvios‐padrão referem‐se à variabilidade inter‐indivíduos estimada por modelos de efeitos mistos (n=10).
A relação E2/P4 foi significativamente maior no α‐MEM quando comparada ao TCM‐199, independentemente do tempo de cultivo (T48h=0,13±0,12 vs 0,01±0,02 (p<0,01); 96h=0,12±0,06 vs 0,01±0,01 (p<0,01); 144h=0,90±0,87 vs 0,01±0,06 (p=0,06), respectivamente).
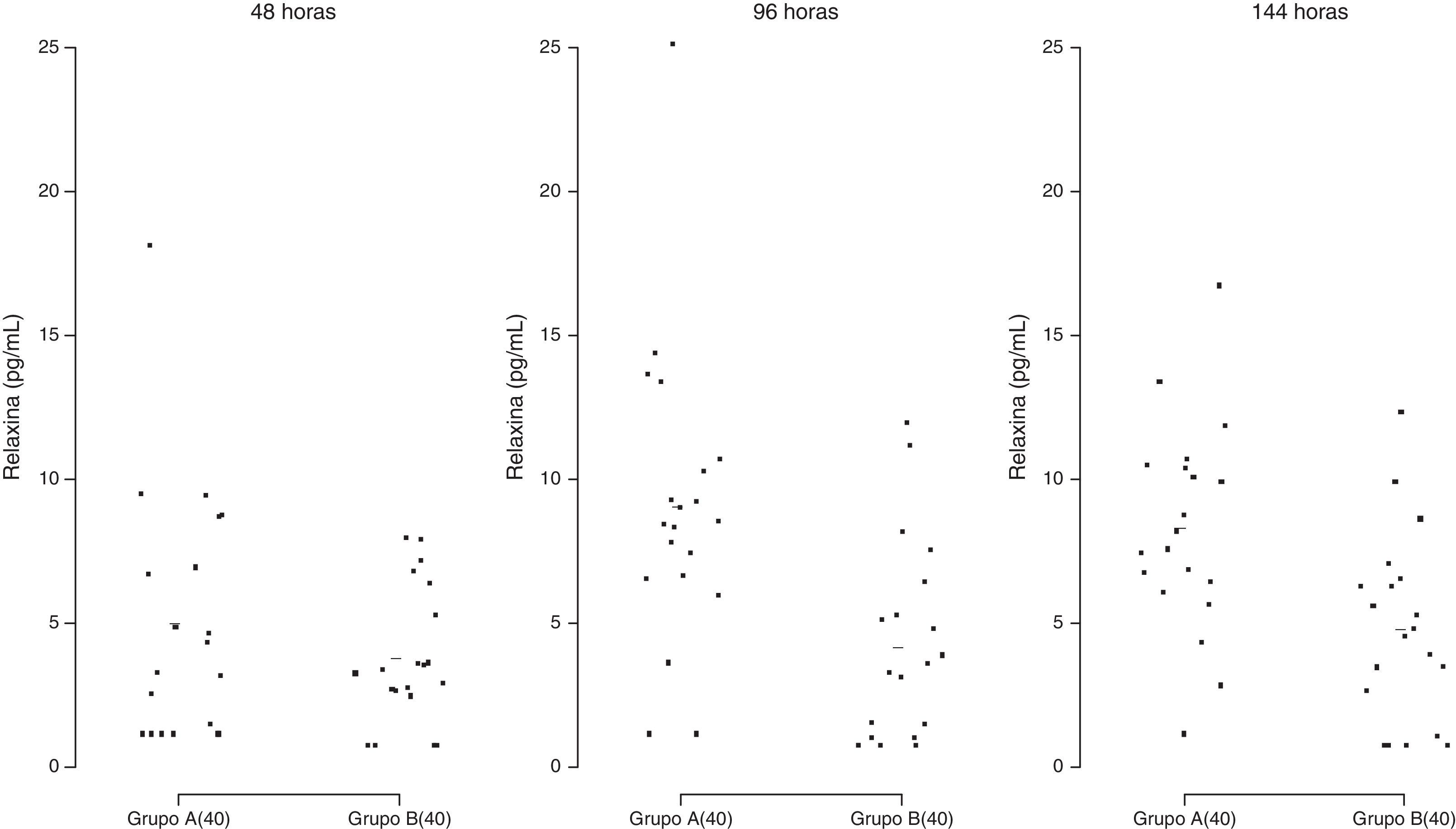
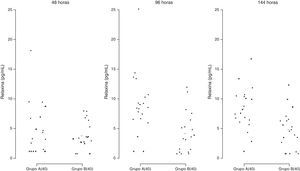
Secreção de relaxinaA secreção de RLN pelas CG (fig. 9) não diferiu no tempo 48 horas entre os dois sistemas de cultura, porém foi significativamente maior no meio TCM‐199 quando comparada ao meio α‐MEM após 96 e 144 horas de cultivo (p=0,0095).
Secreção de relaxina (pg/mL) por células da granulosa humanas (2×105/mL) cultivadas em sistema quimicamente definido ou controle. Meio A=TCM‐199 (controle); Meio B=α‐MEM. Concentração 40=40.000 células/200μL de meio de cultura. Os desvios‐padrão referem‐se à variabilidade inter‐indivíduos estimada por modelos de efeitos mistos (n=10).
No presente estudo, células da granulosa humanas cultivadas em sistema quimicamente definido foram avaliadas quanto à capacidade de reverter o processo de luteinização deflagrado pela hCG usada na HOC e de simular o perfil esteroidogênico característico da fase folicular do ciclo menstrual.
Nosso modelo experimental in vitro foi padronizado em meio de cultura que pode ser considerado como quimicamente definido, já que usa macromolécula sintética como substituto do soro fetal e BSA.21 Foram comparados dois sistemas de cultivo distintos: o sistema já descrito na literatura, representado pelo meio TCM‐199 suplementado com soro, e o sistema proposto, representado pelo meio α‐MEM acrescido de suplementação específica para estimular a capacidade estrogênica das CG.
Nossos resultados demonstram influência importante do sistema de cultivo na diferenciação in vitro das CG humanas. Ao se compararem os dois sistemas testados, a morfologia das culturas foi marcadamente distinta em 100% dos cultivos, sem variações entre indivíduos, bem como as características ultraestruturais analisadas à microscopia eletrônica de transmissão. As CG cultivadas no meio α‐MEM demonstraram características morfológicas similares às CG in vivo. As células mantêm a forma poliédrica e crescem em suspensão formando clusters (fig. 2), os quais aumentam em número, distribuindo‐se por toda a área de cultivo, além de aumentarem em diâmetro e tornarem‐se visivelmente mais compactados ao longo da cultura.
Segundo Gutierrez et al. (1997),13 o padrão de formação de clusters de CG em sistemas livres de soro permite um íntimo contato físico entre as células e isso pode ser responsável por prevenir a luteinização.2 Essa morfologia de crescimento típica também é observada em culturas de CG de outras espécies, como ovinos,16 suínos22 e bovinos.2
No nosso estudo, investigamos adicionalmente a influência da densidade celular (concentração de células/área da placa de cultivo) no perfil de secreção de esteroides das culturas. Cultivamos as CG nas concentrações de 20.000 ou 40.000/200μL de meio e observamos que a capacidade estrogênica das CG cultivadas em meio α‐MEM não aumenta proporcionalmente ao aumento da densidade celular, a despeito da alta produção de E2 até 144 horas de cultivo.
O padrão de crescimento e compactação das CG em clusters provavelmente exerce influência no aporte de hormônios e, consequentemente, na sua biodisponibilidade nas camadas mais internas de CG do cluster, contribuindo para o estabelecimento de subpopulações de CG com distintos perfis esteroidogênicos, como ocorre in vivo.23–25 Contudo, estudos mais detalhados devem ser instituídos para confirmar esse achado. No meio TCM‐199 também não foi verificada produção aumentada de E2, o que provavelmente deve‐se à perda de atividade da aromatase, sendo indiferente a densidade de células em cultivo. O efeito da densidade celular sobre a capacidade esteroidogênica das CG foi evidente apenas na secreção de P4 no meio TCM‐199 após 96 e 144 horas de cultivo, indicando a diferenciação irreversível das CG em direção ao fenótipo de fase lútea, com incremento na produção de P4 proporcional ao aumento da densidade celular.
O íntimo contato entre as CG que crescem em clusters foi evidenciado no presente estudo por meio da presença das comunicações celulares nas amostras analisadas por microscopia eletrônica. Observamos a presença de muitas junções intercelulares, como os desmossomos (fig. 4), na maioria das eletromicrografias das CG que foram cultivadas no meio α‐MEM, compatível com a ultraestrutura relatada na literatura de folículos nas fases iniciais de desenvolvimento.7 A maturação das células da granulosa e a luteinização são processos que implicam mudança na forma da célula e diminuição ou até mesmo ausência das junções celulares e das regiões de aderência celulares no folículo.7,22 Portanto, pode‐se inferir, considerando esses aspectos morfológicos, que o sistema de cultivo proposto foi capaz de reverter ou retardar o processo de luteinização das CG.
Do ponto de vista ultraestrutural, as diferenças mais proeminentes observadas entre os dois sistemas estudados foram o formato e o tamanho das células e as características da superfície celular. Células da granulosa cultivadas em α‐MEM apresentaram formato predominantemente poliédrico e presença de desmossomos, gap junctions e microvilosidades interdigitadas (figs. 3 e 4). Em contraste, as células cultivadas em TCM‐199 apresentaram formato alongado semelhante a fibroblasto contendo microvilosidades, evaginações e protusões da membrana plasmática (fig. 5), características morfológicas compatíveis com instalação do processo de luteinização. Os resultados deste estudo estão de acordo com os relatos da literatura sobre as diferenças ultraestruturais das CG em relação aos seus diferentes estágios de proliferação e luteinização.26,27
Os resultados de estudos in vitro só são significativos se as células mantiverem durante a cultura características funcionais semelhantes às que mantêm in vivo, para que a partir desses resultados se façam inferências a respeito da fisiologia do processo estudado. Do ponto de vista funcional, o padrão de produção hormonal de cada sistema de cultura foi acentuadamente distinto. No sistema convencional com soro (TCM‐199), as CG foram predominante produtoras de progesterona (característica de fase lútea), enquanto no sistema proposto (α‐MEM) as CG secretaram altas concentrações de estradiol, sem o incremento de progesterona, mantendo alta relação estradiol/progesterona, a qual indica manutenção da atividade da aromatase característica da fase folicular. Apesar da alta proliferação celular característica de CG cultivadas em sistema contendo soro, cujo índice pode aumentar 100% durante apenas três dias de cultivo,28 a secreção de E2 apresentou consistente declínio no meio TCM‐199, enquanto a progesterona aumentou significativamente em função do tempo de cultura (figs. 6 e 7).
A adição do soro durante as primeiras horas de cultura ou a feitura de um pré‐tratamento dos poços da placa de cultura com soro são práticas usuais para melhorar a adesão celular.11 Porém, a capacidade das CG de produzirem esteroides in vitro pode ser potencialmente alterada. O soro pode induzir luteinização das CG e células da teca, caracterizada pela diminuição da produção de estradiol e androstenediona e por um rápido aumento na secreção de progesterona, com produção sustentada durante todo o período de cultivo.11,13,29,30 Corroborando esses achados, Gutiérrez et al. (1997)13 demonstraram os efeitos negativos da adição do soro ao meio de cultivo na produção de estradiol in vitro por CG bovinas.
As células obtidas após a aspiração do fluido folicular de pacientes submetidas a ciclos de RA são comumente chamadas de células pré‐luteinizadas, mas diferem entre si quanto ao tipo de cristas mitocondriais, à proliferação do complexo de Golgi, ao tipo de retículo endoplasmático e ao número e tamanho das gotas lipídicas.31 No presente estudo, as CG cultivadas nos dois sistemas analisados partiram dos mesmos pools de fluidos foliculares, ou seja, o tamanho do folículo e a concentração de E2 à qual as CG estavam expostas foram os mesmos, porém se diferenciaram in vitro, assumindo características morfofuncionais distintas, demonstrando um perfil de fase folicular no meio α‐MEM e outro de fase lútea no meio TCM‐199.
Adicionalmente, observamos que a secreção de RLN pelas CG, um polipeptídeo sintetizado pelo corpo lúteo, foi significativamente maior no meio TCM‐199 quando comparado ao α‐MEM, o que comprova o fenótipo de célula luteinizada no TCM‐199 e indica reversão do processo de luteinização no sistema quimicamente definido. De fato, CG humanas cultivadas em sistema contendo soro secretam quantidades expressivas de RLN e são capazes de simular o perfil de secreção do corpo lúteo característico do período gestacional.7 Portanto, a produção endócrina da cultura (esteroides ovarianos e RLN) em meio TCM‐199 foi indicativa de fase final de diferenciação e de luteinização das CG.2,7
A secreção in vitro de RLN tem sido detectada em culturas de CG luteínicas a partir do sexto dia de cultivo,32 enquanto a secreção de RLN in vivo é detectada de cinco a sete dias após o pico de LH.33,34 No nosso estudo, foi possível detectar mais precocemente (dois dias de cultivo) a produção de RLN e em culturas de CG não estimuladas com hCG ou LH. As concentrações de RLN em culturas de CG humanas luteinizadas observadas por Stewart et al. (1997)15 foram indetectáveis ou inferiores a 200 pg/mL até o sexto dia de cultivo das CG. A menor concentração de RLN observada por esses autores foi de 46 pg/mL no décimo dia de cultivo em culturas estimuladas com 0,02 UI/mL de hCG. A baixa secreção de RLN observada em nosso estudo, independentemente do sistema de cultura, provavelmente deve‐se à ausência de hCG ou LH no meio de cultura.
Gutierrez et al.2,13 demonstram a íntima relação entre estrutura e função em sistemas de cultura de CG livres de soro. Nessas culturas, as concentrações de estradiol são mantidas ao longo do cultivo e as CG apresentam características ultraestruturais de células normais, semelhantes às CG in vivo. Essas células contêm retículo endoplasmático em abundância, mitocôndrias com cristas trabeculares e uma extensiva rede de junções Gap. Ao contrário, as CG cultivadas em placas revestidas com soro mostram características de perda da atividade da enzima aromatase. Essa perda de aromatização foi correlacionada com a morfologia das células, que se apresentavam mais alongadas, compatíveis com os resultados obtidos no presente estudo, tanto em relação ao formato alongado das células quanto à redução na atividade da aromatase no meio TCM‐199 (fase lútea). Portanto, as características morfológicas e ultraestruturais, bem como o perfil endócrino das culturas obtido com o sistema quimicamente definido, são similares às CG in vivo de folículos ovarianos em crescimento, enquanto o sistema de cultura convencional com soro irrefutavelmente simula o perfil morfológico/endócrino das células granulosas luteínicas do corpo lúteo em diferenciação (fig. 9).15,35
ConclusõesO sistema de cultura quimicamente definido induziu a reversão do processo de luteinização droga‐induzida durante a HOC, enquanto o sistema padrão, como já descrito na literatura, tende a completar o processo de luteinização, servindo como modelo in vitro de corpo lúteo. A importância deste estudo reside no estabelecimento de um sistema de cultura de CG humanas que, além do potencial de aplicação nos protocolos de preservação de fertilidade, torna‐se um modelo adequado para a investigação dos efeitos das gonadotrofinas usadas nos protocolos de estimulação ovariana, como o HMG, as isoformas de FSH e as associações FSH/LH, e na diferenciação e luteinização das CG pós‐ovulatórias e pode ser útil para estudar diferenças na resposta endócrina em CG coletadas de pacientes com diferentes etiologias de infertilidade e fornecer informações de relevância clínica.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
A Maria Cristina Picinato pela grande ajuda na coleta de amostras durante as captações de oócitos e pela ajuda nas etapas envolvendo procedimentos laboratoriais. A Maria Albina Vercesi e a Tatiana Marina Vieira Giorgenon pela realização de todas as dosagens hormonais.
Trabalho realizado na Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo (USP), São Paulo, SP, Brasil.