A gestação gemelar com mola hidatiforme completa que coexiste com feto vivo (GGMC) é uma entidade rara. Embora as recomendações sejam de conduta expectante, são descritas diversas complicações maternas e fetais, como o aumento da incidência de abortamento espontâneo, de parto prematuro, de sangramento vaginal, de pré‐eclampsia grave e de doença trofoblástica persistente, entre outras complicações. Neste trabalho, descrevemos a evolução clínica de um caso de GGMC que evoluiu para crise tireotóxica, pré‐eclâmpsia grave, interrupção da gestação e necessidade de cuidados intensivos maternos. A necropsia fetal evidenciou feto do sexo feminino, sem malformações aparentes, com alterações placentárias que favorecem cromossomopatia. A avaliação dos restos ovulares evidenciou vilosidades com hiperplasia do trofoblasto e vesículas, achados compatíveis com mola hidatiforme completa. Atualmente, após 15 meses de seguimento, a paciente permanece assintomática e com níveis indetectáveis de gonadotrofina coriônica.
Twin pregnancy with complete hydatidiform mole coexisting with a live fetus is a rare entity, and although the recommendations are expectant management of various maternal and fetal complications are described, such as increasing the number of spontaneous abortion, premature delivery, vaginal bleeding, pre‐eclampsia and severe persistent trophoblastic disease, among other complications. In this paper, we describe the clinical course of a case of GGMC who developed thyrotoxic crisis, preeclampsia severe, termination of pregnancy and maternal need for intensive care. Fetal autopsy showed a female fetus with no apparent defects; with placental changes favoring chromosomal disorders. The evaluation of ovular remains showed villi with trophoblastic hyperplasia and vesicles, suggestive of complete mole. Currently, after 15 months of follow up, the patient remains asymptomatic with undetectable levels of chorionic gonadotropin.
A gestação gemelar com mola hidatiforme completa que coexiste com feto vivo (GGMC) é uma entidade rara, com incidência que varia de uma em 22 mil até uma em 100 mil gestações.1‐3 Morfologicamente, identificam‐se duas regiões claramente distintas: uma placenta sem alterações com um feto normal e uma placenta com degeneração hidatiforme.4‐6
Embora a recomendação atual após o diagnóstico de GGMC seja de conduta expectante,1,6‐8 são descritas diversas complicações, como o aumento da incidência de abortamento espontâneo, de parto prematuro, de sangramento vaginal, de pré‐eclampsia grave e de doença trofoblástica persistente, entre outras.4,5,8‐10 Assim, diversos autores discutem sobre indicações da manutenção e da interrupção programada da gestação.1,4,7‐10
O objetivo deste trabalho foi descrever a evolução clínica de um caso de GGMC que evoluiu para pré‐eclâmpsia grave e crise tireotóxica, com interrupção da gestação e necessidade de cuidados intensivos.
Relato de casoGestante de 32 anos, G4P2cA1, com idade gestacional de 15 semanas e quatro dias, procurou atendimento na Maternidade do Hospital das Clínicas da Universidade Federal de Goiás (HC/UFG) com hiperêmese gravídica havia dois dias, sem outros sintomas. A paciente estava em uso de sulfato ferroso (160mg/dia) e fenobarbital (200mg/dia), devido a diagnóstico prévio de epilepsia. Ao exame físico, apresentava‐se hipocorada (1+/4+), desidratada (1+/4+), afebril e eupneica. A ausculta cardíaca e pulmonar mostrava‐se normal, com pressão arterial de 150 x 90mmHg. Apresentava abdome gravídico, indolor à palpação, com a altura do fundo uterino de 16cm e dinâmica uterina ausente. O exame ultrassonográfico revelou imagem sugestiva de GGMCF, com frequência cardíaca fetal de 150bpm. As duas placentas apresentavam limites claramente distintos, uma de aspecto normal e a outra de aspecto molar.
Após internação hospitalar e tratamento clínico, a paciente apresentou melhoria significativa dos sintomas e recebeu alta após três dias, com retorno agendado no Pré‐Natal de Alto Risco do Serviço.
A paciente foi readmitida após dois dias da alta hospitalar, com piora do quadro de hiperêmese, sialorreia intensa, taquicardia e tremor fino de extremidades, além de cefaleia, escotomas cintilantes e náuseas. A pressão arterial era normal, com valores limítrofes e picos hipertensivos ocasionais. Os exames solicitados (hemograma, função renal, enzimas hepáticas, bilirrubinas e T4 livre) apresentavam valores normais; porém o TSH encontrava‐se suprimido (0,002‐0,008μIU/mL). Foi instituído tratamento clínico com hidratação venosa, medicação antiemética e anti‐hipertensiva, controle do equilíbrio hidroeletrolítico e monitoração de sinais vitais.
No quinto dia de internação a paciente evoluiu com rebaixamento do nível de consciência e revelou proteinúria de 24 horas de 30,03g. Nessa ocasião, foi indicado o abortamento terapêutico, o qual foi induzido com misoprostol (200mcg 6/6h). Houve expulsão fetal e de grande quantidade de vesículas, acompanhada de sangramento vaginal profuso e piora do quadro neurológico, com indicação de transferência para a unidade de terapia intensiva (UTI).
A paciente retornou à enfermaria do HC/UFG após cinco dias na UTI, onde evoluiu com melhoria clínica completa e exame ultrassonográfico normal. Recebeu alta hospitalar com retorno ambulatorial para controle sérico dos níveis de gonadotrofina coriônica (β‐HCG), sem a necessidade de esvaziamento uterino adicional. Após 15 meses de seguimento, permanece assintomática e com níveis indetectáveis de β‐HCG.
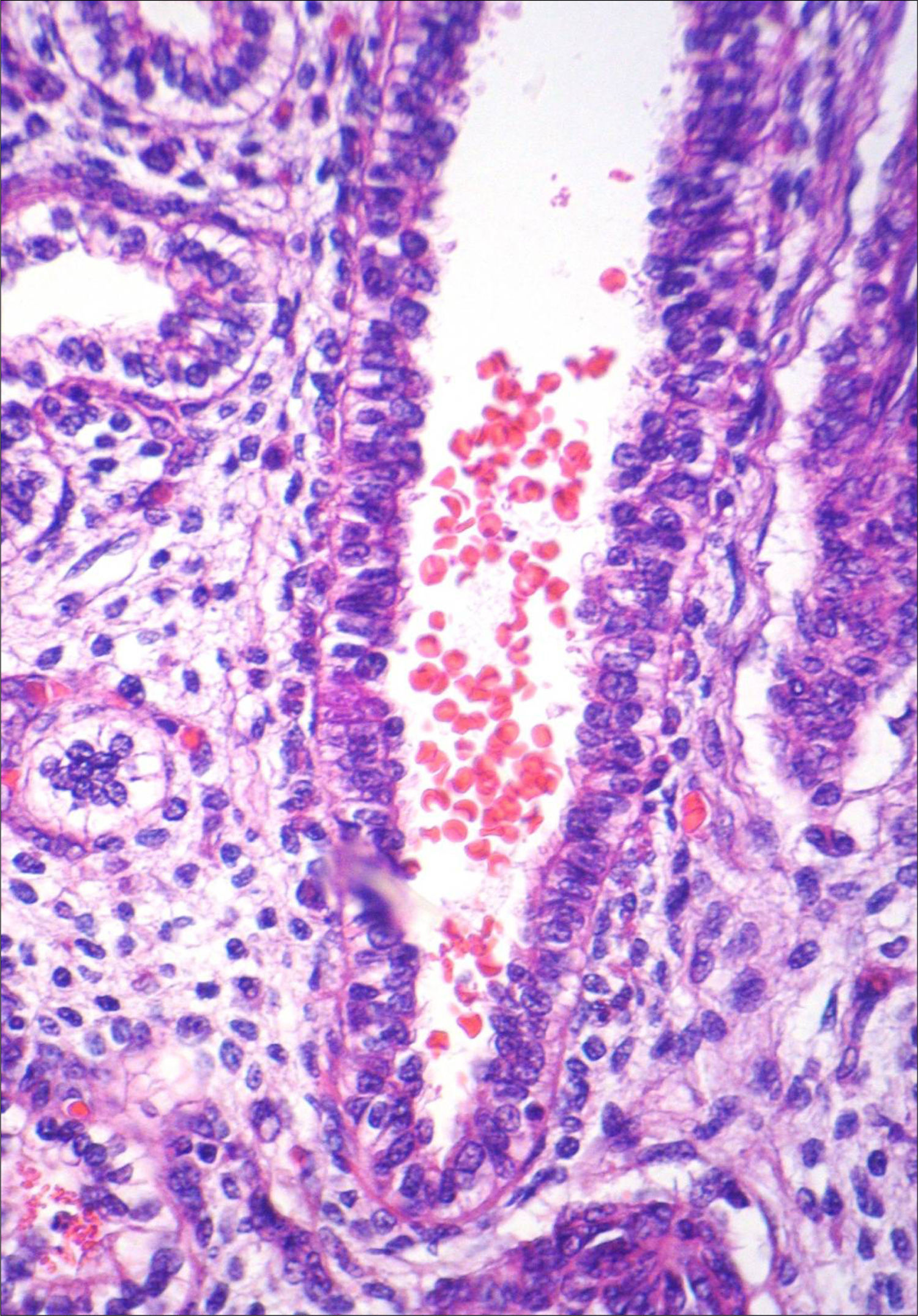
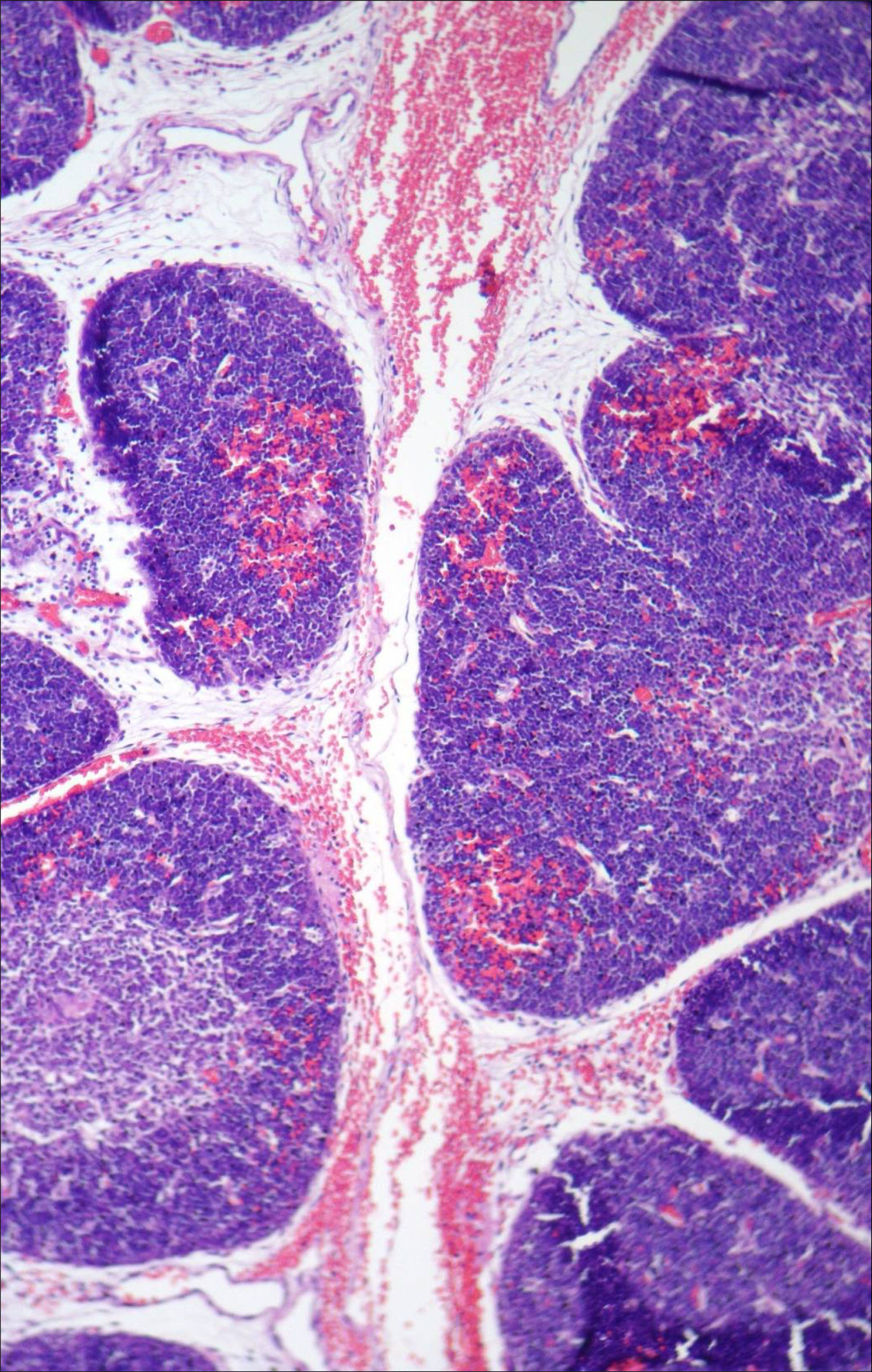
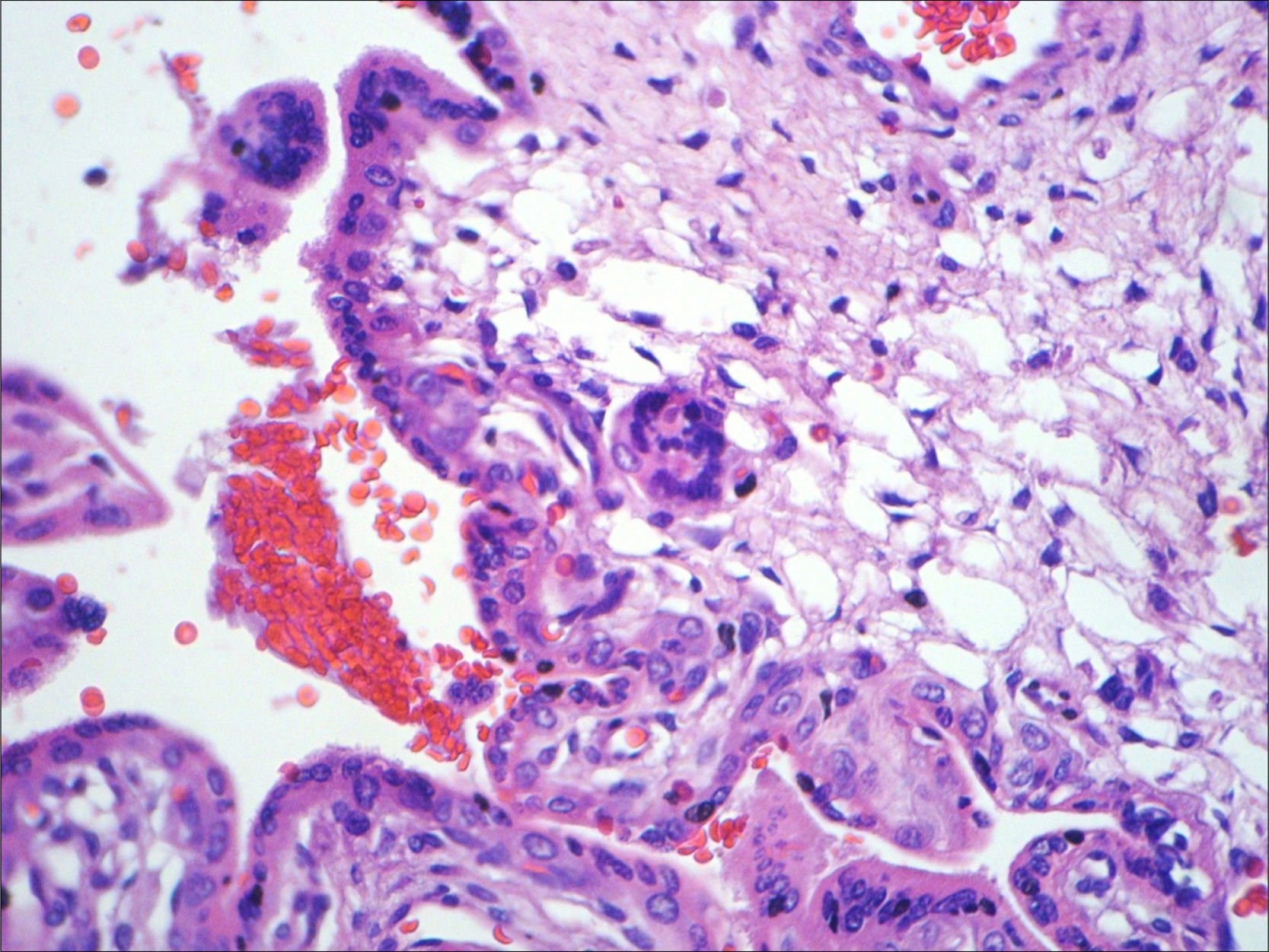
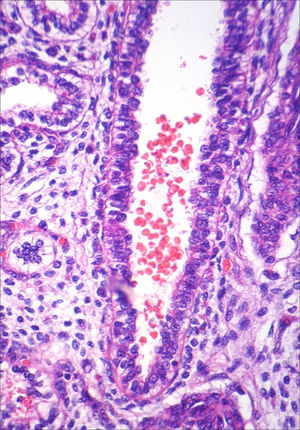
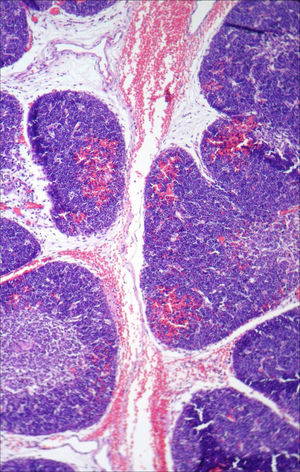
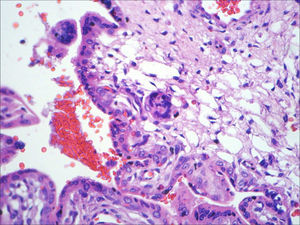
A necropsia evidenciou um feto de 155g, sexo feminino, sem malformações aparentes, com órgãos tópicos e arquitetura histológica adequada. O feto apresentava, entretanto, hemorragia tímica e em pericárdio e pleura viscerais, assim como conteúdo hemorrágico em lúmen intestinal e brônquico, com quadro morfológico que favorecia o óbito por anóxia aguda (figs. 1–3). A avaliação placentária revelou edema vilositário e pseudoinclusões de trofoblasto, sem outras alterações, o que sugeria cromossomopatia (fig. 4).
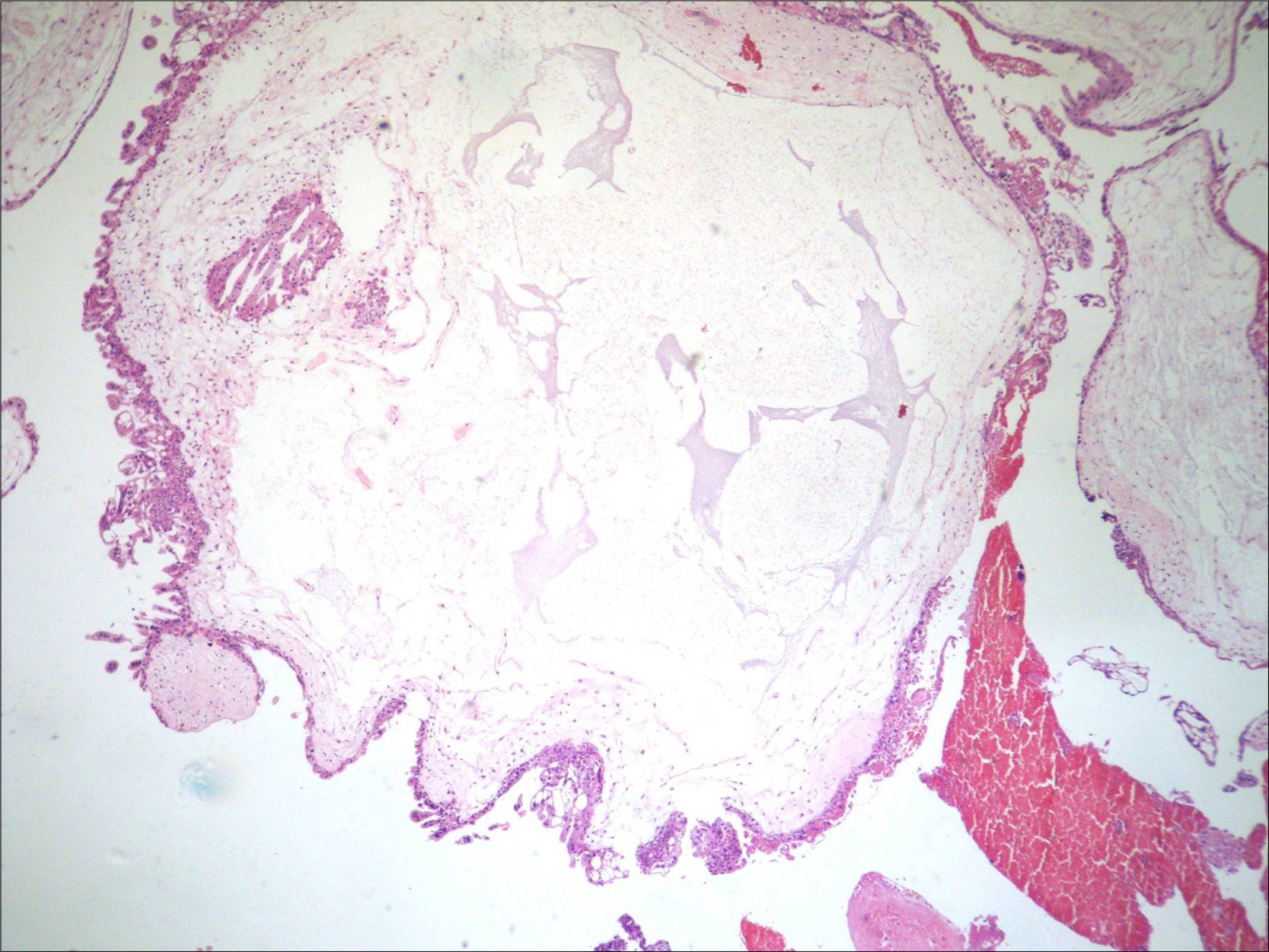
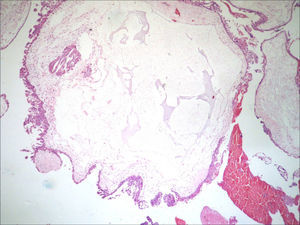
A avaliação dos restos ovulares evidenciou vilosidades com hiperplasia do trofoblasto e vesículas, achados compatíveis com mola hidatiforme completa (fig. 5). O presente relato foi autorizado pela paciente, que assinou um termo de consentimento livre e esclarecido.
DiscussãoApós a suspeita clínica e ultrassonográfica, o diagnóstico pré‐natal de GGMC é feito por meio de métodos invasivos, com a determinação do cariótipo fetal. O método de certeza é por estudo citogenético, o qual identifica o cariótipo diploide, sendo os cromossomos de origem paterna.3,10,11 Na impossibilidade do estudo citogenético, o diagnóstico final é feito realizado com a avaliação histopatológica da placenta após o termino da gestação.12 No presente caso, a avaliação dos restos ovulares evidenciou vilosidades com hiperplasia do trofoblasto e vesículas, achados consistentes com mola completa.13
A manutenção da gestação em casos de GGMC tem sido descrita por diversos autores, apesar das altas taxas de resultados obstétricos desfavoráveis.4,5,7,8,10,14,15 Na conduta conservadora, recomenda‐se seguimento clínico rigoroso, determinação do cariótipo fetal e individualização dos riscos maternos e fetais.1,6,15
Sebire et al.7 analisaram 77 casos de GGMC, com 53 casos (68,8%) de manutenção da gestação; desses, dois (03,8%) evoluíram para pré‐eclâmpsia grave; 23 (43,4%) evoluíram com aborto espontâneo antes de 24 semanas de gestação; e 28 (52,8%) evoluíram com gestações de 28 semanas ou mais, o que resultou em 20 nascidos vivos (37,7%). Yela et al.,10 em uma revisão de 29 trabalhos, encontraram 159 casos de GGMC; desses, apenas 56 (35%) apresentaram término da gestação com feto vivo. A maioria dessas gestações apresentou complicações, como pré‐eclâmpsia e doença trofoblástica persistente.
Nos casos de GGMC é indicado o esvaziamento da cavidade uterina após a resolução da gestação, de preferência por meio de vacuoaspiração, a qual apresenta menor taxa de perfuração uterina.14 No caso de úteros com grande volume, a duração do procedimento pode ser extensa e aumentar a perda sanguínea.14 O material obtido pela curetagem apresenta menor índice de autólise e é mais adequado para a histopatologia.14 Assim como nos casos de mola hidatiforme convencional, o seguimento por meio da dosagem sérica de β‐HCG é obrigatório.4,11,14
Antes do esvaziamento da cavidade uterina, a paciente deve ser submetida à avaliação clínica, com destaque para o diagnóstico de eventuais complicações como anemia, crise tireotóxica, pré‐eclampsia e insuficiência respiratória. Todas essas situações devem ser corrigidas antes do procedimento. No caso descrito, a curetagem uterina não foi possível devido ao quadro clínico grave da paciente, a qual necessitava de cuidados intensivos imediatos. Após o retorno à enfermaria, evoluiu com ausência de sangramento vaginal e exame ultrassonográfico normal, com alta hospitalar e seguimento ambulatorial sem a necessidade de esvaziamento uterino adicional.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.