A preservação da fertilidade de jovens mulheres em idade reprodutiva tem se tornado um dos grandes desafios da medicina, já que a maioria dos tratamentos contra o câncer pode causar insuficiência ovariana prematura, devido à toxicidade ovariana dos agentes quimioterápicos. Com base nessa sensibilidade e com vistas a reverter ou minimizar os danos às células reprodutivas decorrentes da quimioterapia, cada vez se tornam mais frequentes os estudos e a busca tanto por opções para preservar a fertilidade feminina quanto por tratamentos para células cancerosas que sejam mais seletivos.
Este artigo tem como objetivo apresentar uma visão geral sobre os danos causados pelos quimioterápicos à função ovariana e as possíveis opções para a preservação da fertilidade feminina em pacientes com câncer e as perspectivas em oncofertilidade. Foi feita uma pesquisa no banco de dados National Library of Medicine (PubMed), em que foram recuperados artigos publicados entre 1967 e 2015 sobre agentes quimioterápicos e seus danos à fertilidade feminina.
The preservation of fertility in young women of reproductive age has become a major challenge in medicine, since most cancer treatments can cause premature ovarian failure due to ovarian toxicity of chemotherapeutic agents. Based on this sensitivity it is necessary to revert or minimize damage to reproductive cells resulting from chemotherapy. It have become more frequent studies and researches for alternatives to preserve female fertility, and treatments that are more selective for cancer cells. Currently there are several options for preservation of fertility in women undergoing chemotherapy treatments.
This article aims to present an overview of the damage caused by chemotherapy ovarian function and possible options for preserving fertility in female cancer patients and prospects in oncofertilidade. A search on databases were searched for relevant articles: the National Library of Medicine (PubMed) and the Virtual Health Library. Articles published between 1967 and 2015 on chemotherapeutic agents and their damage on female fertility was held.
Estudos mostram que o número de novos casos de câncer tem aumentado a cada ano e a média anual entre os homens e mulheres tem sido de 2,1% e 1,5%, respectivamente.1 Segundo a Organização Mundial da Saúde (OMS), estima‐se que, para 2030, ter‐se‐á 27 milhões de novos casos; 17 milhões de mortes causadas por câncer e 75 milhões de pessoas doentes de câncer. Felizmente, a boa notícia é que a probabilidade de sobreviventes de câncer atualmente é alta e continua a crescer continuamente. As taxas de sobrevivência hoje estão em torno de 80% para vários tipos de câncer, em particular para pacientes jovens.1 Esses resultados têm sido atribuídos aos avanços nos diagnósticos e nas novas terapias contra o câncer que têm aumentado a expectativa e a qualidade de vida dos pacientes ao longo das últimas décadas.2
O desenvolvimento de terapias que possibilitem uma maior sobrevida, bem como que resultem em menores efeitos colaterais para os pacientes é de extrema relevância e interesse para a clínica médica, uma vez que a melhoria e a cura do câncer parecem também ser influenciadas por fatores emocionais. Foi observada maior dificuldade de melhoria em pacientes que apresentam quadro depressivo.3 Segundo Siegel et al. (2013),4 o câncer de mama é o tumor de maior incidência entre as mulheres e acarreta sérios danos emocionais secundários pela retirada da mama e redução da autoestima. Além disso, a impossibilidade de gestar um filho após tratamentos quiomioterápicos também abala fortemente o equilíbrio emocional das mulheres submetidas a tratamentos oncológicos e pode influenciar negativamente no tratamento e no bem‐estar das pacientes. Assim, apesar dos avanços relacionados com um aumento nas taxas de sobrevida e cura, faz‐se necessário desenvolver estratégias para aprimorar a qualidade de vida após o tratamento quimioterápico,2 pois grande parte dos tratamentos resulta em infertilidade ou insuficiência ovariana prematura,5 haja vista que as drogas usadas são extremamente tóxicas para os ovários.
O ovário é um órgão que influencia a qualidade de vida feminina, pois exerce uma função endócrina relacionada à produção e liberação de hormônios esteroides que são responsáveis pelo controle do ciclo reprodutivo. São percebidos efeitos incômodos durante a menopausa, quando cessa a produção de estrógenos.6 Além disso, o ovário é um órgão de extrema relevância para a fertilidade feminina, pois desempenha a função exócrina ou gametogênica, responsável pela produção e liberação de oócitos aptos a serem fertilizados a partir de folículos ovarianos.7 O desenvolvimento folicular ovariano é rigidamente regulado por mecanismos de morte celular e fatores de sobrevivência, por exemplo, fatores de crescimento, citocinas e esteroides.8 A mulher nasce com uma população de cerca de 2 milhões de folículos. No entanto, apenas uma pequena proporção desses folículos (0,1%) alcança a fase ovulatória. Os demais (99,9%) irão sofrer um processo degenerativo natural chamado atresia folicular,9 que persiste até a menopausa, por volta dos 50 anos.10,11 Além dessa perda natural, fatores externos como os tratamentos contra o câncer podem interromper o funcionamento normal dos ovários. Clinicamente, as pacientes podem sofrer de falência ovariana que resulta em amenorreia, aumento da secreção gonadotrofinas e baixo nível de estradiol3 e invariavelmente torna a mulher infértil.
Considerando a relevância desse tema para a saúde reprodutiva da mulher, esta revisão tem por objetivos: apresentar como está organizado e estruturado o ovário; os principais efeitos, sobre a reserva ovariana, das drogas usadas para o tratamento do câncer, bem como destacar o papel da criopreservação do tecido ovariano como uma opção para salvaguardar a fertilidade feminina antes dos tratamentos gonadotóxicos.
Estrutura e organização ovariana e folicularO ovário, na maioria das fêmeas de mamíferos, é um órgão heterogêneo e pode ser dividido em duas regiões: uma medular, que na maioria das espécies consiste na porção interna do ovário e é responsável pela sustentação e nutrição desse órgão; e uma cortical, mais externa, que contém corpos lúteos, albicans e folículos ovarianos em diferentes estádios de desenvolvimento.12 A gônada feminina desempenha uma função endócrina (produção e liberação de hormônios esteroides e diversos peptídeos) e uma função exócrina ou gametogênica (produção e liberação de oócitos), a qual é exercida pela interação de dois fenômenos que ocorrem no ovário, isto é, a oogênese e a foliculogênese.13
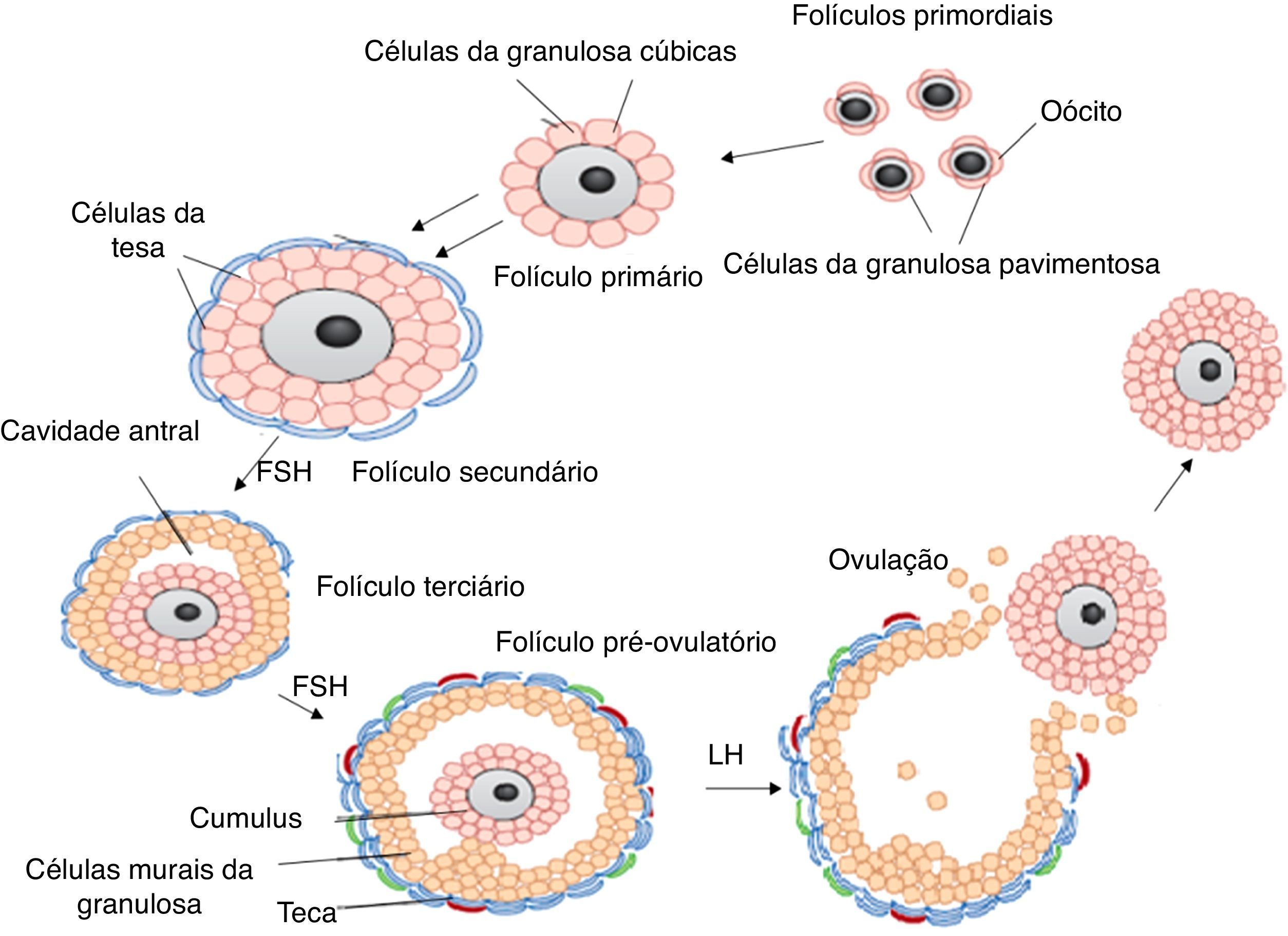
O folículo é considerado a unidade morfológica e funcional do ovário dos mamíferos e é composto por um oócito circundado por células somáticas (célulasda granulosa e tecais), que interagem e promovem a funcionalidade do folículo.14 Dessa forma, o folículo mostra‐se um elemento essencial na promoção de um ambiente ideal para a manutenção, o desenvolvimento e a liberação de um oócito maturo no processo de ovulação.15 De acordo com a presença ou ausência do antro, os folículos ovarianos podem ser classificados em pré‐antrais e antrais, respectivamente.16 Os folículos pré‐antrais podem ainda ser subdivididos em primordiais, de transição, primários e secundários (fig. 1). Destacam‐se os folículos primordiais, que são os menores encontrados no ovário, compreendem 90 a 95% da população folicular e constituem o pool de reserva folicular.7
O número de folículos presentes no ovário varia entre espécies. Na mulher, por exemplo, a população é de aproximadamente 2.000.000.17 No entanto, durante a vida reprodutiva da fêmea ocorre uma redução ordenada da quantidade desses folículos devido a dois fenômenos que ocorrem naturalmente no ovário: ovulação e atresia ou morte folicular.18 A atresia folicular também pode ocorrer precocemente em mulheres jovens em idade reprodutiva ou até mesmo em pré‐púberes após exposição a fatores tóxicos externos aos ovários, como é o caso dos agentes quimioterápicos usados no tratamento contra o câncer.19
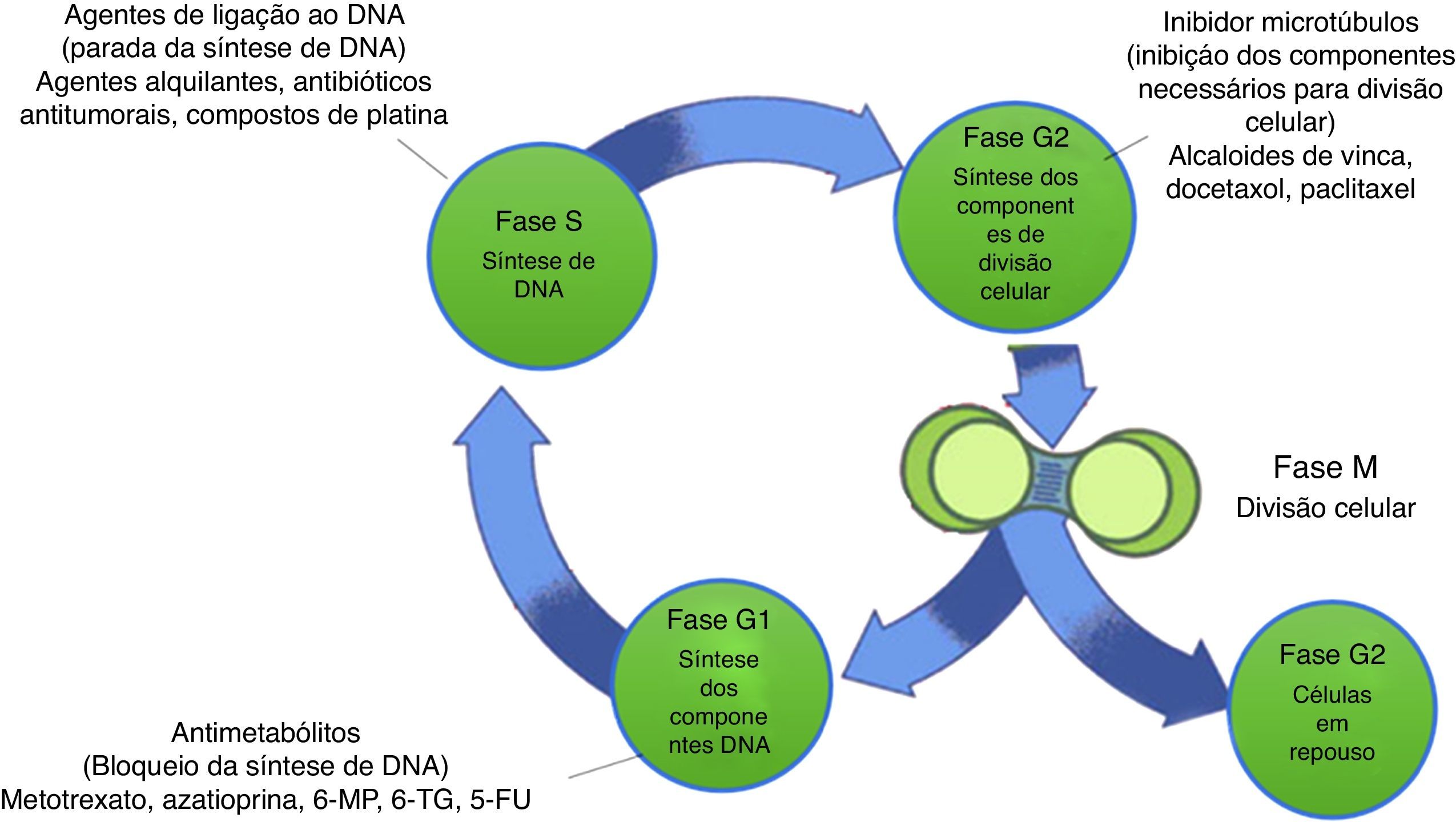
Tratamentos antineoplásicos e a fertilidade femininaA administração de quimioterápicos, necessária para os tratamentos oncológicos resulta em danos devastadores aos ovários.11 Essas drogas levam à diminuição da fertilidade e a menores taxas de natalidade devido a efeitos teratogênicos, causam má formação do feto após tratamento em mulheres sobreviventes do câncer.20,21 A maioria dos agentes quimioterápicos pode afetar oócitos e células da granulosa e da teca. Dessa forma, são prejudiciais à reserva ovariana, podem induzir amenorreia, irreversível em alguns casos.22 O impacto dos tratamentos anticâncer sobre a fertilidade feminina está diretamente relacionado com a idade das pacientes, o tempo de tratamento, o protocolo de quimioterapia e o total cumulativo da dose administrada.2 Os quimioterápicos agem ao interferir no ciclo celular (fig. 2), nas diferentes etapas da síntese do DNA, transcrição e transdução.23,24 A integridade do DNA é fundamental para a proliferação celular adequada. Por isso, altos níveis de danos ao DNA são detectados por proteínas envolvidas no checkpoint do ciclo celular, cuja ativação induz a parada do ciclo celular para evitar a transmissão de DNA danificado durante a divisão celular.25 Lesões no DNA que ocorrem durante a fase S do ciclo celular durante a replicação estão entre as mais severas de todas. Se o DNA danificado não puder ser devidamente reparado, esse dano pode resultar na morte da célula.26 As células cancerosas geralmente têm DNA despirilado, o que reduz a capacidade de sinalizar e reparar algum dano. Assim, elas podem ignorar os pontos de verificação do ciclo celular. Isso permite que as células alcancem altas taxas de proliferação; porém, isso também predispõe a danos no DNA, uma vez que a replicação do DNA danificado aumenta o risco de morte celular.25 Assim, o objetivo das drogas anticâncer é atingir o DNA, o que inspirou o desenvolvimento de numerosos compostos, tais como a cisplatina, doxorubicina, 5‐fluorouracil.27
O efeito gonadotóxico pode resultar de interrupção dos processos celulares e interferência na proliferação celular.28 A falência ovariana prematura é a perda da função ovariana antes dos 40 anos.29 Essa perda extemporânea pode ser causada por agentes antineoplásicos e ocorre principalmente devido à redução do pool de folículos ovarianos devido à atresia folicular, que resulta em fibrose cortical precoce e atrofia ovariana.11
O tratamento do câncer pode ser feito por meio de cirurgia, radioterapia, quimioterapia ou transplante de medula óssea e pode em muitos casos ser necessária a combinação de mais de uma modalidade.30 A cirurgia e/ou radioterapia permitem que um terço dos pacientes seja curado por meio de medidas locais, eficazes quando o tumor ainda não sofreu metástase.31 Contudo, após o desenvolvimento de metástases ou micrometástases, há a necessidade de uma abordagem sistêmica (quimioterapia), que pode ser efetuada em cerca de 60‐70% dos casos.32 Uma vantagem desse tratamento é a de atingir igualmente as metástases disseminadas pelo corpo. Entretanto, há desvantagens importantes a serem consideradas, principalmente aquelas relacionadas aos seus efeitos colaterais, como a infertilidade.33 Portanto, sem ignorar a relevância das demais modalidades de tratamento do câncer, mas em função da necessidade do tratamento quimioterápico, associado aos danos sobre a função reprodutiva, será abordada na presente revisão.
Uso da quimioterapia anticâncerA quimioterapia é um dos tratamentos mais usados em oncologia, pois atua de forma sistêmica, ou seja, em todas as células do corpo. Assim, quando há ocorrência de grandes tumores, metástase, recidivas, ou cânceres de alta malignidade, a quimioterapia se faz essencial ao tratamento desses pacientes.32
A quimioterapia refere‐se a qualquer tratamento que usa compostos químicos, chamados quimioterápicos, que afetam o funcionamento celular.30 Essa medida terapêutica consiste no uso de medicamentos a fim de destruir as células cancerosas e bloquear o seu desenvolvimento.30 Entretanto, a maioria dos quimioterápicos atua de forma não específica, lesa tanto células malignas quanto células normais.34
Praticamente todas as mulheres submetidas à quimioterapia de indução e irradiação corporal total, antes do transplante de medula óssea, são irreversivelmente esterilizadas.35 Dentre os quimioterápicos mais usados na prática oncológica, os agentes alquilantes são, em geral, mais tóxicos para o ovário do que outras classes de quimioterápicos.36,37 No entanto, estudos pré‐clínicos têm mostrado que as antraciclinas e os compostos de platina também têm efeitos tóxicos para as células germinativas.38,39 Também é conhecido que os folículos primordiais (oócitos e células da granulosa) são particularmente sensíveis aos agentes alquilantes.1
Toxicidade ovariana induzida pela quimioterapiaDentre todas as células saudáveis do organismo, os folículos ovarianos mostram‐se particularmente sensíveis aos quimioterápicos e importantes para as mulheres submetidas à quimioterapia, uma vez que a integridade desses folículos é fundamental para assegurar a função reprodutiva feminina. Como consequência dessa sensibilidade, tem sido observada, com frequência, falência ovariana prematura em pacientes submetidas à quimioterapia.40 Esse fato tem sido comprovado por meio de vários estudos pré‐clínicos que descreveram padrões similares de insuficiência ovariana após quimioterapia, principalmente após exposição a agentes alquilantes.11,41,42 A gonadotoxicidade induzida pela quimioterapia envolve principalmente perda da reserva ovariana, ou seja, principalmente folículos primordiais.43 A falência ovariana induzida pela quimioterapia se manifesta pela perda rápida e permanente da menstruação em muitas pacientes. Isso indica que o efeito tóxico também atinge os folículos maduros.40 Esse fenômeno depende da idade da mulher, do regime quimioterapêutico e do número existente de folículos primordiais que constituem a reserva ovariana.44 Também tem sido observado um efeito direto sobre oócitos devido à capacidade de o quimioterápico atravessar a barreira hematofolicular e alcançar os oócitos inclusos nos folículos ovarianos.45 Bar‐ Joseph et al.46 demonstraram a desintegração e dispersão mais rápida e pronunciada da cromatina nos oócitos em estágio de vesícula germinativa (VG) quando comparados com oócitos maturos ou em metáfase II (MII). Esse resultado fortalece a hipótese de que os oócitos em VG e MII respondem diferentemente à exposição a quimioterápicos. Além disso, vários estudos têm demonstrado a presença de fibras colágenas no estroma cortical após tratamento quimioterápico, sinal característico de morte celular e cicatrização do tecido ovariano.41 Ademais, estudos que usaram a técnica de bioimagem observaram uma redução aguda do fluxo sanguíneo ovariano e desintegração da parede dos capilares circunjacentes aos folículos após administração de doxorrubicina (8mg/kg) in vivo.46 Outro estudo que também usou a técnica de bioimagem mostrou que uma única injeção da doxorrubicina (7,5mg/kg) resultou em uma redução significativa no tamanho e do peso dos ovários que persistiu por até um mês após o tratamento.39,47
Gonadotoxicidade de acordo com a classificação dos quimioterápicos antineoplásicosOs fármacos antineoplásicos constituem um grupo heterogêneo de substâncias químicas capazes de inibir o crescimento e/ou os processos vitais das células tumorais com uma toxicidade tolerável sobre grande parte das células normais.48 Essas drogas podem ser classificadas em agentes alquilantes, antraciclinas, antimetabólitos, compostos de platina, taxanos e agentes diversos,49 como mostrado nos tópicos a seguir.
Agentes alquilantesSão compostos capazes de substituir em uma molécula um átomo de hidrogênio por um radical alquil.50 Ligam‐se ao DNA de modo a impedir a desespiralização da dupla hélice de DNA, fenômeno esse indispensável para a reprodução celular.51 Os agentes alquilantes agem em todas as fases do ciclo celular de modo inespecífico, até em células que não estão em divisão ativa, como os oócitos e a população de folículos primordiais.2 No entanto, os danos causados por esse tipo de agente só se tornam perceptíveis durante a divisão celular. Os agentes alquilantes formam ligações interfilamentares com o DNA. Portanto, necessitam de ser metabolizados pelas fosfamidases (enzimas microssomais hepáticas), para que seus metabólitos possam exercer o efeito alquilante celular.52 O principal sítio de alquilação no DNA é a posição N7da guanina, porém outras bases podem ser menos extensivamente alquiladas, como a adenina nas posições N1 e N3, a citosina no N3 e a guanina no O6, assim como grupos fosfatos e proteínas associadas ao DNA.34
A ciclofosfamida é o agente dessa classe mais usado na maioria dos protocolos para o tratamento do câncer de mama.53,54 Recentemente, van der Kaaij et al.55 relataram, após um longo acompanhamento (1964‐2004) de pacientes (idade de 15 a 40) com linfoma de Hodgkin, um aumento no risco de falência ovariana prematura de 23% por cada ano de idade durante o tratamento. Em camundongas, uma exposição mínima à ciclofosfamida (dose única de 20mg/kg) reduziu significativamente a população de folículos primordiais.44 Além do esgotamento folicular, também foi descrito em um estudo feito em humanos que o uso de agentes alquilantes resultou em fibrose do córtex ovariano e danos nos vasos sanguíneos.56 Esses danos mostraram‐se concomitantes com uma depleção de folículos primordiais. Isso indica que danos nos vasos sanguíneos foram associados a lesão nessa categoria folicular. Além disso, os danos nos vasos sanguíneos podem também prejudicar os processos de formação de novos vasos que são fundamentais para o crescimento de folículos normais.11
AntraciclinasRepresentam uma importante classe de antibióticos antitumorais57 e estão amplamente integradas numa variedade de tratamentos anticâncer. Dentre as drogas mais usadas nesse grupo destaca‐se a doxorrubicina, que foi usada pela primeira vez em ensaios clínicos em 196058 e ainda é um agente fundamental na quimioterapia de primeira linha. Atualmente, a doxorrubicina é usada para tratar cerca de 50% dos casos de câncer que ocorrem durante a pré‐menopausa, incluindo cânceres de mama e pediátricos.59 A doxorrubicina transpassa a membrana celular, se acumula tanto no núcleo como nas mitocôndrias e induz o estresse oxidativo e a obliteração cromossômica por meio da inibição da topoisomerase II.60 Além disso, induz a toxicidade no ovário, que se manifesta pela redução na taxa de ovulação, acompanhada por uma redução no tamanho do ovário, causadas provavelmente por um dano agudo ao ovário.39 Esse efeito foi observado por ressonância magnética nas primeiras 24 horas após o tratamento e indicou um edema periovariano marcado, que pode representar redução real do ovário causada por uma mudança de fluidos do tecido do ovário para o saco bursal circundante (ou espaço peritoneal humano).39 Também foi demonstrado que a doxorrubicina, de uma forma dose dependente, provocou indução maciça da fosforilação da histona H2AX, devido à formação de quebras na dupla fita do DNA em oócitos de mamíferos, o que induziu a apoptose e acarretou na redução significativa da sobrevivência in vitro.61,62
Agentes antimetabólitosExercem seus efeitos principalmente por bloquear bioquimicamente a síntese do DNA e, portanto, são restritos à fase S do ciclo celular.24 Muitos desses compostos são análogos de nucleosídeos que exercem a sua atividade por meio do bloqueio de vias do metabolismo dos nucleotídeos, substituem um dos blocos de construção dos ácidos nucleicos e atuam como antagonistas de DNA.63 Os principais compostos desses grupos são os análogos de pirimidina (5‐fluorouracil (5‐FU), capecitabina, floxuridina e gencitabina) e de purina (6‐mercaptopurina, 8‐azaguanina, fludarabina e cladribina).25 Dentre os agentes antimetabólitos mais usados na quimioterapia, destaca‐se o 5‐FU, o qual parece apresentar menor efeito tóxico sobre a função reprodutiva humana.64 Basicamente, o 5‐FU é um análogo de pirimidina que pode ser incorporado pelo DNA e RNA no lugar da uracila ou timina e conduz interferências no processamento de RNA nuclear para assim exercer o seu efeito. No entanto, a sua conversão a 5‐fluoro‐2’‐desoxi‐5’ monofosfato (FdUMP) leva à inibição da timidilato‐sintase (TS) e, subsequentemente, da síntese de DNA.65
A administração única de 5‐FU em camundongas, durante a fase de estro (pós‐ovulatória imediata), resultou em perda de fertilidade, determinada por uma redução na taxa de gestação bem‐sucedida, em relação às camundongas nos quais o 5‐FU foi administrado durante o metaestro, diestro ou proestro.66 No entanto, é salutar observar que ainda há uma escassez de dados clínicos que possam definir o risco de infertilidade. Um relato de caso com uma paciente diagnosticada com câncer de colón demonstrou que o tratamento com 5‐FU associado com leucovorina (20mg/m2/dia), seguido por 5‐FU como um único agente (425mg/m2/dia) de 1‐5 dias a cada 28 dias durante 4 meses, resultou em falência ovariana prematura.67 Contudo, faltam dados sobre a incidência de amenorreia em humanos associados com o único regime de 5‐FU e um aumento do risco de danos nas células germinativas causado por uma dose única de 5‐FU não está bem definido.64
Compostos de platinaOs antineoplásicos formados por compostos de combinação com platina, como a cisplatina e a carboplatina, alquilam o DNA.23,24 O mecanismo de ação desses compostos está relacionado com a inibição seletiva da síntese do DNA.50 A ligação da platina com o DNA ocorre preferencialmente por meio de um dos átomos de nitrogênio da guanina ou da adenina. A interação mais estável é com o nitrogênio da guanina, em razão da possibilidade de formação de ligação de hidrogênio do grupo NH3 da cisplatina com o oxigênio da guanina, uma vez que essa interação não ocorre com a adenina.68,69
A descoberta das propriedades antitumorais da cisplatina constituiu um marco na história da química medicinal, a qual inicialmente dedicava‐se principalmente ao estudo de compostos orgânicos e produtos naturais.70 Barnett Rosenberg et al.71 investigavam o efeito da corrente elétrica no crescimento bacteriano de Escherichia coli quando chegaram à conclusão de que a mitose das bactérias era inibida não por fenômenos elétricos, mas por um agente químico, a cisplatina. Em 1978, a Food and Drug Administration aprovou a cisplatina para o uso clínico nos casos de câncer, como o de bexiga, de colo do útero, de esôfago, de cabeça, de pescoço, de ovário e de testículo.72 No entanto, têm sido relatados efeitos gonadotóxicos em tratamentos quimioterápicos com cisplatina.73 A infertilidade associada à cisplatina é causada pelo efeito tóxico sobre os folículos primordiais, que constituem o pool da reserva ovariana.19 A insuficiência ovariana causada pela cisplatina foi avaliada durante o uso clínico,74‐76 bem como em estudos que usaram camundongos, quer seja in vivo ou in vitro.19,77,78
A cisplatina induz uma redução na taxa de ovulação e causa um declínio nos níveis de hormônio anti‐mulleriano (AMH) e inibina‐A em ratas79‐81 Em mulheres, estudos in vitro resultaram na destruição dos folículos primordiais, caracterizada por inchaço das células da granulosa, marcado pelo acúmulo de citoqueratina e inchaço nuclear. Foram perceptíveis, por meio de análise histológica, alterações na arquitetura dos folículos primordiais.3,82 Contudo, o mecanismo de ação da toxicidade da cisplatina em ovários ainda não foi completamente explicado. Chirino et al.70 sugeriram que tal toxicidade pode ser devida a um aumento da produção de espécies reativas de oxigênio e diminuição da produção de antioxidantes.
TaxanosOs taxanos (paclitaxel e docetaxel) agem sobre o citoesqueleto celular, estabilizam os microtúbulos, interrompem a polimerização/despolimerização normal e conduzem a uma parada das células na fase G2‐M do ciclo celular.83
Em ratas, o tratamento com paclitaxel (7,5mg/kg) resultou na redução no número de folículos primordiais,19 quando comparado com animais não tratados, o que resulta em perda de fertilidade. No entanto, o acompanhamento tardio (após 63 dias) não revelou diferença significativa no número de fetos, implantação local e reabsorção e sugeriu que o efeito tóxico do paclitaxel sobre o ovário pode ser reversível.84 Outro estudo, feito em camundongas pré‐púberes, mostrou que a administração de paclitaxel (2,5 ‐7,5mg/kg) provocou o esgotamento da reserva de folículos primordiais de uma maneira dose‐dependente.85 Apesar dos resultados obtidos até o momento, ainda permanece desconhecido até que ponto o efeito dos taxanos pode causar a falência ovariana prematura, bem como se o seu efeito pode ser reversível ou não.
Opções de preservação da fertilidade para pacientes submetidas à quimioterapiaCom vistas a reverter ou minimizar os danos às células reprodutivas decorrentes da quimioterapia, necessária a pacientes com câncer, cada vez se tornam mais frequente os estudos e a busca tanto por opções para preservar a fertilidade feminina, quanto por tratamentos que sejam mais seletivos para células cancerosas.86 Contudo, de forma geral, as drogas usadas atualmente ainda apresentam danos severos aos folículos ovarianos.39,41,87
Existem diversas opções para preservação da fertilidade de mulheres submetidas a tratamentos quimioterápicos. Dentre essas podem ser mencionadas a administração de análogos do hormônio liberador de gonadotrofinas (GnRH‐a), na tentativa de apenas reduzir os efeitos gonadotóxicos da quimioterapia, ou mesmo opções mais seguras, como a criopreservação de embriões de oócitos maturos (metáfase II) e de tecido ovariano.88,89
No tocante à criopreservação de embriões, sabe‐se que essa técnica já está bem estabelecida em pacientes com risco de falência ovariana prematura e que desejam uma gravidez futura.90 A primeira gravidez resultante de transferência de um embrião humano criopreservado foi relatada em 1983 na Austrália91 e o primeiro nascido vivo após criopreservação de embriões foi relatado em 1984 na Holanda.92 Entre 1997‐2011 foi relatado um aumento na taxa de nascidos vivos de 21% para 39% para os ciclos de transferência de embriões congelados e descongelados em mulheres com idade inferior a 35 anos.90
Apesar desses resultados, a criopreservação de embriões não é apropriada para todas as pacientes que serão submetidas ao tratamento de câncer, principalmente quando são submetidas ao tratamento antes da puberdade.11 Além disso, a criopreservação de embriões requer uma superovulação inicial, o que resulta tanto em retardo do início do tratamento como em desenvolvimento de tumores hormônio‐dependentes.2 Além disso, os custos relacionados aos procedimentos de superovulação e fertilização in vitro são extremamente caros e por isso são uma barreira limitante para as pacientes.1 Além desses aspectos, a criopreservação de embriões envolve ainda questões éticas e legais. Portanto, considerando esses dois últimos aspectos, a criopreservação de oócitos torna‐se uma opção viável para pacientes.
A criopreservação de oócito é uma estratégia atrativa para preservar a fertilidade feminina, uma vez que não necessita de cirurgia, e os protocolos de estimulação hormonal também testados para a fertilização in vitro podem ser usados.93 O primeiro nascimento após a criopreservação de oócitos humanos foi relatado por Chen et al. em 1986.94 Até 2004, cerca de 100 crianças haviam nascido a partir de oócitos criopreservados, porém as taxas de gravidez relatadas têm sido muito baixas, isto é, em torno de 1% a 5%.95 No entanto, há várias razões para limitação do sucesso: baixas taxas de sobrevivência dos oócitos (25‐40%) a temperaturas da criopreservação, baixa implantação dos embriões após a fertilização in vitro tradicional, alta incidência de poliploidia e pouca capacidade de desenvolvimento dos embriões.96 Além disso, semelhantemente ao observado para embriões, se o procedimento é feito com oócitos maturos, existe a necessidade de a paciente se submeter a um tratamento hormonal, o qual não poderá ser possível se o tratamento anticâncer tiver de iniciar imediatamente.
Com vistas a vencer as dificuldades encontradas para a criopreservação de embriões e oócitos, principalmente a necessidade de superovulação, a criopreservação de tecido ovariano é considerada como um método indicado para as mulheres que não podem atrasar o tratamento oncológico.97 A criopreservação de tecido ovariano pode ser planejada imediatamente após o diagnóstico de doenças malignas e não requer estimulação hormonal.1 Portanto, a criopreservação de tecido do córtex ovariano, região rica em folículos primordiais e primários, tem sido sugerida como uma opção para preservar a fertilidade feminina.98 Geralmente, o tecido cortical do ovário é removido por meio de laparoscopia, a qual é seguida pela criopreservação do córtex ovariano.99 Após o tratamento oncológico, o tecido ovariano pode, então, ser descongelado e reimplantado ortotopicamente na fossa ovariana.100 Desde o primeiro relato de nascimento de uma criança saudável após autotransplante de tecido ovariano humano criopreservado,101 a criopreservação de tecido ovariano seguida por reimplante ortotópico levou ao nascimento de mais de 20 bebês saudáveis.102,103 Como pode ser observado, a criopreservação e o transplante de tecido ovariano parecem ser uma forma promissora de preservação da fertilidade.
Considerações finaisOs danos à fertilidade feminina em decorrência de tratamentos antineoplásicos são influenciados por diversos fatores, tais como o mecanismo de ação do agente quimioterápico, protocolo usado, a idade e susceptibilidade das pacientes. Com vistas a minimizar ou até mesmo anular esses danos, o uso de análogos de GnRH representa uma opção menos invasiva e de menor custo para preservação da fertilidade. No entanto, pela falta de um método reconhecidamente eficaz, a combinação de vários métodos de preservação é recomendada, de forma a maximizar as chances de preservar a fertilidade. Dentre esses métodos, a criopreservação de tecido ovariano tem ganhado destaque por não atrasar o início do tratamento oncológico, bem como por permitir o nascimento de indivíduos saudáveis com o uso do transplante de tecido ovariano criopreservado após cura das pacientes. No entanto apesar dos grandes avanços já alcançados com a criopreservação de tecido ovariano humano, os relatos de sucesso limitam‐se ainda a poucos países da Europa e aos Estados Unidos. Além disso, é desejável também que a preservação da fertilidade feminina após tratamentos oncológicos possa ainda ser aperfeiçoada e acreditamos que esteja diretamente ligada ao desenvolvimento de fármacos que atuem de forma mais específica nas células cancerosas, bem como ao conhecimento exato dos mecanismos gonadotóxicos. O conhecimento desses mecanismos permitirá bloquear a via de toxicidade e resultar em maior eficácia da preservação da fertilidade.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.