Durante a foliculogênese em mamíferos, ocorre um longo e complexo processo no qual o oócito adquire a competência necessária para a fecundação. Nesse processo ocorre uma comunicação metabólica bidirecional entre os oócitos e as células somáticas dentro do folículo que garante substratos para o oócito em desenvolvimento. Essa comunicação é mediada pelas junções celulares (junções comunicantes e junções aderentes) presentes nas projeções transzonais. As junções celulares e moléculas de adesão são responsáveis principalmente por promover a adesão entre as células foliculares; mas podem atuar em vias de sinalização celular e na regulação da transcrição gênica nas células somáticas e oócitos. Além disso, as junções comunicantes (junções gap) são canais intermembranares que intermediam a comunicação entre essas células através da passagem de pequenas moléculas. Essas junções comunicantes são compostas por proteínas denominadas conexinas; as conexinas 37 e 43 são as predominantes nos folículos ovarianos. Dessa forma, o conhecimento acerca das junções celulares é de extrema importância para o estudo da foliculogênese. A presente revisão teve como objetivo abordar os principais tipos de junções celulares existentes entre as células foliculares, com destaque para as junções gap e as principais proteínas de membranas (conexinas) presentes nos diferentes estágios do desenvolvimento folicular.
During the mammalian folliculogenesis, a long and complex process occurs, which the oocyte acquires the necessary competence for fecundation. In this process there is a metabolic bidirectional communication among the oocyte and somatic cells inside the follicle, which provides substrates for the oocyte developmental competence. This communication is mediated by cellular junctions (occlusions, adherens and gap junctions) localized in the transzonal projections. Cellular junctions and adhesion mollecules are responsable mainly for promoving the adhesion among follicular cells, however they can act in cellular signaling pathways and in regulation of genic transcription in the follicular cells and oocyte. Moreover, the communication junctions (gap junctions) are intermembrane channels that intermediate the communication among these cells through the passage of small molecules. These gap junctions are composed by connexins, of which the connexins 37 and 43 are the most frequently found in the ovarian follicle. Thus, knowledge of these cellular junctions are of great importance for studying the folliculogenesis process. The aim of this review was to report the main types of cellular junctions localized among the follicular cells, especially the gap junctions and the main membrane proteins (connexins) found in different stages of the follicular development.
Os organismos multicelulares têm células com capacidade de se comunicar umas com as outras e proporcionar um mecanismo indispensável para os tecidos interagirem. A comunicação entre as células ocorre de forma parácrina, endócrina ou autócrina e é mediada por uma variedade de moléculas, como peptídeos, grandes proteínas inseridas na membrana celular, aminoácidos, nucleotídeos, esteroides e outros lipídeos. Além da comunicação via moléculas de sinalização e seus receptores, as células definem seus limites de contato, apical e basolateral, de acordo com características estruturais e funcionais presentes neles.1
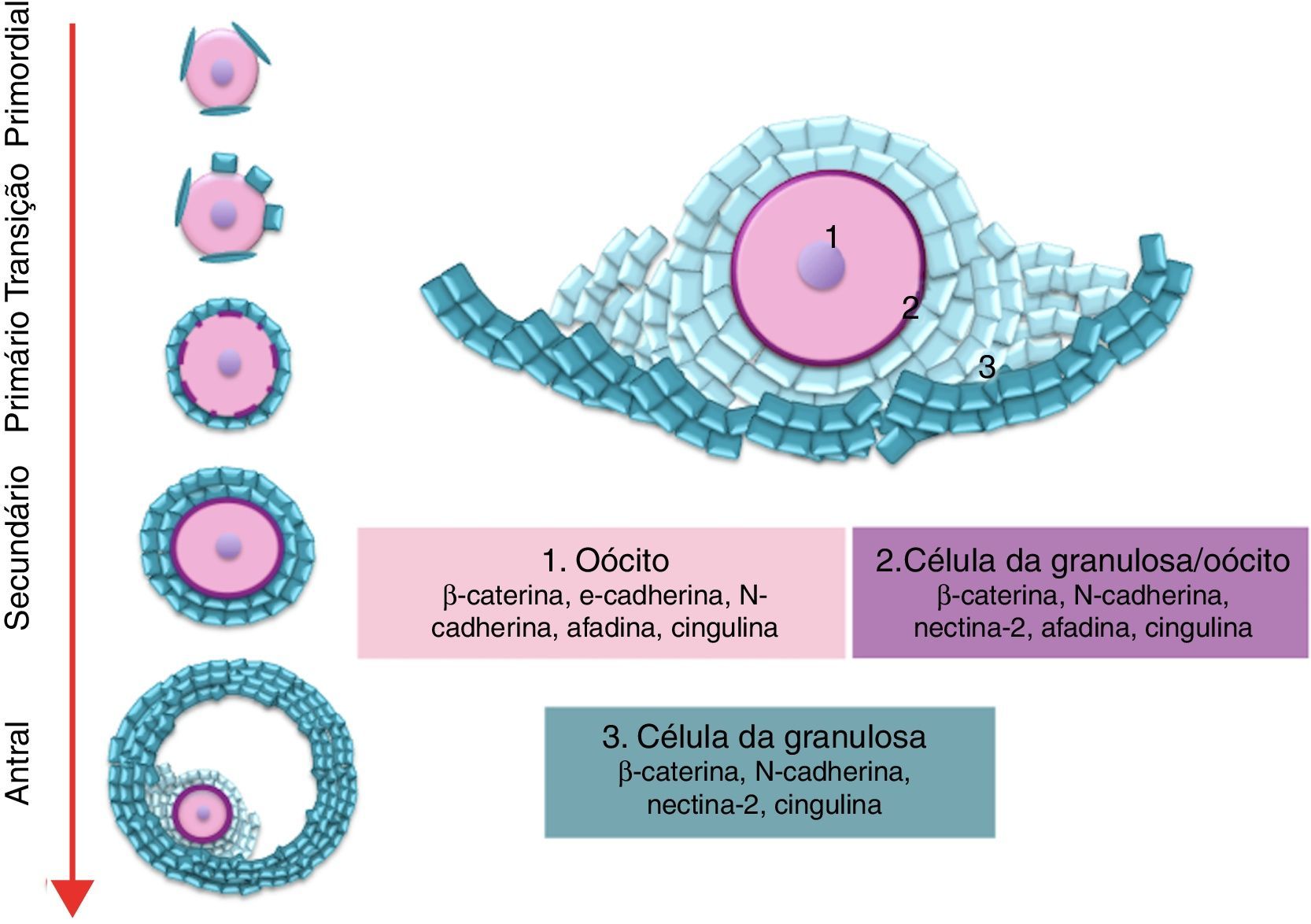
No seu domínio basolateral, as células têm principalmente junções celulares e moléculas de adesão para estabelecer o contato entre si e permitir a comunicação célula‐célula. As junções celulares são divididas em três categorias, de acordo com as suas funções: junções de oclusão, aderentes e comunicantes. As junções de oclusão e aderentes formam importantes estruturas de contato entre células vizinhas. Essas junções são compostas por diferentes proteínas transmembranares que fazem contato entre as células e as ligações intracelulares com o citoesqueleto de actina, além de atuar em vias de sinalização celular, incluindo a regulação da transcrição gênica nas células2 (fig. 1).
As junções comunicantes, também conhecidas como junções gap, são regiões especializadas da membrana celular que intermediam a comunicação entre as células. São canais intercelulares de membrana que permitem a passagem de íons, moléculas que atuam como segundos mensageiros e pequenos metabólitos (<100 KDa).3 As junções comunicantes ou junções gap são compostas por unidades chamadas conexons que formam um conjunto de canais proteicos compostos por uma família de mais de 20 proteínas chamadas conexinas.4
Diversas pesquisas têm tornado evidente que as comunicações intercelulares juncionais (junções comunicantes ou junções gap) exercem importante função no desenvolvimento embrionário e na reprodução.4–6 Especificamente no ovário, há uma clara evidência do envolvimento de junções celulares no desenvolvimento dos folículos ovarianos. Durante o crescimento e o desenvolvimento do gameta feminino (oócito) em mamíferos, há uma conexão contínua dos oócitos com as células foliculares circundantes através de junções de oclusão, aderentes e gap.4,7–9 O folículo ovariano é um exemplo claro da importância das comunicações intercelulares no processo de desenvolvimento. Nos folículos ovarianos, tanto junções de adesão como gap se formam entre o oócito em crescimento e as células foliculares e formam um sincício funcional.10
Dada a importância das junções celulares para o desenvolvimento folicular ovariano, a presente revisão fará uma abordagem sobre os tipos de interações entre as células foliculares, com destaque para as junções gap e as principais conexinas encontradas nos folículos ovarianos.
Papel das comunicações intercelulares no desenvolvimento folicular ovarianoFoliculogênese e desenvolvimento folicularO folículo ovariano consiste no oócito circundado por células somáticas, da granulosa e da teca, que representam a unidade funcional básica do ovário.11 Em mamíferos, o oócito entra em meiose I, passa um período prolongado de quiescência nos folículos primordiais e constitui o pool de reserva de gametas femininos no ovário. A foliculogênese é marcada por um período de proliferação das células da granulosa que circundam o oócito e pelo crescimento oocitário. O crescimento do oócito é acompanhado por expressão gênica seletiva para atender a demandas de estocagem de organelas e macromoléculas que serão herdadas pelo embrião.12
A foliculogênese pode ser divida nas seguintes fases (1) crescimento folicular pré‐antral: compreende a transição do folículo primordial para primário e formação dos folículos secundários em crescimento; (2) crescimento antral: marca o desenvolvimento dos folículos antrais iniciais para o estágio gonadotrofina‐dependentes e (3) crescimento antral terminal: ocorre o desenvolvimento dos folículos antrais para o estágio pré‐ovulatório.13
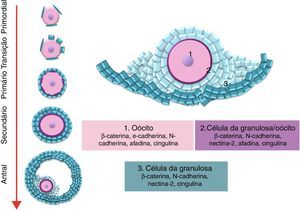
A foliculogênese inicia‐se ainda na vida intrauterina na maioria das espécies, com a formação dos folículos primordiais quiescentes, que são formados pelo oócito em prófase I da meiose circundado por uma camada de células somáticas de formato pavimentoso. Os folículos primordiais saem do pool de reserva e passam para o pool de folículos em crescimento. O folículo primário é caracterizado pela mudança de células foliculares pavimentosas para cúbicas e entra em fase de crescimento. O crescimento progressivo do oócito é acompanhado pela proliferação e multiplicação das camadas de células da granulosa ao redor do oócito e os folículos passam a se denominar secundários ou multilaminares. Durante o crescimento dos folículos secundários, ocorre a diferenciação das células do estroma em células da teca ao redor do folículo em crescimento.14,15 Uma vez que o folículo pré‐antral alcança um tamanho específico, com 6 ou 7 camadas de células da granulosa, começa a ocorrer a formação de uma cavidade preenchida por fluido e esses se tornam folículos antrais. O folículo pré‐ovulatório contém um oócito completamente crescido, circundado por milhares de células do cumulus e células da granulosa murais que delimitam a cavidade antral e são circundadas pela células da teca13 (fig. 1).
Comunicações intercelulares durante o desenvolvimento folicularA morfologia das células da granulosa regula a proliferação celular e a esteroidogênese em camundongos e ratos.16,17 Em outros tipos celulares, a morfologia celular pode ainda regular a síntese de DNA, expressão gênica, diferenciação e apoptose.18 Durante a foliculogênese ocorre uma cooperação metabólica entre oócitos e células somáticas dentro do folículo para assegurar substratos para o oócito em desenvolvimento. Evidências morfológicas sugerem que essa cooperação se estende durante toda a foliculogênese, nos estágios primário, secundário e terciário (antral).19 Essa cooperação é mediada pelas junções comunicantes entre o oócito e as células da granulosa.20 Substratos como aminoácidos, glicose, metabólitos e nucleotídeos são transferidos para o oócito via junções gap.7 Além disso, moléculas que regulam a maturação meiótica do oócito também passam através de junções gap.10
A comunicação entre as células da granulosa e os oócitos acontece de maneira bidirecional e é essencial para o desenvolvimento tanto do oócito como das células da granulosa.7 Ooócito também secreta fatores que afetam os padrões de expressão gênica nas diferentes populações de células da granulosa, como, por exemplo, suprime a expressão de fatores importantes para o desenvolvimento do oócito como Kit Ligand e receptores para o hormônio luteinizante (LH) nas células do cumulus.21–23 Além disso, Sugiura et al.24 demonstraram que a produção energética nos folículos antrais, ou seja, glicólise e ciclo do ácido tricarboxílico, essencial para produção de ATP celular, é regulada por sinais emitidos dos oócitos para as células da granulosa e que a produção desses sinais e a capacidade de responder a eles são coordenados e dependentes do estágio de desenvolvimento das células.
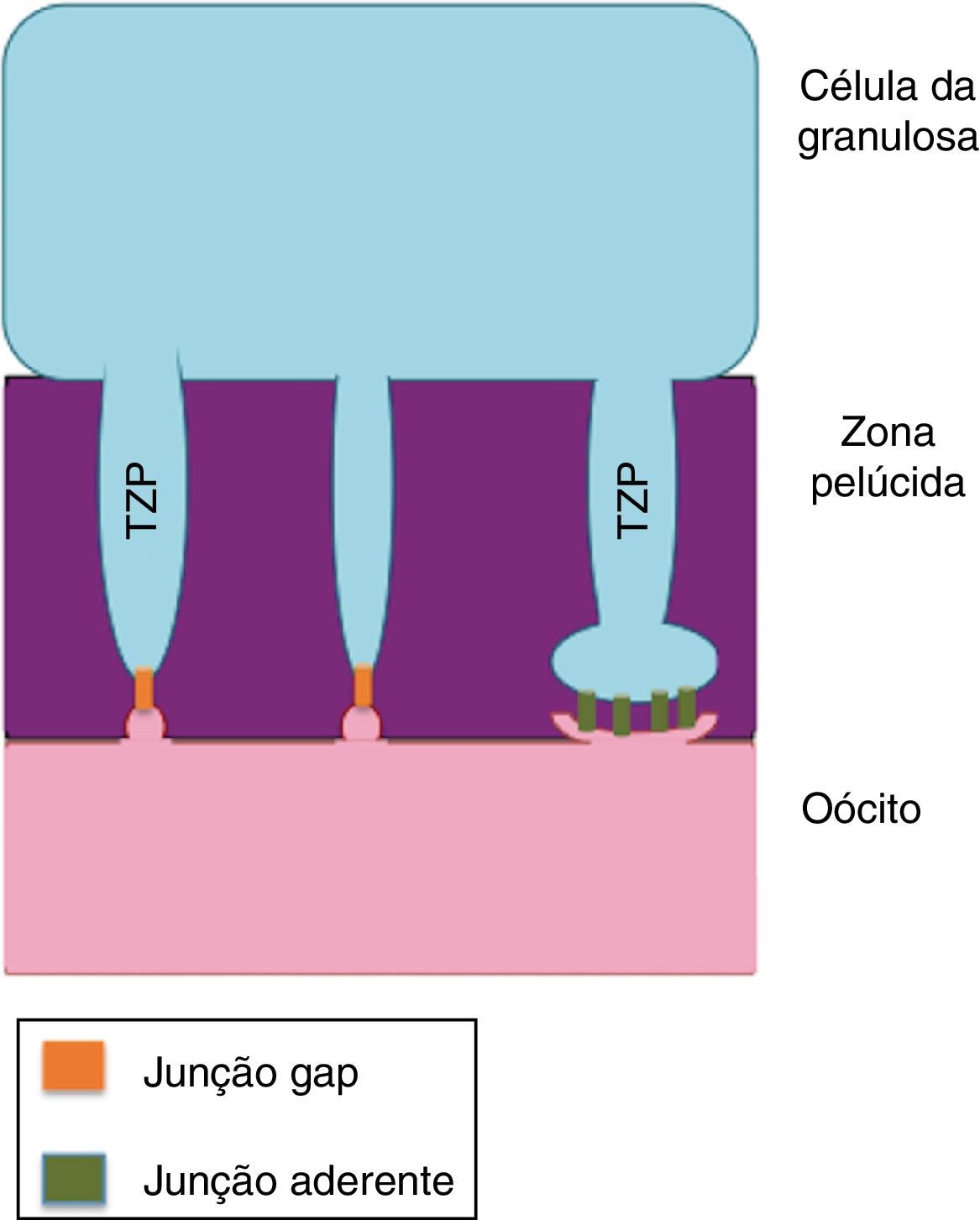
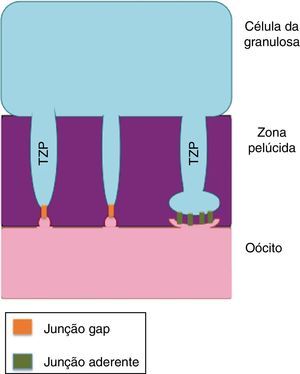
Estudos relatam que essa comunicação entre o oócito em desenvolvimento e as células da granulosa circundantes é facilitada por projeções transzonais (PTZ) das células da granulosa que entram em contato com a superfície do oócito. Esses estudos indicam que esses contatos possibilitam a passagem de fatores de crescimento e a ocupação de receptores na interface entre as células da granulosa e o oócito.25 As PTZ são extensões das células da granulosa que atravessam a zona pelúcida e entram em contato com a superfície do oócito e são estruturas caracterizadas em muitas células de mamíferos por microscopia eletrônica.26 O número e a estrutura dessas PTZ variam de forma dinâmica de acordo com o desenvolvimento folicular e parecem modular a comunicação e a troca de substâncias entre o oócito e as células foliculares.27
As PTZ partem da superfície das células da granulosa e entram em contato com a membrana plasmática do oócito, onde estão presentes junções comunicantes (gap) e junções aderentes ou de oclusão (fig. 2). As PTZ são estruturas ricas em proteínas estruturais dos microtúbulos que dão suporte ao movimento ativo de organelas dentro das células somáticas e permitem o maior contato com a superfície do oócito. Conforme o oócito aumenta em volume citoplasmático, a complexidade das PTZ evolui e aumenta o número de junções comunicantes e junções aderentes.19 Em folículos pré‐antrais as PTZ são numerosas e têm zonas de contato compostas por moléculas de adesão e junções comunicantes que permitem a comunicação entre as células da granulosa e o oolema. Durante o crescimento oocitário inicial, as PTZ se estendem tão profundamente no ooplasma que afetam a vesícula germinativa. Após o desenvolvimento do antro, as PTZ se retraem e mantêm poucas conexões terminais com o oócito em relação aos folículos pré‐antrais.26
Recentemente, Mora et al.8 verificaram que durante o primeiro sinal da diferenciação das células da granulosa nos folículos primordiais murinos, ou seja, durante a transição de células pavimentosas a cúbicas que caracteriza a transição do folículo quiescente para folículo em desenvolvimento, é o momento em que ocorre o aumento do contato entre as membranas do oócito e das células da granulosa. Além disso, observaram que durante o crescimento folicular e mediante surgimento da zona pelúcida as PTZ se tornaram abundantes, concomitantemente ao aumento no número de microvilosidades no oócito e ao aparecimento de regiões elétron densas nos pontos de contato entre as PTZ e as microvilosidades, o que indica a presença de junções celulares nessa região.
Junções de oclusão presentes em folículos ovarianosAs junções de oclusão presentes nas PTZ que entram em contato com a membrana do oócito são complexos proteicos que determinam a polaridade das células e impedem a livre difusão de lipídeos e proteínas entre os domínios apicais e basolaterais da membrana plasmática. Além disso, formam uma barreira epitelial que impede a livre passagem de substâncias via paracelular. As junções de oclusão formam faixas de proteínas transmembranares ao redor de todo o perímetro celular. Proteínas transmembranares, como claudinas e ocludinas, auxiliam a manter adesão celular e regulam a sinalização intracelular e a organização do citoesqueleto.19,26 As moléculas transmembranares que participam das junções de oclusão se ligam a proteínas que ancoram o citoesqueleto das células. Dentre as proteínas de adesão presentes nesses complexos, as ocludinas e claudinas são as mais extensivamente estudadas. Embora as ocludinas sejam moléculas altamente conservadas, as claudinas compreendem uma família de mais de 20 diferentes proteínas, nas quais a claudina‐5 está expressa nas células endoteliais vasculares.28
As proteínas ocludina e claudina‐5 que compõem as junções de oclusão foram encontradas em folículos ovarianos de primatas diferencialmente expressas durante o desenvolvimento folicular.29 Nesse mesmo estudo, quando os autores suprimiram a angiogênese folicular pela inibição do fator de crescimento endotelial vascular (VEGF), verificaram que essa inibição afetou negativamente a expressão de ocludinas nas células da granulosa. Portanto, esse estudo leva a crer que a adesão mediada pela ocludina e claudina‐5 pode exercer um papel crítico durante o crescimento folicular, que exige mudanças morfológicas e fisiológicas no processo de remodelamento do tecido ovariano.
As junções de oclusão influenciam o transporte de fluidos extracelulares entre as células e são os componentes mais apicais dos complexos juncionais intercelulares, os quais selam completamente o espaço entre as células adjacentes. Dessa forma, são importantes não apenas para a comunicação entre as células, mas também promovem a formação de uma barreira na membrana celular que regula a permeabilidade paracelular e mantém a integridade celular e do tecido.30
No folículo ovariano a formação de uma barreira epitelial pelas células da granulosa favorece um movimento seletivo de fluido de fora para dentro do folículo no espaço entre as células da granulosa que é essencial para a formação da cavidade antral.31 Durante a passagem do estágio de folículo pré‐antral para antral, solutos e água atravessam o endotélio capilar para dentro da cavidade antral e se deparam com a multicamada de células da granulosa e seus complexos juncionais, que garantem que o movimento de fluido não ocorra de maneira descontrolada.32 Durante o crescimento do folículo, múltiplos espaços preenchidos por fluido acumulam entre as células da granulosa, os quais se expandem, coalescem e formam uma grande cavidade central que é o antro. A formação desses espaços entre as células da granulosa ocorre provavelmente onde as junções comunicantes e moléculas de adesão estejam reduzidas. A diminuição das junções celulares e de moléculas de adesão provavelmente favorece o desenvolvimento do antro, juntamente com a secreção de moléculas de alto peso molecular, como glicosaminoglicanos e proteoglicanos, que aumentam a pressão osmótica. No entanto, como ocorre a regulação da presença dessas junções nas células da granulosa para formação do fluido folicular ainda não está bem claro.31,32
Curiosamente, em um estudo recente com folículos pré‐antrais de camundongos, as junções de oclusão não foram evidenciadas pela análise ultraestrutural, expressão do mRNA ou pela expressão proteica durante o desenvolvimento folicular. As proteínas presentes nas junções de oclusão, como ocludinas e claudinas, foram encontradas apenas no epitélio do oviduto, mas não em folículos. Os autores encontraram apenas proteínas que são expressas durante a formação das junções de oclusão, as moléculas de adesão juncionais (JAMs) e cingulinas, mas em baixos níveis nas células da granulosa de folículos antrais.8 Sabe‐se que as JAMs se ligam à afadina, a qual já foi encontrada na membrana do oócito. Entretanto, até o momento não há registros de JAMs na membrana do oócito em desenvolvimento.
As adesões epiteliais ocorrem no epitélio que reveste o ovário, incluindo os complexos juncionais e componentes de adesão da matriz extracelular. Esses componentes são críticos para manutenção da integridade estrutural, polaridade e comunicação célula‐célula e sua expressão é estritamente regulada nas células normais. A perda de adesão celular é frequentemente observada em células tumorais, provoca um colapso na organização celular e causa extravasamento de nutrientes e outros fatores necessários para a sobrevivência e o crescimento de tumores e perda do contato entre as células, o que favorece a aquisição de motilidade celular e de fenótipo maligno. A redução da expressão de moléculas de adesão está diretamente relacionada com doenças invasivas e metástases no ovário.33
Junções aderentes presentes em folículos ovarianosAs mudanças no formato das células durante a transição de folículos primordiais para primários e o controle de sua proliferação no início do crescimento folicular são regulados por mudanças nas junções intercelulares e por modificações na arquitetura do citoesqueleto, que influenciam na polaridade das células e na orientação do eixo mitótico.18 Eventos que levam à maturação do folículo e à formação do corpo lúteo no ovário assemelham‐se aos processos estruturais que ocorrem durante a embriogênese. A divisão celular, dissociação, morte, migração e adesão são fenômenos comuns ao desenvolvimento de ovário e organogênese.34 Dessa forma, tem sido proposto que as moléculas de adesão presentes nas junções de ancoragem ou junções aderentes estão envolvidas nos processos de sobrevivência, proliferação, remodelação folicular, maturação, ovulação e formação do corpo lúteo no ovário.34
Nos epitélios, as junções de ancoragem, de adesão ou aderentes (Adherens Junctions) são encontradas abaixo das junções de oclusão, próximas à superfície apical das células com função de adesão celular e parecem estar envolvidas também nos eventos de sinalização celular.35 As junções aderentes são formadas por proteínas transmembranares que formam interações com o citoesqueleto de actina.18 Essas junções exercem múltiplas funções, incluindo a estabilização da adesão entre as células, regulação do citoesqueleto de actina e regulação da sinalização intracelular e transcricional. O eixo das junções aderentes incluem interações com glicoproteínas transmembranares conhecidas como a superfamília das caderinas, como as E‐caderinas, e a superfamília das cateninas, como as B‐cateninas, que juntas controlam a formação e manutenção da estrutura das junções aderentes.36 As E‐caderinas são encontradas em todos os epitélios, enquanto as N‐caderinas são encontradas no tecido nervoso e muscular. As caderinas são proteínas transmembranares dependentes de cálcio que se ligam à actina do citoesqueleto via α‐cateninas e β‐cateninas intracelulares. As nectinas também fazem parte desse complexo juncional e são proteínas transmembranares independentes de cálcio.
Estudos em oócitos de hamsters e ratos demonstraram que a E‐caderina está localizada no oócito, enquanto a N‐caderina foi detectada nas células da granulosa.34,37 Estudos anteriores identificaram o mRNA e a proteína de caderinas e cateninas no ovário de camundongos e ratos, mas não foram verificados em folículos pré‐antrais.38,39 A nectina‐2 também foi imunolocalizada em folículos primários murinos, especificamente na interface entre as células da granulosa e oócito.40
Recentemente, Mora et al.8 caracterizaram as junções celulares no ovário de camundongos e verificaram que, assim como nas células epiteliais, as células da granulosa dos folículos ovarianos expressam as moléculas de adesão que compõem as junções de oclusão, junções aderentes e desmossomos. Além disso, nesse estudo também foram identificadas por RT‐PCR e imunofluorescência as moléculas que associam as junções celulares ao citoesqueleto. Além disso, esses autores caracterizaram por microscopia eletrônica de transmissão a ultraestrutura das junções aderentes entre as células da granulosa e entre a granulosa e oócitos de folículos em diferentes estágios de desenvolvimento. Nesse estudo, os autores identificaram as junções aderentes como um complexo de adesão chave para o crescimento inicial dos folículos. As células da granulosa apresentaram principalmente N‐caderina e nectina‐2 nas junções aderentes e entre o oócito e as células da granulosa existem N‐caderinas oócito específicas e granulosa específicas que interagem entre essas células foliculares. Os autores sugerem que durante a foliculogênese as células da granulosa sofrem mudanças de polaridade, especialmente durante a formação do antro, e não se comportam exatamente como células epiteliais clássicas.
Portanto, acreditamos que ainda há muito para se investigar sobre os processos envolvidos na diferenciação das células da granulosa e do oócito durante a foliculogênese em mamíferos. Ainda são necessários estudos futuros de como as proteínas envolvidas nas junções celulares, moléculas de adesão e do citoesqueleto estão envolvidos na polarização das células foliculares e como participam desses processos de sinalização celular nos folículos ovarianos.
Junções gap em folículos ovarianosAs junções gap são canais intercelulares que permitem a troca citoplasmática de íons e metabólitos de baixo peso molecular entre células adjacentes. Essas comunicações são essenciais em muitos aspectos da fisiologia animal, incluindo a propagação de sinais elétricos e a coordenação da sinalização celular por transferência de mensageiros secundários.41
Durante todo o desenvolvimento folicular e oocitário existe um contínuo acoplamento com as células foliculares circundantes via junções gap,7 o qual se inicia com os folículos primordiais, em algumas espécies, e vai até o estágio antral.18 Na literatura, têm sido constatadas algumas evidências de que a comunicação direta célula‐célula via junções gap está envolvida no crescimento do folículo42 e na maturação do oócito43 através da passagem de substâncias que controlam esse processo.44 Além disso, a presença dessas junções a partir do estágio pré‐antral mostra que o padrão de expressão das junções gap pode refletir uma regulação do desenvolvimento de folículos pré‐antrais em crescimento.
Essas conexões permitem a transferência de aminoácidos, glicose, nucleotídeos e fatores de crescimento endócrinos e parácrinos necessários para o crescimento do oócito. De acordo com Eppig,6 o desenvolvimento dos oócitos é estritamente dependente do suprimento de nutrientes transmitido das células foliculares via junções gap. Durante o crescimento folicular o número de camadas de células da granulosa e de células da teca aumenta. Consequentemente, aumenta a distância do suprimento sanguíneo do oócito. Essa condição faz necessário, portanto, um mecanismo de comunicação intercelular eficiente que permita a passagem de nutrientes essenciais do sangue, necessários para a saúde do oócito, bem como para o desenvolvimento do antro folicular.42 Em um estudo recente com folículos ovarianos de camundongos, Mora et al.8 identificaram por microscopia eletrônica de transmissão a presença de junções gap entre células da granulosa, mostradas pela sua estrutura pentalaminar.
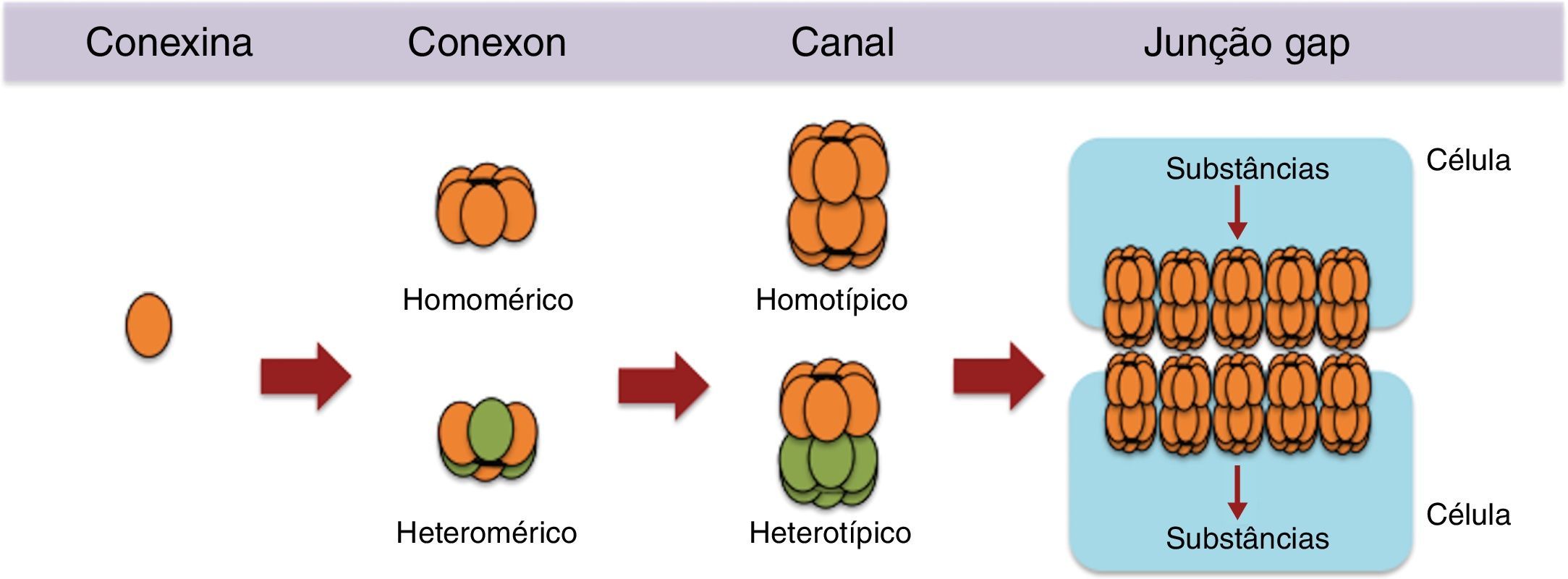
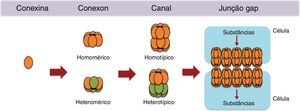
Nos tecidos em geral, inclusive no ovário, sabe‐se que essas estruturas são formadas pelo acoplamento de hemicanais chamados conexons, formados, por sua vez, por oligômeros hexaméricos de proteínas transmembranares chamadas de conexinas.45 Os conexons podem ser formados por apenas um tipo de conexina (conexon homomérico) ou pela interação de diferentes isoformas de conexinas (conexon heteromérico). Os conexons homoméricos e heteroméricos podem formar canais homotípicos e heterotípicos, ou seja, um hemicanal pode se acoplar com um hemicanal idêntico, para formar um canal homotípico, ou um hemicanal diferente para formar um canal heterotípico (fig. 3). De fato, essas variações de conexinas na formação da junção gap fazem com que esses canais sejam permeáveis a praticamente a todos os mensageiros secundários solúveis, aminoácidos, nucleotídeos, íons de cálcio, glicose e seus metabólitos.2
As conexinas são membros de uma grande família de proteínas integrais de membrana e cada uma é produto de um gene diferente, porém todas têm a mesma estrutura básica. Essas proteínas consistem de quatro domínios membranares, dois loops extracelulares, um loop citoplasmático, um domínio N‐terminal e um C‐terminal, citoplasmáticos. Os loops extracelulares formam o domínio de contato que permite o encaixe de conexons das células adjacentes. As similaridades das sequências entre os membros da família das conexinas são concentradas nos domínios transmembranares e nos loops extracelulares, enquanto o tamanho e a variação da sequência estão concentrados nos loops citoplasmáticos e extremidades C‐terminal.5 Estudos mostram que 20 e 21 membros da família de genes das conexinas são expressos no genoma de camundongos e de humanos, respectivamente.46
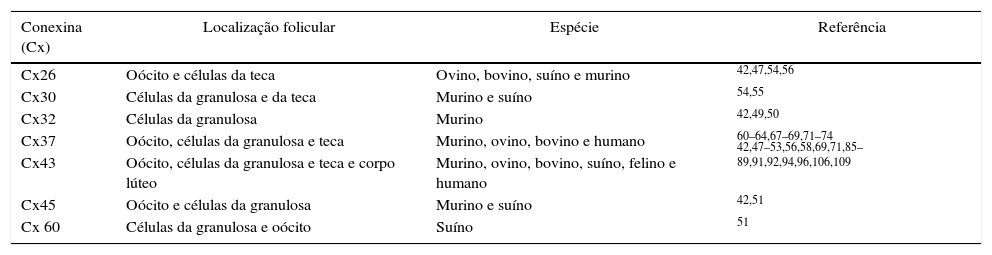
Embora nos ovários as conexinas apresentem um padrão único de expressão, essas proteínas podem ser reguladas pelo metabolismo, pelos hormônios e pelo desenvolvimento.43,47,48 Várias conexinas são expressas dentro do folículo ovariano, em alguns casos dentro do mesmo tipo celular (tabela 1). Por exemplo, as Cx32 e Cx43 foram detectadas em junções gap que unem as células da granulosa em folículos de camundongos.49 Essas mesmas conexinas estão também presentes em células da granulosa de ratos.50 A Cx45 está presente como o menor componente das junções gap em células da granulosa de camundongos e de ratos adultos e oócitos de suínos e colocalizada com a Cx43 em algumas junções gap das mesmas espécies.42,51–53 A Cx60 é expressa em células da granulosa e oócitos em suíno.51
Expressão das conexinas em células foliculares de diferentes espécies
| Conexina (Cx) | Localização folicular | Espécie | Referência |
|---|---|---|---|
| Cx26 | Oócito e células da teca | Ovino, bovino, suíno e murino | 42,47,54,56 |
| Cx30 | Células da granulosa e da teca | Murino e suíno | 54,55 |
| Cx32 | Células da granulosa | Murino | 42,49,50 |
| Cx37 | Oócito, células da granulosa e teca | Murino, ovino, bovino e humano | 60–64,67–69,71–74 |
| Cx43 | Oócito, células da granulosa e teca e corpo lúteo | Murino, ovino, bovino, suíno, felino e humano | 42,47–53,56,58,69,71,85–89,91,92,94,96,106,109 |
| Cx45 | Oócito e células da granulosa | Murino e suíno | 42,51 |
| Cx 60 | Células da granulosa e oócito | Suíno | 51 |
Além das conexinas já mencionadas, outras têm sido detectadas nos folículos ovarianos de outras espécies, notadamente, a Cx30.3 em células da granulosa e da teca de ratas e porcas.54,55 A Cx26 foi identificada em oócitos de ovelhas e vacas e células da teca de porcas.48,54,56 De acordo com Wright et al.,42 a Cx26 e Cx32 também são expressas em oócitos e células da teca de camundongos, porém o RNAm para a Cx26 não foi detectado em oócitos de camundongos desnudos nem em células da granulosa de ovários juvenis.57
Embora existam várias conexinas (Cx26, Cx30, Cx32, Cx37, Cx43 e Cx45) que constituem as junções gaps presentes no ovário, estudos indicam que os tipos que mais influenciam a foliculogênese são as Cx37 e Cx4358 e por essa razão esses tipos têm sido amplamente estudados nos folículos ovarianos.
Localização e importância da Cx37 durante a foliculogênese e oogêneseA Cx37 é um membro da família alfa das conexinas,59 a qual parece ser essencial na foliculogênese e oogênese. Essa conexina é expressa principalmente na superfície dos oócitos60,61 de muitas espécies animais, como camundongas, ratas, vacas e ovelhas.62–64 Entretanto, alguns autores identificaram marcações dessa proteína espalhadas no citoplasma do oócito de camundogas60,61 e vacas.62 Os autores acreditam que a presença dessa proteína no citoplasma do oócito pode ter ocorrido devido à ligação do anticorpo com essa conexina antes da formação da junção gap e sua associação com a membrana65 durante a internalização da Cx37 para degradação ou, ainda, a Cx37 estaria armazenada no citoplasma para ser usada durante as fases subsequentes do desenvolvimento folicular.62 Outros autores associaram essa desorganização em torno do perímetro do oócito como um sinal precoce de atresia ou morte folicular.61,66
Outros investigadores também revelaram que a Cx37 está presente em células da granulosa de folículo de camundongo, bovinos e ovinos adultos,62,64,67 bem como em células da teca de ovinos.64,65 Em bovinos, mesmo em estágios iniciais de desenvolvimento folicular, a Cx37 foi imunomarcada em toda a membranas da células da granulosa e não se restringiu à interface entre as células da granulosa e os oócitos.62 Veitch et al.68 afirmaram que é comum a presença dessa proteína tanto no oócito quanto nas células da granulosa. Entretanto, só existe formação das junções gap com essa estrutura se houver contato direto com o oócito. Além disso, Gittens and Kidder69 verificaram a que a deleção da Cx37 somente nas células da granulosa não afeta a foliculogênese, enquanto a ausência dessa proteína no oócito afeta a oogênese, apresenta oócitos menores e meioticamente incompetentes.
A distribuição dessa conexina nos diferentes compartimentos dos folículos ao longo da foliculogênese parece ser espécie‐específica. Aparentemente, em alguns animais, como camundongos e ratos, essa proteína pode ser detectada a partir de folículos primários.60 Entretanto, Grazul‐Bilska et al.70 verificaram que a proteína está uniformemente distribuída na periferia do citoplasma do oócito e nas células da granulosa de folículos primordiais, está também presente em folículos primários e secundários. De acordo com esses autores, a Cx37 também está presente entre o oócito e as células do cumulus de folículos antrais de ovários fetais ovinos. Kristensen et al.71 demonstraram que a Cx37 é expressa em todos estágios de folículos pré‐antrais humanos, no entanto com uma fraca expressão. Em vacas, a Cx37 foi detectada no oócito e nas células da granulosa, predominantemente localizada em estágios de folículos pré‐antrais.62 Outros autores confirmam a presença dessa proteína mesmo após a ovulação, durante a formação do corpo lúteo,60 e sugeriram que essa proteína está envolvida na regulação da produção de progesterona.64
Devido à presença da Cx37 ao longo de toda a foliculgênese, acredita‐se que essa proteína tem um importante papel nesse processo. Sabe‐se que a Cx37 atua no transporte de metabólitos essenciais para a transição do folículo pré‐antral para a fase antral, ovulação e formação do corpo lúteo.60,64 De fato, camundongos deficientes para a Cx37 tiveram a foliculogênese interrompida no estágio inicial antral e os oócitos não atingiram tamanho normal nem adquiriram competência meiótica.60,72 Carabatsos et al.72 relataram que os oócitos e folículos deficientes em Cx37 param o crescimento quando atingem 52μm e 150μm, respectivamente. Em camundongos e ratas, também tem sido mostrado claramente que a Cx37 é essencial para a oogênese/foliculogênese nessas espécies.60,68,69,73,74 Baseado nos estudos de knockout de gene em camundongas, a ausência de Cx37 nos folículos em desenvolvimento promove a luteinização precoce dessas estruturas, sugere que essa conexina também permite a passagens de importantes substâncias que regulam a formação do corpo lúteo.60 A expressão do RNAm para a Cx37 foi relativamente elevada em corpos lúteos maduros, indicando que pode ser requerida para o desenvolvimento completo e funcional do corpo lúteo.64
Estudos in vitro têm mostrado que a expressão das conexinas em folículos ovarianos pode ser alterada com a presença de hormônios no meio de cultivo, como, por exemplo, gonadotrofina coriônica humana (hCG), LH, hormônio folículo estimulante (FSH), insulina e esteroides.47,58,75,76 Em camundongos, a adição de insulina associada ou não ao FSH no meio de cultivo in vitro de ovário reduz a expressão do RNAm para essa conexina.76 Entretanto, o FSH sem associação com a insulina aumenta a expressão do RNAm para a Cx37. Em ovinos, a expressão de RNAm para a Cx37 nas células da granulosa e tecais é estimulada ou mantida pela adição de hCG.64
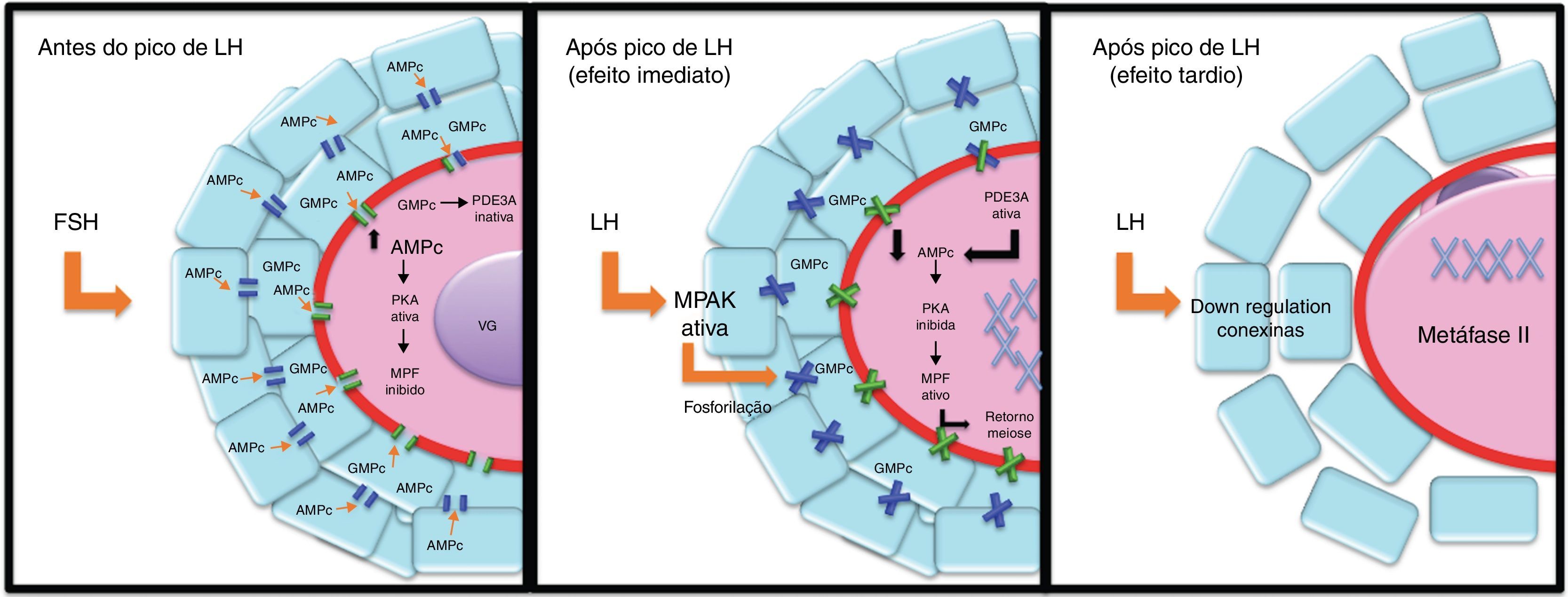
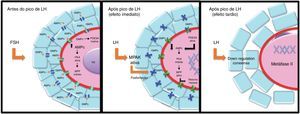
A Cx37 está diretamente relacionada com a preparação para a maturação oocitária. A deficiência de Cx37 pode resultar numa assincronia da maturação nuclear e citoplasmática no oócito.72 Uma explicação para essa assincronia poderia ser atribuída a deficiências nutricionais e o bloqueio da transferência de substâncias inibidoras do meio, como AMPc, resultantes de uma perda de transferência de junções gap. O AMPc produzido nas células da granulosa mantém a maturação via proteína quinase A (PKA), a qual inativa o fator promotor da meiose (MPF). Entretanto, durante a ovulação e a presença do pico de LH (in vivo), existe a perda da comunicac¿a¿o entre as células foliculares e o oo¿cito, pelo fechamento das Junções gap, o que ocasiona a queda da concentrac¿a¿o de AMPc no oo¿cito e inativa a PKA, o que possibilita a reativac¿a¿o do MPF e, consequentemente, a ativação da meiose.77
A presença da Cx37 no endotélio do ovário de ovinos64,70 condiz com a detecção dessa proteína predominantemente no endotélio dos grandes vasos sanguíneos do ovário de camundongas.42,61 Além disso, em vários outros tecidos a Cx37 foi predominantemente expressa em células endoteliais e, portanto, é também conhecida como conexina vascular.78–83 Dessa forma, é possível que a Cx37 também possa desempenhar um papel na função vascular da célula ovariana.
Localização e importância da Cx43 durante a foliculogêneseA Cx43, também pertencente à família alfa das conexinas, forma conexons homoméricos, os quais permitem a passagem de moléculas de até 1.2 KDa, preferencialmente de carga negativa. Por esses canais, moléculas como AMPc, derivados do inositol trifosfato (IP3) e Ca+2 passam livremente por citoplasmas de células adjacentes.84 Essa conexina é bastante estudada no ovário, pois também exerce um importante papel durante os processos de foliculogênese e oogênese.
Essa proteína que foi detectada em ovários de fetos de ovelhas e ratas,85 demostrou um possível papel no desenvolvimento fetal desse órgão. De fato, essa conexina é uma das principais proteínas das junções gap, expressas nas células da granulosa e nos COCs de várias espécies, como bovinos, suínos, ovinos e murinos.47–49,56,86–88 No entanto, a Cx43 também foi encontrada nas células do corpo lúteo de bovinos, suínos e ovinos.47,48,54,64 A Cx43 também foi imunolocalizada em oócitos murinos49,58 e bovinos.89 No entanto, esses relatos não foram apoiados por outros estudos,47,68,90 os quais afirmam que a localização da Cx43 é restrita às células do cumulus. Estudos in vitro têm relatado a possibilidade de formação de canais heterotípicos de Cx43 com a Cx37 em células do cumulus que rodeiam o oócito.68
Em suínos e murinos, a Cx43 foi localizada nas células da granulosa de foli¿culos primários e sua expressa¿o aumenta com o desenvolvimento folicular e com a formac¿a¿o do antro em foli¿culos saudáveis.87,91,92 Em um estudo mais recente, Grazul‐Bilska et al.,70 além de observar em que a Cx43 foi detectada em células da granulosa e da teca em todas as categorias de folículos ovarianos ovinos, observaram que o seu nível de expressão aumentou do folículo primário para o folículo antral. Essa expressão em folículos primordiais também foi detectada em mulheres71 e ratas.86 O aumento no número das junções gap com o tamanho do folículo pode estar relacionado com as crescentes demandas do folículo em crescimento por uma maior troca de metabólitos e sinais regulatórios através de vias de sinalização dependentes de contato.
Ao contrário da Cx37, ainda não foi possível uma investigação acerca da Cx43 no ovário de camundongos knockout, pois esses animais morreram logo após o nascimento.93 No entanto, alguns pesquisadores fizeram o transplante desse ovário para animais selvagens com o intuito de verificar os efeitos da deficiência dessa proteína. O estudo mostrou, portanto, que a ausência da Cx43 levou à interrupção do desenvolvimento folicular no estágio de folículo primário e um retardo no crescimento dos oócitos.9,73
Alguns autores citam que essa proteína está presente também em folículos atrésicos de ratas,87 porcas94 e vacas, mas ausente em ovelhas.48 Cheng et al.94 verificaram que folículos antrais de porcas saudáveis têm Cx43 fosforilada, ou seja, junções gap abertas e atuantes. Por outro lado, nos folículos atrésicos existe uma rápida desfosforilação, uma baixa expressão dessa proteína e consequente fechamento desses canais, o qual causa um aumento da beta‐galactoside alpha‐2,6‐sialyltransferase (1ST6Gal 1). Dessa forma, esses autores sugeriram que a alteração na expressão dessa substância promoveria alteração nos glicoconjugados membranares que iram sinalizar a morte das células da granulosa e a sua fagocitose.94
A expressão da Cx43 e das junções gap nos ovários é afetada por várias substâncias, incluindo hormônios como FSH, LH, seus análogos gonadotrofina coriônica de égua prenhe (PMSG) e hCG, hormônio do crescimento (GH) ou estradiol e segundos mensageiros.47,48,56,58,62,75,95 O estímulo da produção dessas proteínas pode estar ligado ao estímulo da proliferação celular que algumas dessas substâncias proporcionam. Kaiser et al.96 verificaram que o GH recombinante aumenta significativamente o número de folículos em crescimento, bem como o número de estruturas que expressam essa proteína. Porém, em foli¿culos antrais, a expressa¿o da Cx43 é regulada principalmente pelos hormônios FSH e LH, bem como seus análogos (PMSG e hCG, respectivamente). O FSH estimula a expressa¿o da Cx43 no ovário, enquanto o LH reduz.97
A atividade biológica do FSH é traduzida através, principalmente, da via de ativação da PKA dependente de AMPc. Por isso, sugere‐se que o FSH aumenta as comunicações intercelulares através da ativação dessa via, o que ocasiona o aumento da expressão dessas proteínas, bem como a fosforilação delas, e forma as junções gap funcionais.47 Além disso, sabe‐se que o aumento do AMPc levaria a uma redistribuição rápida da Cx43 para a membrana celular e mais tarde à estimulação da expressão do gene Cx43. O estímulo da expressão gênica ocorre através do estímulos de regiões promotoras, como promotor P1.98
Por outro lado, a exposição de células das granulosa/cumulus ao LH, apesar de estimular a via da PKA,99,100 também ativa a via proteína quinase C (PKC),99,100 a qual promove a hiperfosforilação das proteínas das junções gap e leva ao fechamento dos canais.58,101 Sela‐Abramovich et al.101 verificaram que após 10min do estímulo do FSH ocorre a hiperfosforilação desses canais, consequentemente o seu fechamento, além de demonstrar que isso ocorre através da ativação da MAPK. Além disso, após 3h do estímulo do LH ocorre uma redução nas comunicações celulares nos COCs e na expressão da proteína e RNAm da CX43, o que resulta na redução substancial das áreas de membranas das junções gap.58,86,101 Essa alteração na expressão da Cx43 restringe o fluxo de sinais das células foliculares para o oócito e promove a maturação meiótica.102,103 O fechamento dessa conexina cessa o fornecimento de AMPc das células somáticas para o oócito e reduz a concentração intraoocitária desse nucleótido.104 Com a redução do AMPc, a PKA é inativada no oócito e consequentemente ocorre a ativação do MPF.77 O fechamento das conexinas também impede a passagem do GMPc produzido pelas células do cumulus, o qual inibe a hidrólise do AMPc pela fosfodiesterase 3A (PDE3A)105 (fig. 4).
Curiosamente tem sido reportado que processos como a criopreservação e o cultivo in vitro causam danos nas conexinas, as quais são importantes na interação entre oócito e células foliculares.106,107 Os danos nas conexinas podem prejudicar severamente o desenvolvimento folicular, através da interrupção da troca de substâncias entre os componentes foliculares, como aminoácidos, glicose, nucleotídeos e fatores de crescimento endócrinos e parácrinos, necessários para o crescimento do folículo e, consequentemente, para a maturação do oócito.6
Estudos anteriores mostraram uma menor expressão de Cx43 em tecidos ovarianos criopreservados, que foi associada com inadequado desenvolvimento folicular em ratos108 e felinos.109 Também foi demostrado que a criopreservação pelo processo de vitrificação afeta o padrão de expressão gênico e proteico da Cx43 em camundongo e gatas.106,110 Recentemente, Tanpradit et al.106 observaram que o padrão de expressão gênica da Cx43 reduziu após a criopreservação, tanto por congelamento lento como por vitrificação de folículos pré‐antrais inclusos no tecido ovariano de gatas.
Além da criopreservação, o cultivo in vitro reduz a expressão da Cx43, seja em folículos isolados ou inclusos em tecido ovariano.107 Recentemente, nossa equipe verificou uma redução na expressão gênica da Cx43 em folículos ovinos vitrificados e cultivados por 6 dias (Silva, dados não publicados).
Considerações finaisConforme mostrado nos tópicos acima, as junções intercelulares estão presentes durante toda a foliculogênese de diversas espécies, ou seja, desde o estágio de folículo primordial até o desenvolvimento do folículo pré‐ovulatório. Essas junções estão envolvidas nos processos de desenvolvimento folicular e maturação oocitária. Mais especificamente, a presença das junções de oclusão e aderentes é essencial para a manutenção da polaridade e da comunicação entre as células. Já as junções gap estão presentes no oócito, nas células da granulosa e no cumulus em diversos animais e têm importante papel na passagem de substâncias essenciais para a foliculogênese e a oogênese. Portanto, o conhecimento dessas junções (oclusão, aderentes e gaps) é de extrema importância para o estudo da foliculogênese. Conforme mostrado em vários estudos, as conexinas são afetadas pelos processos de criopreservação e cultivo in vitro. Portanto, o estabelecimento de protocolos de ambas as técnicas que afetem minimamente essas proteínas é de extrema importância para as tecnologias de reprodução assistida que envolvam o desenvolvimento de oócitos e folículos ovarianos, in vitro.
Conflito de interessesOs autores declaram não haver conflito de interesses.