A homeopatia apresenta‐se como uma excelente opção de baixo custo e toxicidade para uso na prática da reprodução tanto humana quanto animal. Entretanto, desperta um alto nível de ceticismo em relação a sua real eficácia, notadamente devido ao possível efeito placebo. O uso de modelos in vitro, como a tecnologia do ovário artificial, apresenta‐se como uma ferramenta de grande precisão para dirimir tal controvérsia. Diante disso, esta revisão tem como objetivo fornecer algumas bases sobre a foliculogênese e sua regulação, relatar a importância do cultivo in vitro, com ênfase no hormônio folículo estimulante (FSH), na avaliação do papel dos medicamentos homeopáticos no tratamento de distúrbios reprodutivos ovarianos e no seu uso para melhorar as biotécnicas reprodutivas.
The homeopathy is a low‐cost and toxicity alternative to using in the human and animal reproduction. However, the effect homeopathy awakens a skepticism about its effectiveness, because of the possible placebo effect. The in vitro models, as artificial ovary, is a excellent tool to resolve this controversy. Therefore, the aim of this review to provide some basis on folliculogenesis and its regulation, to report the importance of in vitro culture, with an emphasis on follicle stimulating hormone (FSH), in assessing the role of homeopathic medicines in treating ovarian reproductive disorders and its use to improve reproductive biotechnologies.
Os problemas de fertilidade têm aumentado em todas as partes do mundo.1 Devido a esse fato, pesquisadores têm melhorado e desenvolvido novas técnicas de reprodução assistida com o objetivo de possibilitar à mulher ter filhos saudáveis. Além disso, essas biotécnicas são usadas com o objetivo de melhorar a fertilidade de animais de alto valor zootécnico, preservar espécies em extinção e fazer testes farmacotoxicológicos.2,3
Essas biotécnicas são normalmente in vivo, por meio da administração direta de substâncias que irão regular o desenvolvimento folicular.4 Entretanto, tais substâncias, como por exemplo o FSH, apresentam em geral alto custo e efeitos colaterais.5–7
A homeopatia apresenta‐se como uma excelente opção de baixo custo e toxicidade para uso na prática da reprodução tanto humana quanto animal. A homeopatia tem como base o tratamento com pequenas quantidades de drogas extremamente diluídas capazes de curar uma patologia. Os medicamentos homeopáticos são usados em dose mínima, ou seja, na quantidade de uma substância que poderia ser dada para evitar seus efeitos colaterais e ainda assim continuaria a trazer uma resposta regulatória.8,9 Entretanto, o uso da homeopatia desperta um alto nível de ceticismo em relação a sua real eficácia, notadamente devido ao possível efeito placebo.10,11 O uso de modelos in vitro, como a tecnologia do ovário artificial por meio do cultivo in vitro,12,13 apresenta‐se como uma ferramenta de grande precisão para dirimir tal controvérsia
Diante disso, esta revisão tem como objetivo relatar a importância do cultivo in vitro, com ênfase no hormônio folículo estimulante (FSH), para avaliar o papel dos medicamentos homeopáticos no tratamento de distúrbios reprodutivos ovarianos e o seu potencial uso para melhorar as biotécnicas reprodutivas.
Bases gerais da folículogêneseNa maioria dos mamíferos, o ovário é composto por duas regiões principais: uma interna (medular), responsável pela sustentação desse órgão, e uma mais externa (cortical), na qual podem ser encontrados folículos e corpos lúteos em diferentes estágios de desenvolvimento. Esse órgão é responsável pela produção de fatores de crescimento e hormônios, além de produzir gametas femininos potencialmente fertilizáveis (oócitos), que se encontram dentro de uma estrutura denominada folículo.14
A população de foli¿culos no ovário varia de milhares a milhões (1.500 em camundongas;15 2.500.000 em humanas16) e pode ser influenciada por fatores como espécie, etnia, genética,17,18 idade19 e estado reprodutivo.20 Na época do nascimento, a depender da espécie de mamífero, o ovário contém sua quota máxima de folículos primordiais, os quais estão quiescentes e contêm todos os oócitos potencialmente disponíveis para fertilização durante toda a vida fértil.21 Embora muitos cientistas acreditem que o estoque de folículos ovarianos seja finito e não renovável, estudos apresentam evidências de que pode ocorrer uma pequena renovação na população folicular através da diferenciação das células troncos presentes no ovário, a neofoliculogênese.22,23
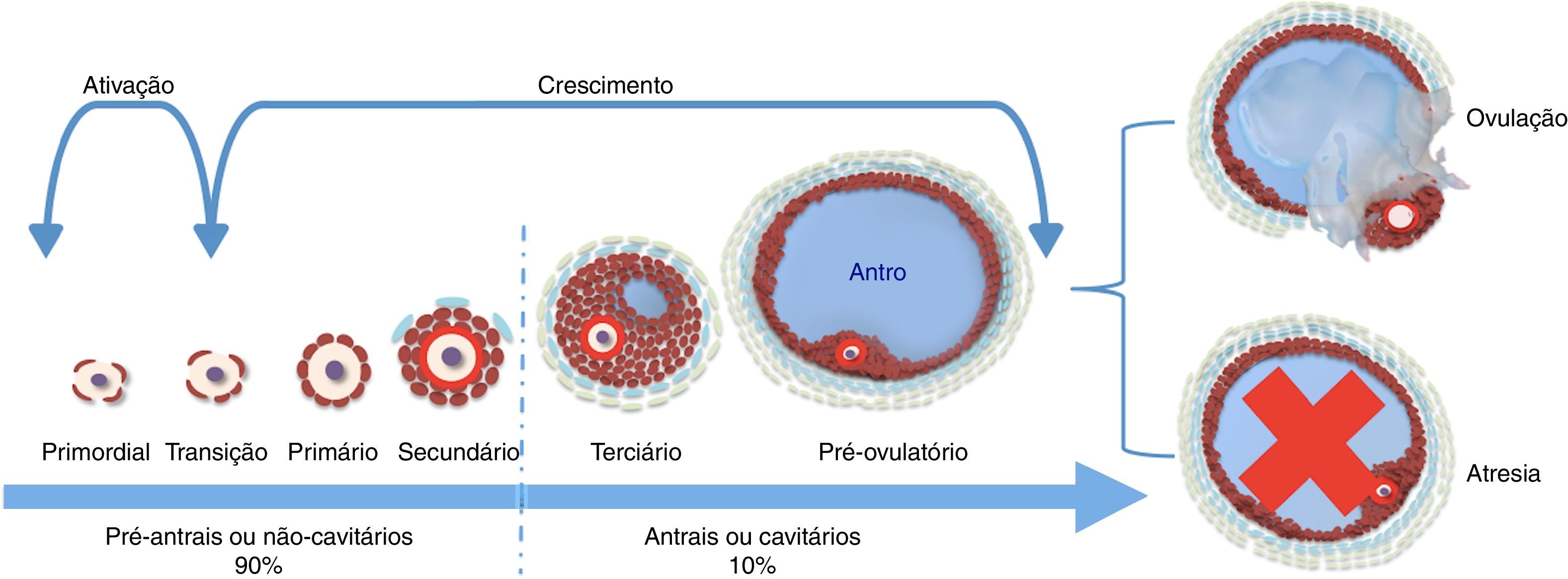
A foliculoge¿nese pode ser definida como o processo de formação, crescimento e maturação folicular, que se inicia com a formação do foli¿culo primordial e culmina com o estágio de foli¿culo pré‐ovulato¿rio.24 Durante o processo da foliculogênese, a morfologia folicular é alterada devido ao crescimento oocitário, à proliferação e à diferenciação das células da granulosa (CG), ao aparecimento das células da teca (CT), à zona pelúcida e uma cavidade repleta de líquido folicular denominada antro.25
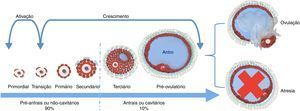
De acordo com o aspecto morfológico, os folículos podem ser classificados em dois grandes grupos: pré‐antrais (Fopa), ou não cavitários, e antrais (FOA), ou cavitários26 (fig. 1). Os Fopa representam mais de 90% da população folicular do ovário27 e podem ser classificados em primordial, de transição, primário e secundário. Já os FOA são representados pelos folículos terciários e pré‐ovulatórios. Os folículos primordiais encontram‐se em estado de quiescência,28,29 são posteriormente ativados, passam a se desenvolver para estádios mais avançados, que culminam com a formação do folículo pré‐ovulatório. No entanto, durante a vida reprodutiva das fêmeas, apesar de muitos folículos serem ativados, apenas uma pequena parte (0,01%) é capaz de se desenvolver até a ovulação, a grande maioria (99,9%) é perdida por um processo natural conhecido como atresia (morte folicular)30 (fig. 1).
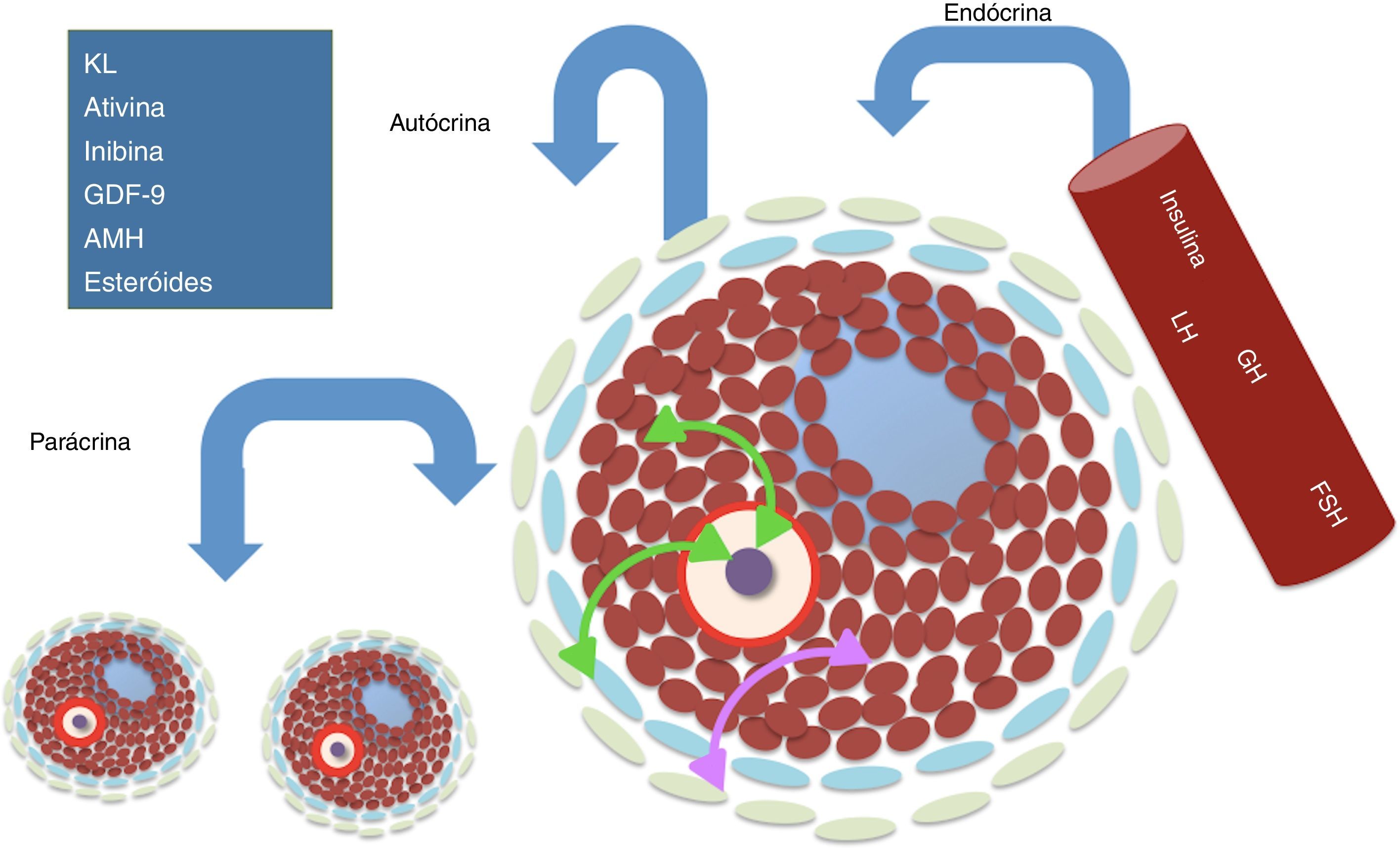
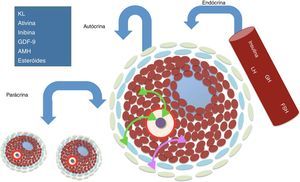
Regulação da foliculogênese e importância do hormônio folículo estimulanteDurante a vida reprodutiva das fêmeas, o desenvolvimento folicular depende da perfeita interação entre fatores auto¿crinos, parácrinos e endo¿crinos.31 Nos processos parácrinos e autócrinos, o próprio oócito desempenha um papel importante na determinação do seu próprio destino através da produção de fatores de crescimento (como, por exemplo, a proteína morfogenética óssea 15 [BMP15] e o fator de crescimento e diferenciação 9 [GDF9]), que vão interagir com as células somáticas (célulasda granulosa e teca) e proporcionar o desenvolvimento folicular. Tanto as células da granulosa (CG) como as células da teca (CT) também produzem seus próprios fatores parácrinos (kit ligand [KL], ativinas, inibinas, hormônio antimülleriano [AMH]) e os hormônios esteroides (estradiol, progesterona e testosterona), os quais, além de coordenar o crescimento do oócito, regulam a proliferação das CG e diferenciação das CT.32–34
Na regulação endrócrina, diversos hormônios promovem o desenvolvimento folicular, dentre eles podemos destacar o FSH. O FSH é uma glicoproteína secretada pela hipófise anterior e é composto por duas subunidades α e β. A primeira é comum a outros hormônios hipofisários, ao passo que a subunidade β confere especificidade a esse hormônio. Apenas o dímero maduro do FSH consegue se ligar a seu receptor (FSHR).35 Esse hormônio apresenta como principal função o desenvolvimento e a maturação gonadal durante a puberdade, além de promover a sobrevivência, o crescimento folicular e finalmente a seleção (recrutamento) e o desenvolvimento de folículos dominantes,36 que precedem o processo de ovulação (fig. 2).
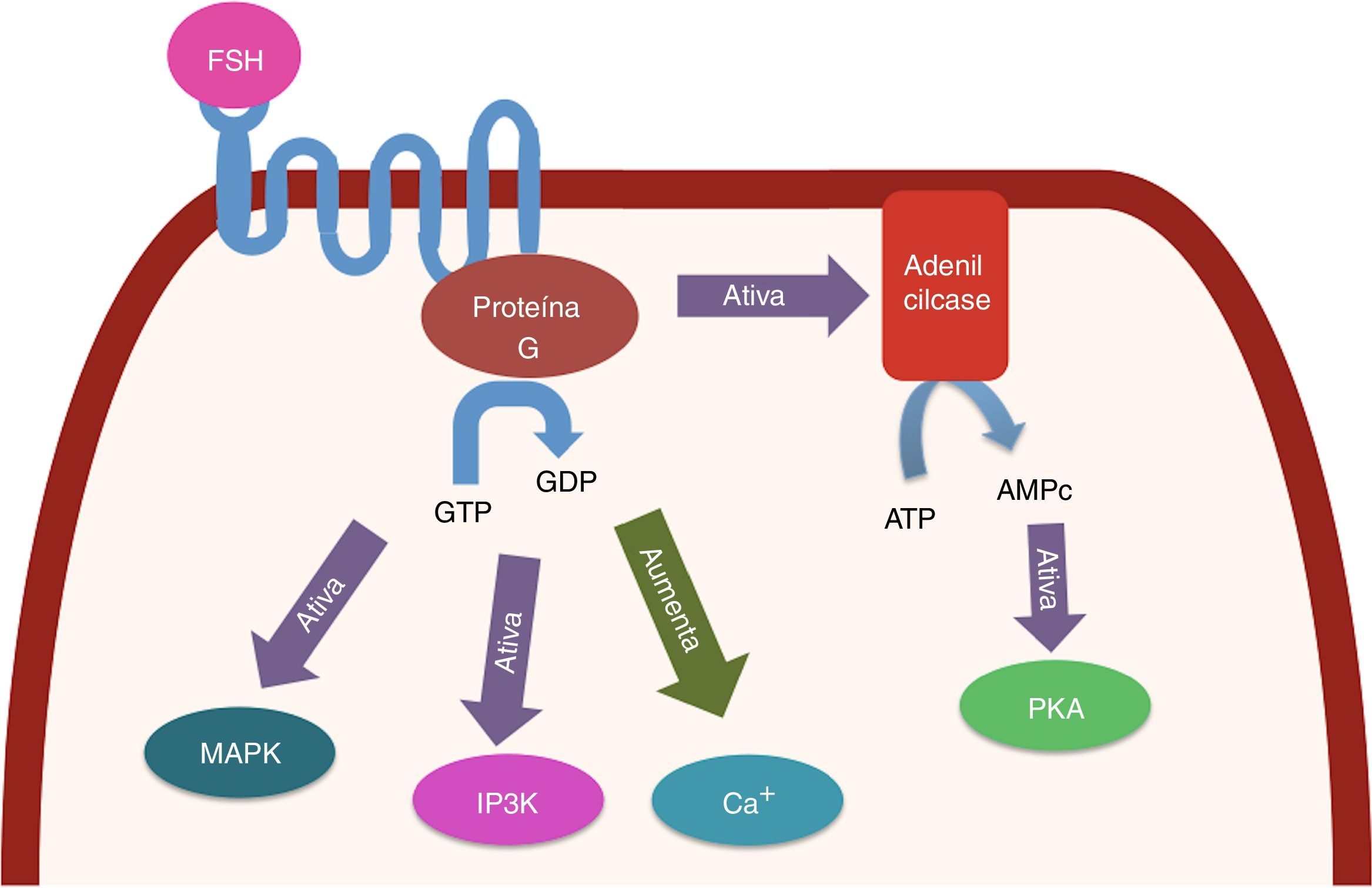
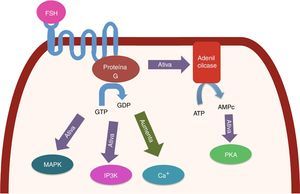
O receptor de FSH (FSHR) se localiza na superfície de CG a partir de folículos primordiais ou primários, embora existam trabalhos que relatam sua presença em oócitos.36–38 Esse receptor é membro da família de receptores acoplados à proteína G. A ativação do FSHR provoca eventos de sinalização, a maior parte iniciada pela ativação da adenilato ciclase, seguida da produção de AMPc, da ativação da proteína quinase A e da fosforilação de outras proteínas. Além disso, a ativação desse receptor está associada com o aumento de cálcio intracelular, a ativação de MAP quinase e a estimulação do trifosfato de inositol.39 Todas as vias de sinalização do FSH juntas promovem a ativação de mais de 100 genes com funções diferentes nas CG40 (fig. 3).
Foliculogênese in vitro: importância da tecnologia do ovário artificialComo mencionado anteriormente, o ovário é composto por uma grande população de Fopa, a grande maioria morre e apenas uma pequena porcentagem alcança a ovulação e torna o rendimento ovariano (número de ovulações durante a vida em relação ao total de folículos presentes) muito baixo. Assim, com o intuito de evitar a grande perda folicular in vivo devido a atresia, a biotécnica de Manipulação de Oócitos Inclusos em Folículos Ovarianos Pré‐Antrais (Moifopa), também conhecida como Ovário Artificial, vem sendo desenvolvida na tentativa de: 1) elucidar os mecanismos envolvidos na regulação da foliculogênese inicial; 2) fazer testes in vitro da ação de fármacos (benéfica ou tóxica), radioatividade, vacinas imunoesterilizantes e nanopartículas sobre os oócitos, que se apresentam como uma opção ao uso de animais em experimentos; 3) produzir bancos genéticos (germoplasma); 4) aperfeiçoar a reprodução assistida de humanos e animais.26
Grandes progressos já foram obtidos com o cultivo in vitro de Fopa em espécies animais. Carrol et al.41 e O’Brien et al.42 obtiveram o nascimento de camundongos a partir de folículos primordiais crescidos, maturados e fecundados in vitro. Nas espécies domésticas, os resultados da PIV têm se limitado a um pequeno e variável número de embriões a partir de folículos secundários crescidos in vitro (suíno – Wu et al.,43 ovinos,44 caprinos45).
A eficiência da Moifopa pode ser afetada por fatores como o tipo de sistema de cultivo usado; a composição do meio de base; a concentração e associação de fatores adicionados ao meio de cultivo.26,46 No tocante aos sistemas de cultivo, os folículos ovarianos podem ser cultivados inclusos no próprio tecido ovariano ou no ovário inteiro (cultivo in situ); ou ainda na forma isolada (cultivo de folículos isolados).47 Em adição, pode ainda ser feito um cultivo em dois passos, no qual é feito primeiramente o cultivo in situ, o que permite a ativação e o desenvolvimento do folículo primordial até estágio secundário, para posteriormente ser isolado e cultivado até o estágio antral.48
A composição do meio é outro fator importante para a obtenção de sucesso durante o cultivo in vitro de folículos pré‐antrais. Uma variedade de meios de base tem sido usada para o desenvolvimento in vitro de folículos pré‐antrais em muitas espécies, dentre eles o meio essencial mínimo (MEM);49 meio McCoy's48 e α‐MEM.50 Esses meios são ainda comumente suplementados com diferentes substâncias, bem como diferentes fatores de crescimento (Telfer et al. 2008) e hormônios, tal como o FSH.51
Estudos in vitro, em caprinos, têm demonstrado que o FSH atua na manutenção da sobrevivência, ativação e no crescimento de Fopa iniciais.51,52 Outros estudos observaram que o FSH, nos estágios mais avançados, promove a formação de antro e o crescimento folicular, reduz a apoptose, estimula a síntese de esteroides e a expressão de receptores para outras substâncias‐chave da foliculogênese,53–56 além de melhorar a aquisição da competência meiótica, a fecundação e o desenvolvimento embrionário a partir de oócitos oriundos de Fopa cultivados in vitro.56,57
O FSH, usado no cultivo in vitro, pode ser extraído da urina de mulheres pós‐menopáusicas, bem como de extrato de hipófise de animais domésticos, como o FSH porcino (FSHp), além de poder ser produzido a partir da tecnologia recombinante (FSHr).58 O FSHr é mais puro e homogêneo, o que poderia propiciar uma maior eficácia nos resultados de crescimento folicular,59 é mais eficiente do que o FSH urinário ou porcino no crescimento de folículos murinos e caprinos cultivados in vitro.52,60 No entanto, a adição dessas substâncias torna o procedimento bastante oneroso, é necessário o estudo de opções, como, por exemplo, a homeopatia.
Papel da homeopatia no tratamento da disfunção ovariana em humanos e animaisA homeopatia é um método terapêutico criado em 1796, por Samuel Hahnemann, que surgiu através de observações e experimentações dos efeitos dos medicamentos em homens saudáveis e tem como princípio a cura pelo semelhante.61,62 O ponto de partida para preparação da maioria dos medicamentos homeopáticos é a tintura‐mãe, um extrato alcoólico (diluído em etanol cereal) da substância original. Essa solução passa por um processo denominado potenciação, que consiste em diluições, em um diluente inerte, álcool ou água, alternadas com dinamizações.10,63 Durante o processo de dinamização, acredita‐se que sejam transmitidas ao diluente as propriedades da substância de origem.10,62,64
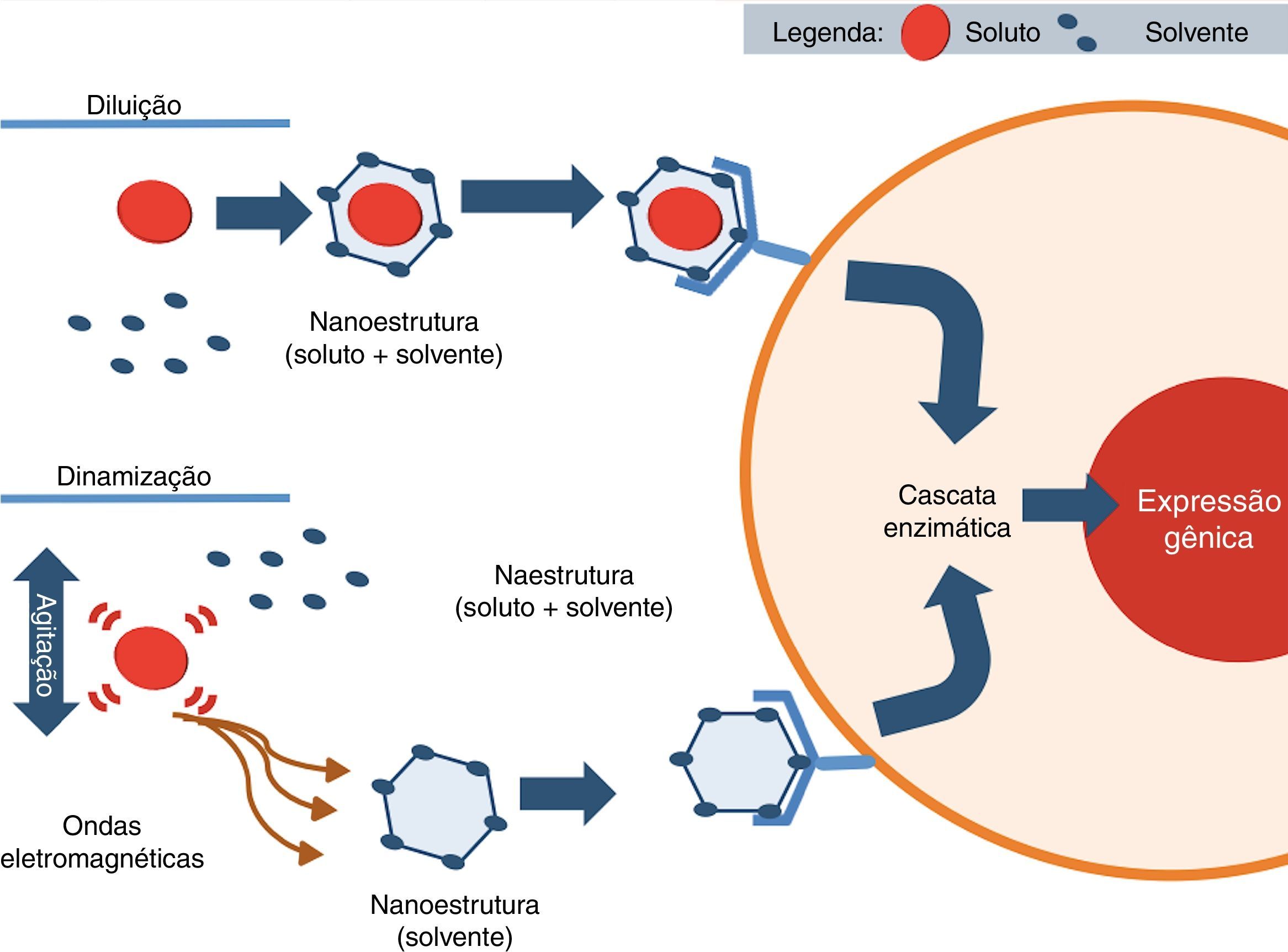
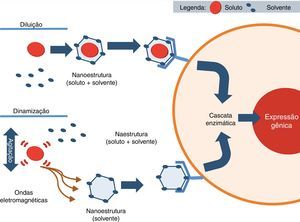
Uma série de homeopatas tem proposto hipóteses para explicar o mecanismo de ação da homeopatia e de que forma o diluente captaria as “informações” do soluto (fig. 4). Davydov65 acredita que durante o processo de dinamização o soluto poderia liberar sua energia ativa para o solvente, através da quebra de algumas das suas diminutas partículas do seu átomo. Outros cientistas66–69 citam a possibilidade de que o soluto, durante as agitações, gere ondas eletromagnéticas de baixa frequência,68,69 que induzem a formação de nanoestruturas estáveis, as quais são capazes de ativar um receptor70 (fig. 4).
Hipótese para o mecanismo de ação dos medicamentos homeopáticos. Durante o processo de diluição o soluto interage com o solvente e cria a sua volta uma nanoestrutura de solvente (gaiola→solvente+soluto) que irá intermediar a ligação desse soluto com o seu receptor celular. No caso da homeopatia, o soluto durante a dinamização gera ondas eletromagnéticas que formaram nanoestrutura somente com solvente que irá se ligar ao receptor celular, desencadear a mesma cascata enzimática e ativar os genes celulares.
A prescrição de um medicamento homeopático varia de acordo com a sintomatologia apresentada pelo paciente. O mesmo medicamento pode ser empregado para tratar diversas doenças, apenas se altera o número de dinamizações usadas. Alguns homeopatas afirmam em consenso que as baixas dinamizações (inferiores a 6 cH) atuam na parte física do organismo e corrigem lesões, enquanto as médias (7‐12 cH) regulam funções e as altas (acima de 12 cH) atuam no lado mental do paciente. Na reprodução, dinamizações baixas de hormônios são indicadas para estimular a fertilidade, as médias para regular, as altas podem ser usadas para frenar ou regular os processos relacionados a fertilidade feminina.71
A homeopatia é usada com sucesso em mulheres com distúrbios hormonais e infertilidade, melhora significativamente as alterações hormonais e normaliza a menstruação.72,73 Com relação aos problemas de fertilidade ligados ao desenvolvimento folicular adequado, a homeopatia também tem sido bastante eficiente no tratamento de ovário policístico e cisto de ovário.1
Medicamentos homeopáticos, tais como o Folliculinum, são usados para restaurar a fertilidade e regular o ciclo menstrual. Medicamentos oriundos de gonadotrofinas hipofisárias (FSH e LH) também são usados. O FSH em baixas dinamizações (FSH 6cH) é aplicado para estimular os folículos ovarianos, é também bastante usado no tratamento de infertilidade.71 Já o medicamento com LH estimula a produção de esteroides, além de tratar infertilidade e distúrbios de ovulação.71
Em animais, essa terapia é usada em sistemas de produção da pecuária, principalmente na orgânica, uma vez que tem a vantagem de manter o equilíbrio animal, atua pela redução do estresse e na manutenção do bem‐estar animal. Além de ser de fácil administração, não produz resi¿duos e não contamina, portanto, o meio ambiente.74
Medicamentos tais como Aristolochia clematis, Graphites, Iodum, Kalium iodatum e Aurum metallicum são usados para regular o ciclo estral e aumentar os sinais do estro em vacas.75 Além disso, o Iodum e o Kalium iodatum são indicados para tratar hiperplasia e atrofia dos ovários de vacas.75 Rajkumar et al.76 verificaram a eficiência do complexo homeopático (Calcarea phosphorica, Aletris farinosa, Pulsatilla, Aurum muriaticum natronatum, Sepia e Phosphorus, todos a uma potência de 30 cH) no tratamento de anestro em vacas, o qual mostrou ser bastante eficiente por apresentar uma indução de 100% de estro.
O uso de combinações de medicamentos homeopáticos também foi descrito para a redução do anestro em búfalas.77 Kumar et al.77 trataram 25 vacas e seis búfalas em anestro com os mesmos medicamentos e dosagens, foi alcançada indução de estro em 68% e 50% em vacas e búfalas, respectivamente. Silva et al.78 usaram o medicamento Pulsatilla nigricans para redução do puerpério em vacas de corte e de leite. Dos 353 bovinos usados no estudo, 127 vacas apresentaram redução do peri¿odo de anestro logo após o parto.
Importância do modelo in vitro do ovário artificial para avaliação da eficiência de medicamentos homeopáticos com ação no ovárioEmbora existam muitos estudos e relatos in vivo publicados na literatura, os estudos relacionados a terapia homeopática na reprodução feminina ainda são bem recentes, foram feitos testes na foliculogênese in vitro somente partir de 2012. Nosso grupo de pesquisa (Lamofopa‐Favet‐Uece) foi o primeiro a investigar a influência de medicamentos diluídos/dinamizados na folículogênese in vitro.
Neste primeiro trabalho, fizemos um cultivo de fragmentos ovarianos de ovinos por sete dias na presença de diferentes dinamizações de FSH (FSH 6, 12 e 30 cH), adicionado diariamente ou a cada dois dias ao meio de cultivo. Durante esse trabalho inovador, confirmaram‐se dados da literatura in vivo que relataram ação diferenciada das potências (Legros et al., 2010), visto que o cultivo a baixa dinamização (FSH 6 cH) estimulou o crescimento folicular, enquanto a alta (FSH 30 cH) reduziu esse crescimento. Além disso, FSH 6 cH adicionado diariamente mostrou resultado superior ao seu veículo (álcool cereal) na sobrevivência e ativação folicular precoce (após um dia), bem como na viabilidade e ultraestrutura desses folículos em relação ao controle fresco.13 Esses resultados foram semelhantes àqueles obtidos com o FSH no cultivo in vitro de Fopa caprino incluso em tecido ovariano.51,52 No entanto, ainda não haviam sido comparadas essas duas apresentações (FSH homeopático vs. FSH alopático) em uma mesma condição experimental.
Recentemente, nossa equipe comparou o efeito dessas duas apresentações (FSH 6 cH e FSHr) no cultivo in vitro de folículos ovarianos ovinos inclusos em tecido ovariano. Novamente verificou‐se que o FSH 6 cH melhora a sobrevivência e promove a ativação precoce (após um dia) quando comparado com o meio de cultivo controle, enquanto o FSHr melhora somente a ativação tardia (sete dias) em relação ao controle cultivado. Além disso, em todos os parâmetros (sobrevivência, ativação e crescimento folicular e oocitário), exceto na ativação precoce, essas duas apresentações foram semelhantes,12 provaram que o FSH homeopático (FSH 6 cH) pode substituir o FSH alopático no meio de cultivo de FOPA ovino.
Na observação do efeito positivo do FSH homeopático na foliculogênese in vitro na fase pré‐antral inicial (ativação de folículos primordiais), decidiu‐se iniciar um estudo para investigar possíveis efeitos da homeopatia (FSH 6 cH) na foliculogênese pré‐antral tardia. Usou‐se para tanto o cultivo de folículos pré‐antrais secundários isolados na espécie ovina. Nossa equipe, portanto, tem cultivado folículos secundários ovinos e suínos isolados, foi observado um comportamento diferente do FSH homeopático na fase pré‐antral tardia quando comparado com a fase pré‐antral inicial. Em ovinos, verificou‐se que o efeito do FSH homeopático (FSH 6 cH) sobre o desenvolvimento folicular e sobre a produção hormonal foi devido em parte ao veículo do FSH dinamizado, isto é, o álcool cereal (Lima et al., dados não publicados). Já em suínos, a homeopatia (ou tratamento homeopático ou adição de FSH 6 cH) promoveu um aumento na formação da cavidade antral e na produção de progesterona e testosterona em relação ao tratamento que continha somente meio de cultivo. Além disso, FSH 6cH aumentou a produção de progesterona significativamente em relação ao seu veículo (Lima et al., dados não publicados). Esses resultados demonstraram que a homeopatia pode atuar de forma diferente do veículo sobre o desenvolvimento folicular, esse efeito provavelmente é influenciado pela espécie animal, duração de cultivo e composição do meio de cultivo.
Por fim, fez‐se um cultivo de fragmentos de tecido ovariano suíno na presença de diferentes medicamentos homeopáticos (FSH 6 cH, Pulsatilla 6 cH e Bos Stress Fertilis 6 cH). Nesse estudo, verificou‐se que todos os medicamentos atuam na ativação folicular, mas FSH 6 cH e Pulsatilla 6 cH melhoram o crescimento folicular e oocitário, enquanto Bos Stress Fertilis® (complexo homeopático) atua na sobrevivência e ativação de folículos suínos inclusos em tecido ovariano (Nunes et al., dados não publicados). Vale a pena ressaltar que a adição do veículo homeopático não melhorou significativamente qualquer dos parâmetros avaliados quando comparada com o controle cultivado.
Considerações finaisApesar do elevado nível de ceticismo em relação ao uso da homeopatia no controle da fisiologia reprodutiva, estudos científicos sérios têm demonstrado eficácia das substâncias homeopáticas, como o FSH, no tratamento de distúrbios reprodutivos. Além disso, a tecnologia do ovário artificial, modelo in vitro de estudo da foliculogênese, tem contribuído de forma decisiva para comprovar a eficiência da homeopatia em condições controladas de estudo. Dessa forma, a homeopatia apresenta‐se como uma opção de baixo custo e toxicidade para o uso na reprodução. Futuros estudos são necessários para elucidar o mecanismo de ação das drogas homeopáticas.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.