La amenaza de la pandemia de gripe
En una situación de pandemia de gripe, la inmensa mayoría de la población es susceptible a la cepa pandémica. Puesto que la población mundial es naïve desde el punto de vista inmunológico al nuevo virus, el Strategic Advisory Group of Experts (SAGE) de la vacuna de gripe A (H1N1) de la Organización Mundial de la Salud (OMS) afirmó el 19 de mayo de 2009 (página web de la OMS) que posiblemente se necesiten dos dosis de la vacuna para proteger a los individuos frente a la infección y frente a la enfermedad grave.
Una preocupación derivada de la aparición de una cepa pandémica es su capacidad para mutar rápidamente, especialmente, si puede infectar a los seres humanos y a especies animales al mismo tiempo. Por ello, la vacuna pandémica deberá ser capaz de inducir protección cruzada frente a variantes antigénicas (drifts).
Existen, además, algunas preocupaciones adicionales ligadas a las especificidades que supone la fabricación de la vacuna antigripal. Un pobre rendimiento en el cultivo del virus puede reducir o retrasar la producción de las dosis de vacuna requeridas y, puede afirmarse que, a partir de la experiencia con la vacuna pandémica H5N1, una vacuna pandémica inactivada fraccionada o de subunidades que no esté adyuvada inducirá una pobre respuesta inmune, requiriéndose mayor contenido de hemaglutinina (HA). En la tabla 1 se resumen los retos relacionados con el desarrollo de una vacuna pandémica de gripe.
Por lo tanto, una vacuna para su uso en una situación de pandemia deberá permitir ahorrar antígeno para solventar los problemas de rendimiento derivados del cultivo del virus. Además, deberá inducir inmunidad cruzada frente a variantes antigénicas (drifts), de modo que induzca protección en el caso de que el virus causante de la pandemia continúe mutando.
La experiencia previa con la vacuna H5N1 adyuvada con AS03
La cepa H5N1 es una importante candidata para desencadenar una pandemia de gripe. Esta cepa es representativa de algunos de los retos que una nueva cepa de gripe puede traer consigo, tales como la inducción de una pobre respuesta inmune en comparación con la respuesta inducida por los virus estacionales, consecuencia de las diferencias genéticas con las cepas humanas circulantes. De hecho, la primera vacuna aviar H5N1 experimental no adyuvada mostró resultados modestos en el primer ensayo clínico realizado en EE. UU. Solamente se observó una adecuada respuesta inmunológica en apenas más de la mitad de los participantes en el estudio que recibieron doble dosis de 90 mcg de una vacuna fraccionada, lo que representa administrar 6 veces más antígeno si lo comparamos con la dosis estándar de 15 mcg de la vacuna de gripe estacional1.
Para obtener un mayor rendimiento antigénico y mejorar la respuesta inmunológica, GlaxoSmithKline (GSK) ha formulado su vacuna H5N1 con un sistema adyuvante conocido como AS03.
La emulsión de agua en aceite con alfa-tocoferol ASO3
El concepto de sistema adyuvante (AS) está basado en la combinación de dos o más ingredientes con capacidad adyuvante. El sistema adyuvante AS03 consiste en una emulsión de aceite en agua con un conocido inmunomodulador, la vitamina E (alfa-tocoferol), para maximizar los beneficios inmunológicos. Esta combinación se basa en la experiencia previa con otras emulsiones de aceite en agua utilizadas para la formulación de vacunas antigripales del anciano2.
Está bien establecido que las emulsiones de aceite en agua pueden inducir concentraciones de anticuerpos elevados cuando se mezclan con un determinado anfígeno, y que disparan la secreción de citocinas, potenciando así el reclutamiento de células del sistema inmune innato3.
Por otra parte, la mezcla adyuvante/antígeno puede sufrir fácilmente una endocitosis por parte de una célula presentadora de antígeno (APC), incrementándose la captación de antígenos4. También se ha podido observar la regulación ejercida por moléculas coestimuladoras durante la interacción entre la APC y la célula T, lo cual repercute en la respuesta celular T y B5.
El efecto inmunomodulador de la vitamina E ha sido descrito en los últimos 15-20 años, tanto en estudios preclínicos como clínicos. La adición de vitamina E puede ayudar a mejorar la disminución de la respuesta inmunológica relacionada con el fenómeno de la inmunosenescencia, potenciando la inmunidad mediada por células en personas sanas de edad avanzada2,6-10.
Las ventajas de una vacuna pandémica formulada con el adyuvante AS03 se han puesto de manifiesto en varios estudios clínicos y preclínicos con la cepa H5N1. Los resultados de estos estudios han sido publicados en los últimos años y se resumen a continuación.
Experiencia clínica con la vacuna H5N1 adyuvada con la emulsión de aceite en agua AS03 conteniendo alfa-tocoferol
Ahorro de antígeno
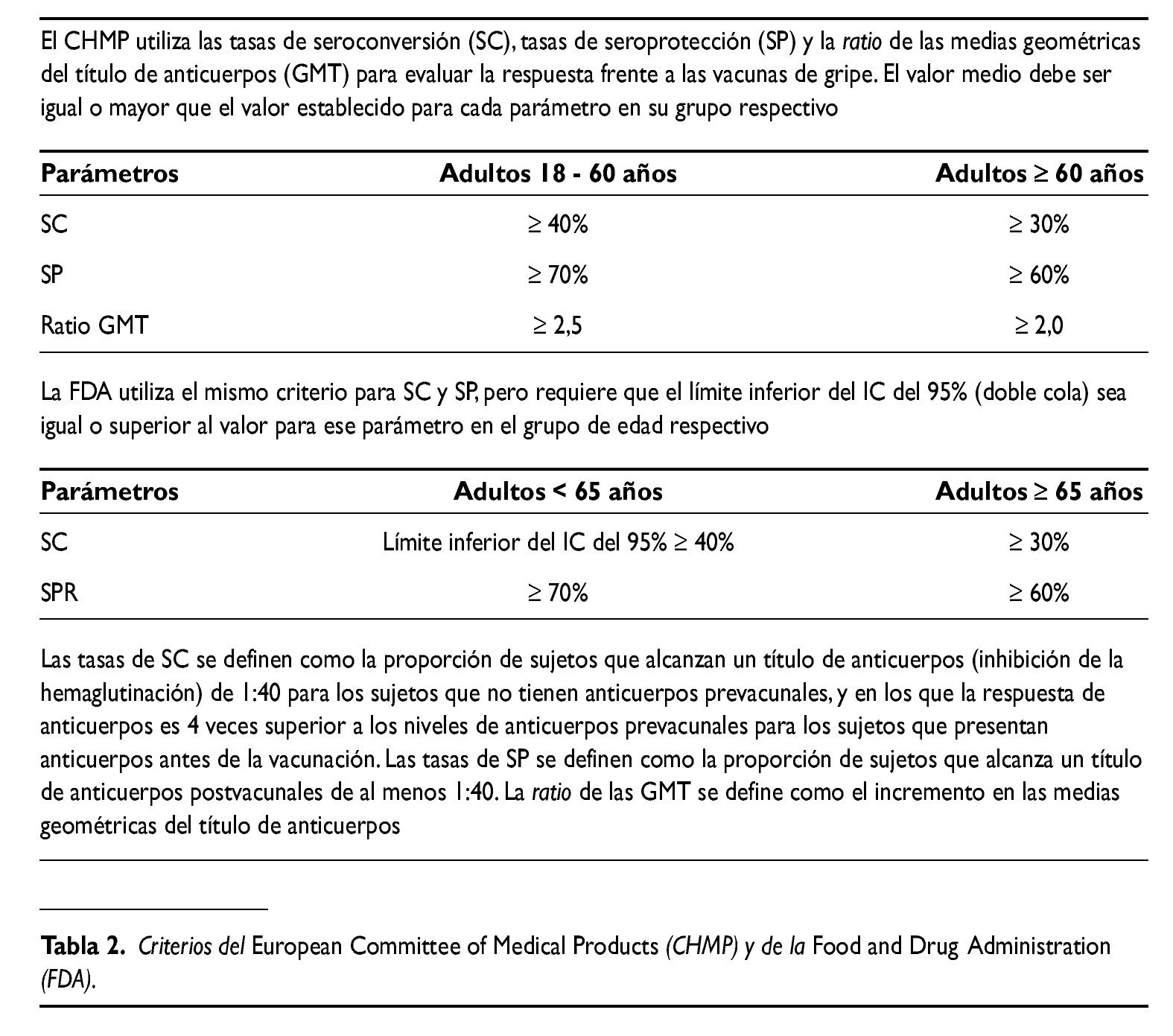
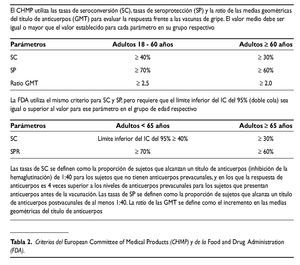
En un estudio de rango de dosis realizado en Bélgica, se administraron dos dosis, separadas tres semanas entre sí, de una vacuna con diferentes concentraciones de hemaglutinina (3,75; 7,5; 15 y 30 mcg) de la cepa A/Vietnam/1194/2004 (A/Vietnam) formulada con y sin el adyuvante AS03 a 8 grupos de voluntarios sanos de 18-60 años. Para todas las dosis de antígeno las formulaciones adyuvadas fueron significativamente más inmunogénicas que las no adyuvadas. Con la dosis más baja de antígeno de 3,75 mcg, la respuesta inmune de la vacuna adyuvada, medida como respuesta de anticuerpos por inhibición de la hemaglutinación frente a la cepa homóloga A/Vietnam, cumplió o ex cedió los tres criterios para el registro de vacunas antigripales establecidos por el European Commmittee for Medicinal Products (CHMP) y por la Food and Drug Administration (FDA) americana (tabla 2). Ninguno de los criterios de la FDA y sólo dos de los tres criterios del CHMP fueron alcanzados por la vacuna no adyuvada con la dosis más alta de 30 mcg. Las tasas de seroconversión de anticuerpos neutralizantes (definido como un incremento de 4 veces la concentración de anticuerpos tras la vacunación con respecto a la situación inmunológica basal antes de la primovacunación) frente a la cepa homóloga fueron del 86% en los sujetos que recibieron la formulación adyuvada que contenía 3,75 mcg de hemaglutinina y sólo del 22% en los que recibieron la vacuna no adyuvada11.
La misma formulación de 3,75 mcg fue evaluada en voluntarios sanos de origen asiático. Las tasas de seroprotección (anticuerpos antihemaglutinina) fueron levemente más altas (95%) que en el estudio realizado en Bélgica (84%). La línea base de presencia de anticuerpos detectables frente a H5N1 en los voluntarios de ambos estudios fue muy baja (2,3 y 1,6% respectivamente). Es posible que, aun no teniendo títulos de anticuerpos detectables, los voluntarios asiáticos estuviesen sensibilizados frente a cepas H5N1, hecho que explicaría la mejor respuesta en esta población que en los sujetos no previamente expuestos a H5N112.
Respuesta inmune cruzada frente a diferentes clades
Para poder estimar el potencial de protección cruzada de la vacuna experimental H5N1 se determinaron los anticuerpos neutralizantes frente a cepas heterólogas. La vacunación con dos dosis de 3,75 mcg conteniendo la cepa A/Vietnam indujo anticuerpos que reaccionaban de forma cruzada frente a las cepas A/Indonesia (subclade 2.1), A/Turquía (subclade 2.2), A/Anhui (subclade 2.3) con tasas de seroconversión mediante la técnica de neutralización del 75, 85 y 75% respectivamente13.
En otro estudio de rango de dosis, se determinó la respuesta inmune mediada por células con formulaciones adyuvadas con AS03 y no adyuvadas de 3,75 y 7,5 mcg. Con este fin se obtuvieron células mononucleares de sangre periférica antes de la vacunación y tres semanas después de la administración de la segunda dosis. La frecuencia y funcionalidad de los linfocitos T CD4+ específicos para H5 fue determinada después de una estimulación con un pool de péptidos, correspondiente a la secuencia H5 completa o con la vacuna fraccionada H5N1 mediante tinción de citocinas intracelulares. Antes de la vacunación, la frecuencia de linfocitos T CD4+ específicos para H5 (expresados por millón de linfocitos T CD4+) no fue diferente entre los grupos. No hubo respuesta dosis dependiente mediada por células. Tras la administración de dos dosis de vacuna la frecuencia de linfocitos T CD4+ específicos para H5 fue mayor en el grupo de la vacuna adyuvada (3.050; IC 95%: 2.340-4.010) que en el grupo vacunado con la formulación no adyuvada (1.650; IC 95%: 1.080-2.160). Las frecuencias de los linfocitos T CD4+ específicos para las secuencias conservadas entre las cepas A/Vietnam y A/Indonesia también fueron más elevadas en el grupo de vacuna adyuvada que en el grupo de vacuna no adyuvada (430 IC 95%: 220-667 frente a 150 IC 95%:89-266). Los linfocitos T CD4+ específicos para H5 expresaron predominantemente IL-2 y CD40L, un perfil consistente con células T de memoria. La respuesta de los linfocitos T específicos de cepa persistió 6 meses después de la primera dosis de vacuna, y la diferencia entre el grupo con vacuna adyuvada y no adyuvada continuó siendo significativa. La frecuencia de linfocitos B de memoria (técnica ELISPOT), también fue significativamente más elevada (p < 0,001) en el grupo que recibió la vacuna adyuvada14.
Flexibilidad de la pauta vacunal para la administración de la segunda dosis
Como se ha descrito anteriormente, la vacuna H5N1 adyuvada con AS03 que contiene 3,75 mcg de HA de la cepa A/Vietnam es muy inmunogénica frente a la cepa vacunal y frente a otras clades de H5N1, después de la administración de dos dosis con un intervalo de 21 días. Se han estudiado diferentes pautas de vacunación utilizando vacunas que contienen cepas homólogas y heterólogas como dosis de refuerzo para evaluar la flexibilidad de la estrategia de vacunación. Una segunda dosis 6 meses después de la primera dosis de vacuna indujo una rápida y potente respuesta inmune seroprotectora frente a ambas cepas homólogas y heterólogas H5N1. Datos clínicos adicionales han demostrado que la vacunación primaria con una sola dosis de vacuna adyuvada con AS03, conteniendo 3,75 mcg de HA, es suficiente para inducir una respuesta inmune cruzada rápida y potente tras la administración de una dosis de refuerzo a los 12 meses. También se alcanzaron los criterios inmunológicos del CHMP para el registro de vacunas de gripe estacional 7 días después de la administración de la dosis de recuerdo. Por tanto, la segunda dosis ha sido administrada con un esquema flexible entre 21 días al menos 12 meses, sin comprometer la calidad de la respuesta inmunológica. Esto confirma aún más la robustez de la inmunidad inducida con la vacuna adyuvada con AS03, y puede tener implicaciones sustanciales en la implementación logística de las campañas de vacunación a gran escala en un escenario de pandemia15.
Estudios en ancianos y niños
Se realizó un estudio con la vacuna H5N1 A/Vietnam en voluntarios con edades comprendidas entre 61 y 88 años. Se administraron dos dosis de vacuna con 3,75 mcg HA adyuvada con AS03 y de vacuna no adyuvada con un intervalo de 21 días. Los tres criterios inmunológicos del CHMP para ancianos con edad superior o igual a 60 años fueron alcanzados en el día 42. La respuesta inmune a la vacuna no adyuvada fue considerablemente más débil, y no alcanzó los criterios de seroconversión, ni de seroprotección16.
En un estudio pediátrico en más de 300 niños de edades comprendidas entre 3 y 9 años, una vacuna que contenía 1,9 mcg de HA cepa A/Vietnam (la mitad de la dosis de adulto) adyuvada con AS03 demostró inducir inmunogenicidad marcada frente a diferentes clades. Después de una segunda dosis con la vacuna adyuvada se superaron todos los criterios del CHMP para vacunas estacionales en adultos, en cuanto a la inhibición de la hemaglutinación frente a la vacuna cepa A/Vietnam y la variante A/Indonesia17. La vacuna adyuvada con AS03 indujo, en niños de 3 a 5 años, una respuesta homóloga específica de linfocitos T CD4+ caracterizada por la producción de IL-2 e IFN gamma, pero no IL-13. Este patrón de citocinas es indicativo de un perfil Th0/Th1 en vez de un perfil Th218.
Protección cruzada en hurones
Puesto que no es posible documentar la eficacia protectora de una vacuna H5N1 en el ser humano, se han desarrollado modelos animales de exposición como alternativa a la investigación clínica19.
El hurón es actualmente aceptado como el mamífero más adecuado para la realización de estudios de eficacia con vacunas frente al virus aviar de alta patogenicidad H5N120. Para asegurar que la reactividad cruzada y la protección cruzada se evalúan en condiciones suficientemente restricitivas, los distintos experimentos se realizaron con diferentes dosis de vacuna, controles y cepas pertenecientes a diferentes clades21.
En un primer experimento, diseñado para evaluar la protección frente a una cepa homóloga a la cepa vacunal, se inmunizaron 6 grupos de hurones por vía intramuscular con dos dosis de vacuna inactivada fraccionada adyuvada con AS03 cepa A/Vietnam, (15; 5; 1,7 y 0,6 mcg de HA). Los grupos control estaban constituidos por grupos de 6 animales y recibieron PBS o el adyuvante AS03, respectivamente. Los animales fueron vacunados los días 0 y 21. El día 49 postvacunación se inoculó por vía intratraqueal una dosis letal de virus homólogo. El 87% de los animales inmunizados con la vacuna adyuvada sobrevivieron al final del periodo de observación, pero el 91% de los hurones en el grupo control falleció de forma prematura como consecuencia de la infección. Todos los animales que recibieron PBS o AS03, mostraron una carga viral elevada del virus en la faringe durante el curso de la infección. En la mayoría de los animales, la administración de la vacuna adyuvada con AS03 redujo la carga viral por debajo del umbral. Se observó una eficacia dosis dependiente que se correlaciona con los niveles de anticuerpos inducidos mediante inhibición de la hemaglutinación22.
En un segundo experimento se evaluó si la vacuna adyuvada con AS03 que contenía la cepa A/Vietnam inducía una protección cruzada frente a la cepa A/Indonesia. Se inmunizaron 4 grupos de hurones por vía intramuscular con dos dosis de la vacuna cepa A/Vietnam (15; 7,5; 3,75 y 1,7 mcg de HA). Dos grupos control de 6 hurones recibieron bien el AS03, sólo la vacuna no adyuvada con concentraión de 15 mcg de HA. Los animales fueron vacunados el día 0 y el día 21, y fueron tratados el día 49 con una dosis letal de la cepa salvaje A/Indonesia. Todos los animales que recibieron dos dosis de al menos 3,75 mcg de la vacuna adyuvada sobrevivieron al reto letal heterólogo. En el grupo que recibió la dosis más baja de vacuna adyuvada (1,7 mcg) todos menos uno de los animales sobrevivieron a la inoculación letal. Por el otro lado, todos los animales del grupo control fallecieron o tuvieron que ser sacrificados el día 3 o 4. Las determinaciones serológicas mostraron que formulaciones con la vacuna A/Vietnam adyuvada indujeron respuestas de anticuerpos neutralizantes frente a la cepa homóloga A/Vietnam en un 74% de los hurones, y frente a la cepa heteróloga A/Indonesia en un 61%. No se encontró respuesta de anticuerpos neutralizantes frente a la cepa homóloga o heteróloga en los grupos control. El 77% de los hurones que sobrevivieron mostraron una respuesta de anticuerpos neutralizantes. Cuatro de los 5 animales que no respondieron, y que sobrevivieron, tenían menor carga viral en el pulmón en comparación con los animales control no vacunados21. Esto hace pensar en el posible papel de la respuesta inmune celular, inducida mediante la vacunación, en el control de la replicación viral19.
En un tercer experimento en hurones inmunizados con H5N1 e inoculados con una cepa heteróloga, la vacuna adyuvada que contenía la cepa A/Indonesia indujo protección frente a la cepa A/Hong Kong, evidenciada por el aumento de las tasas de supervivencia y una menor frecuencia de aislamiento del virus del tracto respiratorio superior e inferior23.
Perfil de tolerabilidad y seguridad de la vacuna H5N1 adyuvada con AS03
En un estudio de rango de dosis inicial se administraron dos dosis de la vacuna, que contenían diferentes dosis (3,75; 7,5; 15 y 30 mcg) de la vacuna H5N1 cepa A/Vietnam, formulada con o sin AS03, a 400 adultos voluntarios sanos de edades comprendidas entre los 18 y 60 años, con un intervalo de tres semanas. Ambas formulaciones presentaron un buen perfil de seguridad. No se registró ningún acontecimiento adverso grave, y todos los participantes completaron la pauta de dos dosis. No hubo evidencia de una relación entre la dosis de antígeno H5N1 y la reactogenicidad, excepto por un incremento del dolor en el punto de inyección cuando se utilizó la dosis más elevada no adyuvada. A pesar de que la pauta con vacuna adyuvada incrementó el número de reacciones adversas solicitadas en el punto de la inyección y de acontecimientos adversos generales en comparación con la pauta no adyuvada, la mayoría de estos efectos fueron de intensidad leve a moderada y desaparecieron en 48 horas11.
En un estudio posterior en una amplia cohorte de adultos sanos se comparó la seguridad y la reactogenicidad de la vacuna de 15 mcg cepa A/Vietnam adyuvada con AS03 frente a la vacuna de gripe estacional Fluarix® (GlaxoSmithKline Biologicals, Rixensart, Bélgica). La cohorte incluía a más de 5.000 sujetos mayores de 18 años. Para este estudio la dosis de HA H5N1 seleccionada fue de 15 mcg, equivalente a la dosis de la vacuna de gripe estacional, para asegurar que se pudiese disponer de datos de seguridad en caso de que se requiriese una dosis más elevada de H5N1 en sujetos con inmunidad reducida, como es el caso de los ancianos. La vacuna H5N1 adyuvada con AS03 presentó un buen perfil de seguridad, a pesar de la utilización de un contenido antígeno 4 veces superior a la dosis seleccionada para la formulación pandémica (3,75 mcg). El 96,7% de los sujetos vacunados completaron el estudio, y el síntoma local comunicado con mayor frecuencia fue dolor en el sitio de la inyección.
La incidencia del dolor fue significativamente más alta en los sujetos que recibieron la vacuna adyuvada que en los que recibieron la vacuna de gripe estacional no adyuvada. El dolor local fue raramente severo, y se observó en sólo el 3,7% de las dosis administradas en adultos de edades comprendidas entre los 18 y 60 años y en el 0,5% de las dosis administradas a ancianos con edad superior a 60 años. Se notificaron casos de inflamación local y enrojecimiento en el lugar de la inyección, pero con más baja frecuencia. Astenia, mialgia y cefalea fueron los síntomas más frecuentemente experimentados. La mayoría de los efectos secundarios, locales y generales, fueron de intensidad leve a moderada y desaparecieron en 48 horas. En general, la vacuna con 15 mcg de antígeno H5N1 adyuvada con AS03 fue bien tole rada, y sus efectos secundarios fueron considerados como clínicamente aceptables (Rümke 2008).
La seguridad de la formulación de 3,75 mcg de HA adyuvada fue probada en un estudio en el que participaron un gran número de adultos asiáticos (1.200 sujetos). Aunque la vacuna adyuvada mostró una incidencia de síntomas locales y generales más elevada que la vacuna no adyuvada, el perfil de reactogenicidad fue aceptable. No se notificaron efectos adversos graves relacionados con la vacuna12.
En un estudio adicional realizado en ancianos de 61 a 88 años, la vacunación con H5N1 adyuvada con AS03 se asoció a un incremento de reactogenicidad local en comparación con el grupo de control, pero, en general, fue bien tolerada. No se observaron patrones clínicos en términos de acontecimientos adversos y no se comunicaron acontecimientos adversos graves relacionados con la vacuna16.
En un estudio pediátrico con más de 300 niños de edades comprendidas entre 3 y 9 años, se comparó la seguridad de dos dosis de la vacuna con 1,9 mcg de HA adyuvada con AS03, administrada con un intervalo de 21 días frente a la vacuna de la gripe estacional no adyuvada (Fluarix®, GlaxoSmithKline Biologicals, Rixensart, Bélgica). La reacción adversa local solicitada notificada más frecuentemente fue dolor en el punto de la inyección en ambos grupos en estudio, pero el dolor local fue más severo en el grupo de AS03. Los efectos adversos comunicados fueron más frecuentes en el grupo inmunizado con la vacuna adyuvada, con fiebre por encima de 39,1º C, pérdida de apetito, somnolencia, cefaleas, trastorno gastrointestinal y mialgia, notificándose como las más intensas. La mayoría de los síntomas duraron de uno a dos días, sin incremento en la duración o en la intensidad tras la administración de la segunda dosis. No se apreció un patrón distinto de sintomatología ni se comunicaron efectos adversos graves. El perfil de reactogenicidad de la vacuna H5N1 adyuvada con AS03 se consideró clínicamente aceptable en esta población17.
Actualmente, los datos de seguridad incluyen a más de 10.000 sujetos que han recibido la vacuna H5N1 adyuvada con AS03, la mayoría de los cuales fueron reclutados en amplios estudios llevados a cabo en Europa y Asia. El adyuvante AS03 se utiliza también en una formulación de vacuna estacional para ancianos. Esta vacuna experimental se encuentra en la actualidad en investigación, en un gran estudio de fase III que incluye más de 40.000 sujetos.
Vacuna H5N1 adyuvada con AS03
La formulación de una vacuna frente a la gripe H5N1 adyuvada con AS03 ha mostrado varios beneficios, entre ellos, los dos más necesarios: ahorro sustancial de antígeno e inmunidad cruzada frente a variantes antigénicas.
Una vacuna desarrollada para hacer frente a la gripe pandémica (Pandemrix®, GlaxoSmithKline Biologicals, Rixensart, Bélgica) y una vacuna antigripal prepandémica (Prepandrix®, GlaxoSmithKline Biologicals, Rixensart, Bélgica) han sido aprobadas en la Unión Europea en mayo de 2008 para la inmunización activa frente al virus de la gripe A/H5N1 en adultos con edades comprendidas entre los 18 y 60 años y recientemente (mayo de 2009) en adultos de más de 60 años de edad. La dosis recomendada consiste en dos dosis de 0,5 ml que contienen 3,75 mcg de HA administradas con un intervalo de al menos 21 días.
La pandemia actual de gripe A/H1N1
La nueva gripe A/H1N1 está causada por un nuevo virus de origen porcino que fue detectado por primera vez en Méjico y en los EE.UU. en marzo y abril de 2009. Desde los primeros casos comunicados hasta el 24 de junio de 2009, más de 55.000 casos han sido confirmados y alrededor de 230 muertes en el mundo han sido notificadas a la OMS24. Debido a la aparición y rápida propagación de esta nueva cepa, la OMS declaró una alerta pandémica fase 6 el 11 de junio de 2009. No está claro en este momento la severidad o gravedad que tendrá este nuevo virus H1N1 en cuanto a número de personas afectadas, complicaciones graves que puedan desarrollar los contagiados o fallecimientos producidos, ni tampoco de qué forma este nuevo virus puede afectar a la población durante la próxima temporada de gripe en otoño e invierno. El virus H1N1 se ha convertido en una nueva cepa de gripe pandémica. Al tratarse de un nuevo virus, la mayoría de la población estará poco inmunizada, si es que lo está, y, como consecuencia, la enfermedad puede ser más grave y se puede propagar más fácilmente. En la actualidad no existe una vacuna que proteja frente a este nuevo virus H1N1. El Centro para el Control y Prevención de Enfermedades (CDC) anticipa que habrá más casos, más hospitalizaciones y más fallecimientos asociados a este nuevo virus si se compara con las cepas estacionales25.
El CDC ha publicado recientemente los resultados de ensayos que evalúan la inmunidad cruzada potencial de las vacunas estacionales frente a la nueva cepa H1N1, y los datos obtenidos sugieren que es improbable que la inmunización reciente (entre 2005 y 2009) con una vacuna estacional no adyuvada, induzca una respuesta de anticuerpos protectora frente al nuevo virus de la gripe A/H1N125. Estos resultados son consistentes con el grado de divergencia genética del nuevo virus de la gripe A-H1N1 de origen porcino y los últimos virus de gripe estacional. Por ejemplo, A/California / 04/09 comparte únicamente entre un 72 y un 73% de identidad de aminoácidos en la porción HA1 de la molécula de HA con los virus de gripe estacional utilizados en este estudio. En comparación, la identidad de secuencia de aminoácido en la porción HA1 entre cepas de vacuna estacional utilizadas en este estudio es del 97 a 98%. En general, parece que los niños, adolescentes y adultos son susceptibles en su mayoría frente a esta nueva cepa. Se ha observado un cierto grado de inmunidad previa a la nueva cepa H1N1 en sujetos de más edad, especialmente en ancianos de más de 60 años. Una posible explicación es que algunos adultos de este grupo de edad hayan tenido alguna exposición previa, a través de infección o vacunación, a un virus de gripe A/H1N1 más directamente relacionado, genéticamente y antigenéticamente, con el nuevo virus de la gripe A/H1N1 que las cepas contemporáneas de la gripe H1N1.
Las investigaciones actuales sobre la respuesta reactiva cruzada a anticuerpos entre personas de diferentes grupos de edad podrían proporcionar una aclaración adicional sobre la inmunidad preexistente, y una mayor orientación en la implementación de la vacunación, como objetivos primarios de vacunación y el intervalo necesario entre dosis para inducir la protección adecuada.
El CDC ha establecido que es necesario el desarrollo de una vacuna con una cepa específica frente al nuevo virus de gripe A/H1N1 para conseguir una protección óptima frente al virus en personas de cualquier edad25.
Conclusiones
La cepa H1N1 (gripe porcina) se ha convertido en la nueva cepa de gripe pandémica. El abordaje de una pandemia plantea enormes retos para lograr una rápida y efectiva protección de la población. Las vacunas son consideradas como una de las estrategias más importantes para limitar las consecuencias de un brote de gripe pandémica. La vacuna pandémica candidata debe ante todo demostrar capacidad de ahorro de antígeno e inmunidad cruzada frente a variantes antigénicas.
En función de la amplia experiencia obtenida con la cepa H5N1, el sistema adyuvante AS03 podría proporcionar a una vacuna H1N1 las características necesarias para que pueda ser utilizada de modo eficaz como vacuna pandémica. En la tabla 3 se incluyen las características observadas en la formulación de H5N1.
Es de esperar que la mayoría, si no todos los efectos observados en la va cuna H5N1, sean similares en la formulación de la vacuna H1N1 adyuvada con AS03.
Estas características, junto con el hecho de que el adyuvante AS03 puede estar disponible en las cantidades necesarias para cubrir el volumen requerido a la hora de fabricar una vacuna pandémica, han hecho que GSK Biologicals haya optado por desarrollar su vacuna H1N1 con este sistema adyuvante.
Agradecimientos
Nos gustaría agradecer a nuestros colegas Mergaerts Voges, Markus Marleen y Juan Carlos Jara millo (GlaxoSmithKline Biologicals) por su asistencia en la preparación del manuscrito.
Conflicto de intereses
Los autores son empleados de GlaxoSmithKline Biologicals, Wavre, Bélgica.
* Artículo traducido. El original en inglés se publicará tambien en la red.
BIBLIOGRAFÍA RECOMENDADA
Bresson JL, Perronne C, Launay O, Gerdil C, Saville M, Wood J, et al. Safety and immunogenicity of an inactivated split-virion influenza A/Vietnam/1194/2004 (H5N1) vaccine: Phase I randomised trial. Lancet. 2006; 367(9523):1657-64.
Dju MY, Maso KE, Filer LJ. Vitamin E (tocopherol) in human tissues from birth to old age. Am J Clin Nutr. 1958;6(1): 50-60.
http://www.who.int/immunization/sage/ SAGEH1N1vaccinerecommendation 2009_05_19.pdf
Liu GC, Ahrens EH, Schreibman PH, Crouse JR. Measurement of squalene in human tissues and plasma: validation and application. J Lipid Res. 1976;17(1):38-45.
Rümke HC, Bayas JM, de Juanes JR, Caso C, Richardus JH, Campins M, et al. Safety and reactogenicity profile of an adjuvanted H5N1 pandemic candidate vaccine in adults within a Phase III safety trial. Vaccine. 2008;26(19): 2378-88.
Vogel RF, Caillet C, Kusters IC, Haensler J. Emulsion-based adjuvants for influenza vaccines. Expert Rev Vaccines. 2009;8(4):483-92.