Aunque entre los años 1959 y 2001 se han descrito al menos 19 epizootias en aves causadas por virus de la gripe altamente patogénicos, la epizootia causada por el virus gripal H5N1, que empieza en el año 2003, no tiene parangón con las anteriores, dada su escala y distribución geográfica. El virus H5N1 causante aún sigue en la actualidad ocasionando unas pérdidas económicas importantes en granjas de aves de corral y un goteo de muertes en seres humanos. La amenaza que sigue atenazándonos es la posibilidad de que el virus adquiera unas propiedades que le hagan transmisible de manera sostenida y eficiente entre seres humanos, y cause una pandemia de proporciones bíblicas en la humanidad. En este artículo se revisarán varios aspectos relacionados con la evolución del virus H5N1, empezando por considerar las restricciones de rango de huésped que evitan la transmisión de virus gripales entre diferentes especies animales. A continuación se presentará un análisis cronológico y geográfico de la difusión del virus H5N1 desde 2003 hasta la actualidad, y se terminará comentando la evolución genética y antigénica del virus y la importancia que estas propiedades tienen en el contexto del desarrollo de vacunas.
Distribución de virus de la gripe A en diferentes especies animales. Posible adaptación de un virus aviar a humano
Los virus de tipo A se clasifican en subtipos en función de la reactividad serológica de sus dos principales proteínas de superficie, la hemaglutinina (HA) y la neuraminidasa (NA). En total se conocen 16 subtipos de hemaglutinina (H1 a H16) y 9 tipos de neuraminidasa (NA) (N1 a N9). Sólo unos pocos de estos subtipos se han aislado de forma repetida y estable en mamíferos. En el hombre sólo se encuentran virus de los subtipos H1, H2 y H3 de HA y de los subtipos N1 y N2 de NA; en cerdos, los subtipos H1 y H3, y los N1 y N2, mientras que en caballos sólo se ha aislado los subtipos H3N8 y H7N7. Frente a esta situación de los mamíferos, todos los subtipos tanto de HA como de NA se encuentran en aves acuáticas, y sólo unos pocos de ellos (H4, H5, H6, H7, H9 y H10; N1, N2, N4 y N7) se han establecido como virus en aves de corral, como gallinas y pavos. Los virus aviares también se pueden clasificar en función de su virulencia en virus de baja y alta patogenicidad, los últimos asociados siempre con una alta mortalidad. Son los subtipos H5 y H7 de HA los dos únicos que se han aislado de virus con alta patogenicidad en aves terrestres de corral. Esta situación muestra la compleja relación que existe entre los diferentes subtipos de HA y NA y la distribución de los virus gripales en diferentes especies animales. Asimismo, estos datos reflejan que hay barreras que evitan la transmisión estable mantenida de virus entre diferentes especies animales, y que deben requerirse cambios importantes en el genoma de un virus para permitir su adaptación a nuevos huéspedes. Revisaremos a continuación qué cambios se predice que deben ocurrir para que un virus aviar, como el H5N1, se adapte a los seres humanos.
Los virus aviares no infectan eficazmente seres humanos, y aunque los de terminantes genéticos y fenotípicos del virus que determina esta restricción de huésped no se conocen totalmente, hay datos que demuestran que varios genes virales están implicados, entre ellos los genes de la HA y de la NA, y los que codifican la polimerasa viral. La HA es la proteína viral implicada en la unión inicial del virus a la célula que va a infectar. Esta unión implica la interacción de la HA con residuos de ácido siálico, que se encuentran en el exterior de la membrana plasmática. Aunque las HA de cepas virales humanas y aviares se unen a ácido siálico, hay una diferencia entre ellas, ya que en el primer caso se unen preferencialmente a residuos de ácido siálico unidos a galactosa por un enlace a 2,6 (que abunda en células humanas de la tráquea), mientras que las HA de virus aviares preferentemente reconocen residuos de ácido siálico unidos a galactosa por un enlace a 2,3 (que abunda en el intestino y la tráquea de los patos). Aunque existen células en el tracto respiratorio humano que tienen ácido siálico unido por enlaces a 2,3 y estas se pueden infectar por virus aviares, se postula que uno de los cambios que deben darse para que el virus H5N1 se transmita eficientemente entre seres humanos es que implique un cambio en la especificidad de unión de la HA. La evidencia actual indica, sin embargo, que un cambio de este tipo por sí sólo no sería suficiente para que el virus se transmita de una manera eficaz y sostenida de humano a humano, ya que se han aislado virus H5N1 con mutaciones en la HA que implican un cambio en la afinidad de dicha proteína a favor de residuos de ácido siálico unidos a través de un enlace a 2,6, y sin embargo estos virus no se han extendido a la población humana.
Los virus gripales, cuando salen de la célula infectada, quedan unidos por la HA a residuos de ácido siálico presentes en la superficie de la célula muerta o a residuos de la capa mucosa (mucina) que cubre el epitelio respiratorio. La NA es la proteína viral encargada de liberar el virus de esta unión, rompiendo la interacción HA-ácido siálico. Se requiere un balance adecuado entre las actividades contrapuestas de la HA y de la NA para una óptima replicación viral. De igual manera que ocurre con la HA, las NA aviares tienen predilección por hidrolizar uniones a 2,3, mientras que las NA de virus humanas lo tienen por los enlaces de tipo a 2,6. Por tanto, es de esperar que un virus aviar que cambie la especificidad de unión de la HA para adaptarse a una mejor replicación en seres humanos debe también alterar la especificidad de la actividad de la NA.
Se postula también que además de las proteínas HA y NA, la adaptación de un virus aviar a humano implicaría también mutaciones en otros genes. De hecho, hay evidencias científicas de que cambios en las proteínas que constituyen la polimerasa viral confieren una mejor capacidad de replicación del virus en células de mamífero. En modelos animales se ha demostrado que cambios en el gen de la polimerasa PB2 convertían virus H5N1 no patogénicos en patogénicos para el ratón. Hace ya 4 años se aislaron virus H5N1 de aves que contienen estos cambios en el gen de PB2 y, por tanto, podría tratarse de virus con una posible mejor adaptación a la replicación en células de mamífero. Sin embargo, como en el caso de los virus con cambios en la especificidad en el gen de la HA, estos no se han extendido entre la población humana.
Una de las preocupaciones que surgió al inicio de esta epidemia, y que aún hoy persiste, es que el virus H5N1 pueda mutar incorporando cambios que le hagan transmitirse eficazmente entre seres humanos. La opinión actual es que, basán donos en las evidencias acumuladas y en la experimentación realizada no parece que la adaptación del virus H5N1 a seres humanos surja como consecuencia de un único cambio aminoacídico que afecte a una sola proteína, sino que muy probablemente sean necesarios múltiples cambios que afecten a varios genes virales.
Cronología de la evolución del virus H5N1
En 1997, en Hong Kong, y tras haberse detectado varios brotes causados por un virus gripal en tres granjas de aves de corral, se describe el primer caso documentado de enfermedad en seres humanos causado por un virus de la gripe H5N1. Este primer caso se trata de un niño de tres años que muere como consecuencia de la infección. En el mismo año se siguen detectando brotes de gripe aviar en la zona, identificándose un total de 17 casos adicionales en seres humanos, 5 de los cuales mueren. El brote aviar se controla gracias al sacrificio de más de 1 millón y medio de aves en la zona.
Tras unos pocos años, en los que no se detectan casos en el hombre, es en 2003 cuando el virus vuelve a ser aislado de seres humanos en Hong Kong. Este mismo año se detecta una alta circulación de un virus H5N1 altamente patogénico en aves en la zona que causa brotes en aves de corral en Tailandia, Vietnam, Japón, China, Camboya, Laos, Malasia e Indonesia. A principios de 2004 empiezan a detectarse casos en seres humanos que, en un año y medio (agosto de 2005), sobrepasan el centenar (Tailandia: 17, Camboya: 4, Indonesia: 1 y Vietnam: 90). En varios países de esta región del Sudeste Asiático el virus no ha podido ser eliminado, y en algunas zonas es endémico y sigue causando brotes en aves de corral, como por ejemplo los ocurridos en 2009 en Vietnam, Indonesia y China.
Entre 1997 y mayo de 2005 los virus H5N1 estuvieron confinados principalmente en el Sudeste Asiático. A partir de esta fecha, y tras haberse aislado en aves migratorias en regiones del centro de China, el virus se extiende hacia el oeste (India, África y Europa).
El primer caso confirmado próximo a Europa se detecta en aves de corral en Turquía en octubre de 2005, y el primero en seres humanos en este mismo país se detecta en enero de 2006. Desde finales de 2005 y durante dos años se van sucediendo aislamientos de virus H5N1 en aves salvajes, y en algún caso en brotes en granjas aviares a lo largo de toda Europa (Alemania, Austria, Croacia, Dinamarca, España, Francia, Hungría, Italia, Polonia, Reino Unido, Rumanía y Suiza). La aparición de casos en aves en Europa disminuye a lo largo de 2008 y 2009, años en los que sólo se aísla algún virus H5N1 en Reino Unido y Alemania. Hasta la fecha no se ha aislado ningún caso en seres humanos en la Unión Europea.
En África el virus se detecta por primera vez en Egipto en un brote de aves de granja en febrero de 2006, y en este mismo país el primer caso en seres humanos ocurre en marzo de 2006. A lo largo de 2006 y del año siguiente se detecta el virus en otros países (Nigeria, Camerún, Costa de Marfil, Togo y Ghana) y el virus aún persiste en este continente, donde causa en los años 2008 y 2009 brotes en aves de corral en Egipto y Nigeria y casos en seres humanos aún en 2009.
En Rusia se detecta el virus por primera vez en julio de 2005 y posteriormente en otras localizaciones, asociado con brotes en aves de granja. En la parte central de Asia el primer aislamiento ocurre en la India en febrero de 2006, y pocos meses después en Pakistán y Afganistán. En India y Afganistán el virus sigue circulando en 2007, y en este mismo año se detecta también en Arabia Saudí. En los últimos dos años se han seguido detectando casos y pequeños brotes en la región (India, Pakistán y algunas zonas de Rusia).
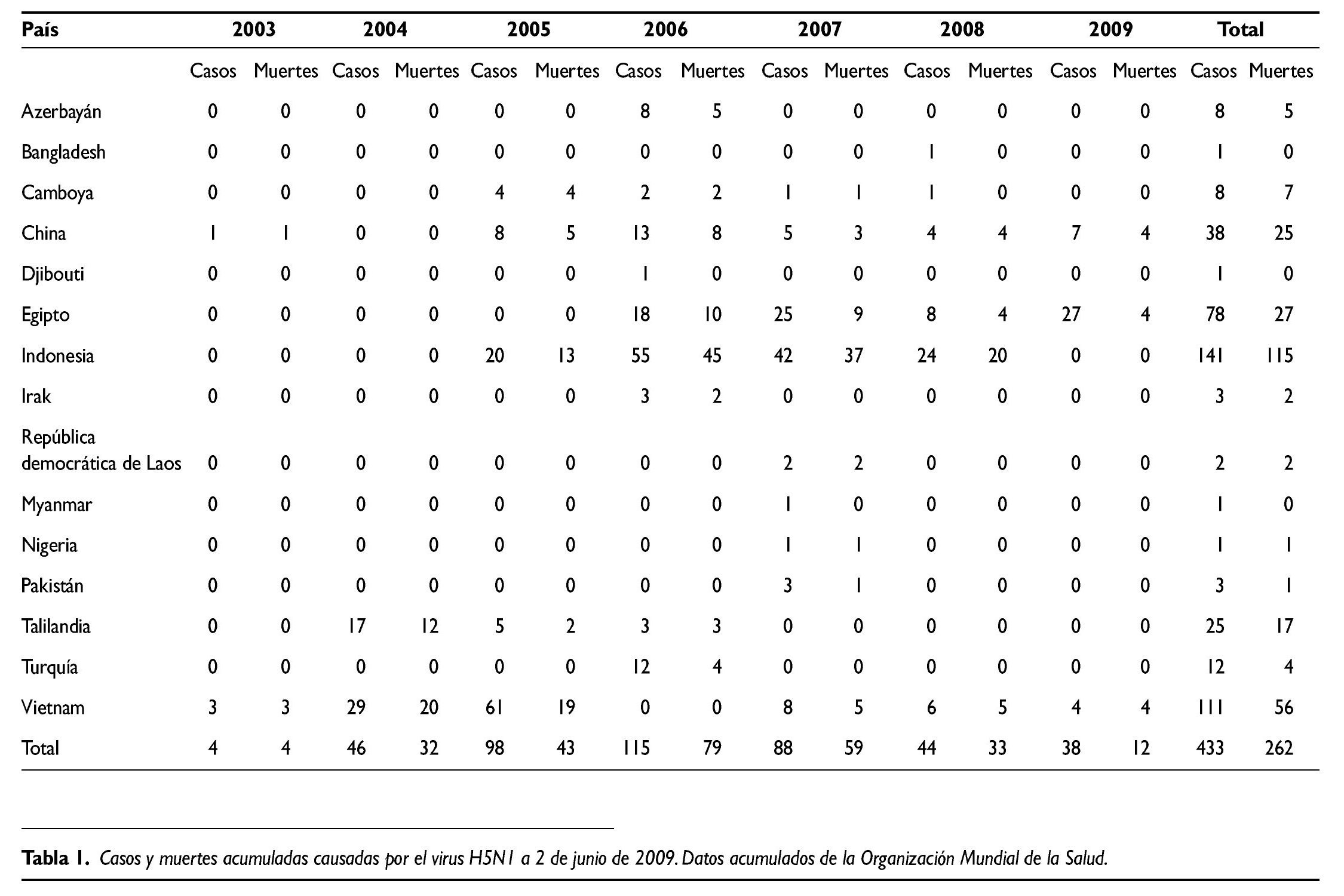
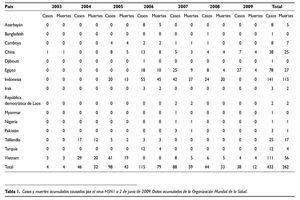
Como se puede ver en la tabla 1, el número total de casos en seres humanos detectados desde 2003 hasta el 2 de junio de 2009 asciende a 433, de los cuales 262 han fallecido. En total se han detectado casos en seres humanos en 15 países, si bien Vietnam e Indonesia dan cuenta de casi la mitad de todos los casos. El año con más casos fue 2006, con un total de 115, número que ha ido reduciéndose en los años siguientes, y así en 2008 sólo se detectaron 38.
Si se quiere obtener una información más detallada sobre la circulación y cronología de la gripe aviar H5N1 se puede obtener a partir de la página web de la Organización Mundial de la Salud (OMS): http:// www.who.int/csr/disease/avian_influen a/en/
Variabilidad genética y antigénica: implicación para la preparación de vacunas
Como se ha comentado en el apartado anterior, desde 2003 el virus H5N1 ha circulado ampliamente y se ha hecho endémico en algunas zonas. Como es habitual en todos los virus, durante este tiempo ha ido evolucionando y acumulado mutaciones en su genoma. La OMS quiere adelantarse a un posible escenario en el que el virus se volviera pandémico y tener seleccionadas de antemano cepas de virus H5N1 bien caracterizadas y con propiedades antigénicas definidas, que pudieran servir para preparar una vacuna. Por ello, la OMS, junto con sus centros colaboradores, realiza un seguimiento detallado de esta epidemia aislando y caracterizando cepas de todas las partes del mundo para monitorizar la evolución del virus.
De acuerdo con la información que recoge, la OMS prepara informes (el último tiene fecha de febrero de 2009) indicando la evolución de los virus H5N1 y una lista con las posibles cepas vacunales. En este último informe, accesible a través de la página web de la OMS: http://www.who.int/csr/disease/avian_influenza/en/ se muestra un análisis filogenético de las HA de virus H5N1 aislados desde 1996 hasta la actualidad, y todos estos se clasifican en un total de 17 grupos genotípicos (denominados clades y subclades). A fecha de mayo de 2009 los virus de la clade 1 se limitan a Camboya, Tailandia y Vietnam, mientras que los virus del la clade 2.1 han seguido circulando en aves de corral y han causado infecciones en seres humanos en Indonesia. Son los virus de la clade 2.2 los que muestran una circulación más extensa, con brotes en aves en más de 60 países en África, Asia y Europa y causa además infecciones en seres humanos en África y Asia. Los virus de la clade 2.3.4 han sido responsables de infecciones en seres humanos en China, Vietnam y otros países de la región. Desde septiembre de 2008 las infecciones en seres humanos las han causado virus de la clade 2.3.2 en China, 2.3.4 en China y Vietnam, de la clade 1 en Camboya, 2.2 en Egipto y virus de la clade 2.1 en Indonesia.
La OMS, además de la caracterización genética de los virus aislados, caracteriza también antigénicamente la HA de los virus mediante ensayos de inhibición de hemaglutinación. Tras analizar y combinar los datos de ambos análisis, selecciona cepas con características representativas de los virus nuevos que aparecen y que se consideran como cepas prototipos para preparar vacunas. En la actualidad hay 12 cepas bien caracterizadas y ya aprobadas por la OMS como cepas vacunales, y otras 7 que están en estadios previos de caracterización. En la tabla 2 se listan las 12 cepas que han completado todo el proceso de caracterización por la OMS y el resto aún no completamente caracterizadas se puede consultar en la página web de la OMS: http://www.who.int/csr/disease/avian_ influenza/en/
BIBLIOGRAFÍA RECOMENDADA
Beigel MD y el Equipo redactor de la OMS. Update on avian influenza A (H5N1) virus infections in humans. New Engl J Med. 2008;358:261-73.
De Jong MD, Hien TT. Avian influenza A (H5N1). J Clin Virol. 2006;35:2-13.
Gambotto A, Barratt-Boyes SM, de Jong MD, Neumann G, Kawaoka Y. Human infection with highly pathogenic H5N1 influenza virus. Lancet. 2008; 371:1464-75.
Horimoto T, Kawaoka Y. Influenza: lessons from the past pandemics, warnings from current incidents. Nature Rev Micriobiol. 2005;3:591-600.
http://www.who.int/csr/disease/avian_influ enza/en/
Melidou A, Gioula G, Exindari M, Chat-zidimitriou D, Mataftsi D. Influenza A (H5N1): an overview of the current situation. EuroSurveill. 2009;14(20): pii:19216.
Peiris JS, de Jong MD, Guan Y. Avian influenza virus (H5N1): a threat to human health. Clin Microbiol Rev. 2007;20: 243-67.
Webster RG, Govorkova EA. H5N1 influenza-continuing evolution and spread. N Engl J Med. 2007;355: 2174-7.