Introducción
Desde hace pocos años los medios de comunicación nos vienen presentando noticias sobre las denominadas enfermedades raras (ER). En los últimos meses de 2006 estos mismos medios se hicieron eco de la celebración de la semana de concienciación sobre ER, durante la cual se celebraron, entre otros actos, dos reuniones internacionales relacionadas con estas enfermedades: la organizada por la Oficina de Enfermedades Raras de los Institutos Nacionales de la Salud de Norte América, denominada International Committee on Rare Diseases (ICORD)1 y la reunión de la plataforma conjunta que reúne a investigadores, industria y organizaciones de afectados: The European Platform for Patients' Organisations, Science and Industry (EPPOSI)2. El colofón de esa semana se hizo coincidir con la presentación oficial de la Fundación para la Investigación sobre Enfermedades Raras, nacida de la mano de la Federación Española de Enfermedades Raras (FEDER)3, que nace con la idea de fomentar la investigación en ER tanto pública como privada. Al mismo tiempo, en el Senado se trabajaba en una ponencia sobre ER cuyas conclusiones ya han sido recientemente publicadas4, y que acaban de ser aprobadas en el pleno de esta cámara. A todos estos hechos recientes habría que añadir otras decisiones tomadas desde los ámbitos administrativos en los últimos dos años, como la creación del Instituto de Investigación en ER en el 20045, la próxima inauguración del denominado Centro de Burgos para ER, la creación de un Centro de Investigación Biomédica en Red (CIBER) para el estudio de la genética de las ER y la promulgación de un Real Decreto sobre centros de referencia6.
A pesar de que la concienciación sobre los problemas que presentan las ER se ha incrementado en estos últimos años, y de que las decisiones asumidas por las administraciones, así como la actividad internacional desarrollada ha sido muy importante, todavía hoy en día se escuchan preguntas generales del tipo de: ¿qué es esto de las ER?, ¿existían antes o es algo de aparición nueva?, ¿por qué tanta atención de los medios?, ¿realmente no están atendidas y se requiere algo especial para ellas?, que demuestran la falta de información existente sobre estas patologías.
Por su parte, los profesionales de la salud también comparten estas preguntas de carácter general, aunque añaden otras que implican más especialización. Cuestiones como ¿cuántas enfermedades existen?, ¿cuáles son?, ¿dónde están los especialistas, la información sobre su distribución, origen, etc.?, ¿existen centros especializados?, ¿cómo se van a poder tratar todas las ER en un centro?, ¿debe la salud pública preocuparse por un tipo de enfermedades que afectan a poca población y a familias con una carga genética específica?, etc., son entre muchas otras, preocupaciones que suelen estar en todos los foros tanto de las administraciones sanitarias como de las sociedades científicas e incluso de los investigadores.
Antes de adentrarnos en la discusión de algunas de estas cuestiones, conviene actualizar algunas ideas básicas y pasar a analizar los problemas que plantean las ER en el mundo de la gestión sanitaria.
Definición y características
El concepto de ER se acuña por primera vez en los Estados Unidos de Norteamérica (EE.UU.) en los años ochenta y siempre ligado a otro concepto, el de medicamentos huérfanos7. Rápidamente estos términos se extienden por otros países como Australia y Japón. A Europa llega de forma oficial en el año 1999, con la promulgación del Plan de Acción de Enfermedades poco Comunes de la Comunidad Europea (CE)8, seguido del Reglamento de Medicamentos Huérfanos lanzado a comienzos del año 20009. Todos estos países agrupan bajo el concepto de ER las enfermedades de baja prevalencia, utilizando en cada uno de ellos una definición de prevalencia distinta. Mientras en los EE.UU. se utiliza la cifra de 200.000 casos para todo el país, el resto decide asumir un término de prevalencia real y poner el límite en menos de 5 casos por cada 10.000 habitantes en la CE, o menos de 2 casos por cada 10.000 en Japón.
La CE también incluye en esta definición las condiciones raras (evolución clínica especial o fenotipo diferente) de enfermedades frecuentes y añade un aspecto no ligado a la cifra de prevalencia consistente en que tanto si es una enfermedad como una condición, debe tener un alto impacto en la mortalidad y/o generar deficiencias funcionales importantes. Con frecuencia el término de enfermedades olvidadas suele intercambiarse con el de ER. Se entiende por enfermedades olvidadas10 aquellas patologías generalmente frecuentes en países no desarrollados, pero poco frecuentes o semi-erradicadas en países desarrollados. Este tipo de enfermedades suelen ser de origen infeccioso, aunque con componentes ambientales muy importantes, sobre las que existe un conocimiento, pero que ya no suelen ser un problema para los países de mayor poder adquisitivo. Por supuesto, son de baja prevalencia en este tipo de países, pero los problemas derivados de las enfermedades olvidadas suelen tratarse dentro de programas especiales, y no dentro del marco de los programas de enfermedades raras. No obstante, algunas iniciativas en el marco de las ER están empezando a introducir apartados que dejan una puerta abierta, para que el futuro, también de algunas de estas enfermedades olvidadas, sea objeto de análisis y dedicación entre las ER.
Bajo el término de ER se incluyen de forma mayoritaria las enfermedades de origen genético, y dada la eclosión de nuevos hallazgos y variantes genéticas, no es extraño que se ofrezcan cifras de entre 5.000 y 7.000 enfermedades diferentes. Sin embargo, no existe una única lista de estas miles de ER, y en realidad nadie sabe cuántas son, porque aunque parezca extraño, existen diferentes formas de entender qué es una enfermedad (entidad clínica, fenotipo evolutivo, mismo fenotipo pero con distinta etiología, clasificaciones en función del órgano afectado, etc.). Por ello, no es de extrañar que estemos tratando un problema cuyo marco es impreciso, y cuya información, en términos de dimensión del problema, es todavía escasa. El término es relativamente joven, y el desarrollo del mismo no está siendo armónico, ya que se están poniendo muchos esfuerzos y recursos en el análisis de los mecanismos biológicos, y muchos menos en la parte más conceptual del problema. No obstante, existen en la actualidad portales de Internet muy útiles cuando se quiere hacer una consulta sobre una enfermedad concreta1,11,12.
Muchas de estas patologías aparecen durante la edad pediátrica, lo que no significa que no existan adultos con las mismas. En realidad, se habla de que el 80% se inician en las edades infantiles, pero cuando se explora la morbilidad de estas patologías se encuentran grandes bolsas de pacientes en edades medias, e incluso en edades avanzadas. Sin duda, la elevada mortalidad de algunas de las enfermedades infantiles, como malformaciones graves, o enfermedades genéticas graves, pueden desempeñar un papel en esta doble visión sobre el rango de edades de la incidencia y el rango de edad donde se observa la mayor prevalencia.
Para la organización de los servicios sanitarios, este tipo de situaciones plantea problemas de muy diversa índole. Para los servicios de pediatría y laboratorios asociados el enfoque se centraría en contar con servicios de alto nivel de calidad diagnóstica y atención preferente para evitar la mortalidad y la discapacidad, mientras que una vez que el caso ya ha sido diagnosticado, los problemas se centrarían en poder mantener una mayor calidad en su seguimiento.
Dentro del marco de las miles de enfermedades de baja prevalencia podríamos establecer dos prototipos: las de más carga genética y aparición en el nacimiento o en la edad pediátrica, que tendrían una más baja prevalencia, mientras que aquellas que tienen un carácter más crónico, con menos componente genético y se inician en edades adultas estarían formadas por un grupo de patologías de prevalencias más elevadas, pero dentro del rango de la definición de ER. Con estos datos preliminares podemos aventurar dos tipos generales de necesidades asistenciales: a) la derivada de los niños y adolescentes con patologías muy poco frecuentes, que requieren su mayoría un diagnóstico de confirmación genético, atención muy dedicada por los altos niveles de deficiencias intelectuales, osteo-musculares, sensoriales y fallos orgánicos, atención familiar y soporte social, así como más investigación y b) las que comienzan en la edad adulta, generalmente con un diagnóstico nada sencillo, sin pruebas de laboratorio concluyentes que confirmen el diagnóstico y que requieren la participación de equipos clínicos con experiencia, tanto en la fase de diagnóstico como en la de tratamiento. Estas enfermedades suelen conllevar tratamientos costosos para los sistemas de salud y una alta dependencia a dichos servicios. También en este segundo grupo podríamos encontrar enfermedades que se han iniciado en edades tempranas, pero cuya supervivencia les ha permitido superar cierto rango de edades. El estado de cronicidad y alta dependencia física y psíquica de muchas de estas patologías requieren mayor atención de las complicaciones y la comorbilidad, rehabilitación y sistemas que proporcionen cuidados de soporte. Por supuesto, estos dos prototipos no son una regla, y entre las miles de enfermedades se dan todo tipo de situaciones.
Otros problemas asociados
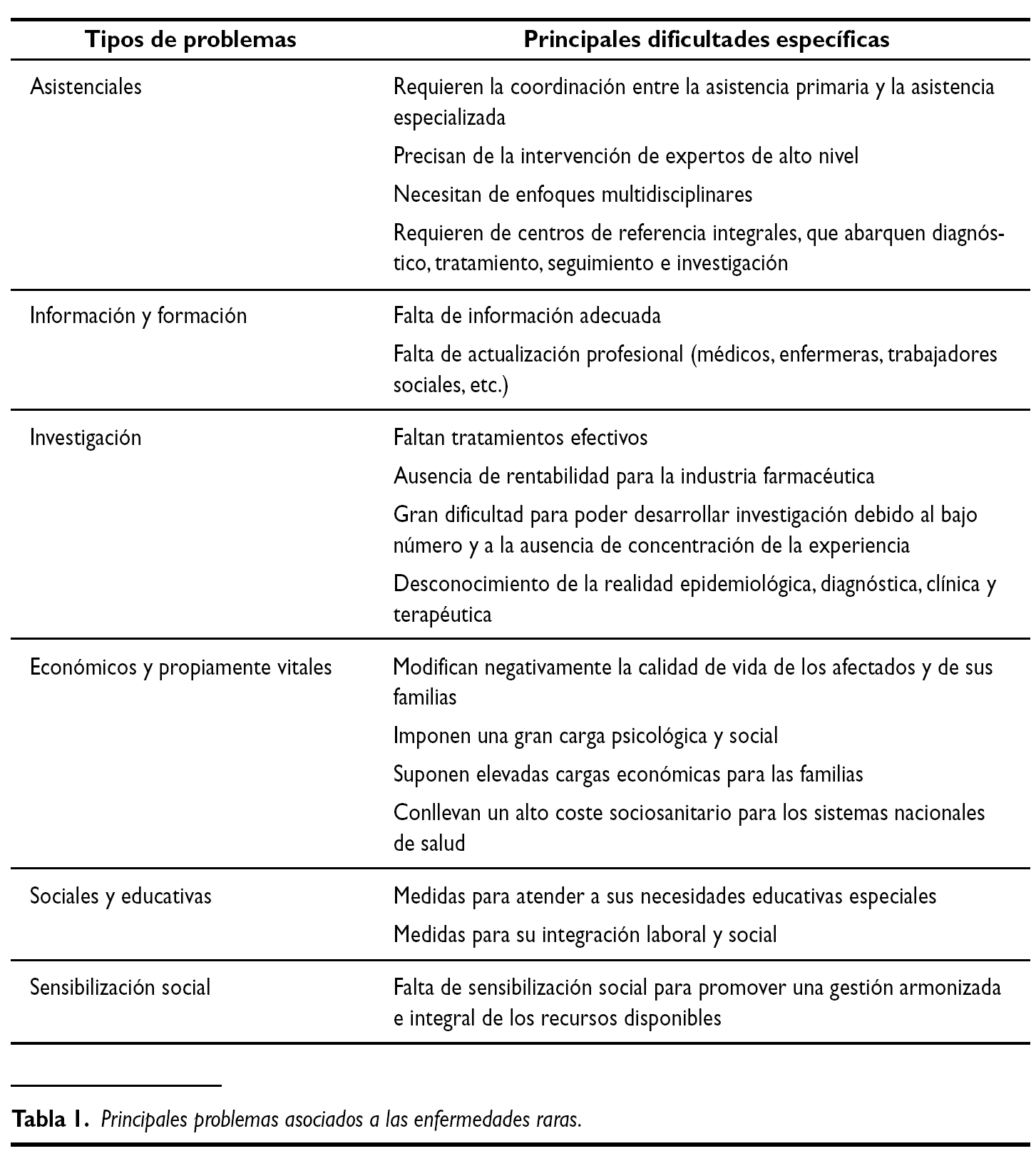
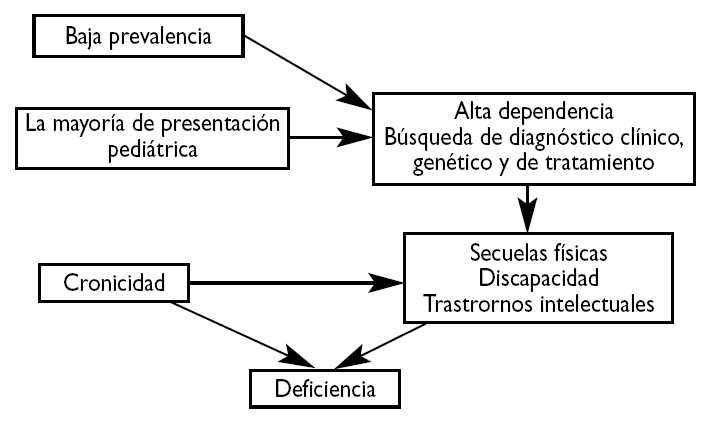
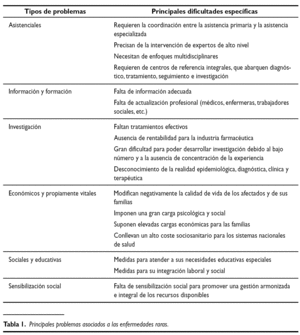
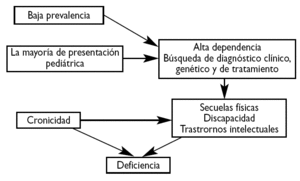
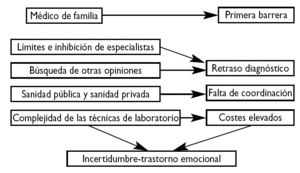
Las necesidades de las enfermedades raras han sido ampliamente enunciadas en muchos foros, pero en muy pocas ocasiones se han estudiado con un cierto criterio metodológico. En España se conocen dos tipos de estudios: uno de carácter general llevado a cabo por el IMSERSO en el año 200113 y otro realizado en el ámbito pediátrico en un área sanitaria de la Comunidad Autónoma de Cantabria14. Ambos utilizaron métodos cualitativos a través de entrevistas personales, focus groups, y entrevistas con detalle a pacientes o familiares. En ambos estudios se pudo constatar la variedad de problemas que estos pacientes y sus familias soportan, pero quizás cabe destacar aquellos procedentes de la falta de información sobre recursos, los debidos a la ausencia de una actualización médica adecuada, las dificultades para la coordinación entre la Atención Primaria y la especializada, la ausencia de experiencia profesional, los problemas económicos y sociales y la falta de sensibilización social (tabla 1, figs. 1 y 2). En definitiva, suponen una gran carga social y familiar y se sienten olvidados15.
Figura 1.Flujo de los principales problemas de las enfermedades raras asociados a baja prevalencia.
Figura 2.Flujo de los principales problemas de las enfermedades raras asociados a temas sanitarios.
Clasificaciones y aspectos epidemiológicos
La falta de una lista exhaustiva de ER viene en parte justificada por la carencia de una clasificación única aceptada internacionalmente. Si bien las versiones de la CIE 9 y 1016 están todavía en uso para los principales sistemas de información en salud, estas dos clasificaciones no abordan el concepto de ER, encontrándose incluidas en todos los grandes grupos de enfermedades, bien con códigos únicos y específicos, como la esclerosis lateral amiotrófica (ELA), bien con códigos que engloban un conjunto de enfermedades todas ellas raras, como las mucopolisacaridosis, o en un conjunto de enfermedades donde se combinan enfermedades frecuentes y raras, como las talasemias.
No es de extrañar que en este contexto no existan sistemas de información adecuados para el conjunto de las ER, salvo aquellos sistemas más próximos que llevan años de tradición en el mundo de la salud pública y que engloban algunos grupos de estas patologías, como el de enfermedades infecciosas, los registros de tumores o los registros más específicos, como los de patología renal crónica.
Más habitual es encontrarse con especialistas clínicos asociados o en solitario, que por su dedicación e interés mantienen algún fichero de casos de una patología concreta al que denominan registro, y que se rige bajo normas de clasificación de sociedades científicas concretas. No todos ellos cumplen esta condición desde el punto de vista metodológico, pero en su mayoría cumplen una función y desarrollan una labor interesante y que merece ser apoyada.
La epidemiología de las ER es, por lo tanto, un reto que sólo se está afrontando muy recientemente en algunos países. En concreto en España se creó la Red Epidemiológica de Enfermedades Raras (REpIER)17 bajo el programa de redes temáticas de investigación cooperativa (RETICS) del ISCIII.
REpIER revisó varios aspectos que afectan al análisis epidemiológico de las ER, como los problemas del cribado y la implantación de nuevas estrategias, la búsqueda de fuentes de información, el análisis de fuentes de morbilidad18 y mortalidad, el desarrollo de métodos para la evaluación del coste-utilidad, la farmacoepidemiología y el análisis de los registros de ER19. Algunos frutos de estos trabajos han visto la luz en publicaciones de las propias consejerías20,21, la apertura de espacios específicos en los portales de las páginas oficiales de las Consejerías de Salud y la declaración oficial de un registro poblacional parte de la Junta de Extremadura22.
Programas europeos
No es posible hablar hoy en día de ER sin referirse al papel desempeñado por la Dirección General de Salud pública de la CE23,24, pero sobre todo hay que destacar la actividad desarrollada por la Organización Europea de Enfermedades Raras (EURORDIS)25, sin cuya participación activa no hubiéramos contado con acciones políticas sobre las ER en Europa. El Plan de Acción sobre Enfermedades Raras sirvió para definir el término de ER en el marco de la CE8, definición que fue adoptada por el reglamento de Medicamentos Huérfanos26. También sirvió para fortalecer acciones en el campo de los sistemas de información y para reforzar el movimiento asociativo en el ámbito europeo, con proyectos financiados desde las propias direcciones generales de la CE y cuyo liderazgo se ubicaba en EURORDIS. Entre las acciones más relevantes se encuentran: a) el proyecto EuroBioBank27, cuyo objetivo ha consistido en implantar normas de actuación ético-jurídicas en el campo de los biobancos de ER y crear un catálogo de muestras distribuido; b) las diferentes fases del proyecto PARD28 a partir del cual EURORDIS puso de manifiesto varios de los problemas existentes en el acceso y la distribución de los medicamentos huérfanos, y c) el proyecto RAPSODY29, que entre otros muchos objetivos tratará de analizar los criterios para la creación de centros de referencia y la cuantificación de las necesidades de asistencia sanitaria de las ER.
Más recientemente, con la entada en acción del nuevo programa de salud pública23, la DG SANCO ha puesto en marcha una task force en ER30 cuyos mandatos son:
1. Asesorar y asistir a la Dirección General de salud Pública de la Comisión Europea en la promoción de la prevención óptima, el diagnóstico, el tratamiento de las ER en Europa, reconociendo que el único valor añadido a conseguir en éstas pasa por la coordinación a nivel europeo.
2. Proporcionar un forum de discusión e intercambio de puntos de vista y experiencias en todos aquellos temas relacionados con las enfermedades raras. La actividad de este grupo, formado por representantes de los Estados miembros, directores de proyectos de investigación aprobados, representantes de EURODIS, de la DG SANCO y de expertos en ER, se está centrando en tres grupos de trabajo específicos dedicados a temas como: a) estándar de cuidados sanitarios que incluye los centros de referencia, las pruebas genéticas y el cribado; b) codificación, clasificación y confidencialidad de los datos, y c) indicadores de salud.
Al mismo tiempo se están financiando diversos proyectos, como el análisis del incremento de la prevalencia de autismo en Europa, y se acaba de poner a consulta pública el Comunidado a la Comisión donde se proponen medidas a adoptar en el seno de la UE para las ER24,31,32.
Programas nacionales
Como tal concepto sólo podemos destacar los emprendidos por Francia e Italia. Francia ha lanzado un programa nacional para las ER con una duración de 4 años y un presupuesto de 20 millones de euros anuales33. El plan recoge todos los aspectos posibles:
1. Epidemiología.
2. Reconocimiento de la especificidad.
3. Información.
4. Formación.
5. Despistaje y accesibilidad a las pruebas diagnósticas.
6. Accesibilidad a los cuidados y su calidad.
7. Medicamentos huérfanos.
8. Atención a las familias y asociaciones.
9. Investigación.
10. Cooperación nacional y europea.
Italia, por su parte, ha centrado sus esfuerzos en desarrollar una estrategia de registro nacional a través de ofertar a los pacientes con ER el no tener que realizar el copago correspondiente por la asistencia sanitaria prestada, tal y como ocurre para el resto de los ciudadanos italianos. También han alcanzado acuerdos con la Oficina de Enfermedades Raras de los Institutos Nacionales de la Salud de los EE.UU. para coordinar el sistema de información y ampliar la cooperación en investigación. Otros países han desarrollado políticas sectoriales, principalmente de designación de centros de referencia, cada uno con arreglo a sus prioridades.
España se encuadra en este conjunto de países, donde no existe un plan de acción global sobre las ER, pero tal y como se recoge en las conclusiones de la ponencia del Senado, recientemente publicadas en boletín del Congreso de las Cortes4, es de esperar que dicho plan, reivindicado por las propia FEDER, sea una realidad durante los próximos meses.
Centros de referencia
La acreditación de centros de referencia para las ER ha sido una reclamación básica de enfermos, familiares, asociaciones de pacientes y también de profesionales. Un sistema de salud de cobertura total debe asumir una homogeneización de las prestaciones y de la cartera de servicios, pero al mismo tiempo no es posible entender la eficiencia del sistema ni la alta especialización sin la existencia de los denominados centros/servicios/unidades de referencia. La existencia de este tipo de centros es algo consustancial con las demandas de mejores niveles asistenciales basados en la experiencia y el conocimiento actualizado. El equilibrio a conseguir está en la adecuada distribución de los recursos para que ambas situaciones, la atención a las necesidades de las patologías poco frecuentes y la que debe prestarse de forma más generalizada a las patologías frecuentes, puedan armonizarse y ser una realidad. Los objetivos a conseguir con estos centros serían la disminución de los retrasos diagnósticos, evitar la confusión diagnóstica, estandarizar los seguimientos clínicos más apropiados, facilitar el acceso a los tratamientos más idóneos para cada caso y, en definitiva, mejorar la calidad de vida de enfermos y familiares. La investigación sería algo propio y casi una consecuencia necesaria y obligada, ligado todo ello a la existencia de dicho centro, pero la constante mezcla de patrones e indicadores supuestamente útiles para la evaluación de la investigación no pueden ser el objetivo a considerar, ni tan siquiera la herramienta para evaluar los centros de referencia. Una buena asistencia puede llevar a una buena investigación, aunque no necesariamente, pero lo contrario no siempre es verdad.
La política más concreta en este sentido ha sido desarrollada por Francia, que hasta el momento ha desarrollado dos convocatorias para la acreditación de centros de referencia, alcanzando la cifra actual de cerca de los 100 centros ya designados34.
EURORDIS ha lanzado un decálogo sobre lo que los pacientes consideran que debe ser un centro de referencia (tabla 2). En España algunas de las Comunidades Autónomas han designado centros de referencia para alguna situación específica, como es el caso de la ELA en la Comunidad de Madrid, el centro especializado en las intervenciones sobre elongaciones óseas ubicado en Cataluña o el diagnóstico genético de diversas patologías raras en las Unidades de Genética de diversos centros sanitarios, distribuidos por la mayor parte de nuestras Comunidades Autónomas.
Con la promulgación del nuevo Real Decreto sobre centros de referencia6 se abre la puerta a la acreditación de unas funciones y objetivos que permitirán el desarrollo de una estrategia de vigilancia y estudio del problema de una forma más coherente. Sin duda la ponencia del Senado recoge con acierto esta necesidad y fija como objetivos la creación de una serie de centros de referencia en un espacio de tiempo determinado. Las conclusiones ahora aprobadas por el Pleno del Senado mantienen este mismo objetivo, demostrando así su importancia.
En este contexto, pero fuera del campo de los servicios de salud propiamente dichos, es importante destacar el impulso que el Ministerio de Trabajo y Asuntos Sociales pretende dar a las Enfermedades Raras con la puesta en funcionamiento del denominado Centro de Burgos, para el que el ministerio fija objetivos importantes, no sólo en el campo de las acciones sociales, asunto de competencia de este organismo, sino en el campo de la información y formación, tan necesarios para un desarrollo eficiente y conjunto de los servicios sanitarios.
Tratamiento de las enfermedades raras y medicamentos huérfanos
En general existe la creencia de que los tratamientos farmacológicos son la solución de las enfermedades raras. Hoy en día, actividades como cirugías especiales de tipo ortopédico, o sobre órganos vitales ante la presencia de malformaciones graves, los trasplantes tanto de órganos como de médula ósea y la rehabilitación35-38 son, entre otras, valiosas armas terapéuticas para ciertas patologías o para paliar aspectos evolutivos específicos de muchas de las ER. Recientemente, la intervención en el campo de la genética, como el denominado diagnóstico preimplantacional39 o las propias acciones de control de la natalidad en algunas parejas, tras un buen asesoramiento a través del consejo genético, son sin duda acciones a tener en cuenta ante un paciente o un portador de una ER. De todas formas, estrictamente hablando, no podemos clasificar de tratamientos a estos últimos, salvo que consideremos enfermos a una pareja de portadores que quieren tener un hijo sano. Es cierto que estamos interviniendo sobre un problema de salud, pero no sobre individuos enfermos. Este tipo de actuaciones nunca conseguirían eliminar toda la carga de enfermedad, porque el ser portador de un gen recesivo no es algo que podamos conocer a priori, salvo en circunstancias muy especiales. La introducción de ciertas tecnologías en los servicios sanitarios, que impactan en los medios y en la sociedad, sin una previa y adecuada evaluación de su coste-efectividad, incluyendo la evaluación de outcomes a largo plazo, suele ser uno de los problemas que soportan estoicamente los sistemas de salud, siempre diezmados de recursos suficientes para hacer frente a toda la demanda que se plantea desde la parte especializada. Las ER son un buen ejemplo de este problema, sobre el que tarde o temprano se tendrán que establecer criterios de actuación coherentes con la evidencia científica existente, dentro del marco de las carteras de servicios.
El impulsar la investigación en el marco de los medicamentos huérfanos todavía sigue siendo una reclamación unánime, de manera que se puedan identificar nuevos tratamientos farmacológicos, que sean bien tolerados, seguros y de administración fácil para cualquier paciente. Esta aspiración choca con la cruda realidad de que no siempre es rentable invertir en investigación para conseguir medicamentos y tratar unos pocos casos en todo el mundo. Por ello, se acuñó el concepto de medicamentos huérfanos40. Las reglamentaciones desarrolladas en varios países y también en el ámbito de la CE han sido positivas, pero también han demostrado que no son tantos los medicamentos realmente curativos ni los avances científicos actuales como para permitir asegurar que la inversión es directamente proporcional a los resultados en términos de coste-efectividad o coste-utilidad. A pesar de ello, los esfuerzos se han realizado en el sentido de favorecer a la industria farmacéutica para que obtenga los retornos apropiados a las inversiones que realiza en un marco de comparación con fármacos para enfermedades frecuentes. En este sentido, los diversos reglamentos de medicamentos huérfanos han enfocado sus actuaciones a la exención de tasas, la prolongación de la exclusividad del mercado del nuevo tratamiento y a la prestación de ayuda para la presentación de la documentación pertinente para alcanzar la designación de medicamento huérfano, entre otras acciones. A cambio, el proponente debe justificar que la molécula propuesta para el tratamiento actúa de una forma biológicamente plausible, y que la enfermedad para la que será utilizada está por debajo de la prevalencia exigida para las ER en Europa9.
Desde la entrada en vigor del reglamento de medicamentos huérfanos en Europa hasta la actualidad se han presentado 634 propuestas. De ellas han optado a la designación de medicamento huérfano 422, pero sólo 30 han alcanzado la fase de autorización para la comercialización. La diferencia entre el número de fármacos designados y comercializados se debe a que la industria farmacéutica puede optar a esta designación en cualquiera de las fases de investigación de la molécula, desde su ideación hasta fases avanzadas donde ya existen posibilidades de su puesta en el mercado. No obstante, los requisitos finales para su comercialización no se diferencian en nada de los que existen para patologías frecuentes y el laboratorio debe haber demostrado que la molécula es eficaz, tiene calidad y es segura. La lista completa de medicamentos designados puede consultarse en la página de la Comisión Europea41.
EURORDIS ha desarrollado estudios sobre disponibilidad y precios en los distintos países de la CE para 5 de los fármacos inicialmente comercializados, demostrándose la existencia de una gran desigualdad en el acceso a los mismos, tanto en el número de fármacos asequibles en cada país, como en el tiempo que pasa desde la aprobación por la Agencia Europea del Medicamento hasta su llegada al mercado nacional. También el precio final de venta, que se negocia con las autoridades de cada país, parece ser un factor de distorsión en esta accesibilidad, ya que se da la curiosa relación que a mayor precio mejor y más pronta es la disponibilidad del mismo en los diferentes países analizados42.
El coste de los medicamentos huérfanos suele ser, por lo general, muy elevado, lo que suele ser un problema añadido para los presupuestos de los sistemas de salud. Recientemente, una comisión de expertos ha analizado este problema, ya que en el momento actual más de 400 fármacos pueden llegar al mercado con precios nada despreciables, y aunque detrás de éstos haya pocos pacientes, los retornos de algunos de estos compuestos suponen una buena fuente de ingresos para los laboratorios. Enfermedades graves y de alta mortalidad pueden pasar a ser con estos tratamientos enfermedades crónicas que requieren el medicamento para toda la vida y a un coste muy elevado, lo que permite, en opinión de los expertos, aventurar que será necesario ajustar el reglamento de medicamentos huérfanos a esta nueva realidad, y pasar de pensar que un medicamento no es rentable a considerar que pasados unos años pueda ser muy rentable y tener que ajustar los precios de partida a la nueva realidad. Sin duda estos problemas deberán ser resueltos en los próximos años para evitar que la solución a uno de ellos derive en otros tan graves como los primeros, y que atenten contra el principio de equidad de los ciudadanos europeos. Recientemente, el Ministerio de Sanidad y Consumo ha asumido la realización de una nueva convocatoria para la investigación clínica sin promotor, situación muy frecuente en las enfermedades raras. Esta decisión podría ser un estímulo para investigadores del sector público, que pudieran estar trabajando en nuevas moléculas, posibles nuevos medicamentos del futuro. Estas acciones podrían también verse impulsadas si las administraciones pudieran asumir el ser los propios dueños de la molécula (futuro medicamento), así como el control de aquellos otros medicamentos que los laboratorios dejan de fabricar por falta de interés43.
El consumo de fármacos por parte de los pacientes con enfermedades raras no se limita al uso de los medicamentos huérfanos. Muchos pacientes presentan síntomas para los que existen tratamientos convencionales, tales como anti-convulsivos, anti-eméticos, productos dietéticos o simplemente analgésicos, cuya utilidad es conocida y cuyo manejo está autorizado. Por ello, el gasto en medicamentos huérfanos o no, y de productos farmacéuticos en general, es bastante elevado y tanto las familias como los sistemas de salud soportan este gasto sin que existan en ocasiones políticas más sociales que puedan ser aplicadas desde el conocimiento de la dimensión del problema.
Enfermedades raras, genética y tratamientos personalizados
También en los últimos años y a raíz del desarrollo del Proyecto del Genoma Humano44 y de otros similares45, se ha empezado a acuñar el concepto de tratamiento personalizado, ligándolo a la influencia de una carga genética en ese individuo en concreto y a la posibilidad de modificación de la misma con acciones farmacológicas ad hoc. Si bien esta idea no es exclusiva de las ER, es en éstas donde parece que toma su fundamento al poder contar con un paradigma de que un gen lleva sin remedio alguno a la presencia de una enfermedad. Aunque existen ejemplos de genes de alta penetrancia que muestran esta relación, la existente entre mecanismo biológico y fenotipo es todavía uno de los retos del mundo de la investigación, independientemente de la complejidad de dicho mecanismo biológico y de su naturaleza46. Los sistemas de salud actuales se ven sobrepasados por esta corriente de opinión imperante en la sociedad, y en concreto en el campo de las ER, donde las pruebas genéticas son importantes, pero en ocasiones se las eleva a un mayor rango aplicando el principio de gen-fenotipo a todo tipo de hallazgo, independientemente de la validez interna del estudio y de la posibilidad de generalización a otras familias y/o poblaciones. Aunque en Europa existe una amplia preocupación por este problema, y proyectos como el de Eurogentest47 o el plan que prepara la propia DG SANCO están tratando de facilitar este proceso de incorporación de nuevos hallazgos a la práctica diaria, la realidad es que en el momento actual muchos de los problemas con los que se encuentran los servicios de gestión de nuestros centros en el campo de las ER se deben a la reiterada reivindicación de los profesionales para incorporar nuevas pruebas diagnósticas o solicitudes de envío de muestras a terceros centros. No existen soluciones mágicas para este problema, pero sin duda los expertos en evaluación de tecnologías y los economistas de la salud deberían adentrarse en el análisis de los problemas derivados de las ER, y sobre todo en los que afectan a la introducción de nuevas tecnologías.
Las ER requieren de nuevos modelos de gestión de las unidades especializadas que diagnostican, tratan y mantienen un seguimiento a grupos de estos pacientes. Dichos modelos deberían tener en cuenta la promoción de dichas unidades para su designación como centros de referencia únicos o en unión a otros, formando y consolidando redes asistenciales, de modo que permitan compartir experiencias, gestionar los medicamentos huérfanos y ayudar a un mayor conocimiento científico de los problemas. Este modelo facilitaría la provisión de datos epidemiológicos y económicos de calidad, facilitando un mayor y mejor conocimiento de las necesidades y el coste real de las intervenciones y procesos. De esta forma, se podría garantizar un futuro mejor para los pacientes, una gestión más eficiente de dichas unidades y una mayor competitividad científica en nuestros profesionales.