Introducción
El asma es una enfermedad inflamatoria crónica de las vías aéreas en la que intervienen diferentes elementos celulares. La inflamación bronquial crónica se relaciona con una hiperrespuesta de las vías aéreas manifestada por episodios recurrentes de tos, disnea, sibilancias y dolor torácico, en particular durante la noche. Estos episodios se acompañan casi siempre de obstrucción variable del flujo aéreo pulmonar, muchas veces reversible de forma espontánea o con tratamiento.1 El asma se define por sus características clínicas, fisiológicas y patológicas.1 La mayoría de los casos de asma presenta una forma intermitente y persistente leve, que se controla de manera adecuada, pero existe un grupo de enfermos en quienes no se consigue el control clínico, aun con apego al tratamiento recomendado con dosis elevadas de fármacos; esto se conoce en la actualidad como asma de difícil control (ADC) y representa un reto diagnóstico y terapéutico.2,3
Epidemiología
Se calcula que 300 millones de personas en el mundo tienen asma y 255 000 individuos murieron por este padecimiento en el año 2005.1 La prevalencia del asma es variable en diferentes regiones del mundo. El asma es la enfermedad crónica más común en la población infantil, es un problema de salud pública en varios países y en las naciones en desarrollo representa el 80% de la mortalidad por asma.1,4
En forma global se considera que la prevalencia del asma en la población varía entre 1% y 18%.5 En escolares de algunas regiones de México, la prevalencia de asma fluctúa entre 4.5% y 12.6%.6,7
En general, se ha calculado que la incidencia anual de asma en adultos es de 4.6 a 5.9 por 1 000 en mujeres y de 3.6 a 4.4 por 1 000 en hombres.8
En México, el asma se incluyó dentro de las enfermedades reportables desde 1995, aunque el primer registro confiable comenzó al año siguiente.4
La tasa bruta de mortalidad por asma en el mundo en el año 2001, de acuerdo con la OMS, fue de 3.73 por 100 000 habitantes. En México, la tasa de mortalidad en 2003 fue de 1.8 por 100 000 habitantes; los grupos de edad más afectados son los menores de un año con una tasa de 2.9 y los mayores de 65 con una tasa de 22.6 por 100 000 habitantes.8
El asma puede afectar a personas de cualquier edad. La incidencia de este padecimiento es más elevada en los niños y en las personas mayores de 15 años de edad se presentan menos casos nuevos. Cabe agregar que en la infancia, el sexo masculino es el más afectado y en la edad adulta la relación se invierte (~2:1).4
Etiopatogenia
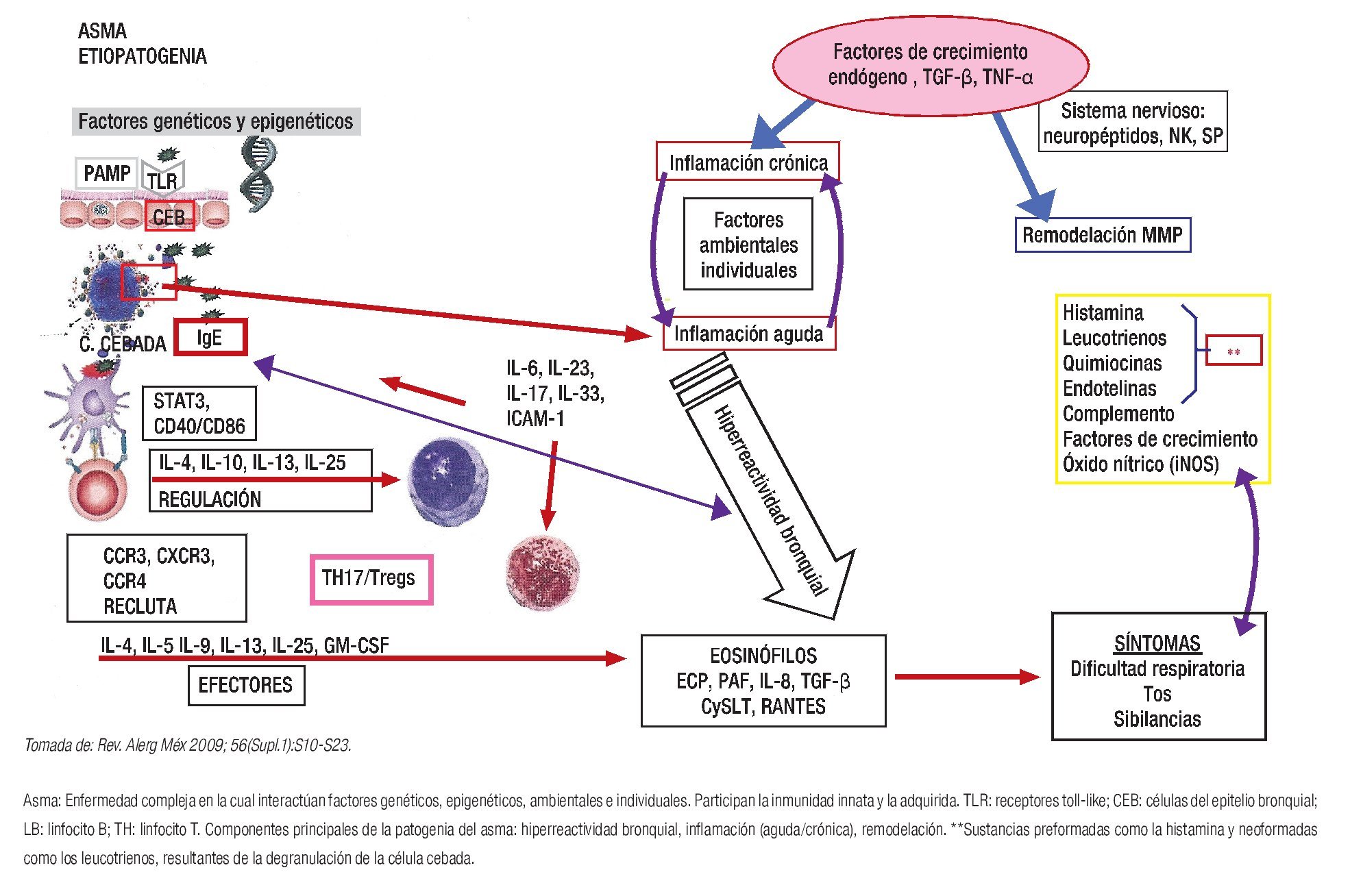
El asma, como enfermedad multifactorial, resulta de la interacción de factores genéticos y ambientales, particulares en cada paciente, los cuales determinan la expresión clínica de la enfermedad9 (Figura 1).
◊ Figura 1. Principales elementos que intervienen en la etiopatogenia del asma.
En la patogenia del asma, con dominio del perfil de linfocitos Th2, intervienen eosinófilos, células cebadas, IL-4, IL-5, IL-13, TNF-α, IgE (en forma variable) y, con mayor actividad, células Th17 y Treg.9,10 Cuando el proceso inflamatorio es crónico hay actividad de metaloproteasas y fibroblastos, como elementos de reparación y remodelación bronquial.9
La activación de las células cebadas, a través de moléculas de IgE adheridas a sus receptores sobre la membrana celular, o por estímulos osmóticos o químicos, provoca la liberación de mediadores vasoactivos con efectos proinflamatorios y broncoconstrictores, en particular a través de la histamina y los leucotrienos.9,10 Los eosinófilos juegan un papel importante como marcador inflamatorio del asma, debido a su actividad en la pared bronquial y al daño tisular ocasionado por sus enzimas y la liberación de leucotrienos y otras citocinas. El incremento de eosinófilos tisulares y pulmonares se correlaciona a menudo con una mayor gravedad del asma.10 Los neutrófilos pueden aumentar su presencia pulmonar durante las exacerbaciones del asma y se han vinculado con el fenotipo de los pacientes que no responden a los corticoesteroides.9,10
Clasificación del asma
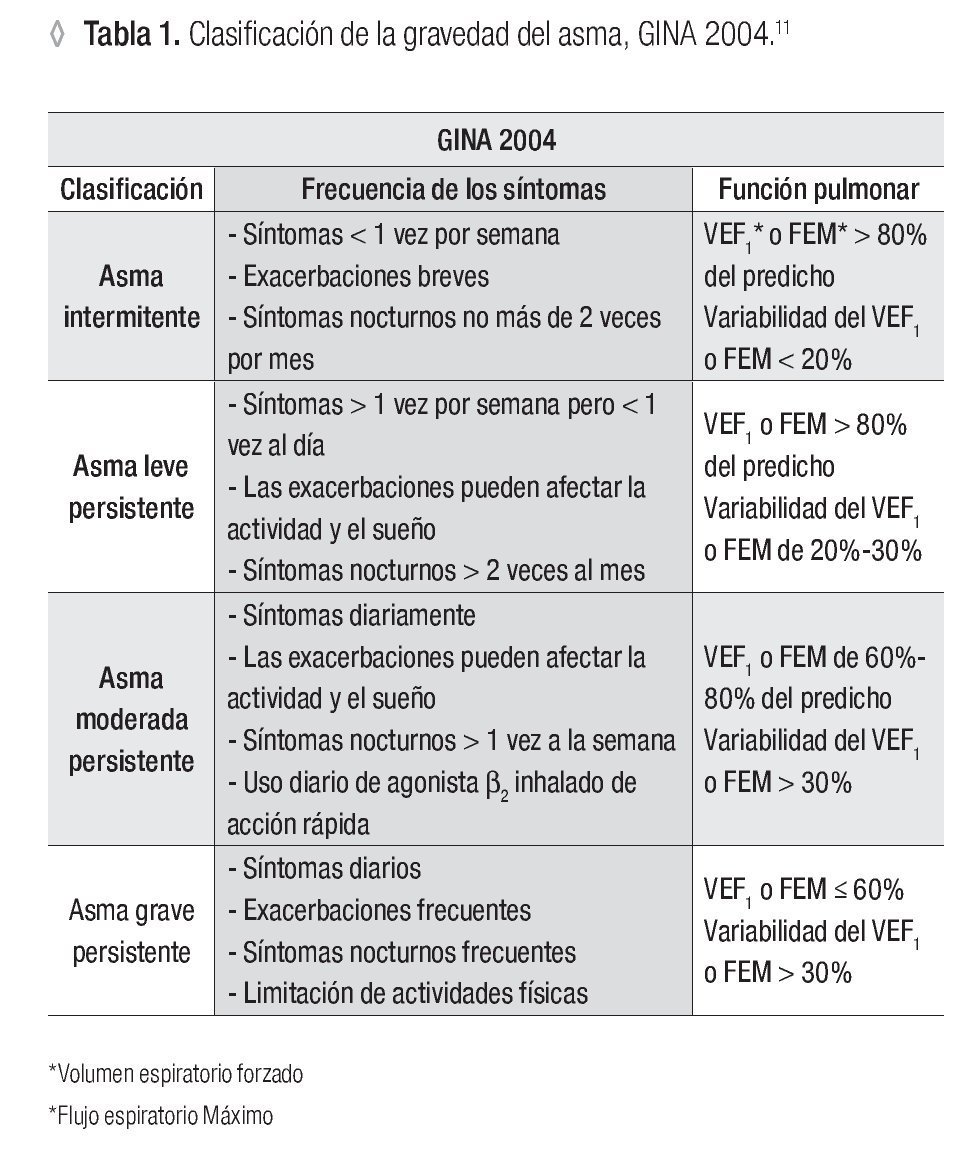
La clasificación propuesta por la Global Initiative for Asthma (GINA), basada en la gravedad, divide el trastorno en asma intermitente, asma persistente leve, moderada y grave (Tabla 1).
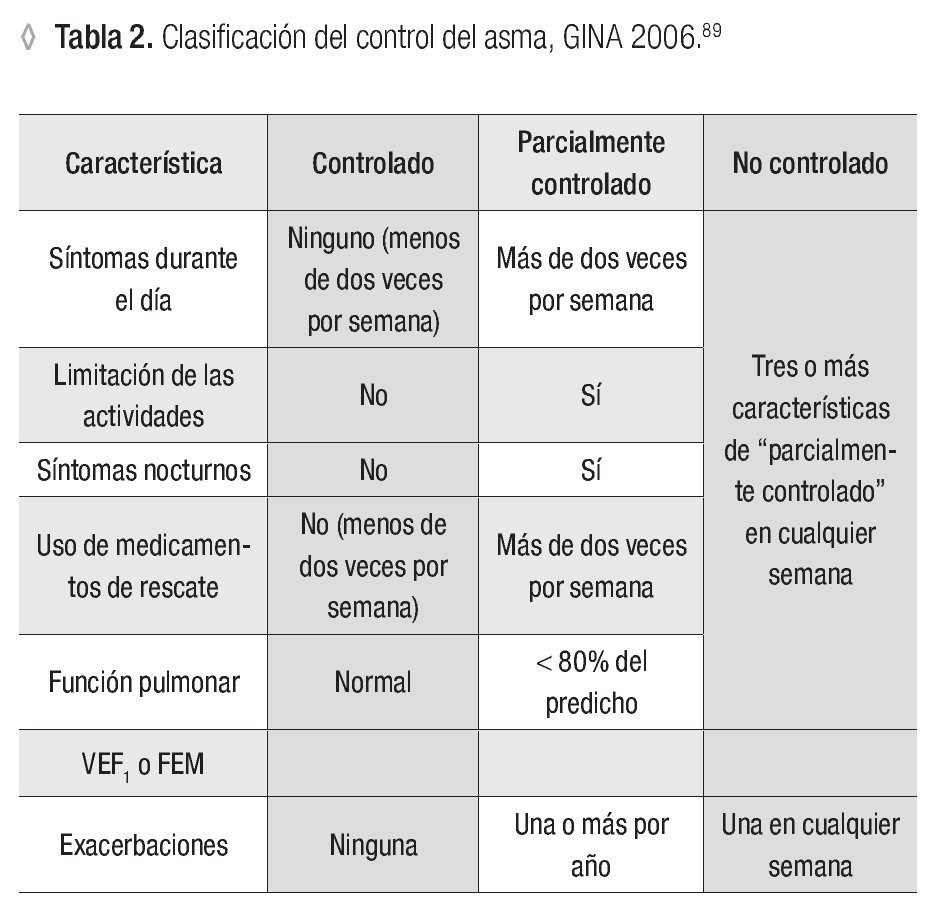
Esta clasificación del asma ha sido útil para tomar decisiones en la evaluación de un paciente y el inicio de su tratamiento; no obstante, debido a que resulta inadecuada para conocer posteriormente el grado de control de la enfermedad, desde 2006 la GINA incluyó la siguiente clasificación: asma controlada, asma parcialmente controlada y asma no controlada11 (Tabla 2).
La gravedad del asma puede variar en el curso del tiempo, por lo que es recomendable valorar la evolución de los pacientes cada tres meses o según lo considere el médico tratante.
En el asma controlada las manifestaciones clínicas son nulas o atenuadas al máximo debido a las intervenciones terapéuticas y se cumplen los objetivos del tratamiento. El control adecuado refleja en buena medida la idoneidad del tratamiento para el asma. El término "control" incluye las característicasclínicasdelaenfermedad(síntomasy exacerbaciones, limitación de actividades) y las pruebas de función pulmonar. Esta clasificación no se ha validado desde el punto de vista clínico. Algunos pacientes con asma pueden tener exacerbaciones frecuentes y periodos asintomáticos con función pulmonar normal; por el contrario, otros enfermos pueden presentar síntomas diarios y sufrir pocas exacerbaciones.
Asma persistente y asma de difícil control (AP y ADC)
En la práctica clínica hay un grupo de pacientes en quienes no es posible controlar el asma y, aun cuando reciben dosis altas de los medicamentos recomendados por las guías clínicas de asma, continúan sin mejoría de los síntomas ni de la función pulmonar, con afectación considerable de su calidad de vida. En 2006 surgió el concepto de asma de difícil control para describir a esta población de pacientes que tiene características clínicas particulares. El Consenso Latinoamericano Sobre Asma de Difícil Control lo definió como el asma insuficientemente controlada, a pesar de una estrategia terapéutica apropiada y ajustada al nivel de gravedad clínica durante al menos seis meses.3
El ADC también se ha denominado asma grave, difícil de tratar, refractaria, inestable, de riesgo mortal o vital, resistente o dependiente de los corticoesteroides, y otros más. Ante la disparidad de conceptos, la OMS clasifica el asma grave en tres tipos: 1) asma grave no tratada, 2) asma grave difícil de tratar y 3) asma grave resistente al tratamiento. Esta última se ha descrito como el asma no controlada a pesar del nivel más alto de tratamiento recomendado.12 El concepto de asma de difícil control, de uso muy extendido desde hace algunos años, parece concordante con el de asma grave resistente al tratamiento propuesto por la OMS. En esta revisión se emplea el nombre de asma de difícil control, dado que actualmente esta variante del asma es la mejor conocida y se identifica bien con ese término.
La prevalencia del ADC se aproxima al 5% de los casos de asma y es menos frecuente en los niños.13
Factores relacionados con el ADC
Entre los factores más comunes relacionados con el ADC se encuentran los siguientes: coexistencia de otras enfermedades, desapego al tratamiento, alteraciones conductuales y psicológicas, y la dificultad de acceso a los servicios médicos.
Enfermedades alérgicas
La presencia de otras enfermedades alérgicas y los antecedentes familiares atópicos son factores de riesgo para el desarrollo de asma. Se ha informado que cerca del 80% de los pacientes asmáticos es alérgico a aeroalergenos.14,15 En un estudio de 2 561 pacientes con asma grave o ADC se encontró que 93% tuvo pruebas cutáneas positivas con aeroalergenos, y su concentración de IgE sérica total fue de 104 UI/mL, en comparación con 32 UI/mL en el grupo con pruebas cutáneas negativas.16 Estos resultados sugieren que en los pacientes con asma grave o ADC es importante hacer una valoración del estado alérgico debido al sólido nexo observado.
Adherencia terapéutica
La falta de observancia del tratamiento en cerca de 50% de los pacientes con asma es una de las principales causas del ADC. El desapego terapéutico es más común en las mujeres y se relaciona con un mayor número de hospitalizaciones y deterioro de la calidad de vida.17 La intervención educativa en este tipo de pacientes incrementa su observancia terapéutica, reduce de forma significativa las dosis de los corticoesteroides inhalados, los cursos de los corticoesteroides sistémicos y las hospitalizaciones durante el primer año.18
Factores psicosociales
Algunos factores psicosociales se han vinculado con el asma no controlada, entre ellos la depresión, ansiedad y negación, lesiones autoinfligidas, inasistencia a las consultas programadas, egresos voluntarios del hospital, uso de psicotrópicos, toxicomanías, desempleo, marginalidad, abuso y maltrato en la infancia, disfunción familiar y una inadecuada relación médico-paciente.19-22 En los niños con ADC, los problemas conductuales y emocionales, como el aislamiento, la depresión y la somatización, son significativos y se relacionan con una baja calidad de vida.23 Cuanto más complejos son los problemas conductuales en los niños, mayor es la gravedad del asma debido a una mala adherencia terapéutica y mecanismos neuroinmunoendocrinos.24 Diversos estudios en pacientes con ADC han explorado las expectativas y creencias acerca de su enfermedad. En los pacientes con ADC, comparados con casos de asma controlada, se ha observado un predominio significativo del enfoque externo del locus de control, lo que se vincula con la creencia de que la enfermedad está influida por la suerte, el destino y otros factores externos, justo lo contrario al enfoque interno que se relaciona con mejor adaptación, uso de información médica y observancia terapéutica.25
Obesidad
La obesidad y el asma tienen un nexo frecuente. El asma grave se presenta más en pacientes con sobrepeso y el índice de masa corporal tiene una correlación positiva con la gravedad del asma.26,27 La obesidad ejerce efectos mecánicos en la función pulmonar e induce un estado proinflamatorio sistémico que puede afectar las vías respiratorias y vincularse con otras comorbilidades que dificultan el control del asma.28,29 Se ha observado que los pacientes adultos con ADC o asma grave que aumentan de peso presentan empeoramiento del control del asma, usan más esteroides sistémicos y disminuye su calidad de vida, en comparación con aquéllos con peso estable o pérdida de peso.30 La obesidad en adultos con ADC tiene una relación inversa con los eosinófilos en esputo y FENO y se acompaña de un mayor riesgo de presentar reflujo gastroesofágico y deterioro de la función pulmonar, lo cual supone la existencia de otros factores, además de la inflamación pulmonar, que actúan en este tipo de pacientes.31
Reflujo gastroesofágico
El reflujo gastroesofágico se ha referido como causa frecuente de los síntomas de asma. En un grupo de pacientes con ADC, más de la mitad presentó reflujo gastroesofágico y el tratamiento con inhibidores de la bomba de protones durante ocho semanas redujo los síntomas en 75% de los casos.32,33
Otros factores
El tabaquismo es un factor de riesgo independiente para el asma grave en adultos.34 En los pacientes asmáticos de minorías étnicas, quienes viven en marginalidad social, y en los adolescentes y adultos jóvenes, es menos probable que tengan un tratamiento formal del asma, recurren más a la atención médica como un recurso de urgencia y consumen de modo más frecuente los fármacos de rescate.35-37 La prevalencia de asma es 38% más frecuente en la raza negra que en la caucásica en Estados Unidos; las visitas a urgencias, las hospitalizaciones y la mortalidad tienen una frecuencia de 380%, 225% y 200% más alta en asmáticos afroamericanos que en los blancos.38 En estudios de cohorte realizados durante un año en asmáticos de raza negra y blanca, en los que se ponderaron las variables socioeconómicas, los pacientes de raza negra presentaron más casos de asma grave, tuvieron menor calidad de vida y más riesgo de atención del asma en los servicios de urgencias.39
Factores económicos y productividad
Los costos directos e indirectos de la atención del asma tienen un alto efecto socioeconómico. El costo anual calculado de la atención del asma en Estados Unidos por paciente es de 3 259 dólares y la mortalidad anual relacionada con ésta cuesta 2 300 millones de dólares. A causa del asma cada año se pierden 14.4 millones de días laborales y 3.6 millones de días escolares.40 Los casos de ADC utilizan 80% del costo de la atención de estos enfermos y la atención de pacientes con asma no controlada cuesta el doble que la del asma controlada.41,42
En una muestra de 2 529 pacientes asmáticos se observó que en quienes cursaban con asma grave o difícil de tratar, el deterioro de la productividad y el ausentismo laboral y escolar fue casi el doble que en los casos de asma leve, y que una disminución de la productividad de 10% puede predecir la asistencia a servicios de urgencias y hospitalización por asma en los siguientes 12 meses.43
Fenotipos de ADC
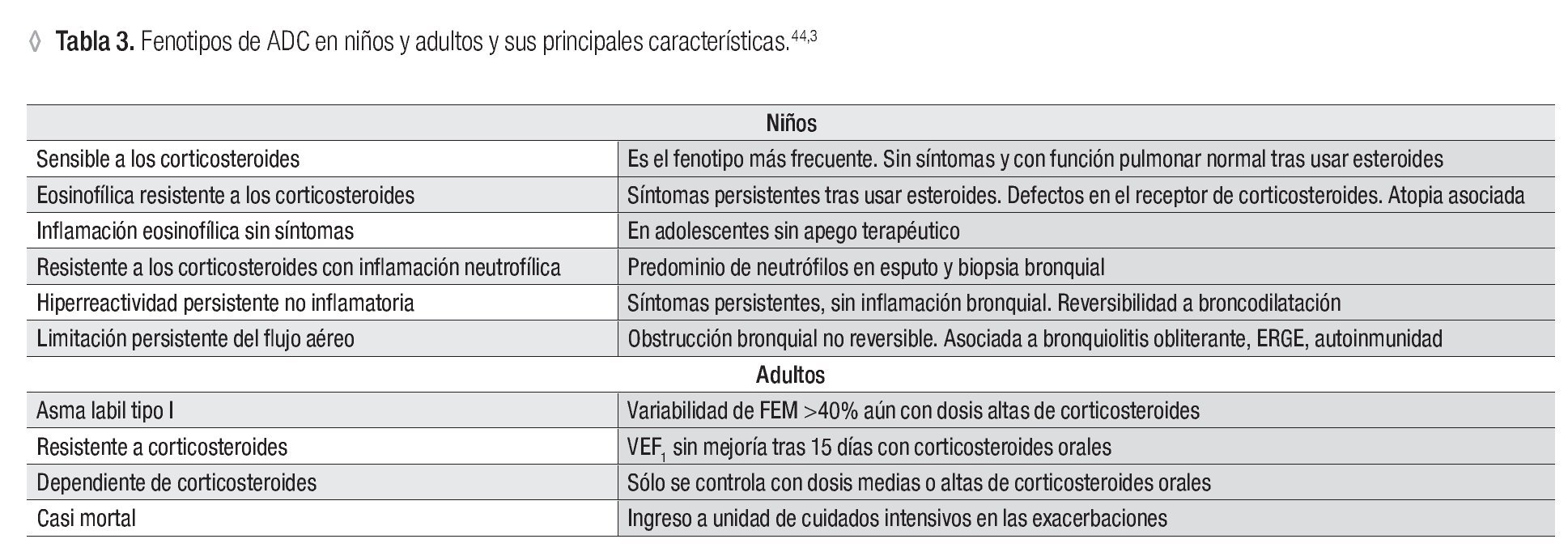
Se han identificado varios fenotipos de ADC en niños y adultos, lo cual hace más complejo el estudio y atención de este subgrupo de pacientes (Tabla 3).
En niños se han descrito seis fenotipos de ADC: sensible a los corticoesteroides, eosinofílico resistente a los corticoesteroides, con inflamación eosinofílica sin síntomas, resistente a los corticoesteroides con inflamación neutrofílica, con hiperreactividad persistente no inflamatoria y con limitación persistente del flujo aéreo.44
En los pacientes adultos con ADC se conocen los siguientes fenotipos:
Asma lábil tipo I: asma con una variabilidad diaria del flujo espiratorio máximo superior al 40% durante más del 50% del tiempo por al menos 150 días, pese a la administración de corticoesteroides inhalados a dosis máximas (1 500 μg de beclometasona o equivalente). Algunas crisis pueden desarrollarse en menos de 3 h.11
Asma resistente (insensible) a los corticoesteroides: es aquella en la cual el volumen espiratorio forzado en el primer segundo (VEF1) no mejora más del 15% después de 15 días de tratamiento con 40 mg/día de prednisona y otros 15 días con el doble de la dosis; esta prueba de respuesta a los corticoesteroides, conocida como prueba de Brompton, debe realizarse en los pacientes que no logran un control adecuado con dosis máximas de corticoesteroides inhalados.3
Asma dependiente de los corticoesteroides: es aquella que sólo se logra controlar con dosis medias y altas de corticoesteroides sistémicos, con los efectos adversos vinculados.
Asma casi mortal: es un episodio agudo de asma que obliga a ingresar al paciente a una unidad de cuidados intensivos.3
El Grupo de Consenso Latinoamericano para el Asma de Difícil Control propone la siguiente definición: asma insuficientemente controlada a pesar de una estrategia terapéutica apropiada, ajustada al nivel de gravedad clínica (mayor al nivel 4 de la GINA), indicada por un especialista y de cuando menos seis meses de duración3 (Tabla 4).
Diagnóstico del ADC
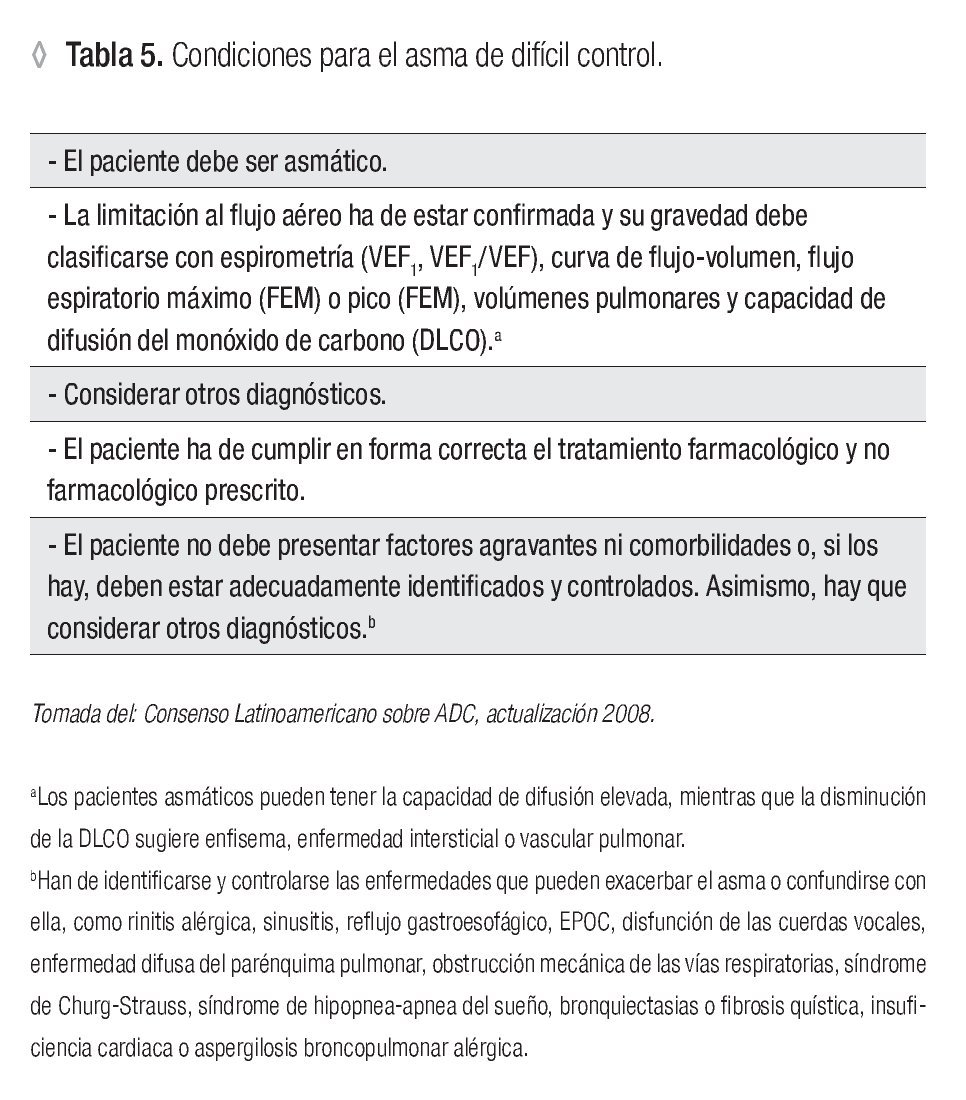
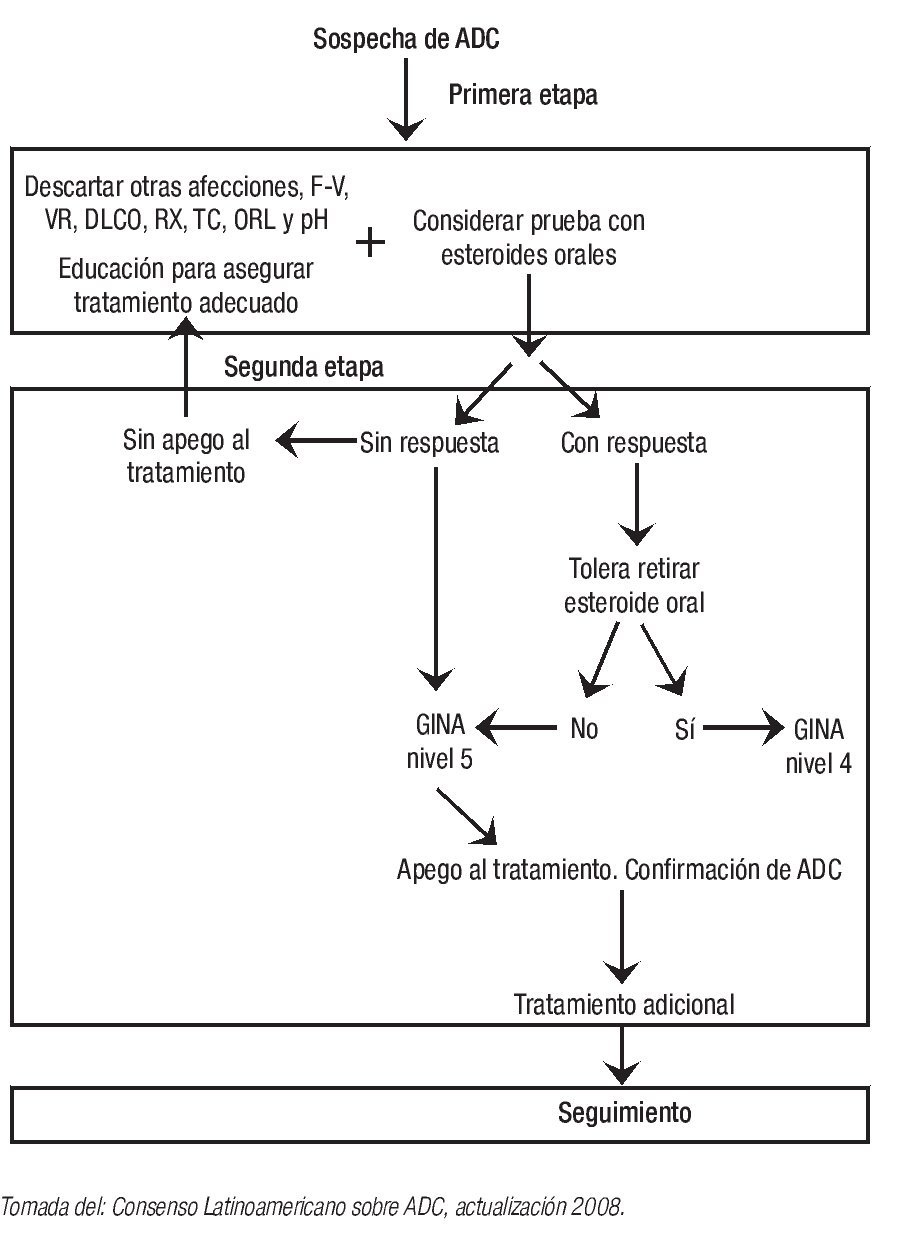
El diagnóstico correcto del ADC se establece ante la falla de respuesta al tratamiento apropiado y ajustado a la gravedad clínica. Sin embargo, diversos factores y enfermedades pueden simular e influir en el desarrollo y manifestaciones del ADC. Ante un diagnóstico presuntivo de ADC se recomienda aplicar un protocolo de estudio para establecer un diagnóstico de certeza, basado en los puntos de la Tabla 5 y la Figura 2.3
◊ Figura 2. Algoritmo diagnóstico para el ADC.
El protocolo de estudio de probable asma persistente y asma de difícil control incluye los siguientes puntos:
1. Confirmar el diagnóstico de asma
2. Considerar el diagnóstico diferencial
3. Identificar comorbilidades y factores exacerbantes
1. Confirmar el diagnóstico de asma: se debe evaluar la limitación al flujo aéreo mediante espirometría (VEF1, VEF1/CVF), curva de flujo-volumen, flujo espiratorio máximo (FEM) y pruebas de provocación bronquial, cuando sea necesario. En los niños menores de cinco años de edad, quienes no son capaces de realizar la espirometría, puede ser útil medir la resistencia de la vía aérea. Los volúmenes pulmonares y la capacidad de difusión del monóxido de carbono ayudan a identificar otras posibilidades diagnósticas. Los pacientes asmáticos pueden tener la capacidad de difusión del monóxido de carbono elevada, mientras que su disminución sugiere enfisema pulmonar, enfermedad intersticial o enfermedad vascular pulmonar. Es importante y necesario auxiliarse con una tomografía computarizada de tórax (TC) y, en caso de sospecha de disfunción de cuerdas vocales, debe practicarse una laringoscopia.3
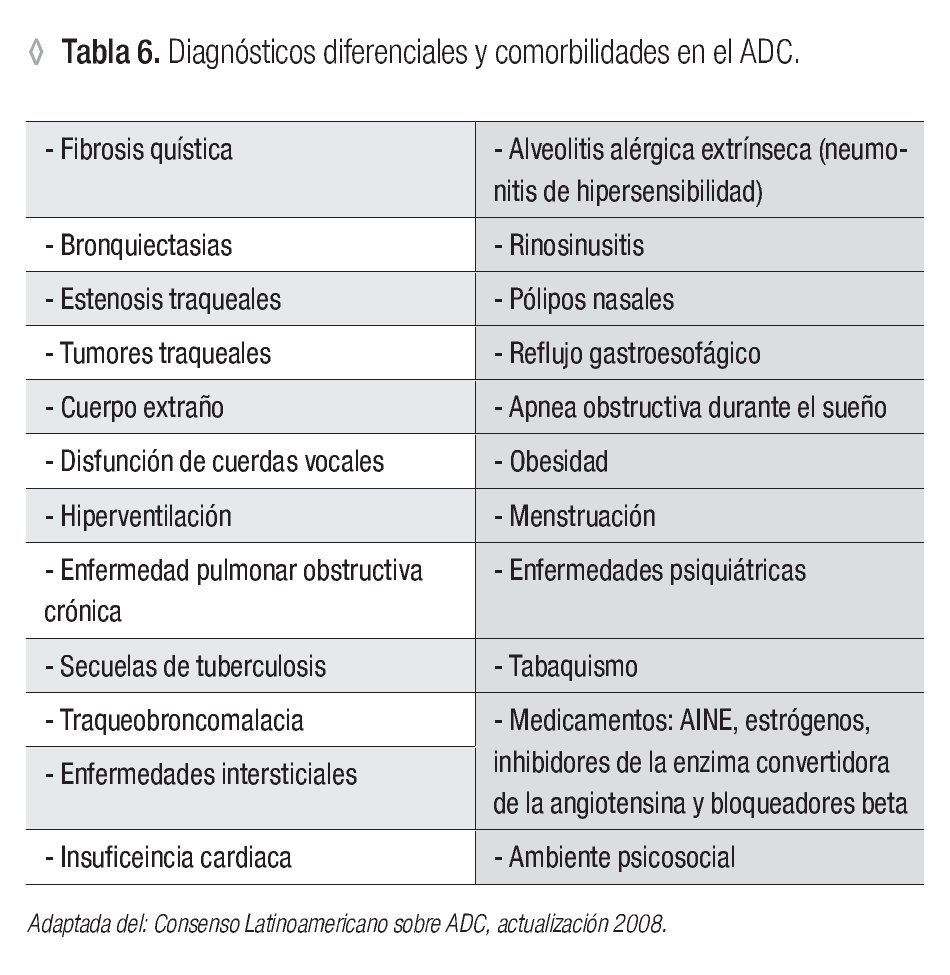
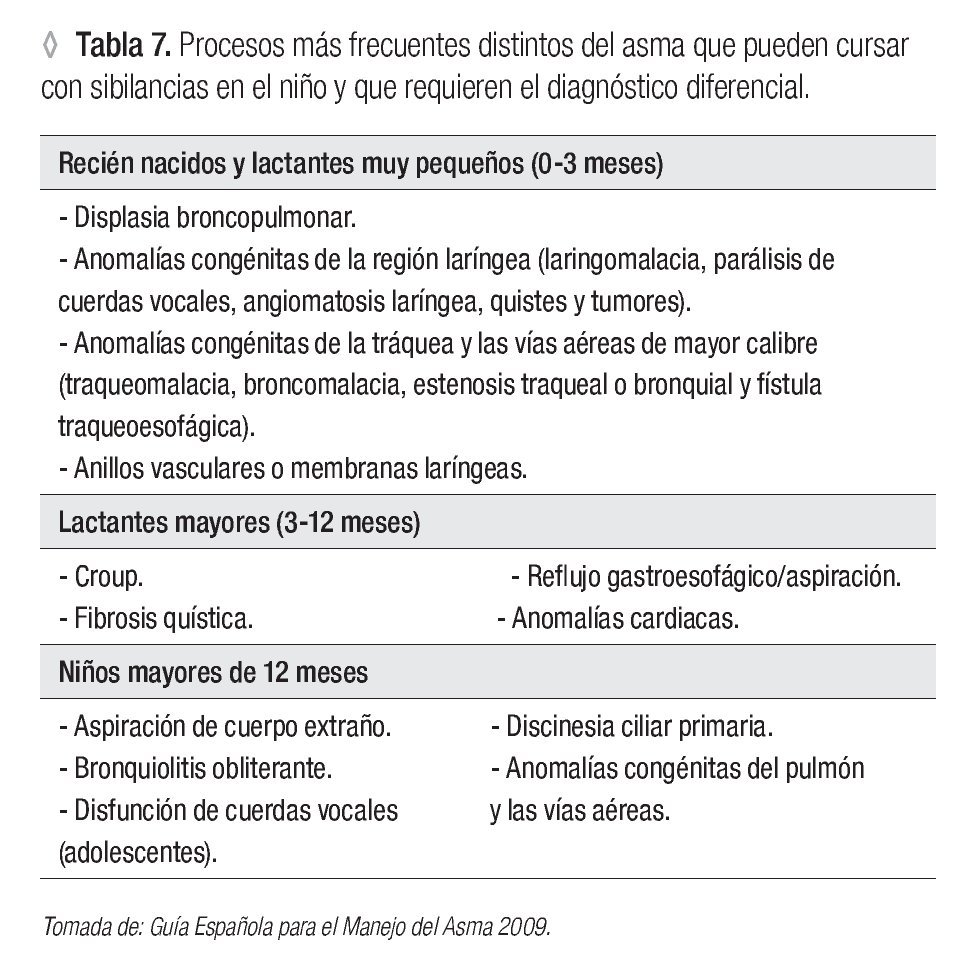
2. Considerar el diagnóstico diferencial: deben investigarse enfermedades respiratorias con síntomas similares a los de los individuos asmáticos, dado que pueden producir errores diagnósticos o terapéuticos. Las enfermedades con afectación respiratoria más a menudo referidas son la alveolitis alérgica extrínseca y la neumonía eosinofílica crónica. Algunas enfermedades no respiratorias como la insuficiencia cardiaca izquierda y otras que deben incluirse en el diagnóstico diferencial pueden ocasionar confusión diagnóstica y se resumen en las Tablas 6 y 7.11
3. Identificar comorbilidades y factores exacerbantes: algunas veces los pacientes presentan enfermedades adjuntas que comparten síntomas con el asma, y que pueden pasar inadvertidas, lo cual retrasa el diagnóstico y un tratamiento adecuados. Entre 75% y 80% de los pacientes asmáticos presenta rinitis estacional o perenne y 7% a 15% cursa con poliposis nasal. Otras afecciones concomitantes frecuentes son la sinusitis hiperplásica eosinofílica y la enfermedad por reflujo gastroesofágico (ERGE). Los sujetos con asma acompañado de ERGE presentan un difícil control del asma y se asume que el tratamiento mejora en grado notable los síntomas asmáticos, aunque no la función pulmonar.3
Diagnóstico de ADC en niños
El abordaje diagnóstico de ADC en niños es similar al de los adultos, pero con algunas características particulares de este grupo etario. De manera inicial debe verificarse el diagnóstico de asma y al mismo tiempo explorar enfermedades vinculadas, factores de tipo ambiental, psicosocial y desapego al tratamiento que podrían exacerbar los episodios de asma.
El diagnóstico de ADC en un niño se establece cuando el asma está fuera de control, aun con el tratamiento correcto recomendado para el nivel 4 de GINA, con dosis de 800 μg de budesonida/día (1 000 μg de beclometasona o 500 μg de fluticasona) junto con LABA, y cuando se administran broncodilatadores de acción corta más de 3 veces/ semana, con ausentismo escolar de más de cinco días/trimestre o sibilancias más de una vez por mes tras descartar otras causas. Los niños con ADC requieren más consultas, reciben tratamientos complejos y se hospitalizan con mayor frecuencia.44 Algunos países europeos han adoptado el protocolo del Royal Brompton Hospital para el diagnóstico de AP y ADC en niños mayores de cinco años, con base en la respuesta a los corticoesteroides sistémicos durante cuatro semanas, y en el estudio de FENO, eosinófilos en esputo inducido, biopsia bronquial y el lavado bronquioalveolar, antes y después del tratamiento con corticoesteroides. De ser necesario deben solicitarse estudios complementarios.45
Estudios de cohorte han mostrado que los escolares con asma persistente y asma de difícil control presentan dos a tres veces más visitas a servicios de urgencias y hospitalizaciones que los adolescentes y adultos, en particular cuando tienen VEF1 menor de 80%. En 10% de los escolares y 15% de los adolescentes con asma grave o de difícil control existe el antecedente de intubación y 53% y 44%, respectivamente, han usado al menos una vez corticoesteroides orales los tres meses previos.46,47
Otros auxiliares diagnósticos
La cuantificación de FENO es un procedimiento no invasivo que permite conocer indirectamente la inflamación de las vías aéreas. Los valores elevados de óxido nítrico se relacionan con un proceso inflamatorio derivado de la actividad eosinofílica en los bronquios.48 Los pacientes con asma grave y FENO > 35 ppb presentan obstrucción bronquial grave, sobredistensión pulmonar, mayor frecuencia en el uso de corticoesteroides orales y también mayor número de visitas a servicios de urgencias.49 La medición del FENO por médicos especialistas es de utilidad ya que confirma el diagnóstico de asma, permite diferenciar el asma de otras enfermedades, predice la respuesta al tratamiento con corticoesteroides inhalados, identifica las recaídas y la pérdida del control, detecta el desapego al tratamiento y ayuda a conocer el efecto de las medidas de control ambiental de alergenos. Este procedimiento ha mostrado ventajas sobre la prueba de hiperreactividad bronquial y la inducción de eosinófilos en esputo. El uso adecuado de FENO en pacientes con AP y ADC coadyuvará a controlar la enfermedad y se estima que podrá abatir en al menos 5% los costos de atención.48
La TC de alta resolución de tres niveles de tórax en niños con asma grave diferencia el engrosamiento de la pared bronquial respecto de los controles con voluntarios sanos, no se correlaciona con pruebas de función pulmonar, aunque puede ser útil para determinar la gravedad del asma e identificar a pacientes en riesgo de remodelación bronquial.50
Tratamiento del ADC
Una vez descartados o atendidos otros factores adjuntos, el tratamiento del ADC se debe enfocar en reducir la inflamación y los síntomas de los pacientes, de acuerdo con su fenotipo. Por esta razón, los medicamentos con efecto antiinflamatorio y broncodilatador son la base del manejo farmacológico.
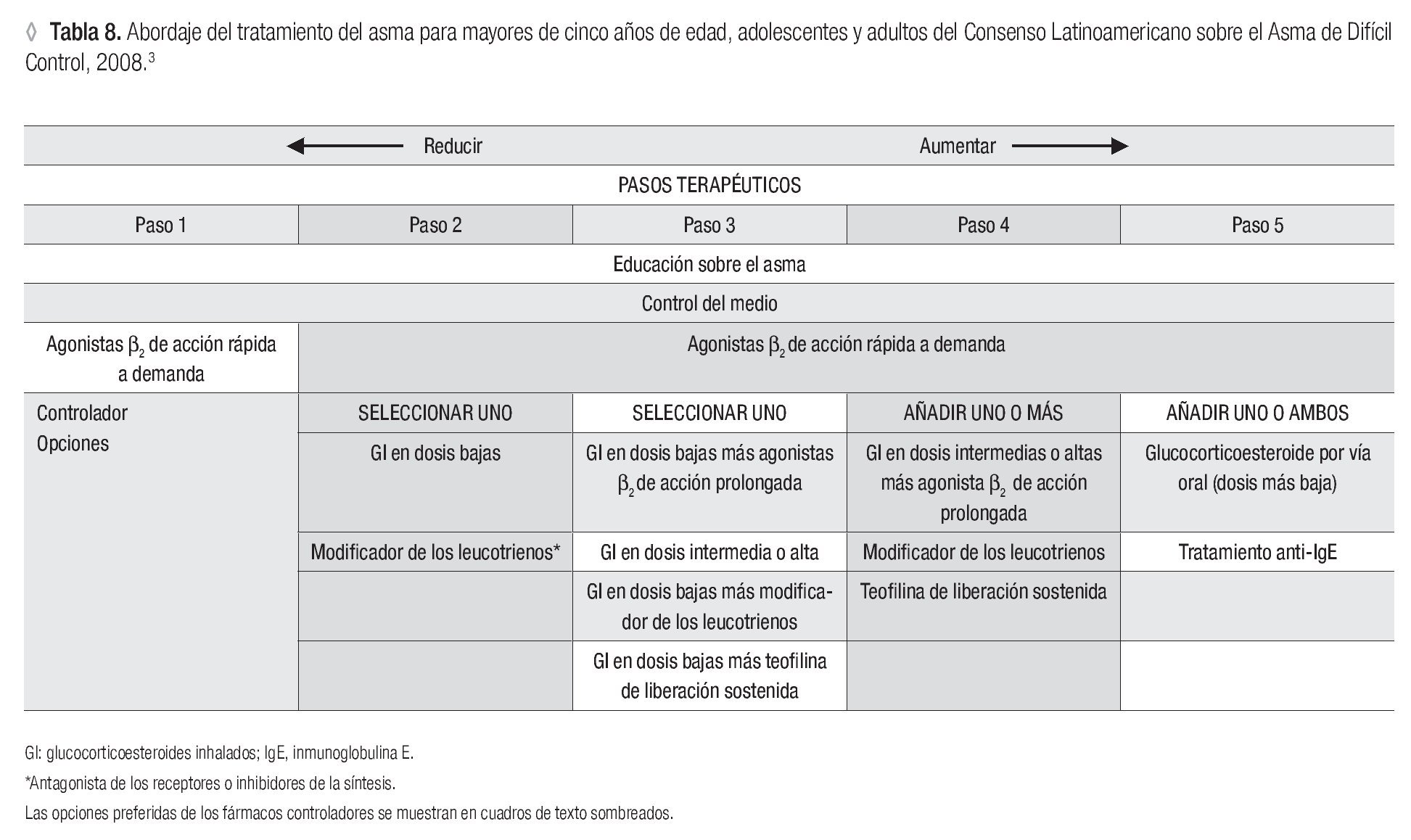
En cuanto al tratamiento en niños, es importante que los médicos de todos los niveles de atención conozcan las diferentes guías clínicas de asma enfocadas en niños y adolescentes; de ese modo es posible establecer un diagnóstico objetivo y derivar oportunamente a este grupo de pacientes con el especialista de mayor experiencia, que tenga la mejor posibilidad de ofrecer las mejores opciones al enfermo (Tabla 8).
De acuerdo con las guías GINA, el nivel 5 de tratamiento es el recomendado para este grupo de pacientes y debe iniciarse con dosis bajas de corticoesteroides orales (p. ej., prednisolona a dosis de 1 mg/kg/día en niños y 40 mg/día en adultos, durante dos a cuatro semanas), con el fin de conseguir el control de la enfermedad o la mejor respuesta posible.
Se recomienda un tratamiento inicial intensivo con corticoesteroides inhalados en dosis altas (dipropionato de beclometasona > 1 000 μg/día o su equivalente de corticoesteroides inhalados) y agonistas adrenérgicos β2 de acción prolongada dos veces al día.3
Algunos pacientes pueden mostrar resistencia a los corticoesteroides debido a alteraciones farmacocinéticas (absorción inadecuada, defectos enzimáticos, aclaramiento rápido e interacciones medicamentosas); anatómicas (remodelación bronquial); moleculares/genéticas (mutaciones del receptor de corticoesteroides, conformacionales, de número, isoformas, translocación o factores de transcripción); inflamatorias (aumento de IL-2, IL-4, IL-13, TNF-α, metaloproteasas, tabaquismo). Estas alteraciones y el perfil neutrofílico en esputo inducido pueden explicar un porcentaje considerable de casos de resistencia al tratamiento.3
Debido a los efectos adversos del uso prolongado de los corticoesteroides, desde hace años se han propuesto varias opciones terapéuticas para reducir o evitar el uso de los corticoesteroides sistémicos.3
Fármacos ahorradores de corticoesteroides
Los agentes modificadores de la respuesta biológica son emergentes en el tratamiento de enfermedades mediadas por mecanismos inmunológicos, como la artritis reumatoide, la espondilitis anquilosante y la enfermedad de Crohn, entre otras. En relación con el asma hay medicamentos en desarrollo y se dispone de otros fármacos con efecto antiinflamatorio y broncodilatador, con propiedades y mecanismos diferentes que pueden ser de ayuda en el tratamiento de esta enfermedad.51
Inhibidores del factor de necrosis tumoral α (TNF-α). Los tres inhibidores del TNF-α disponibles comercialmente son etanercept, infliximab y adalimumab. El golimumab y el certolizumab se encuentran en fases experimentales.
Etanercept: esta molécula contiene una fracciónFcdeIgG1humanayelreceptordetipoIIde TNF-α. Un estudio clínico abierto con 25 mg de etanercept dos veces por semana, durante 12 semanas en 15 pacientes con asma grave, elevó el umbral de obstrucción bronquial en el reto con metacolina y mejoró el VEF1 y la calidad de vida de los pacientes.52 En un estudio de 12 semanas con etanercept en 39 sujetos con asma grave sin respuesta a los corticoesteroides se mostró una mejoría significativa del control del asma y del reto con metacolina, pero sin cambios en la función pulmonar. Los autores consideran que la evidencia es insuficiente y recomiendan hacer estudios controlados en muestras más grandes de pacientes. El etanercept podría tener utilidad sólo en un grupo pequeño de pacientes con asma grave en quienes se documente la participación central del TNF-α.53
Infliximab: es un anticuerpo monoclonal quimérico, 75% humano y 25% murino. En 38 pacientes con asma leve a moderada tratados con una aplicación cada dos semanas, tres veces, de 5 mg/ kg de infliximab por vía intravenosa, se observó un incremento de los eosinófilos periféricos y en esputo y hubo una reducción de las exacerbaciones de asma, pero sin cambios en FEM al concluir ocho semanas del estudio.54
Adalimumab: se han publicado algunos casos de asma secundarios al uso del adalimumab en pacientes sin antecedentes atópicos personales ni familiares, quienes desarrollaron eosinofilia y aumento de IgE sérica. Los individuos dejaron de tener síntomas de asma y los eosinófilos y la IgE volvieron a sus valores basales al suspender el adalimumab.55,56
Golimumab: en un estudio clínico de fase III, la aplicación de tres diferentes dosis de golimumab a 309 pacientes con asma persistente grave no tuvo efectos significativos en la reducción de las exacerbaciones de asma y el incremento del VEF1. Se presentaron reacciones adversas graves en 30% de los pacientes y el estudio se suspendió de forma anticipada.57
La seguridad es un aspecto importante en relación con el uso de los inhibidores de TNF-α. La FDA ha comunicado que los agentes anti-TNF-α tienen un riesgo elevado de linfoma en niños y adolescentes.58 Otros riesgos vinculados con los inhibidores de TNF-α son infecciones graves, enfermedades desmielinizantes, susceptibilidad mayor y reactivación de tuberculosis, hepatitis B e infecciones oportunistas.59-61 Los inhibidores de TNF-α están contraindicados en pacientes con insuficiencia cardiaca congestiva.62
Ciclosporina A: en un estudio clínico abierto en cinco niños de ocho a 15 años de edad, con asma grave no controlada con prednisolona diaria, se utilizó ciclosporina (5 mg/kg/día) durante 18 meses. Tres pacientes lograron suspender la ciclosporina, uno de ellos con recurrencia del asma a los seis meses. Otro individuo suspendió la ciclosporina por presentar hirsutismo grave y se registró un abandono por falta de respuesta.63 El uso de ciclosporina durante 36 semanas en adultos con asma grave mostró reducción de los esteroides orales y mejoría de la función pulmonar, pero con hirsutismo y parestesias como episodios adversos transitorios.64 No es recomendable utilizar la ciclosporina como manejo sistemático en pacientes asmáticos dependientes de corticoesteroides orales debido a sus efectos adversos, de acuerdo con tres estudios clínicos controlados en un análisis sistemático del grupo Cochrane.65
Metotrexato: una revisión sistemática ha encontrado que el metotrexato tiene un efecto pequeño en la reducción de los corticoesteroides en pacientes adultos asmáticos dependientes de esteroides, y añade el riesgo de sus efectos adversos.66 No hay estudios clínicos de metotrexato en niños con asma. Hace algunos años se publicaron dos estudios abiertos con una muestra pequeña de niños asmáticos en quienes se redujo la dosis de esteroides sistémicos con el uso de metotrexato, sin causar reacciones adversas significativas.67
Mofetilo de micofenolato: hay informes anecdóticos del uso de este fármaco en adultos dependientes de esteroides, con buena respuesta clínica, mejoría de la función pulmonar y reducción de los corticoesteroides sistémicos.68
Anticuerpos anti-IL-4: el altrakincept es una fracción del receptor soluble de IL-4 que inhibe la unión de IL-4 a su receptor. Se ha utilizado en dosis semanales mediante nebulización en un escaso número de pacientes con asma persistente leve y moderada, en quienes se observó control de los síntomas y disminución de FENO al suspender los corticoesteroides inhalados.69,70 Sin embargo, estudios de fase III no han confirmado la eficacia mostrada de manera inicial.71 Una proteína mutante de IL-4, pitakinra, con efecto inhibidor de IL-4 e IL-13, ha mostrado reducción de la fase alérgica tardía y de FENO y mejoría de la función pulmonar, pero sin cambios en la hiperreactividad bronquial, cuando se ha utilizado por vía nebulizada y subcutánea en pacientes con asma.72
Anticuerpos anti-IL-5: el anticuerpo monoclonal anti-IL-5, mepolizumab, utilizado en un estudio clínico controlado en pacientes con asma persistente leve a moderada durante 12 semanas, mostró una disminución significativa de los eosinófilos periféricos y en esputo, pero sin diferencias en la hiperreactividad bronquial y otros desenlaces de asma, comparado con el grupo control.73 Otros estudios con mepolizumab han notificado la disminución de proteínas de la membrana basal bronquial, lo cual podría favorecer la regulación del remodelamiento bronquial.74 Otro anticuerpo monoclonal anti-IL-5, el rezlizumab, se ha empleado en pacientes con asma y ha mostrado un decremento de los eosinófilos sanguíneos, pero sin modificar los síntomas del asma.75
Anticuerpos anti-IL-13: actualmente hay estudios en fase I y II del anticuerpo monoclonal anti-IL-13 en pacientes con asma leve, los cuales señalan buena tolerabilidad a diferentes dosis, pero aún sin resultados del efecto sobre la evolución clínica del asma.76
Anticuerpos anti-CD23: el lumiliximab es un anticuerpo específico del receptor de baja afinidad de IgE, CD23, que en estudios de fase I ha mostrado una disminución de 40% de la IgE sérica, pero todavía no se ha documentado su eficacia en el tratamiento del asma.77
Daclizumab: es un anticuerpo monoclonal anti-CD25 que, cuando se aplicó en pacientes con asma moderada y grave durante 150 días, mostró una reducción del número de exacerbaciones y uso de broncodilatadores de rescate e incrementó el VEF1. Debido a las reacciones adversas graves por su potente efecto inmunosupresor no se han efectuado otros estudios en asma.78
Roflumilast: es un inhibidor de la fosfodiesterasa 4 que se administra por vía oral. Cuando se ha comparado el roflumilast en dosis de 500 μg/ día con la beclometasona en dosis de 400 μg/día, en 499 pacientes con asma persistente durante 12 semanas, se ha encontrado una respuesta similar en la mejoría de los síntomas y menor uso de broncodilatadores de corta acción y pruebas de función pulmonar.79
Gammaglobulina intravenosa: son escasos los estudios del uso de la gammaglobulina intravenosa en pacientes asmáticos. En un estudio abierto se trató a niños y adolescentes con asma moderada con cinco aplicaciones mensuales de IgG IV. En menos de la mitad de los casos se logró reducir la dosis de esteroides inhalados. La mejoría clínica se prolongó cuatro meses después de suspender el tratamiento, pero el tamaño de la muestra fue pequeño. Los beneficios observados con el uso de IgG IV son modestos y variables en relación con el alto costo del tratamiento.80
Otros tratamientos de blancos biomoleculares se hallan bajo investigación, enfocados en citocinas, neuropéptidos y quimiocinas, incluidos los receptors Toll-like.
Macrólidos
Claritromicina: el uso de la claritromicina durante ocho semanas en 45 adultos con asma refractaria ha mostrado mejoría de la calidad de vida y reducción de IL-8 y neutrófilos en las vías aéreas de pacientes con el fenotipo de asma no eosinofílica, en comparación con el placebo.81
Troleandomicina: un estudio clínico de troleandomicina contra placebo en asma grave dependiente de corticoesteroides mejoró en dos tercios de los pacientes las pruebas de función pulmonar y redujo el uso de los broncodilatadores, pero los efectos adversos fueron intolerables y obligaron al abandono del tratamiento.82
Termoplastia bronquial: el engrosamiento del músculo liso bronquial es uno de los efectos a largo plazo observados en el asma persistente grave. La aplicación de energía térmica controlada mediante broncoscopia en varias sesiones tiene un efecto prolongado en la reducción de la masa muscular, disminuye los síntomas y las exacerbaciones de asma, y mejora la función pulmonar y la calidad de vida.83
Anticuerpos anti-IgE: el omalizumab es el primer anticuerpo monoclonal anti-IgE diseñado para el tratamiento del asma; contiene 95% de secuencias humanas y 5% murinas. Su mecanismo de acción ocurre a través de la unión de dos moléculas de omalizumab a la porción Fc de una molécula libre de IgE, lo que impide su unión a los receptores de IgE en la membrana de diversas células y el desarrollo de la respuesta inflamatoria alérgica. Dos horas después de administrar omalizumab se reduce 99% la concentración sérica de IgE. Se observa una reducción de la IgE sérica en los pacientes tanto si responden como si no al tratamiento con el omalizumab84 (Figura 3).
◊ Figura 3.Mecanismos de acción del omalizumab.
Se ha publicado que los complejos inmunitarios (omalizumab-IgE) formados por el tratamiento con omalizumab tienen la capacidad de capturar alergenos y favorecer su efecto farmacológico.85
Debido al papel central de la IgE en la inflamación alérgica y a sus efectos de largo plazo en la inducción del remodelamiento de la vía aérea, es factible que tratamientos dirigidos contra la actividad de la IgE puedan influir en el proceso de remodelación al atenuarlo o evitar los cambios durante los siguientes años.86 La remodelación bronquial es un proceso resultante del ciclo de inflamaciónreparación que ocurre en el asma persistente. Se caracteriza por el engrosamiento de la lámina reticular y cambios estructurales en el epitelio (desprendimiento del epitelio, fibrosis subepitelial e infiltración de células inflamatorias), la submucosa (hiperplasia de células caliciformes, proliferación de miofibroblastos), el músculo liso (hiperplasia e hipertrofia) y los vasos sanguíneos (neovascularización) de la pared bronquial.86
Se ha sugerido que la IgE puede promover la supervivencia de las células cebadas a través de la síntesis autocrina de IL-6, por lo que la terapia anti-IgE puede inhibir esta función de manera indirecta. El tratamiento de pacientes con asma persistente leve y moderada con omalizumab durante cuatro semanas disminuye los eosinófilos en el esputo y la submucosa bronquial, células inflamatorias y linfocitos T y B, citocinas proinflamatorias y factores de crecimiento. Lo anterior sugiere que la terapia anti-IgE contribuye a reducir la remodelación de la vía aérea en el asma.86,87
Indicaciones del omalizumab en las guías clínicas de asma
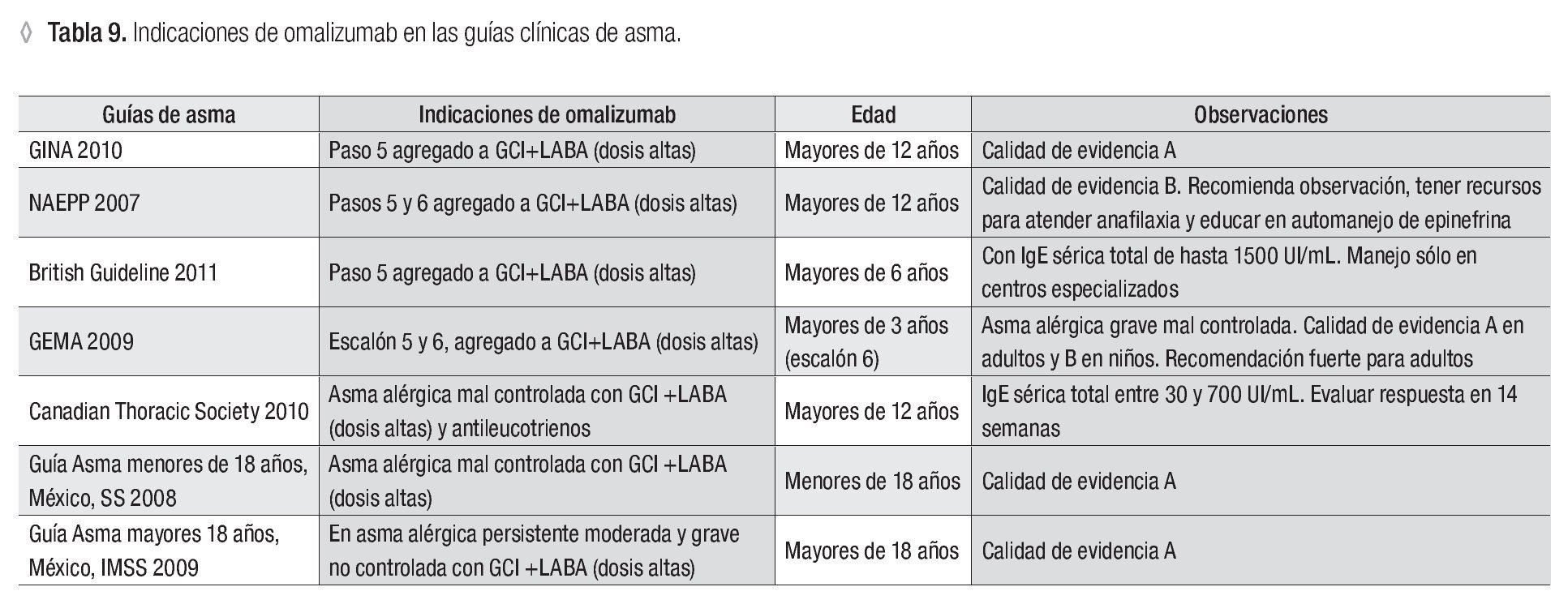
El omalizumab está indicado en el tratamiento del asma alérgica persistente moderada y grave, y ADC en niños y adultos, según las diferentes guías internacionales de asma. En todos los casos se recomienda como terapia agregada a la administración de los corticoesteroides inhalados + LABA y otros controladores (Tabla 9).
En la guía GINA, el uso del omalizumab tiene una calidad de evidencia A y se recomienda en el paso 5 a partir de los 12 años de edad.88,89 La guía del asma de Estados Unidos lo recomienda en los pasos 5 y 6, en mayores de 12 años.10 En la guía del Reino Unido está indicado en mayores de seis años y con concentraciones de IgE hasta de 1 500 UI/ mL.90 En España tiene una sólida recomendación para adultos en los grados 5 y 6 y para mayores de tres años en el grado 6.91 La guía canadiense recomienda su aplicación en mayores de 12 años y la evaluación de la respuesta a las 14 semanas de tratamiento.92 En México, las guías de asma del sector salud, para menores y mayores de 18 años, recomiendan la aplicación del omalizumab con calidad de evidencia A.93,5
La dosis del omalizumab debe individualizarse de acuerdo con la concentración de IgE sérica total y el peso del paciente y se administra por vía subcutánea cada dos o cuatro semanas.94 Las concentraciones de IgE sérica de los pacientes elegibles para tratamiento con omalizumab deben fluctuar entre 30 y 1 500 IU/mL. La aplicación del omalizumab debe continuarse por el tiempo necesario en los pacientes que respondan al tratamiento. Una vez que se ha logrado el control del asma, no es recomendable reducir la dosis personalizada del omalizumab porque puede propiciar la pérdida del control.84 Hoy en día está bajo investigación la eficacia del omalizumab en el tratamiento de la rinitis alérgica, urticaria crónica, dermatitis atópica y alergia alimentaria, así como su aplicación conjunta con inmunoterapia con alergenos.
Eficacia del omalizumab en el tratamiento del asma
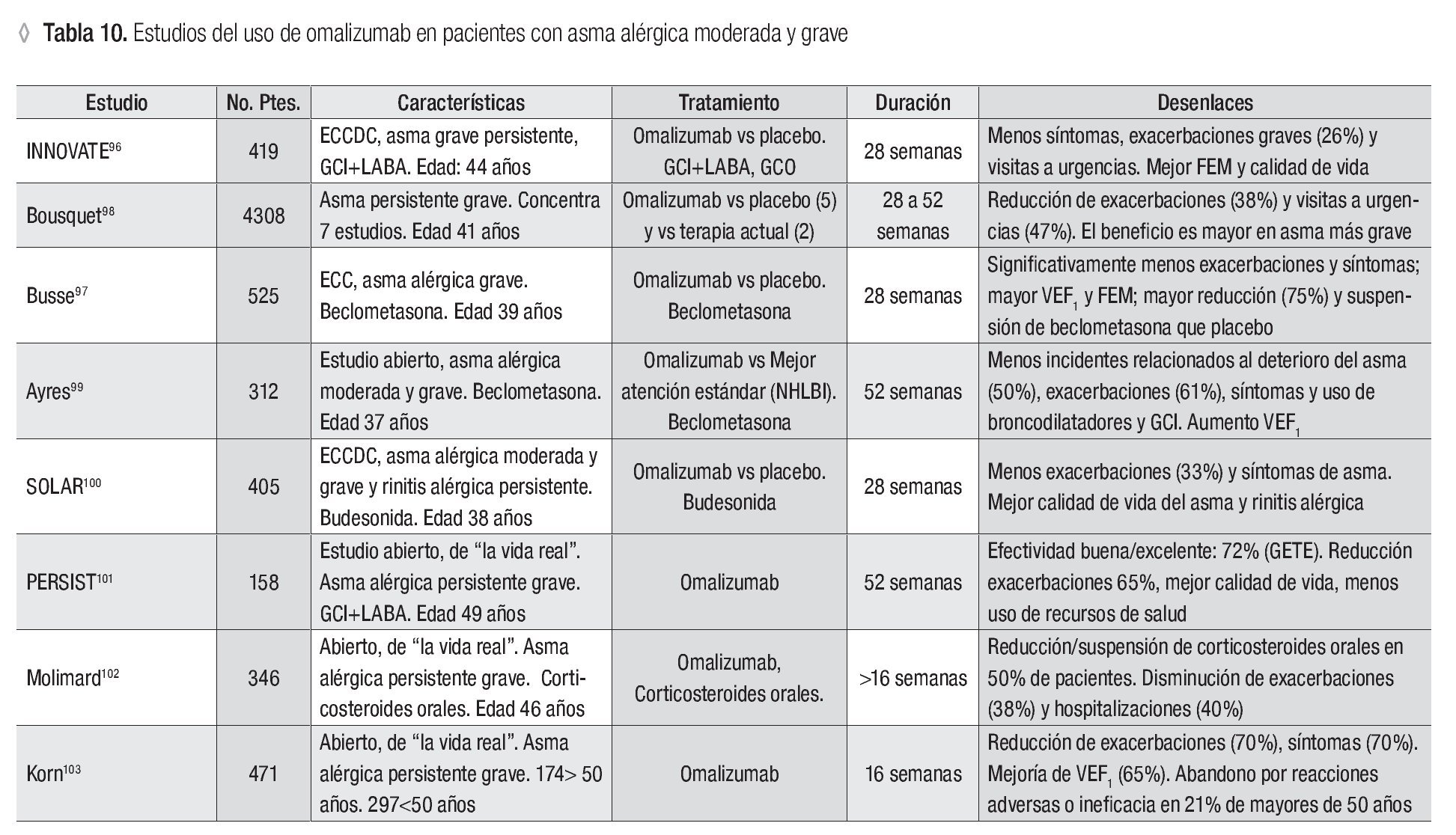
El omalizumab es el fármaco biológico para el tratamiento del asma mejor documentado en estudios de seguridad y eficacia. El omalizumab (Xolair®, Genentech/Novartis) recibió aprobación de la Food and Drug Administration (FDA) en el año 2003 y la European Comission (EC) en agosto de 2009 para el tratamiento del asma persistente moderada y grave. La aprobación para el uso pediátrico del omalizumab se basó en un estudio presentado en el congreso anual de la European Respiratory Society en 2008, que demostró la seguridad y eficacia del omalizumab en pacientes de seis a 11 años de edad tratados durante 24 semanas.95 En pacientes adolescentes y adultos con asma alérgica no controlada se ha observado la eficacia del omalizumab en estudios clínicos controlados al agregarse al tratamiento con esteroides inhalados + LABA, con reducción significativa de las exacerbaciones y síntomas de asma, visitas a los servicios de urgencias, hospitalizaciones, dosis de esteroides inhalados y uso de fármacos de rescate. También se ha observado mejoría en las pruebas de función pulmonar y la calidad de vida87 (Tabla 10).
El estudio INNOVATE (Investigation of Omalizumab in Severe Asthma Treatment) incluyó a 245 pacientes con asma persistente grave inadecuadamente controlada, tratados con omalizumab en comparación con el placebo durante 28 semanas. El 60.5% de los pacientes de este estudio calificó la eficacia del tratamiento con omalizumab como excelente y 60.8% tuvo mejoría significativa. Las reacciones adversas del grupo de omalizumab fueron similares a las del grupo placebo.96
Un estudio clínico de fase III incluyó a 525 pacientes adultos con asma grave alérgica que recibieron tratamiento con omalizumab o placebo durante 16 semanas y una fase de reducción de beclometasona inhalada por 12 semanas más. En el grupo que recibió omalizumab se presentaron menos exacerbaciones y síntomas de asma, se mejoró la función pulmonar y se consiguió descontinuar la beclometasona de manera significativa.97 El análisis de la respuesta al tratamiento con omalizumab en 4 308 sujetos con asma persistente grave de 28 a 52 semanas, 93% con asma alérgica, concentrados de siete estudios aleatorizados, notificó la reducción de las exacerbaciones y las visitas a servicios de urgencias de 38% y 47%, con mayor respuesta clínica en los pacientes con asma más grave.98
Nopp y colaboradores en 2010 informaron el estado clínico e inmunológico de 18 pacientes con asma alérgica grave tratados durante seis años con omalizumab. Los pacientes tuvieron un seguimiento clínico, inmunológico y espirométrico durante el tratamiento y 36 meses después de su conclusión. La mayoría de los pacientes presentó estabilidad clínica y espirométrica. En cuanto a la respuesta inmunológica, se observó una disminución de anticuerpos IgE específicos de gato y una reducción de la sensibilidad de los basófilos a los alergenos. El tratamiento con omalizumab a largo plazo parece desactivar la reactividad de los basófilos a los alergenos. El estudio sugiere que el tratamiento con omalizumab podría ayudar a "superar" en menos tiempo el estado alérgico de pacientes asmáticos, en comparación con otras medidas.104
Con el estudio PERSIST se estudió la eficacia del omalizumab a las 16 y 52 semanas en personas con asma alérgica persistente grave mediante la evaluación global y efectividad del tratamiento (GETE, Global evaluation of treatment effectiveness). Más de 90% de los pacientes no presentó exacerbaciones. A las 16 semanas, 82% de los sujetos refirió una gran mejoría y su calificación GETE fue buena/excelente, con mejoría de los síntomas diurnos y nocturnos.102
El omalizumab ha demostrado ser eficaz en niños y adolescentes con asma alérgica. En un grupo de 334 niños de seis a 12 años de edad, con asma alérgica moderada y grave, el omalizumab administrado durante 28 semanas se relacionó con una mayor disminución de las exacerbaciones de asma que el placebo (18% vs 38%); lo mismo sucedió con la reducción y la eliminación de la beclometasona (100% vs 66% y 55% vs 39%).105 Otrosestudios que han incluido a adolescentes con asma alérgica moderada y grave tratados con omalizumab hasta por 52 semanas han señalado una disminución significativa de las exacerbaciones y los síntomas de asma y rinitis alérgica, y mejoría de la calidad de vida.99,100 En otro estudio de Lanier y colaboradores, en 334 niños de seis a 12 años de edad con asma moderada a grave, se demostró que el omalizumab aplicado durante 52 semanas redujo en grado significativo los síntomas y las exacerbaciones de asma en 43%, en comparación con el grupo placebo.106
Seguridad del omalizumab en el tratamiento del asma
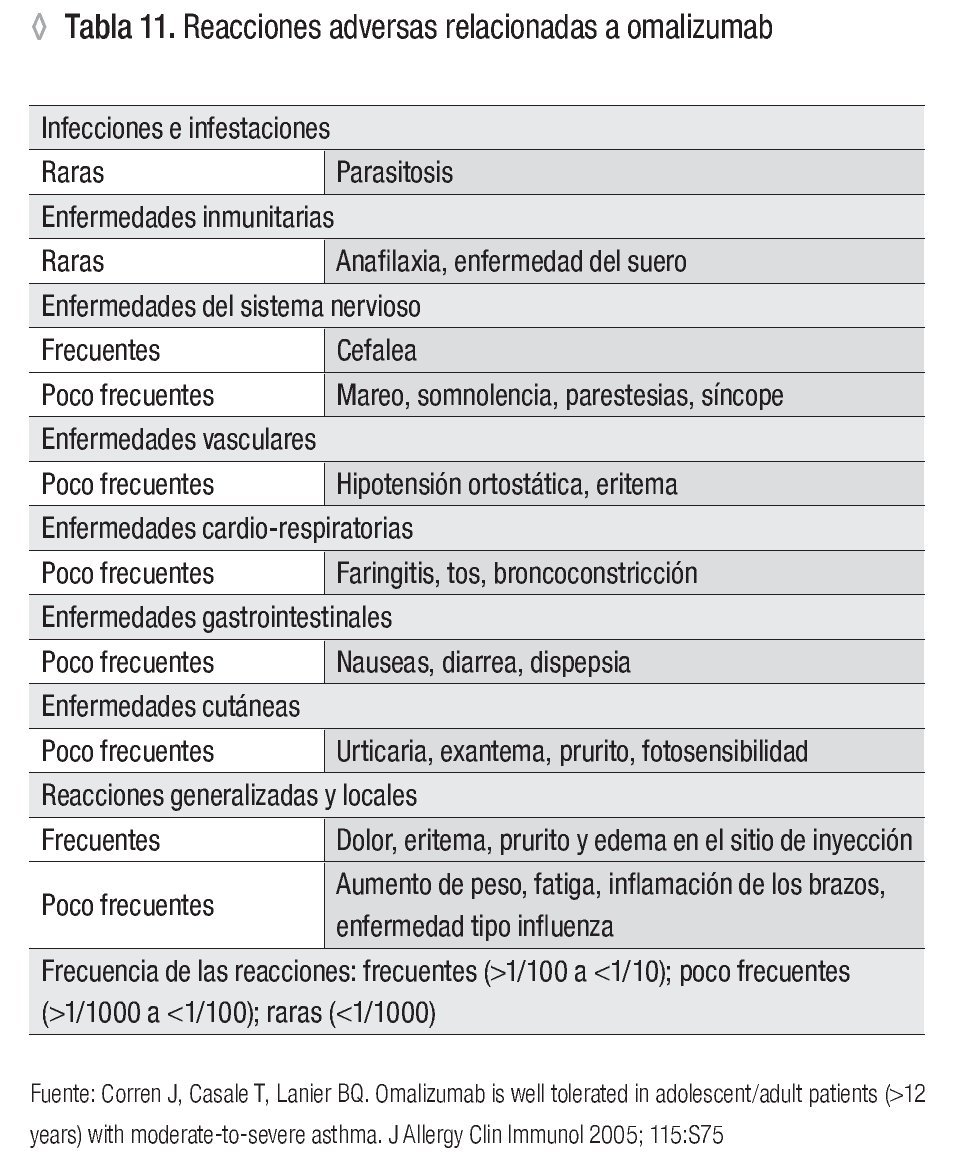
La seguridad del omalizumab en el tratamiento del asma se ha evaluado en múltiples estudios (Tabla 11). En general se ha observado que las reacciones adversas notificadas por el omalizumab y otros tratamientos para el asma son similares.
En el estudio de Corren y colaboradores de 2009, en el que participaron 7 500 pacientes con asma, mayores de 12 años, se presentó anafilaxia en 0.14% de los sujetos que recibieron omalizumab, en comparación con 0.07% del grupo control.107 La FDA ha informado 124 casos de anafilaxia en 57 300 pacientes tratados con omalizumab (0.2%) y la mayoría de los síntomas se presentó dos horas después de aplicar el fármaco.87
El estudio EXCELS (Evaluating the Clinical Effectiveness and Long-Term Safety in Patients with Moderate to Severe Asthma), que actualmente está en curso, está diseñado para evaluar la seguridad y eficacia del omalizumab a largo plazo en la práctica clínica del "mundo real" e integra dos cohortes de pacientes con asma moderada y grave: 5 041 pacientes tratados con omalizumab y 2 886 sujetos tratados sin omalizumab. Los datos basales muestran que no hay diferencias en el número de casos de anafilaxia entre ambos grupos.94 Este estudio también mostró un aumento de los episodios cerebrovasculares y cardiacos en los pacientes tratados con omalizumab, aunque estos efectos no se han informado en otros estudios. Se necesita un análisis más extenso de estos resultados. Como cualquier fármaco, requiere la vigilancia continua por las autoridades regulatorias.87,94,107
Los estudios de seguridad en niños asmáticos tratados con omalizumab hasta por 52 semanas muestran que las reacciones adversas no difieren significativamente de las de los controles.99,100,106,108,109
Las manifestaciones de anafilaxia relacionadas con el omalizumab que se han informado son urticaria, angioedema laríngeo o lingual, broncoconstricción, hipotensión y síncope. La urticaria se presenta con poca frecuencia y se asocia con el tratamiento a largo plazo con omalizumab. Se han propuesto algunas hipótesis para explicar la anafilaxia, incluida la presencia de anticuerpos preexistentes antialotípicos o antiidiotípicos (IgE o IgG) contra anti-IgE o el desarrollo de anticuerpos después de la aplicación inicial o durante la exposición acumulativa al fármaco.94
Se ha informado una baja incidencia de neoplasias en pacientes tratados con omalizumab en comparación con los grupos control (0.5% vs 0.2%), lo cual es similar a lo esperado en la población general.87,94
Debido al probable efecto protector de la IgE contra los helmintos, se ha pensado que los anticuerpos anti-IgE podrían representar un riesgo para contraer parasitosis. Se ha demostrado que ese riesgo no es significativo, cuando se ha comparado con los controles, y no afecta la respuesta al tratamiento antihelmíntico.87 Debe tenerse especial precaución en los pacientes tratados con omalizumab que viajen o residan en regiones endémicas de parasitosis. Sin un paciente con parasitosis no responde a los fármacos antihelmínticos, debe considerarse suspender el tratamiento con omalizumab.109
Datos de economía de la salud en el asma
La falta de control y las exacerbaciones del asma implican una mala calidad de vida y costos socioeconómicos elevados. Los costos en salud comprenden los costos directos de atención médica (atención ambulatoria y hospitalaria, y medicamentos), y los costos indirectos, relacionados con la productividad y pérdida del empleo/ escuela, tiempo y calidad de vida.3,110
Si bien se desconoce la prevalencia real del asma grave, se calcula que entre 5% y 10% de los pacientes asmáticos continuarán sintomáticos aún con el tratamiento máximo recomendado. En los sujetos con asma grave y de difícil control se ejerce al menos 50% de los costos de la atención del asma, debido a las hospitalizaciones, atención en servicios de urgencias y las visitas no programadas al médico.51
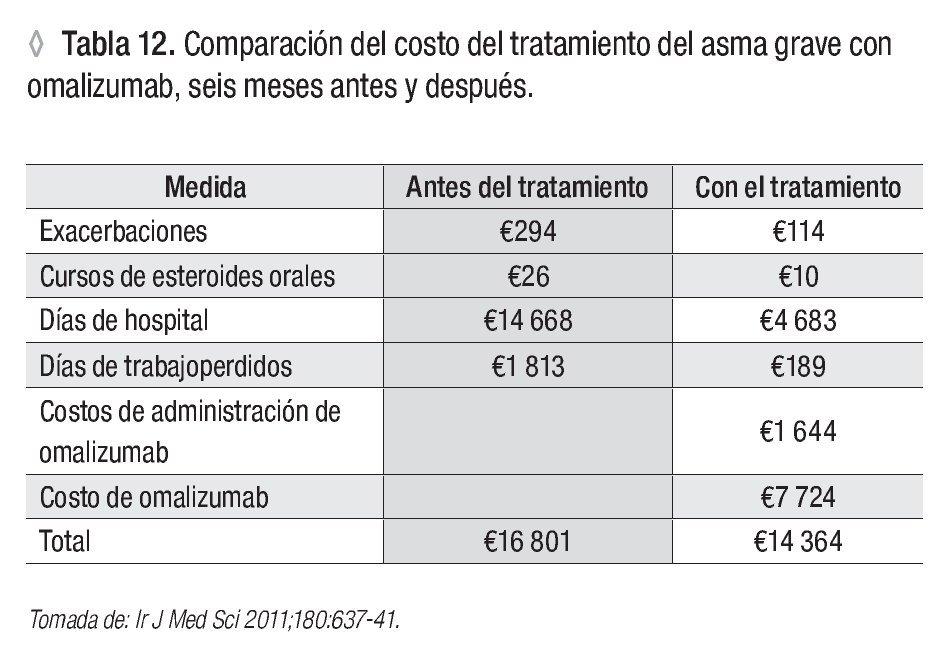
Los costos de la atención médica y la respuesta clínica al tratamiento de 63 pacientes con asma alérgica grave, comparados seis meses antes y seis meses después del tratamiento con omalizumab, se modificaron significativamente: porcentaje de hospitalizaciones (66% vs 24%), número de días/hospital (2.4 vs 0.8), dosis de corticoesteroides orales (3.1 vs 1.2). El costo de la atención por cada paciente tratado con omalizumab se redujo en 834 euros, lo cual en términos de farmacoeconomía representa un beneficio al utilizar la terapia anti-IgE en enfermos con asma alérgica grave adecuadamente seleccionados110 (Tabla 12).
Conclusiones
En la mayoría de los pacientes con asma, la enfermedad se controla de forma apropiada con el tratamiento recomendado en las guías clínicas de asma. En cerca de 5% de los niños y adultos asmáticos no hay una respuesta al tratamiento, aun cuando se utilizan dosis altas de los medicamentos. El AP y ADC tienen un efecto importante en la morbilidad y mortalidad, así como desde el punto de vista socioeconómico. Esta variedad grave del asma representa un reto diagnóstico y de tratamiento. Este grupo de pacientes requiere un estudio clínico exhaustivo para descartar casos falsos de asma. Factores como el desapego al tratamiento, la comorbilidad alérgica, la obesidad, trastornos psicosociales, entre otros, son causas conocidas de la falta de control del asma. Una vez confirmado el diagnóstico de AP y ADC, y corregidos los factores agravantes, el tratamiento debe enfocarse en el fenotipo identificado de asma y en reducir la inflamación bronquial y los síntomas. La terapia con omalizumab es la única que suprime en más de 90% la IgE sérica y previene la respuesta alérgica inflamatoria. Otros modificadores biológicos tienen mayores riesgos que beneficio y su eficacia es menor a la del omalizumab. Al inhibir la respuesta alérgica, el omalizumab disminuye la inflamación bronquial persistente y en consecuencia reduce los mecanismos de reparación que intervienen en el remodelamiento de las vías aéreas. El omalizumab está indicado como terapia agregada a los esteroides inhalados + LABA y otros controladores. Hay múltiples estudios que demuestran la seguridad a largo plazo y la eficacia del omalizumab en el tratamiento del asma alérgica persistente moderada y grave, y de difícil control, en niños y adultos. Los beneficios clínicos del omalizumab son los siguientes: menos exacerbaciones y síntomas de asma, menos visitas a las salas de urgencias y menor número de hospitalizaciones, menor uso de corticoesteroides inhalados y sistémicos, así como mejor función pulmonar y calidad de vida. Las GINA y otras guías internacionales de asma recomiendan el tratamiento agregado de omalizumab en pacientes con asma grave. Las guías del asma del sector salud en México incluyen al omalizumab para su uso en niños y adultos. El asma es una enfermedad compleja, que además de la sensibilización por alergenos y microorganismos, incluye otros mecanismos patogénicos en la reacción inflamatoria bronquial, lo cual explica la diversidad de fenotipos de asma y la falta de respuesta a otros anticuerpos monoclonales y medicamentos. La identificación de defectos en la inmunidad innata (TL-R3 contra virus), que parecen determinar tempranamente el fenotipo atópico bronquial, y en otros fenotipos de asma, ayudarán a comprender mejor la complejidad fisiopatológica del asma y pueden ser la base para desarrollar otras terapias específicas de acuerdo con los defectos identificados.
Correspondencia: Calle Alondra 42, Col.
El Rosedal, Delegación Coyoacán, 04330. México, D. F.
Correo electrónico: mbecer5@gmail.com