Introducción
Las respuestas biológicas que diferentes organismos producen en situaciones de estrés han sido objeto de numerosas investigaciones. A nivel celular existen diferentes mecanismos para ello, aunque uno de los más interesantes, y a la vez controvertido, es la respuesta de proteínas de estrés o heat shock proteins (HSP). En este sentido, una de las principales funciones de las HSP es luchar contra las alteraciones y los defectos en la síntesis de otras proteínas celulares, con el objeto de proteger a las células de los daños que puedan sufrir1. Cualquier tipo de estrés, entendiendo por tal la alteración de la homeostasis, es capaz de inducir su producción, pero en especial las temperaturas elevadas2, la disminución del pH3, los aumentos en la concentración de Ca2+ y de ciertos corticoides4,5, ciertos procesos de isquemia, la disminución de los niveles de glucosa y el agotamiento del glucógeno6, así como otros factores, entre los que se encuentra el ejercicio7,8, son causantes del aumento en los niveles de HSP.
Las HSP están presentes en todo tipo de células, conservándose adecuadamente a lo largo de la evolución celular9. Además, las HSP presentan, entre especies, una alta correspondencia en sus aminoácidos residuales10, algo que apunta hacia una función universal de estas proteínas en la respuesta celular al estrés. Su descubrimiento en larvas de Drosophila melanogaster (mosca del vinagre) se produjo a principios de la década de los años sesenta, tras someter a estos insectos a cierto estrés térmico, de ahí su denominación2.
Son numerosas las HSP que han sido aisladas y definidas, clasificándose en diferentes grupos atendiendo, principalmente, a su masa molecular. De esta forma, pueden diferenciarse diversas proteínas en un rango de 8 a 110 kDa. Las HSP de menor masa son denominadas pequeñas HSP o small HSP, con una masa molecular entre 8 y 27 kDa, un intervalo en el que tienen cabida la ubiquitina, Hsp20, Hsp25, Hsp27 y alfa B-cristalina11. Con una masa molecular mayor se encuentra toda la familia HSP40 (con más de 20 proteínas distintas), así como la familia HSP50, cuyos miembros se ubican en el citosol celular12. Por su parte, la forma precursora de Hsp60 se localiza en el citoplasma, aunque, una vez madura, ejerce sus funciones en la mitocondria13.
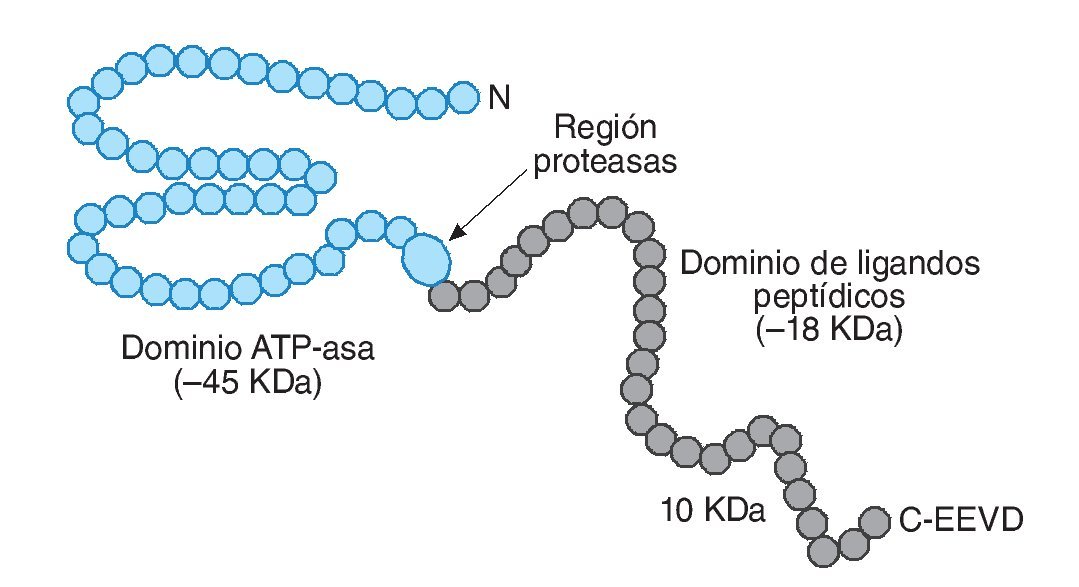
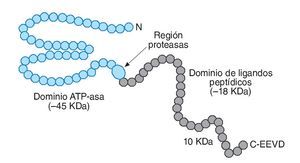
La familia HSP70 cuenta con las proteínas mejor conservadas y, a la vez, más sensibles al estrés térmico (fig. 1). En este grupo se pueden diferenciar, principalmente, 5 moléculas: Hsp70, Hsp72, Hsp73 o Hsc70 (cognado de choque térmico-70), Hsp75 o GRP75 (proteína reguladora de la glucosa 75) y Hsp78 o GRP78. Estas proteínas se pueden localizar en el citosol, en el núcleo, en el retículo endoplasmático y en la mitocondria. Con una distribución similar se encuentra el conjunto de HSP90, el cual incluye Hsp90α, Hsp90β y GRP94, ubicándose las dos primeras en el citoplasma y la tercera en el retículo endoplasmático14. Por último, las HSP con mayor masa molecular, entre 104 y 110 kDa, se localizan en el citosol y núcleo de la célula, respectivamente.
Fig. 1. Representación esquemática de la estructura molecular de HSP70. Adaptada de Liu et al11.
Dado que, prácticamente, las HSP se encuentran en todas las células del cuerpo humano, es fácil dilucidar su presencia en todos los tejidos, localizándose, también, en el intersticio y en la circulación sanguínea15. Parece, además, que la concentración extracelular de un buen número de estas proteínas es un reflejo de su liberación desde diferentes células, esencialmente de aquellas que sufren necrosis16. En cualquier caso, la familia proteica más determinante en el músculo esquelético es la HSP70, de la que destacan Hsp70 y Hsp72 por sus funciones en diferentes procesos biológicos y enfermedades que afectan al músculo esquelético. Así, los objetivos de esta revisión son, por un lado, ofrecer una información más detallada sobre estas funciones y, por otro, resumir las investigaciones que, en los últimos años, se han efectuado con el fin de analizar las respuestas y funciones de estas proteínas en una de las principales situaciones estresantes para el músculo: el ejercicio físico.
HSP70 en el músculo esquelético
Como se ha indicado con anterioridad, la población de HSP70 se ubica en diferentes estructuras de la fibra muscular como son el citosol, el núcleo, el retículo endoplasmático y la mitocondria. Si bien su presencia es característica en este tipo de tejido, el estudio de estas proteínas se ha centrado en las funciones que éstas pueden ejercer en él. Entre estas funciones se pueden destacar la protección frente al estrés oxidativo17,18, la disminución de la debilitación muscular durante la inmovilización17,19, el incremento de la regeneración y proliferación18,20 y la atenuación del daño muscular8,21. Por esta razón, varios estudios intentan aclarar en la actualidad los efectos terapéuticos de la inducción de HSP en el músculo esquelético21,22.
Otras de las funciones de HSP70 tienen que ver con su actuación a modo de chaperones, evitando una formación errónea de proteínas dentro de las células23,24, interviniendo en el plegado de las proteínas de nueva síntesis, en el control de la actividad de las proteínas reguladoras y en la prevención y replegado de agregados de proteínas23,25. Además de las funciones establecidas de protección intracelular, se ha planteado la hipótesis de que la Hsp70 y la Hsp72 cumplen funciones sistémicas. Sin embargo, uno de los aspectos que más ha estimulado a los investigadores ha sido la implicación de HSP70 en diferentes alteraciones o enfermedades que afectan al músculo esquelético. En este sentido, se ha realizado un buen número de investigaciones con el objetivo de definir el papel de estas proteínas en los diferentes procesos biológicos subyacentes a distintas enfermedades y/o lesiones musculares.
Papel de HSP70 en enfermedades y lesiones que afectan al músculo esquelético
Diversos estudios han demostrado que las variaciones en la concentración intracelular de Hsp70 se producen como consecuencia de diferentes alteraciones del músculo esquelético. Una de ellas es el síndrome de miopatía con agregados tubulares. Esta patología puede estar asociada a procesos inflamatorios y, en este caso, parece evidente que la Hsp70 está regulada por citoquinas pro-inflamatorias, como el factor de necrosis tumoral (TNF)-α, interleucina (IL)-1 e IL-626,27.
Por otro lado, hay cierta evidencia de la implicación de Hsp70 en la distrofia muscular de Duchenne (DMD). En este caso, la presencia de Hsp70 en fibras degenerativas de músculos afectados por la DMD28 y la reducción en su expresión génica cuando disminuye la gravedad de la enfermedad29 marcan una relación entre dicha proteína de estrés y este tipo de enfermedad.
La diabetes, y más en concreto su repercusión en el músculo esquelético, ha sido también objeto de diferentes investigaciones en las que se ha valorado la respuesta de las HSP. Teniendo en cuenta que la diabetes causa en el músculo una alteración en el mecanismo antioxidante de defensa, se ha observado una baja concentración intramuscular de Hsp72 ARNm y Hsp32 ARNm (hemo-oxigenasa-1) en pacientes con diabetes tipo 230. Estos hallazgos están en la línea de los obtenidos en otras investigaciones, en las que se han registrado bajas concentraciones de Hsp70 ARNm en pacientes con diabetes tipo 2, unos niveles que, además, correlacionaron con el consumo de glucosa por parte del músculo31.
En cuanto a las lesiones del músculo esquelético, todo parece indicar que aquellas alteraciones que provocan un incremento de las concentraciones sanguíneas de creatín kinasa (CK) se acompañan de un aumento en los niveles musculares de Hsp7032. Sin embargo, y como se indica en uno de los apartados posteriores de este trabajo, no todos los estudios realizados en este sentido han llegado a las mismas conclusiones.
HSP70 y procesos adaptativos musculares
La familia HSP70 también ha sido relacionada con diferentes procesos adaptativos que afectan al músculo esquelético. Dos de los más evidentes son los procesos que conducen a la atrofia y a la hipertrofia muscular. En el caso de la atrofia, que puede derivarse de una degradación y/o de una supresión de la síntesis proteica en la célula muscular33, diferentes HSP pueden verse implicadas34,35. Así, tras la suspensión de los miembros traseros durante 9 semanas, se observó una reducción del 38% en el contenido de Hsp70 en el músculo sóleo de las ratas analizadas, necesitando entre dos a cuatro semanas para su recuperación36. Por otra parte, la exposición a estrés térmico reduce, en ratas, la atrofia muscular consecutiva a la falta de acción de las cargas, lo que puede ser debido al aumento en los músculos de HSP70 y/o de otras proteínas de estrés19.
En la hipertrofia, entendida como un proceso adaptativo fundamental de las células del músculo esquelético, la Hsp70 parece desempeñar un papel fundamental. Así, 6 semanas de entrenamiento de fuerza produjeron una conversión de las cadenas pesadas de miosina y un incremento en la expresión de la isoforma cardiaca de las cadenas pesadas de miosina (MCH-Iα ARNm) en el tríceps braquial. Además, al valorar el contenido de Hsp70 en dicho músculo se encontraron niveles tres veces superiores a nivel proteico y cuatro veces mayores a nivel del correspondiente ARNm37,38. Y después de entrenar un músculo que hasta entonces se había mantenido en reposo, se ha observado un crecimiento del mismo y un aumento significativo en la expresión de Hsp70 y Hsp7236,39. Unido a ello, parece existir una estrecha relación entre la respuesta de Hsp70 y la respuesta del factor de crecimiento insulínico tipo 1 (IGF-1) inducidas por el ejercicio, lo que certifica el papel que, en la hipertrofia muscular, puede desempeñar la familia de HSP7040,41.
Por otro lado, el papel de las HSP en el proceso apoptótico ha sido objeto de diferentes investigaciones a lo largo de los últimos años. Al igual que ocurre con las pequeñas HSP, la Hsp70 ejerce un efecto negativo sobre la apoptosis. Suzuki et al42 encontraron que, en un cultivo celular (mioblastos L6), un pretratamiento consistente en la aplicación de calor (42 °C durante una hora) antes de una agresión de tipo hipoxiareoxigenación redujo el porcentaje de apoptosis temprana. En esta línea, se ha sugerido que la glutamina ejerce un efecto estimulador del turnover proteico en el músculo esquelético, promoviendo así la apoptosis43. Además, la relación entre Hsp70 y IGF-1 puede tener una repercusión sobre el proceso apoptótico, ya que el aumento en la concentración de IGF-1 inducido por el ejercicio se ve acompañado de la activación de la fosfatidilinositol-3-OH quinasa, inhibiendo el proceso de apoptosis44.
Asimismo, es posible que la Hsp70 pueda inhibir la apoptosis evitando la captación de caspasa-9 por el factor activador de la proteasa apoptótica (APAF-1) para formar el apoptosoma45, aunque también se ha registrado una correlación positiva del contenido de Hsp70 con la proteína de linfoma-2 de células B (Bcl-2) y el Hsp70 ARNm, así como una correlación negativa con el contenido de Bcl-2 asociada a la proteína X (Bax) ARNm. Teniendo en cuenta que la proteína Bax es proapoptótica y la proteína Bcl-2 antiapoptótica, estos datos sugieren que el ejercicio físico puede atenuar el proceso de apoptosis en el músculo esquelético46.
Respuestas de HSP70 al ejercicio físico
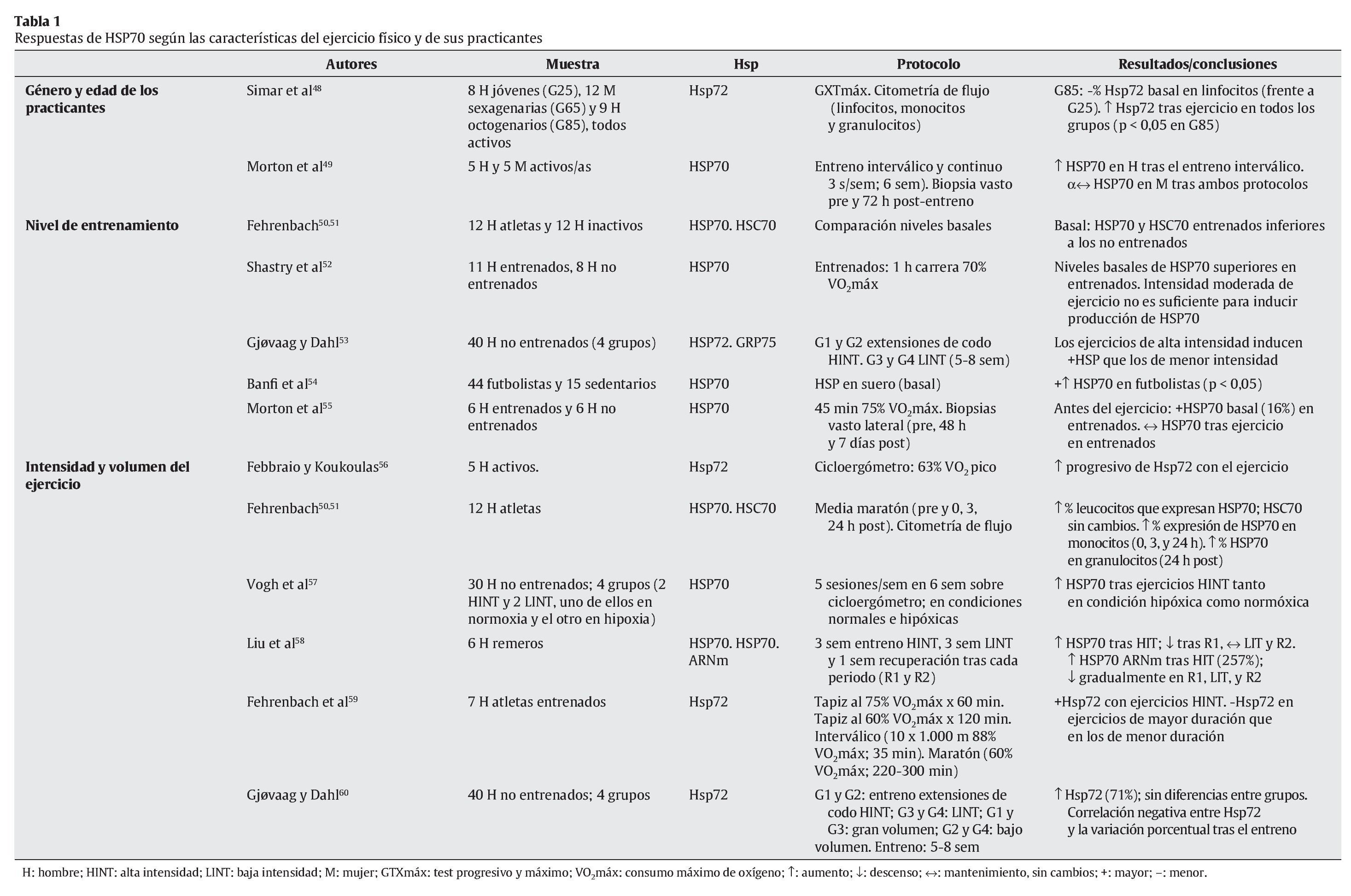
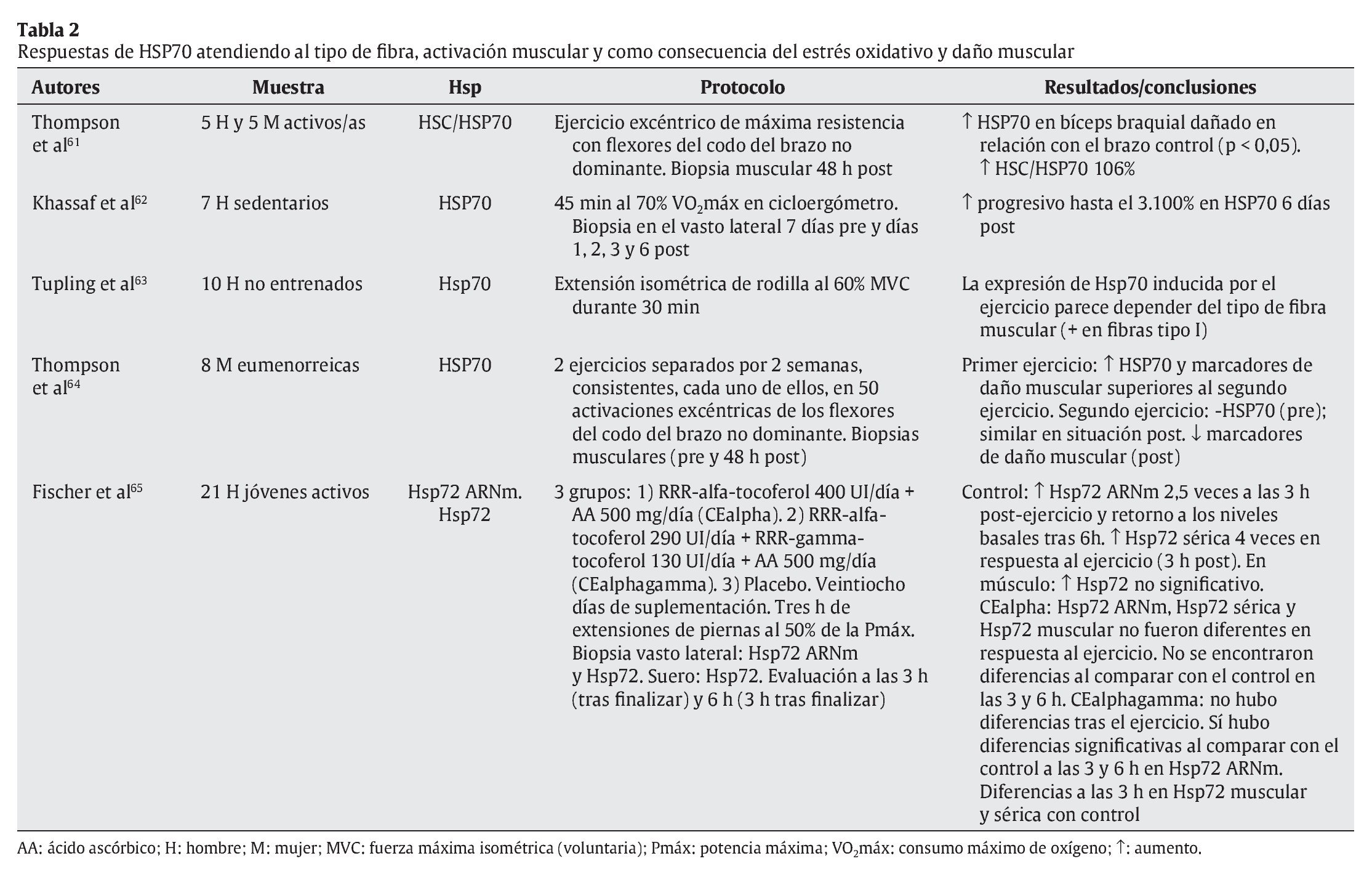
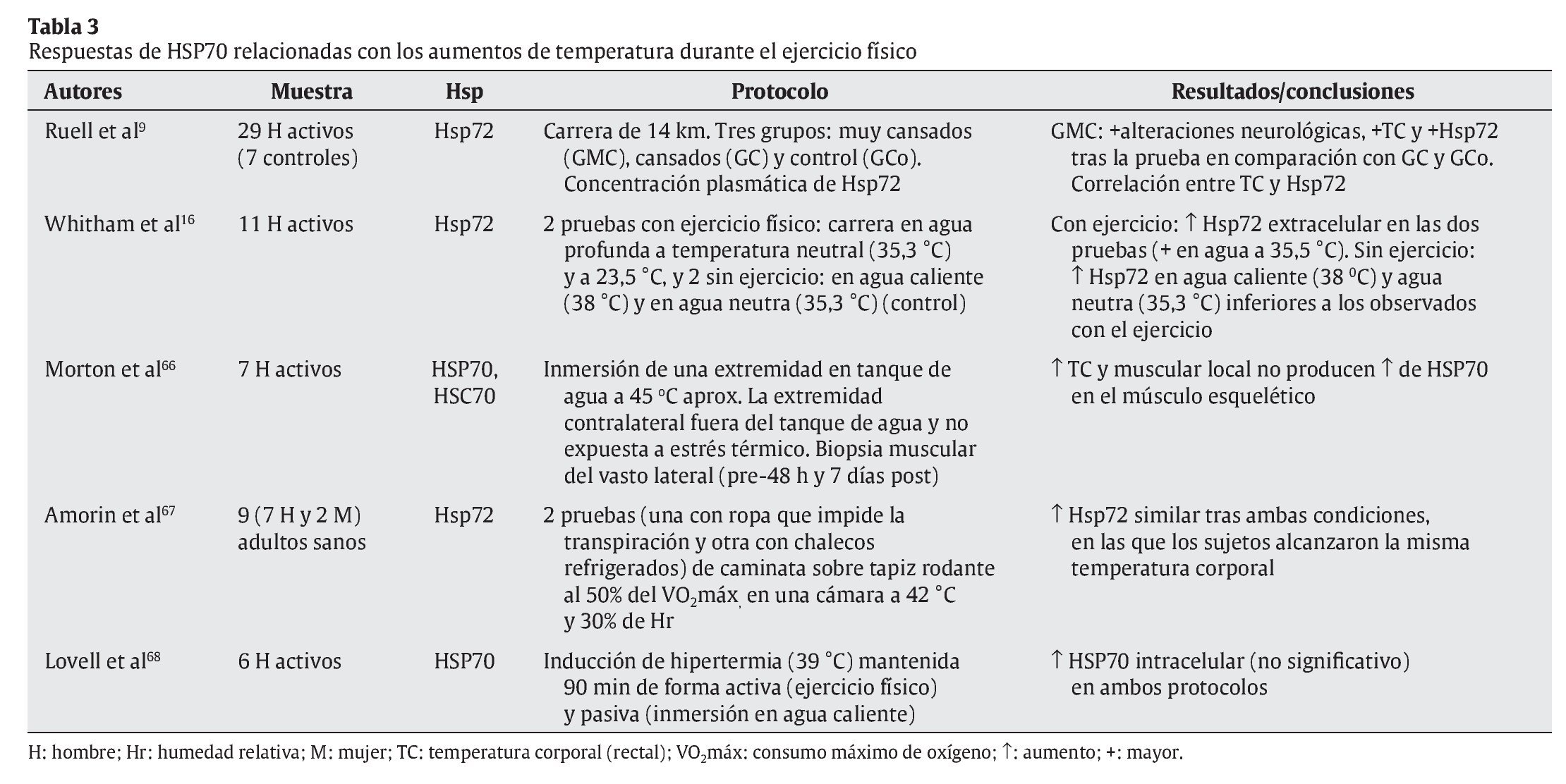
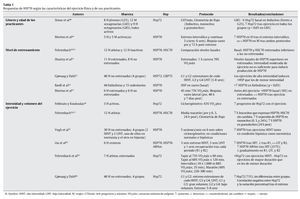
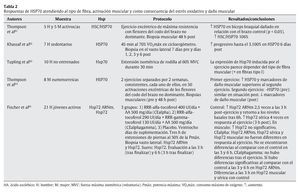
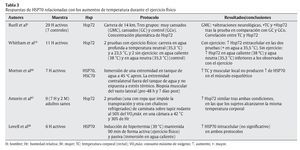
Tal y como se ha indicado con anterioridad, el ejercicio físico se presenta como una de las principales fuentes de estrés, en especial sobre el aparato locomotor. Aunque algunos estudios apuntan a células hepáticas y cerebrales como precursoras de la liberación de HSP70 provocada por el ejercicio físico27,47, el aumento de la temperatura corporal, las repetidas e intensas activaciones musculares, los impactos mecánicos sufridos y todas aquellas alteraciones metabólicas y estructurales experimentadas durante el esfuerzo son diferentes estímulos desencadenantes de la respuesta de HSP70 en la fibra muscular16. En cualquier caso, un buen número de variables relacionadas con el ejercicio físico puede condicionar la respuesta de estas proteínas. En las tablas siguientes se resumen las principales investigaciones que, durante los últimos años, se han desarrollado con seres humanos de cara a determinar las respuestas de HSP70 al ejercicio físico. En su confección se ha tenido en cuenta la naturaleza de las variables que pueden afectar a dicha respuesta, correspondiendo ésta bien a las características del ejercicio físico (tabla 1), bien a los procesos fisiológicos relacionados con el esfuerzo (tablas 2 y 3).
Tal y como se desprende de la información resumida en las tablas anteriores, existe un buen número de condicionantes capaces de modular la respuesta de HSP70 al ejercicio físico. En lo que hace referencia al factor sexo, y a pesar de contar con muy pocos datos al respecto (además, ciertamente contradictorios), se han llegado a observar diferencias en la respuesta de HSP70 tras entrenamientos de tipo interválico, registrándose en hombres una mayor reacción de estas proteínas49. Por su parte, la edad parece ejercer cierta influencia en la respuesta de HSP70 al ejercicio, siendo ésta superior en personas mayores48.
Aunque, a priori, se podría considerar que el nivel de entrenamiento podría inducir ciertas adaptaciones en los niveles de HSP70, los resultados de las investigaciones más recientes no apuntan en una única dirección, ya que al comparar los niveles basales y los obtenidos tras el ejercicio en sujetos entrenados y no entrenados, los resultados son muy discordantes50-55.
Como es bien sabido, dos de las principales variables que determinan el ejercicio físico son su intensidad y duración. Al igual que sucede con otros procesos biológicos en respuesta al estrés, HSP70 reacciona en mayor medida cuando el ejercicio es intenso57-59, siendo la duración del mismo un factor que parece ejercer una menor influencia. De hecho, se ha llegado a registrar una disminución en la respuesta de estas proteínas en ejercicios de larga duración59.
En la tabla 2 se puede apreciar cómo la respuesta de HSP70 es acorde a los casos de daño muscular y estrés oxidativo61,65, especialmente en ejercicios excéntricos aislados, ya que con la práctica frecuente dicha respuesta parece reducirse como parte de la adaptación al ejercicio64. En cualquier caso, las concentraciones de HSP70 pueden quedar elevadas hasta 6 días después de la realización del esfuerzo63, como ocurre con ciertos marcadores de daño muscular. Por otra parte, la respuesta de HSP70 al ejercicio está influenciada por el tipo de fibra implicada, siendo en las fibras tipo I donde se ha registrado una mayor respuesta de estas proteínas.
Por último, y si las contrariedades precedentes son sustanciales, aún son más contundentes cuando se relaciona la respuesta de HSP70 al ejercicio físico y los aumentos de temperatura corporal experimentados por los practicantes. Como se puede observar en la tabla 3, los resultados de algunas investigaciones apuntan hacia una estrecha relación entre la respuesta de estas proteínas de estrés y los aumentos de temperatura corporal inducidos por el ejercicio9,67,68. Sin embargo, las conclusiones a las que se llega en otros recientes estudios se oponen a la anterior, negando tal relación66 o afirmando que además de los aumentos de temperatura corporal, otros factores vinculados con el propio ejercicio físico son los responsables más directos de la respuesta de HSP7016.
Funciones de HSP70 durante el ejercicio físico
Si la descripción de las respuestas de HSP70 al ejercicio físico puede resultar una tarea más o menos fácil, el esclarecimiento de sus funciones es una tarea mucho más compleja. Las conclusiones a las que han llegado la mayoría de estudios indican que las funciones de esta familia proteica parecen estar vinculadas a la protección y adaptación celular, así como a la regulación del metabolismo durante el ejercicio.
Protección celular y facilitación de la adaptación muscular
De forma general, el envejecimiento aumenta la susceptibilidad de las células de diferentes tejidos orgánicos a morir por apoptosis. Las HSP (principalmente HSP70), bien de forma aislada o combinada, ejercen una acción crucial en la supervivencia de los miocitos, al prevenir la aparición de la apoptosis una vez que el corazón ha sufrido los efectos de un proceso de isquemia/repercusión69,70.
Al igual que sucede en el miocardio1,71-75, las HSP parecen desempeñar un papel protector en el músculo estriado, pudiendo facilitar su adaptación cuando su actividad se ve aumentada a causa del ejercicio físico. De hecho, en las horas y días posteriores a un esfuerzo intenso se observa un incremento en la síntesis de HSP70, probablemente para modular los procesos de recuperación y remodelación/adaptación y proteger así a las fibras musculares que se ven implicadas en dicho ejercicio76,77. En esta línea se cree, de forma hipotética, que como resultado de un programa de ejercicio físico las concentraciones de HSP70 en los músculos se incrementarían, protegiéndolos del deterioro y de la pérdida de su funcionalidad relacionada con la edad78. Además, parece ser que esta función protectora de HSP70 se lleva a cabo, preferentemente, sobre los músculos que se hallan constituidos principalmente por fibras lentas, en las que se expresan con gran abundancia la Hsp72 y la Hsp7379.
Regulación del metabolismo energético
El metabolismo energético es crucial para el funcionamiento celular, donde HSP70 actúa a modo de pivote en el mantenimiento de la homeostasis y facilitando la adaptación celular. La participación de HSP70 en la regulación del metabolismo energético se centra en dos aspectos11. Por un lado, y como ya se ha indicado en un apartado anterior, diferentes condiciones energéticas (depleción de glucógeno y ATP, acumulación de ácido láctico y descenso del pH) provocan la respuesta de HSP70. Por otra parte, HSP70 puede ejercer un efecto directo o indirecto sobre el metabolismo energético. En el primer caso, y tal y como se ha demostrado, la Hsp70 contiene un fragmento de ATPasa, algo que puede modular la concentración intracelular de ATP80.
En otro de los estudios realizados, se demostró que un tratamiento hipertérmico previo en el músculo incrementa significativamente la actividad oxidativa de enzimas mitocondriales como el citocromo C, coincidiendo con un aumento paralelo en la expresión de HSP7081.
En una investigación en la que se utilizó una línea celular Hella transgénica con el fin de determinar la incidencia de HSP70 sobre la concentración de ATP, se controló la expresión de esta proteína de estrés, diferenciando células con baja, moderada y elevada expresión de HSP70 tomando como referencia los niveles fisiológicos. Los resultados mostraron que, en comparación con las células no modificadas, las mayores concentraciones de ATP fueron registradas en aquellas en las que se indujo una expresión de HSP70 de tipo moderada (similar a la que se produce bajo estrés fisiológico), y no en aquellas en las que se indujo una elevada expresión de esta proteína de estrés. En este estudio se analizó, además, el efecto ejercido por la expresión de HSP70 sobre el metabolismo glucídico y oxidativo. Los datos obtenidos, relacionados con las células en las que se indujo una sobreexpresión de Hsp70, muestran un aumento en la tasa de consumo de glucosa y de producción de ácido láctico, mientras que, a excepción de un aumento en la actividad de la citrato sintetasa, no se registraron diferencias significativas en el metabolismo oxidativo con las células no modificadas y utilizadas como control82. Además, para estos autores, el papel de HSP70 en la preservación de la concentración intracelular de ATP está vinculado a su efecto estimulante sobre la glucólisis.
En cuanto al efecto indirecto de la HSP70 sobre el metabolismo energético, se ha especulado que su influencia sobre la glucólisis puede estar asociada con el transporte de glucosa. De hecho, se ha descubierto, por un lado, que en células musculares de pacientes diabéticos tipo 2, los niveles de HSP70 se vieron significativamente reducidos30, y por otro, que la baja expresión de HSP70 correlaciona con la resistencia a la insulina31.
Por último, otra posible participación de HSP70 en el metabolismo energético tiene que ver con la modulación de la calmodulina, una proteína reguladora del calcio que interactúa con la hexoquinasa, la única enzima glucolítica que, ligada a la mitocondria, desempeña un importante papel en el intercambio de hidrógeno83. También se ha indicado que el efecto de HSP70 sobre la glucólisis se basa en la prevención de la inhibición de la enzima lactato deshidrogenasa, la cual es causada, principalmente, por el estrés celular84.
Conclusiones
Como cualquier otra célula sometida a estrés, la fibra muscular atiende a una respuesta de HSP, más en concreto de la familia HSP70. Hsp70 y Hsp72 desarrollan funciones biológicas de protección celular, actuando como chaperones proteicos e interviniendo en diferentes alteraciones, enfermedades y otros procesos biológicos que atañen al músculo esquelético. El ejercicio físico, entendido como una de las principales fuentes de estrés sobre el aparato locomotor, provoca las respuestas de HSP70, siendo su intensidad el principal factor desencadenante de las mismas. Además, parece existir una mayor respuesta de HSP70 en fibras tipo I, siendo los ejercicios que mayor daño muscular y estrés oxidativo producen los que mayor reacción generan en estas proteínas. Paradójicamente, la relación entre HSP70 y los aumentos de temperatura derivados de la actividad muscular está aún por definir. Por último, las funciones que estas proteínas pueden acometer durante el ejercicio parecen estar también relacionadas con la regulación del metabolismo energético y con la facilitación de la recuperación. Es necesario llevar a cabo nuevos estudios que concreten estas cuestiones y definan nuevos vínculos entre ejercicio físico, HSP y otros sistemas reguladores orgánicos, como el endocrino y el inmunológico.
Correspondencia:
L. Carrasco Páez.
Departamento de Educación Física y del Deporte. Facultad de Ciencias de la Educación. Universidad de Sevilla.
Avda. Ciudad Jardín, 20-22.
41005 Sevilla. España.
Correo electrónico: lcarrasco@us.es
Historia del artículo:
Recibido el 14 de agosto de 2009.
Aceptado el 28 de septiembre de 2009.