El número de procedimientos endoscópicos, diagnósticos o terapéuticos, así como el requerimiento de sedación durante los mismos, se ha incrementado en los últimos años. Esta técnica genera un riesgo sobreañadido de complicaciones respiratorias intra y postoperatorias en pacientes afectados de esclerosis lateral amiotrófica (ELA), principalmente en aquellos con parámetros estáticos críticos en las pruebas funcionales respiratorias. La insuficiencia respiratoria aguda y la necesidad de intubación orotraqueal con destete prolongado o traqueostoma definitivo es una complicación no deseable, pero real en estos pacientes. Experiencias previas en este sentido han obligado al anestesiólogo a buscar y aplicar medidas que proporcionen una mayor seguridad del paciente durante este tipo de procedimientos; es por ello que presentamos nuestra experiencia con 13 pacientes afectos de ELA durante la sedación profunda para colocación de una gastrostomía endoscópica percutánea de alimentación con ventilación mecánica no invasiva de soporte y su evolución a corto plazo.
The number of diagnostic and therapeutic endoscopic procedures with sedation requirements has increased in the last years. This technique produces an added risk of intra-procedural respiratory failure and respiratory complications in patients with amyotrophic lateral sclerosis, especially in those with critical static parameters in respiratory function tests. Acute respiratory failure and the need for orotracheal intubation with prolonged weaning and definitive tracheostomy are real complications in these patients. For this reason, the experience and results are presented on 13 ALS patients, in whom non-invasive mechanical ventilation was used during deep sedation for percutaneous endoscopic gastrostomy placement.
Los requerimientos de sedación durante procedimientos endoscópicos son cada vez más frecuentes1,2 en nuestro medio hospitalario. El riesgo de complicaciones respiratorias severas durante la intervención bajo sedación se incrementa en pacientes afectados de esclerosis lateral amiotrófica (ELA) y tienen una implicación determinante en su evolución posterior. El empleo de la ventilación mecánica no invasiva (VMNI) constituye una herramienta útil en este tipo de procedimientos1,3-5 permitiendo llevar a cabo una sedación profunda segura y satisfactoria para el paciente.
Presentamos la guía de actuación en nuestro centro para el manejo anestésico de pacientes con ELA durante el implante de una gastrostomía endoscópica percutánea (PEG) bajo sedación y VMNI de soporte, y nuestra valoración global tras la aplicación de ésta técnica de soporte respiratorio en 13 pacientes. Es necesario resaltar la importancia del cuidado de los pacientes durante el procedimiento y las consideraciones perioperatorias más relevantes.
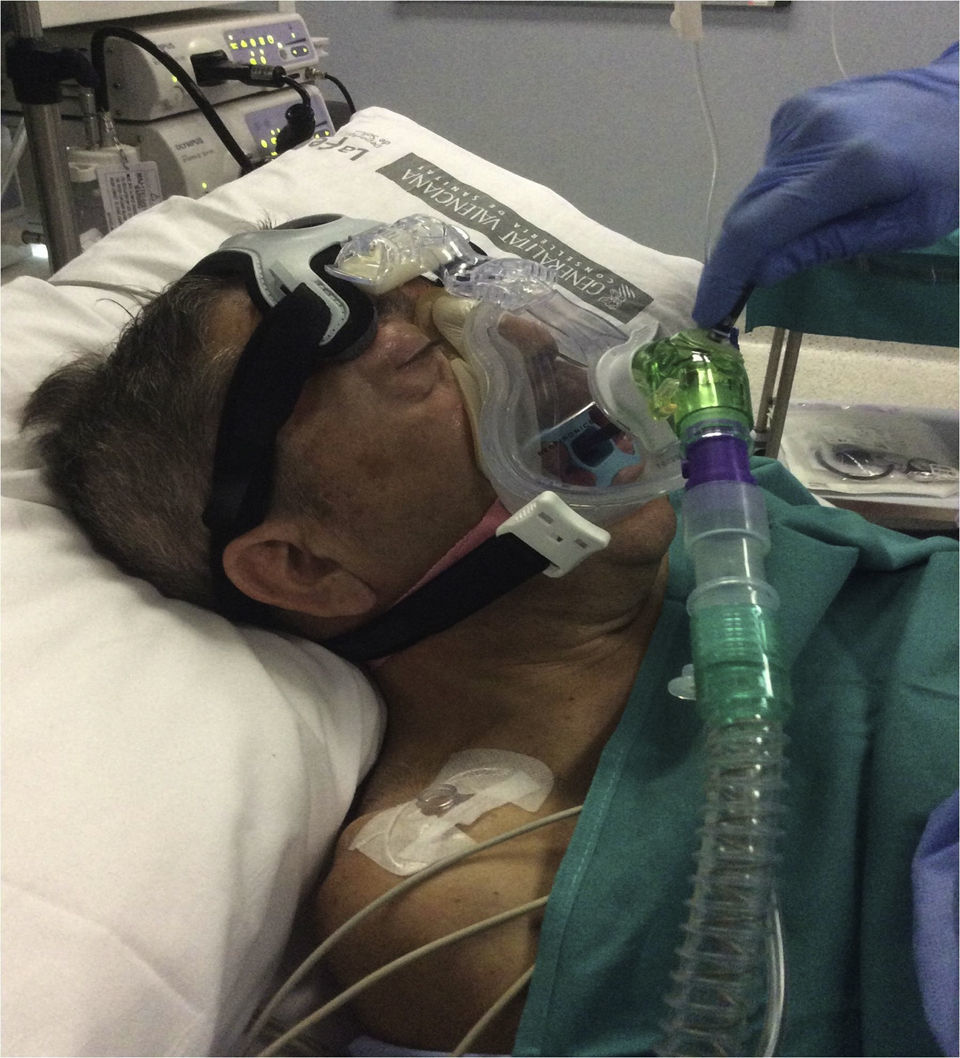
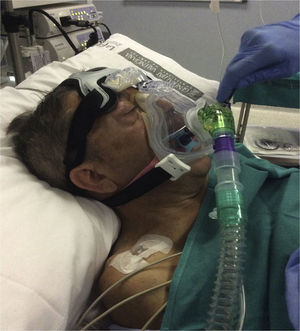
Casos clínicosPresentamos una serie de 13 pacientes afectados de ELA, sometidos a una PEG para alimentación entre mayo del 2014 y mayo del 2015. Previa valoración por el servicio de Neumonología y Neurología, los pacientes acuden a la consulta anestésica una semana antes del procedimiento. Tras analizar los parámetros habituales de la visita preanestésica (VPA) fueron revisados los aspectos relacionados con su patología (ELA), principalmente la situación respiratoria actual. Dentro de las pruebas funcionales respiratorias revisten especial interés los parámetros estáticos (presiones espiratoria e inspiratoria máximas [PEM y PIM]) y el pico flujo de tos (PFT). Los parámetros de soporte domiciliario, las horas de empleo, la necesidad de dispositivos de limpieza de secreción bronquial (CoughAssist E70 Respironics, Philips) y la existencia de voluntades anticipadas (VA) deben quedar registrados de forma clara y destacada en la VPA. Los pacientes con soporte respiratorio o dispositivos mecánicos para movilizar secreciones (tabla 1) debían traerlos el día del procedimiento y realizar su pauta habitual seguida de aspiración en la zona de acogida. No premedicamos con benzodiacepinas de forma rutinaria por el elevado riesgo de depresión respiratoria que presentan estos pacientes. Tras monitorizar de forma estándar, se realizó la topicalización de la cavidad oral con lidocaína al 2% mediante una cánula orofaríngea (MADgic airway®, Teleflex) y se colocó el protector bucal. En los pacientes portadores de VMNI domiciliaria, 5 en total de los 13 casos registrados, se inició el soporte previo a la sedación, en modalidad BiPAP (Respironics V60, modo S/T, Philips) y con sus parámetros habituales. En los pacientes que no eran portadores de VMNI previa, se procedió directamente a la premedicación con 0,5-1mg IV de midazolam y 0,25-0,5mg kg-1 IV de ketamina, en función de la edad y el estadio evolutivo de la ELA. Tras la pérdida del reflejo palpebral y la comprobación de un nivel 5 en la escala de sedación de Ramsay, se colocó la interfase facial (máscara oronasal AF531 con arnés CapStrap, Respironics, Philips) más apropiada (tamaño S, M o L), iniciando el soporte con parámetros preestablecidos (FiO2 100%, presión inspiratoria [IPAP] 10cmH2O, presión espiratoria [EPAP] 4cmH2O, frecuencia respiratoria de rescate 8 resp min−1), y modificándolos según necesidades (fig. 1). Previo a la introducción del endoscopio (momento de máximo estímulo del procedimiento), se administró un bolo de 10-20mg de propofol IV y en función de la respuesta del paciente (tos, movimientos, muecas) se inició la perfusión continua (PC) de propofol 1% a 10-15ml/h.
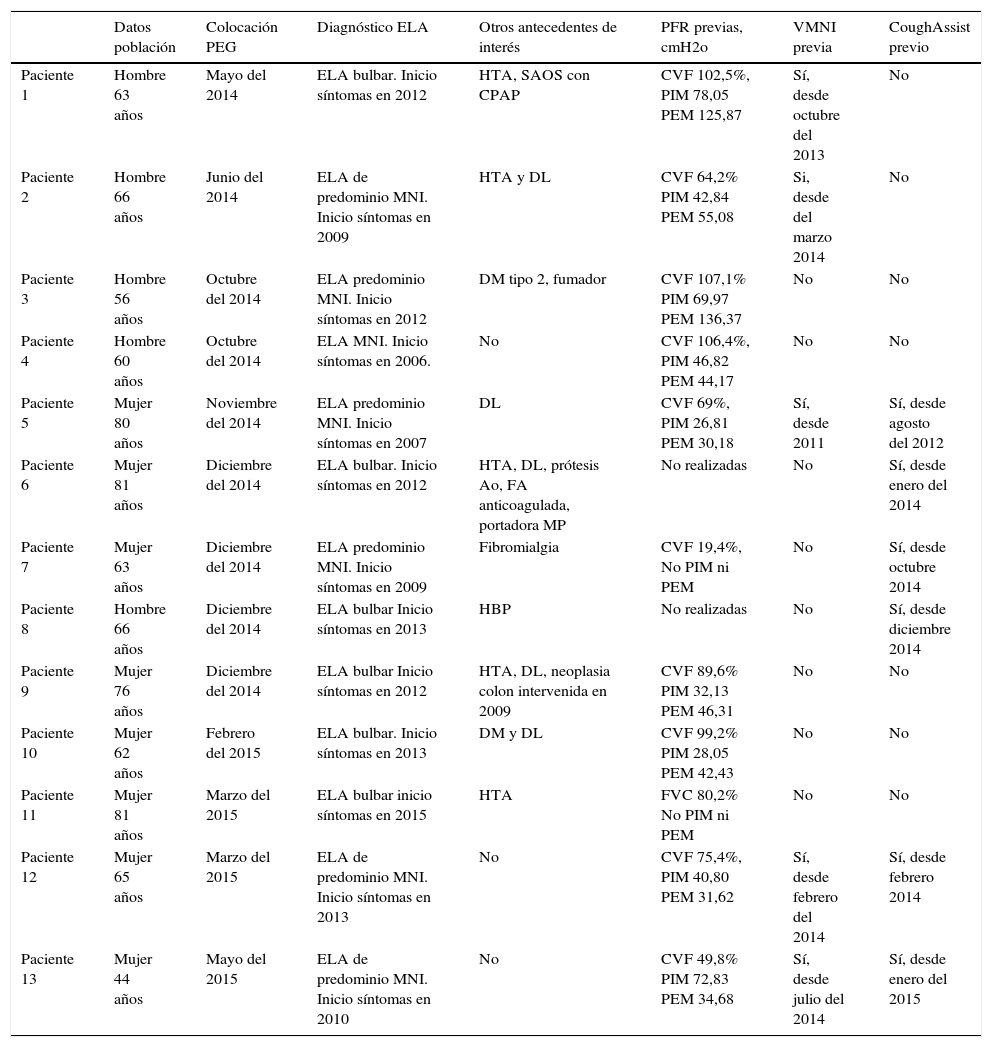
Características de los pacientes
| Datos población | Colocación PEG | Diagnóstico ELA | Otros antecedentes de interés | PFR previas, cmH2o | VMNI previa | CoughAssist previo | |
|---|---|---|---|---|---|---|---|
| Paciente 1 | Hombre 63 años | Mayo del 2014 | ELA bulbar. Inicio síntomas en 2012 | HTA, SAOS con CPAP | CVF 102,5%, PIM 78,05 PEM 125,87 | Sí, desde octubre del 2013 | No |
| Paciente 2 | Hombre 66 años | Junio del 2014 | ELA de predominio MNI. Inicio síntomas en 2009 | HTA y DL | CVF 64,2% PIM 42,84 PEM 55,08 | Si, desde del marzo 2014 | No |
| Paciente 3 | Hombre 56 años | Octubre del 2014 | ELA predominio MNI. Inicio síntomas en 2012 | DM tipo 2, fumador | CVF 107,1% PIM 69,97 PEM 136,37 | No | No |
| Paciente 4 | Hombre 60 años | Octubre del 2014 | ELA MNI. Inicio síntomas en 2006. | No | CVF 106,4%, PIM 46,82 PEM 44,17 | No | No |
| Paciente 5 | Mujer 80 años | Noviembre del 2014 | ELA predominio MNI. Inicio síntomas en 2007 | DL | CVF 69%, PIM 26,81 PEM 30,18 | Sí, desde 2011 | Sí, desde agosto del 2012 |
| Paciente 6 | Mujer 81 años | Diciembre del 2014 | ELA bulbar. Inicio síntomas en 2012 | HTA, DL, prótesis Ao, FA anticoagulada, portadora MP | No realizadas | No | Sí, desde enero del 2014 |
| Paciente 7 | Mujer 63 años | Diciembre del 2014 | ELA predominio MNI. Inicio síntomas en 2009 | Fibromialgia | CVF 19,4%, No PIM ni PEM | No | Sí, desde octubre 2014 |
| Paciente 8 | Hombre 66 años | Diciembre del 2014 | ELA bulbar Inicio síntomas en 2013 | HBP | No realizadas | No | Sí, desde diciembre 2014 |
| Paciente 9 | Mujer 76 años | Diciembre del 2014 | ELA bulbar Inicio síntomas en 2012 | HTA, DL, neoplasia colon intervenida en 2009 | CVF 89,6% PIM 32,13 PEM 46,31 | No | No |
| Paciente 10 | Mujer 62 años | Febrero del 2015 | ELA bulbar. Inicio síntomas en 2013 | DM y DL | CVF 99,2% PIM 28,05 PEM 42,43 | No | No |
| Paciente 11 | Mujer 81 años | Marzo del 2015 | ELA bulbar inicio síntomas en 2015 | HTA | FVC 80,2% No PIM ni PEM | No | No |
| Paciente 12 | Mujer 65 años | Marzo del 2015 | ELA de predominio MNI. Inicio síntomas en 2013 | No | CVF 75,4%, PIM 40,80 PEM 31,62 | Sí, desde febrero del 2014 | Sí, desde febrero 2014 |
| Paciente 13 | Mujer 44 años | Mayo del 2015 | ELA de predominio MNI. Inicio síntomas en 2010 | No | CVF 49,8% PIM 72,83 PEM 34,68 | Sí, desde julio del 2014 | Sí, desde enero del 2015 |
Ao: aórtica; CPAP: presión positiva continua en la vía aérea; CVF: capacidad vital forzada expresada como tanto por ciento respecto al valor teórico; DL: dislipidemia; DM: diabetes mellitus; ELA: esclerosis lateral amiotrófica; FA: fibrilación auricular; HBP: hipertrofia benigna de próstata; HTA: hipertensión arterial; MNI: motoneurona inferior; MP: marcapasos; PEG: gastrostomía endoscópica percutánea; PEM: presión espiratoria máxima, ambas medidas en cmH2O; PFR: pruebas funcionales respiratorias; PIM: presión inspiratoria máxima; SAOS: síndrome apnea obstructiva del sueño; VMNI: ventilación mecánica no invasiva.
La estabilidad hemodinámica (tabla 2) durante la técnica fue la norma con las dosis recomendadas de fármacos anestésicos; sin embargo, en 2 casos (pacientes 6 y 13) tras la administración de midazolam (0,5 y 1mg, respectivamente) y ketamina (35 y 25mg, respectivamente) presentaron una desaturación (saturación de oxígeno [SatO2]=87-88%) inicial que obligó a la retirada de la interfase y la subluxación mandibular durante 50-60 s, recuperando la respiración espontánea y normalizándose la SatO2. La paciente 6, de 81 años, presentaba importante comorbilidad asociada a la ELA y la paciente 13 se encontraba en un estadio avanzado de la enfermedad; en ambas, el reinicio del soporte respiratorio transcurrió sin incidencias. Tras la exteriorización abdominal de la PEG se suspendió la infusión de propofol y se aspiraron secreciones. Una vez recuperada la consciencia, se trasladaron los pacientes a la Unidad de Recuperación, inicialmente aquellos sin soporte domiciliario (pacientes 3, 4, 6 y 7) recibiendo oxigenoterapia con gafas nasales a 2-4 lpm, pero en los últimos casos registrados el traslado se realizó sin necesidad de oxígeno suplementario (pacientes 8-11). Los pacientes que eran portadores de ventilación domiciliaria fueron trasladados con su propio ventilador (pacientes 1, 2, 5, 12 y 13).
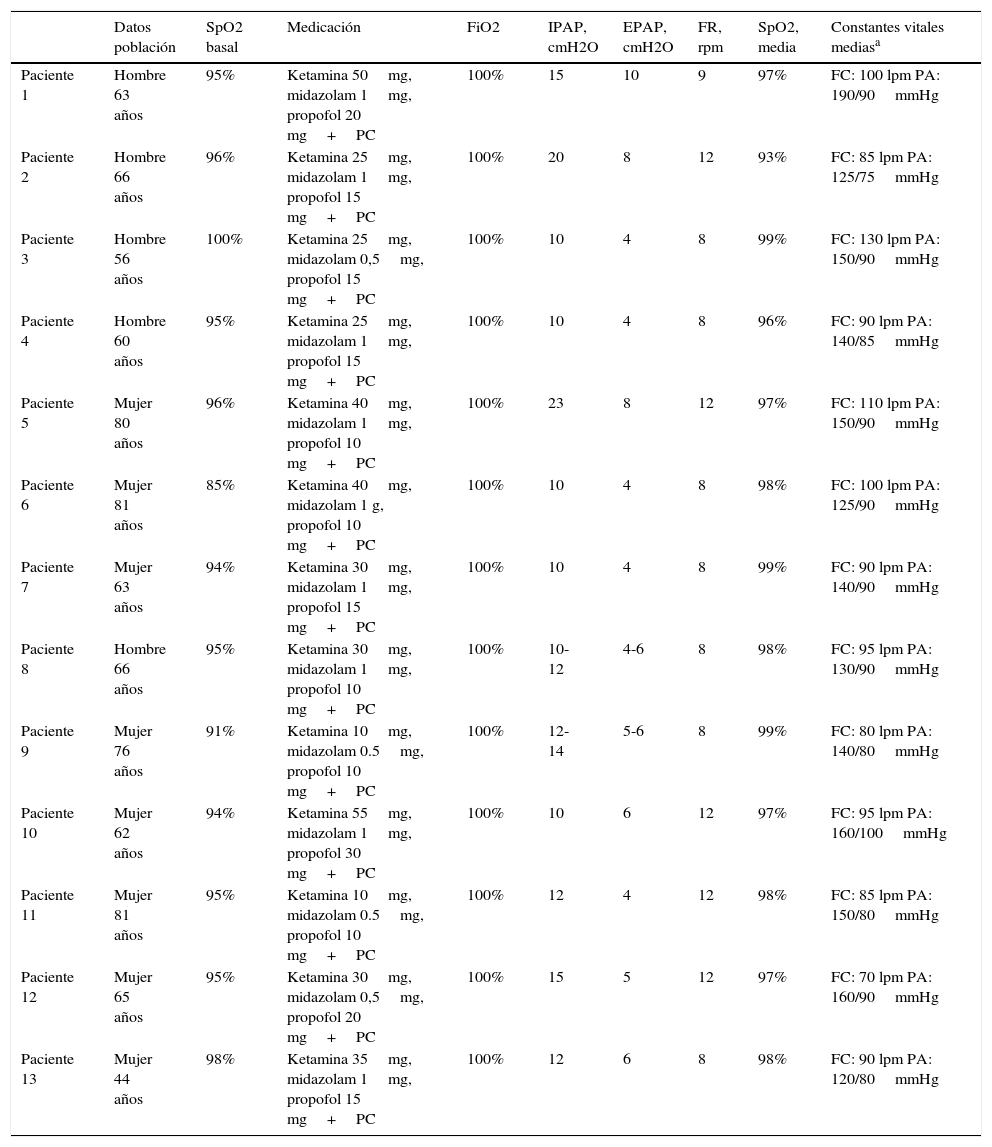
Datos intraprocedimiento
| Datos población | SpO2 basal | Medicación | FiO2 | IPAP, cmH2O | EPAP, cmH2O | FR, rpm | SpO2, media | Constantes vitales mediasa | |
|---|---|---|---|---|---|---|---|---|---|
| Paciente 1 | Hombre 63 años | 95% | Ketamina 50mg, midazolam 1mg, propofol 20 mg+PC | 100% | 15 | 10 | 9 | 97% | FC: 100 lpm PA: 190/90mmHg |
| Paciente 2 | Hombre 66 años | 96% | Ketamina 25mg, midazolam 1mg, propofol 15 mg+PC | 100% | 20 | 8 | 12 | 93% | FC: 85 lpm PA: 125/75mmHg |
| Paciente 3 | Hombre 56 años | 100% | Ketamina 25mg, midazolam 0,5mg, propofol 15 mg+PC | 100% | 10 | 4 | 8 | 99% | FC: 130 lpm PA: 150/90mmHg |
| Paciente 4 | Hombre 60 años | 95% | Ketamina 25mg, midazolam 1mg, propofol 15 mg+PC | 100% | 10 | 4 | 8 | 96% | FC: 90 lpm PA: 140/85mmHg |
| Paciente 5 | Mujer 80 años | 96% | Ketamina 40mg, midazolam 1mg, propofol 10 mg+PC | 100% | 23 | 8 | 12 | 97% | FC: 110 lpm PA: 150/90mmHg |
| Paciente 6 | Mujer 81 años | 85% | Ketamina 40mg, midazolam 1 g, propofol 10 mg+PC | 100% | 10 | 4 | 8 | 98% | FC: 100 lpm PA: 125/90mmHg |
| Paciente 7 | Mujer 63 años | 94% | Ketamina 30mg, midazolam 1mg, propofol 15 mg+PC | 100% | 10 | 4 | 8 | 99% | FC: 90 lpm PA: 140/90mmHg |
| Paciente 8 | Hombre 66 años | 95% | Ketamina 30mg, midazolam 1mg, propofol 10 mg+PC | 100% | 10-12 | 4-6 | 8 | 98% | FC: 95 lpm PA: 130/90mmHg |
| Paciente 9 | Mujer 76 años | 91% | Ketamina 10mg, midazolam 0.5mg, propofol 10 mg+PC | 100% | 12-14 | 5-6 | 8 | 99% | FC: 80 lpm PA: 140/80mmHg |
| Paciente 10 | Mujer 62 años | 94% | Ketamina 55mg, midazolam 1mg, propofol 30 mg+PC | 100% | 10 | 6 | 12 | 97% | FC: 95 lpm PA: 160/100mmHg |
| Paciente 11 | Mujer 81 años | 95% | Ketamina 10mg, midazolam 0.5mg, propofol 10 mg+PC | 100% | 12 | 4 | 12 | 98% | FC: 85 lpm PA: 150/80mmHg |
| Paciente 12 | Mujer 65 años | 95% | Ketamina 30mg, midazolam 0,5mg, propofol 20 mg+PC | 100% | 15 | 5 | 12 | 97% | FC: 70 lpm PA: 160/90mmHg |
| Paciente 13 | Mujer 44 años | 98% | Ketamina 35mg, midazolam 1mg, propofol 15 mg+PC | 100% | 12 | 6 | 8 | 98% | FC: 90 lpm PA: 120/80mmHg |
EPAP: presión positiva espiratoria; FC: frecuencia cardíaca; FiO2: fracción inspiratoria de oxígeno; FR: frecuencia respiratoria; IPAP: presión positiva inspiratoria; lpm: latidos por minuto; PA: presión arterial; PC: perfusión continua; rpm: respiraciones por minuto; SpO2: saturación parcial de oxígeno.
Como complicaciones postoperatorias, se observó una autoextracción de la PEG a las pocas horas del procedimiento (paciente 6), habiendo expresado su voluntad de no recibir maniobras extraordinarias de reanimación; probablemente, la valoración psicológica previa a la técnica pudo no ser correcta. En el momento de la revisión, realizada en septiembre del 2015, 4 de los pacientes habían fallecido a causa de su enfermedad.
DiscusiónLa sedación profunda en el paciente que presenta ELA permite evitar la repetición de procedimientos endoscópicos por mala tolerancia o cirugías más invasivas que incrementan el riesgo de complicaciones respiratorias severas postoperatorias2,3, de ahí la importancia de desarrollar una técnica anestésica segura y satisfactoria tanto para el paciente como para los especialistas implicados (anestesiólogos, endoscopistas, neumólogos, neurólogos). La VMNI permite una mayor profundidad anestésica sin deterioro de la oxigenación y la ventilación3 que en el paciente afectado de ELA puede tener consecuencias fatales.
La ELA es una enfermedad caracterizada por la pérdida progresiva de neuronas motoras del córtex cerebral, el tronco del encéfalo y la médula espinal. La muerte se relaciona principalmente con insuficiencia respiratoria, generalmente en fases avanzadas de la enfermedad. Estos pacientes suelen necesitar soporte nutricional a través de una PEG durante la evolución de su enfermedad, pero la evidencia acerca del momento óptimo de su colocación es escasa3; la Academia Americana de Neurología recomienda la PEG con capacidad vital forzada (CVF)>50% del valor predicho6. La colaboración y el consenso multidisciplinar son fundamentales porque muchos pacientes, en condición física y respiratoria aceptables, rechazan la PEG por sus implicaciones psicosociales, pero un deterioro mayor de su situación basal genera un incremento proporcional de complicaciones durante el procedimiento bajo sedación.
La declaración de consenso del colegio americano de médicos torácicos sobre el manejo respiratorio de pacientes con distrofia muscular de Duchenne6 establece una serie de sugerencias y propuestas sobre la evaluación y manejo de estos pacientes antes de procedimientos con sedación que consideramos extrapolables a los pacientes con ELA. Es imprescindible contar con la evaluación preanestésica y la consulta del especialista en Neumonología, previo al procedimiento y, aunque no especifican con qué anterioridad realizarlas, consideramos que la segunda es preferible llevarla a cabo la semana previa a la intervención. La evaluación pulmonar debe incluir la medición de la CVF, PIM, PEM, PFT, SatO2 a aire ambiente y, si esta es inferior al 95%, medición del etCO2. La CVF<50% en posición sentada es el parámetro más citado como valor predictivo de riesgo de complicaciones respiratorias6, aunque datos recientes lo cuestionan, ya que puede existir hipoventilación significativa con este valor de CVF. En nuestro centro, los neumólogos priorizan el PFT y la PEM y PIM sobre la CVF como valores predictivos de complicaciones e indicadores de PEG. Pacientes con PFT<270 l min−1 o PEM<60cmH2O probablemente tengan tos ineficaz y mayor riesgo de complicaciones respiratorias, siendo opinión de consenso que reciban entrenamiento preoperatorio en asistencia manual y mecánica de la tos; PFT<160 l min−1 implican imposibilidad para eliminar secreciones y es necesaria la asistencia mecánica a la tos, así como plantear la posibilidad de traqueostomía, especialmente si no se consigue un buen manejo de las secreciones. El conocimiento de estos valores críticos es importante, ya que los pacientes pueden precisar procedimientos urgentes, no demorables, y son orientativos del grado de complicaciones al final de la intervención.
En coincidencia con Esquinas et al.2, la VMNI, actualmente, se prodiga cada vez más como soporte respiratorio en fibrobroncoscopias y endoscopias intervencionistas1,2,5,7; un factor limitante en su empleo es la dificultad para adecuar la interfase al procedimiento endoscópico7. Se ha recurrido a la CPAP de Boussignac (Vygon)2,7 o VMNI3-5 en modalidad BiPAP en este tipo de procedimientos y patología, pero la experiencia es limitada1,2. Esquinas et al.2 recomiendan el uso de mascarillas nasales porque no constituyen un obstáculo para el gastroenterólogo; nosotros empleamos mascarilla facial con un codo intermedio (Bronchoscopy Elbow, Respironics, Philips) que dispone de un orificio siliconado que por su diámetro permite la entrada del endoscopio convencional (Olympus Q 165 de 9,8mm) y, aunque la maniobra de abordaje esofágico se ve ligeramente dificultada, no constituye un obstáculo en manos expertas. En nuestra revisión, la mayoría de los autores presentan casos clínicos aislados empleando diferentes interfases (nasal8, oronasal, facial9) y el manejo anestésico de cada procedimiento de forma individual. En nuestra serie, la sedación con midazolam y ketamina (asociada o no a propofol) y el soporte con VMNI permiten el desarrollo del procedimiento con seguridad y buena tolerancia por parte del paciente. El empleo de perfusión de ketamina8 (8μg.kg – 1.min–1) en lugar de propofol probablemente genera menor riesgo de depresión respiratoria, pero el incremento de secreciones, las malas experiencias asociadas al fármaco y el estímulo simpático que provoca (que puede enmascarar la hipertensión arterial o taquicardia, únicos indicadores de dolor o intolerancia del paciente con ELA avanzada), hacen del propofol nuestra primera opción. La experiencia, tanto en técnicas y fármacos de uso habitual en sedación profunda como en el manejo de los diferentes modelos de respiradores de VMNI disponibles, es básica, por lo que seleccionar la interfase más adecuada para cada paciente y disponer de personal de enfermería entrenado y cualificado1,7,10 en este tipo de procedimientos son requisitos imprescindibles. En nuestra revisión observamos que la VMNI con FiO2 intraoperatoria del 35-80% permite SatO2>95% durante la técnica; en nuestra serie, tratándose de procedimientos cortos (15-20min), empleamos FiO2 100% y tras la retirada del soporte (en no portadores de VMNI previamente) mantenemos al paciente respirando aire ambiente durante 5min. Todos mantuvieron SatO2>94% tras recuperar la consciencia. Aunque inicialmente el traslado a la Unidad de Recuperación se realizaba con oxigenoterapia con gafas nasales a 2-4 lpm (en pacientes sin VMNI domiciliaria), actualmente se trasladan sin O2 suplementario para evitar la depresión del centro respiratorio. Todos los pacientes evolucionaron correctamente hasta el alta domiciliaria.
ConclusiónLa sedación profunda con VMNI de soporte durante procedimientos endoscópicos en pacientes con ELA constituye una técnica que garantiza la satisfacción y bienestar del paciente al tiempo que disminuye el número de exploraciones fallidas o procedimientos más invasivos. Aunque la experiencia es limitada, nuestra práctica parece indicar que la VMNI es recomendable y segura durante la sedación profunda, constituyendo una herramienta de primera línea en pacientes sometidos a procedimientos mínimamente invasivos, en quienes la sedación y/o su patología de base (ELA) conlleva un alto riesgo de complicaciones respiratorias que puedan ensombrecer su evolución a corto plazo. La asociación de dosis bajas de midazolam (0,5-1mg) y ketamina (0,5mg/kg), reforzada con bolos o perfusión de propofol, permite una sedación adecuada durante el procedimiento. Destacamos la importancia del correcto manejo interdisciplinar periprocedimiento, incluyendo una VPA que identifique a aquellos pacientes con VMNI domiciliaria o dispositivos de movilización de secreciones y advierta de la existencia de VA, y la intervención de personal cualificado y formado en estas técnicas para garantizar el éxito del procedimiento a corto-medio plazo. No hemos pretendido realizar un estudio retrospectivo de pacientes, sino únicamente presentar nuestra experiencia valorada como satisfactoria con esta técnica. Quizás estudios prospectivos posteriores, incluyendo la monitorización objetiva de la profundidad anestésica con el índice biespectral, nos permita ajustar las dosis empleadas de fármacos, reduciendo riesgos de sobredosificación y complicaciones asociadas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores de este artículo confirman que cada uno, de forma individual, cumple con los requisitos de autoría, y así mismo expresamos que no existe ningún conflicto de intereses relacionado con la publicación del mismo.