La infección por el virus de inmunodeficiencia humana produce una enfermedad sistémica crónica. El tratamiento con fármacos antirretrovirales altamente activos ha modificado la evolución de estos pacientes incrementando la sobrevida. En contraposición, asociadas a su enfermedad y/o a la medicación antirretroviral, se describen múltiples enfermedades crónicas que comprometen aún más la calidad de vida de estos pacientes. Nuestro objetivo es describir las alteraciones endocrinometabólicas en nuestros pacientes ambulatorios con infección por el virus de inmunodeficiencia humana y realizar una actualización del tema.
The human immunodeficiency virus causes a chronic systemic disease. Treatment with highly active antiretroviral drugs has changed the evolution of the disease, and increasing the rate of survival. However, due to the disease and/or the antiretroviral drugs, there are other multiple chronic diseases that compromise the quality of life of the patients even more. The aim of this study is to present endocrine and metabolic changes in outpatients with human immunodeficiency virus, and present an update of the related literature.
La infección por el virus de inmunodeficiencia humana (VIH) produce una enfermedad sistémica crónica, pudiendo afectar también el sistema endocrinometabólico.
El tratamiento con fármacos antirretrovirales ha incrementado ostensiblemente la expectativa de vida de los pacientes portadores del virus de inmunodeficiencia humana y síndrome de inmunodeficiencia adquirida (VIH/sida). En muchos casos, las clásicas infecciones oportunistas han sido desplazadas por la aparición de múltiples enfermedades crónicas cuyos efectos podrían incidir negativamente en el pronóstico de vida de esta población. También, han sido descriptas disfunciones endocrinas, aunque sus mecanismos fisiopatológicos no son del todo conocidos. El virus VIH, en forma directa, por destrucción del órgano afectado o en forma indirecta, a través de las modificaciones que induce en el sistema inmune, podría ser el causal de las alteraciones endocrinas.
Además, muchos de los efectos secundarios de la terapia antirretroviral de alta actividad (TARAA), repercuten afectando, principalmente, el metabolismo lipídico e hidrocarbonado.
En este estudio, de carácter descriptivo transversal, se evaluaron las alteraciones endocrinas y metabólicas en un grupo de pacientes ambulatorios con infección por VIH de la Ciudad Autónoma de Buenos Aires, Argentina.
ObjetivoDescripción de las alteraciones endocrinometabólicas halladas en una población con infección por VIH.
PoblaciónFueron incluidos 57 pacientes con diagnóstico de VIH derivados en forma consecutiva a la División de Endocrinología en el período comprendido entre noviembre de 2005 y abril de 2008.
MétodosSe realizaron determinaciones séricas de calcio, fósforo y creatinina por analizador de bioquímica automático Hitachi; PTH intacta por quimioluminiscencia (IMMULITE 1000) (vn: 10-69pg/ml, coeficiente variación (CV) intra- e interensayo: 5,5 y 7,9%) y 25(OH)VD (VD) por RIA, DiaSorin (CV intra- e interensayo: 8,4 y 12,8%). Se consideraron insuficientes los niveles de VD <30ng/ml1.
La TSH (vn: 0,5-4,0 uUI/ml, CV intra- e interensayo: 4,5 y 5,1%), T4 total (vn: 5,0-11,5μg/dl, CV intra- e interensayo: 4,8 y 6,1%), T4 libre (vn: 0,89-1,76ng/dl, CV intra- e interensayo: 5,9 y 6,4%), T3 (vn: 85-175ng/dl, CV intra- e interensayo: 7,0 y 10%) y anticuerpos antiperoxidasa (AcTPO) (vn: <35 UI/ml, CV intra- e interensayo: 6,2 y 7,1%) fueron realizados por quimioluminiscencia (IMMULITE 2000) y anticuerpo antirreceptor de TSH (TRAb) por el método radiorreceptor (vn: <14,6%, CV intra- e interensayo: 6 y 10%). Se definió hipotiroidismo subclínico (S-clínico) como niveles de TSH >4,2μUI/ml y clínico cuando se asociaba a T4 libre<0,9ng/dl o T4 total<5μg/dl. Hipertiroidismo por TSH menor de 0,06μUI/ml, T4 mayores de 11,5μg/dl y T3 mayores de 175ng/dl. Se determinó cortisol sérico a las 8 h, por RIA (vn: 5-20μg/dl, CV intra- e interensayo: 11,1 y 11,5%), y en seis casos se realizó test de reserva adrenal considerando prueba insuficiente a una respuesta de cortisol postestímulo con ACTH 40 U intramuscular<25μg/dl2.
Las determinaciones de PRL (v: 2,5-17,0; m: 3,0-20ng/ml, CV intra- e interensayo: 16%), LH (v: 1,4-7,7; m fase folicular: 1,6-8,3 mUI/ml, CV intra- e interensayo: 5 y 6,2%), FSH (v: 1,5-14; m fase folicular: 3,4-10 mUI/ml, CV intra- e interensayo: 2,8 y 4,6%) y estradiol (m fase folicular: ND-84pg/ml, CV intra- e interensayo: 9,9 y 11,8%) fueron realizadas por quimioluminiscencia (IMMULITE 1000) y la testosterona total por RIA (vn: 3-6ng/ml, CV intra- e interensayo: 4,4 y 4,8%). Se consideró amenorrea secundaria a la ausencia de menstruación por al menos 90 días. En quienes presentaban ginecomastia se realizó mamografía.
Las mediciones de la densidad mineral ósea (DMO) de cuerpo entero, columna lumbar y cuello de fémur fueron realizadas con un equipo DPX-Lunar y los resultados fueron expresados como Z-score. Para definir osteopenia y osteoporosis fueron utilizando los criterios de la OMS3.
Las determinaciones de triglicéridos, colesterol y sus fracciones se realizaron por autoanalizador (método: colorimétrico enzimático). Niveles de triglicéridos >150mg/dl se definieron como hipertrigliceridemia, niveles de coleterol >200mg/dl como hipercolesterolemia. Glucemias en ayunas >100mg/dl y <126mg/dl se consideraron alteradas (GAA), y las >126mg/dl indicativas de diabetes (DBT). Se realizó test de tolerancia a la glucosa oral en quienes tenían GAA o antecedentes familiares de DBT. Para el diagnóstico de insulinorresistencia se consideró el valor de corte del índice HOMA obtenido en una población sana de la Ciudad Autónoma de Buenos Aires4. Análisis estadístico: los datos se expresan como porcentual, media±SD, y las diferencias se analizaron con el test t de Student.
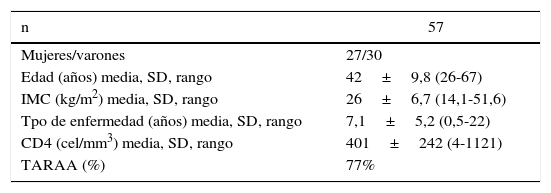
ResultadosEl grupo está conformado por 27 mujeres (6 posmenopáusicas) y 30 varones con edad promedio de 42,1±9,8 años (rango: 26-67). En la tabla 1 se muestran los datos demográficos de la población.
Datos demográficos de la población
| n | 57 |
|---|---|
| Mujeres/varones | 27/30 |
| Edad (años) media, SD, rango | 42±9,8 (26-67) |
| IMC (kg/m2) media, SD, rango | 26±6,7 (14,1-51,6) |
| Tpo de enfermedad (años) media, SD, rango | 7,1±5,2 (0,5-22) |
| CD4 (cel/mm3) media, SD, rango | 401±242 (4-1121) |
| TARAA (%) | 77% |
IMC: índice de masa corporal; SD: desvío estándar; TARAA: terapia antirretroviral de alta actividad.
La determinación del perfil lipídico y de la glucemia fue realizada en 40 y 45 pacientes, respectivamente. Las alteraciones metabólicas fueron los hallazgos más frecuentes. El 62,5% de los pacientes presentaron hipertrigliceridemia y el 53,6% presentaron hipercolesterolemia. Una dislipemia mixta estuvo presente en 18 pacientes (45%).
En 35,5% de los casos se encontró GAA y dos pacientes eran diabéticos. El grupo total presentó índice HOMA 1,77±1,72. La prevalencia de insulinorresistencia fue de 48%, 41% en las mujeres y 58% en los hombres (tabla 2).
Prevalencia de alteraciones del perfil lipídico y glucémico en pacientes ambulatorios con VIH
| n | % | |
|---|---|---|
| Hipertrigliceridemia | 25/40 | 62,5 |
| Hipercolesterolemia | 22/41 | 53,6 |
| Dislipemia mixta | 18/40 | 45 |
| GAA | 16/45 | 35,5 |
| DBT | 2/45 | 4,4 |
| Insulinorresistencia | 14/29 | 48 |
DBT: diabetes; GAA: glucemia alterada en ayunas.
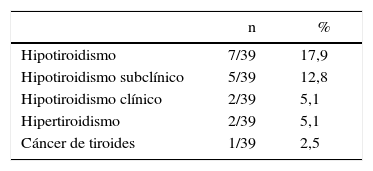
El perfil tiroideo fue realizado en 39 pacientes. En 10 de 39 pacientes se encontraron alteraciones tiroideas; dos pacientes se encontraban clínica y bioquímicamente hipertiroideos, y en un caso se diagnosticó carcinoma papilar de tiroides. El hipotiroidismo estuvo presente en 7 (17,9%) pacientes, cinco (12,8%) presentaban la forma subclínica y 2 (5,1%) la forma clínica. Es de destacar que en todos los casos los AcTPO fueron negativos (tabla 3).
La disfunción sexual en el varón estuvo presente en 3 casos y 4/21 mujeres presentaban amenorrea 2.ª. En todos los casos los niveles de gonadotrofinas, hormonas esteroides sexuales y prolactina fueron normales (datos no mostrados).
En seis casos se observó ginecomastia, siendo unilateral en tres de ellos. La ginecomastia fue confirmada por mamografía, permitiendo además descartar patología neoplásica mamaria.
En relación a la función adrenocortical, el nivel de cortisol 8 h fue 14,5±7,0μg/dl. Dos pacientes presentaron test de reserva adrenal inadecuado; ambos tenían antecedentes de micosis sistémica.
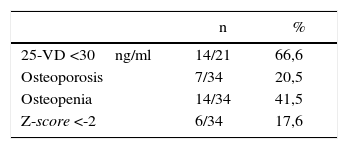
En nuestra población el promedio de VD fue 14,6±6,7ng/ml. El 66,4% de los pacientes tuvieron niveles de VD<30ng/ml (tabla 3). En este grupo, el nivel promedio de calcemia fue menor respecto al observado en el grupo con VD >30ng/ml (9,3±0,6 vs. 9,8±0,3; p <0,05) y el promedio de PTH fue más elevado, aunque sin alcanzar significación estadística (96,9±88,7 vs. 42,2±22,9; p = ns). En el análisis de la masa ósea realizado en este subgrupo de pacientes, observamos una disminución significativa de la DMO de CE expresada en Z-score (-0,76±0,89 vs. 0,36±0,59; p = 0,01). No hubo diferencia en los valores de DMO de columna lumbar y de cuello de fémur (-0,73±0,92 vs. -0,50±1,46 y 0,04±1,13 vs. -0,25±1,1 respectivamente). En el grupo total presentaron osteoporosis y osteopenia en al menos una de las regiones evaluadas el 20 y 41,5% respectivamente; 6/34 pacientes (17,6%) tuvieron Z-score <-2 (tabla 4).
DiscusiónEl VIH es un retrovirus que infecta linfocitos CD4 y macrófagos ocasionando una inmunosupresión severa, pudiendo desencadenar sida. Diferentes desórdenes metabólicos y endocrinos han sido descriptos en individuos afectados con VIH, atribuidos a infecciones oportunistas, enfermedades malignas, producción de citoquinas, agentes terapéuticos utilizados, así como al VIH per se. La TARAA se asocia a varios efectos colaterales como anomalías en el metabolismo de los hidratos de carbono y lípidos, síndrome de lipodistrofia, disfunción gonadal, alteraciones en el metabolismo de la vitamina D y reducción en la masa ósea5–8.
La dislipemia es una complicación frecuente, especialmente en aquellos pacientes que reciben tratamiento con TARAA. No obstante, los cambios lipídicos han sido descriptos aun antes del uso de la misma, vinculándose al VIH per se y a factores inflamatorios. Su prevalencia varía entre 30 y 80%, siendo la más frecuente la hipertrigliceridemia (40 a 80%) seguida de hipercolesterolemia (10 a 50%)9. En nuestra población la dislipemia fue la alteración metabólica más frecuente, y su prevalencia fue similar a la descripta en la bibliografía.
En los pacientes VIH la dislipemia con frecuencia se asocia a otros factores de riesgo cardiovascular, como obesidad visceral, insulinorresistencia, diabetes, tabaquismo y HTA. En usuarios de TARAA el riesgo relativo de infarto de miocardio incrementa en 2 a 4 veces en los primeros 2 a 6 años de tratamiento10,11.
En nuestra población la prevalencia de coinfección con el virus de la hepatitis C (HCV) fue de 31,5% (18/57 pacientes). En otros estudios argentinos osciló entre 32 y 88,3%12. La infección con HCV se asocia a insulinorresistencia y a un estado protrombótico.
El desarrollo de insulinorresistencia y DBT en esta población es multifactorial. A los factores de riesgo conocidos se le suman los asociados a la infección por VIH. Los trastornos del metabolismo de los hidratos de carbono descriptos se incrementaron después de la introducción de la TARAA13–15.
En estos pacientes la glucemia de ayuno generalmente es normal, pero pueden presentar un test de tolerancia a la glucosa oral alterado. El riesgo de desarrollar diabetes es 4,6 veces mayor que en la población no VIH7. El 48% de nuestros pacientes presentó insulinorresistencia. En la población VIH tratada con TARAA la prevalencia de insulinorresistencia asciende a 60%16.
La coinfección con HCV incrementa el riesgo de DBT 3,7 veces en comparación con aquellos con VIH solo. La prevalencia reportada de insulinorresistencia en pacientes VIH coinfectados con HCV es del 27 y 29%. El hallazgo de una prevalencia mayor en esta cohorte (42,8%) podría deberse a la presencia de otros factores de riesgo no analizados en este trabajo17,18.
En la fisiopatología de la disfunción tiroidea en la infección por VIH, la autoinmunidad ha sido implicada en el hipertiroidismo, aunque su rol es menos claro para el hipotiroidismo. El tratamiento con TARAA incrementa la prevalencia de anomalías de la función tiroidea. En estadios tempranos de la infección con VIH los pacientes pueden presentar niveles normales de T3 y T4. Estadios más avanzados de la enfermedad se vinculan a niveles de T3 y T3 libre bajos asociados a elevación de rT3, consistente con enfermedad no tiroidea. La globulina fijadora de tiroxina puede estar elevada y correlaciona en forma negativa con el conteo de CD419.
La desregulación en la producción de citoquinas proinflamatorias, en especial IL-6 y TNFα, podría jugar un rol en el desarrollo de la disfunción tiroidea20.
El hipertiroidismo por enfermedad de Graves se presenta especialmente en el periodo de reconstitución inmunológica21–24. Su prevalencia es del 1,0 a 1,5%, ligeramente mayor que en la población general. En nuestro estudio dos pacientes presentaron hipertiroidismo por enfermedad de Graves, no pudiéndose constatar si fue durante el período de reconstitución inmunológica.
El hipotiroidismo clínico estuvo presente en 5,1% y el hipotiroidismo subclínico en 12,8%. En los pacientes VIH no tratados con TARAA, la prevalencia de hipotiroidismo subclínico se describe entre 7,7 y 10,6% y en los pacientes con TARAA la prevalencia se encuentra entre 1,2 y 17,6%. Su etiología no pareciera ser autoinmune pues en 50-80% de los casos tienen AcTPO negativos25,26.
No se conoce el efecto de la TARAA sobre la función tiroidea. Los inhibidores de la proteasa podrían afectar la regulación de la TSH, los inhibidores no nucleósidos de la transcriptasa reversa podrían interferir en la proliferación, diferenciación y reprogramación de las células tiroideas, y los inhibidores nucleósidos de la transcriptasa reversa serían tóxicos mitocondriales en las células foliculares27.
El tratamiento con estavudina y los niveles bajos de CD4 son factores de riesgo para el desarrollo de hipotiroidismo subclínico. Hay una correlación indirecta entre los niveles de CD4 y TSH, y una directa con los niveles de T3 libre y T4 libre28. Solo uno de nuestros pacientes recibía estaduvina y el bajo número de pacientes no permitió encontrar una relación con el nivel de CD4.
Esta población puede presentar hipotiroidismo central por infiltración hipotálamo-hipofisiaria. En estudios de autopsia se reporta el compromiso hipofisario por patógenos oportunistas y procesos neoplásicos, sin disfunción tiroidea pre mortem29.
El 20% de nuestra población tuvo ginecomastia. En todos, los niveles de hormonas sexuales y prolactina fueron normales, 4 tenían coinfección con HCV y 3 adicciones al alcohol y drogas. Todos se encontraban bajo tratamiento con TARAA.
La ginecomastia en la población con VIH se presenta en 2-5% vs. el 1% en la población no VIH30. Es más frecuente unilateral, obligando a excluir patología maligna (carcinoma de mama, sarcoma de Kaposi, linfoma, plasmocitoma, metástasis, etc.)31,32. Su patofisiología es multifactorial. El consumo de drogas ilícitas, la hepatitis viral, la inhibición del citocromo P-450 por la TARAA, y el síndrome de reconstitución inmunológica producen un aumento de la relación estrógeno/andrógeno por disminución del metabolismo de los estrógenos, desplazamiento de la proteína transportadora y disminución de la síntesis de testosterona. La hiperprolactinemia no se relaciona con la ginecomastia, salvo si se asocia a hipogonadismo hipogonadotrófico. En sujetos VIH positivos existe un aumento de la prevalencia de macroprolactinemia, posiblemente por aumento de autoanticuerpos33,34.
La prevalencia de insuficiencia adrenal en pacientes con sida antes del uso de TARAA era del 5 al 10%, asociada a infecciones oportunistas (citomegalovirus, criptococosis, tuberculosis, histoplasmosis, Pneumocystis carinii), procesos neoplásicos (sarcoma de Kaposi y linfoma)35–37 y la infección por VIH per se.
Esta población puede presentar niveles elevados de cortisol. El aumento de citoquinas como IL-6 e IL-1β estimulan la síntesis de glucocorticoides, por efecto sobre la adrenal y CRH38; también intervendría el estrés crónico y el aumento de producción de CBG39. La resistencia a cortisol fue descrita con clínica de insuficiencia adrenal asociado a hipercortisolemia e incremento moderado de ACTH40. Es más frecuente el deterioro sutil de la reserva adrenal, con deterioro de la respuesta adrenal al estímulo con ACTH, aun en pacientes asintomáticos41. En estadio severo de la enfermedad, el test con CRH demuestra deterioro de la reserva hipofisaria y adrenal en el 25% de los casos41. En nuestra población, todos los pacientes con insuficiencia adrenal tenían antecedentes de micosis sistémica. El déficit de mineralocorticoides puede presentarse como hipoaldosteronismo hiporreninémico o hiperreninémico42–44.
La disfunción gonadal es más frecuente en el varón que en la mujer45. Los estudios en mujeres reportan anovulación hasta en el 40% y menopausia precoz en el 8%46. El hipogonadismo primario o secundario está presente en un 50% de los hombres con sida. Con la introducción de TARAA la prevalencia disminuyó a un 20%47. La etiología es multifactorial. Se describen infecciones por gérmenes oportunistas a nivel gonadal y a nivel hipotálamo-hipofisario. El VIH ha sido identificado como patógeno testicular en el contexto de una respuesta inmune alterada y de enfermedad crónica grave48–50.
En nuestra población, el 10% de los varones y el 19% de las mujeres presentaban disfunción sexual. Los niveles de gonadotrofinas, hormonas sexuales y prolactina fueron normales.
Previo a la introducción de la TARAA, el compromiso óseo más frecuente era la infección por gérmenes oportunistas y la neoplasia. En la actualidad, se describen complicaciones óseas como osteopenia, osteoporosis y osteonecrosis. La prevalencia de osteopenia y osteoporosis se encuentra entre 23-50% y 11-21% respectivamente con o sin tratamiento con inhibidores de la proteasa51,52. En individuos con VIH, la osteoporosis es 3 a 4 veces más frecuente que en controles sanos, siendo responsable del aumento del riesgo de fracturas. Aun en ausencia de TARAA, tienen una mayor prevalencia de baja masa ósea, lo cual sugiere que el VIH per se puede ser un factor que contribuya a la pérdida de masa ósea53–55. En nuestro medio, Bruera et al. observaron que la densidad mineral ósea de columna, cuello de fémur y corporal total fue significativamente menor en los pacientes con VIH vs. los controles sanos y no encontraron diferencia entre los pacientes con o sin TARAA56. El 20 y el 41,5% de los pacientes de este ensayo presentaron osteoporosis y osteopenia respectivamente y el 17,6% tuvieron un Z-score <2,0.
Los inhibidores de proteasa inhiben la osteoblastogénesis y la expresión de la osteoprotegerina ocasionando un incremento de la osteoclastogénesis y de la resorción ósea; los inhibidores nucleósidos de la transcriptasa reversa incrementan el número de osteoclastos57,58.
El VIH promueve la resorción ósea por activación de los linfocitos T que al expresar RANKL (ligando del receptor activador del NF-KB), activan a los precursores de los osteoclastos y la activación de citoquinas proinflamatorias como IL-1 y TNFα. Este estado proinflamatorio a su vez aumenta la replicación del virus59. Aukrust et al. encontraron que la disminución de los niveles de osteocalcina y el aumento de los niveles de C-telopéptido correlacionan con los niveles de TNFα. El inicio de la TARAA se asocia a incremento de la osteocalcina y descenso de TNFα y de la carga viral60.
Los inhibidores nucleósidos de la transcriptasa reversa contribuyen a la pérdida de masa ósea al aumentar la pérdida de calcio ósea secundaria a la hiperlactacidemia61. Los inhibidores de proteasa en forma dosis dependiente deterioran la síntesis de VD y 1,25(OH)2VD y ejercen una ligera inhibición de la 24-hidroxilasa responsable del catabolismo de la 1,25(OH)2VD. El efecto neto es la disminución de la 1,25(OH)2VD, favoreciendo la desmineralización ósea y el deterioro de la respuesta inmune62.
El 66,4% de nuestra población presentó niveles de VD en rango de insuficiencia y el valor promedio de PTH fue mayor en este grupo. La DMO corporal total fue significativamente menor pudiendo reflejar el efecto deletéreo del hiperparatiroidismo secundario al déficit de VD.
En conclusión, el amplio espectro de afecciones endocrino-metabólicas asociadas a la infección con VIH resulta del efecto directo del VIH, la disfunción inmune asociada, infecciones oportunistas, procesos neoplásicos, por efecto de la TARAA y la respuesta endocrina secundaria al estrés por enfermedad crónica. La detección precoz de estas anomalías es de importancia para optimizar la calidad de vida en esta población.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Por la labor realizada a las Técnicas en Densitometría: Yanina Soledad Laguna y Graciela Antunovich.