La obesidad es el principal componente del síndrome metabólico (SM) y determina la progresión de la enfermedad a las complicaciones metabólicas. Los individuos obesos metabólicamente sanos (OMS) parecen estar protegidos contra esas complicaciones. La longitud de los telómeros (LT) es un nuevo marcador del envejecimiento celular, que tiene una relación compleja con el SM. El objetivo principal de este estudio fue investigar por primera vez la LT en OMS y estudiar la asociación entre LT y el número de componentes del SM.
Se estudió a 398 mujeres con una edad media de 46,76±15,47 años (rango: 18-86 años), que se agruparon en: individuos con normopeso sin ningún componente del SM (NP0), obesos sin SM (OMS) y de acuerdo con el número de componentes de SM en los grupos sin ningún componentes de SM (0), con uno o 2 componentes (1+2) y con SM por la presencia de 3 o más componentes (SM).
La LT de los OMS no se diferenció de la de los NP0, pero fue significativamente mayor que la de los individuos con SM (p=0,032). Se observó una disminución de la LT con el aumento progresivo del número de componentes del SM (p=0,004), en donde el grupo 0 presentó una LT significativamente mayor que los grupos 1+2 (p=0,027) y SM (p=0,003).
Demostramos por primera vez que las mujeres OMS presentan una LT similar a las mujeres NP0 y más larga que aquellas mujeres con SM. Además, confirmamos que la LT se acorta con el aumento en el número de alteraciones del SM.
Obesity is the principal component in Metabolic Syndrome (MetS) and determines the progression of metabolic complications. Metabolically healthy obese individuals (MHO) seem to be protected against those complications. Telomere length (TL), as a novel marker of cellular aging, has a complex relationship with MetS. The principal aim of this study was to investigate TL in MHO, and to study the association between TL and the number of MetS components.
A study was conducted on 398 women (mean age: 46.76±15.47 years; range: 18 - 86 years), grouped according to the number of MetS components (0, 1+2, MetS), a group of normal-weight individuals with 0 MetS components (NW0), and a group of obese without MetS (MHO).
No differences were found in the TL of the MHO group compared to the NW0, but it was significantly higher than that of individuals with MetS (P=.032). A decrease in TL was observed with a progressive increase in the number of MetS components (P=.004), whereas the group of individuals without MetS components had significantly longer TL than the groups with 1 and 2 components (P=.027), and MetS (P=.003).
Shorter TL is not associated with MHO, but is related to MetS and with an increased number of metabolic abnormalities.
El síndrome metabólico (SM) es un conjunto de factores de riesgo cardiometabólico que predisponen al desarrollo de diabetes mellitus tipo 2 (DM2) y enfermedad cardiovascular (ECV). Este conjunto de alteraciones metabólicas incluye obesidad central, hipertensión arterial, hiperglucemia y dislipidemia aterogénica, caracterizada por hipertrigliceridemia y descenso del colesterol de lipoproteínas de alta densidad (cHDL). La obesidad, y fundamentalmente la obesidad de origen central o visceral, se constituye en el principal componente del SM, que determina la progresión a estas complicaciones metabólicas1. En Argentina, al igual que en otros países latinoamericanos y en la mayoría de los países industrializados, alrededor de 2 tercios de la población general presenta sobrepeso u obesidad2. Además, hemos participado de un estudio de prevalencia reciente donde hemos podido confirmar el aumento de la prevalencia de obesidad en nuestro medio3.
Un subgrupo de individuos obesos, denominados obesos metabólicamente sanos (OMS), parece estar protegido contra el desarrollo del SM4. La existencia de individuos OMS fue propuesta por primera vez por Sims en 20015, quien consideró que alrededor del 15 al 20% de las personas con obesidad pueden estar libres de las alteraciones metabólicas que constituyen el SM por un período no determinado en esa época. Distintos autores han propuesto diferentes definiciones del fenotipo OMS de acuerdo con la presencia de las anormalidades metabólicas del SM. En este sentido, una de las definiciones más apropiadas y aceptadas es la que surge de un consenso internacional de sociedades médicas, la que define a los individuos OMS como aquellos individuos obesos que presentan como máximo 2 de las alteraciones metabólicas características del SM6. Actualmente, la prevalencia de OMS en los diferentes trabajos publicados se encuentra entre un 10 y un 40%. Esta amplia variación es debida a la utilización de diferentes criterios de reclutamiento a partir del empleo de diferentes definiciones y a diferencias étnicas, sociales y genéticas7. Este es un nuevo concepto a partir del cual un individuo presenta un fenotipo obeso pero sin el acompañamiento de las otras alteraciones metabólicas que caracterizan al SM y, por lo tanto, no presentan un riesgo incrementado de mortalidad, ECV o DM28. Recientemente fue reconocido en un metaanálisis que el riesgo de desarrollar ECV entre los OMS era significativamente menor que en el grupo obeso metabólicamente enfermo (OR=1,24, IC del 95%=1,02-1.55 vs. OR=2,65; IC del 95%=2,18-3.12, respectivamente9). Un seguimiento durante 12 años de 61.299 individuos en Noruega determinó que los OMS no tenían mayor riesgo de infarto agudo de miocardio10.
Otro punto importante a tener en cuenta con respecto a los individuos OMS es si se mantienen metabólicamente sanos a lo largo del tiempo. En este sentido, un estudio longitudinal que siguió a estos pacientes durante 8,2 años estableció que el 67% mantenía un estado metabólico sano11.
En su conjunto, las enfermedades metabólicas crónicas, como la obesidad, el SM y la DM2, están característicamente relacionadas con aquellas alteraciones moleculares que se relacionan con el envejecimiento. La longitud telomérica (LT) constituye un nuevo biomarcador de envejecimiento celular, donde una LT menor indica un aumento de la edad biológica y se ha asociado con un mayor riesgo de morbimortalidad cardiovascular12. Los telómeros son complejos núcleo-proteicos localizados en los extremos de los cromosomas eucariotas, compuestos por un tándem repetitivo de ADN (TTAGGG) y proteínas asociadas, que desempeñan un papel esencial en la integridad y la estabilidad del cromosoma, constituyéndose en un factor crítico de la sobrevida celular13. Durante la replicación celular, el tamaño de los telómeros puede sufrir una reducción de alrededor de 20 a 40 kilopares de bases (kpb) por año. Estudios in vitro han demostrado que cuando el tamaño de los telómeros alcanza un umbral de acortamiento crítico, se detiene la división celular y se promueve la senescencia replicativa, contribuyendo así al envejecimiento y a la subsecuente muerte de la célula14.
La LT es menor en situaciones patológicas como el SM y se relaciona con situaciones biológicas de estrés oxidativo y envejecimiento, con impacto funcional sobre tejidos clave como el tejido adiposo, el hígado y el páncreas15. No se ha estudiado la LT en grupos particulares como OMS e individuos con normopeso sin componentes del SM (NP0). En este contexto, el objetivo principal de este estudio fue investigar la LT en un grupo de individuos con OMS, comparado con un grupo de obesos con SM y un grupo control de individuos NP0. La importancia de contar con una adecuada identificación clínica, bioquímica y genética de los individuos con OMS radica en el hecho que este grupo presenta una menor progresión a ECV que los obesos con presencia de alteraciones metabólicas. Un segundo objetivo del estudio fue evaluar la LT de acuerdo al número de componentes del SM.
Material y métodosPoblaciónDe un total de 641 individuos de la población general de Venado Tuerto, provincia de Santa Fe, reclutados aleatoriamente en 2011 a través de un diseño de muestreo polietápico estratificado, se seleccionó a 398 mujeres para su inclusión en el presente estudio. Esta población se separó en 3 grupos: 1) SM según los criterios del ATP III1; 2) OMS como individuos con obesidad (índice de masa corporal [IMC]>30kg/m2), pero sin SM6, y 3) un grupo de individuos con peso normal (IMC<25kg/m2) y sin ningún componente del SM (NP0). Con el fin de estudiar la asociación entre la LT y el empeoramiento de la condición metabólica, se crearon 2 grupos extra: individuos sin ningún componente del SM (grupo 0) e individuos con uno o 2 componentes del SM (grupo 1+2).
El estudio fue aprobado por el Comité de Ética del Hospital de Venado Tuerto. Todos los participantes dieron su consentimiento informado por escrito.
Las medidas antropométricas (altura, peso y circunferencia de la cintura) y presión arterial sistólica y diastólica (PAS y PAD, respectivamente) se determinaron mediante un protocolo estandarizado. El IMC se calculó como el peso (kg)/altura (m)2.
Después de 12 h de ayuno, se tomaron las muestras de sangre venosa (20ml) a cada individuo. Una alícuota de sangre se congeló a –20°C y se reservó para la extracción de ADN. La alícuota restante se centrifugó y se analizó inmediatamente.
La glucemia sérica en ayunas se determinó mediante un método de glucosa-oxidasa (GLU glucosa GOD-PAP, Roche Diagnostics, Mannheim, Alemania) en un autoanalizador Hitachi 727. La insulinemia sérica en ayunas se midió por inmunoanálisis de electroquimioluminiscencia con un kit comercial (insulina, Roche Diagnostics, Mannheim, Alemania) en un Cobas E411 (Roche Diagnostics, Mannheim, Alemania), con un límite de detección de 2 mU/ml.
Como indicador de insulinorresistencia se utilizó el índice Homoeostasis Model Assessment (HOMA), calculado como glucemia (mM)×insulinemia (mUI/l)/22,5.
Los triglicéridos (TG) y el cHDL se determinaron en suero utilizando procedimientos estandarizados por métodos enzimáticos con kits comerciales (TG Triglicéridos GPO-PAP, COL Colesterol CHOD-PAP y fosfotungstato precipitante, Roche Diagnostics, Mannheim, Alemania), utilizando un autoanalizador Hitachi 727. Los intra-CV (coeficiente de variación) para TG y CT fueron del 1,3 y el 1,1%, respectivamente, y los inter-CV fueron del 2,4 y el 1,5%, respectivamente.
Los niveles séricos de proteína C reactiva ultrasensible (PCR-us) se midieron utilizando inmunonefelometría (Cardio Phase® hsCRP, Siemens Healthcare Diagnostics, Deerfield, EE. UU.) en un Siemens BN perspectiva Nefelómetro (Siemens Healthcare Diagnostics, Deerfield, EE. UU.). Consideramos que los valores de PCR-us>10mg/l representan una respuesta inflamatoria aguda16.
Determinación de la longitud telomérica absolutaLa medición de la LT absoluta se llevó a cabo por PCR cuantitativa en tiempo real como se ha descrito previamente17, en un sistema LightCycler (Roche Diagnostics, Mannheim, Alemania). Brevemente, el ADN genómico fue extraído de leucocitos de sangre periférica. Para cada muestra de ADN se realizaron 2 reacciones consecutivas: la primera para amplificar un fragmento de 75 pb del gen RPLPO (proteína ribosomal grande PO), un gen de copia única, y la segunda para la secuencia telomérica. Ambas PCR se realizaron en un volumen final de 20 μl que contenían 20 ng de DNA, 1X SYBR Green Master Mix (Roche Diagnostics, Mannheim, Alemania) y 250nM o 100nM de primers de RPLPO y telómeros, respectivamente. Las condiciones de PCR fueron: 10min a 95°C, 45 ciclos de 15 s a 95°C y 1min a 60°C. La curva de fusión se realizó con un ciclo de 20 s a 95°C, 15 s a 50° y 98°C con una rampa de temperatura de 0,1°C/s.
Cada muestra se analizó por duplicado y todas las determinaciones incluyeron la determinación de curvas de calibración y un control negativo sin templado, en el que el ADN fue sustituido por el agua. Las curvas de calibración se construyeron utilizando 5 diluciones seriadas de oligonucleótidos sintetizados que contienen el producto RPLP0 y un oligonucleótido que contienen la secuencia telomérica TTAGGG repetida 14 veces para la PCR de telómeros. Los valores que se obtuvieron de las curvas estándar fueron copias diploides del genoma/reacción para la PCR de RPLPO y kpb/reacción para PCR de los telómeros. El valor de kpb/reacción se divide por el número de copias diploides del genoma/reacción para calcular la LT absoluta en kpb de secuencias teloméricas por genoma diploide humana (relación T/S).
Para el análisis de la LT se calculó el logaritmo natural de la LT (lnLT) y lo transformó en una variable cualitativa ordinal teniendo en cuenta la media de la población (M) y su desviación estándar (DE). De esta manera, generamos 5 grupos de acuerdo con los siguientes rangos: lnLT<M – 2 DE; M – 2 DE<lnLT<M – DE; M – DE<lnLT<M+DE; M+DE<lnLT<M+2 DE, y lnLT>M+2 DE.
Evaluación estadísticaLos análisis estadísticos se realizaron con SPSS versión 20.0 (IBM Corp., Armonk, Nueva York, EE. UU.). De acuerdo con el teorema central del límite, debido al número de pacientes incluidos, se trataron todas las variables como con distribución normal. Utilizamos ANOVA de una vía y test post hoc DMS para comparar las características bioquímicas, clínicas, antropométricas y la LT de cada grupo. Se realizó regresión lineal para evaluar la relación entre la LT y la edad en la población general. El análisis de la LT en cada grupo según sus alteraciones metabólicas se realizó mediante regresión lineal múltiple y el estudio de variables ficticias, con la edad como variable independiente con el fin de eliminar su influencia. Un valor de p inferior a 0,05 fue considerado estadísticamente significativo.
ResultadosLa población estudiada en este trabajo consistió en 398 mujeres con una edad media ± DE de 46,76 ± 15,47 años (tabla 1). Las determinaciones bioquímicas, clínicas, antropométricas y de la LT permitieron caracterizar a la población general y a cada grupo (tabla 1).
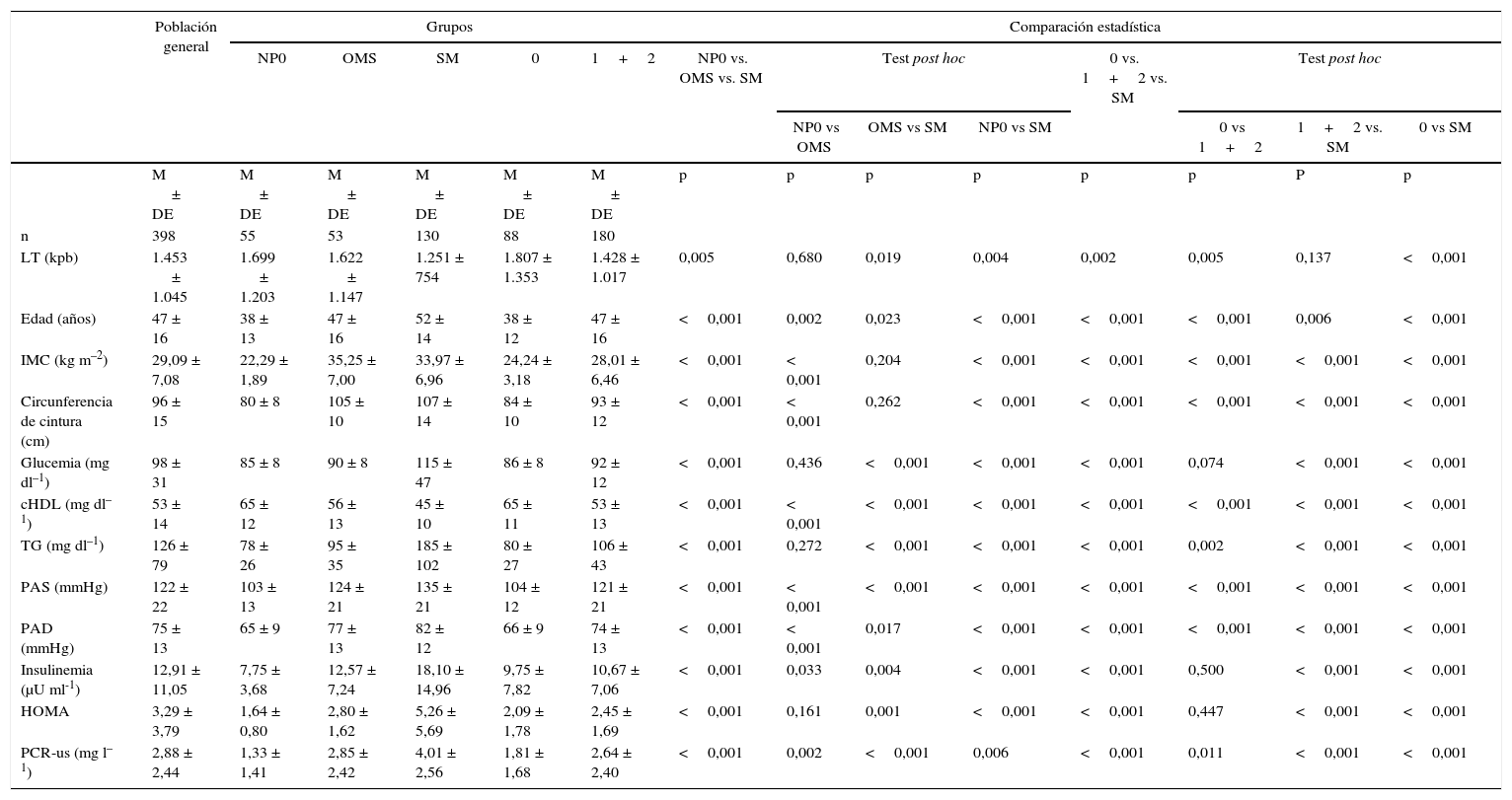
Características bioquímicas, clínicas y antropométricas para la población general y los grupos de individuos con normopeso sin ningún componentes del síndrome metabólico, obesos metabólicamente sanos, síndrome metabólico, individuos sin ningún componente de síndrome metabólico e individuos con uno y 2 componentes de síndrome metabólico
| Población general | Grupos | Comparación estadística | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NP0 | OMS | SM | 0 | 1+2 | NP0 vs. OMS vs. SM | Test post hoc | 0 vs. 1+2 vs. SM | Test post hoc | ||||||
| NP0 vs OMS | OMS vs SM | NP0 vs SM | 0 vs 1+2 | 1+2 vs. SM | 0 vs SM | |||||||||
| M ± DE | M ± DE | M ± DE | M ± DE | M ± DE | M ± DE | p | p | p | p | p | p | P | p | |
| n | 398 | 55 | 53 | 130 | 88 | 180 | ||||||||
| LT (kpb) | 1.453 ± 1.045 | 1.699 ± 1.203 | 1.622 ± 1.147 | 1.251 ± 754 | 1.807 ± 1.353 | 1.428 ± 1.017 | 0,005 | 0,680 | 0,019 | 0,004 | 0,002 | 0,005 | 0,137 | <0,001 |
| Edad (años) | 47 ± 16 | 38 ± 13 | 47 ± 16 | 52 ± 14 | 38 ± 12 | 47 ± 16 | <0,001 | 0,002 | 0,023 | <0,001 | <0,001 | <0,001 | 0,006 | <0,001 |
| IMC (kg m–2) | 29,09 ± 7,08 | 22,29 ± 1,89 | 35,25 ± 7,00 | 33,97 ± 6,96 | 24,24 ± 3,18 | 28,01 ± 6,46 | <0,001 | < 0,001 | 0,204 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 |
| Circunferencia de cintura (cm) | 96 ± 15 | 80 ± 8 | 105 ± 10 | 107 ± 14 | 84 ± 10 | 93 ± 12 | <0,001 | < 0,001 | 0,262 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 |
| Glucemia (mg dl–1) | 98 ± 31 | 85 ± 8 | 90 ± 8 | 115 ± 47 | 86 ± 8 | 92 ± 12 | <0,001 | 0,436 | <0,001 | <0,001 | <0,001 | 0,074 | <0,001 | <0,001 |
| cHDL (mg dl–1) | 53 ± 14 | 65 ± 12 | 56 ± 13 | 45 ± 10 | 65 ± 11 | 53 ± 13 | <0,001 | < 0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 |
| TG (mg dl–1) | 126 ± 79 | 78 ± 26 | 95 ± 35 | 185 ± 102 | 80 ± 27 | 106 ± 43 | <0,001 | 0,272 | <0,001 | <0,001 | <0,001 | 0,002 | <0,001 | <0,001 |
| PAS (mmHg) | 122 ± 22 | 103 ± 13 | 124 ± 21 | 135 ± 21 | 104 ± 12 | 121 ± 21 | <0,001 | < 0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 |
| PAD (mmHg) | 75 ± 13 | 65 ± 9 | 77 ± 13 | 82 ± 12 | 66 ± 9 | 74 ± 13 | <0,001 | < 0,001 | 0,017 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 |
| Insulinemia (μU ml-1) | 12,91 ± 11,05 | 7,75 ± 3,68 | 12,57 ± 7,24 | 18,10 ± 14,96 | 9,75 ± 7,82 | 10,67 ± 7,06 | <0,001 | 0,033 | 0,004 | <0,001 | <0,001 | 0,500 | <0,001 | <0,001 |
| HOMA | 3,29 ± 3,79 | 1,64 ± 0,80 | 2,80 ± 1,62 | 5,26 ± 5,69 | 2,09 ± 1,78 | 2,45 ± 1,69 | <0,001 | 0,161 | 0,001 | <0,001 | <0,001 | 0,447 | <0,001 | <0,001 |
| PCR-us (mg l–1) | 2,88 ± 2,44 | 1,33 ± 1,41 | 2,85 ± 2,42 | 4,01 ± 2,56 | 1,81 ± 1,68 | 2,64 ± 2,40 | <0,001 | 0,002 | <0,001 | 0,006 | <0,001 | 0,011 | <0,001 | <0,001 |
Comparación estadística entre los grupos: ANOVA de una vía y test post hoc DMS.
cHDL: colesterol de lipoproteínas de alta densidad; DE: desviación estándar; HOMA: Homoeostasis Model Assessment como indicador de insulinorresistencia; IMC: índice de masa corporal; LT: longitud telomérica; M: media; NP0: grupo de individuos normopeso sin ningún componente del síndrome metabólico; OMS: obesos metabólicamente sanos; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PCR-us: proteína C reactiva ultrasensible; SM: síndrome metabólico; TG: triglicéridos; 0: grupo de individuos sin ningún componente del síndrome metabólico; 1+2: grupo de individuos con uno o 2 componentes del síndrome metabólico.
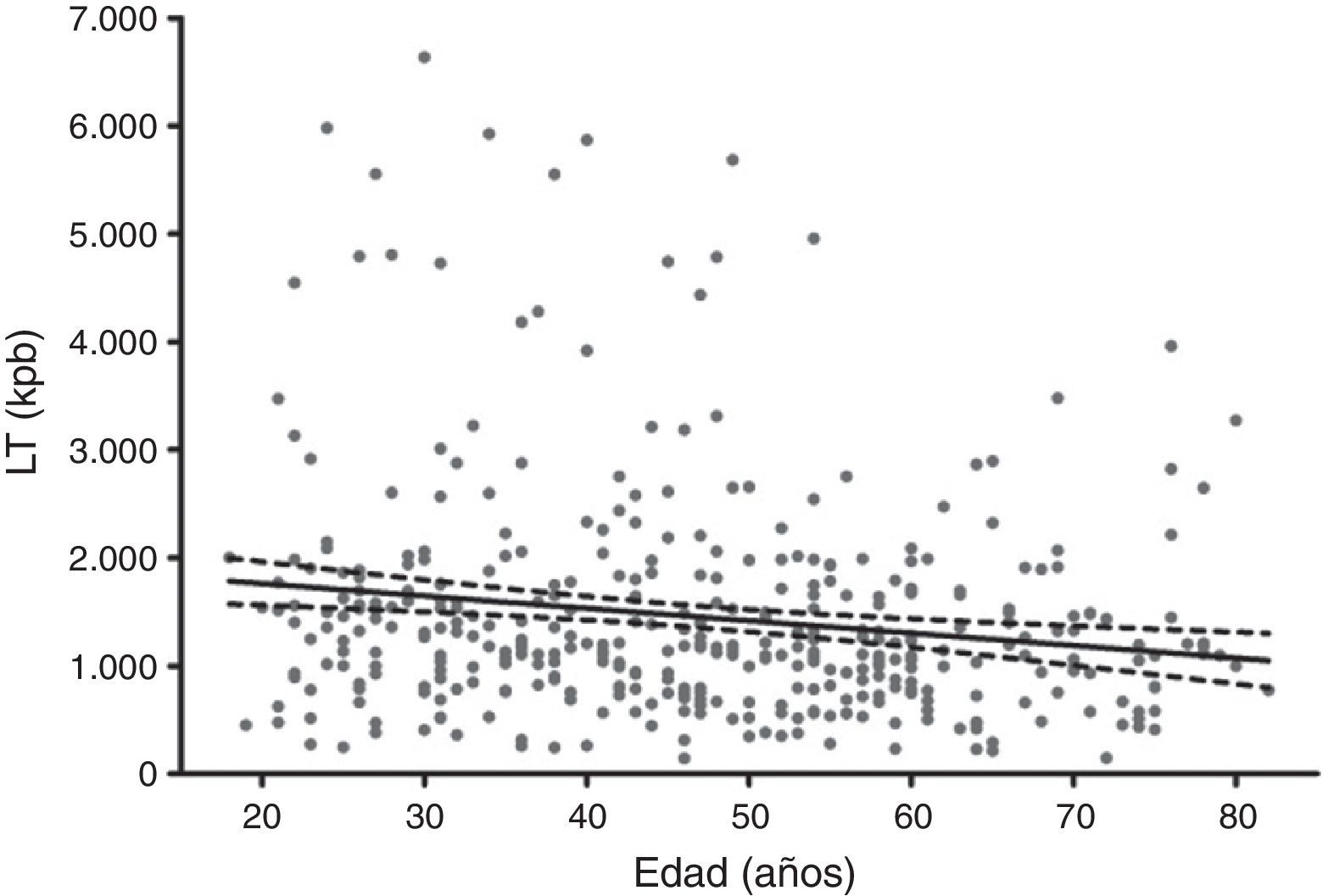
El promedio de la LT de la población general fue 1.453 ± 1.045 kpb. En el estudio de la LT en función de la edad para la población general, se observó una disminución significativa de la LT con la progresión de la edad (p=0,001; β=–11.505; IC del 95%=ß –18.041/–4.969) (fig. 1).
El 13,82% de las mujeres (n=55) fueron NP0, el 13,32% (n=53) fueron OMS y el 32,66% (n=130) presentó SM. El 40,20% restante (n=160) no presentó características de ninguno de los grupos, por lo cual no fue considerado en esta parte del estudio. Todas las características bioquímico-clínicas analizadas mostraron diferencias estadísticamente significativas entre los grupos. La prueba post hoc mostró que estas diferencias se mantienen significativas al comparar los grupos NP0 y SM. La comparación entre grupos OMS y NP0 no mostró diferencias en LT, glucemia, HOMA y TG. Entre los grupos OMS y SM, hubo diferencias en la edad, LT, glucemia, insulinemia, HOMA, cHDL, TG, PAS y PAD (tabla 1).
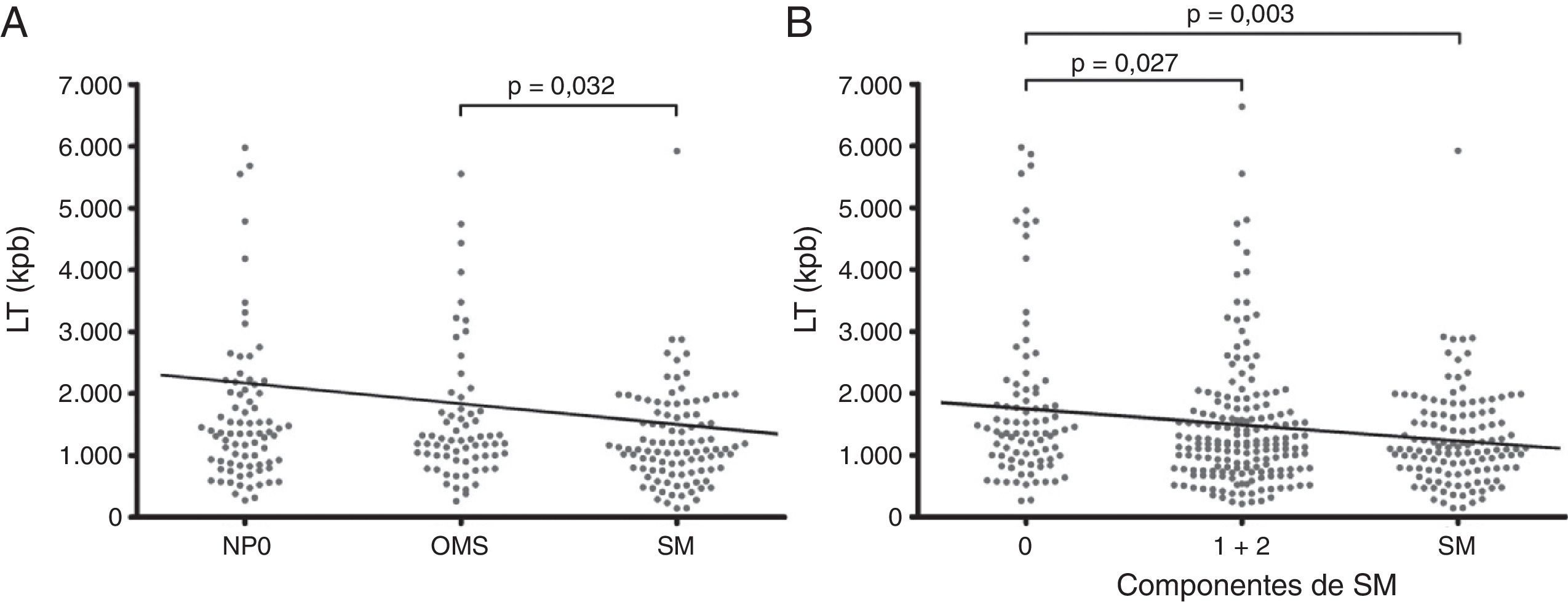
En la tabla 1 se puede observar que el estudio de la LT entre los grupos NP0, OMS y SM mostró diferencias significativas entre los 3 grupos (p=0,005) y la prueba post hoc mostró diferencias en particular entre los OMS vs. SM (p=0,019) y NP0 vs. SM (p=0,004). No se encontraron diferencias entre los grupos NP0 y OMS (p=0,680). La media del lnLT fue 7,07±0,64, con lo cual se utilizaron los siguientes rangos para generar 5 grupos de lnLT: inferiores a 5,77; entre 5,78 y 6,42; entre 6,43 y 7,72; entre 7,73 y 8,37, y mayor que 8,38. Con el uso de la edad como covariable para eliminar su influencia, encontramos diferencias significativas entre los grupos OMS y SM (p=0,032; β=0,240; IC del 95% β=0,021/0,460) (fig. 2A).
Longitud telomérica de cada individuo (•) para los grupos de individuos normopeso sin ningún componentes del síndrome metabólico, obesos metabólicamente sanos y síndrome metabólico (A), y de acuerdo con el número de componentes del síndrome metabólico (B). Regresión lineal múltiple con edad como covariable (−) y estudio de variables ficticias.
LT: longitud telomérica; NP0: grupo de individuos normopeso sin ningún componente del síndrome metabólico; OMS: obesos metabólicamente sanos; SM: síndrome metabólico.
En la población agrupada de acuerdo con el número de componentes del SM, el 22,11% (n=88) de las mujeres no presentaron ningún componente del SM (grupo 0) y el 45,23% (n=180) presentó uno o 2 componentes (grupo 1+2). Todas las características bioquímico-clínicas mostraron diferencias estadísticamente significativas entre los 3 grupos. La comparación post hoc entre cada par de grupos mostró las mayores diferencias entre los grupos 0 y SM. No se encontraron diferencias estadísticas para la glucemia, la insulinemia, el HOMA y CT entre los grupos 0 y 1+2, y la LT no se diferencia al comparar los grupos 1+2 vs. SM (tabla 1). La comparación de la LT también mostró diferencias significativas entre los 3 grupos (p=0,002, tabla 1). Se observó una disminución de la LT con el aumento progresivo en el número de componentes SM, donde el estudio post hoc mostró diferencias en particular entre los grupos 0 vs. 1+2 (p=0,005) y 0 vs. SM (p<0,001), pero no entre los grupos 1+2 y SM (p=0,137). Esta asociación entre la LT y el número de componentes del SM sigue siendo significativa incluso con la corrección de la edad (p=0,004; β=–212.405; IC del 95% β=–357.535/–67.276). El estudio de variables ficticias confirmó las diferencias entre los grupos 0 vs. 1+2 (p=0,027; β=304.108; IC del 95% β=34.955/573.262) y 0 vs. SM (p=0,003; β=442.408; IC del 95% β=148.774 / 736.042) (fig. 2 B).
DiscusiónHemos descripto por primera vez que el grupo de mujeres OMS no presentó diferencias en la LT con respecto a los NP0, mientras que sí presentó diferencias significativas con respecto al grupo con SM. De esta forma, los OMS se definirían como un subgrupo de pacientes obesos con un genotipo metabólico similar al de los individuos NP0, pero significativamente diferente del de las personas obesas con SM.
El grupo de OMS comparado con aquellas mujeres con SM presentaron IMC, circunferencia de cintura y niveles de PCR-us similares, pero presentaron niveles significativamente más bajos en las variables metabólicas, como TG, glucemia y HOMA. Así, las OMS presentan un fenotipo metabólico intermedio entre los individuos NP0 y las personas obesas con SM.
Los estudios clínicos de seguimiento para investigar el riesgo cardiovascular y la mortalidad ubican al grupo OMS como clínicamente intermedio entre aquellos individuos con peso normal y aquellos con SM. Estos pacientes no presentaron un riesgo cardiovascular aumentado con respecto a los no obesos sanos18. Otro estudio que también siguió a los pacientes por 7,4 años demostró que el grupo OMS presentó menor riesgo cardiovascular que los individuos no obesos metabólicamente enfermos19.
Otro de los hallazgos observado en nuestro trabajo fue una asociación entre menores valores de LT y un mayor número de componentes SM, lo cual apoya la relación entre el acortamiento de los telómeros y la gravedad metabólica. De acuerdo con nuestros resultados, un trabajo reciente relacionó una LT menor con un mayor número de componentes del SM, representando un perfil metabólico más grave20. En un estudio de seguimiento a 7 años, los individuos con mayor LT en la etapa basal fueron los que presentaron menor incremento en el IMC y en la grasa corporal21.
La LT debe ser entendida como una variable dinámica, que depende, entre otras cosas, de las condiciones del estilo de vida y del estado metabólico. En un trabajo reciente de seguimiento a 6 años fueron estudiados 3.600 pacientes, de los cuales el 44% presentó un acortamiento en la LT, en el 22% se mantuvo estable y se alargó en el 34% de los individuos estudiados22,23. De esta forma, la LT depende de variables no modificables como la edad, la genética y el género, y de variables modificables como los diferentes componentes del SM, la actividad física, el tabaquismo o la dieta24-26.
Para definir si el acortamiento de la LT es una causa o una consecuencia del empeoramiento de las alteraciones metabólicas, son necesarios nuevos estudios para establecer el papel de la inflamación, la resistencia a la insulina y sobre todo el estrés oxidativo, vía final común de las alteraciones metabólicas que caracterizan el SM. En el presente estudio, los OMS y los pacientes con SM presentaron similares niveles de PCR-us pero estos últimos tuvieron menor LT.
En conclusión, estamos demostrando por primera vez que las mujeres OMS presentan una LT similar a las mujeres con peso normal y sin componentes de SM pero más larga que las mujeres con SM. Además, confirmamos que el acortamiento de la LT se asocia con la presencia de un mayor número de alteraciones del SM.
Estos hallazgos pueden ser importantes en la interpretación fisiopatológica y clínica de los pacientes OMS.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.