El advenimiento de la terapia con inhibidores multicinasas (IMK) representó un cambio radical en el tratamiento de pacientes con carcinoma avanzado de tiroides. Hasta la fecha, 2 fármacos se encuentran aprobados por la Asociación Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) en Argentina: sorafenib, para pacientes con carcinoma diferenciado de tiroides radiorresistente, y vandetanib, para aquellos con carcinoma medular de tiroides (enfermedad progresiva y/o sintomática). Los estudios de fase iii han demostrado que estos fármacos aumentan significativamente la supervivencia libre de progresión en este grupo de pacientes. Si bien tienen una indicación precisa, su manejo requiere de un equipo multidisciplinario en contacto estrecho con un paciente involucrado en su tratamiento. Los efectos adversos de sorafenib y vandetanib son frecuentes, sin embargo, muchos de ellos disminuyen con el tiempo y la mayoría puede manejarse a menudo sin disminuir la dosis ni suspender el fármaco. El conocimiento del correcto manejo de los efectos adversos por parte del equipo tratante constituye una herramienta fundamental para poder educar al paciente y, consecuentemente, poder prevenirlos o minimizarlos, y de esta manera evitar complicaciones severas. El objetivo de esta publicación es brindar una guía para el diagnóstico y tratamiento de los efectos adversos de estos IMK y, por otro lado, presentar la iniciativa del Hospital de Clínicas de la Universidad de Buenos Aires en cuanto a la implementación de la misma.
The advent of multikinase inhibitors therapy has led to a radical change in the treatment of patients with advanced thyroid carcinoma. The ANMAT (the Argentinian regulatory health agency) has currently approved sorafenib for patients with radioiodine resistant differentiated thyroid carcinoma, and vandetanib for patients with medullary thyroid carcinoma (progressive and/or symptomatic disease). It has been demonstrated by phase iii clinical trials that these drugs improve progression free survival in this group of patients. Although they have a precise indication, an interdisciplinary team in close contact with a committed patient, are required for their effective management.
The adverse events of these drugs are common, but many of them may ameliorate over time, and most of them are manageable, even without the need for dose reduction or drug withdrawal. Knowledge of the correct management of the adverse events is a fundamental tool for the medical team and for the patient to prevent or minimise them, to avoid serious complications and to obtain better patient compliance. The primary objective of this article is to provide a guideline for the diagnosis and treatment of the adverse events produced by the multikinase inhibitors, and to present the initiative of the Hospital de Clinicas in order to implement these guidelines.
El cáncer diferenciado de tiroides es la neoplasia endocrina maligna más común y constituye del 1 al 2% de todos los cánceres1. La mayoría de los pacientes se presenta con enfermedad localizada cervical, con un pronóstico excelente y una supervivencia mayor del 97% a los 10 años1. Sin embargo, un subgrupo de pacientes, menos del 10%, presentará metástasis a distancia, y 2 tercios de ellos se volverán refractarios al tratamiento con yodo radiactivo2, con disminución considerable de la supervivencia asociada a enfermedad específica que suele ser, en promedio, de 3 a 5 años desde el diagnóstico de la radiorrefractariedad2,3. Las posibilidades de remisión completa son escasas con cualquier tratamiento, una vez que aparecen metástasis a distancia radiorrefractarias (0-30%)3,4.
Por otro lado, el cáncer medular de tiroides, es una neoplasia neuroendocrina originada en las células parafoliculares o células C. En general, constituyen menos del 5% de todos los cánceres de tiroides5. En el 25% de los casos forma parte de los síndromes de neoplasias endocrinas múltiples y en el 75% restante se presenta de manera esporádica6. Desafortunadamente, muchos tumores medulares, principalmente los esporádicos, se diagnostican cuando presentan extensión extratiroidea o cuando desarrollaron metástasis a distancia5,6. En estos casos la supervivencia a 10 años se reduce a menos del 20%7.
En los últimos años, el tratamiento de los pacientes con tumores tiroideos avanzados (diferenciados y medulares) presentó un cambio radical con el advenimiento de las terapias contra blancos moleculares denominados inhibidores multicinasas (IMK). En nuestro país, se encuentran aprobados por la Asociación Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) 2 IMK: a) sorafenib para el tratamiento de pacientes con cáncer diferenciado de tiroides refractario al radioyodo avanzado y progresivo (local o a distancia), y b) vandetanib para pacientes con tumores medulares en la misma situación. Ambos fármacos fueron aprobados basados en 2 estudios de fase iii (el estudio DECISION para sorafenib y el estudio ZETA, para vandetanib)5,6.
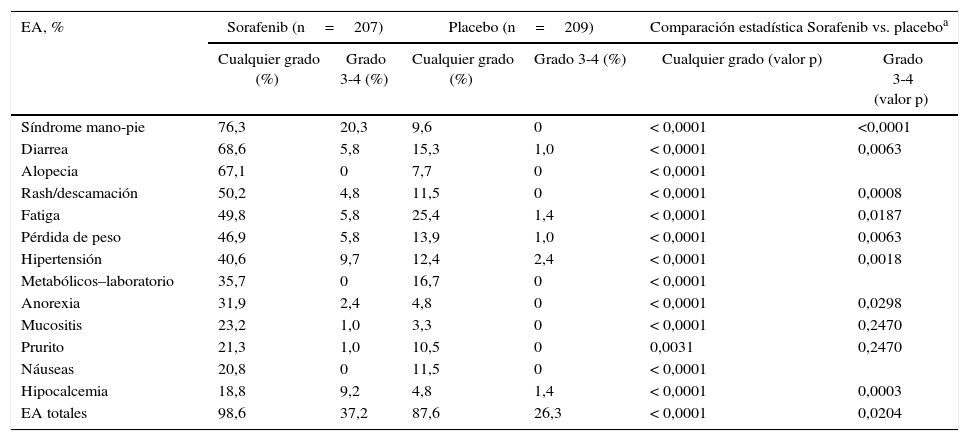
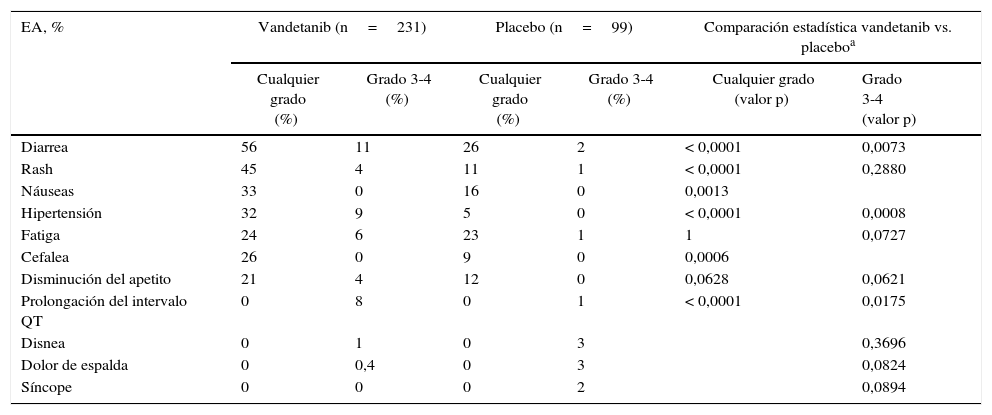
Estos fármacos han demostrado aumentar significativamente la supervivencia libre de progresión (tiempo de supervivencia durante y después del inicio de IMK, en el cual la enfermedad estructural permanece estable), en ambos grupos de pacientes (tabla 1)5,6. Ambos fármacos tienen una indicación precisa y requieren de un equipo multidisciplinario para el manejo de los efectos adversos (EA) que suelen aparecer luego de su indicación. Los EA reportados en ambos estudios de fase iii pueden apreciarse en las tablas 2 y 38,9.
Fármacos inhibidores multicinasas aprobados en Argentina para el tratamiento de cáncer avanzado de tiroides avanzado y progresivo luego de estudios en fase iii
| IMK | Blancos terapéuticos | Tipo de cáncer | n | RP+RC (%) | RP+RC+EE (%) | EE > 6 meses (%) | SLP mediana (meses) |
|---|---|---|---|---|---|---|---|
| Sorafenib | |||||||
| Brose et al.9 | VEGFR RET BRAF PDGFR c-KIT | Carcinoma diferenciado de tiroides refractario al radioyodo | 196 | 12,2 | 54,1 | 41,8 | 10,8 vs. 5,8 |
| Vandetanib | |||||||
Wells et al.8 | VEGFR RET EGFR | Carcinoma medular de tiroides | 231 | 45 | 87 | ND | 30,5a vs. 19,3 |
EE: enfermedad estable: ni incremento ni disminución suficiente en el tamaño de las lesiones que puedan ser considerados como RP, RC o progresión (aumento más del 20% en la suma de las lesiones dianas); ND: no disponible; RC: respuesta completa: desaparición de las lesiones dianas; RP: respuesta parcial: disminución de al menos el 30% de las sumas de los diámetros de las lesiones diana; SLP: supervivencia libre de progresión.
Efectos adversos presentados en el estudio DECISION (sorafenib)
| EA, % | Sorafenib (n=207) | Placebo (n=209) | Comparación estadística Sorafenib vs. placeboa | |||
|---|---|---|---|---|---|---|
| Cualquier grado (%) | Grado 3-4 (%) | Cualquier grado (%) | Grado 3-4 (%) | Cualquier grado (valor p) | Grado 3-4 (valor p) | |
| Síndrome mano-pie | 76,3 | 20,3 | 9,6 | 0 | < 0,0001 | <0,0001 |
| Diarrea | 68,6 | 5,8 | 15,3 | 1,0 | < 0,0001 | 0,0063 |
| Alopecia | 67,1 | 0 | 7,7 | 0 | < 0,0001 | |
| Rash/descamación | 50,2 | 4,8 | 11,5 | 0 | < 0,0001 | 0,0008 |
| Fatiga | 49,8 | 5,8 | 25,4 | 1,4 | < 0,0001 | 0,0187 |
| Pérdida de peso | 46,9 | 5,8 | 13,9 | 1,0 | < 0,0001 | 0,0063 |
| Hipertensión | 40,6 | 9,7 | 12,4 | 2,4 | < 0,0001 | 0,0018 |
| Metabólicos–laboratorio | 35,7 | 0 | 16,7 | 0 | < 0,0001 | |
| Anorexia | 31,9 | 2,4 | 4,8 | 0 | < 0,0001 | 0,0298 |
| Mucositis | 23,2 | 1,0 | 3,3 | 0 | < 0,0001 | 0,2470 |
| Prurito | 21,3 | 1,0 | 10,5 | 0 | 0,0031 | 0,2470 |
| Náuseas | 20,8 | 0 | 11,5 | 0 | < 0,0001 | |
| Hipocalcemia | 18,8 | 9,2 | 4,8 | 1,4 | < 0,0001 | 0,0003 |
| EA totales | 98,6 | 37,2 | 87,6 | 26,3 | < 0,0001 | 0,0204 |
Efectos adversos presentados en el estudio ZETA (vandetanib)8
| EA, % | Vandetanib (n=231) | Placebo (n=99) | Comparación estadística vandetanib vs. placeboa | |||
|---|---|---|---|---|---|---|
| Cualquier grado (%) | Grado 3-4 (%) | Cualquier grado (%) | Grado 3-4 (%) | Cualquier grado (valor p) | Grado 3-4 (valor p) | |
| Diarrea | 56 | 11 | 26 | 2 | < 0,0001 | 0,0073 |
| Rash | 45 | 4 | 11 | 1 | < 0,0001 | 0,2880 |
| Náuseas | 33 | 0 | 16 | 0 | 0,0013 | |
| Hipertensión | 32 | 9 | 5 | 0 | < 0,0001 | 0,0008 |
| Fatiga | 24 | 6 | 23 | 1 | 1 | 0,0727 |
| Cefalea | 26 | 0 | 9 | 0 | 0,0006 | |
| Disminución del apetito | 21 | 4 | 12 | 0 | 0,0628 | 0,0621 |
| Prolongación del intervalo QT | 0 | 8 | 0 | 1 | < 0,0001 | 0,0175 |
| Disnea | 0 | 1 | 0 | 3 | 0,3696 | |
| Dolor de espalda | 0 | 0,4 | 0 | 3 | 0,0824 | |
| Síncope | 0 | 0 | 0 | 2 | 0,0894 | |
El objetivo primario de esta publicación es brindar una guía para el diagnóstico y el tratamiento de los EA de estos IMK. Secundariamente, presentar la iniciativa del Hospital de Clínicas de la Universidad de Buenos Aires en cuanto a la implementación de la misma.
Posología y farmacocinéticaAmbos fármacos, sorafenib y vandetanib, se administran por vía oral y las dosis son de 800mg/día para sorafenib (en general, administradas 2 veces al día) y de 300mg/día para vandetanib (en una única toma diaria).
Vandetanib alcanza su pico plasmático entre 4 a 10 h luego de la administración, con una vida media de 19 días. Su excreción es principalmente por vía intestinal (heces en un 44%) y renal (25%)10,11. Asimismo, sorafenib se absorbe lentamente luego de su administración oral y suele alcanzar la concentración máxima plasmática entre 2,5 a 12,5 h12-14. Su biodisponibilidad es de entre el 38 y el 49%, y suele estar reducida a un 30% cuando el fármaco se administra con una comida rica en grasas12,13,15. Por lo tanto, sorafenib debería ingerirse sin alimentos concomitantes o con una comida con bajo contenido en grasas. El metabolismo de sorafenib se realiza por vía hepática y la excreción es principalmente digestiva12,13.
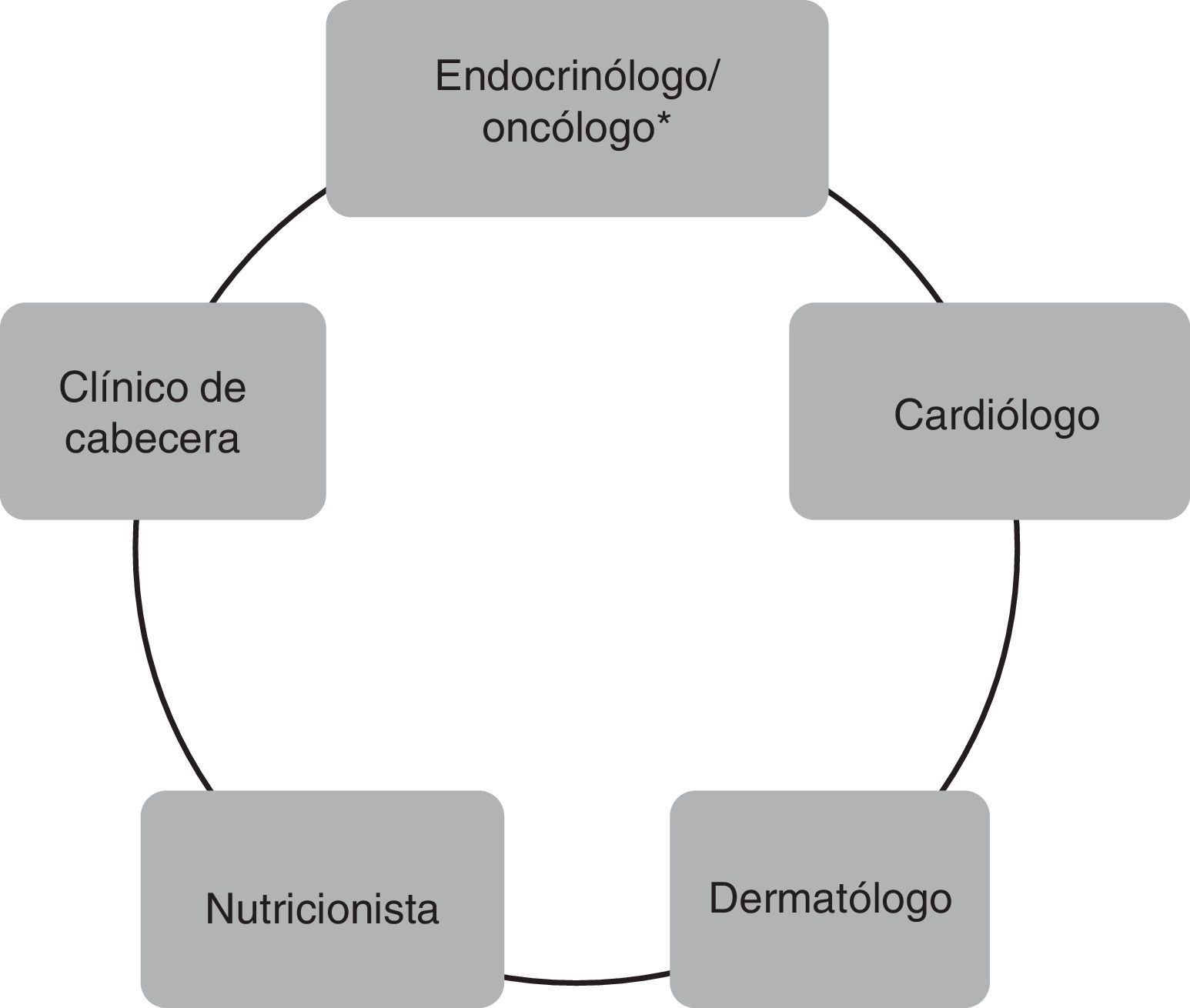
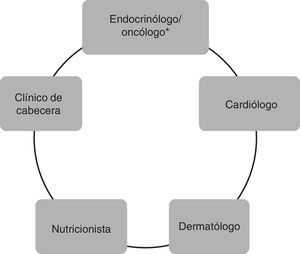
Manejo de los pacientes tratados con inhibidores multicinasasLa prescripción de estos fármacos requiere de un equipo multidisciplinario, tanto para las evaluaciones que son necesarias previas a la indicación, como las de los controles de EA que aparecerán inexorablemente en la mayoría de los pacientes. Este equipo multidisciplinario incluye al cuerpo médico tratante, en nuestro caso, médicos de la División Endocrinología del Hospital de Clínicas de la Universidad de Buenos Aires, y la estrecha interacción con múltiples otras especialidades, como puede apreciarse en la figura 1. Es claro que el médico tratante del paciente con cáncer de tiroides ha sido históricamente el endocrinólogo y, por lo tanto, es el que conoce habitualmente la historia natural de la enfermedad avanzada. Por otro lado, el médico oncólogo tiene mayor experiencia en el manejo de los IMK. Así que, habitualmente, la indicación y el seguimiento luego del inicio de IMK podrán realizarse de manera conjunta con ambas especialidades, dependiendo del centro asistencial.
Equipo multidisciplinario para el manejo de pacientes tratados con inhibidores multicinasas.
* En determinados centros, la indicación y el seguimiento de pacientes tratados con inhibidores multicinasas se realizan en forma conjunta entre el médico oncólogo y el médico endocrinólogo.
En nuestra División, además, existe un esquema práctico para el manejo del paciente tratado con estos fármacos. Cada paciente tiene un residente a cargo, que está en estrecho contacto con él ante cualquier eventualidad o EA. El residente, a su vez, se comunica con las 2 médicas coordinadoras de la terapia con IMK (E. Abelleira y A. Schmidt) y, finalmente, la información es reportada al jefe de la sección tiroides (F. Pitoia). Además, cada residente envía al final del día las evoluciones de EA en formato digital al jefe de la sección, para corroborar que no existieron situaciones que no hubieran sido consideradas previamente.
Más allá de la disponibilidad de un equipo médico con experiencia y capacitado para el manejo de estos fármacos, que sin dudas requiere de una curva de aprendizaje, existen varias consideraciones que se deben tener en cuenta en el momento del inicio de un IMK, estas son16:
- a.
Buen estado general del paciente y expectativa de vida aceptable: antes del inicio de cualquier IMK se debe hacer una evaluación exhaustiva del estado clínico del paciente se conoce poco acerca de la tolerancia de estos fármacos en pacientes con un estado funcional bajo (ECOG ≥ 2)17.
- b.
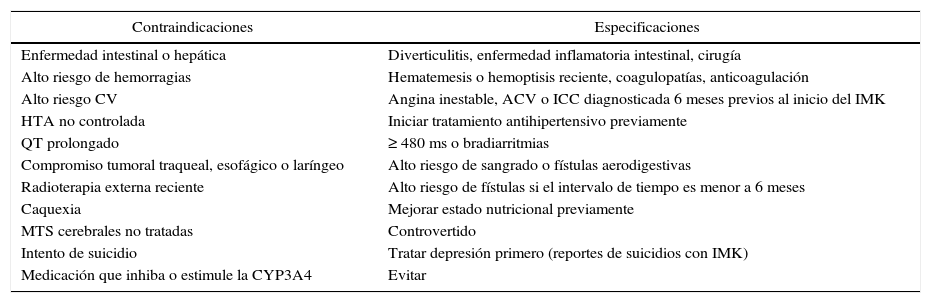
Ausencia de comorbilidades o contraindicaciones (tabla 4)18,19.
Tabla 4.Comorbilidades y contraindicaciones a considerar antes de la indicación de un inhibidor multicinasa
Contraindicaciones Especificaciones Enfermedad intestinal o hepática Diverticulitis, enfermedad inflamatoria intestinal, cirugía Alto riesgo de hemorragias Hematemesis o hemoptisis reciente, coagulopatías, anticoagulación Alto riesgo CV Angina inestable, ACV o ICC diagnosticada 6 meses previos al inicio del IMK HTA no controlada Iniciar tratamiento antihipertensivo previamente QT prolongado ≥ 480 ms o bradiarritmias Compromiso tumoral traqueal, esofágico o laríngeo Alto riesgo de sangrado o fístulas aerodigestivas Radioterapia externa reciente Alto riesgo de fístulas si el intervalo de tiempo es menor a 6 meses Caquexia Mejorar estado nutricional previamente MTS cerebrales no tratadas Controvertido Intento de suicidio Tratar depresión primero (reportes de suicidios con IMK) Medicación que inhiba o estimule la CYP3A4 Evitar ACV: accidente cerebrovascular; CV: cardiovascular; HTA: hipertensión arterial; ICC: insuficiencia cardíaca congestiva; IMK: inhibidor multicinasa; MTS: metástasis.
Adaptado de Haugen et al.19
- c.
Aceptación del tratamiento y el seguimiento: debido a la duración del tratamiento y a la toxicidad potencial de estos fármacos, todos los pacientes deben ser conscientes de que el seguimiento será estrecho y, en algunos casos, prolongado por años.
Además de la indicación formal de los IMK ante tumores avanzados localmente progresivos y/o metastásicos a distancia y potencialmente sintomáticos, los pacientes deben participar activamente en la decisión del inicio del tratamiento8,9.
En este contexto, el paciente y su familia deben tener conocimiento claro del tratamiento y se le deberán explicar ciertas situaciones: a) son fármacos citostáticos8,9, por lo tanto, lo que se espera de ellos es un aumento en la supervivencia libre de progresión de enfermedad (es decir, que detenga el crecimiento de las lesiones tumorales locales o metastásicas a distancia); b) aunque en ninguno de los estudios de fase iii se demostró un aumento de la supervivencia global8,9 (seguramente debido al cross-over entre el grupo de pacientes tratados con placebo a la rama abierta de tratamiento con el fármaco), lo más probable es que el incremento en la supervivencia libre de progresión se asocie a un aumento en la supervivencia global; c) en la mayoría de los casos se observará una resistencia secundaria al tratamiento con los IMK, lo que significará que la efectividad de estos fármacos será por un período variable, en general, no superará los 2 años8,9, y, por último, d) seguramente el paciente presentará algún EA durante el curso del tratamiento. Se debe ser claro con respecto a que la aparición de estos EA es impredecible, variable, transitoria en muchos casos y manejable en la mayoría. Los pacientes que están advertidos de los EA aceptan mejor los síntomas y son más propensos a seguir con el tratamiento20-25.
Todos los pacientes contarán con una evaluación previa al inicio del IMK (examen físico, laboratorio, evaluación cardiovascular, etc.) y controles seriados posteriores al inicio del tratamiento (tabla 5). El equipo médico deberá tener siempre disponible, cada vez que se evalúe a un paciente en tratamiento con IMK, la clasificación de EA de la CTCAE por sus siglas en inglés: Common Terminology Criteria for Adverse Events26 (tabla 6).
Evaluación realizada antes del inicio de sorafenib o vandetanib y controles posteriores, luego de la prescripción
| Basal | 1.er mes | 2.° mes | 3.° mes | 6.° mes | 8.° mes | 10.° mes | 12.° mes | 15.° mes | |
|---|---|---|---|---|---|---|---|---|---|
| Hemograma | |||||||||
| Recuentos de plaquetas | |||||||||
| Glucemia | |||||||||
| Urea Creatinina | |||||||||
| GOT GPT | |||||||||
| Bilirrubinemia total | |||||||||
| LDH | |||||||||
| Albuminemia | |||||||||
| Ionograma plasmático | |||||||||
| TP KPTT | |||||||||
| TSH T4 libre | |||||||||
| Calcemia | |||||||||
| Fosfatemia | |||||||||
| Magnesemia | |||||||||
| Orina completa | |||||||||
| β-HCG (mujer en edad fértil) | |||||||||
| ECG |
ECG: electrocardiograma; GOT: transaminasa glutámico oxalacética; GPT: transaminasa glutámico pirúvica; KPTT: tiempo de tromboplastina parcial activada; LDH: lactato deshidrogenasa; TP: tiempo de protrombina; TSH: tirotrofina; β-HCG: subunidad beta gonadotrofina coriónica humana.
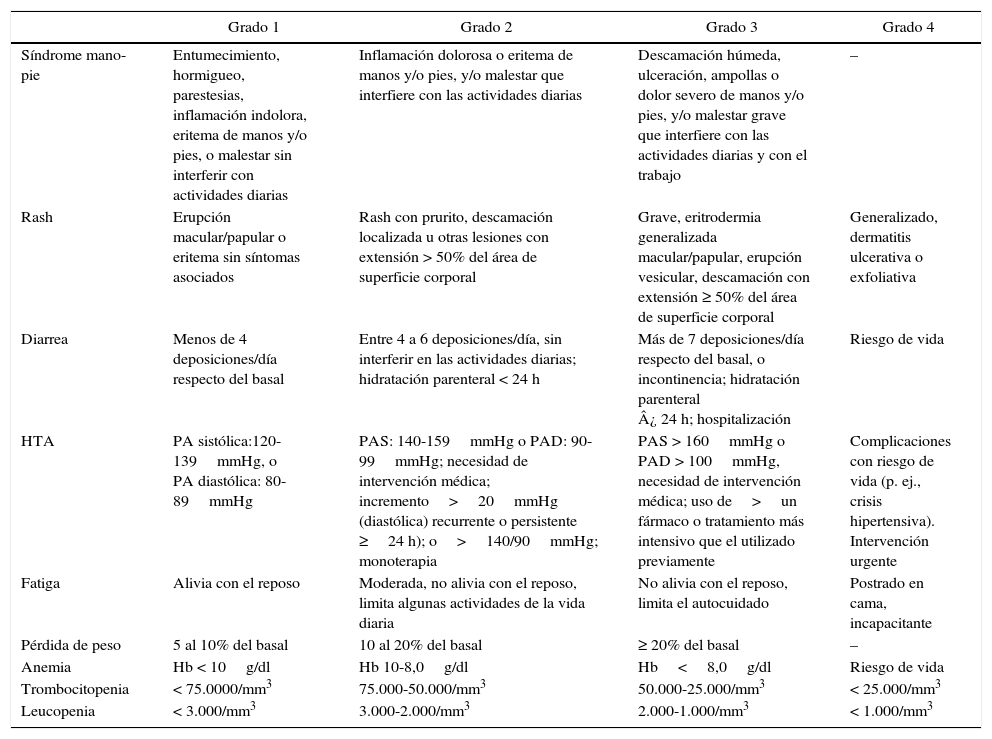
Grados de efectos adversos (Common Terminology Criteria for Adverse Events [CTCAE])
| Grado 1 | Grado 2 | Grado 3 | Grado 4 | |
|---|---|---|---|---|
| Síndrome mano-pie | Entumecimiento, hormigueo, parestesias, inflamación indolora, eritema de manos y/o pies, o malestar sin interferir con actividades diarias | Inflamación dolorosa o eritema de manos y/o pies, y/o malestar que interfiere con las actividades diarias | Descamación húmeda, ulceración, ampollas o dolor severo de manos y/o pies, y/o malestar grave que interfiere con las actividades diarias y con el trabajo | – |
| Rash | Erupción macular/papular o eritema sin síntomas asociados | Rash con prurito, descamación localizada u otras lesiones con extensión > 50% del área de superficie corporal | Grave, eritrodermia generalizada macular/papular, erupción vesicular, descamación con extensión ≥ 50% del área de superficie corporal | Generalizado, dermatitis ulcerativa o exfoliativa |
| Diarrea | Menos de 4 deposiciones/día respecto del basal | Entre 4 a 6 deposiciones/día, sin interferir en las actividades diarias; hidratación parenteral < 24 h | Más de 7 deposiciones/día respecto del basal, o incontinencia; hidratación parenteral ¿ 24 h; hospitalización | Riesgo de vida |
| HTA | PA sistólica:120-139mmHg, o PA diastólica: 80-89mmHg | PAS: 140-159mmHg o PAD: 90-99mmHg; necesidad de intervención médica; incremento>20mmHg (diastólica) recurrente o persistente ≥24 h); o>140/90mmHg; monoterapia | PAS > 160mmHg o PAD > 100mmHg, necesidad de intervención médica; uso de>un fármaco o tratamiento más intensivo que el utilizado previamente | Complicaciones con riesgo de vida (p. ej., crisis hipertensiva). Intervención urgente |
| Fatiga | Alivia con el reposo | Moderada, no alivia con el reposo, limita algunas actividades de la vida diaria | No alivia con el reposo, limita el autocuidado | Postrado en cama, incapacitante |
| Pérdida de peso | 5 al 10% del basal | 10 al 20% del basal | ≥ 20% del basal | – |
| Anemia | Hb < 10g/dl | Hb 10-8,0g/dl | Hb<8,0g/dl | Riesgo de vida |
| Trombocitopenia | < 75.0000/mm3 | 75.000-50.000/mm3 | 50.000-25.000/mm3 | < 25.000/mm3 |
| Leucopenia | < 3.000/mm3 | 3.000-2.000/mm3 | 2.000-1.000/mm3 | < 1.000/mm3 |
PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
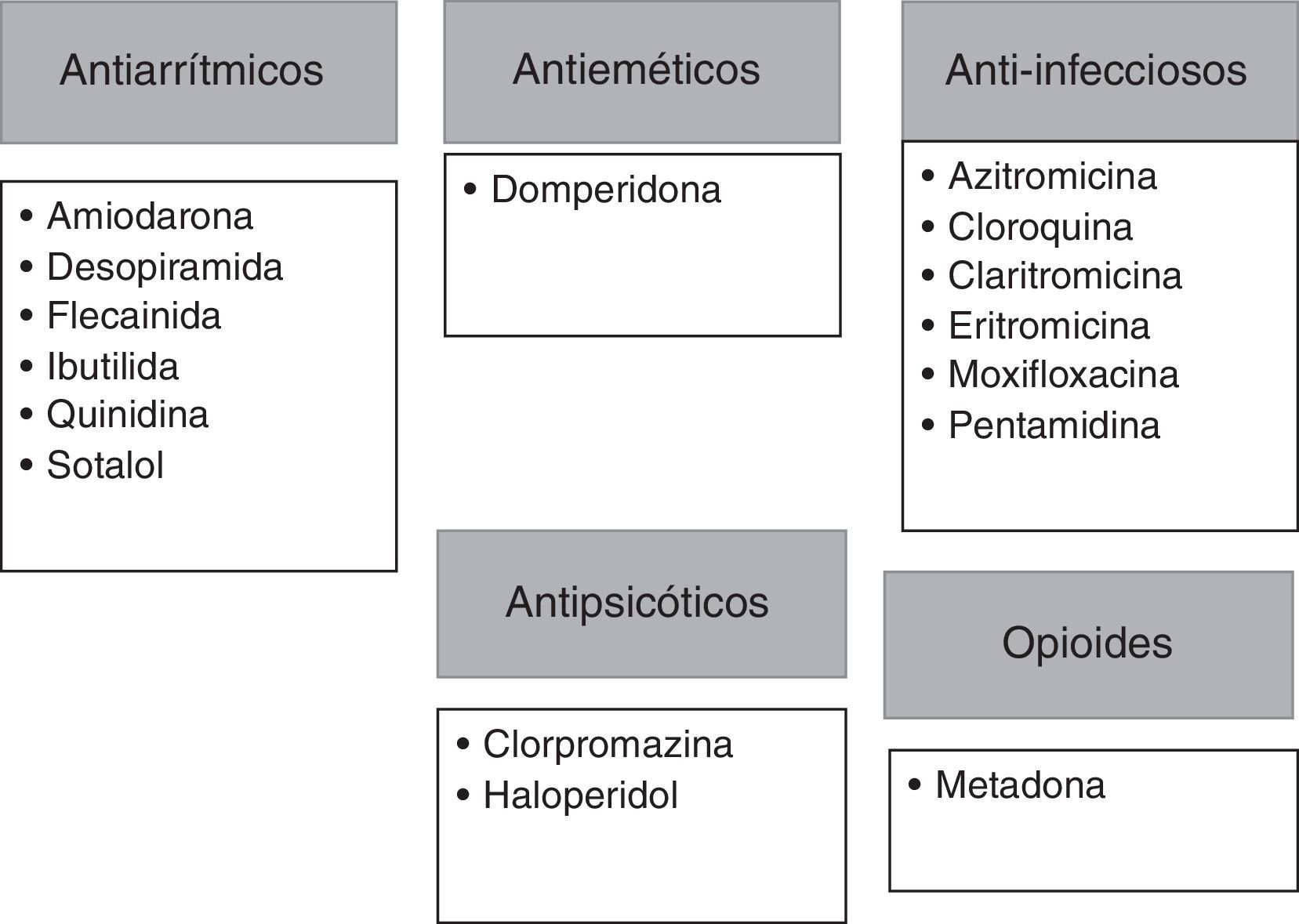
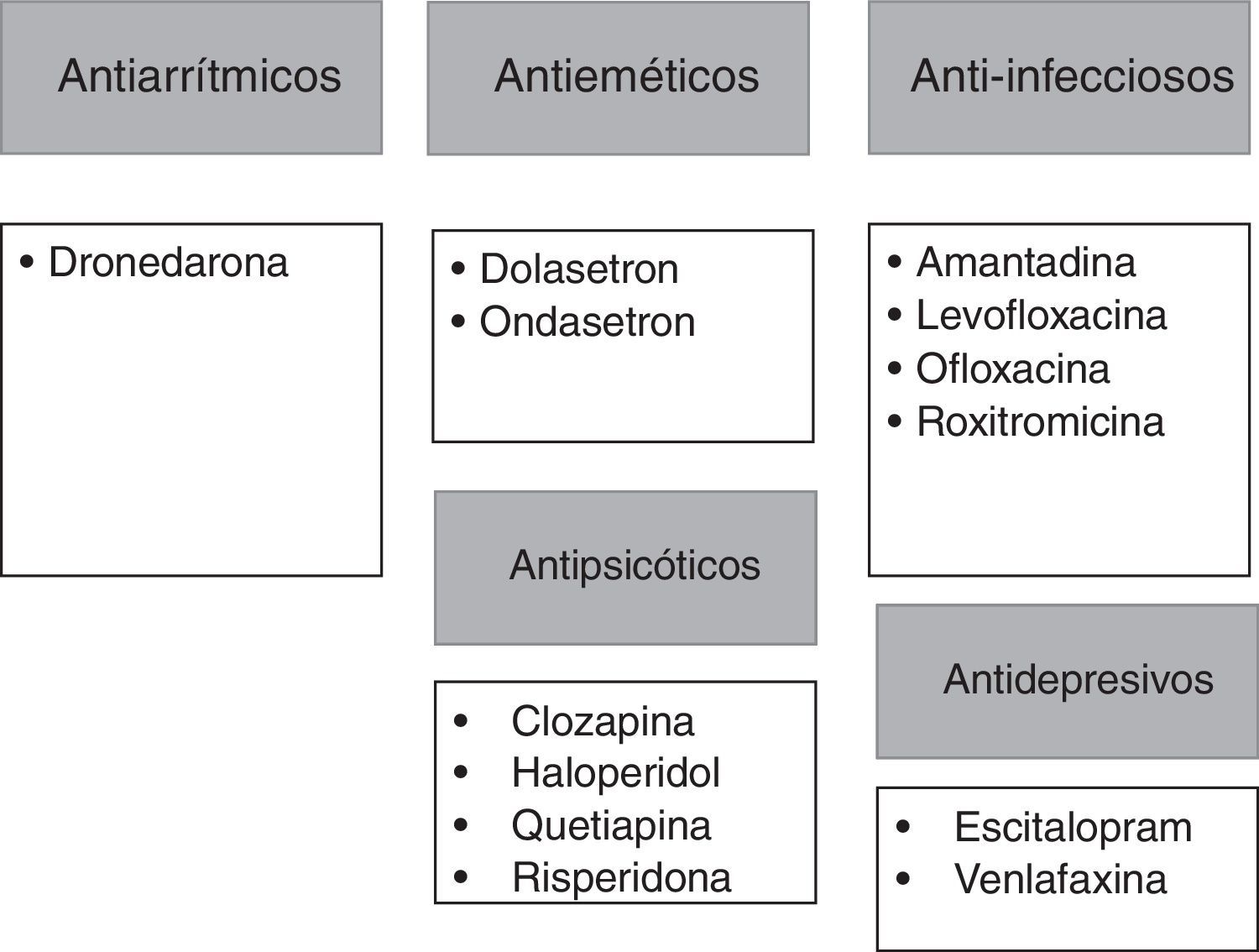
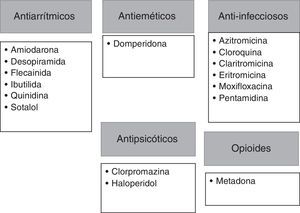
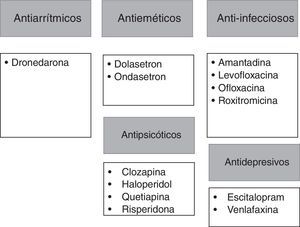
Antes del inicio del tratamiento con vandetanib, se deberán evaluar contraindicaciones específicas como: el síndrome congénito de QT prolongado, la historia previa de torsades de pointes, la administración concomitante de fármacos que generan prolongación del QT o favorecen la misma (figs. 2 y 3), la presencia de un QT corregido ≥ 480 ms, bradiarritmias o insuficiencia cardíaca descompensada27. Además, se tomarán las siguientes precauciones: suspensión de fármacos que puedan prolongar el QT (figs. 2 y 3), corrección de alteraciones hidroelectrolíticas (hipocalemia/hipomagnesemia) y en aquellos pacientes con insuficiencia renal moderada a severa se iniciará una dosis inferior (200mg)8,27.
Fármacos que presentan un riesgo conocido en la prolongación del intervalo QT.
Tomado de QTDrug List28.
Fármacos que presentan potencial de prolongar el intervalo QT.
Tomado de QTDrug List28.
Por otro lado, existen otros fármacos que deben evitarse, aquellos que inhiben la CYP3A4 (vía hepática común para el metabolismo de los IMK), ya que el bloqueo de estas vías de metabolización aumentará la vida media de ambos fármacos, incrementando el riesgo de toxicidad. Dentro de estos fármacos se encuentran: la amiodarona, el verapamilo, la claritromicina, la eritromicina, el ketoconazol y los antirretrovirales, como el indinavir, el ritonavir y el nefinavir28. Por lo tanto, es fundamental que los pacientes conozcan esto, así antes de recibir cualquier fármaco, deberán contactarse con el equipo tratante, o, en su defecto, tener una lista de estos fármacos para ser presentada a cualquier otro médico que prescriba tratamientos adicionales para enfermedades concomitantes.
Controles en pacientes en tratamiento con vandetanib: prolongación del QTDado que vandetanib tiene el potencial de generar una prolongación del intervalo QT, con el riesgo concomitante de desarrollo de arritmias graves como la torsades de pointes29-31, se recomienda realizar una monitorización electrocardiográfica muy estrecha, usualmente lo indicamos semanalmente durante el primer mes y luego cada 2 o 3 meses a lo largo del tratamiento. De manera simultánea, se recomienda monitorear el metabolismo fosfocálcico, la función tiroidea y los electrolitos, principalmente en aquellos con deshidratación importante secundaria a vómitos y/o diarrea, ya que este cuadro puede incrementar la toxicidad de vandetanib27. En el caso de que apareciera toxicidad con prolongación del intervalo QT corregido (≥ 500ms), se debe interrumpir el tratamiento temporalmente y se reiniciará con dosis menor a la inicial, 200mg o 100mg, dependiendo de la dosis que se encontraba recibiendo previamente el paciente.
La presencia de prolongación del intervalo QT ocurrió en un 8% de los pacientes en el estudio ZETA8. Los mecanismos propuestos para este EA serían los siguientes: a) directos: interacción con canales de K+, y b) indirectos: edad, comorbilidades, anormalidades cardíacas intrínsecas, fármacos concomitantes, alteraciones hidroelectrolíticas secundarias a vómitos, diarrea o deshidratación15,32,33.
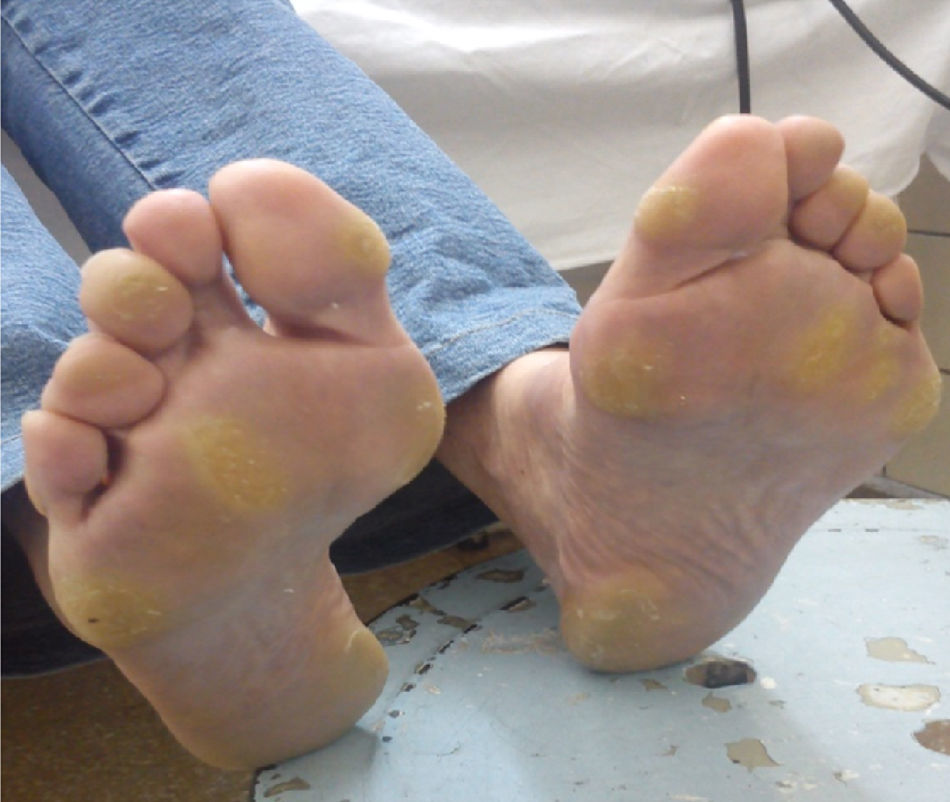
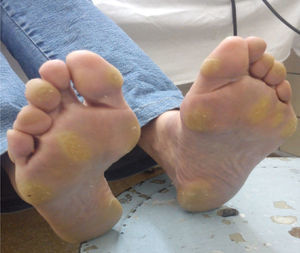
Efectos adversos y manejoSíndrome mano-pie o eritrodisestesia palmoplantar (76% de pacientes en el estudio DECISION, sin reportes en el estudio ZETA)8,9Este síndrome cutáneo se caracteriza por la presencia de placas hiperqueratósicas con bordes eritematosos, más pronunciadas en las áreas expuestas al peso o a la presión, aunque también pueden observarse en el dorso de las manos o en los bordes de la planta del pie. La intensidad puede oscilar desde un simple eritema hasta una hiperestesia severa. Este EA originó una reducción de dosis en el 34% e interrupción en el 27% de los pacientes en el estudio DECISION9. El tiempo promedio de aparición del síndrome mano-pie fue de 18 días desde el inicio de sorafenib9. La severidad, usualmente, tiende a disminuir luego del primer semestre de tratamiento34.
El mecanismo propuesto para este EA es la inhibición de las cascadas de crecimiento y reparación mediadas por el receptor del factor de crecimiento del endotelio vascular (VEGFR, por sus siglas en inglés) y el receptor del factor de crecimiento derivado de las plaquetas (PDGFR, por sus siglas en inglés)35.
El tratamiento fundamental es preventivo manteniendo las manos y los pies bien hidratados. En nuestro país, el laboratorio que comercializa sorafenib asiste a los pacientes proveyéndolos con cremas a base de urea y recomendaciones específicas para el cuidado de pies y manos: remoción de callos, uso de calzado confortable, evitar el uso de agua caliente, entre otras.
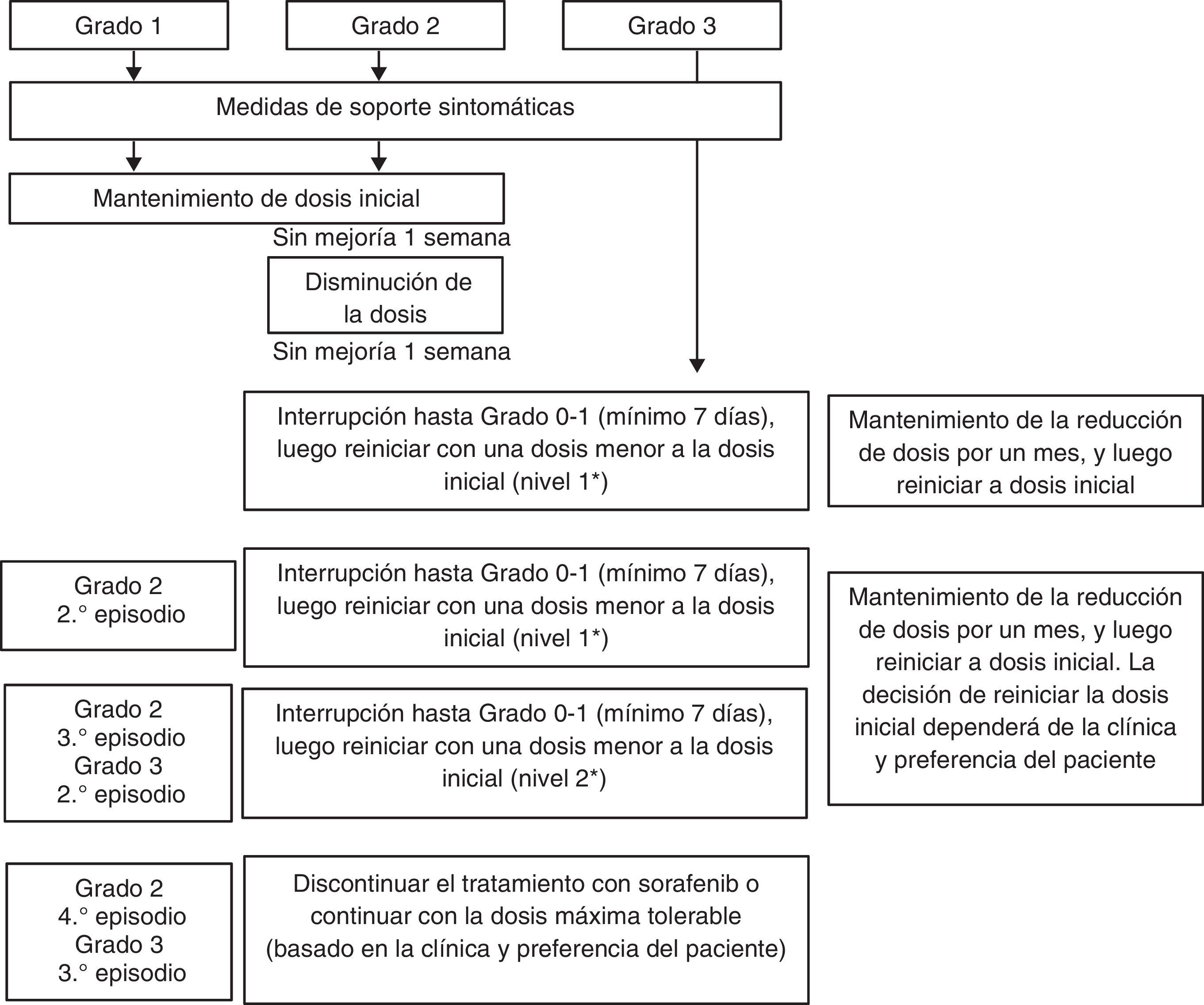
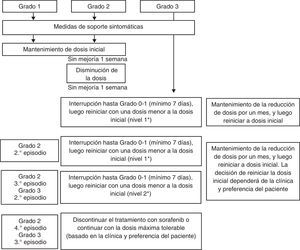
Cuando existe un síndrome mano-pie grado 1 o 2, no se necesita reducción de la dosis de sorafenib. Se usarán las medidas generales anteriormente expuestas. Los pacientes con síndrome mano-pie grado 2 que no mejoren con medidas de sostén ni con la administración de ibuprofeno 600mg 3 veces al día, o aquellos pacientes que presenten EA grado 326, requerirán evaluación dermatológica, asociada a interrupciones breves con probable reducción de la dosis de sorafenib (fig. 4).
Recomendaciones para el manejo del síndrome mano-pie.
* Nivel de dosis 0: 800mg, dosis nivel 1: 600mg, dosis nivel 2: 400mg, dosis nivel 3: 200mg.
Adaptado de Brose et al.32
En nuestra experiencia, la presencia del síndrome mano-pie grado 3 o 4 es menos frecuente debido a las intervenciones tempranas (fig. 5). De nuevo, el hecho de que los pacientes puedan comunicarse y concurrir inmediatamente frente a cualquier cambio en su piel hace que este EA pueda ser manejado precozmente y sea menos severo. Una recomendación adicional que hemos observado en grandes ciudades en donde los pacientes deben trasladarse en transportes públicos por más de una hora de pie, es que esta situación debe ser evitada bajo toda circunstancia. El caso anecdótico fue el de una paciente que concurrió al control sin EA cutáneos y luego de una hora y media de estar de pie en un transporte público desarrolló un síndrome mano-pie grado 2. Otra alternativa que implementamos es dar pequeñas «vacaciones» del tratamiento cuando los pacientes tienen sus propias vacaciones, para que puedan disfrutar de caminar, exponerse al sol con protector solar y disfrutar de otro tipo de dieta sin el riesgo de la aparición de EA.
Rash (50% de los pacientes en el estudio DECISION y 45% de pacientes en el estudio ZETA)8,9Ambos fármacos pueden generar la aparición de rash macular o máculo-papular en las extremidades y en el tronco, el cual suele observarse en los primeros meses de tratamiento. El mecanismo propuesto es directo, a través de la inhibición del VEGFR. Secundariamente, se postula también un aumento en la producción de citocinas y activación de mediadores inflamatorios. Adicionalmente, vandetanib inhibe el receptor de crecimiento epidérmico (EGFR, por sus siglas en inglés), lo que incrementaría el potencial de generar este EA36.
En la mayoría de los casos, se resuelve espontáneamente sin terapias específicas. Usualmente, recomendamos el uso de protectores solares durante los primeros meses de tratamiento. Estos deben ser aplicados cada 2 h y evitar la exposición solar directa. Ante un rash persistente se puede considerar el uso de corticoides tópicos y antihistamínicos bajo la supervisión del dermatólogo32.
Rash pápulo-pustular por vandetanib: este EA ocurrió en un 15% de los pacientes en el estudio ZETA. Se manifiesta como un acné severo en el rostro y el tronco, y por lo general requiere del manejo dermatológico. En un estudio aleatorizado con cetuximab (otro inhibidor del EGFR) validaron el beneficio del uso de minociclina 100mg/día36-38.
Diarrea y otras manifestaciones gastrointestinales (diarrea en el 68% de pacientes del estudio DECISION y 56% en el estudio ZETA)La diarrea es el segundo EA más frecuente con el uso de sorafenib y el primer EA con vandetanib8,9. Los diferentes grados de este EA pueden apreciarse en la tabla 6. En la mayoría de los casos se observa diarrea grado 1 (menos de 4 deposiciones diarias). La presencia de diarreas severas con consecuencias graves ocurren en menos del 10% de los casos8,9,39. En general, suele aparecer luego del tercer o cuarto mes de tratamiento, pero hemos visto en forma inmediata tras el inicio de ambos inhibidores multicinasas. En el caso de pacientes con cáncer medular avanzado, principalmente aquellos con metástasis hepáticas, la diarrea puede ser parte del cuadro clínico y estar presente al momento del inicio de vandetanib. Lo que ocurre luego del inicio del IMK en estos casos es un cambio en la frecuencia y en el tipo de diarrea, suele ser acuosa y generalmente asintomática cuando es generada por la enfermedad, y más profusa asociada a dolor abdominal luego del inicio de vandetanib. Se ha reportado que existiría tolerancia para este EA y que suele hacerse menos evidente luego de los 6 meses de tratamiento32. Los mecanismos propuestos son el bloqueo de c-kit por sorafenib, que se expresa en las células intersticiales de Cajal, las cuales regulan los movimientos peristálticos. Además, ambos fármacos inhiben el VEGFR, lo que produciría daño en la microcirculación. Un tercer mecanismo es el efecto directo irritante del fármaco cuando se elimina por vía intestinal32.
El manejo de la diarrea grado 1 o 2 es sencillo con el ajuste nutricional, generalmente acompañado de la administración de loperamida intermitente luego de cada episodio diarreico, o reglada, de acuerdo con la situación individual del paciente. En algunas ocasiones indicamos la ingesta de sorafenib en forma conjunta con loperamida, observando el cese de este EA. Si la administración conjunta previene la diarrea o determina una menor absorción del IMK es una cuestión que aún no está determinada.
La presencia de otras manifestaciones gastrointestinales como mucositis y dispepsia o acidez son frecuentes en pacientes que reciben IMK8,9. En la mayoría de los casos son autolimitadas y resuelven con medidas generales32.
Hipertensión arterial (40% en el estudio DECISION y 32% en el estudio ZETA)La hipertensión arterial es un EA observado con cualquier IMK8,9; sin embargo, es infrecuente que se presente como EA grado 3 (menos de 10% en ambos estudios)8,9. Una vez que aparece, suele mantenerse estable a lo largo del tratamiento con los IMK32. Una vez más, el mecanismo propuesto para este EA es la inhibición del VEGFR. Esto resultaría en la reducción en los niveles de óxido nítrico y de prostaglandinas, un incremento probable en los niveles de endotelina-1, asociado a rarefacción vascular, trombosis local y otros daños endoteliales adicionales que conducirían a la vasoconstricción y al aumento de la resistencia vascular periférica40.
El manejo de esta condición requiere una monitorización periódica de la presión arterial por parte del paciente y del equipo médico, principalmente durante las primeras 6 semanas de tratamiento, para instruir a los pacientes sobre los cambios higiénico-dietéticos, además de la evaluación conjunta con el cardiólogo. La elección del antihipertensivo debe ser individualizada de acuerdo con el paciente y el IMK utilizado40. No existen estudios que comparen diferentes fármacos antihipertensivos en pacientes recibiendo IMK. Los fármacos de elección para el tratamiento de la hipertensión arterial serían los inhibidores de la enzima conversora de angiotensina. Los betabloqueantes y los bloqueantes de los canales de calcio deben usarse con precaución en pacientes en tratamiento con vandetanib32,40.
Fatiga y pérdida de peso (cercanos al 50% en el estudio DECISION y al 25% en el estudio ZETA)La fatiga es un síntoma muy frecuente en los pacientes tratados con sorafenib o vandetanib8,9. Suele manifestarse en forma más intensa durante los primeros meses de tratamiento y puede mantenerse estable en el tiempo. Debido a que este EA puede cambiar de manera considerable la calidad de vida del paciente, en varias ocasiones determina una reducción de la dosis del IMK41. Ante la presencia de este síntoma es importante realizar una evaluación psiquiátrica para descartar un síndrome depresivo concomitante y la evaluación cardiovascular, para descartar la presencia de insuficiencia cardíaca leve o moderada. Por otra parte, debe evaluarse la presencia de hipotiroidismo tras el inicio del IMK (véase más adelante). Adicionalmente, se puede recomendar que el paciente ingiera el IMK durante la tarde o noche, lo que en ocasiones mejora la fatiga.
En relación con el descenso de peso, usualmente observado con estos IMK, se recomienda la evaluación conjunta con el equipo de nutrición, para fomentar la ingesta hipercalórica, y recomendar actividad física moderada de acuerdo con el estado general del paciente.
Incremento en los niveles de tirotrofina (33% en el estudio DECISION y 49% en el estudio ZETA)En la mayoría de los pacientes con cáncer diferenciado de tiroides, en los cuales necesitamos mantener los niveles de TSH suprimidos, será necesario incrementar la dosis de levotiroxina luego del inicio de sorafenib9,19. Los mecanismos propuestos para este evento asociado son: a) la inhibición de MCT8, una proteína de transporte de hormona tiroidea, que llevaría a una disminución en la absorción intestinal de levotiroxina y/o a una reducción de la retroalimentación hipotálamo-hipofisaria42; b) el incremento en la conversión periférica de T4 a T3 debido a un incremento de la actividad de la deiodinasa tipo 3, con la consecuente disminución de los niveles de T343, y c) la reducción en el clearence de TSH44.
El manejo de esta situación es sencillo, requiere solamente estar alertas a solicitar el perfil tiroideo de manera regular para aumentar la dosis de levotiroxina, cuando sea necesario, más aún en pacientes con carcinoma medular, en donde el incremento de los niveles de TSH puede ser un factor desencadenante de la prolongación del intervalo QT27,45.
Toxicidad hematológicaDado que el VEGFR y c-kit se expresan en los precursores hematopoyéticos, los IMK pueden generar toxicidad en la médula ósea. En un metaanálisis de pacientes tratados con sorafenib para otros tipos de tumores (no tiroideos), se reportó una incidencia de anemia cercana al 40%, el 25% de trombocitopenia y el 35% de linfopenia46. En la mayoría de los casos, se presentaron como EA grado 1 o 2, aunque existen reportes aislados de neutropenia febril en un paciente con cáncer de tiroides tratado con sorafenib47 y de trombocitopenia grado 348,49. En nuestra paciente49, la trombocitopenia grado 3 asociada a hemorragia subconjuntival se presentó luego de 4 meses de tratamiento con dosis plenas de sorafenib (800mg/día). Este EA se resolvió luego de suspender el tratamiento durante 15 días y el recuento plaquetario permaneció normal al volver a iniciar sorafenib con la mitad de la dosis (400mg/día) durante 2 años de tratamiento49. La incidencia de EA hematológicos más severos en pacientes con cáncer de tiroides que los reportados en otros estudios de pacientes tratados con sorafenib podría tener que ver con el daño acumulativo generado por el radioyodo sobre la médula, ya que es habitual que estos pacientes presenten dosis acumuladas superiores a los 600 mCi de I13150,51. La toxicidad hematológica con vandetanib es poco frecuente8.
Hipocalcemia (18% en DECISION, 11% en ZETA)La hipocalcemia se observa más frecuentemente en pacientes con cáncer de tiroides tratados con IMK que en otros tipos de tumores50,51. Se cree que este EA estaría vinculado a una menor absorción de calcio en pacientes con hipoparatiroidismo posquirúrgico, en ambos tipos de cánceres de tiroides8,9.
Otras manifestaciones vasculares: insuficiencia cardíaca y proteinuriaLa inhibición del VEGFR y el daño vascular consecuente se asoció al aumento del riesgo de desarrollar insuficiencia cardíaca congestiva (ICC), proteinuria, hemorragia e infarto agudo de miocardio15,52-54.
Un metaanálisis que incluyó a 10.553 pacientes con cáncer tratados con IMK demostró una incidencia de ICC cercana al 3% (1,4% cuando se consideró ICC severa)54. En la única serie publicada a nivel nacional de pacientes tratados con sorafenib, se observó la aparición de una probable miocardiopatía asociada a dicho fármaco55. El paciente reportado, de sexo femenino y de 50 años de edad, se presentó con una ICC 9 meses después del inicio de sorafenib (fracción de eyección basal antes del inicio del IMK de 67%, la cual disminuyó al 25% cuando el paciente presentó clínica de ICC). Un mes después de la suspensión de sorafenib, la fracción de eyección se incrementó a un 55%55. Si bien los pacientes pueden presentarse, como en este caso, con síntomas dramáticos de ICC, otros pueden hacerlo con signo-sintomatología moderada, en ocasiones difícil de diferenciar de la fatiga provocada por el uso de estos fármacos56. Este efecto directo sobre el miocito cardíaco hasta el momento no fue dilucidado y se ha propuesto como mecanismo fisiopatológico a la inhibición del receptor del factor de crecimiento plaquetario que podría desempeñar un papel como regulador de la respuesta cardiaca compensatoria a la sobrecarga de presión inducida por el estrés57.
Por otro lado, en el metaanálisis previamente mencionado, la incidencia de proteinuria fue cercana al 10% cuando se consideraron todos los grados, pero solo del 0,9% cuando se consideró como EA grado 353. La proteinuria es un EA infrecuente en pacientes tratados con sorafenib o vandetanib; sin embargo, solicitamos una evaluación de esta condición, al menos 2 veces al año.
Carcinoma epidermoide (3,4% en estudio DECISION, no hubo casos en el estudio ZETA)El bloqueo del VEGFR se cree estaría involucrado en el desarrollo de carcinomas epidermoides en pacientes tratados con sorafenib32. En general, se requiere más de un año de tratamiento para observar este EA, por lo que es escasamente reportado cuando sorafenib se usa para el tratamiento de otros tumores con menor supervivencia libre de progresión58,59. En nuestra experiencia, un paciente tratado con sorafenib durante 50 meses desarrolló 3 carcinomas epidermoides (2 en antebrazo y uno en el pabellón auricular) y otro paciente tratado con vandetanib desarrolló el mismo tumor en el tórax. Es poco probable que vandetanib sea la causa de la aparición de este carcinoma epidermoide, debido a que este fármaco inhibe al receptor del factor de crecimiento epidérmico, e incluso se lo ha utilizado como tratamiento de carcinomas epidermoides avanzados60. El desarrollo de este EA severo generalmente no va asociado a suspensión definitiva de sorafenib. Se suele indicar el tratamiento quirúrgico pertinente de la lesión cutánea y se reinicia posteriormente el IMK, con un estrecho control dermatológico.
Otras recomendacionesManejo perioperatorio de pacientes bajo tratamiento con IMKLa cicatrización de heridas es un proceso complejo que involucra la angiogénesis y la interacción entre el endotelio vascular, las plaquetas y la cascada de coagulación61,62. La inhibición de la vía del VEGFR podría alterar el proceso de cicatrización normal, teniendo 2 implicancias: la dehiscencia de una herida previa al inicio del tratamiento con el IMK y, por otro lado, el retraso o fallo en la reparación normal de una lesión. Por lo tanto, debe determinarse el tiempo óptimo de administración y discontinuación de estos fármacos antiangiogénicos para prevenir complicaciones quirúrgicas61.
La mayoría de la evidencia que relaciona el uso de IMK y las alteraciones en la cicatrización proviene del uso del bevacizumab en el cáncer colorrectal. Este es uno de los IMK de vida media más larga, aproximadamente 20 días, por lo que debe ser suspendido entre 6 a 8 semanas previas a la realización de una cirugía mayor programada, y ser reiniciado a las 4 semanas posquirúrgicas y/o una vez que la herida esté completamente reparada61,62.
Aún no se ha logrado definir con exactitud el intervalo óptimo de interrupción de sorafenib y vandetanib, por lo que se debe tener en cuenta, por un lado, el tipo de cirugía a la que será sometido el paciente y, por otro, la vida media del fármaco utilizado. Como regla general, se sugiere suspender los IMK durante un tiempo igual o mayor a 5 vidas medias. La vida media del sorafenib oscila entre 24 a 48 h, por lo que se recomienda empíricamente una semana de suspensión previa a cualquier procedimiento quirúrgico. También es escasa la información acerca del intervalo de reinicio del fármaco posterior a la cirugía, por lo que esta decisión se debe basar en la evolución clínica del paciente y en la progresión adecuada del proceso de cicatrización normal32,63.
ConclusionesLos EA generados por sorafenib y vandetanib son usualmente manejables. Requieren de un equipo médico multidisciplinario, comprometido con el seguimiento continuo y estrecho, y de un paciente involucrado con su tratamiento, que comprenda que la comunicación rápida con el equipo médico puede cambiar el curso del EA, además de estar alerta de que cualquier prescripción de medicación concomitante puede desencadenar complicaciones severas, principalmente en aquellos pacientes tratados con vandetanib.
Cuando se usan incorrectamente, los IMK tienen un elevado potencial de producir daño; usados correctamente prometen ser una poderosa herramienta para el manejo del cáncer de tiroides avanzado y progresivo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesFabián Pitoia es consultor de los laboratorios Bayer y Genzyme-Sanofi. El resto de los autores no presenta conflictos de interés.