Por décadas, el significado clínico de la hormona antimülleriana (HAM) ha estado limitado a su papel crítico en el desarrollo sexual fetal. Sin embargo, en los últimos 20 años esta ha surgido también como marcador de función ovárica.
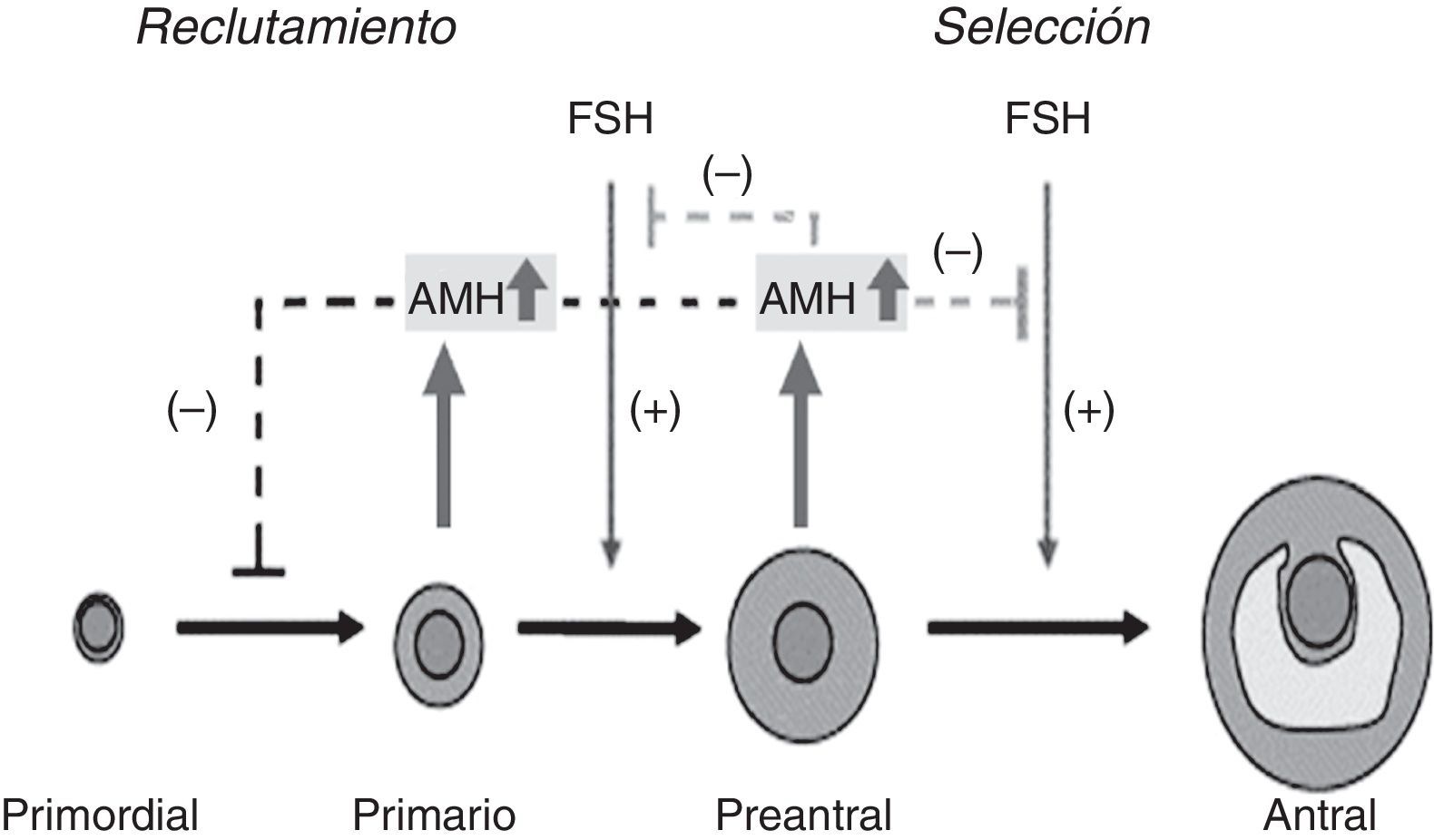
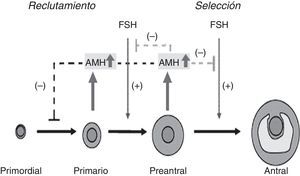
La HAM tiene funciones específicas como regulador del crecimiento folicular, desempeñando su papel como señal de retroalimentación negativa. Jugaría un papel importante tanto en la regulación del número de folículos en crecimiento (inhibiendo el reclutamiento), como en su selección para ser ovulados (inhibiendo a FSH).
La HAM es sintetizada como una pre-prohormona. En el citoplasma cada monómero es clivado generando un fragmento N-terminal: 110 KDa (región pro) y otro C-terminal: 25 KDa (región madura o nativa), unidos en forma no covalente por 2 puentes disulfuro. El dominio C-terminal es el bioactivo, uniéndose al receptor, pero necesita del fragmento N-terminal para desencadenar respuesta biológica. En circulación podemos encontrar una mezcla de la forma pro-HAM y del complejo C-terminal/N-terminal, que serían medidos por los ensayos disponibles.
Distintos autores han demostrado que la HAM es un marcador precoz de la disminución y agotamiento de la reserva ovárica. Muestra una estrecha correlación con la reserva folicular y la capacidad reproductiva, más que la FSH y el estradiol.
La revisión realizada no deja lugar a dudas sobre la utilidad de la HAM en la etapa fértil. Ha mostrado ser una excelente herramienta para caracterizar pobres respondedoras en los procedimientos de fertilización asistida, alertar precozmente en mujeres jóvenes sobre reserva ovárica baja, en relación con su edad cronológica y expresar un número de folículos en crecimiento elevado, como en síndrome de ovario poliquístico, para evitar una hiperestimulación ovárica. El creciente número de pacientes que decidieron retrasar su maternidad y su papel en la fisiología ovárica han posibilitado que la HAM integre hoy la evaluación de mujeres con alteraciones de la fertilidad.
For many years, the clinical significance of the anti-Müllerian hormone (AMH) was limited to its critical role in foetal sexual development. However, in the last 20 years it has also emerged as a marker of ovarian function.
AMH has specific functions as a regulator of follicular growth, playing its role as negative feedback signal. It may also play an important role in the regulation of the number of growing follicles (inhibiting the recruitment) as well as in their selection to be ovulated (inhibiting FSH).
AMH is synthesised as a pre-pro-hormone. In the cytoplasm each monomer is cleaved, generating one N-terminal fragment: 110 KDa (pro region) and another C-terminal fragment: 25 KDa, non-covalently bound by two disulphide bridges. The C-terminal domain is bioactive, binding to the receptor, but requires the N-terminal fragment to trigger a biological response. A mixture of pro-AMH complex and C-terminal/N-terminal complex can be found in the bloodstream, which can be measured by the assays available.
Several authors have shown that AMH is an early marker of the decrease and depletion of ovarian reserve. It shows a close correlation with follicular reserve and reproductive capacity more than FSH and oestradiol.
This review leaves no doubt about the usefulness of AMH in the fertile phase. It has proven to be an excellent tool in characterising poor responders in assisted reproduction procedures, as an early alert in young women of a low ovarian reserve in relation to their chronological age, as well as in expressing a number of follicles in high growth, as in polycystic ovary syndrome, to avoid ovarian hyperstimulation. The growing number of patients who have decided to delay motherhood and the role of AMH in ovarian physiology has led it to an integral part of the assessment of women with impaired fertility.
La hormona antimülleriana (HAM) es una proteína inhibidora de los conductos de Müller. Su existencia fue propuesta por primera vez en 1947 por el profesor Alfred Jost, quien demostró que un componente testicular, distinto de la testosterona, era responsable de la regresión de los conductos de Müller en el desarrollo embriológico masculino1,2.
Por décadas, el significado clínico de la HAM ha estado limitado a su papel crítico en el desarrollo sexual fetal3,4. Sin embargo, en los últimos 15 años, esta ha incrementado su relevancia y ha surgido también como un marcador de función ovárica5.
La HAM es sintetizada como una pre-prohormona. Antes de su liberación, la hormona madura sufre glicosilación y dimerización para producir un dímero de 144 KDa, compuesto por 2 subunidades idénticas de 72 KDa, unidas por puentes disulfuro. Durante su paso citoplasmático cada monómero es clivado para generar un fragmento N-terminal de 110 KDa (región pro) y otro C-terminal de 25 KDa (región madura o nativa) que siguen unidos por uniones no covalentes6. El dominio C-terminal es el bioactivo, uniéndose al receptor, pero necesita del fragmento N-terminal para desencadenar su respuesta biológica. En circulación podemos encontrar una mezcla de la forma pro-HAM y del complejo C-terminal/N-terminal, unido por 2 puentes disulfuro7.
La HAM ha demostrado tener funciones específicas, como regulador del crecimiento folicular, que permiten su aplicación en ginecología, contribuyendo al estudio de la reserva y posible respuesta ovárica, en mujeres con alteraciones de la fertilidad. Otras de sus acciones biológicas incluyen la reducción de la actividad aromatasa y el número de receptores a LH en células de la granulosa, FSH-estimuladas, y también influencia la producción de testosterona por las células de la teca. Esto sugiere que, en contraste con otros marcadores hormonales de la función ovárica, la secreción de HAM reflejaría la actividad de los folículos preantrales y antrales tempranos, resultando un buen marcador para evaluar la reserva ovárica8.
Con la edad existe una declinación en la función reproductiva por reducción del pool de folículos ováricos y la calidad de los ovocitos. El valor de FSH, el de inhibina B y el conteo de folículos antrales parecían ser los marcadores más confiables de la reserva ovárica. Diversos autores han demostrado que los valores de HAM también disminuyen a lo largo de la vida reproductiva9,10. La HAM, producida por los folículos preantrales pequeños, en crecimiento, puede ser utilizada como marcador de la reserva ovocitaria de mujeres que llevan a cabo una fertilización in vitro11.
Sowers et al. mostraron que la HAM es un marcador precoz de la disminución y el agotamiento de la reserva ovárica, asociándola con la edad de la menopausia12. Su medición en sangre puede predecir la edad de inicio de la menopausia, lo cual sería de utilidad clínica para programar un embarazo natural o por fertilización asistida. Su concentración muestra una estrecha correlación con la reserva folicular y la capacidad reproductiva, más que las mediciones de FSH y de estradiol13.
La HAM también sería útil como una herramienta complementaria en el diagnóstico de causas de amenorrea secundaria, como el síndrome de ovario poliquístico (SOP), la falla ovárica precoz y otras disfunciones del eje hipotálamo-hipofisario14,15.
Cambios en el estilo de vida y el nivel educativo, y una mayor participación en diferentes roles sociales y laborales, han llevado a las mujeres a posponer su maternidad. Esta tendencia se ha reflejado en un aumento de la incidencia de tasas de infertilidad y una mayor demanda de terapia para procedimientos de estimulación ovárica16.
El objetivo de este trabajo fue evaluar y actualizar el campo de aplicación de la medición de HAM en mujeres. También analizar la posible influencia de las distintas metodologías, que siguen incorporándose al mercado, para su medición.
La hormona antimülleriana como marcador de reserva ováricaLa reserva ovárica, representada por la cantidad de folículos y la calidad ovocitaria, disminuye con la edad de la mujer, resultando en la disminución de su función reproductiva17.
Distintos marcadores hormonales y ecográficos han sido utilizados para evaluar la reserva ovárica. El incremento de FSH en mujeres de más de 35 años, la disminución de la inhibina B, debida a la reducción del pool de folículos antrales reclutados, la disminución de niveles de estradiol y el recuento de folículos antrales por ecografía, están entre ellos18-21. Hace algunos años se describió que la HAM reflejaba el número de folículos que habían hecho la transición de folículo primordial a folículo en crecimiento y que, además, era independiente del control gonadotrófico16. La HAM se expresa en los folículos que ya fueron reclutados, pero que aún no fueron seleccionados para ser dominantes. Previo y posterior a estos 2 puntos, la HAM no se expresa.
Varios trabajos establecieron el papel de la HAM como una señal de retroalimentación negativa sobre el número de folículos en crecimiento presentes en el ovario. Durante el proceso de selección, un grupo de folículos es seleccionado desde el grupo de folículos en crecimiento, productores de HAM, para continuar su crecimiento hasta estadio preovulatorio. Dado que la HAM afecta a la sensibilidad de los folículos a FSH, desempeñaría un papel al determinar si los folículos experimentan selección o son removidos por atresia22-24.
Esto indica que desempeñaría un papel importante tanto en la regulación del número de folículos en crecimiento (inhibiendo el reclutamiento), como en su selección para ser ovulados (inhibiendo a la FSH)19 (fig. 1).
Sitios de unión de la AMH en la foliculogénesis. Adaptado de Visser et al.16.
Se ha demostrado que los niveles séricos de HAM decrecen a lo largo del tiempo en mujeres normovulatorias, inclusive cuando el patrón menstrual todavía es regular, identificando a las mujeres que se encuentran en el estadio tardío de su edad reproductiva. Otros marcadores no cambian durante este intervalo de tiempo25.
Distintos grupos estudiaron los cambios de los marcadores de reserva ovárica y analizaron cuál de ellos reflejaba mejor el proceso de envejecimiento ovárico. Los valores de HAM disminuyen significativamente, mientras que los niveles de FSH, inhibina B y el recuento de folículos antrales no se modificarían en forma tan significativa. Los resultados también mostraron que las modificaciones de los niveles séricos de HAM ocurren antes que la secuencia de eventos asociados al envejecimiento ovárico9,10.
Cook et al. demostraron que las variaciones de HAM en un ciclo menstrual normal son mínimas, por lo tanto, un solo dosaje de HAM en cualquier momento del ciclo es válido para estudiar la actividad ovárica26. Este punto fue refutado por otros grupos quienes demostraron una disminución de los niveles de HAM en fase lútea27. Sowers et al., en un estudio de cohortes analizando mujeres sanas entre 30 y 40 años, con ciclos regulares, describen 2 patrones de variación de HAM sérica a lo largo del ciclo menstrual. Uno de ellos, el patrón «ovario envejecido», se asocia a ciclos con una media de HAM sérica baja (<1ng/ml), con mínima variación en los niveles a lo largo del mismo. En general, estos ciclos suelen tener una duración menor y se correlacionan con una disminución de la reserva ovárica. Por otro lado, el patrón «ovario joven», asociado a ciclos con media de HAM sérica elevada y una variación estadísticamente significativa en sus niveles durante la fase folicular. Estos 2 patrones tienen que ver con la relativa «edad del ovario», más que con la edad cronológica de las pacientes. Estos investigadores indican que un valor elevado de HAM sérico puede depender del día del ciclo en el que se obtuvo la muestra, mientras que, ante un valor por debajo de 1ng/ml, no deberían suponerse variaciones a lo largo del ciclo28.
En pacientes sometidas a tratamientos de estimulación ovárica niveles adecuados de HAM se asocian a un mayor número de ovocitos maduros, mayor número de embriones y una mayor tasa de embarazo29. El estudio de Muttukrishna et al. mostró una fuerte asociación entre el número de folículos fertilizados y las mediciones basales de HAM e inhibina B y determinó un límite de corte para HAM de 0,2ng/ml (S: 87% y E: 64%) para predecir una peor respuesta al tratamiento.
Diferentes estudios han planteado distintos valores de corte para HAM, incluso utilizando la misma metodología de medición30-32.
La HAM también es útil para identificar mujeres jóvenes con una disminución precoz de su reserva ovárica, así como mujeres que van disminuyendo la reserva ovárica naturalmente por el paso de los años, pero que aún tienen potencial reproductivo. Factores genéticos y determinados hábitos de vida, pueden producir la disminución precoz de la reserva ovárica independientemente de la edad cronológica, por lo tanto mujeres de la misma edad pueden tener distinta reserva ovárica. Ni la edad ni la FSH son suficientes para la evaluación de la capacidad reproductiva33.
La hormona antimülleriana en tumores de células de la granulosaLos tumores de ovario son principalmente de origen epitelial (90%) y el 10% restante es clasificado mayormente como tumores del estroma del cordón sexual, siendo los tumores de las células de la granulosa (TCG) los más frecuentes. Estos tumores se caracterizan por un crecimiento lento y una recurrencia tardía, por lo cual es esencial el seguimiento a largo plazo. Por falta de herramientas diagnósticas para la detección temprana de tumores primarios y su recurrencia, se destaca la necesidad de contar con marcadores tumorales. La HAM, producida por células de la granulosa, es un potencial candidato. Su concentración aumenta en forma significativa más temprano que la evidencia clínica de recaída34.
Un nivel incrementado de HAM es específico para TCG35,36. No se encontraron niveles de HAM elevados en otros tumores ováricos, quistes benignos ni cánceres extraováricos. Los niveles postoperatorios de HAM pueden ser utilizados para evaluar la completa resección del tumor y para predecir una recaída. Niveles elevados de HAM indican enfermedad residual36.
La magnitud del incremento de HAM en el momento del diagnóstico y en la recurrencia, sin embargo, no correlaciona con el estadio de la enfermedad37.
Se invalida el uso de la medición de HAM para detectar estadios tempranos o recurrencia de TCG en mujeres premenopáusicas, con ovarios conservados. En posmenopáusicas solo sería de utilidad con valores bajos de HAM38.
La inhibina B también es producida por las células de la granulosa de los folículos en crecimiento, en un estadio más tardío del crecimiento folicular. Es utilizada actualmente en el seguimiento de los pacientes con TCG. En circunstancias normales los niveles de inhibina B disminuyen significativamente luego de la cirugía, observándose niveles indetectables en pacientes en remisión clínica. Al igual que sucede con la HAM, se observan niveles elevados de inhibina B en estos pacientes y, adicionalmente, en tumores del epitelio ovárico de tipo mucinoso. Tal como se observa para la HAM, la elevación en los niveles de inhibina B predice la recaída antes de que aparezcan los síntomas clínicos39-42.
La hormona antimülleriana en el síndrome de ovario poliquísticoLos niveles de HAM son mayores en las mujeres con SOP, en comparación con las mujeres que no poseen esta patología. Este aumento de HAM se debe a alteraciones en la foliculogénesis, lo que resulta en la acumulación de folículos preantrales y antrales pequeños43-45. El cese del desarrollo de folículos antrales hacia el folículo dominante se debería a la supresión de la actividad de la aromatasa por la HAM y por una menor sensibilidad del folículo a la FSH46,47.
El SOP es una patología endocrina frecuente, que afecta aproximadamente al 6% de las mujeres en edad reproductiva. Según el Consenso de Rotterdam del año 2003, los 3 criterios diagnósticos de SOP son: oligo y/o anovulación (OA), y características ecográficas de ovarios poliquísticos (presencia de más de 12 folículos con un diámetro de 2 a 9 milímetros o volumen ovárico mayor de 10 cm3) e hiperandrogenismo (clínico y/o bioquímico) (HA). El HA clínico caracterizado por hirsutismo, acné y alopecia androgénica y el HA bioquímico definido como un aumento de los andrógenos circulantes: testosterona total, testosterona libre/biodisponible, SDHEA y delta-4 androstenediona (6% de los casos). Sobre la base de estos criterios y luego de excluir desórdenes asociados al exceso de producción de andrógenos, se diferencian 4 fenotipos diferentes de SOP: fenotipo A (OA+HA+PCO); fenotipo B (HA+OA); fenotipo C (HA+PCO) y fenotipo D (OA+PCO)48.
La concentración de HAM sérica se relaciona con el fenotipo de SOP y la severidad de los síntomas. Así, la media más alta de HAM se observa en el fenotipo A y las pacientes con SOP y oligovulación tienen menores niveles de HAM comparados con aquellas que presentan SOP asociado a anovulación43. Se encontraron valores de HAM mayores en pacientes con SOP e HA, en comparación con las que no tenían HA, lo que indica que el HA está asociado con un aumento adicional de HAM49-51.
La HAM sérica por sí sola es un marcador útil para el diagnóstico de SOP y se correlaciona con los criterios diagnósticos convencionales. Sin embargo, la combinación del nivel sérico de HAM con HA y/o OA aumenta marcadamente la capacidad diagnóstica de SOP, pudiendo ser introducido como un nuevo criterio a la hora de diagnosticar esta patología51.
La HAM tiene la capacidad de predecir la hiperrespuesta a tratamientos de estimulación. Es superior que la FSH basal y el recuento de folículos antrales por ecografía para identificar a mujeres con riesgo de presentar síndrome de hiperestimulación ovárica. Evaluar la concentración de la HAM previo a la instauración de los mismos permitiría definir si hay un exceso de folículos en crecimiento52.
La predicción de la respuesta tiene un significado clínico importante, ya que permite la optimización e individualización de las estrategias de hiperestimulación, utilizando regímenes apropiados destinados a reducir la tasa de cancelación y las complicaciones iatrogénicas de tratamiento.
Son necesarios valores cut-off apropiados para la correcta identificación de los grupos. Nardo et al. proponen que un valor de HAM superior a 3,5ng/ml (S: 88% y E: 70%) indicaría riesgo de presentar síndrome de hiperestimulación ovárica, mientras que un valor<1ng/ml se asocia a pobres respondedoras (S: 87% y E: 67%)53.
Dewailly et al. (2011), con 240 pacientes, proponen que un límite de corte de HAM sérica>a 5ng/ml (o > 35pmol/l) sería más sensible y específico que un número de folículos antrales mayor a 19 por ovario54.
Casadei et al. (2013) proponen incluir la HAM como criterio diagnóstico en aquellas pacientes que no presentan HA o anovulación, y/o con características patológicas no tan bien definidas, que requieren para definirla de criterios diagnósticos adicionales. En este estudio observacional prospectivo con 59 mujeres infértiles, se obtuvo por curva ROC un límite de corte para HAM de 33pmol/l (4,62ng/ml), pudiendo caracterizar al 46,6% de las pacientes con sospecha de SOP que tenían algún síntoma55.
Iliodromiti et al. (2013), a partir de un metaanálisis, de 314 trabajos consultados, el análisis por curva ROC de 10 trabajos, mostraron un límite de corte de HAM de 4,7ng/ml (S: 82,8%, E: 79,4%) para el diagnóstico de SOP en mujeres sintomáticas56.
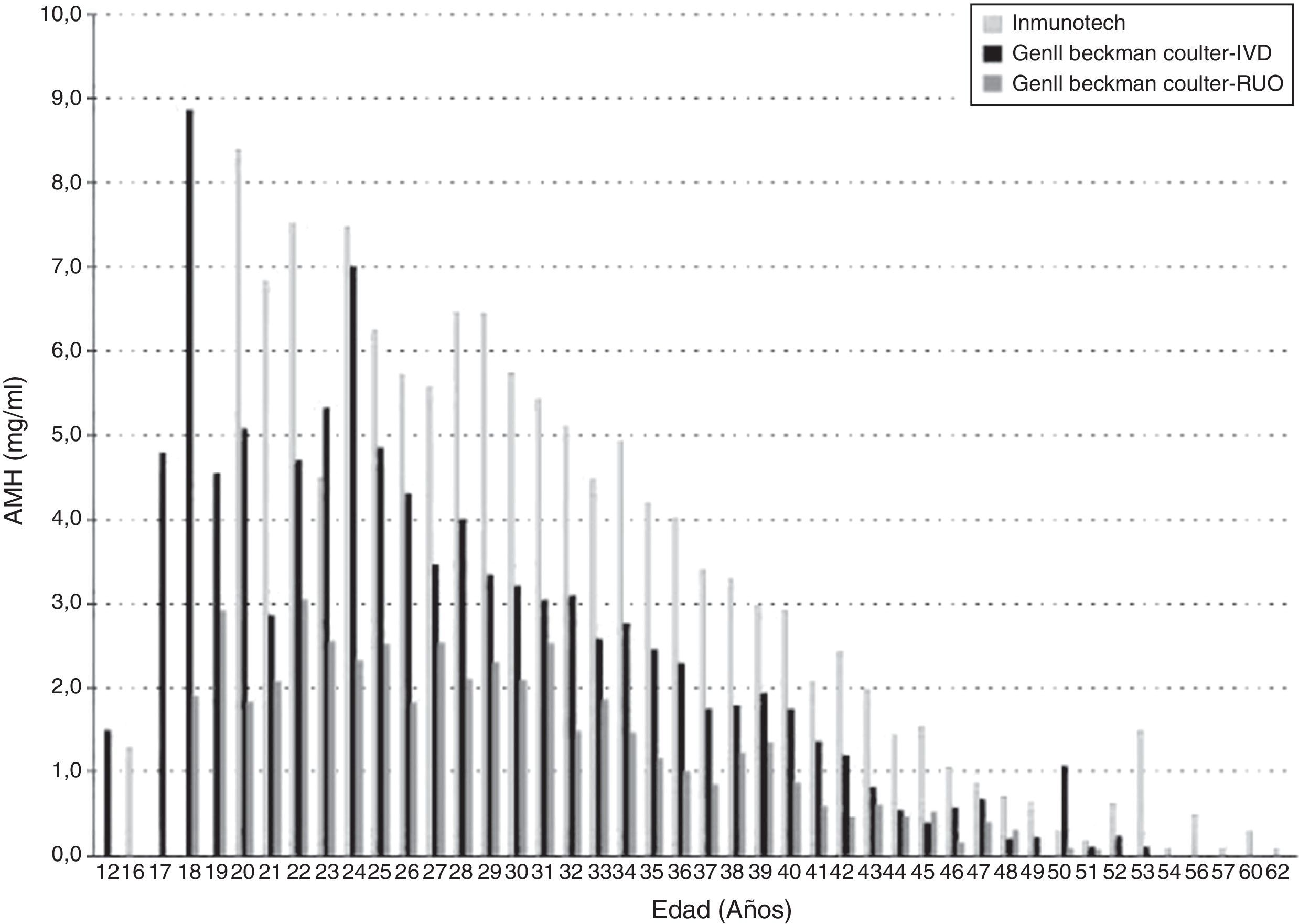
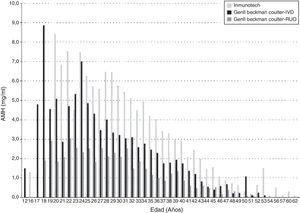
Nuevas metodologías disponibles. ¿Una posible conflictiva?A lo largo de los años se han diseñado diferentes inmunoanálisis con distinta capacidad de detección de las diversas formas moleculares. Los primeros ensayos de laboratorio para la detección de HAM fueron desarrollados en los años 1990. Los ensayos comerciales disponibles de primera generación fueron introducidos por Inmunotech Inc, Marsella-Francia (IOT) y Diagnostic System Laboratories Inc., Webster, TX-USA (DSL)57,58, que utilizaban distintos anticuerpos y estándares. Algunos autores demostraron valores de HAM mayores para IOT que para DSL59-61. La empresa Beckman Coulter Ltd, que ya tenía a Immunotech, compra la empresa DSL y así, en el año 2006, desarrolla un nuevo ensayo: HAM Gen II. Este ensayo combina anticuerpos monoclonales (de DSL) dirigidos contra la región madura o C-terminal y estándares (de IOT). Con este ensayo se detectan ambas formas moleculares, pro-HAM (140 KDa) y complejo activo (135 KDa) no covalentemente unido, en una proporción dependiente de la muestra. Cualquier efecto proteolítico, que dejara los homodímeros disociados del complejo, no afectaría los resultados debido a que la porción C-terminal es más estable que la región N-terminal, por su contenido de residuos de cistina62. Pankhurst et al. resaltaron en su trabajo que si bien su estudio fue realizado con el HAM Gen II, por ser el de mayor utilización en estos momentos, todos los otros métodos también presentarían este cruzamiento con pro-HAM63. La figura 2 muestra claramente que hay otros sistemas que presentarían valores aún más altos que el Gen II.
Resultados de AMH por edad. Valores obtenidos por distintos kits comerciales. Modificada de Lukaszuk et al.65.
Diversos estudios han demostrado variabilidad en los resultados obtenidos por los ensayos comercialmente disponibles. Esto se explica por la utilización de distintos anticuerpos, dirigidos contra epítopes de regiones diferentes, y la falta, aún, de un estándar internacional. Rustamov et al. reportaron un efecto proteolítico sobre la HAM y variaciones debidas a la temperatura durante el traslado de la muestra. Es necesario poner especial cuidado y atención durante la recolección, el traslado y el almacenamiento de la misma. Con el aumento de la temperatura se produciría la exposición de un segundo sitio de unión a anticuerpos, lo que falsamente aumentaría la concentración. Es importante tener en cuenta que en las muestras podemos encontrar mezclas de formas disociadas y complejadas de HAM, situación que aporta variabilidad a los resultados64,65.
Ha sido desarrollado también un kit con mayor sensibilidad analítica (0,075ng/ml) (US HAM/MIS Elisa, AnshLabs, EE. UU.), útil para la evaluación de mujeres que han sido sometidas a quimioterapia. La propuesta es que su elevada sensibilidad permitiría detectar más precozmente su capacidad para retornar a una función ovárica normal y así, mediante el asesoramiento médico adecuado, poder lograr la fertilidad66.
El crecimiento en el número de mediciones de HAM ha permitido el reciente desarrollo de un método electroquimioluminiscente sensible, rápido y totalmente automatizado para las plataformas Elecsys/Cobas. El ensayo ha sido estandarizado contra el kit Gen II de Beckman Coulter, siendo una alternativa atractiva a los métodos manuales disponibles hasta el momento67. La empresa Beckman Coulter tendría en desarrollo un ensayo automatizado, con marca de quimioluminiscencia para su plataforma Access.
Si bien la industria diagnóstica en el corto plazo mejorará la calidad de los ensayos, no se debe dejar de lado la existencia de estas variaciones a la hora de interpretar los resultados.
ConclusionesSi bien la HAM se conoce desde hace ya 40 años, en los últimos años se ha confirmado su utilidad como marcador de reserva ovárica. El conocimiento de la fisiología, el mecanismo de acción, el metabolismo de HAM y la estandarización y el cumplimiento de las condiciones preanalíticas, son, sin duda, de vital importancia para el diseño de técnicas más específicas y confiables, así como para la correcta interpretación de los resultados.
Es necesario un importante trabajo de los organismos competentes para poder contar con la estandarización internacional que se requiere. La industria diagnóstica tendrá por delante el desafío de mejorar sus sistemas de medición, que permitan caracterizar solamente las formas activas de la hormona.
Las numerosas ventajas que presenta respecto a otros marcadores endocrinológicos utilizados y el surgimiento de nuevas y mejores metodologías de medición sustentan, además, su utilización en una gran diversidad de situaciones clínicas. Entre ellas se encuentran patologías endocrinas frecuentes, como el SOP, y patologías infrecuentes, como los tumores de células de la granulosa.
La revisión realizada no deja lugar a dudas sobre la utilidad de la HAM en el área de fertilidad. Ha mostrado ser una excelente herramienta para caracterizar pobres respondedoras en los procedimientos de fertilización asistida, alertar precozmente en mujeres jóvenes sobre reserva ovárica baja, en relación con su edad cronológica y expresar un número de folículos en crecimiento elevado, como en el SOP, para evitar una hiperestimulación ovárica.
El creciente número de pacientes que han decidido retrasar su maternidad y/o someterse a tratamiento de fertilización asistida y su papel en la fisiología ovárica han contribuido a que la HAM integre hoy el panel de evaluación de mujeres con alteraciones de la fertilidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.