El cáncer diferenciado de tiroides (CDT) es el cáncer endocrinológico más frecuente y en las últimas décadas su incidencia ha aumentado. El seguimiento de la enfermedad se efectúa con la medición de tiroglobulina (Tg) sérica, ecografía cervical y barrido corporal total diagnóstico. Los métodos de Tg han evolucionado a través del tiempo. Actualmente, los ensayos inmunométricos de Tg se clasifican en 1.ª y 2.ª generación (1.ª G y 2.ª G). Comprobamos que los ensayos de 2.ª G alcanzan una precisión adecuada para medir valores del orden de 0,1ng/ml y los de 1.ª G de 1ng/ml. La bibliografía señala que en el caso de los pacientes de bajo riesgo, una Tg bajo levotiroxina indetectable por un método de 2.ª G puede evitar la realización de Tg estimulada, sea por la suspensión de la terapia hormonal como por el empleo de la TSH recombinante humana, debido a su mayor sensibilidad. Sin embargo, por su menor especificidad, un valor detectable no asegura la presencia de enfermedad, y debería confirmarse. Para optimizar la utilidad clínica de dicha medición se podrían emplear valores de cortes de acuerdo con la población y el método en lugar de la sensibilidad funcional o límite de cuantificación del mismo. Se señalan también otros aspectos críticos en la medición de Tg como son la discordancia entre distintas metodologías y las interferencias en su medición, principalmente por anticuerpos antitiroglobulina. En presencia de interferencias pierden utilidad los ensayos de Tg de 1.ª y 2.ª G. El seguimiento de los pacientes con Tg interferida tiene limitaciones todavía no resueltas. Es importante consensuar entre médicos y bioquímicos las dificultades técnicas y los criterios de interpretación de los valores de Tg en el seguimiento de los pacientes con CDT.
Differentiated thyroid cancer (DTC) is the most common endocrine cancer (tumour) and its incidence has risen in the past decades. Its follow-up includes measuring serum thyroglobulin (Tg), performing neck ultrasound and a diagnostic whole-body scan. Tg assays have evolved with time. At present immunoassays for Tg are classified as 1st and 2nd generation assays (1st G and 2nd G). 2nd G assays show an adequate (good) precision at levels close to 0.1ng/ml and 1st G assays at levels close to 1ng/ml. The literature shows that for low risk patients on levothyroxine treatment, who undetectable levels by 2ªG assays can avoid the stimulation test performed by thyroid hormone withdrawal or after recombinant human TSH, due to better sensitivity. However, due to lower specificity, detectable levels do not confirm the presence of disease (tumour), and should be confirmed. To optimise the clinical usefulness of the test, cut-off values specific for population and method should be used, instead of functional sensitivity or quantification limit. Critical issues for measuring Tg are discussed, such as non-harmonisation of methods, and interferences, mainly by anti-thyroglobulin antibodies (ATg). 1st and 2nd G assays are less useful in presence of ATg, and follow up of such patients is limited. Consensus between physicians and the laboratory on technical issues and interpretation criteria of Tg values is of outmost importance in the follow-up of DTC patients.
El cáncer diferenciado de tiroides (CDT) es el cáncer endocrinológico más frecuente. En las últimas décadas su incidencia aumentó en todo el mundo, incluido nuestro país, a expensas de tumores de estirpe papilar1. La causa de esta tendencia posiblemente se asocie con el empleo de técnicas de diagnóstico por imágenes de alta resolución y por un mayor acceso de la población a las mismas. Algunos autores señalan que ciertas características que se han acentuado en la sociedad actual, tales como la obesidad, la resistencia a la insulina, un mayor consumo de iodo y una mayor exposición a carcinógenos ambientales y radiaciones, podrían estar relacionados con la mayor incidencia de esta patología2.
Con un tratamiento adecuado, la mayoría de los pacientes con CDT tiene un excelente pronóstico. La mortalidad es baja, menos de un 4%3, y ha permanecido estable durante los últimos 30 años2,3. Sin embargo, hasta un 30% de los casos presentan recurrencia de la enfermedad en los 10 primeros años que siguen a la cirugía, aunque otras veces pueden pasar décadas hasta su detección4,5; de modo que es necesario contar con métodos de seguimiento a largo plazo. En la actualidad, se emplean la medición de la tiroglobulina (Tg) sérica y la ecografía cervical. La combinación de ambas técnicas presenta la mejor sensibilidad y especificidad para la detección de persistencia/recurrencia (valor predictivo positivo [VPP] 96% y valor predictivo negativo [VPN] 99,5%)6.
Los métodos de medición de Tg han ido evolucionando con la intención de superar las limitaciones analíticas. En los 70 se empleaba el radioinmunoanálisis (RIA), un método de diseño competitivo. Luego surgieron ensayos no competitivos: los inmunométricos (IMA), con un límite de detección (LD) más bajo, menor tiempo de incubación, rango de trabajo más amplio, mayor estabilidad del anticuerpo marcado, mayor facilidad de automatización y menor imprecisión. En la actualidad, hay métodos que combinan la cromatografía líquida y la espectrometría de masa en tándem (EM) y están en desarrollo métodos que emplean técnicas de biología molecular. En nuestro medio, la mayoría de los laboratorios emplean los ensayos de tipo IMA en las modalidades que ofrecen distintas marcas comerciales. Una nueva generación de estos ensayos, caracterizada por una mejor sensibilidad y precisión a bajas concentraciones, podría cambiar las estrategias de evaluación del tratamiento, especialmente entre los pacientes con bajo y muy bajo riesgo.
El objetivo de este trabajo es actualizar el «estado del arte» de la medición de Tg y su aplicación clínica. Para ello revisamos 3 aspectos que consideramos críticos por su impacto en el seguimiento del paciente con CDT. Ellos son:
- –
Capacidad de detección del ensayo.
- –
Discordancia entre métodos.
- –
Interferencias en la medición.
La importancia de conocer la capacidad de detección de los métodos de Tg es primordial ya que en el seguimiento de pacientes con CDT se busca evidenciar pequeñas cantidades de tejido tiroideo y que las variaciones halladas en la concentración de Tg a lo largo de períodos extensos reflejen un cambio clínico.
Actualmente, los IMA de Tg se clasifican en ensayos de primera y segunda generación (1.ª G y 2.ª G). Los ensayos de 2.ª G presentan una mejora sustancial en su sensibilidad funcional (SF) de hasta 10 veces comparados con los de 1.ª G (SF ≈ 0,1ng/ml vs. SF ≈ 1,0ng/ml, respectivamente). En el año 2002, la Academia Nacional de Bioquímica Clínica de los Estados Unidos de América (NACB) publicó una guía para el diagnóstico y seguimiento de enfermedad tiroidea, que indica definir la SF de los métodos de la Tg como «la menor concentración que puede ser medida con un coeficiente de variación (CV) entre ensayos del 20%, bajo condiciones experimentales establecidas»7. La SF involucra la imprecisión del ensayo, pero no toma en cuenta la variabilidad biológica, definida por Fraser como la «variación aleatoria de la concentración del analito alrededor del punto de equilibrio homeostático», o sea una fuente de variación inherente al individuo e independiente del método de medida aplicado8.
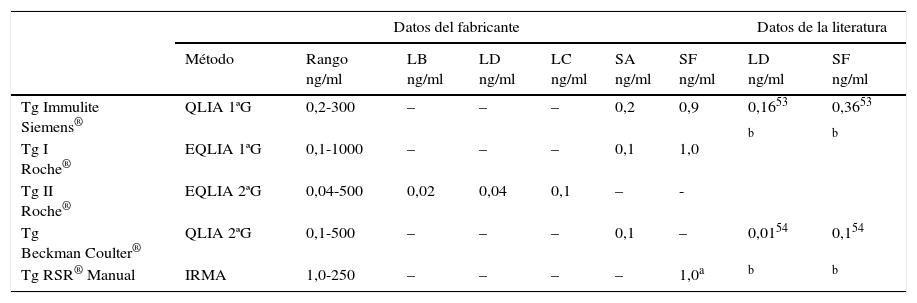
En el año 2012, un panel de expertos del Clinical and Laboratory Standards Institute (CLSI) publicó la guía EP17A2: «Evaluación de la capacidad de detección para procedimientos de medición en el laboratorio clínico»9, que desaconseja el uso de los términos sensibilidad analítica y sensibilidad funcional. Establece, en su lugar, el límite de blanco, el LD y el límite de cuantificación (LC) para caracterizar el comportamiento de los ensayos en el extremo inferior del intervalo de medición (tabla 1). En la actualidad, no todos los fabricantes de kits de Tg aportan esta información y en muchos casos es confusa en cuanto a las expresiones usadas para definir la capacidad de detección (tabla 2).
Parámetros que caracterizan la capacidad de detección de un método
| Límite de blanco | Valor de concentración más alto que es posible observar con una muestra que no contiene el analito en cuestión |
| Límite de detección | Es la concentración más baja de analito que se puede detectar en una muestra que contiene tal analito. En algunas disciplinas se lo identifica con la sensibilidad analítica |
| Límite de cuantificación | Es la menor cantidad de analito que se puede cuantificar bajo condiciones experimentales establecidas y con criterios definidos de error total o sesgo y precisión, es decir con una exactitud conocida Se asemeja a la tradicional SF, pero la misma solo tiene en cuenta la precisión del método |
Metodologías para determinación de Tg (I)
| Datos del fabricante | Datos de la literatura | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Método | Rango ng/ml | LB ng/ml | LD ng/ml | LC ng/ml | SA ng/ml | SF ng/ml | LD ng/ml | SF ng/ml | |
| Tg Immulite Siemens® | QLIA 1ªG | 0,2-300 | – | – | – | 0,2 | 0,9 | 0,1653 | 0,3653 |
| Tg I Roche® | EQLIA 1ªG | 0,1-1000 | – | – | – | 0,1 | 1,0 | b | b |
| Tg II Roche® | EQLIA 2ªG | 0,04-500 | 0,02 | 0,04 | 0,1 | – | - | ||
| Tg Beckman Coulter® | QLIA 2ªG | 0,1-500 | – | – | – | 0,1 | – | 0,0154 | 0,154 |
| Tg RSR® Manual | IRMA | 1,0-250 | – | – | – | – | 1,0a | b | b |
Características de diferentes IMA de Tg: datos aportados por los fabricantes y la literatura.
EQLIA: inmunoensayo electroquimioluminiscente; IRMA: ensayo inmunoradiométrico; LB: límite de Blanco; LC: límite de cuantificacion; LD: límite de deteccion; QLIA: inmunoensayo quimioluminiscente; SA: sensibilidad analitica; SF: sensibilidad funcional.
–: no reportado.
Ante la dificultad para conocer la totalidad de esta información, necesaria para la verificación de los métodos, y al no contar con muestras biológicas de concentración de Tg exactamente valoradas para calcular el LC, hemos determinado la SF de diferentes métodos siguiendo el protocolo de la NACB. Se verificó que la SF es 0,1-0,2ng/ml en los ensayos de 2.ª G, y 0,5-1ng/ml en los de 1.ª G (tabla 3).
Metodologías para determinación de Tg (II)
| Tg | 1.ª generación | 2.ª generación | ||||||
|---|---|---|---|---|---|---|---|---|
| Fabricante | Roche® | Siemens® | RSR® | Roche® | Beckman Coulter® | |||
| Metodología | EQLIA | QLIA | IRMA | EQLIA | QLIA | |||
| Plataforma | Cobas | Immulite | Manual | Cobas | Accessa | |||
| Elecsys 2010 | e601 | 2000a | 1000 | e411 | e601 | |||
| SF (ng/ml) | 1,0 | 1,0 | 0,9 0,6 0,5 | 0,9 | 1,0 | 0,1 | 0,1 | 0,1 0,2 0,1 |
Valores de SF de los diferentes métodos empleados por los profesionales de distintas instituciones que componen el Departamento de Bioquímica de SAEM: Centro Gallego de Buenos Aires, Hospital Alemán, Hospital Álvarez, Hospital Durand, Hospital Fernández, Hospital Posadas, Hospital Ramos Mejía, Hospital Rivadavia.
En los ensayos de 1.ª G la SF estuvo en el rango comprendido entre 0,5 y 1ng/ml. En los de 2.ª G se encontró entre 0,1 y 0,2ng/ml.
EQLIA: inmunoensayo electroquimioluminiscente; IRMA: ensayo inmunoradiométrico; QLIA: inmunoensayo quimioluminiscente; SF: sensibillidad funcional.
En cuanto a la repercusión clínica de esta mejora sobre la capacidad de detección de los IMA, la bibliografía señala que midiendo directamente la Tg bajo levotiroxina (Tgb) con métodos de 2.ª G se podría predecir el valor de la Tg estimulada (Tge), sea por la suspensión de la terapia hormonal como por el empleo de la TSH recombinante humana (TSHrh). Estudios como el de Smallridge et al.10 y el de Spencer et al.11 en los que se emplea un IMA para Tg de 2.ª G (Access® Beckman Coulter, Fullerton, CA; SF: 0,1ng/ml), hallaron una Tge positiva (> 2,0ng/ml)12 en tan solo un 2,5 y un 0,3% de los pacientes con Tgb no detectable, respectivamente. De modo que el hallazgo de una Tge positiva es poco frecuente en pacientes con Tgb < 0,1ng/ml y evidencia que la sensibilidad de un método para predecir una Tge negativa debe ser 0,1-0,2ng/ml. En consecuencia, una Tgb resuelta con un método de 1.ª G no sería confiable para predecir un respuesta negativa de la Tge, por su limitada capacidad de detección (SF ∼ 1ng/ml).
Es importante distinguir entre la sensibilidad de un método de laboratorio, medida por el LC y/o la SF y su sensibilidad clínica, que está definida por la cantidad de resultados concordantes con presencia de enfermedad. Cuando se calcula el valor de corte para la Tgb mediante curva ROC, los estudios muestran diferencias a pesar del empleo del mismo IMA de Tg 2.ª G. A modo de ejemplo, Malandrino et al.6 en una evaluación retrospectiva de 425 pacientes en los que habían medido Tge, encontraron que el valor óptimo de Tgb para predecir recurrencia fue de 0,15ng/ml (sensibilidad: 87% y especificidad: 91%). Schlumberger et al.13, usando el mismo método, en un estudio prospectivo y multicéntrico con 944 pacientes, hallaron un valor de corte de Tgb de 0,27ng/ml (sensibilidad: 65% y especificidad: 87%).
Un metaanálisis publicado en 201414 mostró que la heterogeneidad de los criterios de selección y evaluación de los pacientes y las diferentes marcas de reactivos de Tg de 2.ª G impedían unificar el valor de la Tgb por curva ROC. Sin embargo, cuando elegían como criterio de positividad de la Tge un valor de Tgb ≥ 0,1ng/ml, los resultados entre los grupos mostraron una alta sensibilidad (88-97%) y un alto VPN (97-99%) pero la especificidad (77-85%) y el VPP (42-58%) resultaron bajos. Esto implica que el aumento en sensibilidad de los IMA de 2. G es a expensas de una pérdida en la especificidad, por lo que se corre el riesgo de exponer a un gran número de pacientes, probablemente libres de enfermedad, a pruebas y tratamientos innecesarios. Por otra parte, tampoco sería correcto descartar tales niveles de Tgb, ya que, a pesar de ser muy bajos, podrían tener relevancia clínica. Otro trabajo prospectivo de seguimiento de 715 pacientes con CDT15 concluyó que la Tge mejoraba el diagnóstico de la Tgb en los pacientes con Tgb > 0,27ng/ml. Un consenso europeo del año 201416, a la luz de los conceptos de LD, LC y SF, establece que a los pacientes de bajo riesgo no se les mida la Tge cuando la concentración de Tgb es indetectable con un IMA de 2.ª G. Por el contrario, debería medirse la Tge en aquellos casos con concentraciones detectables (0,1-1,0ng/ml). La Sociedad Europea de Oncología Médica17, la Sociedad Brasilera de Endocrinología y Metabolismo18 y la Asociación Británica de Tiroides19 apoyan esta posición, si bien el valor de corte deberá ser establecido para cada laboratorio y su población. Es importante destacar que estas consideraciones están dirigidas a pacientes de bajo riesgo de recurrencia de CDT, aunque hay publicaciones que incluyen a pacientes de mayor riesgo y muestran que no habría diferencia en la exactitud diagnóstica de la Tgb medida por IMA de 2.ª G20,21. Posiblemente, el hecho de que el número de pacientes enrolados en los estudios es mayoritariamente de bajo riesgo le reste fortaleza estadística a esta última afirmación.
Otra aplicación clínica de esta 2.ª G de ensayos es la monitorización de las concentraciones muy bajas de Tg en los pacientes que no realizaron la ablación con 131I. La indicación de radioablación ha disminuido entre los pacientes con cáncer papilar de tiroides sometidos a tiroidectomía total que tienen resección completa del tumor y cuyos datos histológicos indican un bajo riesgo de enfermedad persistente o recurrente22. En estos casos, es importante saber si los niveles hallados de Tgb pueden ser atribuidos a tejido residual o indicar enfermedad. A la hora de encontrar un valor de Tgb adecuado para el seguimiento de este grupo de pacientes, la bibliografía no es abundante y los resultados son discordantes. Nascimento et al.23, empleando un método de Tg 2.ª G (Access®) indican que una Tgb ≤ 2ng/ml podría ser útil para la mayoría de los pacientes, dentro de los 2 primeros años poscirugía. Otros autores24 usando el mismo IMA de 2.ª G propone un valor de Tgb < 0,5ng/ml. La discrepancia entre estos hallazgos estaría relacionada con los niveles de TSH, que fueron > 2 mUI/ml en el primer estudio y suprimidos por debajo de 0,5 mUI/ml en el segundo. En la práctica, esto puede significar que la Tg puede hacerse detectable o aumentar cuando la TSH < 0,5 mUI/ml pasa a valores normales, sin que esto represente necesariamente recurrencia. Rosario et al.22, en un estudio prospectivo, evaluaron a 69 pacientes con aTg negativo sometidos a tiroidectomía total, pero que no recibieron el radioyodo. Según los autores, se puede esperar reducción o estabilidad de la Tg, mientras la TSH permanezca estable entre 0,5 y 2 mUI/ml. Pequeños aumentos de TSH podrían estimular al tejido tiroideo residual para que secrete más Tg y este aumento, aunque transitorio, puede ser detectado por ensayos de 2.ª G. Por lo que, no solo importa la SF del ensayo de Tg, sino también el grado de estimulación de la TSH y el tamaño del tejido tiroideo remanente al momento de evaluar los resultados.
Últimamente, Rosario et al.25 propusieron un seguimiento basado en la elevación de la Tgb y/o cambio en las imágenes en lugar de realizar la Tge en los pacientes con CDT de bajo riesgo que a los 6 meses de la radioablación tengan una Tgb 2.ª G detectable entre 0,1-0,3ng/ml y una ecografía negativa.
Hay varios modelos para el seguimiento de la cinética de la concentración sérica de Tg. Wong et al.26 calcularon la velocidad de cambio de la Tgb —«thyroglobulin velocity» (TgV)— como una tasa de cambio anual en pacientes con, al menos, una Tgb detectable (≥ 0,3ng/ml medida con equipo de 1.ª G (Immulite®, Siemens Healthcare Diagnostic). La TgV permitió predecir recurrencia con sensibilidad del 83,3% y especificidad del 94,4%. En tanto, Miyauchi et al.27 proponen seguir el tiempo de duplicación de la Tgb (TDTg), que resultó ser un predictor independiente de sobrevida y recurrencia, superior a los clásicos edad, sexo, tamaño tumor, estadio TMN y presencia de nódulos en pacientes con Tgb detectables con método de Tg 1.ª G (electroquimioluminiscencia, Elecsys®, Roche Diagnostics, GmbH). En pacientes con tiroidectomía total que no recibieron radioyodo, Spencer et al.28 consideran que el TDTg con IMA de 2.ª G es un parámetro sensible para detectar recurrencia (bajo niveles estables de TSH) debido a la constancia que tiene la secreción de Tg por parte del tejido remanente sano.
Discordancias en la medición de tiroglobulinaLa variabilidad entre resultados de Tg usando distintos métodos, independientemente de la capacidad de detección de los mismos, se asocia a la heterogeneidad de la molécula de Tg y el diseño de los ensayos utilizados para su detección.
La Tg es una glucoproteína heterogénea de alto peso molecular (660KD) como consecuencia de modificaciones pretraduccionales y postraduccionales, como la glucosilación, la sulfatación, la fosforilación y la iodinación. Durante su maduración se dimeriza y forma complejos plegamientos conformacionales que se pueden desregular en el tejido tumoral alterando la inmunorreactividad de la Tg29. Por otra parte, los IMA muestran alta variabilidad a pesar de estar calibrados con el mismo estándar internacional CRM-457 (Community Bureau of Reference, Bruselas), debido al uso de anticuerpos monoclonales diferentes, que detectan las isoformas de Tg con potencia variable. Esta situación se refleja en la variabilidad entre métodos, que excede la VB intraindividual (15%), por lo cual es recomendable que la monitorización postoperatoria de Tg se realice siempre con el mismo método28. Sin embargo, cuando la clínica no es consistente con los resultados de Tg, una alternativa es el cambio de método, independientemente de la capacidad de detección, sin perder de vista los posibles interferentes.
En pacientes con barrido corporal total positivo y Tg indetectable (IRMA BRAHMS®, Thermo Scientific, Hennigsdorf, Alemania; SF:<0,4ng/ml), descartando presencia aTg, de Ac heterófilos y efecto Hook, Giovanella et al.30 retetestearon la Tg por otros IMA (Immulite®, Siemens Healthcare Diagnostic, SF: 0,4ng/ml y Access®, Beckman Coulter, Fullerton, CA, SF: 0,1ng/ml) encontrando un 75% de pacientes con Tg detectable. Sin embargo, en un 25% la Tg resultó indetectable para cualquier método. Posiblemente, en estos últimos casos, la molécula de Tg tumoral exprese epítopes que impidan su reconocimiento por los anticuerpos al momento de la medición.
Interferencias en la medición de tiroglobulinaLa presencia de anticuerpos puede interferir la medición de Tg, independientemente de que el ensayo sea de 1.a G o 2.a G. Los más comunes son: Ac. aTg, Ac heterófilos (aHet) y factor reumatoideo (FR).
La presencia de aTg, aun en bajas concentraciones, puede interferir y causar dificultades en la detección de enfermedad. Dependiendo de la población, el método y el criterio de positividad utilizado, hasta un 25-30% de pacientes con CDT tienen aTg. Este porcentaje puede ser aún mayor, hasta un 60% en presencia de tiroiditis linfocitaria asociada31. Por este motivo, las determinaciones cuantitativas de aTg por métodos sensibles y específicos constituyen un ensayo complementario esencial para la determinación de Tg.
Todos los IMA, tanto de 1.ª G como de 2.ª G subestiman la concentración de Tg en presencia de aTg32. Los aTg endógenos bloquearían o enmascararían los epítopes de la Tg libre impidiendo que sean reconocidos por los anticuerpos de captura y detección del ensayo. Con los RIA se encontró tanto sobreestimación como subestimación de resultados, dependiendo de la concentración de Tg y aTg de la muestra. Con la EM no hubo ningún efecto significativo de los aTg en la medición de Tg, ya que requiere un tratamiento previo con tripsina, que digiere todas las proteínas de la muestra, incluyendo los aTg o aHet y luego analiza específicamente los péptidos trípticos propios de la Tg. Sin embargo, esta técnica tampoco está exenta de limitaciones, ya que tiene una SF del orden de los IMA de 1.ª G33,34 y se han descripto resultados falsos negativos de Tg en pacientes con aTg positivos y enfermedad persistente/recurrente32.
Existe una gran discordancia entre los resultados obtenidos con diferentes métodos empleados en la medición de aTg35, posiblemente debido a que los aTg son mezcla heterogénea de inmunoglobulinas. Si bien existe un patrón internacional (IRP 65/93, preparado a partir de muestras provenientes de pacientes con enfermedad tiroidea autoinmune y no con CDT), los métodos de aTg no están estandarizados directamente con él, sino que tienen su propio estándar interno, lo cual contribuye a la variabilidad de resultados. Además, la fuente y la calidad de la molécula de Tg usada como antígeno en los ensayos de aTg es probablemente de origen no tumoral y puede expresar epítopes que no son reconocidos por los aTg del paciente con CDT. También se ha descripto que altas concentraciones de Tg en la muestra pueden causar discordancia entre los ensayos de aTg36.
La prevalencia de aTg positivos varía no solo con el método, sino también con el criterio de positividad aplicado. Los valores de corte asignados por los fabricantes de los ensayos comerciales son apropiados para el diagnóstico de enfermedad tiroidea autoinmune, pero pueden no serlo para descartar interferencia por aTg en la medición de Tg36,37. En el consenso del año 201338, se recomienda usar el LC de los ensayos de aTg como valor de corte cuando se investiga interferencia en la medición de Tg (gradoC). De este modo, se ha reducido el número de muestras aTg falsamente negativas, aunque no se han logrado eliminar completamente39.
Existen condiciones clínicas que hacen sospechar que el resultado de Tg puede estar interferido: un valor de Tg prequirúrgica o prerradioablación<1ng/ml, un resultado no acorde con el estado clínico del paciente, la presencia de tiroiditis linfocitaria y/o diagnóstico previo de enfermedad tiroidea autoinmune. Con el fin de investigar la posibilidad de aTg falsamente negativos, se ha propuesto evaluar la relación entre el valor de Tg medido por IMA y por RIA: existiría interferencia cuando el resultado de Tg por IMA es menor del 75% que el obtenido por RIA (Tg IMA/Tg RIA:<75%)37. Esta estrategia es difícil de implementar en nuestro medio porque el RIA se reemplazó por técnicas que no requieren el uso de material radiactivo; además, es controvertida porque emplea al RIA como gold standard y el cociente no ha sido validado en forma independiente como un índice clínicamente relevante de la interferencia por aTg38. Además, como se señaló anteriormente, el efecto de la interferencia por aTg en los RIA depende de la concentración de Tg32. Otra posibilidad es realizar un ensayo de recuperación de Tg, midiendo la concentración de Tg antes y después de agregar una cantidad conocida de Tg exógena al suero en estudio. Los ensayos convencionales que añaden 40-50ng/ml de Tg con tiempos cortos de incubación muestran baja sensibilidad para detectar interferencia40 En la actualidad, frente a los IMA que miden concentraciones de Tg<1ng/ml, se ha considerado agregar de 1 a 5ng/ml («mini recovery»)41, pero aún no hay suficiente evidencia a favor o en contra para recomendar su uso38. Otro abordaje razonable es repetir la medición de los aTg con otro método42.
Dado que la presencia de aTg le resta utilidad a los IMA para Tg, se ha indicado medir la concentración sérica de aTg en el tiempo para monitorear al paciente con CDT. Si bien los niveles de aTg no pueden ser considerados como marcador tumoral, ya que indican la activación del sistema inmunitario más que la carga tumoral, son un marcador subrogante. Cuando la concentración de aTg disminuye, hay menor riesgo de recurrencia o persistencia, mientras que cuando se mantiene estable o aumenta, dicho riesgo se incrementa38,40. En estos casos se debe usar siempre el mismo método, evaluar el coeficiente de variación entre ensayos y considerar los posibles efectos de cualquier fármaco modulador del sistema inmunitario28,37,38,43.
Dado que aún no se ha encontrado la forma de medir con exactitud la Tg en presencia de aTg, se continúa trabajando para encontrar nuevos marcadores de CDT. Algunos investigadores identifican tirocitos circulantes a través de la medición de fragmentos de ARNm tiroideo específicos de Tg, de receptor de TSH o de tiroperoxidasa, o bien tratan de poner en evidencia mutaciones conocidas44-49. Sin embargo, estas técnicas están todavía en desarrollo y no han sido validadas para su uso clínico38.
Otras interferencias menos frecuentes en la medición de Tg pueden deberse a la presencia de aHet y FR. En el primer caso, los aHet son anticuerpos que se unen a antígenos de origen animal que pueden reconocer epítopes en los anticuerpos monoclonales (ratón, conejo, cabra) empleados en los ensayos. Generalmente, forman un puente entre el anticuerpo de captura y el de detección del ensayo, lo que produce un resultado falsamente elevado. Si se unen al anticuerpo de captura o al de detección, el resultado estará falsamente disminuido, pero esto raramente ocurre. La tasa de interferencia por aHet en los ensayos automatizados es entre un 1,5 y un 3%50.
Al igual que los aHet, la presencia de FR puede interferir en los ensayos, principalmente en los IMA51. Se halla en el 5 al 10% de la población general y hasta en el 70% de los pacientes con artritis reumatoidea. Son autoanticuerpos, usualmente IgM, que se pueden unir a la región Fc de la IgG de los anticuerpos humanos y de otras especies. La interferencia por aHet y FR es generalmente paciente y ensayo específica, por lo que no se recomienda la búsqueda sistemática de su presencia. Ante la sospecha clínica, se sugiere confirmar el resultado de Tg con otro método, hacer diluciones seriadas y/o usar tubos comerciales con agentes bloqueantes50-52.
ConclusionesEn ausencia de aTg, los IMA siguen siendo los métodos de elección para el seguimiento de los pacientes con CDT. Los métodos de Tg de 2.ª G alcanzan una precisión adecuada para medir valores del orden de 0,1ng/ml y los de 1.ª G de 1ng/ml. Sin embargo, el aumento en la sensibilidad de los IMA de 2.ª G es a expensas de la especificidad.
Bioquímicos y médicos deben conocer e informar cómo se evaluó la capacidad de detección del método que utilizan para conocer con precisión qué expresan con un resultado «no detectable». Los laboratorios deben asegurar el desempeño de sus ensayos en el tiempo para el adecuado seguimiento de los pacientes con CDT.
En el caso de pacientes de bajo riesgo, una Tgb indetectable por un método de 2.ª G puede evitar la realización de la Tge, pero un valor detectable no asegura la presencia de enfermedad, que debe confirmarse con la medición de Tge.
Para optimizar la utilidad clínica de la Tgb, se podrían emplear valores de corte de acuerdo con la población y el método empleado en lugar de la SF/LC del mismo.
En presencia de aTg, pierden utilidad tanto los IMA de Tg de 1.ª G como los de 2.ª G, debe tenerse en cuenta que las nuevas estrategias para seguir a los pacientes aTg positivos con CDT tienen limitaciones todavía no resueltas.
Es importante consensuar entre médicos y bioquímicos las dificultades técnicas y los criterios de interpretación de los valores de Tg en el seguimiento del paciente con CDT.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.